Method Article
뇌 조각에서 전체 셀 패치 클램프 녹음
요약
이 프로토콜은 전체 셀 패치 클램프 녹음을 수행하기위한 기본 절차 단계를 설명합니다. 이 기술은 신경 세포의 전기적 동작의 연구를 허용하고, 뇌 조각에서 수행하는 경우, 여전히 상대적으로 잘 보존 된 뇌 회로에 통합되어 신경 세포에서 다양한 신경 기능의 평가를 할 수 있습니다.
초록
전체 셀 패치 클램프 기록은 신경 세포의 상당한 부분의 전기적 특성의 조사를 허용하는 전기 생리 기술이다. 이러한 구성에서, 마이크로 피펫은 이전에 사용 된 세포 날카로운 전극 기록 방법보다 더욱 정확한 이온 전류 측정 전류 누설을 방지함으로써 제공 세포막에 밀착된다. 고전적으로, 전체 셀 기록 세포 배양 모델 해리 신경 뇌 조각 뉴런 제제를 포함하는 다양한 형태의 신경 세포에서 수행하고, 그대로 마취 또는 웨이크 동물 일 수있다. 요약하면,이 기술은 대단히 흥분 세포의 수동 및 능동 생물 물리학 적 특성의 이해에 기여하고있다. 이 기술의 주요 장점은 조작 (예, 약물은 실험자 유도 가소성)는 특정한 신경 기능 또는 C를 변경할 수있는 방법의 특정 정보를 제공하는 것이다실시간 hannels. 또한 세포막의 중요한 개구 내부 피펫 용액 자유롭게 도입하는 약물, 예를 들어 작용제 또는 특정 세포 단백질의 길항제를위한 수단을 제공하며 인접 셀의 기능을 변경하지 않고 이러한 대상을 조작하는 세포질 내로 확산 할 수있다. 전체 셀 기록에 초점이 문서는 뇌 조각의 뉴런에 생리 학적으로 관련 맥락에서, 즉 상대적으로 잘 보존 된 뇌 회로에 신경을 기록하는 장점을 가지고 준비를 시행 하였다. 특히, 적절한 약리학과 결합 될 때, 이러한 기술은 학습, 약물 남용에 대한 노출, 스트레스 등의 경험 중 어느 방식에 따른 구체적인 neuroadaptations 발생을 식별 할 수있는 강력한 도구이다. 요약하면, 뇌 조각에서 전체 셀 패치 클램프 녹음은 생체 준비를 오래 지속 변화를 측정 할 수있는 수단을 제공신경 기능에 해당 그대로 깨어 동물에서 개발했습니다.
서문
패치 클램프 기술은, 1970 년대 후반에 개발 1,2-되었습니다 전기 생리 기술은 실시간 조직에서 단일 또는 다중 이온 채널의 기능을 연구하기위한 기본 툴이다. 달성 될 수있는 다른 패치 구성 중에서, 전체 셀 패치 클램프 기록은 뉴런의 주요부의 전기적 성질의 조사를 허용한다. 고전적으로,이 기술은 시험 관내에서 두 뇌 조각 갓 해리 뉴런 또는 세포 배양 모델 (3)에 행해진 다. 뇌 조각 뉴런에서 수행하는 경우,이 기술은 여러 가지 장점을 제공한다. 특히, (I) 신경 세포는 다소 상대적으로 보존 된 뇌 회로에 기록되고, 세포 배양 용 제제에 비해 3 생리 관련이있는 환경을 제공한다. 이것은 급성 pharmacolog 임의의 유형에 의해 유발되는 세포 및 분자 사건을 초기에 포착, 또는 실시간으로 모니터링 할 수있게iCal의 조작 - 생체 내 조건의 전형적인 사용하여 달성 될 수없는 시간 해상도; 시각적으로 뇌 조각에 뇌 영역을 식별에 (II) 기능은 모두가 형광 마커를 표현 할 때 뇌 영역은 공부에 대한 특정 신경 세포에 대한 높은 지역 특이성 3 수 있습니다; (ⅲ) (세포 내 레코딩을위한 날카로운 마이크로 피펫으로 막을 천공 대조적으로) 원형질막의 상당 부분을 열어 세포의 세포 내 공간에 접근 4. 차례로,이 내부 용액을 구성하는 특정 이온의 함량 또는 농도가 너무 분자 표적을 수정할 또는 셀룰러 메커니즘이 상이한 조건 하에서 조사 될 수 있습니다. 예를 들어, 전체 셀 구성, 특정 약학 제 (예 : 길항제) 설정시 한 기록 마이크로 피펫 (패치 피펫) 용액에 직접 세포질 내로 확산 및 putat에 역할을 추가 할 수 있다는이웃하는 셀들에 상기 타겟의 기능을 변경하지 않고 세포 내 표적 필자. 또한, 마이크로 피펫 날카로운 기록 비교 패치 클램프 전극의 선단에 큰 개구 낮은 저항, 낮은 경쟁중인 잡음 및 셀 (4)의 내부로 더 따라서 전기적 접속을 제공한다. 그러나, 피펫 팁에 큰 구멍이 셀 투석으로 이어질 및 연구 5,6에서있는 생명 현상의 발현에 중요 할 수있다 세포 내 분자 기계함으로써 손실 할 수 있습니다. 이 경우, 날카로운 전극 녹음이 더 적합 할 수있다. 녹음이 유형시켜 세포 내 공간과 내부 피펫 용액의 이온 교환을 최대한 방지 전체 셀 녹음에 사용되는 것보다 훨씬 작은 기공을 가진 마이크로 피펫을 필요로한다.
(급성 또는 만성) 경험의 모든 형태를 포함 남용 11,1의 약물에 노출 7-10 학습2 등 응력 13,14은 특정 뇌 영역에서의 신경 기능의 다양한 측면을 변경할 수있다. 이러한 변화는 종종 (일 시간)을 개발하기 위해 시간을 필요로하기 때문에, 특정 경험을받은 동물의 뇌 조각에서 전체 셀 녹음 연구자들은 이러한 변화를 식별 할 수 있습니다. 기본적으로 (모든 경우) 신경 세포의 기능 (예를 들면, 리간드 - 활성화 된 이온 채널 전압 관문 이온 채널, 신경 전달 물질 트랜스 포터)함으로써 뇌 회로 활동 및 동작 환경에 의해 변경 될 수있다 (환경 의존성 참여 요소 많은 소성) 10,15-17. 신경 수준에서 뇌 회로의 활동이 시냅스 사이의 지속적인 상호 작용 (예를 들면, 글루타메이트 전송) 및 고유 세포의 흥분 요인 (예를 들어, axosomato-수지상 이온 채널에서 나온다 : 칼륨, K +, 나트륨, 나트륨 + 칼슘, 칼슘 2 + ). 도 ë을 사용하여 특정 조건에서전자 셀 패치 클램프 전기 생리학 기술, 시냅스 대 고유 흥분의 변화에서 특히 발생하는 신호 변경은 분리 될 수있다.
대부분의 경우, 시냅스 흥분성 전체 셀 전압 - 클램프 기술을 이용하여 평가된다. 본 촬영 모드는 α 아미노 -3- 히드 록시 -5- 메틸 -4- isoxazolepropionic 산 수용체에 의해 매개되는 예를 들어, 이온 전류 [의 측정 (허용 AMPA 수용체)와 신경 세포막을 통한 N 메틸 -D- 아스파르트 산 수용체 (NMDA 수용체)] 세트 전압의 막전위 채. 여기에서, 실험자는 세슘을 포함하는 내부 마이크로 피펫 솔루션 (고사 +), K + 채널의 폭 넓은 차단제 (키 고유 흥분 요인)를 사용합니다. 전체 셀 구성의 확립되면, 세포 내 공간에서 고사 +의 확산은 K + 채널을 차단하고, 이에 상대적으로 효율적인 공간 클램프 및 사전을 모두 허용다른 측정치들에 내재 흥분성 요인의 영향 벤트. 불규칙한 모양의 세포 (예를 들어, 신경 세포), 그리고 18, 19 아버 광대하고 복잡한 수지상 특히 신경을 녹음 할 때 공간 클램프의 문제, 즉, 전압 클램프에 어려움 전체 셀은 발생한다. 체세포 전압 클램프 저조한 제어 뉴런의 수지상 트리 전압 때문에, 연구중인 수지상 전기 신호의 다양한 양태는 수지상의 거리에 비례하여 변형된다. (인공 뇌 - 척수액, ACSF) 세포 외 용액에 용해 된 이러한 피크로 톡신 (감마 - 아미노 산, GABA 수용체 길항제) 또는 kynurenic 산 (글루타메이트 수용체의 광범위한 차단제)와 같은 약물 학적 도구와 결합하여,이 기술은 글루타메이트를 측정 할 수 있도록 수용체 -와 GABA 각기 전류를 R은 중재.
대조적으로, 극한의 흥분은 일반적으로 전류 - 클램프 기록 모드에서 평가된다.전압 클램프 기록 반대로, 본 촬영 모드는 신경 세포막에 흐르는 이온 전류에 의한 막 전위의 변화를 측정 할 수있다. 뉴런 나 +와 K + 채널 모두를 필요로 활동 전위를 생성하기 위해 일반적으로 고유 흥분의 변화는 능력의 변화를 통해 평가된다. 현재 클램프 녹음을 수행 할 때 따라서, 가능한 Micropipette는 K + 대신 고사 +를 포함하는 내부 용액으로 채워집니다. 글루타메이트와 GABA에게 ACSF에 용해 된 수용체 매개 전류 차단되는 약물과 결합하여,이 실험 설계 시냅스 흥분성의 전위 변화에 의해 오염되지 않고 신경 소성 본질적인 요인 (예를 들면, K는 + 채널)의 기여를 측정 할 수 있도록 요인.
이 문서에서는 t 기본 필요한 절차 단계를 설명합니다O (I) 건강한 뇌 조각을 제조; (ⅱ) 전체 셀 구성을 달성하고, (ⅲ) 극한 흥분성 시냅스 및 평가하는 기본 파라미터를 모니터링한다.
프로토콜
모든 실험은 UT 남서부 기관 동물 보호 및 사용위원회의 승인 된 프로토콜에 따라 수행하였고, 실험 동물에 의해 경험 응력 불편과 고통을 최소화하도록 선택되었다.
1. 솔루션
참고 : 사전에 마이크로 피펫 내부 솔루션을 준비합니다. 가장 기초적인 실험을 위해, 용액의 두 종류가 충분해야 : CS + 및 K + 기반 기반 솔루션.
- 전압 클램프 실험에 사용 고사 + 기반 솔루션 (예를 들어, 고사 + 글루코 네이트 솔루션 자료 참조). RT에서 준비합니다.
- 3.54 g의 CsOH (~ 2.01 ml)로 4.62 g의 D-글루 콘산 (~ 3.696 ml)에 혼합하여 117 mM의 CS-이 품목 솔루션을 준비합니다.
- DDH 2 O 90 ML을 추가하고 30 분 동안 평형 수 있습니다.
- 0.4 밀리미터 EGTA = 15.2 mg의; 2.8 mM의 염화나트륨 = 16.4 mg을, 고체 성분 (20 mM의 HEPES = 0.476 g 추가 5 MM의 테트라 에틸을 (TEA) 클로라이드 = 83 mg)을 얻었다.
- ~ 97 ml에 DDH 2 O에 추가합니다.
- 7.2 50 % CsOH로 용액의 pH를 조정 - 7.3.
- DDH 2 O와 필요한 경우 삼투압과 정확한 확인
참고 : 좋은 범위 ~ 280 - 285 mOsm. (- 310 mOsm, 우리 실험실에서 300 mOsm 보통 300) 20 mOsm 표준 ACSF의 삼투압 이하 - 최적의 삼투압은 15해야한다. 삼투압 솔루션 특정 조성에 따라 다를 수 있습니다. - -20 ° C 이하에서 1,000 μL 및 저장소에 나누어지는.
- , 분취, 준비 동결, 기록의 날에 내부 용액에 ATP / GTP를 추가합니다.
- 10 mg을 GTP에 64.63 mg을 ATP를 추가하고 DDH 2 O.의 637.11 μL에 용해
- -20 ° C 이하에서 10 μL 씩 저장을 준비합니다. 실험의 날에 내부 용액 1000 ㎕를 각각 100 배 나누어지는을 섞는다. ATP / GTP가 내부 용액에 첨가되면, ATP / GTP의 degradati 않도록 얼음에 유지에.
- 신경 발사가 평가 될 수 있도록 K + 컨덕턴스가 기능을 유지 전류 및 전압 클램프 실험을 모두 사용 K + 기반 솔루션 (예를 들면, K-이 품목 솔루션 자료 참조). RT에서 준비합니다.
- 원하는 최종 부피에 따라 모든 재료의 무게를. 용액 90 ㎖, 120 mM의 글루코 네이트 K = 2.81 g의 제조; 20mM의 KCl을는 0.149 g을 =; 10 mM의 HEPES = 0.238 g; 0.2 밀리미터 EGTA = 0.008 g; 2 밀리미터의 MgCl 2 = 0.021 g.
- 최종 용액 부피의 90 %에 도달하기에 충분한 DDH O 2를 사용한다. 이것은 충분한 공간이 pH와 삼투압 조절 방치 확인해야합니다.
- 추가하고 모든 재료를 혼합 한 후, 용액이 pH를 측정하기 전에 명확해야합니다.
- K + 하이드 록 사이드 (KOH)을 사용하여 7.3 - 항상 용액을 교반하면서 pH를 7.2로 조정한다.
- pH를 조정 한 후, 삼투압 및 광고를 사용하여285 mOsm - 280 만 삼투압.
참고 : 최적의 삼투압은 15해야 - 표준 ACSF의 삼투압 아래 20 mOsm (보통 300-310 mOsm, 우리 실험실에서 300 mOsm). 삼투압 솔루션 특정 조성에 따라 다를 수 있습니다. - -20 ° C 이하에서 1,000 μL 및 저장소에 나누어지는.
- , 분취, 준비 동결하고 기록하는 일에 내부 용액에 ATP / GTP를 추가한다 (단계 1.1.8 참조).
- 표준 ACSF (자료 참조) 1 L를 준비합니다.
참고 : 관심있는 뇌 영역을 녹화 할 때 일상적으로 사용하는 조리법을 사용하여 뇌 조각 중간 가시 뉴런 (MSNs)을 녹음 할 때 우리는 우리의 실험실에서이 조리법을 사용하지만, 요리법 실험실 사이에 다를 수 있습니다, 따라서 우리가 실험을하는 것이 좋습니다 . - 해부 ACSF 준비 (슬라이스 솔루션 ~ 125 ml의 참고 :. 완전히 뇌 잠수함한다으로 정확한 볼륨이 슬라이스 챔버의 크기에 따라 달라집니다)에 사용2.8-2.2 단계를 반복합니다.
- 5 밀리미터를 kynurenic 산을 준비 슬라이스 동안 뇌 잠수함하기에 충분한 볼륨 표준 ACSF에서 (글루타메이트 수용체에 의한 흥분 독성 프로세스를 차단하기 위해). kynurenic 산을 용해하는 데 도움이되는 초음파 처리기를 사용합니다.
주 : 초음파의 길이가 용액 중 고체의 양 및 크기에 따라 달라질 수있다. (- 우리의 조건에서 2 분, 약 1) 용액은 공정의 끝에서 명확히한다. - 2 °의 C - 온도가 0에 도달 할 때까지 얼음 양동이에 95 % O 2, 5 % CO 2 가스 버블 링하면서 냉각.
- 5 밀리미터를 kynurenic 산을 준비 슬라이스 동안 뇌 잠수함하기에 충분한 볼륨 표준 ACSF에서 (글루타메이트 수용체에 의한 흥분 독성 프로세스를 차단하기 위해). kynurenic 산을 용해하는 데 도움이되는 초음파 처리기를 사용합니다.
- 녹화 ACSF를 준비합니다.
- 표준 ACSF의 1 L를 타고 (또는 어떤 단계 1.3에서 제조 한 용액에서 왼쪽)하는 적절한 약리 에이전트가 계획 한 실험에 따라 추가 될 수있다.
- 흥분성 시냅스 후 전류 또는 전위 (EPSCs 또는 EPSPS), 글루타메이트 수용체 길항제를 기록 할 때 예를 들어, (kynure를 100 μM의 피크로 톡신을 추가NIC 산, 2 밀리미터; 또는 CNQX 10 μM와 D-APV 50 μM) 시냅스 이벤트에서 어떤 영향이 없을 신경 발사를 평가할 때 억제 시냅스 후 전류 또는 전위 (IPSCs 또는 IPSPs), 두 피크로 톡신과 글루타메이트 수용체 길항제를 기록하는 조합.
- 표준 ACSF의 1 L를 타고 (또는 어떤 단계 1.3에서 제조 한 용액에서 왼쪽)하는 적절한 약리 에이전트가 계획 한 실험에 따라 추가 될 수있다.
2. 슬라이스 준비
- 구축 또는 슬라이스 복구 실을 구하십시오.
참고 : 회수 실의 원리는 간단하고, 실험 (도 1)로 할 수있다. 간략하게, 상기 챔버는 바스켓 ACSF의 표면보다 낮은 수준으로 뇌 조각을 유지하도록 삽입되는 용기이다. 다양한 과학 기업들도 슬라이스 복구 챔버를 판매하고 있습니다.- 30 cc의 주사기를 절단하여 - (6mm 높은 4) (B, 상위 뷰 그림 1A, 측면보기) 예를 들어, 네 개의 링을 구하십시오. 이어서, 접착제 (예를 들면, 나일론 호로부터 절단 그물 연신e) 상기 링의 한쪽에 뇌 조각 (그림 1B)를 보유하고 함께 반지를 접착제합니다.
주 : 접착제 총이 사용될 수있다. - 네 개의 고리가 붙어되면, 복구 뇌 조각 (그림 1C 및 D)에서 산소 거품을 전환하기 위해 링 (그림 1A 및 B)의 두 가지로 곡선 등변 사다리꼴 모양의 플라스틱 벽을 붙입니다. 도 1d에 도시 된 바와 같이, 플라스틱의 벽과 동일한 측 (여기서, 가스 분산 튜브) 산소 확산 시스템을 삽입한다.
- 30 cc의 주사기를 절단하여 - (6mm 높은 4) (B, 상위 뷰 그림 1A, 측면보기) 예를 들어, 네 개의 링을 구하십시오. 이어서, 접착제 (예를 들면, 나일론 호로부터 절단 그물 연신e) 상기 링의 한쪽에 뇌 조각 (그림 1B)를 보유하고 함께 반지를 접착제합니다.
- 2 °의 C - 슬라이스에 앞서, 네이트 (95 % O 2 / 5 % CO 2)와 슬라이스 솔루션을 냉각 0 (단계 1.4 참조).
- 실온에서 표준 ACSF와 사용자 지정 복구 챔버를 입력합니다. ACSF 잘 산소되어 있는지 확인 - 복구 챔버에서 슬라이스를 배치하기 전에 (20 ~ 30 분, 시간은 챔버 체적에 따라 달라질 수 있습니다). 기포가 직접 사기에 오지 않는 것을 확인슬라이스와 접촉되는하거나 방해.
- 라인 vibratome 얼음 얼음 트레이와 슬라이스 챔버의 절반 1/3 잠기도록 찬물로 입력합니다. 조심스럽게 산소 전달 시스템 (예를 들면, 가스 확산 돌)과 슬라이스 챔버의 온도 프로브 그래서 어느 항목이 블레이드 이동 또는 슬라이스 조작을 방해 놓습니다.
- 뇌를 추출하고 원하는 뇌 영역을 해부에 필요한 해부 영역 및 도구를 준비합니다.
참고 : 특정 뇌 영역에 따라 달라집니다 수행 정확한 해부는 다른 뇌 구조가 서로 다른 평면 (. 예를 들어, 관상, 시상, 또는 수평 슬라이스)에서 슬라이스 필요합니다 공부했다.- underpad에 다음과 같은 도구를 배치 : 잘린 가위, (쥐의 두개골에 대한 더 적합 같은 rongeurs이나 넓은 끝이 어떤 수술 도구,,) 메스, 작은 직선 날카로운 팁 가위, 선박 삽관 포셉, 곡선 지혈 겸자, TW를eezers, 주걱, 주걱, 여과지, 페트리 접시, 하나의 에지 면도날 및 시아 노 아크릴 레이트 접착제를 떠서.
- 온도가 0에 도달하면 - 2 °의 C를, 슬라이싱 챔버 (버퍼 트레이)에 슬라이스 솔루션을 전송합니다.
- 이소 플루 란을 이용하여 탈수 챔버에서 마우스를 마취. 정확한 사용량은 챔버의 크기에 따라 다양하지만, 작은 콘서트홀 케이지 몇 방울을 사용할 수있다 (~ 3-4). 렌더링 움직이지 때까지 새장에 마우스를두고 (자극 촉각에 응답하지, 약 15 초 여기에 설명 된 조건). 심장 박동 정지하기 전에 (세포 생존 능력을 향상) 후, 동물이 깊은 마취되어 있는지 확인 목을 베다하기 위해 꼬리와 발 핀치 테스트를 수행합니다.
주 : 적절한 명분 일부 실험실이 세포 생존 가능한 흥분 독성 과정만큼 최소화 높이기 위해 라이브 잘린을 수행 할 수있는 권한을 얻었다. - 절개를 수행합니다.
참고 : 뇌해야합니다빠르게 추출 (<45 초).- 메스를 사용하여 꼬리 지느러미 할 주동이에서 두개골의 상단에있는 표피를 잘라.
- 헤드 양쪽 두피 껍질.
- 작은 직선 날카로운 팁 가위를 사용하여 소뇌를 제거합니다 lambdoid 봉합을 따라 interparietal 판을 잘라. 후두 뼈를 제거합니다.
- 동일한 가위를 사용하여, 시상 봉합 잘라.
- 각 정수리 뼈 아래의 혈관 삽관 집게 (또는 rongeurs 쥐의 두개골을 깨는 경우)를 밀어 뇌를 노출 당깁니다.
- 곡선 지혈 겸자 사용하여 부러진 뼈를 제거하는 핀셋이나 혈관 삽관 집게를 사용하여 다음을 깰 정면 뼈를 꼬집어. 잘라는 해부을 방해 할 수있는만큼 부드럽게 가능한 한 뇌경막을 제거합니다.
- 뇌 아래 주걱을 밀어 부드럽게 이전에 얼음처럼 차가운 ACSF 가득 슬라이스 챔버 (버퍼 트레이)에 배치하기 위해 두개골에서 뇌를 빼냅니다. 뇌를 보자2 분 - 1 냉각.
- 얼음과 더 큰 표면 접촉을 허용하는 얼음 물 페트리 접시를 작성하여 해부 플랫폼을 준비 그것의 뚜껑을 덮고 위에 필터 종이를 놓습니다. 차가운 ACSF와 여과지를 젖은.
- 뇌가 냉각되면 얼음 가득한 페트리 접시에 두뇌를 배치하고 신속하게 슬라이스의 원하는 평면을 얻기위한 적절한 절개를 수행합니다.
- 핵 중격 의지 (NAC)를 포함 시상 조각을 얻으려면, 잘라 그들은 여전히 존재하는 경우 후각 결절과 소뇌를 제거하는 하나의 에지 면도날을 사용합니다. 그리고, (2)의 시상 수행 컷 - 플레이트를 들고 시편에 접착되는 평면을 얻기 우반구의 측면 테두리로부터 3mm를 (단계 2.8.11 참조).
참고 :이 절단 - 두 반구에서 NAC를 포함하는 조각의 수집을 허용 할 반구의 측면 테두리에서 3mm를. 적절한 해부 따라 달라집니다조사되는 뇌 영역에서. 여기서, 절개가 수행되어, NAC 뉴런 시상 뇌 조각에 기록 될 수있다. - 신속 접착제 슬라이싱 원하는 평면에 따른 판에 뇌의 평탄한 절단면 (시료 보유 판에인가 시아 노 아크릴 레이트 접착제를 사용하여). 시상 뇌 조각 단계 2.8.10를 참조 구하십시오.
- 즉시 배치하고 뇌가 (안전을 위해 시료 판을 고정 만 블레이드 홀더를 설정) rostro - 꼬리 쪽을 분리되도록 슬라이싱 챔버에서 접시를 들고 시편을 고정합니다.
- 해당 슬라이스 매개 변수 (- 4, 진동 9-10, 슬라이스 두께 250 μm의 속도 (3) 자료에 언급 된 vibratome의 실험실에서 사용되는 파라미터)와 vibratome를 설정합니다.
- 슬라이싱시 (RT시) 회수 챔버로 뇌 조각을 전송하는 플라스틱 트림 전달 피펫을 사용하여 (단계 2.3 참조). 복구 시간 연구중인 신경 세포 유형에 따라 달라질 수있다(일반적으로 30-90 분).
3. 녹화 가능한 Micropipette과 조작 준비
- 원하는 마이크로 피펫 속성을 얻기 위해 끌어 당기는 사용 설명서의 구체적인 가이드 라인을 참조하십시오.
참고 : MSNs를 들어, 우리는 3.2-4.0 MΩ의 피펫 저항 범위를 사용합니다. - ACSF 산소를 / 분 2 ml의에 흐름을 조정합니다. 설비에 설치된 연동 펌프 또는 진공 라인을 이용하여 진공 ACSF.
- 관류 히터 컨트롤러 돌리고 원하는 온도를 얻기 위해, 온도 설정을 조정 (예를 들어, 31.8-32.2 °의 C 참조).
주 : 온도 안정성 챔버 일정한 ACSF 레벨 일정한 유속 모두 갖는 의존한다. 뉴런의 여러 생물 물리학 적 특성 때문에 (예를 들어, 입력 저항, R 내가, 또한 막 저항, R의 m라고도 함) 안정적인 온도를 유지하는 것이 중요하다, 온도에 민감하다. - COMPU를 켭니다터 제어 증폭기, 카메라, 미세 조작기 및 현미경 배경 빛. 조직의 전기 자극을 필요로하는 실험을 수행하는 경우, 자극 컨트롤러와 분리 장치의 전원을 켭니다.
참고 : 다른의 일부 앰프를 사용하기 전에 "워밍업"을 추천 제조, 그래서 정확한 운영 절차에 대한 설명서를 참조하는 것이 좋습니다. - 카메라 캡처, 신호 수집 및 증폭기 소프트웨어를 시작합니다.
- 슬라이스 배치 및 시각화 :
- 플라스틱 트림 팁 전송 피펫을 사용하여 부드럽게 복구 실에서 하나의 뇌 조각에 그립니다.
- 기록 챔버에 이송 피펫을 넣고 부드럽게 챔버의 바닥을 라이닝 커버 슬립 상에 피펫 밖으로 짜내 슬라이스.
참고 :만큼 더 오버 플로우가 발생되지 않는 한,이 욕조에 유출 복구 실에서 일부 ACSF을 가지고 무해하다. - 조각 (S)의 위치를 변경하는 집게를 사용하여O 원하는 영역은 상기 기록 챔버의 중심에 정확하게 배치한다. 현미경 저전력 (4X) 대물 렌즈 및 위치에 도움을 접안 렌즈를 사용합니다.
- 원하는 위치가 달성 된 후, 챔버 (또한 "하프"라고도 함) 슬라이스 홀드 아래로 뇌 슬라이스 위치를 고정.
- 높은 전력 (40X) 대물 렌즈로 전환 접촉 챔버 내의 ACSF 형성 될 때까지 조심스럽게 내립니다.
- 초점 조직을 가지고 미세 조정 휠을 사용합니다. ACSF 접촉 슬라이스 호감 또는 ACSF 응축기로 유출시킬 수있는 챔버의 하부를 라이닝 커버 슬립을 깰 수 과도 대물 렌즈를 낮추는 현미경에 대략 조정 휠을 사용하지 않는 동안 손상.
- 포커스 조직 레벨 일 때, 형상에 대한 타겟 영역에 세포를 관찰한다. 사균 <그들의 팽윤 세포막과 핵 (의해 쉽게 식별 할강한> 그림 1E). 건강한 세포는 원형, 난형 또는 타원형 균일 한 구조 (그림 1E)로 표시한다.
- 표적 세포를 찾아보십시오. 기록 마이크로 피펫을 안내하기 위해 컴퓨터 스크린에 표시한다. 이러한 QCapture 같은 소프트웨어를 사용하는 경우, 마우스 왼쪽 클릭을 개최하여 대상 셀 주위에 사각형을 그립니다.
- 배치와 기록 마이크로 피펫을 이동 ACSF 접촉되는 대물 렌즈에 의해 형성된 원뿔에 충분한 공간이있을 수 있도록, 대물 렌즈를 올린다.
- 마이크로 피펫 배치 및 위치
- 1 ML의 주사기, 비금속 마이크로 실린 바늘 및 전용 필터를 사용하여 단계를 참조 계획된 실험 (K + 기반 또는 고사 + 기반의 내부 솔루션에 따라 미리 준비 내부 솔루션을 마이크로 피펫을 채우기 1.1., 1.2 컴포지션, 및 재료). 내부 있도록 충분히 솔루션을 사용하여용액을 마이크로 피펫 홀더 내의 염화 코팅은, 와이어 전극과 접촉한다.
참고 : 실버 와이어 전극이 가정용 표백제에 담가 염소 할 수 있습니다. 뉴 클레오 시드 3 인산 (ATP 및 GTP)을 사용하기 전에 내부의 용액에 첨가 될 수있다. ATP / GTP 저하를 방지하기 위해 얼음 용액을 함유하는 주사기를 유지한다. - 그들은 마이크로 피펫은 조직에있는 동안 나와서 슬라이스를 가릴 수 있으므로 마이크로 피펫에 기포가 없는지 확인합니다.
- 용액은 염화은 코팅 된 와이어 전극에 접촉하도록 상기 전극 홀더에 마이크로 피펫을 놓는다.
- 콘 세탁기는 마이크로 피펫 주위에 시일을 형성 할 수 있도록 피펫 캡을 조입니다.
- 피펫을 입력 파편을 방지하기 위해 ACSF의 마이크로 피펫을 침지하기 전에 긍정적 인 압력을 적용합니다.
- 잠금 위치에서 headstage g (챔버 접함)하고, 미세 조작기를 사용하여 배치이 침지 목표의 중심에서 약하므로 챔버쪽으로 내려 uide.
- (매질에서 고속으로 설정 됨)으로 미세 조작기 마이크로 피펫을 움직이는 동안, 마이크로 피펫을 찾아 XY 축상의 셀의 위치를 향해 안내하기 위해 컴퓨터 스크린을 사용한다.
- 전압인가 단계에 의해 마이크로 피펫 저항을 측정하여 (예를 들어, 4 MV 100 밀리 용) Clampex 소프트웨어에서 "막 시험"을 사용하는 경우와 같은 '온천'모드와 같은 특정 소프트웨어를 통해 수동 또는 자동으로 수행 될 수있다 (또한 단계 4 참조) . 확인 기포 또는 다른 이물질이 마이크로 피펫을 막지 있도록하기 위해 폴리에틸렌 관을 가진 마이크로 피펫 홀더에 연결된 공기 충전 주사기 (예를 들어, 30 공통 주사기)를 이용하여 정압을 적용한다.
- 마이크로 피펫을 제거한 후, 수동으로 또는 예컨대 & # 특정 소프트웨어를 통해 달성 될 수 제로 피펫 전류를 감소시키기 위해 전압 오프셋을 수행39; 컴퓨터 제어 앰프 사령관에 '오프셋 피펫.
참고 :이 기능은 욕조와 마이크로 피펫 솔루션 (즉, 액체 접합 가능성 20) 사이의 농도 차이에 의해 발생하는 전압을 보상합니다.
- 1 ML의 주사기, 비금속 마이크로 실린 바늘 및 전용 필터를 사용하여 단계를 참조 계획된 실험 (K + 기반 또는 고사 + 기반의 내부 솔루션에 따라 미리 준비 내부 솔루션을 마이크로 피펫을 채우기 1.1., 1.2 컴포지션, 및 재료). 내부 있도록 충분히 솔루션을 사용하여용액을 마이크로 피펫 홀더 내의 염화 코팅은, 와이어 전극과 접촉한다.
4. 막 시험
참고 :이 단계는 자료에 언급 된 앰프에 적용됩니다.
- 컴퓨터 제어 증폭기 커맨더 사용시 항상 막 시험을 수행하는 전압 클램프 모드를 설정한다.
참고 : 막 시험 "욕조"모드로 설정되어있을 때, 시일이 형성 될 때, 막 검사 마이크로 피펫 저항과 밀봉 성을 측정 할 수있다. - 막의 파열되면,이 "셀"모드 (또한 접속 저항 R에 a)이 직렬 저항 (R 용 S) 때문에, R i 및 막 커패시턴스 (C의 P) 막 테스트 수를 전환한다 (단계 5.8 참조)얻을 수.
5. 최종 접근, 인감 형성하고, 전체 셀 구성을 얻기
- 미세 포커스 휠을 사용하여, 서서히 마이크로 피펫이면서 다운 포커싱 시작한다. 항상 먼저 아래로 초점을 맞춘 후 초점면에 이르기까지 마이크로 피펫을 낮 춥니 다. 이것은 마이크로 피펫 팁이 갑자기 슬라이스로 침투되지 않도록합니다.
- 마이크로 피펫은 조각의 표면과 접촉 올 때, 중간 낮은 모드로 micromanipulator에 속도를 느리게.
- 조심스럽게 접근 경로에서 이물질을 취소 피펫 홀더에 연결된 공기로 채워진 주사기 빛 양압을 적용합니다.
- XYZ 제어 노브로 번갈아 또는 둘 XZ 축이 Z 축 노브의 회전 위치를 변경합니다 (micromanipulator에 모델이 허용하는 경우)의 대각선에 접근하여 어느 셀에 접근. 후자의 방법은 조직의 수직 압축을 방지 할 수 있습니다.
참고 : 여기에서, 목표는슬라이스에 최소한의 피해를하여 세포에 접근한다. 마이크로 피펫은 딤플이 표시 셀 (도 2) (마이크로 피펫의 선단을 통해 가해지는 양압에 의한 세포 표면의 둥근 변색)에 충분히 근접 할 때. - 딤플이 (도 2-1)을 표시 할 때, 시일 (도 2-2)을 생성하기 위하여 피펫 홀더 흡입관에 접속 된 튜브를 통해 약한 간단한 흡인 적용. 막 테스트를 모니터링하십시오.
참고 : 일부 도장이 형성되어있는 경우 (<1 GΩ), ( "기가 옴 씰"또는 "기가 시일"인감 형성을 촉진하고 기가 옴에게 저항에 도달 할 수 있습니다 (컴퓨터 제어 앰프 사령관에) 유지 가능성을 낮추는 방법으로 음의 전류를 주입> 1 - 5 GΩ). 씰의 높은 저항 (> 1 GΩ)는 기록 신호에 모두 제한 소음 오염은의 기계적 안정성에 기여반점. - 기가 시일이 형성되는 동안 막 파열되면 갑작스런 변화를 방지하기 위해 전위 (V 레스트) 쉬고 생리 최대한 가까운 셀의 홀딩 전위를 가지고, 컴퓨터 - 제어 증폭기 커맨더를 사용한다. 예를 들어, MSNs는 일반적으로 전압 클램핑 -70 또는 -80 MV (: -70 -90 MV 생리 V 받침대)에 있습니다.
- 기가 시일을 형성 한 후, 수동 또는 자동으로 신속하고 느린 커패시턴스 보상. 이러한 'CP 빠른'에 대한 Multiclamp 사령관을 눌러 '자동'슬로우와 'CP "같은 컴퓨터 제어 앰프 사령관을 사용하는 경우.
- 시일이 안정 1 GΩ (또는 10 미만 주입 - 목적의 막 전위의 셀을 보유하는 20 씩) 이상을 유지하면 세포막을 파열 5.5에서와 같이 (도 2와 동일한 튜브를 통해 간단한 강한 흡인 적용 -3).
참고 :이 여러 가지 시련을 걸릴 수 있습니다. 좋은 막 파열은 승 달성편 흡입 충분히 강하게 파열 막은 막 또는 세포의 많은 부분에 그려지지하기 위하여 (기록시 R의 증가로 이어질 수있다) 마이크로 피펫하지만 약한 정도로 방해되지 않도록 수행된다. - 이 패치의 손실을 초래할 수 있으므로 성공적인 전체 셀 구성을 달성 한 후, 정기적으로 중요한 드리프트에 대한 마이크로 피펫을 평가하는 위치와 정확한 모니터링합니다. 드리프트 진폭이 여러 가지 요인에 따라 달라질 수 있습니다, 예를 들어, 리그 설치의 품질과 headstage에 당기는 힘. 이상적으로, 드리프트는 거의 존재해야합니다.
- 막 시험에서 "셀"모드로 전환하여, 이러한 R I, R S와 C P는 같은 셀의 다른 매개 변수를 볼 수 있습니다. 녹화 중에 이러한 매개 변수를 모니터링합니다.
참고 :이 모든 매개 변수 (섹션 4 단계를 "막 테스트"참조) 세포와 세포 유형의 초기 상태를 평가하는 데 도움이 될 수 있습니다. - 제 일단위의 단계 E는 완료 계획 멤브레인 전압 (예를 들면, 활동 전위 소성)의 변화를 측정하는 경우 (예 EPSCs, IPSCs) 전류를 측정, 전류 - 클램프 모드로 전환 전압 클램프 모드로 유지된다. 후자의 경우, 원하는 막 전압에서 셀을 유지하는 (+) 또는 전류를 주입 (수동 가이드 증폭기를 참조하십시오,이 단계를 수행합니다).
결과
온도 용이 실험자에 의해 제어되는 요소는, 이온 채널과 수용체의 생물 리 학적 특성에 영향을 미치는, 이로써 시냅스 전류 (PSC를) (EPSC 및 IPSCs) 스파이크를 유발하는 신경 기능의 파형.도 3 도 4는 신경 세포에 소성 온도의 영향을 각각 유발 EPSCs (eEPSCs)의 기울기를 나타낸다. 소성 패턴 (도 3)는 초과되어 조정 개구 특정 전압 - 게이트 이온 채널을 폐쇄함으로써 형성된다 (즉, 1 차 스파이크 레이턴시, 수, 주파수 및 활동 전위 파형 스파이크) (NA +, 칼슘 + 및 K +), 온도에 민감한 공정. 평균 스파이크 수는 온도에 따라 증가하는 방법 3은 그림. 스파이크 freque하지만 여기에 설명 된 실험 조건 (MSNs 녹음)에서 그 주ncy이 subphysiological 온도 (28 ° C)에서 변경 될하지 않는 것, 그것은 상당히 온도가 생리 학적으로 중요한 레벨 (32 ° C)에 도달 할 때 증가한다. 그림 4a는의 예를 보여줍니다 방법 eEPSCs의 기울기, 일반적으로 사용되는 매개 변수 시냅스 강도를 평가, 온도 증가한다.
전체 셀 구성에 밀봉 상태로 천이 할 때 R (S)가 어느 정도 효율적인 멤브레인 개구를 통해 실험, 즉,에 의해 제어 될 수 있지만, 일반적으로 R 천천히 s의 기록시 증가한다. 이 기록시 피펫 팁 막힘 통제 다양한 이벤트, 예를 들면, 멤브레인을 다시 폐쇄 또는 파편의 결과 일 수있다. 이 패치를 손상시킬 수 있지만, 약간의 흡입을 가하여 상기 멤브레인을 다시 열려고 때때로 안정 R의 S를 유지할 수있다. 모든 경우에있어서, R의 변화를 알 수 있기 때문에연구중인 전기 신호 파형 ter에게,주의 깊게 관찰하고, PSC를에게 (전압 클램프 모드) 녹화시. (4)도 특별히 표시되어야하는 경우 R의 증가 (도 4B), 글루타메이트 수용체 - 매개 된 전류의 크기 (eEPSCs ) (그림 4C, D)이 감소한다. R s의 변화 (예,이 실험실) 15 %를 초과하는 경우 일반적으로, 실험자 그러나 일부 실험실은 20 %의 변화에서 이렇게 데이터를 폐기합니다. 이 기준은 기사의 방법 섹션에 표시해야합니다.
정의 된 신경 세포의 경우, R은 온도 나, 휴대 상태 및 패치의 품질을 포함한 여러 요인에 의해 영향을받을 수있다. R i가 감소 할 때 특히, PSC 진폭 또는 뉴런의 기능도 감소 스파이크를 생성합니다. 예를 들어, 그림 4E는 R i가 크게 변화하지 않을 때, 일을 보여줍니다스파이크의 전자 번호 (신경 세포 1) 상대적으로 안정적으로 유지; 언제 R I 증가뿐만 스파이크의 수가 증가 (신경 2). 10 %의 변화가 바이어스 데이터에 대한 충분한 따라서 유사 R s의, R 내가주의 깊게 모니터링해야합니다.
전술 한 바와 같이, R은 전 녹화 중 제어 또는 온도, R (S)을 모니터하는 것이 중요하고. 예를 들어, 인해 변경 될 수있다 연구 (PSC를 또는 소성) 아래에있는 신호의 변화 (또는 제어의 부족) 이러한 요인보다는 실험 조작의 효과의 예를 들면, 전 대 후 효과를 관찰 약물 목욕 응용 프로그램입니다.

그림 1. 주문 제작 복구 회의소 (AD) 및 건강과 죽은 신경 세포 (E)를 표시 400X에서 뇌 조각의 그림. 광고)사용자 정의 복구 실을 만드는 절차는 단계 2.1에 설명되어 있습니다. NAC 내측 쉘 대 400X 건강 (빨간색 화살표의 예를 도시에서 뇌 조각에서 MSNs) 죽은 신경 세포 (파란색 화살표)의 E) 그림. 일부 세포가 건강한로 표시되어 있지만, 자신의 구형 측면 (별표와 빨간색 화살표)를 원하는대로 그들이 건강한 가능하지 않을 수도 있음을 나타내는 있습니다. 최종 건강 상태는 V의 휴식과 R을 기반으로 평가된다 i가 전체 셀 구성을 달성 한 후. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

마이크로 피펫은 토륨 충분히 가까우면. 기가 시일를 확보하고 전체 셀 구성을 설정하는 기본 절차 단계를 묘사 한 그림 2. 다이어그램즉 세포는 세포막 (단계 1 접근법)의 딤플을 작성 마이크로 피펫 및 세포막 간의 긴밀한 접촉을 생성 할 간략한 부드러운 흡입을 적용한다. 제대로 수행 한 경우, 접촉이 강화되고 저항은 증가하고 1 GΩ (기가 시일) 이상 (2 단계, 인감 형성)에 도달 할 것이다. 시일이 안정 1 GΩ 초과하면, 세포막 (단계 3, 전체 셀 구성) 파열 짧고 강한 흡입을 적용한다. 전체 셀 구성을 달성하는 것은 세포질과 마이크로 피펫 내부 사이의 연속성을 수 있습니다. 자세한 내용은 프로토콜 단계 5.1-5.8를 참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
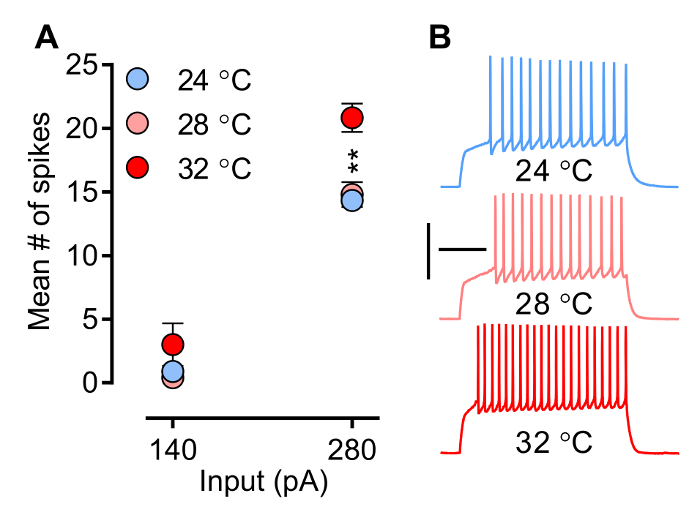
그림 3. 신경 발사 (내장 흥분)는 전류 조개에서 평가한다 P 모드. 여기서, 현재 단계의 미리 정의 된 증분 시리즈는 막 전압의 변화를 유도하기 위해 주어진, 따라서 활동 전위를 발생시킨다. A) 평균 스파이크 번호 NAC 280 펜실베니아 온도. B) 샘플 트레이스 증가 세 가지 다른 온도 설정에서 내측 쉘 MSNs (28 ° C, N = 5; 24 ° C, N = 9, 32 ° C, N = 6). 기록 챔버 내의 온도를 직접 스파이크 주파수에 영향을 미친다. 그러나 스파이크 주파수 subphysiological 온도로 변경 될 것 같지 않지만 온도 32 ° C, 생리 학적으로 관련이 온도에 도달 할 때 크게 증가 참고. 뉴런은 -80 MV에서 개최됩니다. 양방향 ANOVA : 상호 작용, P <0.0001; 온도 효과, p = 0.0041; 사후 테스트 : 24 ° C, 28 ° C는 32 ° C에서 유의 한 차이가 있습니다 ** P <0.01. 데이터는 SEM ± 평균으로 표시됩니다. 교정 : 200 밀리 초, 50 MV.jove.com/files/ftp_upload/54024/54024fig3large.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

하나의 NAC 쉘 MSN에서 eEPSC 진폭의 전기 신호에서 연구. A) 예의 파형에 온도, R S 및 R 내가이 그림 4. 효과. 24에서 28 ° C와 32 ° C로 온도를 높이면 eEPSCs의 기울기를 증가시킨다. eEPSCs 슬로프에서 온도에 의한 변화가 빠르게 발생합니다. 여기서, eEPSCs 기울기는 전압 클램프 모드에서 평가된다. 교정 : 5 밀리 초, 단일 NAC 쉘 MSN에서 eEPSCs 경사의 100 pA에 BD) 예.. R의 증가 (B)는 eEPSCs의 기울기 R의 함수로서 eEPSC 슬로프 (C). D) 상관 분석을 감소하면의. 피어슨의 R = -0.5717, p <0.0001. 뉴런 전압 클램프 -80 MV. E에) 스파이크를 생성 할 수있는 신경 세포의 기능에 R I의 효과를 나타내는 두 개의 뉴런 트레이스의 일례이다. 뉴런은 전류 클램프, -80 MV에서 개최된다. 교정 :. 200 밀리 초, 50 MV 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 프로토콜은 뇌 조각의 뉴런에서 전체 셀 패치 클램프 실험을 수행하기위한 기본 절차를 설명합니다. 그러나,이 기술의 복잡성 전위 감도 완전이 문서에서 설명 될 수 없다. 여기, 우리는 가장 기본적인 단계를 묘사하고 성공적이고 엄격한 전체 세포 녹음을 달성하기위한 제어해야합니다 중요한 매개 변수를 강조하기 위해 노력했다. 더 이론적 인 학습, 많은 책과 기사는 뇌 조각 3,21-24과 세포 생존 능력을 강화하기 위해 25 ~ 27을 사용하는 솔루션을 구체화 할 수 있습니다 방법 모두에서 전체 셀 패치 클램프 녹음에 발표되었다. 정기적으로 적절한 녹음을 수행하기 위해 집중적 인 연습을 통해 기술 능력의 향상이 필요합니다. 시냅스 기능과 고유 excitabi의 변화에 대한 중요한 정보를 제공하는 단계의 적절한 응용 프로그램이 언급과 그럼에도 불구하고, 세포가 패치 할 수있는 시간 사후,lity.
일반적으로, 신중 모두 ACSF 내부 마이크로 피펫 용액, 뇌 해부의 각 공정의 제조 성공적인 전체 셀 구성을 달성 슬라이싱 및 엄격한 바이어스 데이터를 획득하는 중요성 외에 집중 연습이 필요하다. 주로, 건강한 뇌 조각을 생성하는 것이 중요합니다. 간략하게, 뇌 (이상적으로는 <45 초), 저온 유지 신속 해부 - 슬라이싱하는 동안 (0-2 °의 C) 적절한 슬라이싱 솔루션 모든 셀 상태를 제공하는 데 중요한 역할을한다. 이 슬라이싱 솔루션은 실험실 연구 될 세포 형태 및 / 또는 뇌 영역에 따라 상이 할 수 있음을 언급 주목할 만하다. NAC 또는 등쪽 선조체를 얇게하면, 실험실 등은 수크로오스 기반 솔루션 (34), 고 마그네슘 2+와 같은 28 ~ 33은, 그러나, 다른 방법이 또한 사용될 수있다 흥분 독성 프로세스를 최소화하기 위해 슬라이싱 솔루션 kynurenic 산을 사용하여 / 저 칼슘 2 + 솔루션 (35) 등. 이들은 단지 몇 가지 예와 (인한 나이, 등) 프로세스 흥분 독성 뇌 뇌 영역의 민감도에 따라 조정될 수있다. 솔루션 및 세포 생존에 대한 자세한 내용은 25 ~ 27를 참조하십시오. 이 뇌척수액을 모방하고 슬라이싱 중에 발생 가능한 흥분 독성 과정만큼 최소화되도록 궁극적 음이온, 양이온, 및 다른 약물의 농도 (예를 들면, 아스 코르 베이트는 글루타메이트 수용체 길항제) 슬라이싱 솔루션 구도를 판단한다. 이 문서에 제시된 프로토콜은 NAC 또는 뇌 조각의 등쪽 선조체에서 MSNs에서 녹음 할 때 일상적으로 저자의 이전 연구 28-31에서 사용 된 표준 용액에 대해 설명합니다. 또한, 두 ACSF 및 내부 마이크로 피펫 솔루션에 대한 삼투압의 적절한 조정이 성공적으로 실 형성 및 전체 세포의 conf의 유지 보수를 위해 중요하다프린터의 구성. 내 피펫 솔루션 세포 외 용액의 농도 구배를 만들려면 ACSF의 삼투압 내부 마이크로 피펫 솔루션에 대한보다 커야합니다. 이상적으로, 차이는 10 ~ 30 mOsm 범위 수 있습니다.
성공적인 전체 셀 구성을 달성하는 것은 효율적인 녹음을 수행하기위한 또 다른 중요한 단계입니다. 피펫은 욕조에 배치되면 먼저, 피펫의 용량이 조절 될 수있다. 자동 설정은 일반적으로 적절하게 설정되어 있지만, 적절하게 수행하지 않을 때 이러한 세포가 손상 될 수 있으므로주의 셀 용량의 빠르고 느린 조정을 사용하는 것이 좋습니다. 둘째, 상기 멤브레인은 멤브레인의 상당한 개구부에 이끌 파열함으로써 세포 내 및 마이크로 피펫 환경 사이의 양호한 통신을 허용 할 필요가 짧은 막 흡입된다. 이는 R s는 기록을 통해 상대적으로 안정적으로 유지됩니다 보장합니다. CS-기반의 마이크로 피펫 솔루션을 사용하는 경우,막 전위가 쉬고 즉시 전체 셀 구성의 확립에 따라 평가되어야한다 (단계 5.8 참조). 실제로, 셀 내부 세슘 +의 확산을 막 쉬고 전위의 감소를 야기한다. 적절한 휴식 잠재력을 확인하려면, 액상 접합 잠재력 (20)를 평가해야합니다. 그러나, 실험 (단계 5.8 이후) 멤브레인을 깨는 후 관찰 된 휴식 잠재력을보고하고 액체 접촉 전위를 조정하지 않을 수도 있습니다. 모든 경우에서, 문서의 방법 섹션에서 언급되어야한다. 전체 셀 구성의 확립시에, C의 P는 얻어 질 수 있고 전지 상태 및 / 또는 세포 유형을 평가하는 간접 파라미터로서 사용될 수있다. 셋째, 녹음이 시작했을 때, 다른 매개 변수를 엄격하게 모니터링해야합니다. 신경 세포의 흥분을 평가할 때 제어되어야 중요한 요소는 온도, R s의, 및 R 내가있다.
같이위에서 언급 한, R 및 I C p를 셀 상태 및 / 또는 세포 유형을 나타낼 수있다. 예를 들어, 세포막은 절연체로서 작용 함께 막 용량을 구성한다 (세포 내 및 세포 외 용액의 다른 성분으로 인해) 전하를 분리한다. 용량이 클수록 막 표면 (뉴런 특이 적) 클수록. 그런 다음 놀라운 일이 아니다 특정 신경 세포 유형의 전시 C p와 R I 동일한 범위 내 (수학적 C (P)에 관련). R S는 피펫 팁의 크기에 직접적으로 관련되어, 따라서 일반적으로 품질이나 막 개구부의 크기를 나타낸다. 간단히, 전체 셀 구성을 확립시 세포질 마이크로 피펫으로 용액 도통 외부 매체로부터 완전히 격리된다. R (S) (또는 R의 A)는 CURREN 대한 저항에 기인t는 세포질에 피펫에서 흘러합니다. 일부 촬영 조건 (예를 들어, 현재 클램프 모드 또는 전압 - 게이트 이온 전류의 전압 클램프 녹음)의 경우, R의이 적절하게 보상되어야한다 (참고를 참조하십시오. 3,21-24 또는 적절한 R의 보상을위한 앰프 매뉴얼 가이드) .
도 4에 설명 된대로 극적 전기 신호 파형 예 EPSC 진폭에 영향을 줄 수 있기 때문에, R (S)가 특히 중요하다. 그럼에도 불구하고, R들주의 깊게 관찰 된 효과의 오프라인 해석에 대해 모니터링해야합니다. 경우에, 막은되는 경우 R의 증가 바이어스 연구중인 전기 신호의 파형 (도 4B-D) 마이크로 피펫 팁 막힘이나 막의 리 클로저 발생 적절히 파열되지 않았다. 요약하면, 많은 문제가 기록하는 동안 발생 될 수 있으며, 사람들은 일반적으로 세 가지 범주에 속하는 : ⅰ) 조직 관련예를 들면, 빈약 해부, ACSF의 삼투압 및 저산소증의 부적응에 세포 사망률을 증가; ⅱ) 장비 관련, 예를 들어, 소음과 접지 문제, 온도 조절, 조각 및 마이크로 피펫 위치, 등.; 및 ⅲ) 데이터의 해석은, 예를 들면 변화가 전기 파형 변화 파라미터의 변화 (R 난 R의 온도는,도 3 및 4 참조)보다는 실험 결과와 같은 데이터를 가압 불필요한 실험 아티팩트의 결과 일 수있다 관찰 조작.
뇌 조각의 전체 셀 녹화 환경 의존적 가소성을 평가하기위한 강력한 방법이지만,이 방법은 데이터의 해석을 제한한다. 특히, 전체 - 세포의 기록 방법의 세 가지 중요한 제한 사항은 그 (ⅰ) 특정 단백질 (예를 들면, 이온 채널)를 구별 할 수없는 기능의 발현 수준의 변화; (ⅱ)이 때문에기술은 그것을 관찰 이온 전류 또는 변경의 정확한 서브 셀룰러 현지화를 제공하지 않습니다 전체 막을 통한 전류 흐름 (또는 상당 부분을) 평가; 일부 현상이 개발하거나 표현하는 (ⅲ) 전체 셀 구성의 침윤 세포 내 분자 기계의 장애로하여 필요한 셀 콘텐츠의 리드 투석하고. 투석을 방지하는 한 가지 방법은 날카로운 전극 녹음 또는 천공 패치 3,21,23 기술을 사용하는 것이다. 이러한 스타틴과 같은 후자 조공 항생제 분자 관해서하는 피펫 용액에 첨가 될 수있다. 이러한 기공의 형성은 세포 내 두 번째 메신저 메커니즘을 방해하지 않고 전류의 기록을 수 있습니다. 그럼에도 불구하고, 최근 나노 기술의 발전과 nanoelectrodes (36)의 개발은 신경 녹음을 개선하기위한 강력한 도구를 제공합니다. developmen는 아래에 여전히 신경 과학에서 이러한 기술 발전t과는 이제 고전으로 지금까지 접근하지 않았다 서브 세포 구획 내에서 이온 채널의 기능을 그대로 세포 내 환경을 유지, 우리의 범위에서, 즉 최소한의 침입으로 패치 클램프 및 세포 내 녹음을 수행 할 수있는 가능성을 가하고, 그리고 조사 패치 클램프 전극 (37).
공개
저자의 아무도는 경쟁의 이익 또는 충돌하는 이해 관계가 없습니다.
감사의 말
이 연구는 UT 사우스 웨스턴 시작 기금 (SK)에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Isolated pulse stimulus generator | A.M.P.I | Master-8 | |
| Isolation unit (ISO-Flex) | A.M.P.I | ISO-Flex | |
| Computer controlled Amplifier | Molecular Devices | Multiclamp 700B | |
| Digital Acquisition system | Molecular Devices | Digidata 1500 | |
| Microscope | Olympus | BX-51 | |
| Micromanipulator | Sutter Instruments | MPC-200 | |
| Chamber and in-line Heater | Warner Instruments | TC-344B | |
| Vibratome Slicer | Leica | VT1000 S | |
| Micropipette Puller | Narishige | PC-10 | |
| Imaging Camera | Q Imaging | QIClick-F-M-12 | |
| Narishige pipette puller PC-10 | Narishige | PC-10 | |
| Glass capillaries | WPI | TW150F-3 | |
| Slice hold-down (harp) | Warner Instruments | 64-0255 | |
| Slice Chamber | Warner Instruments | RC-26 | |
| Nonmetallic syringe needle | World Precision Instruments | MF28G67-5 | |
| Syringe filters | Nalgene | 176-0045 | |
| Glue Gun | Home Depot | various | |
| Gas dispersion tube | Ace Glass Inc. | various | |
| Decapitation scissors | Home Depot | 100649198 | |
| Scalpel Handle #3 | World Precision Instruments | 500236 | |
| Small straight sharp tips scissors | World Precision Instruments | 14218 | |
| Vessel canulation forceps | World Precision Instruments | 500453 | |
| Curved hemostatic forceps | World Precision Instruments | 501288 | |
| Economy Tweezers #3 | World Precision Instruments | 501976-6 | |
| Spatula | Fisher Scientific | 14357Q | |
| Scooping spatula | Fisher Scientific | 14-357Q | |
| Petri dish | Fisher Scientific | 08-747B | |
| Filter paper | Lab Depot | CFP1-110 | |
| Solutions | |||
| Cs-Gluconate internal solution (pH 7.2–7.3, 280–290 mOsm) | |||
| D-gluconic acid 50% | Sigma Aldrich/various | G1951 | |
| Cesium-OH (CsOH) 50% | Sigma Aldrich/various | 232041 | |
| NaCl, 2.8 mM | Sigma Aldrich/various | S7653 | |
| HEPES, 20 mM | Sigma Aldrich/various | H3375 | |
| EGTA, 0.4 mM | Sigma Aldrich/various | E4378 | |
| tetraethylammonium-Cl, 5 mM | Sigma Aldrich/various | T2265 | |
| Na2GTP, 0.3 mM | Sigma Aldrich/various | G8877 | |
| MgATP, 2 mM | Sigma Aldrich/various | A9187 | |
| K-Gluconate internal solution (pH 7.2–7.3, 280–290 mOsm) | |||
| K D-gluconate, 120 mM | Sigma Aldrich/various | G4500 | |
| KCl, 20 mM | Sigma Aldrich/various | P3911 | |
| HEPES, 10 mM | Sigma Aldrich/various | H3375 | |
| EGTA, 0.2 mM | Sigma Aldrich/various | E4378 | |
| MgCl2 | Sigma Aldrich/various | M8266 | |
| Na2GTP, 0.3 mM | Sigma Aldrich/various | G8877 | |
| MgATP, 2 mM | Sigma Aldrich/various | A9187 | |
| Standard artificial cerebrospinal fluid (ACSF, osmolarity ≈ 300-310 mOsm) | |||
| KCl, 2.5 mM | Sigma Aldrich/various | P3911 | |
| NaCl, 119 mM | Sigma Aldrich/various | S7653 | |
| NaH2PO4•H2O, 1 mM | Sigma Aldrich/various | S9638 | |
| NaHCO3, 26.2 mM | Sigma Aldrich/various | S8875 | |
| Glucose, 11 mM | Sigma Aldrich/various | G8270 | |
| MgSO4-7H2O, 1.3 mM | Sigma Aldrich/various | 230391 | |
| CaCl2-2H2O, 2.5 mM | Sigma Aldrich/various | C3881 | |
| Additional compounds used for solutions preparation | |||
| KOH | various | ||
| Kynurenic acid | Sigma Aldrich/various | K3375 | |
참고문헌
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibres. Nature. 260 (5554), 799-802 (1976).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annu Rev Physiol. 46, 455-472 (1984).
- Cahalan, M., Neher, E. Patch clamp techniques: an overview. Methods Enzymol. 207, 3-14 (1992).
- Staley, K. J., Otis, T. S., Mody, I. Membrane properties of dentate gyrus granule cells: comparison of sharp microelectrode and whole-cell recordings. J Neurophysiol. 67 (5), 1346-1358 (1992).
- Horn, R., Marty, A. Muscarinic activation of ionic currents measured by a new whole-cell recording method. J Gen Physiol. 92 (2), 145-159 (1988).
- Pusch, M., Neher, E. Rates of diffusional exchange between small cells and a measuring patch pipette. Pflugers Arch. 411 (2), 204-211 (1988).
- Kandel, E. R., Dudai, Y., Mayford, M. R. The molecular and systems biology of memory. Cell. 157 (1), 163-186 (2014).
- Kourrich, S., Bonci, A. Chapter 5: Synaptic and Neural plasticity. Neurobiology of Mental Illness. 4th edn. , Oxford University Press. (2013).
- Mozzachiodi, R., Byrne, J. H. More than synaptic plasticity: role of nonsynaptic plasticity in learning and memory. Trends Neurosci. 33 (1), 17-26 (2010).
- Zhang, W., Linden, D. J. The other side of the engram: experience-driven changes in neuronal intrinsic excitability. Nat Rev Neurosci. 4 (11), 885-900 (2003).
- Kourrich, S., Calu, D. J., Bonci, A. Intrinsic plasticity: an emerging player in addiction. Nat Rev Neurosci. 16 (3), 173-184 (2015).
- Luscher, C., Malenka, R. C. Drug-evoked synaptic plasticity in addiction: from molecular changes to circuit remodeling. Neuron. 69 (4), 650-663 (2011).
- McEwen, B. S., Morrison, J. H. The brain on stress: vulnerability and plasticity of the prefrontal cortex over the life course. Neuron. 79 (1), 16-29 (2013).
- Sandi, C., Haller, J. Stress and the social brain: behavioural effects and neurobiological mechanisms. Nat Rev Neurosci. 16 (5), 290-304 (2015).
- Kim, S. J., Linden, D. J. Ubiquitous plasticity and memory storage. Neuron. 56 (4), 582-592 (2007).
- Ganguly, K., Poo, M. M. Activity-dependent neural plasticity from bench to bedside. Neuron. 80 (3), 729-741 (2013).
- Kullmann, D. M., Moreau, A. W., Bakiri, Y., Nicholson, E. Plasticity of inhibition. Neuron. 75 (6), 951-962 (2012).
- Bar-Yehuda, D., Korngreen, A. Space-clamp problems when voltage clamping neurons expressing voltage-gated conductances. J Neurophysiol. 99 (3), 1127-1136 (2008).
- Williams, S. R., Mitchell, S. J. Direct measurement of somatic voltage clamp errors in central neurons. Nat Neurosci. 11 (7), 790-798 (2008).
- Neher, E. Correction for liquid junction potentials in patch clamp experiments. Methods Enzymol. 207, 123-131 (1992).
- Defelice, L. J. Electrical Properties of Cells-Patch Clamp for Biologists. , Plenum Press. (1997).
- Kornreich, B. G. The patch clamp technique: principles and technical considerations. J Vet Cardiol. 9 (1), 25-37 (2007).
- Molleman, A. Patch Clamping: An Introductory Guide To Patch Clamp Electrophysiology. , John Wiley & Sons, Ltd. (2003).
- Neher, E., Sakmann, B. The patch clamp technique. Sci Am. 266 (3), 44-51 (1992).
- Richerson, G. B., Messer, C. Effect of composition of experimental solutions on neuronal survival during rat brain slicing. Exp Neurol. 131 (1), 133-143 (1995).
- Tanaka, Y., Tanaka, Y., Furuta, T., Yanagawa, Y., Kaneko, T. The effects of cutting solutions on the viability of GABAergic interneurons in cerebral cortical slices of adult mice. J Neurosci Methods. 171 (1), 118-125 (2008).
- Ye, J. H., Zhang, J., Xiao, C., Kong, J. Q. Patch-clamp studies in the CNS illustrate a simple new method for obtaining viable neurons in rat brain slices: glycerol replacement of NaCl protects CNS neurons. J Neurosci Methods. 158 (2), 251-259 (2006).
- Kourrich, S., et al. Dynamic interaction between sigma-1 receptor and Kv1.2 shapes neuronal and behavioral responses to cocaine. Cell. 152 (1-2), 236-247 (2013).
- Kourrich, S., Klug, J. R., Mayford, M., Thomas, M. J. AMPAR-Independent Effect of Striatal aCaMKII Promotes the Sensitization of Cocaine Reward. J Neurosci. , (2012).
- Kourrich, S., Rothwell, P. E., Klug, J. R., Thomas, M. J. Cocaine experience controls bidirectional synaptic plasticity in the nucleus accumbens. J Neurosci. 27 (30), 7921-7928 (2007).
- Kourrich, S., Thomas, M. J. Similar neurons, opposite adaptations: psychostimulant experience differentially alters firing properties in accumbens core versus shell. J Neurosci. 29 (39), 12275-12283 (2009).
- Rothwell, P. E., Kourrich, S., Thomas, M. J. Environmental novelty causes stress-like adaptations at nucleus accumbens synapses: implications for studying addiction-related plasticity. Neuropharmacology. 61 (7), 1152-1159 (2011).
- Rothwell, P. E., Kourrich, S., Thomas, M. J. Synaptic adaptations in the nucleus accumbens caused by experiences linked to relapse. Biol Psychiatry. 69 (11), 1124-1126 (2011).
- Koya, E., et al. Silent synapses in selectively activated nucleus accumbens neurons following cocaine sensitization. Nat Neurosci. 15 (11), 1556-1562 (2012).
- Conrad, K. L., et al. Formation of accumbens GluR2-lacking AMPA receptors mediates incubation of cocaine craving. Nature. 454 (7200), 118-121 (2008).
- Kruskal, P. B., Jiang, Z., Gao, T., Lieber, C. M. Beyond the patch clamp: nanotechnologies for intracellular recording. Neuron. 86 (1), 21-24 (2015).
- Novak, P., et al. Nanoscale-targeted patch-clamp recordings of functional presynaptic ion channels. Neuron. 79 (6), 1067-1077 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유