Method Article
脳スライスにおける全細胞パッチクランプ記録
要約
このプロトコルは、全細胞パッチクランプ記録を実行するための基本的な処理手順を説明します。この技術は、神経細胞の電気的挙動の研究を可能にし、脳スライスに行ったときに、まだ比較的よく保存脳の回路に集積されているニューロンからの様々な神経機能の評価を可能にします。
要約
全細胞パッチクランプ記録は、ニューロンの要部の電気的特性の研究を可能にする電気生理学的手法です。この構成では、マイクロピペットは、リーク電流を防止し、それによって以前に使用され、細胞内シャープ電極記録方法よりも正確なイオン電流の測定値を提供する細胞膜と密着しています。古典的には、全細胞記録は、細胞培養モデル、解離ニューロン、脳切片におけるニューロンを含む製剤の各種におけるニューロン上で実行し、完全な麻酔または覚醒動物であることができます。要約すると、この技術は非常に興奮性細胞のパッシブとアクティブの生物物理学的特性の理解に貢献してきました。この手法の主な利点は、特定のニューロンの機能またはCを変化させることができる方法の特定の操作( 例えば 、薬理学的、実験誘起塑性)に関する情報を提供することですリアルタイムでhannels。また、原形質膜の重要な開口部は、特定の細胞内タンパク質の薬物、 例えば 、アゴニストまたはアンタゴニストを導入し、そして隣接セルにおけるそれらの機能を変更することなく、これらのターゲットを操作するための手段を提供し、自由に細胞質中に拡散するための内部ピペット溶液を可能にします。この記事では、脳切片におけるニューロンの生理学的に関連する文脈で、 すなわち 、比較的よく保存され、脳の回路内のニューロンを記録するという利点があるの準備を行って全細胞記録に焦点を当てます。具体的には、適切な薬理学と組み合わせたときに、この技術は、このような学習、乱用薬物への曝露、ストレスなどの経験、任意のタイプ以下の発生した特定の神経適応の同定を可能にする強力なツールです。要約すると、脳切片における全細胞パッチクランプ記録は、ex vivoで調製長期的な変化を測定する手段を提供します無傷の覚醒した動物で開発した神経細胞の機能インチ
概要
パッチクランプ法、1970年代後半1,2に開発された電気生理学的技術は、生きている組織では、単一または複数のイオンチャネルの機能を研究するための主要なツールです。達成することができる別のパッチ構成の中で、全細胞パッチクランプ記録は、ニューロンの要部の電気的挙動の研究を可能にします。古典的には、この技術は、脳スライス、新たに解離ニューロンの、または細胞培養モデル3のいずれかでインビトロで行われます。脳スライス中のニューロン上で実行するとき、この手法にはいくつかの利点を提供します。具体的には、(i)ニューロンは、ある程度相対的に保存脳回路に記録され、そして細胞培養調製物と比較して、3生理学的に関連する環境を提供します。これは、急性pharmacologのいずれかのタイプによってトリガされた細胞および分子事象を早期に取り込む、あるいはリアルタイムでモニタリングすることができますiCalの操作- 生体内条件の古典用いて達成することができない時間分解能。視覚的に脳スライスに脳領域を識別するために、(ii)の機能は、両方の彼らは、蛍光マーカーを発現時に脳領域が研究のために、特定のニューロンのための高い地域の特異性3を可能にします。 (ⅲ)(細胞内記録のための鋭いマイクロピペットで膜に穴を開けるとは対照的に)形質膜4のかなりの部分を開放することにより、細胞の細胞内空間へのアクセスを。今度は、これは、内部液を構成する特定のイオンの含有量または濃度が非常に分子標的を変更するか、細胞のメカニズムが異なる条件下で研究することができることができます。例えば、全細胞構成、任意の特定の薬理学的薬剤( 例えば 、アンタゴニスト)を確立時に1が記録マイクロピペット(パッチピペット)溶液は、直接細胞質内に拡散し、そのputatに作用しに追加できます隣接するセル内のターゲット関数を変更することなく、細胞内標的をアイブ。さらに、シャープなマイクロピペットの記録と比較して、パッチクランプ電極の先端の大きな開口部は低抵抗、あまり競合ノイズ、ひいてはセル4の内側へのより良い電気的アクセスを提供します。しかし、ピペットチップでの大きな開口部はセル透析、および研究5,6の下にある生物学的現象の発現に重要であり得る細胞内分子機構のそれによって損失につながる可能性があることに注意してください。この場合には、シャープ電極記録は、より適切であり得ます。録音のこのタイプは、それによって細胞内空間と内部ピペット溶液との間のイオン交換を最大限に防止する、全細胞記録のために使用されるものよりもはるかに小さい孔を有するマイクロピペットを必要とします。
7月10日の学習を含む(急性または慢性)経験のいずれかの形、乱用11,1の薬物への曝露2 等ストレス13,14は 、特定の脳領域における神経機能の様々な態様を変化させることができます。これらの変化は、多くの場合、(数時間から数日)を開発するために時間が必要であるため、具体的な経験を受けた動物からの脳スライスにおける全細胞記録は、研究者は、これらの変更を識別することができます。基本的に、(すべてではない)、ニューロンの機能に関与する成分( 例えば 、リガンド活性化イオンチャネル、電位依存性イオンチャンネル、神経伝達物質トランスポーター)、それによって脳回路の活動および行動の多くは、経験によって変化させることができる(経験に依存可塑性)10,15-17。神経細胞レベルでは、脳の回路の活動は、シナプスの間に一定の相互作用( 例えば 、グルタミン酸伝達)および固有細胞の興奮因子( 例えば 、axosomato樹状イオンチャネルから出:;カリウム、K +、ナトリウム、Na +およびカルシウム、 の Ca 2+ )。 wholを使用して、特定の条件の下で電子細胞は、パッチクランプ電気生理学的手法、シナプス対固有興奮性の変化から、具体的発信信号の変化を単離することができます。
ほとんどの場合、シナプスの興奮は、全細胞電圧クランプ技術を用いて評価され 、この記録モードは、αアミノ-3-ヒドロキシ-5-メチル-4- isoxazolepropionic酸受容体(によって媒介される、 例えば [イオン電流の測定を可能にしますAMPA受容体)および神経原形質膜を介してN-メチル-D-アスパラギン酸受容体(NMDA受容体)]のセット電圧で膜電位を保持しています。ここでは、実験者は、セシウム(Cs +)を含有する内部マイクロピペットソリューション、K +チャネル(キー固有興奮要因)の幅広いブロッカーを使用します。全細胞構成の確立時に、細胞内空間内のCs +の拡散は、K +チャンネルを遮断し、それによって、比較的効率的なスペースでクランプと事前の両方を許可します他の測定上の本質的な興奮の要因の影響をベント。不規則な形の細胞( 例えば 、ニューロン)、および18,19アーバ広大で複雑 な樹状で、特にニューロンを記録するときにスペースクランプの問題は、 すなわち 、電圧クランプに難易全細胞は、発生します。体細胞電圧クランプ不十分コントロールニューロンの樹状突起における電圧ので、研究対象の樹状電気信号の様々な態様は、樹状距離依存的に歪んでいます。 (人工脳脊髄液、ACSF)細胞外溶液に溶解し、このようなピクロトキシン(ガンマ-アミノ酪酸、GABA受容体拮抗薬)またはキヌレン酸(グルタミン酸受容体の広いブロッカー)などの薬理学的なツールと組み合わせることで、この技術は、グルタミン酸の測定を可能にしますそれぞれ受容体とGABA A R媒介電流。
対照的に、本質的な興奮性は、通常、電流 - クランプ記録モードで評価されます。電圧クランプ記録とは対照的に、この記録モードは、神経細胞膜を通って流れるイオン電流により誘導される膜電位の変化を測定することができます。典型的には、内因性の興奮性の変化は、両方のNa +及びK +チャネルを必要とする活動電位を生成するニューロンのための能力の変化を介して評価されます。電流クランプ記録を行う際したがって、マイクロピペットは、K +の代わりのCs +を含有する内部溶液で満たされています。グルタミン酸やGABA ACSFに溶解し、受容体媒介電流を遮断する薬理学的薬剤と組み合わせることで、この実験デザインは、シナプスの興奮の潜在的な変化によって汚染されることなく、ニューロンの発火に固有の要因( 例えば 、K +チャネル)の寄与を測定することができます要因。
この記事では、トンの基本的な必要な手続きの手順を説明しますO(ⅰ)健康な脳スライスを準備します。 (ii)の全細胞構成を達成し、および(iii)シナプスおよび固有興奮性を評価するための基本的なパラメータを監視します。
プロトコル
全ての実験は、UT南西施設内動物管理使用委員会によって承認されたプロトコルに従って行われ、実験動物が経験するストレス、不快感および痛みを最小にするように選択しました。
1.ソリューション
注:事前にマイクロピペット内部ソリューションを準備します。最も基本的な実験目的のために、ソリューションの2種類で十分です:セシウム+ベースとK +ベースのソリューションを提供しています。
- 電圧クランプ実験のために使用するのCs +ベースの溶液( 例えば 、セシウム+グルコン酸溶液を、 マテリアルを参照)。 RTで準備します。
- 3.54グラムのCsOHを(〜2.01ミリリットル)で4.62グラムのD-グルコン酸(〜3.696ミリリットル)を混合することにより、117 mMのセシウムグルコン酸溶液を調製します。
- ddH 2 O 90ミリリットルを追加し、30分間平衡化させます。
- 0.4mMのEGTA = 15.2ミリグラム; 2.8のNaCl = 16.4ミリグラム; 5mMのテトラエチルアンモニウム(TEA固体成分(20mMのHEPES = 0.476グラムを追加します。)塩化= 83 mg)を。
- 〜97ミリリットルにのddH 2 Oを追加します。
- 7.2に50%のCsOHで溶液のpHを調整する - 7.3。
- ddH 2 Oで、必要に応じて浸透圧と正しいを確認してください
注:良い範囲は〜280です - 285ミリオスモル。 ( - 310 mOsmで、私たちの研究室で300mOsmで通常300)20 mOsmで標準ACSFの浸透圧の下に - 最適な浸透圧は15でなければなりません。浸透圧は、ソリューションの特定の組成に応じて変えることができます。 - -20℃以下で千μLとストアへのアリコート。
- 準備、アリコート、凍結、および記録の日に内部液にATP / GTPを追加します。
- 10ミリグラムGTPに64.63ミリグラムのATPを追加してのddH 2 Oの637.11μlの溶解
- -20℃以下で10μlのアリコートとストアを準備します。実験の日に、内部液の千μlの各100xのアリコートを混ぜます。 ATP / GTPを内部溶液に添加されると、ATP / GTP degradatiを防止するために氷の上に維持しますに。
- ニューロンの発火を評価することができるように、K +コンダクタンスが機能しての電流と電圧クランプ実験の両方に使用するK +ベースの溶液( 例えば 、K-グルコン酸ソリューション、 マテリアルを参照してください)。 RTで準備します。
- 所望の最終量に応じてすべての材料を計量します。溶液を90ミリリットル、120 mMのK-グルコン酸= 2.81グラムを調製するために、 20 mMのKClを0.149グラムを=。 10mMのHEPES = 0.238 gであり0.2mMのEGTA = 0.008グラム。 2のMgCl 2 = 0.021グラム。
- 最終溶液の体積の90%に達するのに十分なのddH 2 Oを使用してください。これは、十分なスペースがpH及び浸透圧調整のために残されていることを確認する必要があります。
- すべての成分を添加し、混合した後、溶液はpH値を測定する前に明確であることを確認してください。
- K +水酸化物 (KOH)を使用して、7.3 -絶えず攪拌しながら、pHを7.2に調整します。
- pHを調整した後、浸透圧計と広告を使用します285 mOsmで - 280のちょうど浸透圧。
注:最適な浸透圧は15でなければならない - 標準ACSFの浸透圧より20 mOsmで(通常は300から310 mOsmで、私たちの研究室で300mOsmで)。浸透圧は、ソリューションの特定の組成に応じて変えることができます。 - -20℃以下で千μLとストアへのアリコート。
- (ステップ1.1.8を参照)の準備、アリコート、凍結、および記録の日に内部液にATP / GTPを追加します。
- 標準ACSF( 材料を参照)の1 Lを用意。
注:脳スライスにおける中型有棘ニューロン(MSNs)を記録するときに我々は我々の研究室で、このレシピを使用し、しかし、レシピは研究室との間で異なることがあり、そのため、私たちは関心の脳領域を記録する際に実験者が日常的に使用されているレシピを使用することを推奨します。 - 解剖ACSF準備(スライスソリューション、〜125ミリリットルに注意してください。それは完全に脳を水没する必要がありますように正確なボリュームがスライス室の大きさによって異なります)で使用するために2.8から2.2を繰り返します。
- スライス時に脳を沈めるために十分な量で標準ACSFで(グルタミン酸受容体によって誘発される興奮毒性プロセスをブロックする)を5mMにキヌレン酸を準備します。キヌレン酸を溶解を助けるために超音波処理器を使用してください。
注:超音波処理の長さは、溶液中の固形分の体積と量に応じて変化し得ます。 ( - 私たちの条件で2分の周り1)ソリューションは、プロセスの終わりまでに明確でなければなりません。 - 2°C -温度が0になるまで氷のバケツで95%O 2、5%CO 2ガスでバブリングしながらクールダウン。
- スライス時に脳を沈めるために十分な量で標準ACSFで(グルタミン酸受容体によって誘発される興奮毒性プロセスをブロックする)を5mMにキヌレン酸を準備します。キヌレン酸を溶解を助けるために超音波処理器を使用してください。
- 記録用ACSFを準備します。
- 標準ACSFの1 Lを取る(または任意のステップ1.3で調製した溶液から左)これに適切な薬理学的薬剤は、計画された実験に応じて添加してもよいです。
- 興奮性シナプス後電流または電位(EPSCsまたはのEPSP)、グルタミン酸受容体拮抗薬(kynureを記録する場合、例えば、100μMのピクロトキシンを追加NIC酸、2 mMの。またはシナプス事象の影響を受けるの非存在下でのニューロンの発火を評価する際抑制性シナプス後電流または電位(性IPSCまたはIPSPsの)、両方のピクロトキシンおよびグルタミン酸受容体拮抗薬を記録するD-APVの組み合わせCNQX、10μMと50μM)。
- 標準ACSFの1 Lを取る(または任意のステップ1.3で調製した溶液から左)これに適切な薬理学的薬剤は、計画された実験に応じて添加してもよいです。
2.スライスの準備
- スライス回収室を構築したり得ます。
注:回収チャンバ原理は簡単であり、実験室( 図1)で作製することができます。簡潔には、チャンバは、バスケットは、ACSFの表面よりも低いレベルで脳切片を保持するように挿入された容器です。様々な科学的な企業もスライス回収室を販売しています。- 30ccのシリンジを切断して、 - (高6から4mm)(B、平面図(a)、側面図)の例としては、4つのリングを得ます。その後、接着剤( 例えば 、ナイロンHOSから切り出しネットを伸ばしe)のリングの片側に脳スライス( 図1B)を保持し、一緒にリングを接着します。
注:グルーガンを使用することができます。 - 環四 つが接着されると、回復脳切片( 図1CおよびD)からの酸素の泡をそらすためにリング( 図1AおよびB)の2つに湾曲した等脚台形状のプラスチック壁を接着。 図1Dに示すように、プラスチック製の壁と同じ側のシステム(ここでは、ガス分散管)拡散酸素を挿入します。
- 30ccのシリンジを切断して、 - (高6から4mm)(B、平面図(a)、側面図)の例としては、4つのリングを得ます。その後、接着剤( 例えば 、ナイロンHOSから切り出しネットを伸ばしe)のリングの片側に脳スライス( 図1B)を保持し、一緒にリングを接着します。
- 2℃ -スライスする前に、含酸素化合物(95%O 2/5%CO 2)とスライス液を冷却0にする(ステップ1.4を参照してください)。
- RTで標準ACSFでカスタム回収室を埋めます。 ACSFはよく酸素であることを確認してください - 回収室にスライスを配置する前に(20〜30分、時間がチャンバの容積に応じて異なる場合があります)。気泡が直接詐欺に来ていないことを確認してくださいスライスでタクトまたはそれらを混乱させる。
- ライン氷でビブラ製氷皿とスライス室の2分の1〜3分の1が水没するように、冷たい水で満たします。慎重ので、どちらのアイテムがブレード移動またはスライス操作を妨害するスライスチャンバー内の酸素デリバリーシステム( 例えば 、ガス拡散石)および温度プローブを配置します。
- 脳を抽出し、所望の脳領域を切開するために必要な解剖エリアやツールを準備します。
注:実際に実行解剖は、特定の脳領域に依存することになるなど、さまざまな脳の構造が異なる平面( 例えば 、冠状、矢状、または水平スライス。)でスライスする必要があります検討しました。- アンダーパッド上で以下のツールを配置します:断頭はさみ、メス、小さなストレート鋭い先端はさみ、血管カニュレーション鉗子(例えば鉗子などまたはワイド先端を持つ任意の手術用具、ラットの頭蓋骨に適している)、湾曲した止血鉗子、TWeezers、へら、へら、濾紙、ペトリ皿、単一のエッジかみそりの刃、およびシアノアクリレート接着剤をすくい取ります。
- 温度が0に達すると - 2℃を、スライス室(バッファトレイ)にスライスソリューションを転送します。
- イソフルランを使用して、乾燥室でマウスを麻酔。正確な量は、使用室の大きさに応じて異なりますが、小さな靴箱ケージのために数滴を使用してもよい(〜3から4)。不動までケージにマウスを残す(触覚刺激に応答していません。ここに記載された条件のために約15秒)。心臓が鼓動を停止する前に(細胞の生存率を向上させる)、その後、動物を深く麻酔されていることを確認首を切るために、尾と足のピンチテストを実行します。
注:適切な正当化では、いくつかの研究室が可能な、興奮毒性プロセスな限り最小限に抑え、細胞の生存率を高めるために、ライブ断頭を実行するための許可を取得。 - 解剖を行います。
注:脳がなければなりません急速に抽出した(<45秒)。- メスを使用すると、吻側から尾側に頭蓋骨の上に表皮を切りました。
- 頭部の両側に頭皮の皮をむきます。
- 小さなストレート鋭い先端のハサミを使用して、小脳を除去するために、ラムダ縫合に沿って壁間の板をカット。後頭骨を削除します。
- 同じハサミを使用して、矢状縫合糸を切ります。
- 各頭頂骨下の血管のカニュレーション鉗子(または鉗子ラットの頭蓋骨を破壊されている場合)をスライドさせ、脳を露出するように引っ張ります。
- 湾曲した止血鉗子を使用して、その後、骨折を除去するために、ピンセットや血管のカニュレーション鉗子を使用し、それらを破壊するために前頭骨をつまみます。それは解剖を妨害することができるようにできるだけ穏やか硬膜をカットし、削除します。
- 脳下記のへらをスライドさせ、ゆっくりと以前に氷のように冷たいACSFで満たされたスライス室(バッファトレイ)に配置する頭蓋骨から脳を引き出します。脳をしてみましょう2分 - 1のためにクールダウン。
- 、氷とより大きな表面接触を可能にするために、いくつかの氷水でペトリ皿を充填することにより解剖プラットフォームを準備し、その蓋でそれをカバーし、上にろ紙を置きます。冷たいACSFでろ紙を湿ら。
- 脳を冷却された後、氷で満たされたペトリ皿に脳を置き、迅速スライスの所望の面を得るための適切な解剖を行います。
- 側坐核(NAC)を含む矢状スライスを得るためには、切断され、彼らはまだ存在している場合嗅覚結節および小脳を除去するために、単一のエッジかみそりの刃を使用します。 (ステップ2.8.11を参照)、試料保持板に接着される平坦な表面を得るために、右半球の外側縁から3ミリメートル - 次に、2の矢状カットを行います。
注:のみ2切削 - 半球の外側縁から3mmすることは両半球から側坐核を含むスライスの収集を可能にします。適切な解剖は異なります検討されている脳の領域上。ここでは、切開が行われるので、側坐核ニューロンは矢状脳切片に記録することができます。 - 急速にのりスライスの所望の平面に応じてプレート上に脳の平らな切断面(試料保持板に適用されるシアノアクリレート接着剤を使用して)。矢状脳切片を得るためにステップ2.8.10を参照してください。
- 脳は、吻側 - 尾側にスライスされるので、すぐにスライスチャンバー内の試料保持板を配置して固定します(安全のために、試料プレートが固定されている場合のみ、ブレードホルダーを設定)。
- 適切なスライスパラメータ(: - 4、振動9-10、およびスライス厚250μmのスピード3 の材料で述べたビブラトームのためのラボで使用されるパラメータ)でビブラトームを設定します。
- スライス時には、(ステップ2.3参照)(室温で)回収室に脳スライスを転送するためにプラスチックトリミングトランスファーピペットを使用しています。回復時間は、研究中である神経細胞型に応じて変えることができます(一般的に30から90分)。
3.録音マイクロピペットとリグの準備
- 希望するマイクロピペットの特性を得るために、プラーユーザーズマニュアルの具体的なガイドラインを参照してください。
注:MSNsために、我々は3.2から4.0MΩのピペット抵抗範囲を使用しています。 - ACSFに酸素および/分2ミリリットルへの流れを調整します。施設に設置蠕動ポンプまたは真空ラインを用いた真空ACSF。
- 灌流ヒータコントローラをオンにして、所望の温度を得るために、温度設定を調整( 例えば 、31.8から32.2°C)を。
注:温度安定性は、一定のACSFレベルとチャンバ内の一定流速の両方を有するに依存します。いくつかの生物物理学的ニューロンの性質ので( 例えば 、入力抵抗、R Iとも呼ばれる膜抵抗、R m)は温度に敏感であり、安定した温度を維持することが重要です。 - コンピュオンにしますター制御増幅器、カメラ、マイクロマニピュレーターおよび顕微鏡背景光。組織の電気的刺激を必要とする実験を行った場合、刺激コントローラと分離ユニットの電源をオンにします。
注:他のいくつかのアンプは、正確な操作手順のためのマニュアルを参照することをお勧めしますので、使用前に「ウォームアップ」をお勧めし製造しています。 - カメラのキャプチャ、信号取得およびアンプソフトウェアを起動します。
- スライスの配置と可視化:
- プラスチックトリミングされたチップのトランスファーピペットを使用して、静かに回収室から1脳切片で描きます。
- 記録室に転送ピペットを置き、そっとチャンバーの底の内側を覆うカバーガラス上にピペットの外にスライスを絞ります。
注:限り、オーバーフローが発生していないとして、お風呂にこぼれる回収室からいくつかのACSFを持つように無害です。 - スライスSの位置を変更するために鉗子を使用して所望の領域oを記録チャンバーの中心に正確に配置されます。顕微鏡の低消費電力(4X)対物レンズと位置決めアシストするために接眼レンズを使用してください。
- 所望の位置が達成された後、チャンバー内の(また、「ハープ」としても知られる)スライス押さえと脳切片の位置を固定します。
- ハイパワー(40X)は、対物レンズに切り替えて、接触がチャンバ内ACSFで形成されるまで静かにそれを下げます。
- 焦点に組織を持って来るために微調整ホイールを使用してください。 ACSFに接触して、対物レンズが過度にスライスをつぶすことができ、あるいはACSFは、コンデンサの上にこぼさせることができるチャンバの底部の内側を覆うカバースリップを、破る低下など顕微鏡上で粗調整ホイールを使用していないがとそれを損傷します。
- 焦点は、組織レベルであるときに、形状の標的領域内の細胞を観察します。死んだ細胞は、<自分の膨潤形質膜と核(によって容易に同定可能です強い>図1E)。健康な細胞は、円形、卵形、または楕円形の均質な構造( 図1E)として表示されます。
- 標的細胞を探します。記録マイクロピペットを手助けするために、コンピュータ画面上にマークします。このようなQCaptureなどのソフトウェアを使用する場合は、マウスの左クリックを保持することによって、標的細胞の周囲に四角形を描画します。
- 記録マイクロピペットを配置し、移動するACSFと接触している対物レンズによって形成された円錐状に十分なスペースが存在することになるので、対物レンズを上げます。
- マイクロピペットの配置とポジショニング
- 1ミリリットルの注射器、非金属マイクロニードル、および専用のフィルターを使用して、手順を参照してください、計画された実験(K +ベースやCs +ベースの内部液に応じて予め用意された内部溶液をマイクロピペットを埋める1.1。、1.2組成物、および材料 )。内部ように、十分なソリューションを使用してください解決策は、マイクロピペットホルダー内の塩化物で被覆された銀線電極に接触します。
注:銀ワイヤ電極は、家庭用漂白剤に浸漬することにより塩素化することができます。ヌクレオシド三リン酸(ATPおよびGTP)は、使用前に内部溶液に添加することができます。 ATP / GTPの劣化を防ぐために、氷の上で解決策を含む注射器を保管してください。 - 彼らはマイクロピペットを組織している間に出てくるとスライスを曖昧にすることができますようにマイクロピペットで気泡がないことを確認してください。
- 解決策は、塩化銀コーティングされたワイヤ電極に接触するように、電極ホルダーにマイクロピペットを置きます。
- コーンワッシャーがマイクロピペットの周りにシールを形成するようにピペットキャップを締めます。
- ピペットに入るの破片を防ぐためにACSFにマイクロピペットを浸漬する前に、正圧を適用します。
- (チャンバーに向かって)ロックされた位置にヘッドステージを配置し、マイクロマニピュレーターを使用して、グラムそれは浸漬目的の中央下に大体あるので、室内に向かってダウン用ガイド。
- (高速に培地に設定)マイクロマニピュレーターでマイクロピペットを移動させながら、マイクロピペットを見つけて、XY軸上のセルの位置に向かってそれを導くためにコンピュータの画面を使用します。
- 電圧ステップを適用することにより、マイクロピペットの抵抗を測定する( 例えば 、4 mVでは、100ミリ秒)Clampexソフトウェアで「膜テスト」を使用している場合、このような「風呂」モードのように、特定のソフトウェアを介して、手動または自動で行うことができ、(また、ステップ4を参照します) 。確かに気泡またはその他の異物は、マイクロピペットをブロックしないようにするために、ポリエチレンチューブでマイクロピペットホルダーに接続された空気が充填されたシリンジ( 例えば 、30ccの注射器)を使用して正の圧力を加えます。
- マイクロピペットをクリアした後、手動で、または例えば、&#などの特定のソフトウェアを介して達成することができるゼロにピペット電流を低減するためにオフセット電圧を行います39;コンピュータ制御アンプの司令官に「オフセットピペット。
注意:この関数は、バス、マイクロピペットのソリューション( すなわち 、液体接合部電位20)との間の濃度差に起因する任意の電圧を補償します。
- 1ミリリットルの注射器、非金属マイクロニードル、および専用のフィルターを使用して、手順を参照してください、計画された実験(K +ベースやCs +ベースの内部液に応じて予め用意された内部溶液をマイクロピペットを埋める1.1。、1.2組成物、および材料 )。内部ように、十分なソリューションを使用してください解決策は、マイクロピペットホルダー内の塩化物で被覆された銀線電極に接触します。
4.薄膜テスト
注:このステップは、 材料に記載された増幅器に適用されます。
- コンピュータ制御アンプの司令官を使用する場合は、必ずメンブレンテストを実行するために、電圧クランプモードに設定します。
注:膜試験は「バース」モードに設定されている場合にシールを形成する際に、膜試験は、マイクロピペットの抵抗とシール抵抗を測定することができます。 - 膜が破裂されると、に「セル」モード(別名アクセス抵抗は 、R a)は直列抵抗(R S)が、R i及び膜キャパシタンス(C Pの)膜の試験をすることができるスイッチ(ステップ5.8参照)得られます。
5.最終的なアプローチ、シール形成、および全細胞構成の取得
- ファインフォーカスホイールを使用して、徐々にマイクロピペットを下げながらダウン焦点を当て始めます。常に最初のダウン焦点を当て、その後焦点面までのマイクロピペットを下げます。これは、マイクロピペットの先端が急にスライスに浸透しないことを保証します。
- マイクロピペットは、スライスの表面との接触になると、中低モードにマイクロマニピュレータースピードが遅くなります。
- ゆっくりと進入経路からごみをクリアするためにピペットホルダーに接続された空気を充填したシリンジを用いて光の正圧をかけます。
- (マイクロマニピュレーターモデルがそれを許可している場合)の両方XZ軸はZ軸ノブの回転に伴って変更されるXYZコントロールノブと交互にすることによって、または斜めに接近することにより、いずれかのセルに近づきます。後者の方法は、組織の縦方向の圧縮を防ぐことができます。
注:ここでは、目標でありますスライスへの最小限のダメージを与えることによって、細胞に接近します。マイクロピペットは、細胞に十分に近い場合ディンプルは、(マイクロピペットの先端を介して印加された正の圧力によって引き起こされる細胞表面のラウンド変色)( 図2)が表示されます。 - ディンプルは、( 図2-1)が表示されたら、シール( 図2-2)を作成するために、ピペットホルダー吸引管に接続されたチューブを介して弱いと簡単な吸引を適用します。膜テストを監視してください。
注:部分的なシールが形成されている場合(<1GΩ)、(「ギガオームのシール」または「ギガシール」シールの形成を容易にし、gigaohmsに抵抗に到達することができる(コンピュータ制御増幅器コマンダに)保持電位を低下させることによって、負の電流を注入> 1 - 5GΩ)。シールの高抵抗(> 1GΩ)が記録された信号の両方に制限ノイズの混入とは、機械的安定性に貢献していきますパッチ。 - ギガシールが形成されているが、膜が破裂されると、急激な変化を防止するために、生理学的な静止電位(V レスト )のできるだけ近くに、セルの保持電位をもたらすためにコンピュータ制御アンプの司令官を使用しています。例えば、MSNsは通常、電圧クランプ-70または-80 mVの(:-70 -90 mVの生理V レスト )です。
- ギガシールを形成した後、手動または自動で高速と低速の容量を補います。このようなMulticlampの司令官、「Cpが速い」と「Cpが「遅いため、プレス「自動」としてコンピュータ制御アンプの司令官を使用している場合。
- シールが安定したままで、1GΩ(または10未満の注入-希望の膜電位で細胞を保持するために20 PA)を上記の場合は、原形質膜を破裂させるために5.5と同様の管を通って簡単に、強力な吸引を適用する( 図2 -3)。
注:これは、いくつかの試行がかかる場合があります。良い破水はwが達成され、鶏の吸引が十分強く破裂した膜は、膜や細胞の大部分に描画されないために(記録中のR Sの増加につながる可能性)マイクロピペットが、弱く十分に詰まらせないように行われます。 - 成功した全細胞構成を達成した後、定期的にそれはパッチの損失につながる可能性として評価し、重要なドリフトを補正するためにマイクロピペットの位置を監視。ドリフト振幅は、いくつかの要因に応じて異なるが、 例えば 、リグのインストールの品質とヘッドステージに引っ張り力。理想的には、ドリフトはほとんど存在でなければなりません。
- 膜テストで「セル」モードに切り替えることで、このようなR I、R sおよびC pのような細胞の異なるパラメータを表示します。録音中にこれらのパラメータを監視します。
注:これらのパラメータはすべて(、ステップ4の「膜テスト」の項を参照)細胞および細胞型の初期の健康状態を評価することができます。 - 第一回上記のステップeは、完成した計画は、膜電圧( 例えば 、活動電位発火)の変化を測定する場合( 例えば 、EPSCs、性IPSC)の電流を測定、または電流クランプモードに切り替えるには、電圧クランプモードのままにされています。後者の場合は、(マニュアルガイドをアンプに参照し、このステップを実行する)は、所望の膜電位で細胞を保持するために、正または負の電流を注入します。
結果
温度、容易に実験者によって制御される因子は、イオンチャネル及び受容体の生物物理学的特性に影響を及ぼし、それによってシナプス後電流(のPSC)(EPSCと性IPSC)のスパイクを誘発するニューロンの能力の波形は図3 図4は、ニューロン発火とそれぞれ誘発EPSCs(eEPSCs)の傾きに対する温度の効果を示します。発火パターン( 図3)(1 回目のスパイクに、すなわち 、待ち時間、数、周波数、および活動電位波形をスパイク)は、特定の電位依存性イオンチャネルのタイミングと協調開閉し(Na +、のCa 2によって形作られています+、およびK +)、温度に敏感なプロセス。平均スパイク数は温度に依存して増加する方法を図3に示す図 。実験条件でここに記載ことに注意してください(MSNs録音)スパイクfrequeもののNCYはsubphysiological温度(28℃)で変更されているように見える温度が生理学的に関連するレベル(32°C)に達すると、それが大幅に増加しません。 図4Aは eEPSCsの方法傾斜、一般的に使用されているパラメータの一例を示していますシナプスの強さを評価し、温度と共に増加します。
全細胞構成をシール状態から遷移するとき、R sはやや効率的な膜の開口部を通って実験、 すなわち 、によって制御することができるが、Rが徐々に通常だ記録中に増加します。これは、記録時にピペットチップを詰まら様々な制御不可能な事象、 例えば 、膜の再閉鎖または破片の結果であり得ます。それはパッチを危険にさらすかもしれませんが、わずかな吸引を適用することにより、膜を再度開こうとすると、時々 、安定したR Sを維持するのに役立ちます。全ての場合において、R sの変化は、Alができるため研究中の電気信号の波形terを、それは注意深く監視し、PSCのを(電圧クランプモード)を記録する場合。 図4を特に示していなければならない場合には、R の増加( 図4B)、グルタミン酸受容体媒介電流の振幅(eEPSCs )( 図4C、D)が減少します。 R s内の変化( 例えば 、この研究室)15%を超えたとき、通常、実験者は、しかし、いくつかの研究室が20%変化から行う、データを破棄する。この基準は、記事の方法のセクションに示されなければなりません。
定義されたニューロンのために、R iは 、温度、細胞の健康、およびパッチの品質など、いくつかの要因によって影響を受けることができます。具体的には、R iがスパイクを生成するために、PSCの振幅または神経細胞の能力を低下さも減少します。例えば、 図4Eは、目、R iは著しく変化しないときことを示していますスパイクの電子の数が(ニューロン1)比較的安定した状態を保ちます。とき、R Iが増加するだけでなくスパイクの数が増加する(ニューロン2)。 10%の変化がバイアスデータに十分であるとしてそのため、同様にR sの、R iは注意深く監視する必要があります。
上述したように、温度を制御または監視することが重要R S、及び録音中R Iです。例えば、研究(のPSCまたは焼成)の下にある信号の変化を観察による変化(またはコントロールの欠如)これらの要因のではなく、実験操作の効果に、 例えば 、事前対のポストエフェクトでもよいです薬浴アプリケーション。

図1.カスタムメイド回復商工会議所(AD)と健康とデッドニューロン(E)を表示400Xで脳スライスの写真。広告)カスタム回収室を作るための手順は、ステップ2.1で説明されている。側坐核内側シェル対 400Xは、健康(赤い矢印の例を示す時、脳スライスにおけるMSNs)死んだニューロン(青矢印)のE)の写真。いくつかの細胞は、健康と示されているが、その球状の局面は、それらが所望の(アスタリスク付きの赤い矢印)ほど健康ではないかもしれないことを示していることに注意してください。最終的な健康状態は、iが全細胞構成を達成した後のV 休息とRに基づいて評価されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。

ギガシールを入手し、全細胞構成を確立するための基本的な手続きステップを示す 図2. 図。マイクロピペットは、目に十分に近い場合E細胞は、形質膜にディンプルを作成する(ステップ1、アプローチ)、マイクロピペットと原形質膜との間の緊密な連絡先を作成するための簡単な、穏やかな吸引を適用します。適切に実行した場合、接触が強化されると抵抗が増加し、1GΩ(ギガシール)以上(ステップ2、シールの形成)に到達します。シールは安定しており、1GΩより上になると、原形質膜(ステップ3、全細胞構成を)破裂する簡潔かつ強力な吸引を適用します。細胞全体の構成を達成することは、細胞質およびマイクロピペットの内部との間の継続性を可能にします。詳細については、プロトコルのステップ5.1から5.8を参照してください。 この図の拡大版をご覧になるにはこちらをクリックしてください。
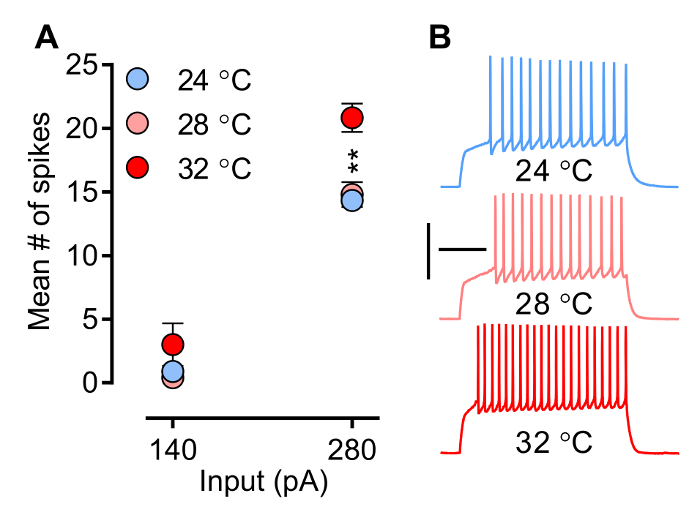
図3.神経発火(内因性興奮)は現在、アサリに評価されます Pモード。ここで、現在のステップの事前定義され、増分シリーズは、膜電位の変化を誘発し、これにより活動電位を誘発するために与えられる。A)平均スパイク数が温度と共に増加する。B)サンプルトレース280 Paに側坐核から三つの異なる温度設定における内側シェルMSNs(; 28°C、N = 5; 24°C、N = 9と32°C、N = 6)。記録チャンバー内の温度を直接スパイクの周波数に影響を与えます。しかし、スパイク周波数はsubphysiological温度で変更することはしていないようですが、温度が32℃、生理学的に関連する温度に達したときに、それが大幅に増加することに注意してください。ニューロンは、-80 mVので開催されています。双方向ANOVA:相互作用、P <0.0001;温度効果はp = 0.0041;事後テスト:24°Cと28°Cは、32°C、**はp <0.01と有意に異なっています。データは、平均±SEMとして表されます。校正:200ミリ秒、50 mVの。jove.com/files/ftp_upload/54024/54024fig3large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。

図4.温度の影響、R sおよび単一のNACシェルMSNからeEPSC振幅の電気信号の下で研究。A) は実施例の波形にR I。 24から28°Cおよび32°Cの温度を増加させることeEPSCsの傾きを増加させます。 eEPSCsスロープの温度による変化が急速に起こることに注意してください。ここで、eEPSCs勾配は、電圧クランプモードで評価されます。キャリブレーション:5ミリ秒、100 pAのBD)単一のNACシェルMSNからeEPSCsスロープの例。。 R Sが増加する(B)、eEPSCsの傾きは、Rの関数としてeEPSC勾配の(C)D)相関分析を減少します秒。ピアソンのR = -0.5717、P <0.0001。ニューロンは、電圧クランプ-80 mVのである。スパイクを生成するニューロンの能力にR、iの効果を示す2つのニューロンからのトレースのE)の例。ニューロンは、電流クランプ、および-80 mVので開催されています。校正:200ミリ秒、50 mVのこの図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
このプロトコルは、脳切片におけるニューロンの全細胞パッチクランプ実験を行うための基本的な手順を説明します。しかし、この技術の複雑さ、可能性と感度は完全にこの資料に記載することはできません。ここでは、最も基本的な手順を描写し、成功と厳格なホールセル記録を達成するために制御されなければならない重要なパラメータを強調しようとしています。さらに理論的な学習のために、多くの本や記事は、脳スライス3,21-24にし、細胞生存率を高めるために25から27を使用したソリューションを絞り込むことができます方法の両方の全細胞パッチクランプ記録に公開されています。日常的に適切な録音を行うためには、集中的な練習を通じて技術的なスキルの向上が必要です。それにもかかわらず、前述の手順の適切なアプリケーションと、細胞がシナプスの機能および固有excitabiの変更に関する重要な情報を提供し、時間死後パッチを適用することができますリティ。
一般的には、慎重にACSFと内部マイクロピペット・ソリューションの両方を準備することの重要性に加えて、脳の解剖からの各ステップは、成功した全細胞構成を実現し、スライスし、厳格かつ公正なデータを得ることは集中的な練習が必要です。主に、健康な脳スライスを生成することが重要です。簡潔には、脳(理想的には<45秒)、低温のメンテナンスを迅速に解剖 - スライスしながら(0~2℃)で、適切なスライスのソリューションはすべて、細胞の健康を確保する上で重要な役割を果たしています。スライスのソリューションは、研究所と調査された細胞型および/または脳領域に応じ間で異なる可能性があることを言及することは注目すべきです。側坐核または背側線条体をスライスするとき、我々の研究室等は、スクロースベースのソリューション34、高マグネシウム2+ 28-33が 、しかしながら、他の方法も使用することができる興奮毒性プロセスを最小限にするためにスライス液にキヌレン酸を使用します /低のCa 2+ソリューション35、 など 。これらはほんの一例であり、(年齢によるものなど、)興奮毒性プロセスに脳や脳の領域の感度に応じて調整することができます。ソリューションおよび細胞生存率の詳細については、25-27を参照してください。それは脳脊髄液を模倣し、スライス中に発生する可能性興奮毒性プロセスな限り最小限に抑えるように最終的には、陰イオン、陽イオン、およびスライスのソリューションを構成する他の薬剤( 例えば 、アスコルビン酸、グルタミン酸受容体拮抗薬)の濃度が決定されます。この記事で紹介したプロトコルは、側坐核または脳スライスにおける背側線条体におけるMSNsから録音するときに日常著者の以前の研究28-31で使用した標準的な解決策について説明します。また、ACSFと内部マイクロピペットソリューションの両方のための浸透圧を適切に調整するには、全細胞のconfの成功シール形成と維持のために重要ですiguration。イントラピペット溶液に細胞外溶液の濃度勾配を作成するには、ACSFの浸透圧は、内部のマイクロピペットのソリューションよりも高くする必要があります。理想的には、差が10から30ミリオスモルの範囲とすることができます。
成功した全細胞構成を達成することは、効率的な記録を行うための別の重要なステップです。ピペットは、浴中に配置されると、まず、ピペットのキャパシタンスを調整することができます。自動設定は、通常、適切に設定されているが、適切に行われていない場合は、これらが細胞に損傷を与えることができるように注意して電池容量の高速と低速の調整を使用することをお勧めします。第二に、膜を破壊することが必要である簡単な膜吸引は、膜の重要な開口部につながり、それによって細胞内および細胞内マイクロピペットの環境との間の良好なコミュニケーションが可能になります。これは、R sが記録を通して比較的安定した状態で維持されるようになります。セシウムベースのマイクロピペットのソリューションを使用している場合は、膜静止電位がすぐに全細胞構成の確立時に評価されるべきである(ステップ5.8を参照してください)。実際、細胞内でのCs +の拡散は、膜静止電位の損失を引き起こします。適切な静止電位を決定するために、液体接合部電位は、20を評価しなければなりません。しかし、実験者は(ステップ5.8の後)は、膜を破壊した後に観察された静止電位を報告し、液間電位を調整しないこともできます。すべての場合において、それは記事の方法の項に記載しなければなりません。全細胞構成の確立時に、C pを得ることができ、細胞の健康および/ または細胞のタイプを評価するための間接的なパラメータとして使用することができます。第三に、レコーディングが始まったとき、他のパラメータが厳密に監視する必要があります。神経細胞の興奮性を評価する際に制御しなければならない重要な要素は、温度、R SおよびR、Iです。
として上述したように、R iおよびC pは 、細胞の健康および/ または細胞型を示すことができます。例えば、原形質膜は、絶縁体として作用し、一緒に膜キャパシタンスを構成する、(細胞内および細胞外液の別の組成物から得られた)電荷を分離します。キャパシタンスが高いほど、膜表面(ニューロン特異的)より大きい。これは、特定のニューロンタイプの展示C pのことは驚くべきことではないと R iは (数学的にC pに関連する)同じ範囲内にあります。 R Sは 、ピペットチップの大きさに直接関係するので、通常質または膜の開口部の大きさを示します。簡単に言えば、全細胞構成を確立する際に、細胞質は、マイクロピペット内の溶液と電気的に連続し、外部メディアから完全に分離さになります。 R S(又はR a)はカレン用の抵抗に由来しますtは細胞質にピペットから流れます。いくつかの記録条件( 例えば 、電流クランプモードまたは電位依存性イオン電流の電圧クランプ記録)については、R sは適切に補償する必要があります(参考文献を参照してください。3,21-24または適切なR の補償のためのアンプのマニュアルガイド) 。
図4で説明したように、劇的に電気信号波形、 例えば 、EPSC振幅に影響を与えることができるように、R sが特に重要です。それにもかかわらず、R sが慎重に任意の観察された効果のオフライン解釈のために監視する必要があります。ケースでは、膜が、その場合のR の増加とバイアス研究中の電気信号の波形( 図4B-D)マイクロピペットチップの目詰まりや膜の再閉鎖発生する可能性があり、適切に破裂されていません。記録しながら要約すると、多くの問題が発生することができ、それらは通常、三つのカテゴリーに分類さは、i)組織関連例えば 、不良による解剖、ACSFの浸透圧の調整不良、および低酸素に対する細胞の死亡率を増加させました。 ⅱ)機器関連、 例えば 、ノイズや接地の問題、温度制御、スライスおよびマイクロピペットの位置など 。そしてiii)データの解釈、 例えば 、観察された変化ではなく、実験の結果より、図3&4)を参照して 、R I、R、S、温度(電気波形を変化させるパラメータの変化などのデータをバイアス望ましくない実験的なアーティファクトの結果であり得ます操作。
脳スライスにおける全細胞記録を経験依存可塑性を評価するための強力な技術であるが、このアプローチは、データの解釈を制限します。具体的には、全細胞記録技術の三つの重要な制限があることは、(i)特定のタンパク質( 例えば 、イオンチャンネル)が区別できないの機能と発現レベルの変化; (ⅱ)このため、技術は膜全体(または大部分)を流れる電流を評価し、それが観察されるイオン電流や変更の正確な細胞内局在を提供していません。および(iii)全細胞構成の侵襲性を開発するために、または発現する細胞コンテンツの透析に、それによっていくつかの現象のために必要な細胞内分子機構の破壊をもたらします。透析を回避する1つの方法は、鋭い電極の録音または穿孔パッチ技術3,21,23を使用することです。後者に関しては、例えば、ナイスタチン等の造孔抗生物質分子は、ピペット溶液に添加することができます。これらの孔の形成は、細胞内のセカンドメッセンジャーメカニズムを中断することなく、電流の記録を可能にします。それにもかかわらず、ナノテクノロジーとナノ電極36の開発における最近の進歩は、ニューロンの録音を改善するための強力なツールを提供しています。神経科学におけるこのような技術の進歩はdevelopmenの下にまだありますトンとなりました、 すなわち 、私たちのリーチに低侵襲でパッチクランプおよび細胞内記録を実行する可能性を入れてそのまま細胞内環境を保ち、そして古典でアクセスこれまでにはなかったサブ細胞区画内のイオンチャネルの機能を調査していますパッチクランプ電極37。
開示事項
著者はいずれも、競合する利益や利害を持っていません。
謝辞
この研究は、サウスウエスタン大学のスタートアップ資金(SK)によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Isolated pulse stimulus generator | A.M.P.I | Master-8 | |
| Isolation unit (ISO-Flex) | A.M.P.I | ISO-Flex | |
| Computer controlled Amplifier | Molecular Devices | Multiclamp 700B | |
| Digital Acquisition system | Molecular Devices | Digidata 1500 | |
| Microscope | Olympus | BX-51 | |
| Micromanipulator | Sutter Instruments | MPC-200 | |
| Chamber and in-line Heater | Warner Instruments | TC-344B | |
| Vibratome Slicer | Leica | VT1000 S | |
| Micropipette Puller | Narishige | PC-10 | |
| Imaging Camera | Q Imaging | QIClick-F-M-12 | |
| Narishige pipette puller PC-10 | Narishige | PC-10 | |
| Glass capillaries | WPI | TW150F-3 | |
| Slice hold-down (harp) | Warner Instruments | 64-0255 | |
| Slice Chamber | Warner Instruments | RC-26 | |
| Nonmetallic syringe needle | World Precision Instruments | MF28G67-5 | |
| Syringe filters | Nalgene | 176-0045 | |
| Glue Gun | Home Depot | various | |
| Gas dispersion tube | Ace Glass Inc. | various | |
| Decapitation scissors | Home Depot | 100649198 | |
| Scalpel Handle #3 | World Precision Instruments | 500236 | |
| Small straight sharp tips scissors | World Precision Instruments | 14218 | |
| Vessel canulation forceps | World Precision Instruments | 500453 | |
| Curved hemostatic forceps | World Precision Instruments | 501288 | |
| Economy Tweezers #3 | World Precision Instruments | 501976-6 | |
| Spatula | Fisher Scientific | 14357Q | |
| Scooping spatula | Fisher Scientific | 14-357Q | |
| Petri dish | Fisher Scientific | 08-747B | |
| Filter paper | Lab Depot | CFP1-110 | |
| Solutions | |||
| Cs-Gluconate internal solution (pH 7.2–7.3, 280–290 mOsm) | |||
| D-gluconic acid 50% | Sigma Aldrich/various | G1951 | |
| Cesium-OH (CsOH) 50% | Sigma Aldrich/various | 232041 | |
| NaCl, 2.8 mM | Sigma Aldrich/various | S7653 | |
| HEPES, 20 mM | Sigma Aldrich/various | H3375 | |
| EGTA, 0.4 mM | Sigma Aldrich/various | E4378 | |
| tetraethylammonium-Cl, 5 mM | Sigma Aldrich/various | T2265 | |
| Na2GTP, 0.3 mM | Sigma Aldrich/various | G8877 | |
| MgATP, 2 mM | Sigma Aldrich/various | A9187 | |
| K-Gluconate internal solution (pH 7.2–7.3, 280–290 mOsm) | |||
| K D-gluconate, 120 mM | Sigma Aldrich/various | G4500 | |
| KCl, 20 mM | Sigma Aldrich/various | P3911 | |
| HEPES, 10 mM | Sigma Aldrich/various | H3375 | |
| EGTA, 0.2 mM | Sigma Aldrich/various | E4378 | |
| MgCl2 | Sigma Aldrich/various | M8266 | |
| Na2GTP, 0.3 mM | Sigma Aldrich/various | G8877 | |
| MgATP, 2 mM | Sigma Aldrich/various | A9187 | |
| Standard artificial cerebrospinal fluid (ACSF, osmolarity ≈ 300-310 mOsm) | |||
| KCl, 2.5 mM | Sigma Aldrich/various | P3911 | |
| NaCl, 119 mM | Sigma Aldrich/various | S7653 | |
| NaH2PO4•H2O, 1 mM | Sigma Aldrich/various | S9638 | |
| NaHCO3, 26.2 mM | Sigma Aldrich/various | S8875 | |
| Glucose, 11 mM | Sigma Aldrich/various | G8270 | |
| MgSO4-7H2O, 1.3 mM | Sigma Aldrich/various | 230391 | |
| CaCl2-2H2O, 2.5 mM | Sigma Aldrich/various | C3881 | |
| Additional compounds used for solutions preparation | |||
| KOH | various | ||
| Kynurenic acid | Sigma Aldrich/various | K3375 | |
参考文献
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibres. Nature. 260 (5554), 799-802 (1976).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annu Rev Physiol. 46, 455-472 (1984).
- Cahalan, M., Neher, E. Patch clamp techniques: an overview. Methods Enzymol. 207, 3-14 (1992).
- Staley, K. J., Otis, T. S., Mody, I. Membrane properties of dentate gyrus granule cells: comparison of sharp microelectrode and whole-cell recordings. J Neurophysiol. 67 (5), 1346-1358 (1992).
- Horn, R., Marty, A. Muscarinic activation of ionic currents measured by a new whole-cell recording method. J Gen Physiol. 92 (2), 145-159 (1988).
- Pusch, M., Neher, E. Rates of diffusional exchange between small cells and a measuring patch pipette. Pflugers Arch. 411 (2), 204-211 (1988).
- Kandel, E. R., Dudai, Y., Mayford, M. R. The molecular and systems biology of memory. Cell. 157 (1), 163-186 (2014).
- Kourrich, S., Bonci, A. Chapter 5: Synaptic and Neural plasticity. Neurobiology of Mental Illness. 4th edn. , (2013).
- Mozzachiodi, R., Byrne, J. H. More than synaptic plasticity: role of nonsynaptic plasticity in learning and memory. Trends Neurosci. 33 (1), 17-26 (2010).
- Zhang, W., Linden, D. J. The other side of the engram: experience-driven changes in neuronal intrinsic excitability. Nat Rev Neurosci. 4 (11), 885-900 (2003).
- Kourrich, S., Calu, D. J., Bonci, A. Intrinsic plasticity: an emerging player in addiction. Nat Rev Neurosci. 16 (3), 173-184 (2015).
- Luscher, C., Malenka, R. C. Drug-evoked synaptic plasticity in addiction: from molecular changes to circuit remodeling. Neuron. 69 (4), 650-663 (2011).
- McEwen, B. S., Morrison, J. H. The brain on stress: vulnerability and plasticity of the prefrontal cortex over the life course. Neuron. 79 (1), 16-29 (2013).
- Sandi, C., Haller, J. Stress and the social brain: behavioural effects and neurobiological mechanisms. Nat Rev Neurosci. 16 (5), 290-304 (2015).
- Kim, S. J., Linden, D. J. Ubiquitous plasticity and memory storage. Neuron. 56 (4), 582-592 (2007).
- Ganguly, K., Poo, M. M. Activity-dependent neural plasticity from bench to bedside. Neuron. 80 (3), 729-741 (2013).
- Kullmann, D. M., Moreau, A. W., Bakiri, Y., Nicholson, E. Plasticity of inhibition. Neuron. 75 (6), 951-962 (2012).
- Bar-Yehuda, D., Korngreen, A. Space-clamp problems when voltage clamping neurons expressing voltage-gated conductances. J Neurophysiol. 99 (3), 1127-1136 (2008).
- Williams, S. R., Mitchell, S. J. Direct measurement of somatic voltage clamp errors in central neurons. Nat Neurosci. 11 (7), 790-798 (2008).
- Neher, E. Correction for liquid junction potentials in patch clamp experiments. Methods Enzymol. 207, 123-131 (1992).
- Defelice, L. J. . Electrical Properties of Cells-Patch Clamp for Biologists. , (1997).
- Kornreich, B. G. The patch clamp technique: principles and technical considerations. J Vet Cardiol. 9 (1), 25-37 (2007).
- Molleman, A. . Patch Clamping: An Introductory Guide To Patch Clamp Electrophysiology. , (2003).
- Neher, E., Sakmann, B. The patch clamp technique. Sci Am. 266 (3), 44-51 (1992).
- Richerson, G. B., Messer, C. Effect of composition of experimental solutions on neuronal survival during rat brain slicing. Exp Neurol. 131 (1), 133-143 (1995).
- Tanaka, Y., Tanaka, Y., Furuta, T., Yanagawa, Y., Kaneko, T. The effects of cutting solutions on the viability of GABAergic interneurons in cerebral cortical slices of adult mice. J Neurosci Methods. 171 (1), 118-125 (2008).
- Ye, J. H., Zhang, J., Xiao, C., Kong, J. Q. Patch-clamp studies in the CNS illustrate a simple new method for obtaining viable neurons in rat brain slices: glycerol replacement of NaCl protects CNS neurons. J Neurosci Methods. 158 (2), 251-259 (2006).
- Kourrich, S., et al. Dynamic interaction between sigma-1 receptor and Kv1.2 shapes neuronal and behavioral responses to cocaine. Cell. 152 (1-2), 236-247 (2013).
- Kourrich, S., Klug, J. R., Mayford, M., Thomas, M. J. AMPAR-Independent Effect of Striatal aCaMKII Promotes the Sensitization of Cocaine Reward. J Neurosci. , (2012).
- Kourrich, S., Rothwell, P. E., Klug, J. R., Thomas, M. J. Cocaine experience controls bidirectional synaptic plasticity in the nucleus accumbens. J Neurosci. 27 (30), 7921-7928 (2007).
- Kourrich, S., Thomas, M. J. Similar neurons, opposite adaptations: psychostimulant experience differentially alters firing properties in accumbens core versus shell. J Neurosci. 29 (39), 12275-12283 (2009).
- Rothwell, P. E., Kourrich, S., Thomas, M. J. Environmental novelty causes stress-like adaptations at nucleus accumbens synapses: implications for studying addiction-related plasticity. Neuropharmacology. 61 (7), 1152-1159 (2011).
- Rothwell, P. E., Kourrich, S., Thomas, M. J. Synaptic adaptations in the nucleus accumbens caused by experiences linked to relapse. Biol Psychiatry. 69 (11), 1124-1126 (2011).
- Koya, E., et al. Silent synapses in selectively activated nucleus accumbens neurons following cocaine sensitization. Nat Neurosci. 15 (11), 1556-1562 (2012).
- Conrad, K. L., et al. Formation of accumbens GluR2-lacking AMPA receptors mediates incubation of cocaine craving. Nature. 454 (7200), 118-121 (2008).
- Kruskal, P. B., Jiang, Z., Gao, T., Lieber, C. M. Beyond the patch clamp: nanotechnologies for intracellular recording. Neuron. 86 (1), 21-24 (2015).
- Novak, P., et al. Nanoscale-targeted patch-clamp recordings of functional presynaptic ion channels. Neuron. 79 (6), 1067-1077 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved