Method Article
Las grabaciones de células enteras Patch-clamp en rodajas de cerebro
En este artículo
Resumen
Este protocolo se describen los pasos básicos de procedimiento para la realización de patch-clamp grabaciones de células enteras. Esta técnica permite el estudio del comportamiento eléctrico de las neuronas, y cuando se realiza en secciones de cerebro, permite la evaluación de varias funciones neuronales de las neuronas que todavía están integrados en los circuitos cerebrales relativamente bien conservadas.
Resumen
De células enteras de grabación de patch-clamp es una técnica electrofisiológica que permite el estudio de las propiedades eléctricas de una parte sustancial de la neurona. En esta configuración, la micropipeta está en estrecho contacto con la membrana de la célula, lo que impide la fuga de corriente y por lo tanto proporciona mediciones de corriente iónica más preciso que el método de grabación electrodo afilado intracelular utilizado anteriormente. Clásicamente, la grabación de célula entera se puede realizar en las neuronas en varios tipos de preparaciones, incluidos los modelos de cultivo celular, las neuronas disociadas, neuronas en rodajas de cerebro, y en animales anestesiados o despierto intactas. En resumen, esta técnica ha contribuido enormemente a la comprensión de las propiedades biofísicas pasivos y activos de las células excitables. Una ventaja principal de esta técnica es que proporciona información sobre la forma específica manipulaciones (por ejemplo, farmacológica, experimentador inducida por plasticidad) pueden alterar las funciones neuronales específicos o channels, en tiempo real. Además, la apertura significativa de la membrana de plasma permite que la solución de la pipeta interna para difundir libremente en el citoplasma, proporcionar medios para la introducción de medicamentos, por ejemplo, agonistas o antagonistas de las proteínas intracelulares específicas, y la manipulación de estos objetivos, sin alterar sus funciones en las células vecinas. En este artículo se centrará en la grabación de células enteras a cabo en las neuronas en rodajas de cerebro, una preparación que tiene la ventaja de grabación de las neuronas en los circuitos cerebrales relativamente bien conservados, es decir, en un contexto fisiológicamente relevante. En particular, cuando se combina con la farmacología adecuada, esta técnica es una poderosa herramienta que permite la identificación de neuroadaptaciones específicos que se produjeron después de cualquier tipo de experiencias, como el aprendizaje, la exposición a drogas de abuso, y el estrés. En resumen, las grabaciones de células enteras patch-clamp en rodajas de cerebro proporcionan medios para medir ex vivo de preparación de cambios de larga duraciónen las funciones neuronales que se han desarrollado en animales despiertos intactas.
Introducción
La técnica de patch-clamp, una técnica electrofisiológica que se ha desarrollado a finales de 1970 de 1,2, es una herramienta fundamental para el estudio de las funciones de los canales iónicos individuales o múltiples en el tejido vivo. Entre las diferentes configuraciones de parches que se pueden lograr, grabaciones de células enteras patch-clamp permiten el estudio del comportamiento eléctrico de una parte sustancial de la neurona. Clásicamente, esta técnica se realiza in vitro, ya sea en rodajas de cerebro, neuronas recién disociadas, o en modelos de cultivo celular 3. Cuando se realiza en las neuronas en rodajas de cerebro, esta técnica presenta varias ventajas. En particular: (i) las neuronas se registran en los circuitos cerebrales relativamente conservadas que hasta cierto punto, y en comparación con las preparaciones de cultivo celular, proporcionan un ambiente que es fisiológicamente relevante 3. Esto permite la captura temprana, o incluso el seguimiento en tiempo real, los eventos celulares y moleculares que son accionados por cualquier tipo de pharmacolog agudamanipulaciones iCal - una resolución temporal que no se puede lograr usando clásica en condiciones in vivo; (ii) la capacidad para identificar visualmente las regiones del cerebro en rodajas de cerebro permite una alta especificidad regional 3 tanto para la región del cerebro estudiada y para las neuronas específicas cuando expresan marcadores fluorescentes; (iii) el acceso al espacio intracelular de la célula mediante la apertura de una parte importante de la membrana plasmática (en contraste con la punción de la membrana con una micropipeta agudo para grabaciones intracelulares) 4. A su vez, esto permite que el contenido o concentración de iones específicos que componen la solución interna a ser modificados objetivos así moleculares o mecanismos celulares pueden estudiarse bajo diferentes condiciones. Por ejemplo, al establecer la configuración de célula completa, cualquier agente farmacológico específico (por ejemplo, antagonistas) que se puede añadir a la micropipeta de grabación (parche pipeta) solución se difundirá directamente en el citoplasma y actuar en su putative dianas intracelulares sin alterar la función objetivo en las células vecinas. Además, en comparación con la grabación micropipeta agudo, la gran abertura en la punta del electrodo de patch clamp proporciona una resistencia más baja, menos ruido de la competencia, y por lo tanto un mejor acceso eléctrico al interior de la célula 4. Sin embargo, en cuenta que la gran abertura en la punta de la pipeta puede conducir a la diálisis de células, y por lo tanto la pérdida de la maquinaria molecular intracelular que puede ser crítica para la expresión de los fenómenos biológicos que están bajo 5,6 estudio. En este caso, las grabaciones de electrodos afilados pueden ser más adecuados. Este tipo de grabaciones requiere micropipetas con un poro que es mucho menor que los utilizados para las grabaciones de células enteras, evitando de este modo la mayor parte del intercambio iónico entre el espacio intracelular y la solución de la pipeta interna.
Cualquier forma de experiencia (aguda o crónica), incluyendo el aprendizaje de 7-10, la exposición a drogas de abuso 11,12, el estrés 13,14, etc., puede alterar diversos aspectos de la función neuronal en regiones específicas del cerebro. Debido a que estas alteraciones a menudo requieren tiempo para desarrollarse (horas o días), conjunto de células grabaciones en secciones de cerebro de animales que han sido sometidos a una experiencia específica permiten a los investigadores a identificar estos cambios. Básicamente, muchos (si no todos) los componentes que participan en funciones neuronales (por ejemplo, canales iónicos activados por ligando, canales de iones dependientes de voltaje, transportadores de neurotransmisores), y así la actividad y el comportamiento del circuito cerebro, puede ser alterado por la experiencia (dependiente de la experiencia plasticidad) 10,15-17. A nivel neuronal, la actividad circuito cerebral emerge de constantes interacciones entre sináptica (por ejemplo, la transmisión del glutamato) y los factores de excitabilidad celular intrínsecos (por ejemplo, canales de iones axosomato-dendríticas: sodio, Na +, potasio, K +, y calcio, Ca 2+ ). En condiciones específicas utilizando whole-células patch-clamp técnicas electrofisiológicas, alteraciones señal que se origina en concreto de los cambios en la excitabilidad intrínseca vs sináptica se puede aislar.
En la mayoría de los casos, la excitabilidad sináptica se evalúa mediante la técnica de fijación de voltaje de células enteras. Este modo de grabación permite la medición de las corrientes de iones [por ejemplo, mediada por los receptores del ácido α-amino-3-hidroxi-5-metil-4-isoxazolpropiónico ( receptores de AMPA) y los receptores de N-metil-D-aspártico (NMDA)] receptores a través de la membrana plasmática neuronal mientras se mantiene el potencial de membrana a una tensión de consigna. Aquí, los experimentadores utilizan las soluciones internas de micropipeta que contienen cesio (Cs +), un amplio bloqueantes de los canales de K + (factores intrínsecos excitabilidad clave). Al establecimiento de configuración de célula completa, la difusión de Cs + en el espacio intracelular bloqueará los canales de K +, y por lo tanto permitirá que tanto un relativamente eficiente espacio-clamp y preventilar influencia de los factores intrínsecos de excitabilidad en otras mediciones. Problemas de espacio-clamp, es decir, la dificultad de fijación de voltaje de células enteras, surgen cuando se graban las células de forma irregular (por ejemplo, neuronas), y en particular de neuronas con una vasta y compleja dendríticas cenador 18,19. Dado que los controles mal de fijación de voltaje somática voltaje en el árbol dendrítico de las neuronas, diversos aspectos de las señales eléctricas dendríticas en estudio se distorsionan de forma dendrítica dependiente de la distancia. Combinado con herramientas farmacológicas tales como la picrotoxina (ácido gamma-aminobutírico, GABA Un antagonista del receptor) o ácido quinurénico (amplio bloqueador de receptores de glutamato) disuelto en la solución extracelular (líquido cefalorraquídeo artificial, ACSF), esta técnica permite la medición de glutamato receptor-y corrientes de GABA A R-mediada respectivamente.
Por el contrario, la excitabilidad intrínseca se evalúa por lo general en el modo de grabación actual-clamp.A diferencia de la grabación de fijación de voltaje, este modo de grabación permite la medición de las variaciones en los potenciales de membrana inducidos por las corrientes de iones que fluyen a través de la membrana plasmática neuronal. Por lo general, la alteración de la excitabilidad intrínseca se evalúa a través de cambios en la capacidad de las neuronas para generar potenciales de acción, lo que requiere tanto de Na + y K + canales. Por lo tanto, al realizar grabaciones de corriente-clamp, micropipetas se llenan con una solución interna que contiene K + en lugar de Cs +. En combinación con los agentes farmacológicos que bloquean glutamato y GABA A las corrientes mediadas por el receptor disueltos en el ACSF, este diseño experimental permite la medición de la contribución de los factores intrínsecos (por ejemplo, los canales de K +) para la descarga neuronal sin ser contaminada por los posibles cambios en la excitabilidad sináptica factores.
En este artículo se describen los pasos básicos de procedimiento necesarias to (i) preparar rodajas de cerebro sanas; (Ii) lograr configuración de célula completa, y (iii) controlar parámetros básicos para evaluar sináptica y la excitabilidad intrínseca.
Protocolo
Todos los experimentos se llevaron a cabo de acuerdo con protocolos aprobados por el Comité Institucional de Cuidado y Uso de Animales UT Southwestern, y se eligieron a fin de minimizar el estrés, molestias y dolor experimentado por los animales de experimentación.
1. Soluciones
Nota: Se preparan soluciones internas de micropipetas con antelación. Para la mayoría de los propósitos experimentales básicos, dos tipos de soluciones deben ser suficientes: las soluciones basadas en Cs + y K + con base.
- Las soluciones basadas en el uso de Cs + (por ejemplo, solución de gluconato de Cs +, ver Materiales) para los experimentos de fijación de voltaje. Preparar a TA.
- Preparar la solución de Cs-Gluconato 117 mM mediante la mezcla de ácido D-glucónico 4,62 g (~ 3.696 ml) con 3,54 g CsOH (~ 2,01 ml).
- Añadir ddH2O a 90 ml y dejar reposar y estabilizar durante 30 minutos.
- Añadir los ingredientes sólidos (HEPES 20 = 0,476 g; 0,4 mM EGTA = 15,2 mg; 2,8 mM NaCl = 16,4 mg; 5 mM de tetraetilamonio (TEA) De cloruro de = 83 mg).
- Añadir ddH2O a ~ 97 ml.
- Ajustar el pH de la solución con 50% de CsOH a 7.2 a 7.3.
- Compruebe osmolaridad y correcta, si es necesario con ddH2O
Nota: Un buen rango es de ~ 280 - 285 mOsm. osmolaridad óptima debería ser 15 a 20 mOsm por debajo de la osmolaridad de ACSF estándar (por lo general 300 a 310 mOsm, 300 mOsm en nuestro laboratorio). Osmolaridad puede variar dependiendo de las soluciones de composiciones específicas. - Alícuota de 1.000 l y se almacena a -20 ° C o menos.
- Preparar, alícuota, congelar, y añadir ATP / GTP a la solución interna en el día de la grabación.
- Añadir 64.63 mg a 10 mg de ATP y GTP disolverse en 637.11 l de ddH2O
- Preparar 10 ml de alícuotas y se almacena a -20 ° C o menos. Mezcle cada 100x alícuota con 1.000 l de solución interna en el día del experimento. Una vez que se añade ATP / GTP a la solución interna, mantener en hielo para evitar degradati ATP / GTPen.
- Las soluciones basadas en el uso de K + (por ejemplo, solución de K-gluconato, ver Materiales) para ambos experimentos intensidad y tensión-clamp, donde las conductancias de K + permanecen funcional para que la descarga neuronal se puede evaluar. Preparar a TA.
- Pesar todos los materiales de acuerdo con el volumen final deseado. Para preparar 90 ml de solución, 120 mM de K-gluconato = 2,81 g; KCl 20 mM = 0,149 g; mM HEPES 10 = 0.238 g; mM EGTA 0,2 = 0,008 g; 2 mM de MgCl 2 = 0,021 g.
- Use suficiente ddH 2 O para alcanzar 90% del volumen de solución final. Esto debería garantizar que suficiente espacio se deja para el ajuste del pH y osmolaridad.
- Después de añadir y mezclar todos los ingredientes, asegúrese de que la solución es clara antes de medir el pH.
- Mientras que constantemente se agitaba la solución, ajustar el pH a 7.2 a 7.3 usando hidróxido de K + (KOH).
- Después de ajustar el pH, utilice el osmómetro y adsimplemente osmolaridad a 280 - 285 mOsm.
Nota: osmolaridad óptima debería ser 15 - 20 mOsm por debajo de la osmolaridad de ACSF estándar (por lo general 300 - 310 mOsm, 300 mOsm en nuestro laboratorio). Osmolaridad puede variar dependiendo de las soluciones de composiciones específicas. - Alícuota de 1.000 l y se almacena a -20 ° C o menos.
- Prepare, alícuota, congelar, y añadir ATP / GTP a la solución interna en el día de la grabación (véase la etapa 1.1.8).
- Preparar 1 litro de ACSF estándar (ver Materiales).
NOTA: Nosotros usamos esta receta en nuestro laboratorio durante la grabación de las neuronas espinosas medias (MSN) en rodajas de cerebro, sin embargo, las recetas pueden diferir entre laboratorios, y por lo tanto, se recomienda que el experimentador utilizar una receta que se utiliza de forma rutinaria durante la grabación de la región del cerebro de interés . - Preparar la ACSF disección (solución rebanar, ~ 125 ml Nota:. Volumen exacto dependerá del tamaño de la cámara de corte en lonchas como debe sumergir completamente el cerebro) para su uso enlos pasos 2.2 a 2.8.
- Preparar 5 mM de ácido quinurénico (para bloquear los receptores de los procesos de excitotoxicidad inducida por glutamato) en ACSF estándar en un volumen suficiente para sumergir el cerebro durante el rebanado. Use un aparato de ultrasonidos para ayudar a disolver el ácido quinurénico.
Nota: La longitud de la sonicación puede variar dependiendo del volumen y la cantidad de sólidos en la solución. Las soluciones deben ser claros por el final del proceso (alrededor de 1 - 2 min en nuestras condiciones). - Enfríe mientras se burbujeaba con un 95% de O2, 5% de gas CO 2 en un cubo de hielo hasta que la temperatura llegue a 0 - 2 ° C.
- Preparar 5 mM de ácido quinurénico (para bloquear los receptores de los procesos de excitotoxicidad inducida por glutamato) en ACSF estándar en un volumen suficiente para sumergir el cerebro durante el rebanado. Use un aparato de ultrasonidos para ayudar a disolver el ácido quinurénico.
- Preparar ACSF para la grabación.
- Tome 1 L de estándar ACSF (o lo que queda de la solución preparada en la etapa 1.3) a la que pueden añadirse agentes farmacológicos apropiados dependiendo de experimentos planificados.
- Por ejemplo, añadir 100 picrotoxin M durante la grabación de las corrientes postsinápticas excitatorias o potenciales (EPSCs o EPSPS), antagonistas de los receptores de glutamato (kynureácido nic, 2 mM; o una combinación de D-APV 50 mM con CNQX 10 M) al grabar inhibitoria corrientes postsinápticas o potenciales (IPSCs o IPSPs), y ambos antagonistas del receptor de picrotoxina y el glutamato en la evaluación de la descarga neuronal en ausencia de cualquier influencia de eventos sinápticas.
- Tome 1 L de estándar ACSF (o lo que queda de la solución preparada en la etapa 1.3) a la que pueden añadirse agentes farmacológicos apropiados dependiendo de experimentos planificados.
2. Preparación de la rebanada
- Construir u obtener una cámara de recuperación rebanada.
Nota: El principio de una cámara de recuperación es sencillo y se puede producir en el laboratorio (Figura 1). Brevemente, la cámara es un receptáculo en el que se inserta una cesta para contener los cortes de cerebro en un nivel que es más bajo que la superficie de ACSF. Varias compañías científicos también venden cámaras de recuperación de la rebanada.- A modo de ejemplo, obtener cuatro anillos (4 - 6 mm de altura) (Figura 1A, vista lateral; B, vista desde arriba) cortando una jeringa de 30 cc. A continuación, la cola se extendía redes (por ejemplo, un corte de nylon hose) a un lado de los anillos para sujetar las secciones de cerebro (Figura 1B) y la cola de los anillos juntos.
Nota: Una pistola de pegamento se puede utilizar. - Una vez que los cuatro anillos se pegan, pegar una pared de plástico en forma de trapecio isósceles curvada para dos de los anillos (Figura 1A y B) para desviar burbujas de oxígeno a partir de los cortes de cerebro en recuperación (Figura 1C y D). Como se muestra en la Figura 1D, insertar un sistema de difusión de oxígeno (aquí, un tubo de dispersión de gas) en el mismo lado que las paredes de plástico.
- A modo de ejemplo, obtener cuatro anillos (4 - 6 mm de altura) (Figura 1A, vista lateral; B, vista desde arriba) cortando una jeringa de 30 cc. A continuación, la cola se extendía redes (por ejemplo, un corte de nylon hose) a un lado de los anillos para sujetar las secciones de cerebro (Figura 1B) y la cola de los anillos juntos.
- Antes de cortar, compuestos oxigenados (95% de O2 / 5% de CO 2) y enfriar la solución de corte (véase el paso 1.4) a 0 - 2 ° C.
- Llenar la cámara de recuperación personalizada con ACSF estándar a temperatura ambiente. Asegúrese de que la ACSF está bien oxigenada (20 - 30 min, el tiempo puede variar de acuerdo con el volumen de la cámara) antes de colocar las rebanadas en la cámara de recuperación. Asegúrese de que las burbujas de gas no vienen en con directatacto con las rodajas o interrumpir ellos.
- Línea de la bandeja de hielo vibratome con hielo y rellenar con agua fría para que entre un tercio y la mitad de la cámara de corte está sumergido. Con cuidado, coloque un sistema de suministro de oxígeno (por ejemplo, piedra gas de difusión) y una sonda de temperatura en la cámara de corte por lo que ni elemento interfiere con el movimiento de la cuchilla o la manipulación rebanada.
- Preparar el área de disección y las herramientas necesarias para extraer el cerebro y disección de la región cerebral deseada.
Nota: La disección exacta se realice dependerá de la región específica del cerebro estudiada como diferentes estructuras cerebrales se requieren cortar en diferentes planos (por ejemplo,,, o rebanadas horizontales sagital coronal.).- Coloque las siguientes herramientas en una almohadilla inferior: tijeras de decapitación, bisturí, pequeños rectos tijeras punta afilada, fórceps de canulación recipiente (o cualquier herramienta quirúrgica con una punta ancha, tales como pinzas gubias, lo que es más adecuado para los cráneos de rata), pinzas hemostáticas curvas, tweezers, espátula, pala espátula, papel de filtro, placa de Petri, cuchilla de afeitar sola punta, y el pegamento de cianoacrilato.
- Cuando la temperatura llega a 0 - 2 ° C, transferir la solución de corte a la cámara de corte (baño tampón).
- Anestesiar el ratón en una cámara de desecación utilizando isoflurano. La cantidad exacta puede variar de acuerdo con el tamaño de la cámara utilizada, pero para una pequeña jaula caja de zapatos utilizar unas gotas (~ 3-4). Deje el ratón en la jaula hasta inmóviles prestados (que no responden a los estímulos táctiles; alrededor de 15 segundos para las condiciones descritas aquí). Realizar pruebas de arrastre de la cola y los pies para asegurarse de que el animal está profundamente anestesiado, y luego decapitar antes de que el corazón deja de latir (mejora la viabilidad celular).
Nota: Con la debida justificación, algunos laboratorios obtener la autorización para llevar a cabo la decapitación en vivo con el fin de minimizar en lo posible los procesos de excitotoxicidad y mejorar la viabilidad celular. - Realizar la disección.
Nota: El cerebro debe serextraída rápidamente (<45 s).- Utilizando el bisturí corta la piel superficial en la parte superior del cráneo de rostral a caudal.
- Pelar el cuero cabelludo en cada lado de la cabeza.
- El uso de pequeñas tijeras de punta aguda directamente, cortar la placa interparietal lo largo de esta sutura para eliminar el cerebelo. Quitar el hueso occipital.
- Utilizando las mismas tijeras, cortar la sutura sagital.
- Deslice la pinza de canulación recipiente (o gubia si se rompen un cráneo de rata) debajo de cada huesos parietales y tire para exponer el cerebro.
- Usando las pinzas hemostáticas curvas, una pizca de los huesos frontales para romperlos, a continuación, utilizar pinzas o fórceps canulación recipiente para eliminar los huesos rotos. Corte y retire la duramadre lo más suavemente posible, ya que puede interferir con la disección.
- Deslizar la espátula por debajo del cerebro y tirar suavemente el cerebro fuera del cráneo para colocarlo en la cámara de corte (baño tampón) previamente lleno de ACSF enfriado con hielo. Dejar que el cerebroenfriar durante 1 - 2 min.
- Preparar la plataforma disección rellenando una cápsula de Petri con hielo y un poco de agua de hielo para permitir una mayor superficie de contacto, cubrirlo con su tapa y coloque un papel de filtro en la parte superior. Mojar el papel de filtro con ACSF frío.
- Una vez que el cerebro se enfría, coloque el cerebro en la placa de Petri llena de hielo, y realizar rápidamente la disección adecuado para obtener el plano deseado de corte.
- Para obtener cortes sagitales que contienen el núcleo accumbens (NAC), utilizar una sola hoja de afeitar borde para cortar y retirar los tubérculos olfatorios y el cerebelo si todavía están presentes. Después, realice un corte sagital de 2 - 3 mm del borde lateral del hemisferio derecho para obtener la superficie plana que se pega en la muestra de la placa de sujeción (consulte el paso 2.8.11).
Nota: sólo el corte 2 - 3 mm del borde lateral del hemisferio permitirá la recogida de las rebanadas contienen el NAC de ambos hemisferios. La disección apropiado dependeráen la región del cerebro que se investiga. Aquí, la disección se realiza de manera neuronas NAC se pueden grabar en rodajas de cerebro sagital. - Rápidamente pegamento (utilizando pegamento de cianoacrilato aplicada a la placa de muestras de retención) la superficie de corte plana del cerebro en la placa de acuerdo con el plano deseado de corte. Para obtener cortes de cerebro sagital ver el paso 2.8.10.
- Inmediatamente colocar y fijar la muestra de placa de sujeción en la cámara de corte para que el cerebro se corta rostro-caudal (por seguridad, configurar el soporte de la cuchilla sólo cuando se fija la placa de la muestra).
- Ajuste el vibratome con parámetros adecuados de rebanado (parámetros utilizados en el laboratorio para la vibratome mencionado en Materiales: velocidad 3 - 4, 9-10 de vibración, y rebanada espesor de 250 micras).
- Tras el corte, utilice una pipeta de transferencia de plástico recortado para transferir los cortes de cerebro a la cámara de recuperación (a temperatura ambiente) (véase el paso 2.3). El tiempo de recuperación puede variar dependiendo del tipo neuronal que está bajo estudio(Típicamente 30 a 90 min).
3. Micropipetas de grabación y preparación del aparejo
- Consulte las directrices específicas del manual del usuario del extractor para obtener las propiedades deseadas de micropipeta.
Nota: Para MSN, se utiliza un rango de resistencia de la pipeta de 3,2-4,0 mO. - Oxigenar la ACSF y ajustar el flujo a 2 ml / min. ACSF vacío usando una bomba de vacío o peristálticos líneas instaladas en la instalación.
- Encienda el controlador del aparato de perfusión y ajustar los ajustes de temperatura con el fin de obtener la temperatura deseada (por ejemplo, 31,8 - 32,2ºC).
Nota: Estabilidad de la temperatura depende de tener tanto a nivel ACSF constante y velocidad de flujo constante en la cámara. Desde varias propiedades biofísicas de las neuronas (por ejemplo, la resistencia de entrada, Ri, también llamada resistencia de la membrana, R m) son sensibles a la temperatura, se mantiene una temperatura estable es importante. - Encienda compuamplificador de ter-controlado, cámara, micromanipulador, y la luz de fondo microscopio. Si se realiza un experimento que requiere la estimulación eléctrica del tejido, active el controlador de estímulo y la unidad de aislamiento.
Nota: Algunos amplificadores de otros fabricantes recomiendan un "calentamiento" antes de su uso, por lo que se recomienda consultar el manual para el procedimiento de operación exacta. - Iniciar la captura de la cámara, la adquisición de señales y el software de amplificador.
- Rebanada de Colocación y Visualización:
- Con una pipeta de transferencia de plástico con punta recortada, dibujar suavemente en una corte de cerebro de la cámara de recuperación.
- Coloque la pipeta de transferencia en la cámara de registro y apretar suavemente la rebanada de la pipeta en el cubreobjetos que recubre el fondo de la cámara.
Nota: Mientras se está produciendo ningún desbordamiento, es inofensivo para tener algo de ACSF de la cámara de recuperación de desembocar en el baño. - El uso de fórceps para alterar la posición de la rebanada so el área deseada será colocado exactamente en el centro de la cámara de grabación. Utilizar el microscopio de baja potencia (4X) lente objetivo y el ocular para la ayuda en el posicionamiento.
- Después de que se ha alcanzado la posición deseada, asegurar la posición de cortes de cerebro con una rebanada de sujeción (también conocido como un "arpa") en la cámara.
- Cambiar a alta potencia (40X) de lente de objetivo y bajar suavemente hasta que el contacto se forma con la ACSF en la cámara.
- Utilice la rueda de ajuste fino para llevar el tejido en el foco. Mientras que en contacto con el ACSF, no utilice la rueda de ajuste grueso en el microscopio como la reducción de la lente del objetivo en exceso puede aplastar en la división o incluso romper la hoja de la cubierta que recubre el fondo de la cámara, lo que puede causar ACSF que se derrame sobre el condensador y dañarlo.
- Cuando la atención se centra en el nivel de los tejidos, células observar en la región diana para la forma. Las células muertas son fácilmente identificables por su membrana plasmática y el núcleo hinchado ( Figura 1E). Las células sanas deben aparecer como redonda, ovoide o elíptica estructuras homogéneas (Figura 1E).
- Busque una célula diana. Marcarlo en la pantalla del ordenador con el fin de ayudar a guiar la micropipeta grabación. Si se utiliza el software como QCapture, dibujar un cuadrado alrededor de la célula diana mediante la celebración el clic izquierdo del ratón.
- Elevar la lente del objetivo por lo que habrá espacio suficiente en el cono formado por la lente de objetivo está en contacto con la ACSF para colocar y mover la micropipeta de grabación.
- Micropipeta Colocación y Posicionamiento
- Usando una jeringa de 1 ml, una aguja microjeringa no metálico, y un filtro dedicado, llenar una micropipeta con la solución interna preparada de antemano de acuerdo con el experimento planificada (K + con base o Cs + -basado solución interna, consulte los pasos 1.1., 1.2 y materiales para la composición). Use suficiente solución para el interiorsolución entra en contacto con el electrodo de alambre de plata cloruro recubierto dentro del soporte micropipeta.
Nota: El electrodo de alambre de plata puede ser clorada al sumergirlo en el blanqueo de la casa. nucleósidos trifosfato (ATP y GTP) se pueden añadir a la solución interna antes de su uso. Mantener la jeringa que contiene la solución en hielo para evitar la degradación de ATP / GTP. - Asegúrese de que no haya burbujas de aire en la micropipeta, ya que pueden salir mientras que la micropipeta es en el tejido y oscurecen la rebanada.
- Coloque la micropipeta en el soporte de electrodo de modo que la solución entra en contacto con el electrodo de alambre cloruro de plata recubierto.
- Apriete la tapa de la pipeta de manera que la arandela de cono se forma un sello alrededor de la micropipeta.
- Aplicar presión positiva antes de sumergir la micropipeta en el ACSF para evitar que los desechos entren en la pipeta.
- Coloque el cabezal de la platina en la posición bloqueada (de cara a la cámara), y utilizando el micromanipulador, guía hacia abajo hacia la cámara por lo que es más o menos bajo el centro del objetivo sumergido.
- Mientras se mueve la micropipeta con el micromanipulador (fijado en media a alta velocidad), utilice la pantalla del ordenador para localizar la micropipeta y guiarla hacia la ubicación de la celda en el eje XY.
- Medir la resistencia micropipeta mediante la aplicación de un escalón de tensión (por ejemplo, 4 mV para 100 ms), que se puede lograr de forma manual o automáticamente a través de software específico, como el modo de "baño 'si se utiliza" Test de membrana "en software Clampex (véase también el paso 4) . Con el fin de asegurarse de que no hay burbujas de aire o cualquier otro objeto extraño bloquean la micropipeta, aplicar presión positiva utilizando la jeringa llena de aire (por ejemplo, la jeringa 30 cc) conectado al soporte micropipeta con tubo de polietileno.
- Después de la limpieza de la micropipeta, lleve a cabo un desplazamiento para reducir la corriente de la pipeta a cero de tensión, que se puede lograr de forma manual o por medio de software específico, como & #39, compensado 'en el control del amplificador controlado por ordenador pipeta.
Nota: Esta función compensará toda la tensión causada por las diferencias de concentración entre el baño y las soluciones de micropipeta (es decir, el potencial de unión líquida 20).
- Usando una jeringa de 1 ml, una aguja microjeringa no metálico, y un filtro dedicado, llenar una micropipeta con la solución interna preparada de antemano de acuerdo con el experimento planificada (K + con base o Cs + -basado solución interna, consulte los pasos 1.1., 1.2 y materiales para la composición). Use suficiente solución para el interiorsolución entra en contacto con el electrodo de alambre de plata cloruro recubierto dentro del soporte micropipeta.
4. Prueba de membrana
Nota: Este paso se aplica al amplificador mencionado en los Materiales.
- Cuando se utiliza un comandante amplificador controlado por ordenador, siempre lo puso en el modo de fijación de voltaje para realizar la prueba de la membrana.
Nota: Cuando la prueba de la membrana se encuentra en el modo "Bath", la prueba de la membrana permite la medición de la resistencia de la micropipeta y la resistencia del sello cuando se forma la junta. - Una vez que se rompe la membrana (véase el paso 5.8), cambiar la prueba de la membrana a modo de "célula" de modo que la resistencia en serie (R s) (también llamada resistencia acceso, Ra), Ri y capacitancia de la membrana (C p) puedeSer obtenido.
5. Final Approach, sello de Formación, y obtener la configuración de célula completa
- El uso de la rueda de enfoque fino, empezar a centrarse hacia abajo al tiempo que reduce la micropipeta gradualmente. Siempre se centran abajo primero y luego baje la micropipeta hasta el plano de enfoque. Esto asegurará que la punta de la micropipeta no penetra bruscamente en la división.
- Cuando la micropipeta entra en contacto con la superficie de la loncha, reducir la velocidad de micromanipulador a modo de medio-bajo.
- aplicar suavemente presión positiva ligera con la jeringa llena de aire conectado al soporte de pipetas para limpiar toda la suciedad de la trayectoria de aproximación.
- El enfoque de la célula, ya sea por la alternancia con los mandos de control de XYZ, o por acercarse diagonal (si el modelo micromanipulador permite) donde ambos ejes XZ se cambian con la rotación de la perilla de eje Z. El último método evitará la compresión vertical de tejido.
Nota: En este caso, el objetivo esacercarse a la célula por infligir un daño mínimo a la división. Cuando la micropipeta está lo suficientemente cerca a la célula aparece un hoyuelo (una decoloración ronda de la superficie celular causada por la presión positiva aplicada a través de la punta de la micropipeta) (Figura 2). - Cuando el hoyuelo (Figura 2-1), aplicar una aspiración débil y breve a través del tubo que está conectado al tubo de succión soporte de pipeta con el fin de crear la junta (Figura 2-2). Mantener el seguimiento de la prueba de la membrana.
Nota: Si se forma un sellado parcial (<1 GΩ), la inyección de corrientes negativas al bajar el potencial de mantenimiento (en el control del amplificador controlado por ordenador) puede facilitar la formación del sello y llegar a gigaohms resistencia ( "sello gigaohmio" o "gigaseal"> 1 - 5 GΩ). La alta resistencia de la junta (> 1 GΩ) será tanto la contaminación de ruido límite a la señal grabada y contribuir a la estabilidad mecánica de laparche. - Mientras que un gigaseal se está formando, utilizar el mando amplificador controlado por ordenador para llevar el potencial de retención de la célula lo más cerca posible a fisiológica potencial de reposo (V resto) con el fin de evitar cambios repentinos una vez que se rompe la membrana. Por ejemplo, los MSN son generalmente tensión sujeta a -70 o -80 mV (V fisiológica resto: -70 a la -90 mV).
- Después de la gigaseal ha formado, compensar la capacitancia rápido y lento manual o automáticamente. Si se utiliza un comandante amplificador controlado por ordenador, tales como comandante Multiclamp, pulse 'Auto' para 'Cp Fast' y 'Cp es lento ".
- Si el sello se mantiene estable y por encima de 1 GΩ (o la inyección de menos de 10 a 20 pA para mantener la célula en el potencial de membrana se desea), aplicar una breve y fuerte succión a través del mismo tubo como en 5.5 a la ruptura de la membrana plasmática (Figura 2 -3).
Nota: Esta operación puede tardar varios ensayos. Una buena ruptura de la membrana se logra wsucción gallina se realiza con suficiente fuerza para que la ruptura de membrana no obstruye la micropipeta (que puede conducir a un aumento en R s durante la grabación), pero lo suficientemente débil con el fin de no dibujar en una gran parte de la membrana o de la célula. - Después de alcanzar una configuración de célula completa con éxito, el seguimiento periódico del lugar micropipeta para evaluar y corregir la deriva significativa, ya que puede conducir a la pérdida del parche. Amplitud Drift puede variar de acuerdo a varios factores, por ejemplo, la calidad de la instalación de equipo de perforación y fuerzas de tracción en el cabezal de la platina. Idealmente, la deriva debe ser casi inexistente.
- Al cambiar al modo de "célula" en la prueba de la membrana, ver diferentes parámetros de la celda como Ri, R s y C p. Seguimiento de estos parámetros durante la grabación.
Nota: Todos estos parámetros pueden ayudar a evaluar el estado de salud inicial de las células y tipos celulares (ver "Prueba de membrana" sección, paso 4). - Una vez THe los pasos anteriores se han completado, permanecen en el modo de fijación de voltaje para medir corrientes (por ejemplo, EPSCs, IPSC), o cambiar a modo de corriente-clamp si la planificación para medir los cambios en la tensión de la membrana (por ejemplo, potencial de acción disparando). Para esta última, se inyecta corriente positiva o negativa para mantener la célula en el voltaje de la membrana deseada (para llevar a cabo este paso, consulte la guía del amplificador manual).
Resultados
Temperatura, un factor que se controla fácilmente por el experimentador, influye en las propiedades biofísicas de los canales iónicos y los receptores, y por lo tanto la forma de onda de las corrientes post-sinápticos (PSC) (EPSC y IPSCs) y la capacidad de las neuronas por obtener picos. Figura 3 y la Figura 4 muestran el efecto de la temperatura sobre la descarga neuronal y la pendiente de EPSCs evocados (eEPSCs), respectivamente. El patrón de disparo (Figura 3) (es decir, la latencia de la espiga 1 st, Spike número, la frecuencia, y la acción de forma de onda potencial) está conformado por una apertura y cierre de canales específicos de iones dependientes de voltaje programado y coordinado (Na +, Ca2 +, y K +), un proceso sensible a la temperatura. la Figura 3 muestra cómo el número pico media aumenta con la temperatura. Cabe destacar que en las condiciones experimentales descritas aquí (grabaciones MSN) aunque freque picono parece ncy ser alterado a temperatura subfisiológica (28 ° C), aumenta significativamente cuando la temperatura alcanza el nivel fisiológicamente relevante (32 ° C). La Figura 4A muestra un ejemplo de cómo la pendiente de eEPSCs, un parámetro que se utiliza comúnmente para evaluar la fuerza sináptica, aumenta con la temperatura.
Aunque R s puede ser algo controlado por el experimentador, es decir, a través de una abertura de la membrana eficiente cuando la transición de un estado sellado a la configuración de célula entera, R es por lo general lentamente aumenta durante la grabación. Esto puede ser el resultado de varios eventos incontrolables, por ejemplo, la membrana de cierre repetido o residuos que obstruyen la punta de la pipeta durante la grabación. Un intento de volver a abrir la membrana aplicando una ligera succión, aunque podría comprometer el parche, a veces puede ayudar a mantener un R s estable. En todos los casos, ya que los cambios de I s puede colter la forma de onda de la señal eléctrica en estudio, se debe monitorizar cuidadosamente, y especialmente cuando se graba PSCs (modo de fijación de voltaje). La figura 4 muestra que cuando aumenta R s (Figura 4B), amplitud de las corrientes mediadas por el receptor de glutamato (eEPSCs ) disminuye (Figura 4 C, D). Por lo general, los experimentadores descartan los datos cuando los cambios en R s superan el 15% (por ejemplo, este laboratorio), sin embargo, algunos laboratorios lo hacen desde un cambio del 20%. Este criterio debe ser indicado en la sección método del artículo.
Para una neurona se define, R i puede estar influenciada por varios factores, incluyendo la temperatura, la salud celular, y la calidad de parche. Específicamente, cuando R i disminuye, amplitudes PSC o la capacidad de las neuronas para generar picos también disminuye. Por ejemplo, la figura 4E muestra que cuando R i no varía significativamente, THe número de espigas permanecen relativamente estables (neurona 1); y cuando R i aumenta, el número de espigas también aumenta (neurona 2). Por lo tanto y de manera similar a R s, Ri debe ser monitoreado cuidadosamente, ya que el 10% de los cambios son suficientes para los datos de polarización.
Como se describió anteriormente, es crítico para controlar o supervisar la temperatura, R s, y R i durante las grabaciones. Por ejemplo, los cambios observados en la señal que se encuentra bajo estudio (PSC) o de disparo puede ser debido a cambios (o la falta de control) de estos factores, más que el efecto de las manipulaciones experimentales, por ejemplo, pre vs. post-efectos de aplicación del baño de drogas.

Figura 1. Por encargo cámara de recuperación (AD) y una imagen de un corte de cerebro a 400X Mostrando sana y Dead Las neuronas (E). ANUNCIO)El procedimiento para hacer una cámara de recuperación personalizado se describe en el paso 2.1. E) Cuadro de NAC MSN shell medial en un corte de cerebro a 400X que muestra ejemplos de sanos (flechas rojas) vs. neuronas muertas (flechas azules). Tenga en cuenta que, si bien algunas células se indican como sano, su aspecto esférico indican que pueden no ser tan saludable como se desea (flechas rojas con asteriscos). El estado de salud final se evaluó sobre la base de reposo V y R i después de lograr la configuración de célula completa. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2. Diagrama que representa las etapas básicas de procedimiento para obtener un Gigaseal y establecer la configuración de célula completa. Cuando la micropipeta es lo suficientemente cerca de thcélulas E Para crear un hoyuelo en la membrana plasmática (paso 1, Approach), se aplica una breve y suave de succión para crear un contacto estrecho entre la micropipeta y la membrana plasmática. Si se realiza correctamente, el contacto fortalecerá y la resistencia aumentará y llegar a 1 GΩ (gigaseal) o más (paso 2, la formación del sello). Una vez que el sello es estable y por encima de 1 GΩ, aplicar una aspiración breve y fuerte para romper la membrana de plasma (paso 3, configuración de célula completa). El logro de la configuración de célula entera permitirá la continuidad entre el citoplasma y el interior micropipeta. Para más detalles, véase el paso protocolo de 5,1-5,8. Haga clic aquí para ver una versión más grande de esta figura.
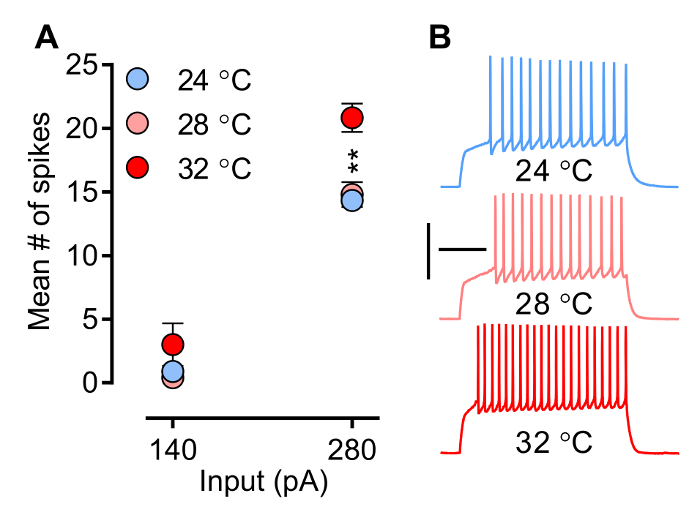
Figura 3. neuronal Firing (excitabilidad intrínseca) se evalúa en Current-almeja Modo p. Aquí, una serie predefinida e incremental de pasos actuales se da con el fin de obtener cambios en el voltaje de la membrana, y de ese modo activar los potenciales de acción. A) Mean número pico aumenta con la temperatura. trazas B) de muestra a 280 pA de NAc MSN cáscara mediales en tres niveles de temperatura (24 ° C, n = 9; 28 ° C, n = 5; y 32 ° C, n = 6). La temperatura en la cámara de registro afecta directamente a la frecuencia de pico. Sin embargo, tenga en cuenta que, si bien no parece ser modificado a temperatura subfisiológica frecuencia de pico, que aumenta significativamente cuando la temperatura alcanza los 32 ° C, una temperatura fisiológicamente relevante. Las neuronas se llevan a cabo a -80 mV. ANOVA de dos vías: la interacción, p <0,0001; efecto de la temperatura, p = 0,0041; pruebas post hoc: 24 ° C y 28 ° C son ambos significativamente diferentes de 32 ° C, ** p <0,01. Los datos se representan como media ± SEM. Calibración: 200 mseg, 50 mV.jove.com/files/ftp_upload/54024/54024fig3large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.

Figura 4. Efecto de la temperatura, R s, y R i en la forma de onda del Ejemplo señal eléctrica en estudio. A) de eEPSC amplitud de una sola MSN shell NAc. El aumento de la temperatura de 24-28 ° C y a 32 ° C aumenta la pendiente de eEPSCs. Tenga en cuenta que los cambios inducidos por la temperatura en la pendiente eEPSCs ocurren rápidamente. Aquí, la pendiente eEPSCs se evalúa en el modo de fijación de voltaje. Calibración: 5 ms, 100 BD) Ejemplo de eEPSCs pendiente de una sola MSN cáscara NAC pA.. Cuando aumenta r s (B), la pendiente de eEPSCs disminuye (C). D) Análisis de correlación de la pendiente eEPSC como una función de Rs. R de Pearson = -0.5717, p <0,0001. Las neuronas son Ejemplo de las huellas de dos neuronas que muestran el efecto de R i en la capacidad de la neurona para generar picos de tensión-sujeta a -80 mV. E). Las neuronas son corrientes de apriete, y se mantiene a -80 mV. Calibración:. 200 mseg, 50 mV Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo describe el procedimiento básico para la realización de experimentos de células enteras patch-clamp en las neuronas en rodajas de cerebro. Sin embargo, la complejidad, el potencial y sensibilidad de esta técnica no pueden ser completamente descritos en este artículo. Aquí, hemos tratado de delinear los pasos más básicos y ponen de relieve los parámetros importantes que deben ser controlados para lograr conjunto de células grabaciones exitosas y rigurosos. Para el aprendizaje teórico, muchos libros y artículos han sido publicados tanto en células enteras de grabación de patch-clamp en rodajas de cerebro 3,21-24 y sobre los métodos que se pueden refinar las soluciones utilizadas 25-27 con el fin de mejorar la viabilidad celular. Para llevar a cabo de forma rutinaria grabaciones adecuadas, se requiere la mejora de las habilidades técnicas a través de la práctica intensiva. horas, sin embargo, con la correcta aplicación de las medidas mencionadas, las células se pueden asignar post mortem, que proporcionan información importante acerca de cambios en las funciones sinápticas y excitabi intrínsecalidad.
En general, además de la importancia de preparar cuidadosamente ambas soluciones ACSF y micropipette interna, cada paso de la disección del cerebro, el corte, el logro de configuración de célula completa con éxito, y la obtención de datos rigurosa e imparcial requiere práctica intensiva. En primer lugar, es fundamental para generar cortes de cerebro sano. Brevemente, la rápida disección del cerebro (idealmente <45 seg), el mantenimiento de una temperatura baja - soluciones de corte en lonchas apropiados (0 2 ° C), mientras que el corte, y todos juegan un papel importante en asegurar la salud de la célula. Es digno de mención que las soluciones que rebanan pueden diferir entre los laboratorios y de acuerdo con el tipo de célula y / o región del cerebro que se investigó. Cuando cortar el cuerpo estriado NAc o dorsal, nuestro laboratorio y otros utilizan ácido quinurénico para la solución de corte para minimizar los procesos de excitotoxicidad 28-33, sin embargo, otros métodos también se pueden utilizar, tales como soluciones a base de sacarosa 34, de alta Mg 2+ / bajas de Ca 2 + 35 soluciones, etc. Estos son sólo algunos ejemplos y se pueden ajustar de acuerdo a la sensibilidad de la región del cerebro o el cerebro a los procesos de excitotoxicidad (por ejemplo, debido a la edad). Para más información sobre las soluciones y la viabilidad celular, consulte 25-27. En última instancia, la concentración de aniones, cationes, y otros fármacos (por ejemplo, ascorbato, antagonistas del receptor de glutamato) que componen las soluciones de corte es determinada de modo que imita el líquido cefalorraquídeo y minimiza tanto como sea posible los procesos de excitotoxicidad que se producen durante el rebanado. El protocolo presentado en este artículo se describen las soluciones estándar que se utilizan habitualmente en los estudios previos de los autores 28-31 cuando grabe de MSN en el NAC o el estriado dorsal en rodajas de cerebro. Por otra parte, el ajuste apropiado de la osmolaridad para ambas soluciones ACSF y micropipette interna son fundamentales para la formación del sello de éxito y el mantenimiento de conf de células enterasiguration. Para crear un gradiente de concentración de la solución extracelular a la solución dentro de la pipeta, ACSF osmolaridad debe ser mayor que para las soluciones de micropipeta internos. Idealmente, la diferencia puede variar de 10 a 30 mOsm.
El logro de una configuración de célula completa con éxito es un paso importante para la realización de grabaciones eficientes. En primer lugar, la capacitancia de la pipeta se puede ajustar una vez que la pipeta se coloca en el baño. A pesar de los ajustes automáticos generalmente se fijan correctamente, es aconsejable el uso de ajustes rápidos y lentos de capacitancia celular con precaución ya que pueden dañar la célula cuando no se realiza adecuadamente. En segundo lugar, breve aspiración de membrana que es necesario romper la membrana dará lugar a una significativa apertura de la membrana, y por lo tanto permitir una buena comunicación entre intracelular y el medio intra-micropipeta. Esto asegurará que R s se mantendrá relativamente estable durante la grabación. Si se usa solución micropipeta basado en Cs,el potencial de membrana en reposo debe ser evaluada inmediatamente después de establecimiento de la configuración de célula completa (véase el paso 5.8). En efecto, la difusión de Cs + dentro de la célula causa la pérdida de potencial de membrana en reposo. Para determinar el potencial de reposo adecuado, el potencial de unión líquida debe ser evaluado 20. Sin embargo, el experimentador puede informar el potencial de reposo que se observa después de romper la membrana (después de la etapa 5.8) y optar por no ajustar para el potencial de unión líquida. En todos los casos, debe ser mencionado en la sección de método del artículo. Tras la creación de la configuración de célula completa, C p también se puede obtener y se puede utilizar como un parámetro indirecto para evaluar la salud celular y / o tipo de célula. En tercer lugar, cuando se iniciaron las grabaciones, otros parámetros deben ser controlados rigurosamente. Los factores críticos que deben ser controlados en la evaluación de la excitabilidad neuronal son la temperatura, R s, y R i.
Comomencionado anteriormente, R i y C p pueden ser indicativos de salud de las células y / o tipo de célula. Por ejemplo, la membrana plasmática, que actúa como un aislante, separa carga (como resultado de la diferente composición de la intracelular y soluciones extracelulares), que en conjunto constituyen la capacitancia de la membrana. Cuanto mayor sea la superficie de la membrana (neuronal específica), mayor es la capacitancia. A continuación, no es sorprendente que los tipos específicos neuronales exhibición C py R i (matemáticamente relacionado con C p) que están dentro de la misma gama. R s está directamente relacionado con el tamaño de la punta de la pipeta, y por lo tanto es generalmente indicativo de la calidad o el tamaño de la abertura de la membrana. Brevemente, al establecer la configuración de célula completa, el citoplasma se convierte en continua eléctricamente con la solución en la micropipeta y completamente aislado del medio externo. R s (o R a) se origina de la resistencia para el Current fluya desde pipeta para citoplasma. Para algunas condiciones de grabación (por ejemplo, el modo de corriente de pinza o de registro de fijación de voltaje de las corrientes de iones dependientes de voltaje), R s debe compensarse adecuadamente (véase la Ref. 3,21-24 o amplificador guía manual para una compensación adecuada R s) .
Como se describe en la Figura 4, R s es particularmente importante ya que puede afectar dramáticamente la forma de onda de la señal eléctrica, por ejemplo, la amplitud EPSC. No obstante, R s se debe vigilar cuidadosamente a interpretaciones fuera de línea de los efectos observados. En caso de que la membrana no se ha roto adecuadamente, obstrucción punta de la micropipeta o re-cierre de la membrana puede ocurrir, en el que se incrementa y el sesgo caso R s de la forma de onda de la señal eléctrica en estudio (Figura 4B-D). En resumen, muchos problemas se pueden encontrar durante la grabación, y los que por lo general se dividen en tres categorías: i) los tejidos relacionados, Por ejemplo, aumento de la mortalidad celular debido a la mala disección, la inadaptación de la osmolaridad ACSF, y la hipoxia; ii) relacionada con el equipo, por ejemplo, los problemas de ruido y de puesta a tierra, control de temperatura, cortar y micropipeta posicionamiento, etc.; y iii) la interpretación de datos, por ejemplo, los cambios observados pueden ser el resultado de artefactos experimentales no deseadas de desviación de los datos como los cambios en los parámetros eléctricos de forma de onda que alteran (R i, R s, temperatura, véase la Figura 3 y 4) y no el resultado de la experimentación manipulaciones.
Aunque la grabación de células enteras en rodajas de cerebro es una técnica poderosa para evaluar dependiente de la experiencia plasticidad, este enfoque limita la interpretación de los datos. En particular, tres limitaciones importantes de técnica de registro de células enteras son que: (i) cambios en los niveles de función y de expresión de proteínas específicas (por ejemplo, canales de iones) no pueden distinguirse; (Ii) porque estetécnica evalúa el flujo de corriente a través de toda la membrana (o una parte sustancial), que no proporciona precisa la localización subcelular de las corrientes iónicas o los cambios que se observan; y (iii) la invasividad de configuración de célula completa conduce a la diálisis del contenido de la celda, y de ese modo a la interrupción de la maquinaria molecular intracelular necesario para algunos fenómenos que se desarrollan o que se expresen. Una forma de evitar la diálisis es utilizar grabaciones de electrodos afilados o la técnica de patch perforada 3,21,23. Con respecto a las últimas moléculas antibióticas, formadores de poros, tales como la nistatina se puede añadir a la solución de la pipeta. La formación de estos poros permitirá la grabación de las corrientes sin interrumpir el segundo mecanismos de mensajería dentro de la célula. No obstante, los recientes avances en nanotecnología y el desarrollo de nanoelectrodos 36 proporcionan potentes herramientas para la mejora de las grabaciones neuronales. Tal avance tecnológico en la neurociencia están aún en development y ahora están poniendo a nuestro alcance la posibilidad de realizar patch-clamp e intracelulares grabaciones con una invasión mínima, es decir, manteniendo intacto el medio intracelular, y la investigación de las funciones de los canales de iones dentro de los compartimentos subcelulares que eran hasta ahora no accesibles con clásica electrodos de patch-clamp 37.
Divulgaciones
Ninguno de los autores tiene intereses en competencia o intereses en conflicto.
Agradecimientos
Esta investigación fue apoyada por los fondos de inicio de UT Southwestern (SK).
Materiales
| Name | Company | Catalog Number | Comments |
| Isolated pulse stimulus generator | A.M.P.I | Master-8 | |
| Isolation unit (ISO-Flex) | A.M.P.I | ISO-Flex | |
| Computer controlled Amplifier | Molecular Devices | Multiclamp 700B | |
| Digital Acquisition system | Molecular Devices | Digidata 1500 | |
| Microscope | Olympus | BX-51 | |
| Micromanipulator | Sutter Instruments | MPC-200 | |
| Chamber and in-line Heater | Warner Instruments | TC-344B | |
| Vibratome Slicer | Leica | VT1000 S | |
| Micropipette Puller | Narishige | PC-10 | |
| Imaging Camera | Q Imaging | QIClick-F-M-12 | |
| Narishige pipette puller PC-10 | Narishige | PC-10 | |
| Glass capillaries | WPI | TW150F-3 | |
| Slice hold-down (harp) | Warner Instruments | 64-0255 | |
| Slice Chamber | Warner Instruments | RC-26 | |
| Nonmetallic syringe needle | World Precision Instruments | MF28G67-5 | |
| Syringe filters | Nalgene | 176-0045 | |
| Glue Gun | Home Depot | various | |
| Gas dispersion tube | Ace Glass Inc. | various | |
| Decapitation scissors | Home Depot | 100649198 | |
| Scalpel Handle #3 | World Precision Instruments | 500236 | |
| Small straight sharp tips scissors | World Precision Instruments | 14218 | |
| Vessel canulation forceps | World Precision Instruments | 500453 | |
| Curved hemostatic forceps | World Precision Instruments | 501288 | |
| Economy Tweezers #3 | World Precision Instruments | 501976-6 | |
| Spatula | Fisher Scientific | 14357Q | |
| Scooping spatula | Fisher Scientific | 14-357Q | |
| Petri dish | Fisher Scientific | 08-747B | |
| Filter paper | Lab Depot | CFP1-110 | |
| Solutions | |||
| Cs-Gluconate internal solution (pH 7.2–7.3, 280–290 mOsm) | |||
| D-gluconic acid 50% | Sigma Aldrich/various | G1951 | |
| Cesium-OH (CsOH) 50% | Sigma Aldrich/various | 232041 | |
| NaCl, 2.8 mM | Sigma Aldrich/various | S7653 | |
| HEPES, 20 mM | Sigma Aldrich/various | H3375 | |
| EGTA, 0.4 mM | Sigma Aldrich/various | E4378 | |
| tetraethylammonium-Cl, 5 mM | Sigma Aldrich/various | T2265 | |
| Na2GTP, 0.3 mM | Sigma Aldrich/various | G8877 | |
| MgATP, 2 mM | Sigma Aldrich/various | A9187 | |
| K-Gluconate internal solution (pH 7.2–7.3, 280–290 mOsm) | |||
| K D-gluconate, 120 mM | Sigma Aldrich/various | G4500 | |
| KCl, 20 mM | Sigma Aldrich/various | P3911 | |
| HEPES, 10 mM | Sigma Aldrich/various | H3375 | |
| EGTA, 0.2 mM | Sigma Aldrich/various | E4378 | |
| MgCl2 | Sigma Aldrich/various | M8266 | |
| Na2GTP, 0.3 mM | Sigma Aldrich/various | G8877 | |
| MgATP, 2 mM | Sigma Aldrich/various | A9187 | |
| Standard artificial cerebrospinal fluid (ACSF, osmolarity ≈ 300-310 mOsm) | |||
| KCl, 2.5 mM | Sigma Aldrich/various | P3911 | |
| NaCl, 119 mM | Sigma Aldrich/various | S7653 | |
| NaH2PO4•H2O, 1 mM | Sigma Aldrich/various | S9638 | |
| NaHCO3, 26.2 mM | Sigma Aldrich/various | S8875 | |
| Glucose, 11 mM | Sigma Aldrich/various | G8270 | |
| MgSO4-7H2O, 1.3 mM | Sigma Aldrich/various | 230391 | |
| CaCl2-2H2O, 2.5 mM | Sigma Aldrich/various | C3881 | |
| Additional compounds used for solutions preparation | |||
| KOH | various | ||
| Kynurenic acid | Sigma Aldrich/various | K3375 | |
Referencias
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibres. Nature. 260 (5554), 799-802 (1976).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annu Rev Physiol. 46, 455-472 (1984).
- Cahalan, M., Neher, E. Patch clamp techniques: an overview. Methods Enzymol. 207, 3-14 (1992).
- Staley, K. J., Otis, T. S., Mody, I. Membrane properties of dentate gyrus granule cells: comparison of sharp microelectrode and whole-cell recordings. J Neurophysiol. 67 (5), 1346-1358 (1992).
- Horn, R., Marty, A. Muscarinic activation of ionic currents measured by a new whole-cell recording method. J Gen Physiol. 92 (2), 145-159 (1988).
- Pusch, M., Neher, E. Rates of diffusional exchange between small cells and a measuring patch pipette. Pflugers Arch. 411 (2), 204-211 (1988).
- Kandel, E. R., Dudai, Y., Mayford, M. R. The molecular and systems biology of memory. Cell. 157 (1), 163-186 (2014).
- Kourrich, S., Bonci, A. Chapter 5: Synaptic and Neural plasticity. Neurobiology of Mental Illness. 4th edn. , (2013).
- Mozzachiodi, R., Byrne, J. H. More than synaptic plasticity: role of nonsynaptic plasticity in learning and memory. Trends Neurosci. 33 (1), 17-26 (2010).
- Zhang, W., Linden, D. J. The other side of the engram: experience-driven changes in neuronal intrinsic excitability. Nat Rev Neurosci. 4 (11), 885-900 (2003).
- Kourrich, S., Calu, D. J., Bonci, A. Intrinsic plasticity: an emerging player in addiction. Nat Rev Neurosci. 16 (3), 173-184 (2015).
- Luscher, C., Malenka, R. C. Drug-evoked synaptic plasticity in addiction: from molecular changes to circuit remodeling. Neuron. 69 (4), 650-663 (2011).
- McEwen, B. S., Morrison, J. H. The brain on stress: vulnerability and plasticity of the prefrontal cortex over the life course. Neuron. 79 (1), 16-29 (2013).
- Sandi, C., Haller, J. Stress and the social brain: behavioural effects and neurobiological mechanisms. Nat Rev Neurosci. 16 (5), 290-304 (2015).
- Kim, S. J., Linden, D. J. Ubiquitous plasticity and memory storage. Neuron. 56 (4), 582-592 (2007).
- Ganguly, K., Poo, M. M. Activity-dependent neural plasticity from bench to bedside. Neuron. 80 (3), 729-741 (2013).
- Kullmann, D. M., Moreau, A. W., Bakiri, Y., Nicholson, E. Plasticity of inhibition. Neuron. 75 (6), 951-962 (2012).
- Bar-Yehuda, D., Korngreen, A. Space-clamp problems when voltage clamping neurons expressing voltage-gated conductances. J Neurophysiol. 99 (3), 1127-1136 (2008).
- Williams, S. R., Mitchell, S. J. Direct measurement of somatic voltage clamp errors in central neurons. Nat Neurosci. 11 (7), 790-798 (2008).
- Neher, E. Correction for liquid junction potentials in patch clamp experiments. Methods Enzymol. 207, 123-131 (1992).
- Defelice, L. J. . Electrical Properties of Cells-Patch Clamp for Biologists. , (1997).
- Kornreich, B. G. The patch clamp technique: principles and technical considerations. J Vet Cardiol. 9 (1), 25-37 (2007).
- Molleman, A. . Patch Clamping: An Introductory Guide To Patch Clamp Electrophysiology. , (2003).
- Neher, E., Sakmann, B. The patch clamp technique. Sci Am. 266 (3), 44-51 (1992).
- Richerson, G. B., Messer, C. Effect of composition of experimental solutions on neuronal survival during rat brain slicing. Exp Neurol. 131 (1), 133-143 (1995).
- Tanaka, Y., Tanaka, Y., Furuta, T., Yanagawa, Y., Kaneko, T. The effects of cutting solutions on the viability of GABAergic interneurons in cerebral cortical slices of adult mice. J Neurosci Methods. 171 (1), 118-125 (2008).
- Ye, J. H., Zhang, J., Xiao, C., Kong, J. Q. Patch-clamp studies in the CNS illustrate a simple new method for obtaining viable neurons in rat brain slices: glycerol replacement of NaCl protects CNS neurons. J Neurosci Methods. 158 (2), 251-259 (2006).
- Kourrich, S., et al. Dynamic interaction between sigma-1 receptor and Kv1.2 shapes neuronal and behavioral responses to cocaine. Cell. 152 (1-2), 236-247 (2013).
- Kourrich, S., Klug, J. R., Mayford, M., Thomas, M. J. AMPAR-Independent Effect of Striatal aCaMKII Promotes the Sensitization of Cocaine Reward. J Neurosci. , (2012).
- Kourrich, S., Rothwell, P. E., Klug, J. R., Thomas, M. J. Cocaine experience controls bidirectional synaptic plasticity in the nucleus accumbens. J Neurosci. 27 (30), 7921-7928 (2007).
- Kourrich, S., Thomas, M. J. Similar neurons, opposite adaptations: psychostimulant experience differentially alters firing properties in accumbens core versus shell. J Neurosci. 29 (39), 12275-12283 (2009).
- Rothwell, P. E., Kourrich, S., Thomas, M. J. Environmental novelty causes stress-like adaptations at nucleus accumbens synapses: implications for studying addiction-related plasticity. Neuropharmacology. 61 (7), 1152-1159 (2011).
- Rothwell, P. E., Kourrich, S., Thomas, M. J. Synaptic adaptations in the nucleus accumbens caused by experiences linked to relapse. Biol Psychiatry. 69 (11), 1124-1126 (2011).
- Koya, E., et al. Silent synapses in selectively activated nucleus accumbens neurons following cocaine sensitization. Nat Neurosci. 15 (11), 1556-1562 (2012).
- Conrad, K. L., et al. Formation of accumbens GluR2-lacking AMPA receptors mediates incubation of cocaine craving. Nature. 454 (7200), 118-121 (2008).
- Kruskal, P. B., Jiang, Z., Gao, T., Lieber, C. M. Beyond the patch clamp: nanotechnologies for intracellular recording. Neuron. 86 (1), 21-24 (2015).
- Novak, P., et al. Nanoscale-targeted patch-clamp recordings of functional presynaptic ion channels. Neuron. 79 (6), 1067-1077 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados