Method Article
تسجيلات خلية كاملة التصحيح، المشبك في الدماغ شرائح
In This Article
Summary
يصف هذا البروتوكول الخطوات الإجرائية الأساسية لأداء خلية كاملة تسجيلات التصحيح المشبك. هذه التقنية تتيح دراسة السلوك الكهربائي للخلايا العصبية، وعندما أجريت في شرائح الدماغ، تسمح للتقييم مختلف الوظائف العصبية من الخلايا العصبية التي لا تزال متكاملة في الدوائر الكهربائية في المخ الحفاظ عليها بشكل جيد نسبيا.
Abstract
خلية كاملة تسجيل التصحيح، المشبك هو أسلوب الكهربية التي تسمح للدراسة الخواص الكهربية لجزء كبير من الخلايا العصبية. في هذا التكوين، micropipette في اتصال مع ضيق غشاء الخلية، مما يمنع تسرب الحالي، وبالتالي توفر القياسات الحالية الأيونية أكثر دقة من حاد داخل الخلايا طريقة تسجيل الكهربائي المستخدمة سابقا. تقليديا، وتسجيل كامل الخلية لا يمكن أن يؤديها على الخلايا العصبية في أنواع مختلفة من الاستعدادات، بما في ذلك نماذج زراعة الخلايا، الخلايا العصبية فصل الخلايا العصبية في الدماغ شرائح، وفي الحيوانات تخدير أو مستيقظا سليمة. وخلاصة القول، وقد ساهم هذا الأسلوب إلى حد كبير في فهم الخصائص الفيزيائية الحيوية السلبية والإيجابية للخلايا منفعل. والميزة الرئيسية لهذا الأسلوب هو أنه يوفر معلومات حول كيفية محددة التلاعب (على سبيل المثال، الدوائية،-مجرب يسببها المطاوعة) قد يغير وظائف الخلايا العصبية محددة أو جhannels في الوقت الحقيقي. بالإضافة إلى ذلك، وفتح كبير من غشاء البلازما يسمح الحل ماصة الداخلية لتنتشر بحرية في السيتوبلازم، وتوفير وسيلة لادخال المخدرات، على سبيل المثال، منبهات أو الخصوم من البروتينات داخل الخلايا المحددة، والتلاعب هذه الأهداف دون تغيير وظائفهم في الخلايا المجاورة. أداء هذه المادة سوف تركز على تسجيل كامل الخلية في الخلايا العصبية في الدماغ شرائح، تمهيدا لديه ميزة تسجيل الخلايا العصبية في الدماغ الدوائر الحفاظ عليها بشكل جيد نسبيا، أي في سياق ذي صلة من الناحية الفسيولوجية. على وجه الخصوص، عندما جنبا إلى جنب مع الأدوية المناسبة، وهذا الأسلوب هو أداة قوية تسمح بتحديد neuroadaptations المحددة التي وقعت بعد أي نوع من التجارب، مثل التعلم، والتعرض لتعاطي المخدرات، والإجهاد. وباختصار، تسجيلات خلية كاملة التصحيح، المشبك في شرائح الدماغ توفر وسيلة لقياس في فيفو إعداد تغييرات تستمر فترات طويلةفي وظائف الخلايا العصبية التي وضعت في الحيوانات المستيقظة سليمة.
Introduction
تقنية التصحيح، المشبك، وهي تقنية الكهربية التي تم تطويرها في أواخر 1970s 1،2، هي الأداة الرئيسية لدراسة وظائف القناة الايونية واحدة أو متعددة في الأنسجة الحية. بين تكوينات التصحيح المختلفة التي يمكن تحقيقها، وتسجيلات خلية كاملة التصحيح، المشبك تسمح دراسة السلوك الكهربائي لجزء كبير من الخلايا العصبية. تقليديا، يتم تنفيذ هذه التقنية في المختبر إما على شرائح الدماغ، الخلايا العصبية فصلها حديثا، أو على نماذج الثقافة الخلية 3. عندما أجريت على الخلايا العصبية في الدماغ شرائح، تقدم هذه التقنية العديد من المزايا. على وجه الخصوص: يتم تسجيل (ط) الخلايا العصبية في الدماغ الدوائر المحافظة نسبيا إلى حد ما، وبالمقارنة مع الاستعدادات زراعة الخلايا، وتوفير بيئة التي هي ذات الصلة من الناحية الفسيولوجية 3. وهذا يسمح التقاط وقت مبكر، أو حتى على الشاشة في الوقت الحقيقي، والأحداث الخلوية والجزيئية التي يتم تشغيلها من قبل أي نوع من pharmacolog الحادالتلاعب كال - قرار الزمني الذي لا يمكن تحقيقه باستخدام الكلاسيكية في ظروف الجسم الحي. (ب) القدرة على تحديد بصريا مناطق الدماغ في شرائح الدماغ تسمح خصوصية إقليمية عالية 3 على حد سواء لدراسة المنطقة الدماغ والخلايا العصبية محددة عندما يعبرون عن علامات الفلورسنت. (ج) الوصول إلى الفضاء داخل الخلايا من الخلية من خلال فتح جزء كبير من غشاء البلازما (على النقيض من ثقب غشاء مع micropipette حاد للتسجيلات داخل الخلايا) 4. في المقابل، وهذا يسمح للمحتوى أو تركيز أيونات معينة يؤلف الحل الداخلي إلى تعديل أهداف جزيئية ذلك أو الآليات الخلوية يمكن دراستها تحت ظروف مختلفة. على سبيل المثال، عند إنشاء تكوين خلية كاملة، أي وكيل الدوائية محددة (على سبيل المثال، الخصوم) التي يمكن للمرء أن يضيف إلى micropipette تسجيل (التصحيح ماصة) سوف حل منتشر مباشرة في سيتوبلازم وتتصرف على أساسها putat لهاإيف أهداف داخل الخلايا دون تغيير وظيفة الهدف في الخلايا المجاورة. بالإضافة إلى ذلك، بالمقارنة مع تسجيل micropipette حاد، وفتح كبير في طرف القطب المشبك التصحيح يوفر أدنى مقاومة، والضوضاء أقل المتنافسة، وبالتالي تحسين فرص الكهربائية إلى داخل الخلية 4. ومع ذلك، لاحظ أن فتحة كبيرة في الطرف ماصة قد يؤدي إلى غسيل الكلى الخلايا، وبالتالي فقدان الآلية الجزيئية الخلايا التي قد تكون حاسمة للتعبير عن الظواهر البيولوجية التي هي تحت الدراسة 5،6. في هذه الحالة، قد تكون التسجيلات القطب حادة أكثر ملاءمة. هذا النوع من التسجيلات يتطلب بال micropipettes مع مسام أصغر بكثير من تلك المستخدمة للتسجيلات خلية كاملة، وبالتالي منع معظم التبادل الأيوني بين الفضاء داخل الخلايا والحل ماصة الداخلي.
أي شكل من أشكال الخبرة (حادة أو مزمنة)، بما في ذلك التعلم 7-10، والتعرض لتعاطي المخدرات 11،12، والإجهاد 13،14، وما إلى ذلك، يمكن أن يغير جوانب مختلفة من وظيفة الخلايا العصبية في مناطق محددة في الدماغ. لأن هذه التعديلات غالبا ما تتطلب وقتا لتطوير (ساعات إلى أيام)، وتسجيلات خلية كاملة في شرائح الدماغ من الحيوانات التي خضعت لتجربة محددة تسمح للباحثين التعرف على هذه التغييرات. في الأساس، فإن العديد (إن لم يكن كل) المكونات التي تشارك في وظائف الخلايا العصبية (مثل القنوات الأيونية تنشيط يجند، قنوات أيون الجهد مسور، النقل العصبي)، وبالتالي النشاط الدائرة الدماغ والسلوك، ويمكن أن تتغير من تجربة (تجربة تعتمد اللدونة) 10،15-17. على مستوى الخلايا العصبية، والنشاط الدائرة الدماغ يظهر من تفاعلات مستمرة بين متشابك (على سبيل المثال، نقل الغلوتامات) وعوامل استثارة الخلوية الذاتية (على سبيل المثال، وقنوات ايون axosomato شجيري: الصوديوم، الصوديوم، البوتاسيوم، K +، والكالسيوم، الكالسيوم 2+ ). في ظل ظروف معينة باستخدام مصنعونالبريد الخلية، التعديلات إشارة مصدرها على وجه التحديد من التغييرات في مقابل متشابك استثارة الجوهرية يمكن عزل التصحيح المشبك تقنيات الكهربية.
في معظم الحالات، يتم تقييم استثارة متشابك باستخدام خلية كاملة تقنية الجهد المشبك. يسمح هذا الوضع تسجيل قياس التيارات أيون [على سبيل المثال، بوساطة مستقبلات حمض α-أمينو-3-هيدروكسي-5-ميثيل-4-isoxazolepropionic ( مستقبلات أمبا) ومستقبلات N-ميثيل-D-الأسبارتيك حمض (مستقبلات NMDA)] من خلال غشاء البلازما الخلايا العصبية في حين الضغط على غشاء المحتملة في مجموعة الجهد. هنا، المجربون استخدام الحلول الداخلية micropipette التي تحتوي على مادة السيزيوم (جيم +)، مانع واسعة من K + قنوات (الرئيسية عوامل استثارة الجوهرية). على إنشاء تكوين خلية كاملة، ونشر جيم + في الفضاء داخل الخلايا كتلة K + القنوات، وبالتالي سيسمح كل من كفاءة نسبيا الفضاء المشبك وقبلتنفيس عن تأثير عوامل استثارة الجوهرية على قياسات أخرى. قضايا الفضاء المشبك، أي صعوبة في الجهد المشبك في خلية كاملة، تنشأ عند تسجيل الخلايا على شكل غير منتظم (على سبيل المثال، الخلايا العصبية)، وبشكل خاص الخلايا العصبية مع شجيري واسعة ومعقدة الشجرة 18،19. لأن الجسدية الجهد المشبك الضوابط سيئة الجهد في شجرة شجيري من الخلايا العصبية، مشوهة جوانب مختلفة من الإشارات الكهربائية الجذعية قيد الدراسة في الطريقة التي تعتمد على المسافة الجذعية. جنبا إلى جنب مع أدوات الدوائية مثل بيكروتوكسين (غاما الغاما حامض، GABA وخصم مستقبلات) أو حامض kynurenic (مانع واسعة من مستقبلات الغلوتامات) الذائب في حل خارج الخلية (الاصطناعي الدماغية الشوكي السائل، ACSF)، وهذا الأسلوب يسمح بقياس الغلوتامات مستقبلات GABA ووالتيارات R بوساطة التوالي.
في المقابل، وعادة ما يتم تقييمها استثارة الجوهرية في وضع تسجيل المشبك الحالي.بدلا من تسجيل الجهد المشبك، وهذا وضع تسجيل يسمح بقياس الاختلافات في إمكانات غشاء الناجمة عن التيارات أيون التي تتدفق من خلال غشاء البلازما الخلايا العصبية. عادة، يتم تقييم التغيير في استثارة الجوهرية من خلال التغييرات في القدرة على الخلايا العصبية لتوليد إمكانات العمل، الأمر الذي يتطلب على حد سواء نا + وقنوات K +. ولذلك، عند تنفيذ تسجيلات المشبك الحالي، تمتلئ بال micropipettes مع حل داخلي يحتوي على K + بدلا من جيم +. جنبا إلى جنب مع وكلاء الدوائية التي تمنع الغلوتامات وGABA والتيارات بوساطة مستقبلات الذائبة في ACSF، وهذا التصميم التجريبي يسمح قياس مساهمة العوامل الجوهرية (على سبيل المثال، K + قنوات) إلى إطلاق الخلايا العصبية دون أن الملوثة التغيرات المحتملة في استثارة متشابك العوامل.
هذه المادة سوف تصف الخطوات الإجرائية اللازمة الأساسية رس (ط) إعداد شرائح الدماغ صحية؛ (ب) تحقيق تكوين خلية كاملة، و (ج) مراقبة المعايير الأساسية لتقييم متشابك واستثارة الجوهرية.
Protocol
أجريت جميع التجارب وفقا للبروتوكولات التي وافقت عليها لجنة رعاية الحيوان المؤسسية واستخدام UT جنوب غربي، وتم اختيار ذلك لتقليل التوتر، وعدم الراحة، والألم التي يعيشها حيوانات التجارب.
1. حلول
ملاحظة: إعداد الحلول الداخلية micropipette مقدما. بالنسبة لمعظم أغراض تجريبية الأساسية، يجب أن نوعين من الحلول تكفي: جيم + المستندة وK + الحلول المستندة.
- استخدام جيم + الحلول المستندة إلى (على سبيل المثال، جيم + غلوكونات حل، انظر المواد) للتجارب الجهد المشبك. التحضير في RT.
- إعداد 117 ملي حل CS-غلوكونات عن طريق خلط 4.62 غرام حمض-D الغلوكونيك (~ 3.696 مل) مع 3.54 ز CsOH (~ 2.01 مل).
- إضافة ده 2 O إلى 90 مل، والسماح لها تتوازن لمدة 30 دقيقة.
- تضاف المكونات الصلبة (20 ملي HEPES = 0.476 غرام؛ 0.4 ملي EGTA = 15.2 ملغ؛ 2.8 ملي مول كلوريد الصوديوم = 16.4 ملغ و 5 ملي رباعي إيثيل الأمونيوم (TEA) كلوريد = 83 ملغ).
- إضافة ده 2 O إلى ~ 97 مل.
- ضبط درجة الحموضة من الحل مع 50٪ CsOH إلى 7،2-7،3.
- تحقق الأسمولية وصحيحة إذا لزم الأمر مع ده 2 O.
ملاحظة: هناك مجموعة جيدة من ~ 280-285 ملي أوزمول. وينبغي أن يكون الأسمولية المثلى 15-20 الميلي أسمول تحت الأسمولية من ACSF القياسية (عادة 300-310 ملي أوزمول، 300 ملي أوزمول في مختبرنا). قد تختلف الأسمولية اعتمادا على الحلول تركيبة محددة. - قسامة إلى 1000 ميكرولتر ومخزن في -20 درجة مئوية أو أقل.
- إعداد، قسامة، وتجميد، وإضافة ATP / GTP إلى حل داخلي في يوم تسجيل.
- إضافة 64.63 ملغ ATP إلى 10 ملغ GTP وتذوب في 637.11 ميكرولتر من ده 2 O.
- إعداد 10 مكل ومخزن في -20 درجة مئوية أو أقل. خلط كل 100X قسامة مع 1000 ميكرولتر من حل داخلي في يوم التجربة. مرة واحدة يضاف ATP / GTP إلى حل داخلي، والحفاظ على الجليد لمنع degradati ATP / GTPعلى.
- استخدام K + الحلول المستندة إلى (على سبيل المثال، حل K-غلوكونات، انظر المواد) لكلا التجربتين current- والجهد المشبك حيث لا تزال K + المواصلة وظيفية بحيث يمكن تقييم إطلاق الخلايا العصبية. التحضير في RT.
- تزن كل المواد وفقا لحجم النهائي المطلوب. لإعداد 90 مل من محلول، 120 ملي K-غلوكونات = 2.81 غرام؛ 20 ملي بوكل = 0.149 غرام؛ 10 ملي HEPES = 0.238 غرام؛ 0.2 ملي EGTA = 0.008 غرام؛ 2 مم MgCl 2 = 0.021 غرام.
- استخدام ما يكفي من ده 2 O لتصل إلى 90٪ من حجم الحل النهائي. هذا ينبغي أن تكفل تبقى أن مساحة كافية لدرجة الحموضة وتعديل الأسمولية.
- بعد إضافة وخلط جميع المكونات، تأكد من أن الحل واضح قبل قياس درجة الحموضة.
- مع التحريك باستمرار الحل، وضبط درجة الحموضة إلى 7،2-7،3 باستخدام K + هيدروكسيد (KOH).
- بعد ضبط درجة الحموضة، واستخدام مقياس التناضح والإعلانفقط الأسمولية إلى 280-285 ملي أوزمول.
ملاحظة: الأسمولية الأمثل يجب أن يكون 15-20 الميلي أسمول تحت الأسمولية من ACSF القياسية (عادة 300-310 ملي أوزمول، 300 ملي أوزمول في مختبرنا). قد تختلف الأسمولية اعتمادا على الحلول تركيبة محددة. - قسامة إلى 1000 ميكرولتر ومخزن في -20 درجة مئوية أو أقل.
- إعداد، قسامة، وتجميد، وإضافة ATP / GTP إلى حل داخلي في يوم من تسجيل (راجع الخطوة 1.1.8).
- إعداد 1 لتر من ACSF القياسية (انظر المواد).
ملاحظة: نحن نستخدم هذه الوصفة في مختبرنا عند تسجيل الخلايا العصبية الشوكية المتوسطة (MSNs) في شرائح الدماغ، ومع ذلك، قد تختلف صفات بين المختبرات، وبالتالي، فإننا نوصي مجرب استخدام وصفة يستخدم عادة عند تسجيل منطقة في الدماغ من الفائدة . - إعداد ACSF تشريح (حل تشريح، ~ 125 مل ملاحظة: سوف حجم بالضبط يعتمد على حجم غرفة التشريح كما ينبغي أن يغرق تماما الدماغ) لاستخدامها فيالخطوات 2،2-2،8.
- إعداد 5 ملم حمض kynurenic (لمنع الغلوتامات عمليات excitotoxic المواد التي يسببها مستقبلات) في معيار ACSF في حجم كاف لغمر الدماغ تشريح خلال. استخدام sonicator للمساعدة في حل حامض kynurenic.
ملاحظة: طول صوتنة قد تختلف تبعا لحجم وكمية من المواد الصلبة في الحل. يجب أن تكون الحلول واضحة في نهاية عملية (حوالي 1-2 دقائق في ظروفنا). - تهدئة في حين ظهرت على السطح مع 95٪ O 2، 5٪ غاز ثاني أكسيد الكربون 2 في دلو من الجليد حتى تصل درجة الحرارة 0-2 درجة مئوية.
- إعداد 5 ملم حمض kynurenic (لمنع الغلوتامات عمليات excitotoxic المواد التي يسببها مستقبلات) في معيار ACSF في حجم كاف لغمر الدماغ تشريح خلال. استخدام sonicator للمساعدة في حل حامض kynurenic.
- إعداد ACSF للتسجيل.
- تأخذ 1 لتر من معيار ACSF (أو ما ترك من الحل أعد في الخطوة 1.3) التي يمكن إضافة وكلاء الدوائية المناسبة اعتمادا على تجارب مخطط لها.
- على سبيل المثال، إضافة 100 بيكروتوكسين ميكرومتر عند تسجيل مثير التيارات ما بعد المشبكية أو الإمكانيات (EPSCs أو EPSPs)، مضادات مستقبلات الغلوتامات (kynureشركة الاستثمارات الوطنية حامض، 2 مم. أو مزيج من D-APV 50 ميكرومتر مع CNQX 10 ميكرومتر) عند تسجيل المثبطة التيارات ما بعد المشبكية أو الإمكانيات (IPSCs أو IPSPs)، وكلاهما بيكروتوكسين والغلوتامات مستقبلات عند تقييم إطلاق الخلايا العصبية في حالة عدم وجود أي تأثير من الأحداث متشابك.
- تأخذ 1 لتر من معيار ACSF (أو ما ترك من الحل أعد في الخطوة 1.3) التي يمكن إضافة وكلاء الدوائية المناسبة اعتمادا على تجارب مخطط لها.
2. إعداد شريحة
- بناء أو الحصول على غرفة الإنعاش شريحة.
ملاحظة: مبدأ لغرفة الإنعاش واضح وصريح ويمكن أن يتم في المختبر (الشكل 1). لفترة وجيزة، الغرفة هو وعاء التي يتم إدراجها سلة لعقد شرائح الدماغ عند مستوى أقل من سطح ACSF. أيضا بيع الشركات العلمية المختلفة غرف الانتعاش شريحة.- وكمثال على ذلك، الحصول على أربع حلقات (4-6 ملم عالية) (الشكل 1A، عرض الجانب، B، رأي كبار) عن طريق خفض حقنة 30 سم مكعب. ثم، وشبكات امتدت الغراء (على سبيل المثال، وقطع من النايلون هوسه) إلى جانب واحد من حلقات لعقد شرائح الدماغ (الشكل 1B) والغراء الحلقات معا.
ملاحظة: مسدس الغراء يمكن استخدامها. - مرة واحدة يتم لصقها تعتمد الحلقات المعدنية الأربع، الغراء متساوي الساقين على شكل شبه منحرف الجدار البلاستيك المنحني لاثنين من حلقات (الشكل 1A و B) لتحويل فقاعات الأكسجين من شرائح الدماغ يتعافى (الشكل 1C و D). كما هو مبين في الشكل 1D، إدراج نظام الأكسجين نشرها (هنا، أنبوب تشتت الغاز) على نفس الجانب الجدران البلاستيكية.
- وكمثال على ذلك، الحصول على أربع حلقات (4-6 ملم عالية) (الشكل 1A، عرض الجانب، B، رأي كبار) عن طريق خفض حقنة 30 سم مكعب. ثم، وشبكات امتدت الغراء (على سبيل المثال، وقطع من النايلون هوسه) إلى جانب واحد من حلقات لعقد شرائح الدماغ (الشكل 1B) والغراء الحلقات معا.
- قبل التقطيع، الأوكسجين (95٪ O 2/5٪ CO 2) وتهدئة حل تشريح (راجع الخطوة 1.4) إلى 0-2 درجة مئوية.
- ملء غرفة الإنعاش مخصصة مع ACSF القياسية في RT. تأكد من أن ACSF والاوكسيجين بشكل جيد (20 - 30 دقيقة، والوقت قد تختلف وفقا لحجم الغرفة) قبل وضع شرائح في غرفة الإنعاش. تأكد من أن فقاعات الغاز لا تأتي في يخدع المباشربراعة مع شرائح أو تعطيلها.
- خط علبة الجليد vibratome مع الثلج وملء مع الماء البارد حتى أن ثلث إلى نصف من غرفة التشريح والمغمورة. بعناية وضع نظام توصيل الأكسجين (مثل الغاز نشرها الحجر) والتحقيق في درجة الحرارة في غرفة التشريح حتى لا البند يتداخل مع حركة شفرة أو التلاعب شريحة.
- إعداد منطقة تشريح والأدوات اللازمة لاستخراج المخ وتشريح المنطقة الدماغ المطلوب.
ملاحظة: تشريح دقيق يقوم سيعتمد على منطقة محددة في الدماغ درس سيتطلب هياكل الدماغ المختلفة والتقطيع في طائرات مختلفة (على سبيل المثال، الاكليلية، السهمي، أو شرائح أفقية).- وضع الأدوات التالية على underpad: مقص قطع الرأس، مشرط، صغير مستقيم مقص طرف حادة، ملقط إقناء؛ إدخال القنية السفينة (أو أي أداة جراحية مع طرف واسعة، مثل رينجرز، الذي هو أكثر ملاءمة لجماجم الفئران)، ملقط مرقئ المنحني، TWeezers، ملعقة، ملعقة شفط، ورق الترشيح، طبق بتري، واحدة حافة شفرة الحلاقة، والغراء cyanoacrylate.
- عندما تصل درجة الحرارة 0-2 درجة مئوية، ونقل حل التقطيع إلى غرفة التشريح (صينية عازلة).
- تخدير الماوس في غرفة تجفيف باستخدام الأيزوفلورين. قد تختلف المبلغ المحدد وفقا لحجم الغرفة المستخدمة، ولكن لقفص صندوق أحذية صغير استخدام بضع قطرات (~ 3-4). ترك الماوس في القفص حتى متحرك المقدمة (لا يستجيب لمسية المحفزات، وحوالي 15 ثانية لظروف وصفها هنا). أداء الذيل وقرصة القدم الاختبارات لضمان تخدير الحيوان بعمق، ثم قطع رأس قبل توقف القلب النابض (يعزز بقاء الخلية).
ملاحظة: مع التبرير المناسب، بعض المختبرات الحصول على إذن لإجراء قطع الرؤوس الحية من أجل تقليل بقدر العمليات excitotoxic المواد الممكنة وتعزيز بقاء الخلية. - إجراء تشريح.
ملاحظة: يجب أن يكون الدماغاستخراج بسرعة (<45 ثانية).- باستخدام مشرط قطع الجلد السطحية على الجزء العلوي من الجمجمة من منقاري إلى الذيلية.
- قشر فروة الرأس على كل جانب من الرأس.
- باستخدام صغير مستقيم مقص طرف حاد، وقطع لوحة الجداريين على طول الدرز اللامي لإزالة المخيخ. إزالة العظم القذالي.
- باستخدام نفس مقص، وقطع الدرز السهمي.
- حرك ملقط إقناء؛ إدخال القنية السفينة (أو رينجرز إذا كسر في الجمجمة الفئران) أسفل كل العظام الجدارية وسحب لفضح الدماغ.
- باستخدام ملقط مرقئ المنحني، قرصة عظم جبهي لكسر لهم، ثم استخدام ملاقط أو ملقط إقناء؛ إدخال القنية سفينة لإزالة العظام المكسورة. قطع وإزالة جافية كما بلطف قدر الإمكان لأنها يمكن أن تتداخل مع تشريح.
- حرك الملعقة تحت الدماغ وسحب بلطف الدماغ من الجمجمة وضعه في غرفة التشريح (صينية عازلة) شغل سابقا مع ACSF الجليد الباردة. دع المختهدئة 1 - 2 دقيقة.
- إعداد منصة التشريح عن طريق ملء طبق بيتري مع الثلج وبعض الماء المثلج للسماح بمزيد من سطح الاتصال، وتغطي مع غطاء ووضع ورقة ترشيح على القمة. الرطب ورقة الترشيح مع ACSF الباردة.
- مرة واحدة يتم تبريد الدماغ أسفل، وضع الدماغ على طبق بيتري مملوءة الجليد، وبسرعة إجراء تشريح المناسب للحصول على طائرة المطلوب من تشريح.
- للحصول على شرائح سهمي تحتوي على النواة المتكئة (بريدا)، استخدم ميزة واحدة شفرة حلاقة لقطع وإزالة الدرنات حاسة الشم والمخيخ إذا كانت لا تزال موجودة. ثم، إجراء خفض السهمي من 2-3 ملم من الحدود الجانبية للنصف الأيمن للحصول على سطح مستو التي سيتم لصقها على عينة عقد لوحة (راجع الخطوة 2.8.11).
ملاحظة: قطع فقط 2-3 ملم من الحدود الجانبية للنصف الكرة سيسمح جمع شرائح تحتوي على بريدا من نصفي الكرة الأرضية. فإن تشريح المناسب يتوقففي منطقة الدماغ التي يتم التحقيق فيها. هنا، يتم إجراء تشريح الخلايا العصبية بريدا حتى يمكن تسجيلها في شرائح الدماغ السهمي. - بسرعة الغراء (باستخدام الغراء cyanoacrylate تطبيقها على لوحة عينة القابضة) على سطح قطع شقة من الدماغ على لوحة وفقا لطائرة المطلوب من تشريح. للحصول على شرائح الدماغ السهمي راجع الخطوة 2.8.10.
- المكان على الفور وتأمين عينة عقد لوحة في غرفة التشريح لذلك شرائح الدماغ rostro-caudally (للسلامة، وإنشاء حامل شفرة فقط عندما يتم تأمين لوحة عينة).
- تعيين vibratome مع المعلمات المناسبة تشريح (البارامترات المستخدمة في المختبر لvibratome المذكورة في المواد: سرعة 3-4، والاهتزاز 9-10، وشريحة سمك 250 ميكرون).
- على تشريح، واستخدام نقل ماصة بلاستيكية قلص لنقل شرائح الدماغ إلى غرفة الإنعاش (في RT) (راجع الخطوة 2.3). قد تختلف وقت التعافي تبعا لنوع الخلايا العصبية التي هي قيد الدراسة(عادة 30-90 دقيقة).
3. تسجيل بال micropipettes وإعداد تزوير
- الرجوع إلى مبادئ توجيهية محددة من دليل المستخدم مجتذب في الحصول على خصائص micropipette المطلوب.
ملاحظة: للحصول على MSNs، ونحن نستخدم مجموعة المقاومة ماصة من 3،2-4،0 MΩ. - الأوكسجين في ACSF وضبط تدفق إلى 2 مل / دقيقة. فراغ ACSF باستخدام مضخة أو فراغ تحوي خطوط المثبتة في المرفق.
- تشغيل وحدة تحكم سخان نضح وضبط إعدادات درجة الحرارة من أجل الحصول على درجة الحرارة المطلوبة (على سبيل المثال، 31،8-32،2 درجة مئوية).
ملاحظة: يعتمد استقرار درجة الحرارة على وجود كل مستوى ACSF المستمر وسرعة تدفق ثابتة في الغرفة. منذ العديد من الخصائص الفيزيائية الحيوية من الخلايا العصبية (على سبيل المثال، ومقاومة المدخلات، R ط، وتسمى أيضا مقاومة الغشاء، R م) هي حساسة للحرارة، والحفاظ على درجة حرارة ثابتة المهم. - تشغيل كمبيومكبر للصوت التي تسيطر عليها ثالثا، وكاميرا، micromanipulator، وضوء المجهر الخلفية. إذا كان أداء تجربة تتطلب التحفيز الكهربائي للأنسجة، بدوره على جهاز تحكم التحفيز وحدة العزلة.
ملاحظة: بعض مكبرات الصوت من المصنوعات الأخرى يوصي "الاحماء" قبل الاستخدام، لذلك ينصح للتشاور دليل لإجراءات التشغيل المحدد. - بدء التقاط الكاميرا، واكتساب إشارة والبرمجيات مكبر للصوت.
- شريحة التنسيب والتصور:
- استخدام البلاستيك قلص طرف ماصة نقل، رسم بلطف في شريحة الدماغ واحد من غرفة الإنعاش.
- وضع ماصة نقل في غرفة تسجيل والضغط بلطف شريحة من ماصة على ساترة بطانة الجزء السفلي من الغرفة.
ملاحظة: طالما لا تجاوز يحدث، فمن غير ضارة لديك بعض ACSF من غرفة الإنعاش يصب في الحمام. - استخدام ملقط لتغيير موقف شريحة الصورةس سيتم وضعها على المنطقة المرغوبة بالضبط في وسط غرفة تسجيل. استخدام المجهر طاقة منخفضة (4X) عدسة موضوعية والعدسة للحصول على المساعدة في تحديد المواقع.
- بعد أن تم تحقيق الموضع المطلوب، وتأمين موقف شريحة الدماغ مع شريحة عقد لأسفل (المعروف أيضا باسم "القيثارة") في الغرفة.
- التحول إلى الطاقة العالية (40X) عدسة موضوعية وخفض برفق حتى يتم تشكيل اتصال مع ACSF في الغرفة.
- استخدام عجلة الضبط الدقيق لجلب الأنسجة في التركيز. بينما في اتصال مع ACSF، لا تستخدم عجلة تعديل الخشنة على المجهر كما خفض عدسة الهدف بشكل مفرط يمكن سحق شريحة أو حتى كسر زلة غطاء بطانة الجزء السفلي من الغرفة، والتي يمكن أن تسبب ACSF لسفك على المكثف و الاضرار بها.
- عندما يكون التركيز على مستوى الأنسجة، ومراقبة الخلايا في المنطقة المستهدفة للشكل. الخلايا الميتة يمكن تمييزها بسهولة عن طريق غشاء البلازما الخاصة بهم تضخم والنواة (<قوي> الشكل 1E). يجب أن تظهر الخلايا السليمة كما مستديرة، بيضاوية، أو هياكل متجانسة بيضاوي الشكل (الشكل 1E).
- بحث عن الخلية المستهدفة. علامة على شاشة الكمبيوتر من أجل مساعدة في توجيه micropipette تسجيل. في حالة استخدام برنامج مثل QCapture، رسم مربع حول الخلية المستهدفة من خلال عقد الزر الأيسر للفأرة.
- رفع عدسة موضوعية لذلك سيكون هناك مساحة كافية في مخروط التي شكلتها عدسة الهدف يجري في اتصال مع ACSF لوضع ونقل micropipette تسجيل.
- Micropipette التنسيب وتحديد المواقع
- باستخدام حقنة 1 مل، إبرة محقنة مكروية غير المعدنية، ومرشح مخصص، وملء micropipette مع حل داخلي معدة مسبقا وفقا لتجربة المخطط لها (K + المستندة أو جيم + المستندة إلى حل داخلي، نرى خطوات 1.1، 1.2 ، والمواد اللازمة لتكوين). استخدام حل يكفي حتى الداخليةالحل يأتي في اتصال مع القطب الفضة الأسلاك المغلفة كلوريد داخل حامل micropipette.
ملاحظة: سلك كهربائي الفضة يمكن المكلورة عن طريق نقع في التبييض المنزلية. نيوكليوسيد ثلاثي الفوسفات (ATP وGTP) ويمكن أن يضاف إلى حل داخلي قبل استخدامها. الحفاظ على حقنة تحتوي على محلول على الجليد لمنع تدهور ATP / GTP. - تأكد من عدم وجود فقاعات الهواء في micropipette لأنها يمكن أن يخرج في حين أن micropipette في الأنسجة وتحجب شريحة.
- وضع micropipette في حامل الكهربائي حتى يأتي الحل في اتصال مع سلك كهربائي كلوريد الفضة المطلية.
- إحكام الغطاء ماصة بحيث غسالة مخروط ستشكل ختم حول micropipette.
- تطبيق الضغط الايجابي قبل غمر micropipette في ACSF لمنع الحطام من دخول ماصة.
- وضع headstage في وضع القفل (التي تواجه غرفة)، واستخدام micromanipulator، زuide عليه نحو الغرفة لذلك هو تقريبا تحت مركز الهدف مغمورة.
- أثناء نقل micropipette مع micromanipulator (وضعت في المتوسط إلى سرعة عالية)، واستخدام شاشة الكمبيوتر لتحديد موقع micropipette وتوجيهها نحو موقع الخلية على محور XY.
- قياس المقاومة micropipette من خلال تطبيق خطوة الجهد (على سبيل المثال، 4 بالسيارات لمدة 100 ميللي ثانية)، والتي يمكن إنجازها يدويا أو آليا عن طريق برامج معينة مثل وضع 'حمام' في حالة استخدام "غشاء اختبار" في برنامج Clampex (انظر أيضا الخطوة 4) . من أجل التأكد من عدم وجود فقاعات الهواء أو أي أجسام غريبة أخرى عرقلة micropipette، وتطبيق الضغط الايجابي باستخدام حقنة مليئة بالهواء (على سبيل المثال، 30 سم مكعب حقنة) متصلا حامل micropipette مع أنابيب البولي ايثيلين.
- بعد مسح micropipette، إجراء تعويض الجهد للحد من ماصة التيار إلى الصفر، والتي يمكن إنجازها يدويا أو عن طريق برامج معينة مثل & #39؛ ماصة تعويض "على قائد مكبر للصوت الكمبيوتر التي تسيطر عليها.
ملاحظة: وهذه وظيفة تعويض عن أي جهد الناجمة عن الاختلافات تركيز بين الحمام والحلول micropipette (أي السائل تقاطع احتمال 20).
- باستخدام حقنة 1 مل، إبرة محقنة مكروية غير المعدنية، ومرشح مخصص، وملء micropipette مع حل داخلي معدة مسبقا وفقا لتجربة المخطط لها (K + المستندة أو جيم + المستندة إلى حل داخلي، نرى خطوات 1.1، 1.2 ، والمواد اللازمة لتكوين). استخدام حل يكفي حتى الداخليةالحل يأتي في اتصال مع القطب الفضة الأسلاك المغلفة كلوريد داخل حامل micropipette.
4. غشاء اختبار
ملاحظة: هذه الخطوة تنطبق على مكبر للصوت المذكورة في المواد.
- عند استخدام مكبر للصوت قائد الكمبيوتر التي تسيطر عليها، ودائما وضعها على وضع الجهد المشبك لأداء اختبار الغشاء.
ملاحظة: عندما يتم تعيين اختبار الغشاء في وضع "باث"، واختبار غشاء يسمح للقياس المقاومة micropipette والمقاومة ختم عندما يتم تشكيل الختم. - بمجرد تمزق الغشاء (راجع الخطوة 5.8)، والتحول اختبار الغشاء إلى "خلية" واسطة بحيث سلسلة المقاومة (R ق) (وتسمى أيضا مقاومة الوصول، R أ)، R i و السعة غشاء (C ع) يمكنالحصول عليها.
5. نهج النهائي، ختم تشكيل، والحصول على تكوين خلية كاملة
- باستخدام عجلة التركيز غرامة، وبدء التركيز أسفل في حين خفض micropipette تدريجيا. نركز دائما يجلس اولا وبعد ذلك خفض micropipette وصولا الى الطائرة من التركيز. وسوف يضمن هذا غيض micropipette لن تخترق فجأة في شريحة.
- عندما يحين micropipette في اتصال مع سطح شريحة، وإبطاء سرعة micromanipulator لوضع متوسطة منخفضة.
- بلطف تطبيق الضغط الايجابي الخفيف مع حقنة مليئة بالهواء متصلة حامل ماصة لمسح أي حطام من مسار النهج.
- الاقتراب من الخلية إما عن طريق بالتناوب مع السيطرة على المقابض XYZ، أو تقترب بشكل مائل (إذا كان نموذج micromanipulator يسمح لها) حيث يتم تغيير كلا المحورين XZ مع دوران المقبض Z المحور. إن أسلوب الأخير منع ضغط الرأسي للأنسجة.
ملاحظة: هنا، والهدف هوالاقتراب من الخلية عن طريق إلحاق أضرار طفيفة لشريحة. عندما micropipette قريب بما فيه الكفاية إلى الخلية يظهر الدمل (أ التشويه جولة من سطح الخلية الناجمة عن الضغط الايجابي تطبيقها من خلال غيض من micropipette) (الشكل 2). - عند ظهور الدمل (الشكل 2-1)، وتطبيق شفط الضعيف وجيزة من خلال أنبوب متصل إلى أنبوب شفط حامل ماصة من أجل خلق ختم (الشكل 2-2). حافظ على مراقبة اختبار الغشاء.
ملاحظة: إذا تم تشكيل ختم الجزئي (<1 GΩ)، عن طريق الحقن التيارات السلبية عن طريق خفض عقد إمكانات (على قائد مكبر للصوت الكمبيوتر التي تسيطر عليها) يمكن أن تسهل تشكيل ختم والوصول gigaohms المقاومة ( "ختم gigaohm" أو "gigaseal"> 1 - 5 GΩ). المقاومة العالية للختم (> 1 GΩ) على حد سواء التلوث الحد من الضوضاء إلى الإشارات المسجلة وتسهم في تحقيق الاستقرار الميكانيكي للالتصحيح. - في حين أن gigaseal يتشكل، استخدم قائد مكبر للصوت الكمبيوتر التي تسيطر عليها لتحقيق إمكانية عقد الخلية في أقرب وقت ممكن لالفسيولوجيه يستريح المحتملة (V بقية) للحيلولة دون حدوث تغيرات مفاجئة بمجرد تمزق الغشاء. على سبيل المثال، MSNs وعادة ما تكون في -70 أو -80 بالسيارات (الفسيولوجية V بقية: -70 إلى -90 بالسيارات)، فرضت الجهد.
- بعد أن شكلت gigaseal، تعويض عن السعة السريعة والبطيئة يدويا أو تلقائيا. في حالة استخدام مكبر للصوت قائد الكمبيوتر التي تسيطر عليها مثل قائد Multiclamp، اضغط على 'السيارات' ل 'حزب المحافظين السريع "و" حزب المحافظين بطيئة ".
- إذا بقي ختم مستقر وأعلاه 1 GΩ (أو حقن أقل من 10-20 السلطة الفلسطينية لعقد الخلية في غشاء المحتملة المطلوب)، وتطبيق قصيرة وشفط قوي من خلال الأنبوب نفسه كما في 5.5 إلى تمزق غشاء البلازما (الشكل 2 -3).
ملاحظة: هذا قد يستغرق عدة محاكمات. ويتحقق تمزق غشاء جيد ثيتم تنفيذ الدجاجة شفط بقوة بما فيه الكفاية بحيث الغشاء تمزق لا تسد micropipette (والذي قد يؤدي إلى زيادة في R الصورة أثناء التسجيل)، ولكن ضعيفة بما فيه الكفاية لكي لا رسم في جزء كبير من الغشاء أو الخلية. - بعد تحقيق تكوين خلية كاملة بنجاح، ومراقبة بانتظام الموقع micropipette لتقييم وتصحيح الانحراف كبير لأنها قد تؤدي إلى فقدان التصحيح. قد تختلف الانجراف السعة وفقا لعدة عوامل، على سبيل المثال، ونوعية تركيب تلاعب والتجاذبات على headstage. من الناحية المثالية، ينبغي أن يكون الانجراف تكاد تكون منعدمة.
- عن طريق التحول إلى "خلية" واسطة في اختبار الغشاء، عرض معلمات مختلفة من الخلايا مثل R ط، R الصورة وC ص. رصد هذه المعلمات أثناء التسجيل.
ملاحظة: يمكن لجميع هذه المعايير تساعد في تقييم الوضع الصحي الأولي من الخلايا وأنواع الخلايا (راجع القسم "اختبار غشاء"، الخطوة 4). - مرة واحدة عشريتم الانتهاء من البريد الخطوات المذكورة أعلاه، يبقى في وضع الجهد المشبك لقياس التيارات (على سبيل المثال، EPSCs، IPSCs)، أو التبديل إلى وضع المشبك الحالي إذا التخطيط لقياس التغيرات في غشاء الجهد (على سبيل المثال، العمل المحتملين اطلاق النار). لهذا الأخير، وضخ تيار إما إيجابية أو سلبية لعقد الخلايا في الغشاء الجهد المطلوب (لتنفيذ هذه الخطوة تشير إلى مكبر للصوت دليل يدوي).
النتائج
درجة الحرارة، وأحد العوامل التي يتم التحكم بسهولة من قبل المجرب، يؤثر على الخصائص الفيزيائية الحيوية من القنوات الأيونية والمستقبلات، وبالتالي الموجي التيارات ما بعد المشبكية (شركات الأمن الخاصة) (EPSC وIPSCs) وقدرة الخلايا العصبية لانتزاع المسامير. الشكل 3 والشكل (4) إظهار تأثير درجة الحرارة على إطلاق الخلايا العصبية والمنحدر من EPSCs أثار (eEPSCs) على التوالي. نمط إطلاق النار (الشكل 3) (أي الكمون إلى ارتفاع 1 ش، مسمار عدد، والتردد، والعمل الموجي المحتملين) يتشكل من افتتاح توقيت ومنسق وإغلاق القنوات الأيونية محددة الجهد بوابات (الصوديوم، الكالسيوم 2 +، وK +)، وهي عملية حساسة لدرجة الحرارة. ويبين الشكل 3 كيف يزيد عدد سبايك متوسط درجة الحرارة. لاحظ أنه في ظروف تجريبية الموصوفة هنا (تسجيلات MSNs) على الرغم من ارتفاع frequeلا يبدو NCY أن يتغير في درجة حرارة subphysiological (28 ° C)، لأنه يزيد بشكل ملحوظ عندما تصل درجة الحرارة المستوى المناسب من الناحية الفسيولوجية (32 درجة مئوية). ويبين الشكل 4A مثال عن كيفية المنحدر من eEPSCs، معلمة الذي يستخدم عادة ل تقييم قوة متشابك، ويزيد مع ارتفاع درجة الحرارة.
على الرغم من R الصورة يمكن السيطرة عليها إلى حد ما من قبل المجرب، أي من خلال فتحة غشاء كفاءة عند الانتقال من دولة ختم لتكوين خلية كاملة، R ق عادة ببطء يزيد أثناء التسجيل. هذا يمكن أن يكون نتيجة للعديد من الأحداث لا يمكن السيطرة عليها، على سبيل المثال، غشاء إعادة إغلاق أو الحطام انسداد طرف ماصة أثناء التسجيل. محاولة لإعادة فتح الغشاء عن طريق تطبيق شفط طفيف، على الرغم من أنها قد تؤثر سلبا على التصحيح، ويمكن أن تساعد في بعض الأحيان الحفاظ على استقرار R الصورة. في جميع الحالات، وذلك لأن التغيرات R الصورة يمكن آلثالثا الموجي للإشارة الكهربائية قيد الدراسة، فإنه يجب أن تراقب بعناية، وبخاصة عند تسجيل الأمنية الخاصة (وضع الجهد المشبك). ويبين الشكل 4 أنه عندما R الصورة الزيادات (الشكل 4B)، اتساع الغلوتامات التيارات بوساطة مستقبلات (eEPSCs ) النقصان (الشكل 4C، D). عادة، المجربون تجاهل البيانات عندما تتجاوز التغييرات في R ق 15٪ (على سبيل المثال، هذا المختبر)، ولكن بعض المختبرات تفعل ذلك من تغيير 20٪. ينبغي الإشارة إلى هذا المعيار في القسم طريقة المقال.
لعصبون محددة، R ط يمكن أن تتأثر بعوامل عدة، بما في ذلك درجة الحرارة، وصحة الخلايا، ونوعية التصحيح. على وجه التحديد، عندما R ط النقصان، سعة PSC أو قدرة الخلايا العصبية لتوليد المسامير يقلل أيضا. على سبيل المثال، ويبين الشكل 4E أنه عندما R أنا لا تختلف كثيرا، التبقى عدد (ه) من المسامير مستقر نسبيا (الخلية العصبية 1)؛ وعندما R ط الزيادات، يزيد عدد المسامير وكذلك (الخلية العصبية 2). لذلك وعلى نحو مماثل لR ق، ص ط يجب أن تراقب بعناية، حيث 10٪ التغييرات كافية لبيانات التحيز.
كما هو موضح أعلاه، فمن الأهمية بمكان للسيطرة أو مراقبة درجة الحرارة، R الصورة، وR ط خلال التسجيلات. على سبيل المثال، لاحظ التغييرات في إشارة إلى أن قيد الدراسة (الأمنية الخاصة أو إطلاق النار) قد يكون نتيجة للتغيرات (أو عدم وجود رقابة) من هذه العوامل بدلا من تأثير التلاعب التجريبية، على سبيل المثال، ما قبل مقابل بعد آثار المخدرات تطبيق الحمام.

الشكل 1. حسب الطلب غرفة الإنعاش (AD)، وصورة من الدماغ شريحة في 400X عرض صحي والميت الخلايا العصبية (E). ميلادي)ووصف الإجراء لجعل غرفة الإنعاش المخصصة في الخطوة 2.1. E) صورة بريدا MSNs سطي قذيفة في شريحة الدماغ في 400X تظهر أمثلة من (الأسهم الحمراء الصحية) مقابل الخلايا العصبية الميتة (الأسهم الزرقاء). لاحظ أنه على الرغم من أن يشار إلى بعض الخلايا كما صحية، وجوانبها كروية تشير إلى أنها قد لا تكون صحية على النحو المرغوب فيه (السهام الحمراء مع العلامات النجمية). ويتم تقييم الحالة الصحية النهائي على أساس بقية الخامس وR ط بعد تحقيق تكوين خلية كاملة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2. مخطط تصور للخطوات الإجرائية بسيطة للحصول على Gigaseal وإنشاء تكوين خلية كاملة، وعندما micropipette قريب بما فيه الكفاية إلى thخلية الإلكترونية لخلق الدمل في غشاء البلازما (الخطوة 1، النهج)، وتطبيق شفط قصيرة ورقيقة إلى إنشاء جهة اتصال ضيق بين micropipette وغشاء البلازما. إذا أجريت بشكل صحيح، فإن الاتصال تعزيز وسيزيدها وتصل إلى 1 GΩ (gigaseal) أو أكثر (الخطوة 2، تشكيل ختم). وبمجرد أن الختم هو مستقر وأعلاه 1 GΩ، وتطبيق شفط قصيرة وقوية لتمزق غشاء البلازما (الخطوة 3، التكوين كامل الخلية). إن تحقيق تكوين خلية كاملة تسمح الاستمرارية بين السيتوبلازم والداخلية micropipette. لمزيد من التفاصيل، انظر بروتوكول خطوة 5،1-5،8. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
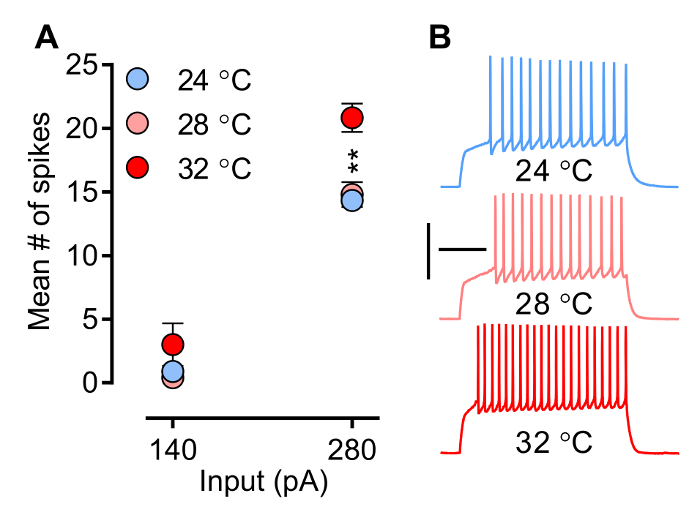
الشكل 3. يتم تقييم العصبية الفصل (الجوهرية استثارة) في الحالي، البطلينوس الوضع ص. هنا، يتم إعطاء سلسلة محددة مسبقا وتدريجية من الخطوات الحالية من أجل انتزاع التغيرات في غشاء الجهد، وبالتالي تؤدي إلى إمكانات العمل. يزيد أ) متوسط عدد ارتفاع درجة الحرارة. آثار B) عينة في 280 السلطة الفلسطينية من بريدا MSNs قذيفة وسطي في ثلاثة إعدادات درجة حرارة مختلفة (24 درجة مئوية، ن = 9؛ 28 درجة مئوية، ن = 5 و 32 درجة مئوية، ن = 6). درجة الحرارة في غرفة تسجيل يؤثر تأثيرا مباشرا على تردد ارتفاع. ومع ذلك، لاحظ أنه بالرغم من أن لا يبدو تردد سبايك أن يتغير في درجة حرارة subphysiological، لأنه يزيد بشكل ملحوظ عندما تصل درجة الحرارة 32 درجة مئوية، ودرجة حرارة ذات الصلة من الناحية الفسيولوجية. تقام الخلايا العصبية في -80 بالسيارات. في اتجاهين أنوفا: التفاعل، ف <0.0001. تأثير درجة الحرارة، ع = 0.0041. اللاحق الاختبارات: 24 ° C و 28 درجة مئوية على حد سواء مختلفة كثيرا عن 32 درجة مئوية، ** ف <0.01. يتم تمثيل البيانات كما يعني ± SEM. المعايرة: 200 ميللي ثانية، 50 فولت.jove.com/files/ftp_upload/54024/54024fig3large.jpg "الهدف =" _ فارغة "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الرقم 4. تأثير درجات الحرارة وR الصورة، وR ط على الموجي من الإشارة الكهربائية قيد الدراسة. أ) مثال من eEPSC السعة من واحد بريدا قذيفة MSN. زيادة درجة الحرارة 24-28 درجة مئوية وإلى 32 درجة مئوية يزيد من منحدر eEPSCs. لاحظ أن التغييرات التي يسببها درجة الحرارة في eEPSCs المنحدر تحدث بسرعة. هنا، يتم تقييم eEPSCs منحدر في وضع الجهد المشبك. المعايرة: 5 ميللي ثانية، و 100 دينار بحريني السلطة الفلسطينية) مثال eEPSCs المنحدر من واحدة بريدا قذيفة MSN. عندما يزيد R الصورة (B)، المنحدر من eEPSCs النقصان (C). د) تحليل الارتباط من eEPSC المنحدر بوصفها وظيفة من Rالصورة. بيرسون R = -0.5717، ف <0.0001. الخلايا العصبية هي مثال على آثار من اثنين من الخلايا العصبية التي تبين تأثير R ط على قدرة الخلايا العصبية لتوليد المسامير في -80 بالسيارات. E-فرضت الجهد). الخلايا العصبية هي الحالية، فرضت، وعقدت في -80 بالسيارات. المعايرة: 200 ميللي ثانية، 50 فولت الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يصف هذا البروتوكول الإجراء الأساسي لأداء خلية كاملة التجارب التصحيح، المشبك على الخلايا العصبية في الدماغ شرائح. ومع ذلك، فإن التعقيد، وإمكانات وحساسية هذه التقنية لا يمكن وصفها بشكل كامل في هذه المقالة. هنا، حاولنا لتحديد الخطوات الأساسية وتؤكد المعالم الهامة التي يجب أن تسيطر عليها لتحقيق تسجيلات خلية كاملة ناجحة وصارمة. لمزيد من التعلم النظري، وقد تم نشر العديد من الكتب والمقالات على كل خلية كاملة تسجيل التصحيح، المشبك في شرائح الدماغ 3،21-24 وعلى الأساليب التي يمكن صقل الحلول المستخدمة 25-27 من أجل تعزيز بقاء الخلية. من أجل أداء روتيني التسجيلات المناسبة، لا بد من تحسين المهارات الفنية من خلال التدريب المكثف. ساعات على الرغم من ذلك، مع التطبيق السليم للخطوات المذكورة، خلايا يمكن مصححة بعد الوفاة، وتوفير المعلومات الهامة حول التغييرات في وظائف متشابك وexcitabi جوهريعنه lity.
بشكل عام، بالإضافة إلى أهمية إعداد بعناية على حد سواء ACSF وmicropipette الداخلي الحلول، كل خطوة من تشريح الدماغ، تشريح، وتحقيق النجاح تكوين خلية كاملة، والحصول على بيانات دقيقة وغير متحيزة يتطلب ممارسة مكثفة. في المقام الأول، فمن الأهمية بمكان لتوليد شرائح الدماغ السليمة. لفترة وجيزة، تشريح السريع للدماغ (مثالي <45 ثانية)، والحفاظ على درجة حرارة منخفضة (0-2 درجة مئوية) تقطيع الوقت، والحلول تشريح المناسبة كلها تلعب دورا هاما في ضمان صحة الخلية. ومن الجدير بالذكر الإشارة إلى أن حلول تشريح قد تختلف بين المختبرات وفقا لنوع من الخلايا و / أو منطقة الدماغ التي سيتم التحقيق فيها. عندما تشريح بريدا أو الظهرية المخطط، مختبرنا وغيرها من استخدام حمض kynurenic من أجل حل تشريح للحد من عمليات excitotoxic المواد 28-33، ومع ذلك، أساليب أخرى يمكن أن تستخدم أيضا، مثل الحلول المستندة إلى السكروز 34، وارتفاع المغنيسيوم 2+ / منخفضة الكالسيوم 2+ حلول 35، الخ. هذه هي بعض الأمثلة فقط، ويمكن تعديلها وفقا لحساسية الدماغ أو المخ المنطقة لعمليات excitotoxic المواد (على سبيل المثال، نظرا لكبر سنه). للحصول على مزيد من المعلومات حول الحلول وبقاء الخلية، يرجى الاطلاع 25-27. في نهاية المطاف، وتركيز الأيونات والكاتيونات، وغيرها من المخدرات (على سبيل المثال، أسكوربات، مضادات مستقبلات الغلوتامات) التي تشكل حلول تشريح يتم تحديد بحيث يحاكي السائل النخاعي ويقلل بقدر العمليات excitotoxic المواد الممكنة التي تحدث تشريح خلال. يصف بروتوكول المعروضة في هذه المقالة الحلول القياسية التي استخدمت بشكل روتيني في الدراسات السابقة المؤلفين 28-31 عند التسجيل من MSNs في حلف شمال الأطلسي أو المخطط الظهري في شرائح الدماغ. وعلاوة على ذلك، والتكيف السليم للالأسمولية لكلا حلول ACSF وmicropipette الداخلي حاسمة لتشكيل ختم ناجحة وصيانة أسيوط خلية كاملةiguration. لإنشاء التدرج تركيز من حل خارج الخلية إلى حل داخل ماصة، وينبغي أن يكون ACSF الأسمولية أعلى من الحلول micropipette الداخلية. من الناحية المثالية، يمكن أن الفرق تتراوح 10-30 الميلي أسمول.
تحقيق تكوين خلية كاملة الناجح هو خطوة هامة أخرى لإجراء التسجيلات فعالة. أولا، ماصة السعة يمكن تعديلها مرة واحدة يتم وضع ماصة في الحمام. على الرغم من أن عادة يتم تعيين الإعدادات التلقائية بشكل صحيح، فإنه من المستحسن استخدام تعديلات سريعة وبطيئة من السعة خلية بحذر وهذه يمكن أن يؤدي إلى تلف الخلايا عندما يتم تنفيذ بشكل مناسب. ثانيا، موجز غشاء شفط ما هو ضروري للتمزق والغشاء تؤدي إلى الانفتاح بصورة كبيرة من الغشاء، وبالتالي تسمح التواصل الجيد بين داخل وداخل الوسط micropipette. وسوف يضمن هذا R الصورة ستظل مستقرة نسبيا طوال تسجيل. في حالة استخدام الحل micropipette مقرها جيم،ينبغي تقييم إمكانات غشاء يستريح فور إنشاء تكوين خلية كاملة (راجع الخطوة 5.8). في الواقع، ونشر جيم + داخل الخلية يسبب فقدان غشاء المحتملة يستريح. لتحديد إمكانية الراحة المناسبة، وإمكانية تقاطع السائلة يجب تقييم 20. ومع ذلك، المجرب قد تقرير إمكانات يستريح الذي لوحظ بعد كسر الغشاء (بعد الخطوة 5.8) واختيار عدم ضبط لإمكانية تقاطع السائلة. في جميع الحالات، يجب أن يكون الذكر في القسم طريقة المقال. على إنشاء تكوين خلية كاملة، ويمكن أيضا الحصول C ص، ويمكن استخدامها كمعلمة غير المباشرة لتقييم صحة الخلية و / أو نوع من الخلايا. ثالثا، عندما بدأت التسجيلات، غيرها من المعالم يجب أن تراقب بدقة. العوامل الحاسمة التي يجب أن تسيطر عليها عند تقييم استثارة الخلايا العصبية هي درجة الحرارة، R الصورة، وR ط.
مثلالمذكورة أعلاه، R i و C ص يمكن أن يكون مؤشرا على صحة الخلية و / أو نوع من الخلايا. على سبيل المثال، غشاء البلازما، التي تعمل بمثابة عازل، يفصل تهمة (الناتجة عن تركيبة مختلفة من داخل وخارج الخلية الحلول)، والتي تشكل معا السعة الغشاء. أكبر سطح الغشاء (العصبية محددة)، وارتفاع السعة. ومن ثم ليس من المستغرب أن محددة أنواع الخلايا العصبية المعرض C p و R ط (المتعلقة رياضيا لC ع) التي تقع ضمن نفس النطاق. R الصورة غير ذي صلة مباشرة إلى حجم رأس ماصة، وبالتالي فهو عادة مؤشرا على نوعية أو حجم فتحة غشاء. لفترة وجيزة، على إنشاء تكوين خلية كاملة، السيتوبلازم يصبح المستمر كهربائيا مع الحل في micropipette ومعزولة تماما عن الوسط الخارجي. R الصورة (أو آر) تنبع من المقاومة للCURRENر بالتدفق من ماصة إلى السيتوبلازم. بالنسبة لبعض ظروف التسجيل (على سبيل المثال، وضع المشبك الحالي أو تسجيل الجهد المشبك التيارات أيون الجهد بوابات)، ويجب تعويض R الصورة بشكل صحيح (الرجوع إلى المرجع 3،21-24 أو يدوي مكبر للصوت دليل على التعويض المناسب R الصورة) .
كما هو موضح في الشكل (4)، R الصورة مهم بشكل خاص لأنها يمكن أن تؤثر بشكل كبير على الموجي إشارة الكهربائية، على سبيل المثال، EPSC السعة. ومع ذلك، يجب أن تراقب R الصورة بعناية لتفسيرات خارج الخط من أي آثار لوحظ. في حال لم يتمزق الغشاء بشكل صحيح، micropipette غيض انسداد أو إعادة الإغلاق من الغشاء قد تحدث، والذي يزيد من حالة R الصورة والتحيز الموجي للإشارة الكهربائية قيد الدراسة (الشكل 4B-D). وباختصار، يمكن أن تصادف مشاكل عديدة أثناء التسجيل، وهذه تقع عادة تحت ثلاث فئات: أ) الأنسجة المتصلة بها، على سبيل المثال، زيادة معدل الوفيات الخلية بسبب سوء التشريح، والاختلال في الأسمولية ACSF، ونقص الأكسجين. ب) المتعلقة بالمعدات، على سبيل المثال، والضوضاء وأسس مشاكل، التحكم في درجة الحرارة، وشريحة وmicropipette تحديد المواقع، وغيرها؛ والثالث) تفسير البيانات، على سبيل المثال، لاحظ التغييرات يمكن أن يكون نتيجة من التحف التجريبية غير مرغوب فيها يتحامل البيانات مثل التغييرات في معلمات تغيير الموجي الكهربائية (R ط، R الصورة، ودرجة الحرارة، انظر الشكل 3 و 4) وليس نتيجة التجريبية التلاعب.
وعلى الرغم من تسجيل كامل الخلية في شرائح الدماغ هي تقنية قوية لتقييم تعتمد على خبرة اللدونة، وهذا النهج يحد من تفسير البيانات. على وجه الخصوص، ثلاثة قيود هامة من تقنيات التسجيل خلية كاملة هي: (أ) التغيرات في وظيفة والتعبير مستويات بروتينات معينة (على سبيل المثال، القنوات الأيونية) لا يمكن تمييزها. (ب) لأن هذاتقنية بتقييم تدفق التيار من خلال الغشاء كله (أو جزء كبير)، فإنه لا يوفر دقة التعريب شبه الخلوية التيارات الأيونية أو التغيرات التي لوحظت. و (ج) الغازية من تكوين خلية كاملة يؤدي إلى غسيل الكلى لمحتوى الخلية، وبالتالي تعطل الآلات الجزيئية الخلايا ضرورية لبعض الظواهر لتطوير أو الإفصاح عن هذه الفكرة. طريقة واحدة لتجنب غسيل الكلى هو استخدام التسجيلات القطب حادة أو تقنية التصحيح مثقبة 3،21،23. وفيما يتعلق الأخيرة، تشكيل مسام جزيئات المضادات الحيوية مثل النيستاتين يمكن أن تضاف إلى الحل ماصة. سوف تكون هذه المسام تسمح للتسجيل التيارات دون تعطيل آليات رسول الثانية داخل الخلية. ومع ذلك، التطورات الأخيرة في تكنولوجيا النانو وتطوير nanoelectrodes 36 توفر أدوات قوية لتحسين التسجيلات العصبية. هذا التقدم التكنولوجي في علم الأعصاب لا تزال قيد التنر ويضعون الآن في متناول أيدينا إمكانية لإجراء التصحيح، المشبك والخلايا التسجيلات مع الحد الأدنى من الغزو، أي الحفاظ على الوسط بين الخلايا سليمة، وتحقق وظائف القنوات الأيونية داخل مقصورات شبه الخلوية التي كانت حتى الآن لا يمكن الوصول إليها مع الكلاسيكية أقطاب التصحيح، المشبك 37.
Disclosures
لا شيء المؤلفين مصالح متناقضة أو المصالح المتضاربة.
Acknowledgements
وأيد هذا البحث من قبل صناديق بدء التشغيل UT جنوب غربي (SK).
Materials
| Name | Company | Catalog Number | Comments |
| Isolated pulse stimulus generator | A.M.P.I | Master-8 | |
| Isolation unit (ISO-Flex) | A.M.P.I | ISO-Flex | |
| Computer controlled Amplifier | Molecular Devices | Multiclamp 700B | |
| Digital Acquisition system | Molecular Devices | Digidata 1500 | |
| Microscope | Olympus | BX-51 | |
| Micromanipulator | Sutter Instruments | MPC-200 | |
| Chamber and in-line Heater | Warner Instruments | TC-344B | |
| Vibratome Slicer | Leica | VT1000 S | |
| Micropipette Puller | Narishige | PC-10 | |
| Imaging Camera | Q Imaging | QIClick-F-M-12 | |
| Narishige pipette puller PC-10 | Narishige | PC-10 | |
| Glass capillaries | WPI | TW150F-3 | |
| Slice hold-down (harp) | Warner Instruments | 64-0255 | |
| Slice Chamber | Warner Instruments | RC-26 | |
| Nonmetallic syringe needle | World Precision Instruments | MF28G67-5 | |
| Syringe filters | Nalgene | 176-0045 | |
| Glue Gun | Home Depot | various | |
| Gas dispersion tube | Ace Glass Inc. | various | |
| Decapitation scissors | Home Depot | 100649198 | |
| Scalpel Handle #3 | World Precision Instruments | 500236 | |
| Small straight sharp tips scissors | World Precision Instruments | 14218 | |
| Vessel canulation forceps | World Precision Instruments | 500453 | |
| Curved hemostatic forceps | World Precision Instruments | 501288 | |
| Economy Tweezers #3 | World Precision Instruments | 501976-6 | |
| Spatula | Fisher Scientific | 14357Q | |
| Scooping spatula | Fisher Scientific | 14-357Q | |
| Petri dish | Fisher Scientific | 08-747B | |
| Filter paper | Lab Depot | CFP1-110 | |
| Solutions | |||
| Cs-Gluconate internal solution (pH 7.2–7.3, 280–290 mOsm) | |||
| D-gluconic acid 50% | Sigma Aldrich/various | G1951 | |
| Cesium-OH (CsOH) 50% | Sigma Aldrich/various | 232041 | |
| NaCl, 2.8 mM | Sigma Aldrich/various | S7653 | |
| HEPES, 20 mM | Sigma Aldrich/various | H3375 | |
| EGTA, 0.4 mM | Sigma Aldrich/various | E4378 | |
| tetraethylammonium-Cl, 5 mM | Sigma Aldrich/various | T2265 | |
| Na2GTP, 0.3 mM | Sigma Aldrich/various | G8877 | |
| MgATP, 2 mM | Sigma Aldrich/various | A9187 | |
| K-Gluconate internal solution (pH 7.2–7.3, 280–290 mOsm) | |||
| K D-gluconate, 120 mM | Sigma Aldrich/various | G4500 | |
| KCl, 20 mM | Sigma Aldrich/various | P3911 | |
| HEPES, 10 mM | Sigma Aldrich/various | H3375 | |
| EGTA, 0.2 mM | Sigma Aldrich/various | E4378 | |
| MgCl2 | Sigma Aldrich/various | M8266 | |
| Na2GTP, 0.3 mM | Sigma Aldrich/various | G8877 | |
| MgATP, 2 mM | Sigma Aldrich/various | A9187 | |
| Standard artificial cerebrospinal fluid (ACSF, osmolarity ≈ 300-310 mOsm) | |||
| KCl, 2.5 mM | Sigma Aldrich/various | P3911 | |
| NaCl, 119 mM | Sigma Aldrich/various | S7653 | |
| NaH2PO4•H2O, 1 mM | Sigma Aldrich/various | S9638 | |
| NaHCO3, 26.2 mM | Sigma Aldrich/various | S8875 | |
| Glucose, 11 mM | Sigma Aldrich/various | G8270 | |
| MgSO4-7H2O, 1.3 mM | Sigma Aldrich/various | 230391 | |
| CaCl2-2H2O, 2.5 mM | Sigma Aldrich/various | C3881 | |
| Additional compounds used for solutions preparation | |||
| KOH | various | ||
| Kynurenic acid | Sigma Aldrich/various | K3375 | |
References
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibres. Nature. 260 (5554), 799-802 (1976).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annu Rev Physiol. 46, 455-472 (1984).
- Cahalan, M., Neher, E. Patch clamp techniques: an overview. Methods Enzymol. 207, 3-14 (1992).
- Staley, K. J., Otis, T. S., Mody, I. Membrane properties of dentate gyrus granule cells: comparison of sharp microelectrode and whole-cell recordings. J Neurophysiol. 67 (5), 1346-1358 (1992).
- Horn, R., Marty, A. Muscarinic activation of ionic currents measured by a new whole-cell recording method. J Gen Physiol. 92 (2), 145-159 (1988).
- Pusch, M., Neher, E. Rates of diffusional exchange between small cells and a measuring patch pipette. Pflugers Arch. 411 (2), 204-211 (1988).
- Kandel, E. R., Dudai, Y., Mayford, M. R. The molecular and systems biology of memory. Cell. 157 (1), 163-186 (2014).
- Kourrich, S., Bonci, A. Chapter 5: Synaptic and Neural plasticity. Neurobiology of Mental Illness. 4th edn. , (2013).
- Mozzachiodi, R., Byrne, J. H. More than synaptic plasticity: role of nonsynaptic plasticity in learning and memory. Trends Neurosci. 33 (1), 17-26 (2010).
- Zhang, W., Linden, D. J. The other side of the engram: experience-driven changes in neuronal intrinsic excitability. Nat Rev Neurosci. 4 (11), 885-900 (2003).
- Kourrich, S., Calu, D. J., Bonci, A. Intrinsic plasticity: an emerging player in addiction. Nat Rev Neurosci. 16 (3), 173-184 (2015).
- Luscher, C., Malenka, R. C. Drug-evoked synaptic plasticity in addiction: from molecular changes to circuit remodeling. Neuron. 69 (4), 650-663 (2011).
- McEwen, B. S., Morrison, J. H. The brain on stress: vulnerability and plasticity of the prefrontal cortex over the life course. Neuron. 79 (1), 16-29 (2013).
- Sandi, C., Haller, J. Stress and the social brain: behavioural effects and neurobiological mechanisms. Nat Rev Neurosci. 16 (5), 290-304 (2015).
- Kim, S. J., Linden, D. J. Ubiquitous plasticity and memory storage. Neuron. 56 (4), 582-592 (2007).
- Ganguly, K., Poo, M. M. Activity-dependent neural plasticity from bench to bedside. Neuron. 80 (3), 729-741 (2013).
- Kullmann, D. M., Moreau, A. W., Bakiri, Y., Nicholson, E. Plasticity of inhibition. Neuron. 75 (6), 951-962 (2012).
- Bar-Yehuda, D., Korngreen, A. Space-clamp problems when voltage clamping neurons expressing voltage-gated conductances. J Neurophysiol. 99 (3), 1127-1136 (2008).
- Williams, S. R., Mitchell, S. J. Direct measurement of somatic voltage clamp errors in central neurons. Nat Neurosci. 11 (7), 790-798 (2008).
- Neher, E. Correction for liquid junction potentials in patch clamp experiments. Methods Enzymol. 207, 123-131 (1992).
- Defelice, L. J. . Electrical Properties of Cells-Patch Clamp for Biologists. , (1997).
- Kornreich, B. G. The patch clamp technique: principles and technical considerations. J Vet Cardiol. 9 (1), 25-37 (2007).
- Molleman, A. . Patch Clamping: An Introductory Guide To Patch Clamp Electrophysiology. , (2003).
- Neher, E., Sakmann, B. The patch clamp technique. Sci Am. 266 (3), 44-51 (1992).
- Richerson, G. B., Messer, C. Effect of composition of experimental solutions on neuronal survival during rat brain slicing. Exp Neurol. 131 (1), 133-143 (1995).
- Tanaka, Y., Tanaka, Y., Furuta, T., Yanagawa, Y., Kaneko, T. The effects of cutting solutions on the viability of GABAergic interneurons in cerebral cortical slices of adult mice. J Neurosci Methods. 171 (1), 118-125 (2008).
- Ye, J. H., Zhang, J., Xiao, C., Kong, J. Q. Patch-clamp studies in the CNS illustrate a simple new method for obtaining viable neurons in rat brain slices: glycerol replacement of NaCl protects CNS neurons. J Neurosci Methods. 158 (2), 251-259 (2006).
- Kourrich, S., et al. Dynamic interaction between sigma-1 receptor and Kv1.2 shapes neuronal and behavioral responses to cocaine. Cell. 152 (1-2), 236-247 (2013).
- Kourrich, S., Klug, J. R., Mayford, M., Thomas, M. J. AMPAR-Independent Effect of Striatal aCaMKII Promotes the Sensitization of Cocaine Reward. J Neurosci. , (2012).
- Kourrich, S., Rothwell, P. E., Klug, J. R., Thomas, M. J. Cocaine experience controls bidirectional synaptic plasticity in the nucleus accumbens. J Neurosci. 27 (30), 7921-7928 (2007).
- Kourrich, S., Thomas, M. J. Similar neurons, opposite adaptations: psychostimulant experience differentially alters firing properties in accumbens core versus shell. J Neurosci. 29 (39), 12275-12283 (2009).
- Rothwell, P. E., Kourrich, S., Thomas, M. J. Environmental novelty causes stress-like adaptations at nucleus accumbens synapses: implications for studying addiction-related plasticity. Neuropharmacology. 61 (7), 1152-1159 (2011).
- Rothwell, P. E., Kourrich, S., Thomas, M. J. Synaptic adaptations in the nucleus accumbens caused by experiences linked to relapse. Biol Psychiatry. 69 (11), 1124-1126 (2011).
- Koya, E., et al. Silent synapses in selectively activated nucleus accumbens neurons following cocaine sensitization. Nat Neurosci. 15 (11), 1556-1562 (2012).
- Conrad, K. L., et al. Formation of accumbens GluR2-lacking AMPA receptors mediates incubation of cocaine craving. Nature. 454 (7200), 118-121 (2008).
- Kruskal, P. B., Jiang, Z., Gao, T., Lieber, C. M. Beyond the patch clamp: nanotechnologies for intracellular recording. Neuron. 86 (1), 21-24 (2015).
- Novak, P., et al. Nanoscale-targeted patch-clamp recordings of functional presynaptic ion channels. Neuron. 79 (6), 1067-1077 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved