Method Article
在脑片全细胞膜片钳记录
摘要
这个协议描述用于执行全细胞膜片钳记录基本程序步骤。这种技术允许神经元的电行为的研究,并在大脑切片进行时,允许的各种神经元功能从仍在集成在相对保存良好脑电路的神经元的评估。
摘要
全细胞膜片钳记录是一种电生理技术,可以在神经元的主要部分的电特性的研究。在该构造中,微管是在与细胞膜,从而防止电流的泄漏,从而提供了更精确的离子电流测量,比以前使用的细胞内急剧电极记录方法紧密接触。经典地,全细胞记录,可对神经元在不同类型的制剂,包括细胞培养模型,解离的神经元,在脑切片的神经元进行的,并在完整的麻醉或清醒动物。总之,这项技术已经极大地促进了兴奋细胞的被动和主动生物物理性质的理解。这种技术的主要优点是,它提供了有关如何具体操作( 例如 ,药理学,实验者诱发塑性)可以改变特定神经元功能或channels实时。此外,质膜显著开口允许内部吸管溶液自由地扩散到细胞质中,提供装置用于将药物, 例如激动剂或特定的细胞内蛋白质的拮抗剂,并且在不改变在相邻小区中其功能操作这些目标。本文将着重于全细胞记录在大脑切片进行神经元,即在相对 保存完好的大脑回路, 即记录的神经元,在生理相关环境的优点做准备。特别是,当与适当的药理学结合,这种技术是一种强大的工具,允许发生以下的任何类型的经验,例如学习,暴露于滥用的药物,和应力具体neuroadaptations鉴定。总之,在脑切片全细胞膜片钳记录提供装置在体外制备持久的变化来测量在神经元功能,在完整的清醒动物已经制定。
引言
该膜片钳技术,已在70年代末1,2已经开发了一种技术,电,是在活组织研究单个或多个离子通道功能的主要工具。在可以实现不同的贴片的配置,全细胞膜片钳记录允许神经元的主要部分的电行为的研究。传统上,这种技术进行体外或脑切片,新鲜分离的神经元,或者在细胞培养模型3。当在脑切片的神经元进行的,该技术存在几个优点。特别是:(ⅰ)的神经元被记录在相对 保存脑电路,其在一定程度上,并与细胞培养物制剂,提供即生理有关3的环境。这使得早期捕捉,甚至实时监测,即通过任何类型的急性pharmacolog触发细胞和分子事件的iCal操作-不能用在体内条件古典来实现时间分辨率; (二)功能,以视觉识别的脑切片脑区允许高特异性的区域时,3他们表达荧光标记物都为大脑区域的研究和针对特定神经元; (三)进入细胞的细胞内空间通过打开质膜的显著部分(对比与细胞内记录一个尖锐微量刺穿膜)4。反过来,这使得构成内部溶液特定离子的含量或浓度来进行修改,以便分子靶点或细胞机制可以在不同条件下进行研究。例如,在建立全细胞结构,任何具体的药理活性剂( 例如 ,拮抗剂),人们可以添加到记录微量(膜片吸管)溶液将直接扩散进入细胞质和其putat作用香港专业教育学院细胞内靶没有在相邻小区中改变目标函数。此外,相对于尖锐微量记录,在膜片钳电极的前端的大的开口提供较低的电阻,较少的竞争噪音,并且因此更好的电接入单元4的内部。然而,请注意,在枪头的大开口可能会导致细胞透析和由此细胞内分子机械可能对的是所研究5,6-生物学现象的表达临界的损失。在这种情况下,锋利的电极录音可能更适合。这种类型的记录的需要与细孔比那些用于全细胞记录,从而防止了大多数的细胞内空间和所述内部电极内液之间的离子交换的小得多微量。
任何形式的经验(急性或慢性),包括学习7-10,避免滥用11,1药物2,应力13,14 等 ,可以改变在特定脑区域的神经元功能的各个方面。因为这些改变通常需要时间来制定(数小时至数天),在大脑切片全细胞记录从动物已经历特定体验允许研究人员确定这些变化。基本上,许多(如果不是全部)参与神经元功能( 例如 ,配体活化的离子通道,电压门控离子通道,神经递质转运蛋白),由此脑电路的活动和行为,可以通过经验来改变(经验依赖性部件可塑性)10,15-17。在神经元水平,大脑回路活动从内在细胞的兴奋性因素( 如 axosomato枝晶离子通道突触之间的不断互动( 如谷氨酸传输),并出现了:;钾,K +,钠,钠离子和钙离子,钙离子 )。在使用whol具体条件电子细胞膜片钳电生理技术,从突触与固有的兴奋性的变化特别始发信号变化可被分离。
在大多数情况下,突触兴奋是使用全细胞电压钳技术进行评估。该记录模式允许离子电流[ 例如 ,由α-氨基-3-羟基-5-甲基-4-异唑酸受体介导的测定( AMPA受体)和N-甲基-D-天冬氨酸受体(NMDA受体)通过神经元质膜而保持在一设定的电压的膜电位。在这里,实验者使用含有铯的微量内部解决方案(CS +),K +通道的广泛阻滞剂(关键的内在因素兴奋)。一旦建立全细胞构型的, 对 Cs +的细胞内空间中的扩散将阻止K +通道,从而将允许一个相对有效的空间钳和预发泄对其他测量内在的兴奋性因素的影响。太空钳问题, 即难以电压钳全细胞膜,引起记录不规则形状的细胞( 如神经元),并具有广阔而复杂的树突18,19特别的神经元时。因为体细胞电压钳很差控制在神经元的树突树电压,正在研究树突电信号的各个方面会扭曲,树枝状距离依赖性的方式。用溶解在细胞外溶液中的药理学工具,如印防己毒素(γ-氨基丁酸A受体拮抗剂)或犬尿烯酸(谷氨酸受体的宽阻断剂)(人工脑脊髓液,ACSF)相结合,这种技术允许谷氨酸的测定受体分别GABA A R介导的电流。
相比之下,固有兴奋性通常评估在电流钳记录模式。相对于电压钳记录,这种记录模式允许在由流经神经元质膜中的离子电流的诱导的膜电位变化的测量。通常情况下,改变在固有兴奋性是通过在能力改变评估神经元来产生动作电位,既要有Na +和K +通道。因此,执行电流钳记录时,微量填充有包含K +,而不是对 Cs +的内部溶液。与阻止谷氨酸和GABA溶解在学联A受体介导的电流药剂相结合,实验设计允许的内在因素( 如 K +通道),神经元放电的贡献测量没有通过突触兴奋性的潜在变化被污染因素。
本文将介绍基本的必要程序ŤO(i)拟定健康的大脑切片; (ⅱ)实现全细胞结构,和(iii)监测基本参数来评估突触和固有的兴奋性。
研究方案
所有实验均按照由UT西南机构动物护理和使用委员会批准的方案进行,并且被选择,以最小化应力,不适,疼痛由实验动物经历。
1.解决方案
注:事先准备好微管内部的解决方案。对于最基本的实验目的,两种解决方案应该足够了:CS +的和K +的解决方案。
- 使用铯+的解决方案( 例如 ,铯+葡萄糖液,见材料 ),电压钳实验。准备在室温。
- 通过用3.54克的CsOH(〜2.01毫升)混合4.62克-D-葡糖酸(〜3.696毫升)制备117毫铯葡萄糖溶液。
- 添加DDH 2 O的90 ml和让它平衡30分钟。
- 添加固体成分(20毫米的HEPES =0.476克; 0.4毫EGTA = 15.2毫克; 2.8毫摩尔NaCl = 16.4毫克; 5毫四乙铵(TEA)氯化物= 83毫克)。
- 添加的DDH 2 O到〜97毫升。
- 调整为50%的CsOH溶液的pH至7.2 - 7.3。
- 检查渗透压和纠正,如果需要用的DDH 2 O.
注:一个良好的范围是280〜 - 285毫渗量。最佳渗透压应为15 - ( - 310毫渗量,300毫渗量在我们的实验室通常为300)标准学联的渗透压20毫渗量以下。摩尔渗透压浓度可以根据方案具体组合物而变化。 - 等分至1000微升并贮存在-20℃或更低。
- 准备,等分,冷冻,并添加ATP / GTP上记录的那天的内部溶液。
- 添加64.63毫克ATP至10毫克GTP和637.11微升的DDH 2 O的溶解
- 在-20℃或以下制备10微升等份和存储。混合每100×等分试样与1000微升在实验当天内部溶液。一旦ATP / GTP加到内部溶液,保持在冰上,以防止ATP / GTP degradati上。
- 使用K +基于解决方案( 例如 ,K-葡萄糖溶液,参见材料 )为电流,电压钳实验其中K +电导保持功能,使神经元放电可以评估。准备在室温。
- 根据所需的最终体积称量的所有材料。对于准备加入90ml溶液中,120毫米K-葡萄糖= 2.82克; 20毫米氯化钾=0.149克; 10毫米的HEPES =0.238克; 0.2毫米EGTA = 0.008克; 2毫米氯化镁2 = 0.021 克
- 使用足够的DDH 2 O的达到90%,最终的解决方案体积。这应确保足够的空间留给pH值和渗透压调节。
- 加入所有的成分混合后,确保该解决方案是测量pH之前清楚。
- 使用K +氧化钾(KOH)7.3 -同时不断搅拌该溶液,调节pH至7.2。
- pH调整后,使用渗压计和广告只是渗透压280 - 285毫渗量。
注:最佳渗透压应为15 - 标准学联的渗透压低于20毫渗量(通常为300 - 310毫渗量,在我们的实验室300毫渗量)。摩尔渗透压浓度可以根据方案具体组合物而变化。 - 等分至1000微升并贮存在-20℃或更低。
- 准备,等分,冻结,并添加ATP / GTP对记录当天的内部解决方案(见步骤1.1.8)。
- 准备1 L的标准学联(见材料 )。
注:记录在大脑切片中型多棘神经元(的MSN)时,我们使用这个配方在我们的实验室,但是,配方可能实验室之间的差异,因此,我们建议实验者使用记录感兴趣的大脑区域时所经常使用的食谱。 - 制备解剖ACSF(切片溶液,〜125毫升注意:精确量将取决于切片室的尺寸,因为它应该充分浸没脑)在使用中步骤2.2 - 2.8。
- 制备5mM的犬尿烯酸(阻断谷氨酸受体诱导的兴奋性中毒过程)在标准ACSF在足够体积切片期间淹没大脑。使用超声波仪,以帮助溶解犬尿酸。
注意:超声处理的长度可以根据在溶液固体的体积和量而变化。 ( - 在我们的条件下2分钟左右1)的解决方案必须通过该过程的结束是清楚的。 - 冷却,同时用95% 的 O 2,5% 的 CO 2气体在冰一桶鼓泡直至温度达到0 - 2℃。
- 制备5mM的犬尿烯酸(阻断谷氨酸受体诱导的兴奋性中毒过程)在标准ACSF在足够体积切片期间淹没大脑。使用超声波仪,以帮助溶解犬尿酸。
- 准备学联进行录制。
- 取1 L的标准学联(或从步骤1.3准备的解决方案,无论左)到可能根据实验计划中加入适当的药物制剂。
- 例如,记录兴奋性突触后电流或电位(EPSCS或EPSPS),谷氨酸受体拮抗剂时添加100μM印防己毒素(kynure网卡酸,2毫;或具有CNQX10μM的在没有从突触事件的任何影响评估神经元放电时记录的抑制性突触后电流或电位(IPSC的或IPSPs),并且两个印防己毒素和谷氨酸受体拮抗剂当D-APV 50μM)的组合。
- 取1 L的标准学联(或从步骤1.3准备的解决方案,无论左)到可能根据实验计划中加入适当的药物制剂。
2.切片准备
- 构造或获取片回收室。
注意:对于一个回收室的原理是简单的,并且可以在实验室中( 图1)进行。简单地说,该室是在其中一个篮子被插入以比ACSF的表面低的水平以保持大脑切片的容器。各种科学公司也卖片回收房。- 作为一个例子,获得四个环(4 -第6毫米高)( 图1A,侧视图; B,顶视图)通过切割30cc的注射器。然后,胶水拉伸网( 例如 ,由尼龙居屋切e)对环中的一个侧面以保持脑切片( 图1B)和环粘合在一起。
注:胶枪可以使用。 - 一旦四个环胶合,胶的弯曲等腰梯形形塑料壁两个环( 图1A和B)的,从回收脑切片( 图1C和D)转移氧的气泡。 如图1D所示,插入在同一侧的氧扩散系统(在此,一个气体分散管)作为塑料壁。
- 作为一个例子,获得四个环(4 -第6毫米高)( 图1A,侧视图; B,顶视图)通过切割30cc的注射器。然后,胶水拉伸网( 例如 ,由尼龙居屋切e)对环中的一个侧面以保持脑切片( 图1B)和环粘合在一起。
- 前切片,含氧化合物(95%O 2/5%CO 2)和冷却切片溶液(参见步骤1.4),以0 - 2℃。
- 填充在室温标准学联的自定义恢复室。确保ACSF是公含氧 - 放置切片在回收室之前(20 30分钟,时间可根据腔室体积变化)。确保气泡不来直接CON与片圆通或破坏它们。
- 行vibratome制冰盘与冰中,用冷水,使三分之一的切片腔的一半被浸没补。小心地将氧递送系统( 例如 ,气体扩散石)和在切片室中的温度探测器,以便既不项干扰了叶片运动或切片操纵。
- 准备必要提取大脑和解剖所需大脑区域中的解剖区域和工具。
注意:执行将取决于特定脑区域的精确解剖研究作为不同的大脑结构将在不同的平面( 例如 ,冠状,矢状,或水平切片。)需要切片。- 放置在一个焊以下工具:断头剪刀,解剖刀,小直锐利尖端剪刀,容器插管钳子(或具有宽尖端的任何外科工具,如骨钳,它更适合于大鼠头骨),弯止血钳,总重量eezers,锅铲,舀抹刀,滤纸,培养皿,单刃刀片,和氰基丙烯酸酯胶。
- 当温度达到0 - 2°C,转移切片解决切片室(缓冲盘)。
- 使用异氟醚麻醉鼠标在干燥室中。确切量可根据所使用的腔室的大小而变化,但对于一个小鞋盒笼使用几滴(〜3 - 4)。离开小鼠中直至呈现不动的保持架(没有响应触觉刺激;对于这里所描述的条件约15秒)。执行尾巴和脚捏测试,以确保动物是深度麻醉,然后斩首心脏停止跳动之前(增强细胞活力)。
注意:使用适当的理由,一些实验室获得,以便尽可能多的兴奋过程尽量减少和增强细胞活力的现场演出斩首授权。 - 执行清扫。
注:大脑必须快速萃取(<45秒)。- 使用手术刀切开从喙头骨尾鳍顶部的浅表皮肤。
- 剥开在头部的每一侧的头皮。
- 使用小直尖头剪刀,剪断interparietal板沿着人字缝,除去小脑。卸下枕骨。
- 使用相同的剪刀,剪断矢状缝。
- 将每个顶骨下方的血管插管钳(或者,如果打破大鼠颅骨骨钳),并拉来揭露大脑。
- 使用弯止血钳,捏额骨打破他们,然后使用镊子或血管插管钳去除断骨。切割并尽量轻柔去除硬膜,因为它可以与解剖干扰。
- 滑动大脑下方的锅铲轻轻拉出来大脑颅骨将它放在前面充满了冰冷学联切片室(缓冲盘)。让你的大脑降温1 - 2分钟。
- 通过填充一个培养皿冰和一些冰水允许更大的表面接触,准备清扫平台,凭借其盖上盖子,并将其放置滤纸之上。湿冷学联滤纸。
- 一旦脑冷却下来,放置在冰填充培养皿大脑,并迅速地进行适当的解剖用于获得切片的所需平面。
- 得到含有伏隔核(NAC)矢状切片,使用单刃剃刀片切割并除去嗅结节和小脑他们是否仍然存在。然后,执行的2矢状切 - 从右半球,以获得平坦的表面,这将在保持板试样粘外侧缘3毫米(见步骤2.8.11)。
注:切割只2 - 从半球的外侧缘3毫米将允许从两个半球含有伏隔片的集合。适当的剥离将取决于在被调查的大脑区域。这里,进行清扫,以便伏隔神经元可被记录在矢状脑切片。 - 迅速胶(用施加在试样保持板氰基丙烯酸酯胶)根据分片的所期望的平面内的脑的平坦切断面到板。为了获得矢状脑切片见步骤2.8.10。
- 马上到位等大脑切片rostro-尾端(安全,建立只有当样品板被固定在刀片座)固定在切片腔固定板标本。
- 设置适当的切片参数(在实验室中使用的材料中提到的vibratome参数:速度3 - 4,振动9-10和切片厚度250微米)的vibratome。
- 后切片,使用塑料修剪移液管转移大脑切片到回收室(在RT)(参见步骤2.3)。恢复时间可以根据神经元类型是正在研究变化(一般为30 - 90分钟)。
3.记录微量移液器和钻机研制
- 请参阅车夫用户手册的具体准则,以获得所需的微量属性。
注意:对于MSN中,我们使用的3.2-4.0MΩ吸管电阻范围。 - 充氧的ACSF和调节流量为2毫升/分。使用安装在该设施蠕动泵或真空行真空ACSF。
- 转动灌注加热器控制器上,以获得所需的温度调节温度设置( 例如 ,31.8 - 32.2℃)。
注意:温度稳定性取决于具有两个腔室中的恒定ACSF级别和恒定的流速。由于神经元的几个生物物理特性( 例如 ,输入电阻,R I,也称为膜电阻,R M)是温度敏感,保持稳定的温度是重要的。 - 打开COMPU之三控制放大器,摄像头,显微,并在显微镜背景光。如果执行需要的组织的电刺激实验中,转刺激控制器和隔离单元上。
注:其他一些制造商的放大器使用推荐前"热身",因此建议咨询手册确切的操作步骤。 - 启动摄像头采集,信号采集和放大器的软件。
- 切片放置和可视化:
- 使用塑料修整尖移液管,轻轻地从回收腔具有一个脑片绘制。
- 放置在记录室中的移液管和轻轻挤压片出来的吸移管的上盖玻片衬腔室的底部。
注意:只要没有溢出发生,它是无害的有从恢复室蔓延到卫浴的一些学联。 - 使用镊子以改变片S的位置Ø所需区域将在录音室的中心精确地放置。使用显微镜低功率(4X)的物镜和用于在定位辅助目镜。
- 所需的位置已经达到后,固定在腔室中的片压紧(也称为"竖琴")脑切片的位置。
- 切换到高功率(40X)物镜,直到接触与该室中的ACSF形成轻轻将其放下。
- 使用微调轮,使组织成为关注的焦点。同时与ACSF接触,不使用粗调轮上的显微镜作为降低物镜过度可以粉碎片甚至断裂盖玻片衬腔室的底部,这可能会导致ACSF到溅到冷凝器和损坏。
- 当焦点在组织水平,观察对形状目标区域的细胞。死细胞是由它们膨胀细胞膜和细胞核(易于识别图1E)。健康细胞应显示为圆形,卵形,或椭圆形的同质结构( 图1E)。
- 寻找一个目标小区。它标记在电脑屏幕上,以帮助引导记录微量。如果使用软件如的QCapture,通过按住鼠标左键来绘制目标细胞周围的正方形。
- 提高物镜所以会有在由物镜与ACSF接触放置并移动记录微量形成的锥体足够的空间。
- 微管安置和定位
- 用1ml注射器,非金属微量针,和一个专用过滤,填充微量具有根据所计划的实验(K +的或Cs +的内部溶液中事先准备的内部溶液,参见步骤1.1。,1.2和材料组合物)。使用足够的解决方案,因此内部溶液进入与微量夹持器内的氯乙烯 - 涂覆的银线电极接触。
注意:银线电极可以通过在家用漂白浸泡被氯化。三磷酸核苷(ATP&GTP)可以被添加到使用前的内部溶液。保持含冰的解决方案,以防止ATP / GTP降解注射器。 - 确保中有微量无气泡,因为他们可以出来,而微管是在组织和掩盖片。
- 放置微量在电极保持器,从而将溶液开始与氯化银包覆线电极接触。
- 拧紧吸管帽,使得锥形垫圈将形成围绕微量的密封。
- 浸泡微量的学联,以防止碎屑进入移液器之前应用正压力。
- 放置在锁定位置的探头(面对腔),并使用显微,G指南下来朝向腔室,以便它是大致浸没物镜中心下。
- 在移动用显微微量(设定在中到高速),使用计算机屏幕来定位微量并引导它向着在XY轴的小区的位置。
- 通过将电压施加步骤测量微量电阻( 例如 ,4毫伏为100毫秒),其可手动或自动如果在Clampex软件使用"膜测试"来实现通过特定的软件,如"浴"模式(参见步骤4) 。为了确保没有气泡或任何其他异物阻塞微量,使用连接到与聚乙烯管微量保持器的空气填充的注射器( 例如 ,30毫升注射器)施加正压。
- 清除微量后,可进行电压偏移到吸移管电流降低到零,这可以手动或通过特定的软件如&#来实现39;移液管上的计算机控制的放大器指挥官偏移'。
注:此功能所造成的浴缸和微量的解决方案( 即 ,液接电位20)之间的浓度差的电压补偿。
- 用1ml注射器,非金属微量针,和一个专用过滤,填充微量具有根据所计划的实验(K +的或Cs +的内部溶液中事先准备的内部溶液,参见步骤1.1。,1.2和材料组合物)。使用足够的解决方案,因此内部溶液进入与微量夹持器内的氯乙烯 - 涂覆的银线电极接触。
4.隔膜测试
注意:此步骤适用于在材料中提到的放大器。
- 当使用计算机控制的放大器指挥官,总是将其置于电压钳模式进行膜测试。
注意:当膜测试中的"浴"模式被设置时,所述膜测试允许微量阻力和密封阻力的测量形成的密封时。 - 一旦该膜破裂(参见步骤5.8),切换膜测试为"细胞"模式,这样串联电阻(R S)(也称为接入电阻中 ,R a)中,R i和膜电容(C p)的可来获得。
5.最后进场,形成密封,并获得全细胞配置
- 使用精细调焦轮,开始关注下降,而逐渐降低微量。总是先重心下移,进而降低微量下降到焦点的平面。这将确保微量移液器尖端不会突然渗透到切片。
- 当微量开始与片的表面接触,减慢显微速度到中等低模式。
- 轻踩刹车正压与连接到吸管持有人清除的方法路径上的任何杂物空气充式注射器。
- 或者通过与XYZ控制旋钮交替,或者由接近对角(如果显微模型允许)其中两个XZ轴与Z轴旋钮的旋转而改变了接近细胞。后一种方法将防止组织的垂直压缩。
注意:在此,目标是通过造成与切片损害最小接近细胞。当微量足够接近出现凹坑的细胞( 图2)(由通过微量的前端所施加的正压力在细胞表面的圆褪色)。 - 当凹坑出现( 图2-1),通过连接到吸液管保持器吸管以创建密封( 图2-2)的管施加弱和简要吸力。随时监控膜测试。
注意:如果形成局部密封(<1GΩ),通过降低保持电位(计算机控制放大器司令)可以促进形成密封,达到千兆欧姆电阻("亿欧姆封"或"千兆欧密封"注射负电流> 1 - 5GΩ)。密封件的耐高(> 1GΩ)都将限制噪音污染记录的信号,并有助于在机械稳定性补丁。 - 虽然千兆欧密封正在形成,使用计算机控制的放大器指挥官带来了细胞的控股潜力尽可能接近生理为了防止突然的变化,一旦膜破裂静息电位(V 休息 )。例如,的MSN通常电压钳位在-70或-80毫伏(生理V 休息 :-70〜-90毫伏)。
- 在千兆欧密封形成后,手动或自动补偿快,慢电容。如果使用计算机控制的放大器指挥官如Multiclamp指挥官,按"自动""的Cp快"和"慢的Cp"。
- 如果密封保持稳定,高于1GΩ(或注入低于10 - 20 pA的保持在所需的膜电位的细胞),应用通过同样的管简短而强大的吸力在5.5破裂质膜( 图2 -3)。
注意:这可能需要多次试验。一个好的膜破裂达到W¯¯进行母鸡吸入足够强烈,使得破裂膜不堵塞微量(这可能会导致在记录期间的增加中的R S),但弱够以未在膜或细胞的很大一部分绘制。 - 成功实现全细胞构造后,定期监视微量位置,以评估和校正显著漂移,因为它可能导致贴剂的损失。漂移的幅度可以根据几个因素而变化, 例如 ,钻机安装的质量和在探头的拉力。理想情况下,漂移应该是几乎不存在。
- 通过切换到在膜测试"单元格"模式,查看小区的不同的参数,如R I,R 5和C 页 。在录制过程中监视这些参数。
注意:所有这些参数可以帮助评估细胞和细胞类型的初始健康状态(见"膜测试"部分中,步骤4)。 - 第一次上述E的步骤完成后,留在电压钳模式来测量电流( 例如 ,EPSCS,IPSC的),或者切换到电流钳模式,如果规划来测量膜电压( 例如 ,动作电位击发)的变化。对于后者,注入或正或负的电流保持在所需的膜电压在细胞(来执行此步骤,请参考放大器手册指南)。
结果
温度,即很容易被实验者控制的因素,影响离子通道和受体的生物物理特性,并由此突触后电流(的PSCs)(EPSC和IPSC的)和神经元以引起尖峰的能力的波形。 图3和图4显示温度对神经元放电和效果分别诱发EPSCS(eEPSCs)的斜率。点火模式( 图3)( 即 ,等待时间的1 次穗,穗数目,频率,和动作电位波形)被定时和协调的开口和特定的电压门控离子通道的闭合状(Na +的, 钙+和K +),处理对温度敏感。 图3示出的平均穗数随温度如何增加。注意,在虽然穗freque此处所述的实验条件下(的MSN记录)NCY似乎并不在subphysiological温度(28℃)被改变,则显著增加时温度达到生理相关水平(32℃)。 图4A示出的示例如何eEPSCs的斜率,即通常用于一个参数评估突触强度,增加了与温度。
尽管R 5可以稍微被实验者, 也就是说 ,通过一个高效膜开口从密封状态转变到全细胞配置时控制中,R通常š慢慢记录期间增加。这可以是各种不可控的活动, 例如 ,膜再封闭或碎片记录期间堵塞枪头的结果。试图通过施加轻微的吸力,重新打开薄膜,尽管它可能危及补丁,有时可以帮助维持一个稳定的R 5。在所有的情况下,因为R 5的变化可以人之三所研究的电信号的波形,它必须仔细监测,特别是记录的PSCs时(电压钳模式) 图4示出了当R S增加( 图4B),谷氨酸受体介导的电流的振幅(eEPSCs )减小( 图4C,D)。通常情况下,实验者丢弃数据时,R 5的变化超过15%( 例如 ,该实验室),但有些实验室从20%的变化这样做。这个标准必须在文章的方法部分中注明。
在定义的神经元中,R 我可以由几个因素,包括温度,细胞的健康,以及贴剂的质量的影响。具体地,当R I减小,PSC幅度或神经元的能力,以产生尖峰也减小。例如, 图4E示出了当R i未显著变化,第尖峰电子数量保持相对稳定(神经元1);当R I的增加,尖峰的增加以及数(神经元2)。因此,类似于R 之间 ,R 我必须仔细监测,因为10%的变化是足够的偏置数据。
如上所述,它记录在关键是要控制或监视温度,R s和R I。例如,观察到的这些因素,由于变化是所研究(的PSCs或击发)信号的变化可以是(或缺少控制的),而不是实验操作的效果, 例如 ,前与的后的效果药浴应用。

图1.定做恢复室(AD)和400X显示健康和死亡的神经元(E)的脑切片的照片。广告)做一个自定义恢复室的过程步骤2.1有描述。E)在400倍出健康(红色箭头的例子中的脑切片伏隔核内侧外壳的MSN) 与死亡的神经元(蓝色箭头)的图片。请注意,虽然某些细胞被表示为健康的,它们的球面方面表明,根据需要(以星号红色箭头)它们可能不为健康的。最终的健康状况是基于V 休息和R评估我实现全细胞配置后, 请点击此处查看该图的放大版本。

图2. 图描绘了基本的程序步骤,以取得千兆欧密封,并建立全细胞配置,当微量足够接近THÈ细胞以创建在质膜(步骤1,方法)一个凹坑,施加短暂和温和抽吸创建微量和质膜之间形成紧密接触。如果正确执行,该接触将加强和电阻将增加,并且达到1GΩ(千兆欧密封)或多个(第2步,密封形成)。一旦密封件是稳定的和上述1GΩ,施加短暂和强大吸力破裂质膜(步骤3,全细胞配置)。实现全细胞配置将允许细胞质和微量内部之间的连续性。有关详细信息,请参阅协议的步骤5.1-5.8。 请点击此处查看该图的放大版本。
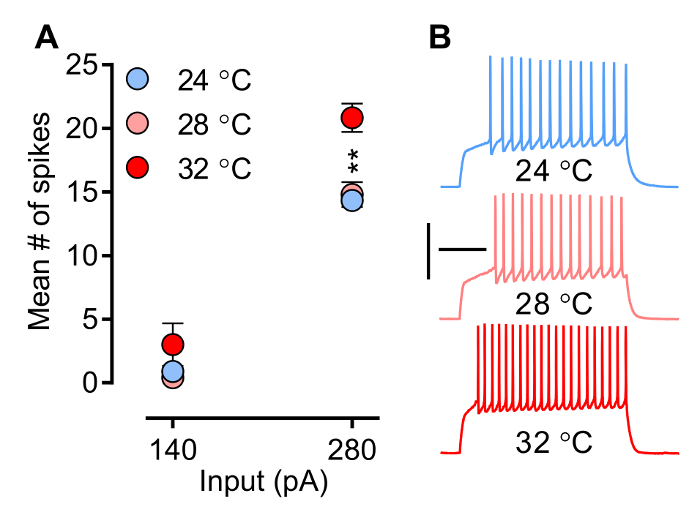
图3.神经元放电(内在兴奋)的电流蚌进行评估 P模式。在此,一个预先定义和增量序列的当前步骤是为了引起在膜电压的变化给定,由此触发动作电位。A)的平均穗数随温度。B):试样的痕迹在280 pA的从伏隔增加外壳内侧的MSN在三个不同温度设置(24°C,N = 9; 28°C,N = 5;和32°C,N = 6)。在记录室中的温度直接影响尖峰频率。然而,请注意,虽然尖峰频率似乎并不在subphysiological温度被改变,它显著当温度达到32℃时,生理相关的温度增大。神经元-80 mV的举行。两因素方差分析:互动,P <0.0001;温度效应,p值= 0.0041;事后检查:24°C和28°C都从32℃的显著不同,** P <0.01。数据被表示为平均值±SEM表示。校准:200毫秒,50毫伏。jove.com/files/ftp_upload/54024/54024fig3large.jpg"目标="_空白">点击此处查看该图的放大版本。

图4.温度,R S和R I对从单一的伏隔核的外壳MSN eEPSC幅度的电信号正在研究中。A)例的波形 。温度的升高24至28°C和32℃,增加eEPSCs的斜率。注意eEPSCs斜率温度引起的变化迅速发生。这里,eEPSCs斜率在电压钳模式进行评估。校准:5毫秒,从单一的伏隔核的外壳MSN eEPSCs坡100 pA的BD)为例。当R S增加(B)eEPSCs的斜率减小(C)D)eEPSC斜率的相关分析为R的函数秒。皮尔逊的R = -0.5717,P <0.0001。神经元是电压钳位在-80毫伏。E)从两个神经元表示R I的对神经元,以产生尖峰的能力的影响的痕迹的实施例。神经元是目前钳位,并在-80 mV的举行。校准:200毫秒,50毫伏请点击此处查看该图的放大版本。
讨论
这个协议描述了在脑切片的神经元进行全细胞膜片钳实验的基本步骤。然而,该技术的复杂性,电势和敏感性不能完全在本文中描述。这里,我们试图描绘最基本的步骤和强调,必须加以控制以实现成功的和严格全细胞记录的重要参数。对于进一步的理论学习,许多书籍和文章已经在脑片3,21-24并可以以增强细胞活力细化使用25-27的解决方法,发表了两个全细胞膜片钳记录。为了经常进行适当的记录,需要通过强化练习技术技能的提高。尽管如此,与步骤正确运用所提到的,细胞可以修补小时验尸报告,提供有关在突触功能和内在excitabi变化的重要信息lity。
在一般情况下,除了仔细制备既ACSF和内部微量解决方案,从大脑解剖每一步骤,切片,实现成功的全细胞结构,并获得严谨和公正数据的重要性需要密集的做法。首先,它是产生健康的大脑切片的关键。简要地说,脑(理想地<45秒),低温度的维护快速解剖(0 - 2℃),而切片,以及适当的切片解决方案都在确保细胞的健康中起重要作用。值得注意的是,提及的是切片溶液可以实验室和根据细胞类型和/或大脑区域将要调查不同。当切片伏隔或背侧纹状体,我们的实验室和其他人使用犬尿烯酸为切片溶液,以尽量减少兴奋毒性过程28-33,然而,其它方法也可以使用,例如基于蔗糖的溶液34中 ,高的Mg 2+ /低钙的解决方案35 等 。这些只是几个例子,并且可以根据脑或脑区域兴奋毒性过程的灵敏度调整( 例如,由于年龄)。有关解决方案和细胞活力的进一步信息,请参阅25-27。最终,阴离子,阳离子,和其它药物的浓度( 例如 ,抗坏血酸盐,谷氨酸盐受体拮抗剂),该组成切片解被确定为使得它模拟脑脊液和减少一样多切片过程中发生的可能的兴奋毒性过程。在这篇文章中介绍的协议描述了从在NAC或大脑切片的背侧纹状体的MSN记录时在作者的先前的研究28-31常规使用的标准解决方案。另外,渗透压为ACSF和内部微量溶液适当的调整是成功的密封形成和全细胞CONF维持临界iguration。创建从细胞外溶液到帧内吸管溶液浓度梯度,ACSF摩尔渗透压浓度应比用于内部微量溶液更高。理想的是,差的范围可以从10到30毫渗量。
成功实现全细胞结构是用于进行高效的记录的另一个重要步骤。首先,一旦吸移管被放置在浴可以调整吸移管电容。尽管自动设置通常设置正确,建议使用电池容量的快和慢的调整要小心,因为在不恰当地执行了这些可能会损坏电池。第二,简要膜抽吸所必需的破裂膜会导致膜的显著开口,从而允许细胞内和细胞内微量环境之间的良好的通信。这将确保R 5将在整个记录保持相对稳定。如果使用基于CS的微量的解决方案,膜静息电位应当在建立全细胞构造的立即进行评估(见步骤5.8)。事实上, 对 Cs +的小区内的扩散导致膜静息电位的损失。来确定适当的静息电位,该液体接界电势必须评估20。然而,实验者可能会报告是打破膜(步骤5.8之后)后观察到的静息电位,并选择不调整为液体接界电势。在所有的情况下,它必须在制品的方法部分中提到的。一旦建立全细胞构造中,也能够得到中 c p,并且可以被用作间接参数来评估细胞的健康和/或细胞类型。第三,当录音开始时,其他参数必须严格监控。必须评估神经元兴奋时被控制的关键因素是温度,R s和R I。
如如上所述,R I和C P能够被指示细胞的健康和/或细胞类型。例如,细胞膜,充当绝缘体,分隔电荷,它们共同构成该膜电容(来自不同的组合物中的细胞内和细胞外溶液的所得)。较大的膜表面(神经元特异性),较高的电容。它是那么就不奇怪了特定的神经元类型的附件C p和 R I(数学相关至C p)的是相同的范围内的。 R 5为直接相关枪头的大小,因此通常表示质量或膜开口的大小。简要地说,在建立全细胞构造中,细胞质变成与微量的溶液连续通电,并从外部介质完全隔离。 R 5(或R a)由用于柯伦电阻起源吨至从吸管流入细胞质中。对于某些拍摄条件( 如电流钳模式或电压门控离子电流的电压钳记录),R 一定还是适当的补偿(参见参考文献3,21-24或进行适当的R 5补偿放大器手册指南) 。
如在图4中描述,因为它可以显着地影响所述电信号的波形, 例如 ,EPSC振幅R 5为特别重要。尽管如此,R 5必须仔细监测的任何观察到的效果离线解释。在情况下,膜没有被正确破裂,微量移液器尖端堵塞或重新封闭该膜可能会发生,在这种情况下,R 5增加,偏压电信号的所研究的波形( 图4B-D)。总之,很多问题可以在录制时遇到的,以及那些通常归入三类:一)组织有关, 例如 ,增加细胞的死亡率由于解剖差,学联渗透压,缺氧失调; ⅱ)设备有关的, 例如 ,噪声和接地的问题,温度控制,切片和微量的定位等 ;和iii)数据的解释, 例如 ,观察到的变化可以是不希望的实验工件偏置数据像在电波形改变参数(R I,R S,温度, 见图3和4)的改变,而不是实验的结果的结果操作。
虽然在脑片全细胞记录是评估经验依赖可塑性一个强大的技术,这种做法限制了数据的解释。具体地,全细胞记录技术的三个重要的限制是:(ⅰ)在特定的蛋白质( 例如 ,离子通道)不能分辨的功能和表达水平的变化; (ⅱ),因为这技术评估通过整个膜的电流流动(或实质部分),但它不提供所观察到的离子电流或变化的准确亚细胞定位;和(iii)全细胞结构的侵袭导致细胞内容的透析,由此细胞内分子机制的中断所需的一些现象开发或待表达。避免透析的一种方法是用锋利的电极记录或穿孔修补术3,21,23。关于后者,孔隙形成抗生素分子如制霉菌素可以添加到吸管溶液。这些孔的形成将允许电流的记录,但不将小区内干扰第二信使的机制。然而,最近在纳米技术的进步和纳米电极36的发展为提高神经录音功能强大的工具。这样的技术进步在神经科学仍在发展吨和现在将我们的目标,以最小的侵袭, 即执行膜片钳和细胞内记录的可能性,保持细胞内环境的完整,并调查离子通道的功能即是迄今未与经典访问亚细胞区室中膜片钳电极37。
披露声明
作者都没有利益冲突或利益冲突。
致谢
这项研究是由德克萨斯大学西南启动资金(SK)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Isolated pulse stimulus generator | A.M.P.I | Master-8 | |
| Isolation unit (ISO-Flex) | A.M.P.I | ISO-Flex | |
| Computer controlled Amplifier | Molecular Devices | Multiclamp 700B | |
| Digital Acquisition system | Molecular Devices | Digidata 1500 | |
| Microscope | Olympus | BX-51 | |
| Micromanipulator | Sutter Instruments | MPC-200 | |
| Chamber and in-line Heater | Warner Instruments | TC-344B | |
| Vibratome Slicer | Leica | VT1000 S | |
| Micropipette Puller | Narishige | PC-10 | |
| Imaging Camera | Q Imaging | QIClick-F-M-12 | |
| Narishige pipette puller PC-10 | Narishige | PC-10 | |
| Glass capillaries | WPI | TW150F-3 | |
| Slice hold-down (harp) | Warner Instruments | 64-0255 | |
| Slice Chamber | Warner Instruments | RC-26 | |
| Nonmetallic syringe needle | World Precision Instruments | MF28G67-5 | |
| Syringe filters | Nalgene | 176-0045 | |
| Glue Gun | Home Depot | various | |
| Gas dispersion tube | Ace Glass Inc. | various | |
| Decapitation scissors | Home Depot | 100649198 | |
| Scalpel Handle #3 | World Precision Instruments | 500236 | |
| Small straight sharp tips scissors | World Precision Instruments | 14218 | |
| Vessel canulation forceps | World Precision Instruments | 500453 | |
| Curved hemostatic forceps | World Precision Instruments | 501288 | |
| Economy Tweezers #3 | World Precision Instruments | 501976-6 | |
| Spatula | Fisher Scientific | 14357Q | |
| Scooping spatula | Fisher Scientific | 14-357Q | |
| Petri dish | Fisher Scientific | 08-747B | |
| Filter paper | Lab Depot | CFP1-110 | |
| Solutions | |||
| Cs-Gluconate internal solution (pH 7.2–7.3, 280–290 mOsm) | |||
| D-gluconic acid 50% | Sigma Aldrich/various | G1951 | |
| Cesium-OH (CsOH) 50% | Sigma Aldrich/various | 232041 | |
| NaCl, 2.8 mM | Sigma Aldrich/various | S7653 | |
| HEPES, 20 mM | Sigma Aldrich/various | H3375 | |
| EGTA, 0.4 mM | Sigma Aldrich/various | E4378 | |
| tetraethylammonium-Cl, 5 mM | Sigma Aldrich/various | T2265 | |
| Na2GTP, 0.3 mM | Sigma Aldrich/various | G8877 | |
| MgATP, 2 mM | Sigma Aldrich/various | A9187 | |
| K-Gluconate internal solution (pH 7.2–7.3, 280–290 mOsm) | |||
| K D-gluconate, 120 mM | Sigma Aldrich/various | G4500 | |
| KCl, 20 mM | Sigma Aldrich/various | P3911 | |
| HEPES, 10 mM | Sigma Aldrich/various | H3375 | |
| EGTA, 0.2 mM | Sigma Aldrich/various | E4378 | |
| MgCl2 | Sigma Aldrich/various | M8266 | |
| Na2GTP, 0.3 mM | Sigma Aldrich/various | G8877 | |
| MgATP, 2 mM | Sigma Aldrich/various | A9187 | |
| Standard artificial cerebrospinal fluid (ACSF, osmolarity ≈ 300-310 mOsm) | |||
| KCl, 2.5 mM | Sigma Aldrich/various | P3911 | |
| NaCl, 119 mM | Sigma Aldrich/various | S7653 | |
| NaH2PO4•H2O, 1 mM | Sigma Aldrich/various | S9638 | |
| NaHCO3, 26.2 mM | Sigma Aldrich/various | S8875 | |
| Glucose, 11 mM | Sigma Aldrich/various | G8270 | |
| MgSO4-7H2O, 1.3 mM | Sigma Aldrich/various | 230391 | |
| CaCl2-2H2O, 2.5 mM | Sigma Aldrich/various | C3881 | |
| Additional compounds used for solutions preparation | |||
| KOH | various | ||
| Kynurenic acid | Sigma Aldrich/various | K3375 | |
参考文献
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibres. Nature. 260 (5554), 799-802 (1976).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annu Rev Physiol. 46, 455-472 (1984).
- Cahalan, M., Neher, E. Patch clamp techniques: an overview. Methods Enzymol. 207, 3-14 (1992).
- Staley, K. J., Otis, T. S., Mody, I. Membrane properties of dentate gyrus granule cells: comparison of sharp microelectrode and whole-cell recordings. J Neurophysiol. 67 (5), 1346-1358 (1992).
- Horn, R., Marty, A. Muscarinic activation of ionic currents measured by a new whole-cell recording method. J Gen Physiol. 92 (2), 145-159 (1988).
- Pusch, M., Neher, E. Rates of diffusional exchange between small cells and a measuring patch pipette. Pflugers Arch. 411 (2), 204-211 (1988).
- Kandel, E. R., Dudai, Y., Mayford, M. R. The molecular and systems biology of memory. Cell. 157 (1), 163-186 (2014).
- Kourrich, S., Bonci, A. Chapter 5: Synaptic and Neural plasticity. Neurobiology of Mental Illness. 4th edn. , Oxford University Press. (2013).
- Mozzachiodi, R., Byrne, J. H. More than synaptic plasticity: role of nonsynaptic plasticity in learning and memory. Trends Neurosci. 33 (1), 17-26 (2010).
- Zhang, W., Linden, D. J. The other side of the engram: experience-driven changes in neuronal intrinsic excitability. Nat Rev Neurosci. 4 (11), 885-900 (2003).
- Kourrich, S., Calu, D. J., Bonci, A. Intrinsic plasticity: an emerging player in addiction. Nat Rev Neurosci. 16 (3), 173-184 (2015).
- Luscher, C., Malenka, R. C. Drug-evoked synaptic plasticity in addiction: from molecular changes to circuit remodeling. Neuron. 69 (4), 650-663 (2011).
- McEwen, B. S., Morrison, J. H. The brain on stress: vulnerability and plasticity of the prefrontal cortex over the life course. Neuron. 79 (1), 16-29 (2013).
- Sandi, C., Haller, J. Stress and the social brain: behavioural effects and neurobiological mechanisms. Nat Rev Neurosci. 16 (5), 290-304 (2015).
- Kim, S. J., Linden, D. J. Ubiquitous plasticity and memory storage. Neuron. 56 (4), 582-592 (2007).
- Ganguly, K., Poo, M. M. Activity-dependent neural plasticity from bench to bedside. Neuron. 80 (3), 729-741 (2013).
- Kullmann, D. M., Moreau, A. W., Bakiri, Y., Nicholson, E. Plasticity of inhibition. Neuron. 75 (6), 951-962 (2012).
- Bar-Yehuda, D., Korngreen, A. Space-clamp problems when voltage clamping neurons expressing voltage-gated conductances. J Neurophysiol. 99 (3), 1127-1136 (2008).
- Williams, S. R., Mitchell, S. J. Direct measurement of somatic voltage clamp errors in central neurons. Nat Neurosci. 11 (7), 790-798 (2008).
- Neher, E. Correction for liquid junction potentials in patch clamp experiments. Methods Enzymol. 207, 123-131 (1992).
- Defelice, L. J. Electrical Properties of Cells-Patch Clamp for Biologists. , Plenum Press. (1997).
- Kornreich, B. G. The patch clamp technique: principles and technical considerations. J Vet Cardiol. 9 (1), 25-37 (2007).
- Molleman, A. Patch Clamping: An Introductory Guide To Patch Clamp Electrophysiology. , John Wiley & Sons, Ltd. (2003).
- Neher, E., Sakmann, B. The patch clamp technique. Sci Am. 266 (3), 44-51 (1992).
- Richerson, G. B., Messer, C. Effect of composition of experimental solutions on neuronal survival during rat brain slicing. Exp Neurol. 131 (1), 133-143 (1995).
- Tanaka, Y., Tanaka, Y., Furuta, T., Yanagawa, Y., Kaneko, T. The effects of cutting solutions on the viability of GABAergic interneurons in cerebral cortical slices of adult mice. J Neurosci Methods. 171 (1), 118-125 (2008).
- Ye, J. H., Zhang, J., Xiao, C., Kong, J. Q. Patch-clamp studies in the CNS illustrate a simple new method for obtaining viable neurons in rat brain slices: glycerol replacement of NaCl protects CNS neurons. J Neurosci Methods. 158 (2), 251-259 (2006).
- Kourrich, S., et al. Dynamic interaction between sigma-1 receptor and Kv1.2 shapes neuronal and behavioral responses to cocaine. Cell. 152 (1-2), 236-247 (2013).
- Kourrich, S., Klug, J. R., Mayford, M., Thomas, M. J. AMPAR-Independent Effect of Striatal aCaMKII Promotes the Sensitization of Cocaine Reward. J Neurosci. , (2012).
- Kourrich, S., Rothwell, P. E., Klug, J. R., Thomas, M. J. Cocaine experience controls bidirectional synaptic plasticity in the nucleus accumbens. J Neurosci. 27 (30), 7921-7928 (2007).
- Kourrich, S., Thomas, M. J. Similar neurons, opposite adaptations: psychostimulant experience differentially alters firing properties in accumbens core versus shell. J Neurosci. 29 (39), 12275-12283 (2009).
- Rothwell, P. E., Kourrich, S., Thomas, M. J. Environmental novelty causes stress-like adaptations at nucleus accumbens synapses: implications for studying addiction-related plasticity. Neuropharmacology. 61 (7), 1152-1159 (2011).
- Rothwell, P. E., Kourrich, S., Thomas, M. J. Synaptic adaptations in the nucleus accumbens caused by experiences linked to relapse. Biol Psychiatry. 69 (11), 1124-1126 (2011).
- Koya, E., et al. Silent synapses in selectively activated nucleus accumbens neurons following cocaine sensitization. Nat Neurosci. 15 (11), 1556-1562 (2012).
- Conrad, K. L., et al. Formation of accumbens GluR2-lacking AMPA receptors mediates incubation of cocaine craving. Nature. 454 (7200), 118-121 (2008).
- Kruskal, P. B., Jiang, Z., Gao, T., Lieber, C. M. Beyond the patch clamp: nanotechnologies for intracellular recording. Neuron. 86 (1), 21-24 (2015).
- Novak, P., et al. Nanoscale-targeted patch-clamp recordings of functional presynaptic ion channels. Neuron. 79 (6), 1067-1077 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。