Method Article
Registrazioni Whole-cell patch-clamp nel cervello fette
In questo articolo
Riepilogo
Questo protocollo descrive passaggi procedurali di base per l'esecuzione di cellule intere registrazioni patch-clamp. Questa tecnica consente di studiare il comportamento elettrico dei neuroni, e quando eseguito in sezioni di cervello, permette di valutare diverse funzioni neuronali da neuroni che sono ancora integrati in circuiti cerebrali relativamente ben conservati.
Abstract
Whole-cell patch-clamp registrazione è una tecnica elettrofisiologica che permette lo studio delle proprietà elettriche di una parte sostanziale del neurone. In questa configurazione, la micropipetta è a stretto contatto con la membrana cellulare, che impedisce la dispersione di corrente e quindi fornisce misure di corrente ionica più preciso del metodo di registrazione elettrodo affilato intracellulare precedentemente utilizzato. Classicamente, la registrazione a cellula intera può essere eseguita su neuroni in vari tipi di preparati, compresi i modelli di colture cellulari, i neuroni dissociate, i neuroni in fettine di cervello, e in animali anestetizzati o sveglio intatte. In sintesi, questa tecnica ha enormemente contribuito alla comprensione della passivi e attivi proprietà biofisiche di cellule eccitabili. Uno dei principali vantaggi di questa tecnica è che fornisce informazioni sulle modalità specifiche manipolazioni (ad esempio, farmacologico, sperimentatore indotta plasticità) possono alterare le funzioni neuronali specifici ochannels in tempo reale. Inoltre, significativa apertura della membrana plasmatica permette alla soluzione pipetta interna di diffondersi liberamente nel citoplasma, predisporre mezzi per farmaci introduzione, ad esempio, agonisti o antagonisti di specifiche proteine intracellulari, e manipolare tali obiettivi senza alterare le loro funzioni in cellule vicine. Questo articolo si concentrerà sulla registrazione a cellula intera eseguita su neuroni in fettine cerebrali, una preparazione che ha il vantaggio di registrazione neuroni relativamente ben conservati circuiti cerebrali, cioè in un contesto fisiologicamente rilevanti. In particolare, quando combinato con adeguate farmacologia, questa tecnica è uno strumento potente che consente di identificare neuroadaptations specifici che si sono verificati in seguito a qualsiasi tipo di esperienze, quali l'apprendimento, l'esposizione a sostanze d'abuso, e lo stress. In sintesi, le registrazioni a cellula intera patch-clamp in fettine di cervello forniscono i mezzi per misurare in ex vivo preparazione cambiamenti duraturinelle funzioni neuronali che si sono sviluppate negli animali svegli intatti.
Introduzione
La tecnica del patch-clamp, una tecnica elettrofisiologica che è stato sviluppato alla fine del 1970 1,2, è uno strumento primario per studiare le funzioni di uno o più canali ionici nel tessuto vivo. Tra le diverse configurazioni di patch che si possono ottenere, registrazioni whole-cell patch-clamp permettono lo studio del comportamento elettrico di una parte sostanziale del neurone. Classicamente, questa tecnica viene eseguita in vitro sia su fettine cerebrali, neuroni appena dissociate, o su modelli di coltura cellulare 3. Quando eseguito sui neuroni in fettine cerebrali, questa tecnica presenta diversi vantaggi. In particolare: (i) i neuroni sono registrati nei circuiti cerebrali relativamente conservate che in qualche misura, e rispetto alle preparazioni di coltura cellulare, forniscono un ambiente che è fisiologicamente rilevanti 3. Questo permette di catturare in anticipo, o anche il monitoraggio in tempo reale, gli eventi cellulari e molecolari che sono attivati da qualsiasi tipo di pharmacolog acutamanipolazioni iCal - una risoluzione temporale che non può essere raggiunto utilizzando classica in condizioni in vivo; (ii) capacità di identificare visivamente le regioni del cervello in fettine di cervello permette un'elevata specificità regionale 3 sia per la regione del cervello studiato e per i neuroni specifici quando esprimono marcatori fluorescenti; (iii) l'accesso allo spazio intracellulare della cellula aprendo una porzione significativa della membrana plasmatica (in contrasto pungere la membrana con una micropipetta tagliente per le registrazioni intracellulari) 4. A sua volta, questo consente al contenuto o la concentrazione di ioni specifici che compongono la soluzione interna da modificare bersagli molecolari modo o meccanismi cellulari possono essere studiati in condizioni diverse. Ad esempio, su di stabilire cellula intera configurazione, qualsiasi agente farmacologico specifico (ad esempio, gli antagonisti) che si può aggiungere alla micropipetta di registrazione (patch pipetta) soluzione sarà direttamente diffondersi nel citoplasma e di agire sul suo putative bersagli intracellulari senza alterare la funzione obiettivo in cellule vicine. Inoltre, rispetto alla registrazione micropipetta tagliente, la grande apertura sulla punta dell'elettrodo patch clamp offre minore resistenza, meno rumore CONCORRENTI, e quindi un migliore accesso elettrico all'interno della cella 4. Si noti tuttavia che l'ampia apertura sulla punta della pipetta può portare alla dialisi cellule, e quindi la perdita di macchinario molecolare intracellulare che può essere critico per l'espressione dei fenomeni biologici che sono in fase di studio 5,6. In questo caso, le registrazioni elettrodo taglienti può essere più adatto. Questo tipo di registrazioni richiede micropipette con un poro che è molto più piccolo di quelli usati per le registrazioni cellule intere, impedendo così la maggior parte lo scambio ionico tra lo spazio intracellulare e la soluzione pipetta interna.
Ogni forma di esperienza (acuta o cronica), compreso l'apprendimento 7-10, l'esposizione a sostanze d'abuso 11,12, lo stress 13,14, ecc, possono alterare i vari aspetti della funzione neuronale in regioni specifiche del cervello. Poiché queste alterazioni spesso richiedono tempo per svilupparsi (ore o giorni), le registrazioni integrali delle cellule in fettine di cervello da animali che sono stati sottoposti a una specifica esperienza permettono ai ricercatori di identificare questi cambiamenti. In sostanza, molti (se non tutti) i componenti che partecipano nelle funzioni neuronali (per esempio, ligando-attivato canali ionici, canali ionici voltaggio-dipendenti, trasportatori neurotrasmettitori), e in tal modo l'attività del circuito del cervello e del comportamento, può essere alterato da esperienza (l'esperienza-dipendente plasticità) 10,15-17. A livello neuronale, l'attività circuito cerebrale emerge dalle interazioni costanti tra sinaptica (ad esempio, trasmissione glutammato) e fattori intrinseci eccitabilità cellulare (per esempio, canali ionici axosomato-dendritica: sodio, Na +, potassio, K +, e di calcio, Ca 2+ ). In condizioni specifiche che utilizzano da tE-CELL patch-clamp tecniche elettrofisiologiche, alterazioni di segnale provenienti in particolare da variazioni sinaptica vs. eccitabilità intrinseca può essere isolato.
Nella maggior parte dei casi, l'eccitabilità sinaptica è valutato utilizzando la tecnica voltage-clamp whole-cell. Questa modalità di registrazione permette la misura di correnti ioniche [ad esempio, mediati dai recettori di acido α-ammino-3-idrossi-5-metil-4-isoxazolepropionic ( recettori AMPA) e recettori N-metil-D-aspartico (NMDA)] attraverso la membrana plasmatica neuronale, mentre tengono il potenziale di membrana ad una tensione impostata. Qui, sperimentatori utilizzano le soluzioni interne micropipetta contenenti cesio (Cs +), una vasta bloccanti di canali K + (chiave fattori intrinseci eccitabilità). Su creazione di cellula intera configurazione, la diffusione di Cs + nello spazio intracellulare bloccherà canali K +, e quindi permetterà sia relativamente efficiente spazio-clamp e presfogare influenza dei fattori intrinseci eccitabilità su altre misure. Problemi di spazio-clamp, cioè, la difficoltà di tensione-clamp tutta la cella, sorgono quando si registra cellule di forma irregolare (ad esempio, neuroni), e in particolare neuroni con un vasto e complesso dendritic arbor 18,19. Poiché morsetto tensione somatica controlli scarsamente voltaggio nella struttura dendritica dei neuroni, vari aspetti dei segnali elettrici dendritiche in esame sono distorti in maniera dendritica distanza-dipendente. Combinato con strumenti farmacologici come picrotoxin (acido gamma-aminobutirrico, GABA A antagonista del recettore) o acido kinurenico (ampio bloccante dei recettori del glutammato) disciolti nella soluzione extracellulare (fluido cerebro-spinale artificiale, ACSF), questa tecnica permette di misurare glutammato recettore e le correnti GABA A R-mediata, rispettivamente.
Al contrario, l'eccitabilità intrinseca viene generalmente valutato in modalità di registrazione corrente-clamp.Al contrario di registrazione voltage-clamp, questa modalità di registrazione permette la misura delle variazioni potenziali di membrana indotte da correnti ioniche che fluisce attraverso la membrana plasmatica neuronale. Tipicamente, alterazione dell'eccitabilità intrinseca è valutata attraverso cambiamenti nella capacità di neuroni di generare potenziali d'azione, che richiede sia Na + e canali del K +. Pertanto, quando si eseguono registrazioni corrente-clamp, micropipette sono riempiti con una soluzione interna che contiene K + anziché Cs +. In combinazione con agenti farmacologici che bloccano glutammato e GABA A correnti recettoriali disciolti nel ACSF, questo disegno sperimentale permette la misura del contributo di fattori intrinseci (ad esempio, K + canali) a neuronale senza essere contaminati da potenziali variazioni dell'eccitabilità sinaptica fattori.
Questo articolo descrive i passi procedurali necessari di base to (i) prepara fette di cervello sane; (Ii) ottenere cellula intera configurazione, e (iii) monitorare i parametri fondamentali per valutare sinaptica e l'eccitabilità intrinseca.
Protocollo
Tutti gli esperimenti sono stati eseguiti in conformità con i protocolli approvati dalla Institutional Animal Care e Usa Comitato UT Southwestern, e sono stati scelti in modo da minimizzare lo stress, disagio e dolore provato da animali da esperimento.
1. Soluzioni
Nota: Preparare le soluzioni interne micropipetta in anticipo. Per la maggior parte degli scopi sperimentali di base, due tipi di soluzioni dovrebbero bastare: le soluzioni basate Cs + -based e K +.
- Le soluzioni basate su Usa CS + (ad esempio, la soluzione Cs + gluconato, vedi Materiali) per esperimenti di voltage-clamp. Preparare a temperatura ambiente.
- Preparare 117 mm soluzione Cs-gluconato miscelando 4,62 g di acido D-gluconico (~ 3.696 ml), con 3,54 g CsOH (~ 2,01 ml).
- Aggiungere DDH 2 O a 90 ml e lasciar riposare e stabilizzare per 30 min.
- Aggiungere gli ingredienti solidi (20 mm Hepes = 0,476 g; 0,4 mm EGTA = 15,2 mg; 2,8 mm NaCl = 16,4 mg; 5 mM tetraetilammonio (TEA) Cloruro = 83 mg).
- Aggiungere DDH 2 O per ~ 97 ml.
- Regolare il pH della soluzione con 50% CsOH a 7,2 - 7.3.
- Controllare osmolarità e correggere, se necessario, con DDH 2 O.
Nota: Una buona gamma è ~ 280-285 mOsm. osmolarità ottimale dovrebbe essere 15 - 20 mOsm sotto l'osmolarità di ACSF standard (di solito 300-310 mOsm, 300 mOsm nel nostro laboratorio). Osmolarità può variare a seconda soluzioni composizioni specifiche. - Aliquota da 1.000 ml e conservare a -20 ° C o al di sotto.
- Preparare, un'aliquota, congelamento, e aggiungere ATP / GTP alla soluzione interna del giorno di registrazione.
- Aggiungere 64.63 mg ATP a 10 mg GTP e sciogliere in 637.11 ml di DDH 2 O.
- Preparare 10 aliquote microlitri e conservare a -20 ° C o al di sotto. Mescolare ogni 100x aliquota con 1000 ml di soluzione interna il giorno dell'esperimento. Una volta ATP / GTP viene aggiunto alla soluzione interna, mantenere in ghiaccio per evitare degradati ATP / GTPsopra.
- Le soluzioni basate su l'uso K + (ad esempio, la soluzione K-gluconato, vedi Materiali) per entrambi gli esperimenti current- e la tensione-clamp dove K + conduttanze rimangono funzionale in modo che scarica neuronale può essere valutata. Preparare a temperatura ambiente.
- Pesare tutti i materiali secondo il volume finale desiderato. Per la preparazione di 90 ml di soluzione, 120 mm K-gluconato = 2.81 g; 20 mM KCl = 0,149 g; 10 mM HEPES = 0,238 g; 0,2 mM EGTA = 0,008 g; 2 mM MgCl 2 = 0,021 g.
- Usi abbastanza DDH 2 O a raggiungere il 90% del volume soluzione finale. Ciò dovrebbe garantire che abbastanza spazio è lasciato per il pH e la regolazione osmolarità.
- Dopo aver aggiunto e mescolando tutti gli ingredienti, assicurarsi che la soluzione è chiara prima di misurare il pH.
- Mentre mescolando la soluzione, aggiustare il pH a 7,2-7,3 usando K + idrossido (KOH).
- Dopo aver regolato il pH, utilizzare la osmometer e annunciosolo osmolarità di 280-285 mOsm.
Nota: osmolarità ottimale dovrebbe essere 15 - 20 mOsm sotto l'osmolarità di ACSF standard (di solito 300-310 mOsm, 300 mOsm nel nostro laboratorio). Osmolarità può variare a seconda soluzioni composizioni specifiche. - Aliquota da 1.000 ml e conservare a -20 ° C o al di sotto.
- Preparare, aliquota, congelare, e aggiungere ATP / GTP alla soluzione interna, al momento della registrazione (vedere il punto 1.1.8).
- Preparare 1 l di ACSF standard (vedi Materiali).
Nota: Usiamo questa ricetta nel nostro laboratorio per la registrazione di neuroni spinosi medi (MSN) in fettine di cervello, tuttavia, le ricette possono differire tra i laboratori, e di conseguenza, si consiglia lo sperimentatore usare una ricetta che viene utilizzato di routine quando si registra la regione del cervello di interesse . - Preparare la ACSF dissezione (soluzione affettare, ~ 125 ml Nota:. Volume esatta dipenderà dalle dimensioni della camera di affettatura come dovrebbe immergere completamente il cervello) per l'uso inpassi 2,2-2,8.
- Preparare 5 mm di acido kinurenico (per bloccare glutammato processi eccitotossici recettore indotta) in serie ACSF in un volume sufficiente per immergere il cervello durante affettare. Utilizzare un sonicatore per aiutare a sciogliere l'acido kinurenico.
Nota: La lunghezza della sonicazione può variare a seconda del volume e la quantità di solidi nella soluzione. Le soluzioni devono essere chiari dalla fine del processo (circa 1 - 2 min nelle nostre condizioni). - Raffreddare mentre ribolle con il 95% O 2, 5% di gas CO 2 in un secchio di ghiaccio finché la temperatura raggiunge i 0-2 ° C.
- Preparare 5 mm di acido kinurenico (per bloccare glutammato processi eccitotossici recettore indotta) in serie ACSF in un volume sufficiente per immergere il cervello durante affettare. Utilizzare un sonicatore per aiutare a sciogliere l'acido kinurenico.
- Preparare ACSF per la registrazione.
- Prendere 1 L standard ACSF (o qualunque lasciato dalla soluzione preparata al punto 1.3) a cui possono essere aggiunti opportuni agenti farmacologici seconda esperimenti pianificati.
- Ad esempio, aggiungere 100 micron picrotoxin quando si registrano le correnti post-sinaptica eccitatoria o potenziali (EPSCs o EPSPS), antagonisti dei recettori del glutammato (kynureL'acido nic, 2 mm; o una combinazione di D-APV 50 mM con CNQX 10 pM) durante la registrazione correnti inibitorie post-sinaptici o potenziali (iPSCs o IPSPs), ed entrambi Picrotoxin e glutammato antagonisti del recettore per valutare neuronale in assenza di qualsiasi influenza di eventi sinaptici.
- Prendere 1 L standard ACSF (o qualunque lasciato dalla soluzione preparata al punto 1.3) a cui possono essere aggiunti opportuni agenti farmacologici seconda esperimenti pianificati.
2. Preparazione Slice
- Costruire o di ottenere una camera di recupero fetta.
Nota: Il principio di una camera di recupero è semplice e può essere effettuata in laboratorio (Figura 1). Brevemente, la camera è un contenitore nel quale è inserito un cestello per contenere le fette di cervello ad un livello che è inferiore alla superficie ACSF. Diverse società scientifiche vendono anche le camere di recupero fetta.- A titolo di esempio, ottenere quattro anelli (4 - alti 6 millimetri) (Figura 1A, vista laterale, b, vista superiore) dal taglio di una siringa da 30 cc. Poi, colla reti allungato (ad esempio, tagliato da un hos nylone) ad un lato degli anelli per tenere le fette di cervello (Figura 1B) e incollare gli anelli insieme.
Nota: Una pistola colla può essere utilizzato. - Una volta che i quattro anelli sono incollati, incollare una parete di plastica a forma di trapezio isoscele curvo a due degli anelli (Figura 1A e B) per deviare bolle di ossigeno dalle fette di cervello recupero (Figura 1C e D). Come mostrato nella Figura 1D, inserire un sistema ad ossigeno diffondente (qui, un tubo di dispersione di gas) sullo stesso lato delle pareti di plastica.
- A titolo di esempio, ottenere quattro anelli (4 - alti 6 millimetri) (Figura 1A, vista laterale, b, vista superiore) dal taglio di una siringa da 30 cc. Poi, colla reti allungato (ad esempio, tagliato da un hos nylone) ad un lato degli anelli per tenere le fette di cervello (Figura 1B) e incollare gli anelli insieme.
- Prima di affettare, ossigenare (95% O 2/5% di CO 2) e raffreddare la soluzione per affettare (vedi punto 1.4) per 0-2 ° C.
- Riempire la camera di recupero personalizzato con ACSF di serie a temperatura ambiente. Assicurarsi che il ACSF è ben ossigenato (20 - 30 min, tempo può variare a seconda del volume della camera) prima di posizionare le fette nella camera di recupero. Assicurarsi che le bolle di gas non vengano a con direttatatto con le fette o interrompere.
- Linea la vaschetta del ghiaccio vibratome con ghiaccio e riempire con acqua fredda in modo che un terzo alla metà della camera di taglio è sommerso. Posizionare accuratamente un sistema di erogazione di ossigeno (ad esempio, gas diffondente pietra) ed una sonda di temperatura nella camera di affettatura così non oggetto interferisce con il movimento della lama o manipolazione slice.
- Preparare l'area dissezione e gli strumenti necessari per estrarre il cervello e sezionare la regione del cervello desiderato.
Nota: La dissezione esatta eseguita dipenderà regione specifica del cervello studiato come diverse strutture cerebrali richiederanno affettare in piani diversi (ad esempio, coronali, sagittali, o fette orizzontali.).- Posizionare i seguenti strumenti su un underpad: forbici la decapitazione, bisturi, piccole dritte forbici punta acuminata, pinze nave incannulamento (o qualsiasi strumento chirurgico con una punta larga, come rongeurs, che è più adatto per crani di ratto), curve pinze emostatiche, TWeezers, spatola, scavare spatola, carta da filtro, piastra di Petri, lama di singolo bordo di rasoio, e colla cianoacrilato.
- Quando la temperatura raggiunge 0 - 2 ° C, trasferire la soluzione affettare alla camera affettatrice (vasca del buffer).
- Anestetizzare il mouse in una camera di essiccazione con isoflurano. quantità esatta può variare a seconda delle dimensioni della camera utilizzata, ma per una piccola gabbia shoebox utilizzare alcune gocce (~ 3 - 4). Lasciare il mouse nella gabbia fino immobile reso (non risponde a stimoli tattili; circa 15 sec per le condizioni descritte qui). Eseguire test di coda e pinch piede per garantire che l'animale è profondamente anestetizzato, poi decapitarlo prima che il cuore smette di battere (migliora la vitalità cellulare).
Nota: Con adeguata giustificazione, alcuni laboratori ottenere l'autorizzazione per eseguire la decapitazione in diretta al fine di minimizzare il più possibile i processi eccitotossici e migliorare la vitalità cellulare. - Eseguire la dissezione.
Nota: Il cervello deve essereestratto rapidamente (<45 sec).- Usando il bisturi tagliare la pelle superficiale, sulla parte superiore del cranio da rostrale a caudale.
- Peel cuoio capelluto su ciascun lato della testa.
- Utilizzando piccole forbici rette punta affilata, tagliare la piastra interparietale lungo la sutura lambdoidea per rimuovere il cervelletto. Rimuovere l'osso occipitale.
- Utilizzando le stesse forbici, tagliare la sutura sagittale.
- Far scorrere la pinza nave incannulamento (o Rongeurs se rompere un teschio topo) sotto ogni ossa parietali e tirare per esporre il cervello.
- Utilizzando le pinze emostatiche curve, stringere le ossa frontali per rompere loro, quindi utilizzare pinzette o le pinze nave incannulamento per rimuovere le ossa rotte. Tagliare e rimuovere la dura madre il più delicatamente possibile in quanto si può interferire con la dissezione.
- Far scorrere la spatola sotto il cervello e tirare delicatamente il cervello fuori dal cranio per posizionarlo nella camera di taglio (vassoio buffer) precedentemente riempito con ACSF ghiacciata. Lasciate che il cervelloraffreddare per 1 - 2 min.
- Preparare la piattaforma di dissezione riempiendo una capsula di Petri con ghiaccio e acqua di ghiaccio per consentire una maggiore superficie di contatto, coprire con il coperchio e mettere un filtro di carta sulla parte superiore. Bagnare la carta da filtro con ACSF freddo.
- Una volta che il cervello è raffreddato, collocare il cervello sul piatto Petri piena di ghiaccio, ed eseguire rapidamente la dissezione appropriata per ottenere il piano desiderato di affettatura.
- Per ottenere fette sagittali contenenti nucleus accumbens (NAC), utilizzare un unico filo della lama di rasoio per tagliare e rimuovere i tubercoli olfattive e il cervelletto se sono ancora presenti. Quindi, eseguire un taglio sagittale di 2 - 3 mm dal bordo laterale dell'emisfero destro per ottenere la superficie piana che sarà incollato sul campione in possesso di piastra (vedere il punto 2.8.11).
Nota: taglio solo 2 - 3 mm dal bordo laterale dell'emisfero permetterà la raccolta di fette contenenti NAc da entrambi gli emisferi. La dissezione appropriata dipenderàsulla regione del cervello che è indagato. Qui, la dissezione viene eseguita neuroni in modo NAC può essere registrati in fettine di cervello sagittali. - Rapidamente colla (con colla cianoacrilato applicata al piatto portacampione tiene) la superficie tagliata piatta del cervello sulla piastra secondo il piano desiderato di affettatura. Per ottenere fettine di cervello sagittali vedere passo 2.8.10.
- Immediatamente posizionare e fissare il campione in possesso di placca nella camera di taglio in modo che il cervello è affettato rostro-caudale (per la sicurezza, ha istituito il supporto della lama solo quando la piastra del campione è assicurato).
- Impostare la vibratome con i parametri appropriati affettatrici (parametri utilizzati in laboratorio per la vibratome cui Materiali: velocità 3-4, 9-10 vibrazioni, e fetta dello spessore di 250 micron).
- Al taglio, utilizzare una pipetta di trasferimento di plastica bordato di trasferire le fette di cervello alla camera di recupero (a temperatura ambiente) (vedi punto 2.3). Il tempo di recupero può variare a seconda del tipo neuronale che è allo studio(Tipicamente 30 - 90 min).
3. Registrazione Micropipette e Preparazione Rig
- Fare riferimento alle linee guida specifiche del manuale d'uso estrattore per ottenere le caratteristiche desiderate micropipetta.
Nota: Per MSN, utilizziamo una serie di resistenza pipetta di 3,2-4,0 MW. - Ossigenare il ACSF e regolare il flusso di 2 ml / min. ACSF vuoto utilizzando un peristaltiche linee pompa o per vuoto installate nella struttura.
- Accendere il controller di riscaldamento perfusione e regolare le impostazioni di temperatura per ottenere la temperatura desiderata (ad esempio, il 31,8 - 32.2 ° C).
Nota: Stabilità di temperatura dipende da avere sia un livello ACSF costante e velocità del flusso costante nella camera. Poiché diverse proprietà biofisiche dei neuroni (ad esempio, la resistenza di ingresso, R i, chiamato anche la resistenza della membrana, R m) sono sensibili alla temperatura, mantenendo una temperatura stabile è importante. - Accendere compuAmplificatore ter-controllato, macchina fotografica, micromanipolatore, e la luce del microscopio sfondo. Se si esegue un esperimento che richiede la stimolazione elettrica del tessuto, accendere controllore stimolo e l'unità di isolamento.
Nota: Alcuni amplificatori da altri produttori di raccomandare un "warm-up" prima dell'uso, quindi si raccomanda di consultare il manuale per la procedura operativa esatto. - Inizia cattura macchina fotografica, l'acquisizione del segnale e il software dell'amplificatore.
- Fetta posizionamento e visualizzazione:
- Usando una pipetta di trasferimento di plastica tagliata a punta, aspirare lentamente in una fetta del cervello dalla camera di recupero.
- Posizionare la pipetta di trasferimento nella camera di registrazione e premere delicatamente la fetta dalla pipetta sul vetrino coprioggetti rivestono il fondo della camera.
Nota: Finché non troppo pieno è in corso, è innocuo per avere qualche ACSF dalla camera di recupero versare nella vasca. - Utilizzare pinze per modificare la posizione della fetta so l'area desiderata sarà posizionato esattamente al centro della camera di registrazione. Utilizzare il microscopio a bassa potenza (4X) lente obiettivo e l'oculare per l'assistenza nel posizionamento.
- Dopo la posizione desiderata è stata raggiunta, fissare la posizione fetta cervello con una fetta hold-down (noto anche come "arpa") nella camera.
- Passare a elevata potenza (40X) lente dell'obiettivo e abbassarlo delicatamente fino a quando il contatto è formata con il ACSF nella camera.
- Usare la ruota di regolazione fine per portare il tessuto a fuoco. Mentre in contatto con il ACSF, non utilizzare la rotella di regolazione grossolana sul microscopio ad abbassare la lente obiettiva eccessivamente può schiacciare la fetta o addirittura rompere il vetrino che costeggiano il fondo della camera, che può causare ACSF versare sul condensatore e danneggiarlo.
- Quando il focus è a livello dei tessuti, osservare le cellule nella regione di destinazione per la forma. Le cellule morte sono facilmente identificabili per la loro membrana plasmatica gonfiato e il nucleo ( Figura 1E). Le cellule sane dovrebbero apparire come rotonda, ovoidale, o strutture omogenee ellittica (Figura 1E).
- Cercare una cellula bersaglio. Segnare sullo schermo del computer, al fine di aiutare a guidare la micropipetta registrazione. Se si utilizza software come QCapture, disegnare un quadrato attorno alla cella di destinazione tenendo premuto il tasto sinistro del mouse.
- Sollevare la lente obiettivo così ci sarà spazio sufficiente nel cono formato dalla lente obiettivo essendo in contatto con il ACSF per posizionare e spostare la micropipetta registrazione.
- Micropipetta Placement e Posizionamento
- Usando una siringa da 1 ml, un ago microsiringa non metallico, ed un filtro dedicato, riempire una micropipetta con la soluzione interna preparata in anticipo secondo l'esperimento pianificata (K + sede o Cs + -based soluzione interna, vedere i passi 1.1., 1.2 e materie per la composizione). Utilizzare abbastanza soluzione in modo che il internasoluzione viene a contatto con l'elettrodo a filo di argento cloruro rivestite all'interno del supporto micropipetta.
Nota: L'elettrodo filo d'argento può essere clorata immergendola in candeggina. trifosfati nucleosidici (ATP e GTP) possono essere aggiunti alla soluzione interna prima dell'uso. Tenere la siringa contenente la soluzione in ghiaccio per evitare il degrado ATP / GTP. - Assicurarsi che non vi siano bolle d'aria nel micropipetta in quanto possono venire fuori mentre la micropipetta è nel tessuto e oscurano la fetta.
- Posizionare la micropipetta nel supporto dell'elettrodo per cui la soluzione viene a contatto con l'elettrodo a filo cloruro d'argento rivestito.
- Serrare il tappo pipetta in modo che la rondella cono formerà un sigillo intorno alla micropipetta.
- Applicare una pressione positiva prima di immergere la micropipetta nel ACSF per evitare che i detriti di entrare nella pipetta.
- Posizionare headstage in posizione di blocco (verso la camera), e utilizzando il micromanipolatore, guide giù verso la camera in modo che è approssimativamente sotto il centro dell'obiettivo immersa.
- Durante lo spostamento della micropipetta con micromanipolatore (fissato a media ad alta velocità), utilizzare lo schermo del computer per individuare la micropipetta e guidarlo verso la posizione della cella sull'asse XY.
- Misurare la resistenza micropipetta applicando un gradino di tensione (per esempio, 4 mV per 100 msec), che può essere eseguita manualmente o automaticamente mediante software specifico come la modalità 'vasca' se utilizza "Test membrana" nel software Clampex (vedi anche punto 4) . Per assicurarsi che non bolle d'aria o di altri corpi estranei bloccano la micropipetta, applicare pressione positiva usando la siringa piena d'aria (ad esempio, 30 cc siringa) collegato al supporto micropipetta con tubo in polietilene.
- Dopo aver eliminato la micropipetta, eseguire un offset per ridurre la corrente pipetta a zero tensione, che può essere eseguita manualmente o tramite software specifico come & #39; compensato 'sul comandante amplificatore controllato dal computer pipetta.
Nota: Questa funzione di compensare qualsiasi tensione causata da differenze di concentrazione tra la vasca e le soluzioni micropipetta (cioè, liquido potenziale svincolo 20).
- Usando una siringa da 1 ml, un ago microsiringa non metallico, ed un filtro dedicato, riempire una micropipetta con la soluzione interna preparata in anticipo secondo l'esperimento pianificata (K + sede o Cs + -based soluzione interna, vedere i passi 1.1., 1.2 e materie per la composizione). Utilizzare abbastanza soluzione in modo che il internasoluzione viene a contatto con l'elettrodo a filo di argento cloruro rivestite all'interno del supporto micropipetta.
4. Prova a membrana
Nota: Questo passaggio si applica all'amplificatore menzionato nei Materiali.
- Quando si utilizza un computer controllato comandante amplificatore, impostare sempre su modalità tensione-clamp per eseguire il test della membrana.
Nota: Quando la prova membrana è impostato in modalità "bagno", il test membrana consente la misurazione della resistenza micropipetta e la resistenza tenuta quando si forma il sigillo. - Una volta che la membrana si rompe (vedi passo 5.8), passa il test membrana modalità "Cell", in modo che la resistenza serie (R s) (chiamato anche resistenza di accesso, R a), R i e capacità di membrana (C p) puòessere ottenuto.
5. Final Approach, Formazione Seal, e ottenere la cellula intera configurazione
- Utilizzando la ruota messa a fuoco fine, iniziare a concentrarsi verso il basso, riducendo al contempo la micropipetta a poco a poco. Sempre concentrarsi verso il basso e poi abbassare la micropipetta verso il basso rispetto al piano di messa a fuoco. Questo farà sì che la punta micropipetta non bruscamente penetrare nella fetta.
- Quando la micropipetta viene a contatto con la superficie della fetta, rallentare la velocità micromanipolatore nella modalità a medio-bassa.
- applicare una leggera pressione positiva leggera con la siringa piena d'aria collegato al titolare pipetta per eliminare tutti i residui dal percorso di avvicinamento.
- Approccio cella sia con tensione alternata con le manopole XYZ, o avvicinandosi diagonale (se il modello micromanipolatore consente) in cui entrambi gli assi XZ vengono modificate con la rotazione della manopola dell'asse Z. Quest'ultimo metodo impedirà compressione verticale di tessuto.
Nota: Qui, l'obiettivo èavvicinare la cella infliggendo danno minimo per la fetta. Quando la micropipetta è abbastanza vicino alla cella appare una fossetta (a scolorimento giro di superficie cellulare causata dalla pressione positiva applicata attraverso la punta della micropipetta) (Figura 2). - Quando la fossetta (Figura 2-1), applicare una aspirazione debole e breve attraverso il tubo che è collegato al tubo di aspirazione titolare pipetta in modo da creare la guarnizione (Figura 2-2). Continuare a monitorare il test della membrana.
Nota: Se si forma una tenuta parziale (<1 G), l'iniezione di correnti negative abbassando il potenziale tenendo (il comandante amplificatore controllato dal computer) può facilitare la formazione di tenuta e raggiungere gigaohms resistenza ( "sigillo gigaohm" o "gigaseal"> 1 - 5 GΩ). L'elevata resistenza della guarnizione (> 1 G) saranno entrambi contaminazione rumore limite al segnale registrato e contribuire alla stabilità meccanica delpatch. - Mentre un gigaseal sta formando, utilizzare il telecomando dell'amplificatore controllato dal computer per portare partecipazione potenziale della cella più vicino possibile fisiologici potenziale di riposo (V riposo) al fine di evitare variazioni repentine volta la membrana si rompe. Ad esempio, MSN sono di solito tensione bloccato a -70 o -80 mV (fisiologica V riposo: -70 a -90 mV).
- Dopo il gigaseal ha formato, compensare capacitanza veloce e lento manualmente o automaticamente. Se si utilizza un computer controllato comandante amplificatore come Multiclamp comandante, premere 'Auto' per 'Cp Fast' e 'Cp lento ".
- Se la guarnizione rimane stabile e sopra 1 G (o parenterale meno di 10 - 20 pA per tenere la cella nel potenziale di membrana desiderata), applicare una breve e forte aspirazione attraverso il tubo stesso come in 5.5 a rompere la membrana plasmatica (Figura 2 -3).
Nota: Questa operazione potrebbe richiedere diversi studi. Un buon rottura della membrana si ottiene wgallina aspirazione viene eseguita abbastanza forte in modo che la membrana rottura non intasare la micropipetta (che può portare ad un aumento della R s durante la registrazione), ma abbastanza debole per non disegnare in una grande porzione della membrana e la cella. - Dopo aver raggiunto una cellula intera configurazione di successo, controllare regolarmente la posizione micropipetta per valutare e correggere la deriva significativo in quanto può portare alla perdita della patch. Drift ampiezza può variare in funzione di diversi fattori, ad esempio, la qualità dell'installazione rig e forze di trazione sul headstage. Idealmente, la deriva dovrebbe essere quasi inesistente.
- Passando alla modalità "Cell" nel test a membrana, visualizzare diversi parametri della cella come R, R s e C p. Monitorare questi parametri durante la registrazione.
Nota: Tutti questi parametri possono aiutare a valutare lo stato di salute iniziale delle cellule e tipi di cellule (sezione vedere "prova a membrana", punto 4). - Una volta esimoe sopra passaggi sono stati completati, rimane in modalità di tensione-clamp per misurare le correnti (ad esempio, EPSCs, IPSCs), o passare alla modalità corrente-clamp se la pianificazione per misurare variazioni del potenziale di membrana (ad esempio, del potenziale d'azione di tiro). Per questi ultimi, iniettare corrente positiva o negativa per tenere la cella nel potenziale di membrana desiderata (per eseguire questa operazione, fare riferimento all'amplificatore guida manuale).
Risultati
Temperatura, un fattore che è facilmente controllato dallo sperimentatore, influenza le proprietà biofisiche di canali ionici e recettori, e quindi la forma d'onda delle correnti post-sinaptiche (PSC) (EPSC e iPSCs) e la capacità dei neuroni di suscitare picchi. Figura 3 la figura 4 mostra l'effetto della temperatura sulla neuronale e la pendenza della EPSCs evocati (eEPSCs) rispettivamente. Il pattern di cottura (Figura 3) (cioè, la latenza per il picco 1 °, picco numero, frequenza, e potenziali di azione waveform) è modellato da una apertura e chiusura di specifici canali ionici voltaggio-dipendenti temporizzato e coordinata (Na +, Ca 2 + e K +), un processo sensibile alla temperatura. la Figura 3 mostra come il numero medio di picco aumenta con la temperatura. Si noti che in condizioni sperimentali qui descritte (registrazioni MSN) anche se freque picconcy non sembra essere modificata a temperatura subphysiological (28 ° C), aumenta in modo significativo quando la temperatura raggiunge il livello fisiologicamente rilevanti (32 ° C). La figura 4A mostra un esempio di come la pendenza di eEPSCs, un parametro che viene comunemente utilizzato per valutare la forza sinaptica, aumenta con la temperatura.
Anche se R s può essere in qualche modo controllata dallo sperimentatore, vale a dire, attraverso un'apertura di membrana efficiente durante la transizione dallo stato di tenuta a cellula intera configurazione, R solito è lentamente aumenta durante la registrazione. Questo può essere il risultato di vari eventi incontrollabili, per esempio, membrana richiusura o detriti intasamento la punta della pipetta durante la registrazione. Un tentativo di riaprire la membrana applicando un leggero vuoto, anche se potrebbe compromettere la patch, a volte può aiutare a mantenere una stabile R s. In tutti i casi, perché i cambiamenti R s possibile alter la forma d'onda del segnale elettrico in fase di studio, deve essere attentamente monitorata, in particolare quando si registra PSC (modo tensione-clamp). Figura 4 mostra che quando aumenta R s (Figura 4B), l'ampiezza delle correnti mediate dai recettori del glutammato (eEPSCs ) diminuisce (Figura 4C, D). Tipicamente, sperimentatori scartano i dati quando variazioni R s supera il 15% (per esempio, questo laboratorio), tuttavia alcuni laboratori fanno da una variazione del 20%. Questo criterio deve essere indicato nella sezione Metodo dell'articolo.
Per un neurone definito, Ri possono essere influenzati da diversi fattori, tra cui la temperatura, la salute delle cellule, e la qualità delle patch. In particolare, quando R i diminuisce, ampiezze PSC o capacità dei neuroni di generare picchi diminuisce anche. Ad esempio, la Figura 4E mostra che quando R i non varia significativamente, the il numero di punte rimangono relativamente stabili (Neuron 1); e quando R i aumenta, il numero di picchi aumenta pure (Neuron 2). Pertanto, e in modo simile a R s, R devo essere attentamente monitorati, il 10% sono sufficienti modifiche ai dati di polarizzazione.
Come descritto sopra, è fondamentale per controllare o monitorare la temperatura, R s e R i durante le registrazioni. Per esempio, ha osservato cambiamenti nel segnale che è in fase di studio (PSC o cottura) può essere dovuto a cambiamenti (o una mancanza di controllo) di questi fattori, piuttosto che l'effetto di manipolazioni sperimentali, ad esempio, pre vs post-effetti di applicazione vasca di droga.

Figura 1. Su ordine di recupero Camera (AD) e l'immagine di un cervello fetta a 400X Visualizzazione sano e Dead Neuroni (E). ANNO DOMINI)La procedura per fare una camera di recupero personalizzato è descritto al punto 2.1. E) Immagine della CNA MSN mediale della shell in una fetta del cervello a 400X che mostra esempi di (frecce rosse sani) vs. neuroni morti (frecce blu). Si noti che, anche se alcune cellule sono indicati come sano, il loro aspetto sferica indicano che essi non possono essere sano come desiderato (frecce rosse con l'asterisco). Lo stato di salute finale è valutata sulla base di riposo V e R i dopo aver raggiunto cellula intera configurazione. Fai clic qui per vedere una versione più grande di questa figura.

Figura 2. Schema raffigurante le fasi procedurali di base per ottenere un Gigaseal e stabilire la cellula intera configurazione. Quando la micropipetta è abbastanza vicino a the cellule per creare una fossetta nella membrana plasmatica (step 1, Approach), applicare una breve e leggera aspirazione per creare uno stretto contatto tra la micropipetta e la membrana plasmatica. Se eseguita correttamente, il contatto rafforzerà e la resistenza aumenterà e raggiungerà 1 G (gigaseal) o più (fase 2, la formazione di Seal). Una volta che il sigillo è stabile e soprattutto 1 G, applicare una aspirazione breve e forte per rompere la membrana plasmatica (passaggio 3, cellula intera configurazione). Il raggiungimento della configurazione cellula intera permetterà continuità tra il citoplasma e l'interno micropipetta. Per i dettagli, vedere il passaggio del protocollo 5.1-5.8. Cliccate qui per vedere una versione più grande di questa figura.
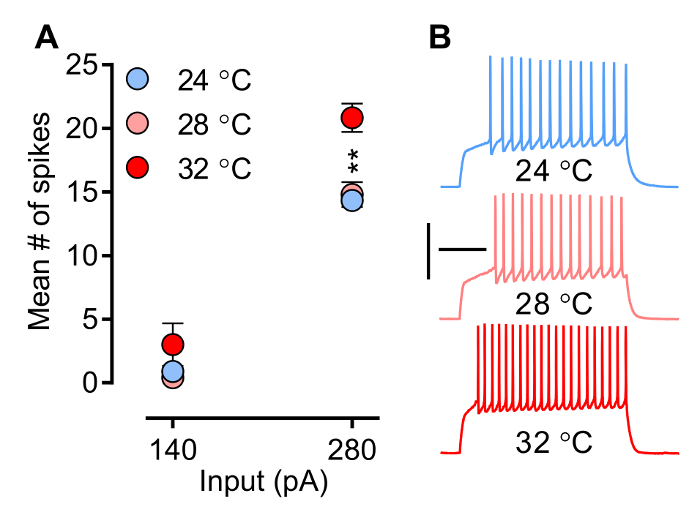
Figura 3. neuronale di cottura (intrinseca Eccitabilità) è valutata in Current-vongole Modalità p. Qui, una serie di pre-definiti e incrementale di passaggi di corrente è dato in modo da ottenere cambiamenti nella tensione della membrana, e quindi innescare potenziali d'azione. A) Numero medio picco aumenta con la temperatura. traccia B) campione a 280 pA da NAC MSN guscio mediale a tre temperature diverse (24 ° C, n = 9; 28 ° C, n = 5; e 32 ° C, n = 6). La temperatura nella camera di registrazione influisce direttamente frequenza spike. Tuttavia, si noti che anche se la frequenza spike non sembra essere modificata a temperatura subphysiological, aumenta in modo significativo quando la temperatura raggiunge i 32 ° C, una temperatura fisiologicamente rilevanti. I neuroni sono tenuti a -80 mV. ANOVA a due vie: interazione, p <0,0001; effetto di temperatura, p = 0,0041; test post hoc: 24 ° C e 28 ° C sono entrambi significativamente diversi da 32 ° C, ** p <0.01. I dati sono rappresentati come media ± SEM. Calibrazione: 200 msec, 50 mV.jove.com/files/ftp_upload/54024/54024fig3large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.

Figura 4. Effetto della temperatura, R s e R i sulla forma d'onda del segnale elettrico in fase di studio. A) Esempio di eEPSC ampiezza da un singolo NAc shell MSN. Aumentando la temperatura dal 24 al 28 ° C e 32 ° C aumenta la pendenza della eEPSCs. Si noti che le variazioni di temperatura indotte in pendenza eEPSCs si verificano rapidamente. Qui, pendenza eEPSCs è valutata in modalità voltage-clamp. Calibrazione: 5 msec, 100 pA BD) Esempio di eEPSCs pista da un unico NAc shell MSN.. Quando aumenta R s (B), la pendenza della eEPSCs diminuisce (C). D) Analisi di correlazione di pendenza eEPSC in funzione di Rs. R di Pearson = -0,5717, p <0,0001. I neuroni sono Esempio di tracce da due neuroni che mostrano l'effetto di Ri dalla capacità del neurone di generare picchi di tensione bloccato a -80 mV. E). I neuroni sono in corso-serrata, e ha tenuto a -80 mV. Calibrazione:. 200 msec, 50 mV Clicca qui per vedere una versione più grande di questa figura.
Discussione
Questo protocollo descrive la procedura di base per l'esecuzione di cellule intere esperimenti di patch-clamp su neuroni in fettine di cervello. Tuttavia, la complessità, il potenziale e la sensibilità di questa tecnica non possono essere completamente descritti in questo articolo. Qui, abbiamo cercato di delineare i passaggi più elementari e sottolineare parametri importanti che devono essere controllati per ottenere registrazioni cellule intere di successo e rigorose. Per ulteriori apprendimento teorico, molti libri e articoli sono stati pubblicati su entrambi cellula intera registrazione patch-clamp in fettine di cervello 3,21-24 e metodi che possono perfezionare le soluzioni utilizzate 25-27 al fine di migliorare la vitalità delle cellule. Per eseguire routine registrazioni appropriate, è necessario miglioramento delle competenze tecniche attraverso la pratica intensiva. ore Tuttavia, con una corretta applicazione dei passaggi accennato, le cellule possono essere combinati post mortem, che forniscono importanti informazioni su cambiamenti delle funzioni sinaptiche e excitabi intrinsecalità.
In generale, oltre l'importanza di preparare con attenzione entrambe le soluzioni ACSF e micropipetta interno, ogni passo dalla dissezione del cervello, affettare, ottenendo cellula intera configurazione di successo, e ottenere dati rigoroso e imparziale richiede pratica intensiva. In primo luogo, è fondamentale per generare sezioni di cervello sane. Brevemente, rapida dissezione del cervello (idealmente <45 sec), il mantenimento di una bassa temperatura (0 - 2 ° C) mentre affettare, e soluzioni adeguate affettatura tutti svolgono un ruolo importante nel garantire la salute delle cellule. È degno di nota ricordare che le soluzioni affettatrici possono differire tra laboratori e in base al tipo di cellula e / o di una regione del cervello che saranno oggetto di indagine. Quando affettare striato NAc o dorsale, il nostro laboratorio e altri utilizzano l'acido kinurenico per la soluzione taglio per ridurre al minimo i processi eccitotossici 28-33, tuttavia, possono essere utilizzati anche altri metodi, come ad esempio soluzioni di saccarosio a base 34, alta Mg 2+ / bassi soluzioni Ca 2+ 35, ecc. Questi sono solo alcuni esempi e possono essere regolati in base alla sensibilità della regione del cervello o cervello di processi eccitotossici (ad esempio, a causa di età). Per ulteriori informazioni sulle soluzioni e vitalità cellulare, si prega di consultare 25-27. In definitiva, la concentrazione di anioni, cationi e altri farmaci (ad esempio, ascorbato, recettore del glutammato antagonisti) che compongono soluzioni affettatrici è determinato in modo che imita liquido cerebrospinale e minimizza il più possibile i processi che si verificano durante eccitotossici affettatura. Il protocollo presentato in questo articolo descrive soluzioni standard che sono stati regolarmente utilizzati in precedenti studi degli autori 28-31 quando si registra da MSN nel NAc o striato dorsale in fettine di cervello. Inoltre, la corretta regolazione della osmolarità per entrambe le soluzioni ACSF e micropipetta interno sono fondamentali per la formazione della guarnizione di successo e la manutenzione di conf whole-celliguration. Per creare un gradiente di concentrazione da soluzione extracellulare soluzione intra-pipetta, ACSF osmolarità deve essere superiore per soluzioni micropipetta interne. Idealmente, la differenza può variare da 10 a 30 mOsm.
Il raggiungimento di un cellula intera configurazione di successo è un altro passo importante per lo svolgimento delle registrazioni efficienti. Innanzitutto, pipetta capacità può essere regolata una volta che la pipetta viene posto nel bagno. Anche se le impostazioni automatiche di solito sono impostati correttamente, si consiglia di utilizzare le regolazioni veloci e lente di capacità delle cellule con cautela in quanto potrebbero danneggiare la cellula quando non è eseguita in modo appropriato. In secondo luogo, breve aspirazione membrana che è necessario per rompere la membrana porterà ad una significativa apertura della membrana, e quindi consentire una buona comunicazione tra intracellulare e intra-micropipetta ambiente. Questo farà sì che R s rimarrà relativamente stabili durante la registrazione. Se si utilizza la soluzione micropipetta Cs-based,il potenziale di membrana di riposo dovrebbe essere valutata immediatamente dopo la costituzione della cellula intera configurazione (vedi punto 5.8). Infatti, la diffusione di Cs + all'interno della cellula causa la perdita di potenziale di membrana di riposo. Per determinare il potenziale di riposo corretta, il potenziale giunzione liquida deve essere valutato 20. Tuttavia, lo sperimentatore può segnalare il potenziale di riposo che si osserva dopo la rottura della membrana (dopo il passo 5.8) e scegliere di non registrare per ottenere il potenziale di giunzione liquida. In ogni caso, va menzionato nella sezione Metodo dell'articolo. Su istituzione della cellula intera configurazione, C p può anche essere ottenuto e può essere utilizzato come un parametro indiretto per valutare la salute delle cellule e / o il tipo di cellula. In terzo luogo, quando le registrazioni hanno iniziato, gli altri parametri devono essere rigorosamente controllati. I fattori critici che devono essere controllati al momento di valutare l'eccitabilità neuronale sono la temperatura, R s e R i.
Comedi cui sopra, R i e C p può essere indicativo di salute delle cellule e / o il tipo di cellula. Ad esempio, la membrana plasmatica, che agisce come un isolante, separa carica (risultante dalla diversa composizione del intracellulari ed extracellulari soluzioni), che insieme costituiscono la capacità di membrana. Più grande è la superficie della membrana (specifico neuronale), maggiore è la capacità. È allora non sorprende che specifica i tipi neuronali mostra C p e R i (matematicamente legato al C p) che sono all'interno della stessa gamma. R s è direttamente correlata alla dimensione della punta della pipetta, e, pertanto, di solito è indicativo della qualità o la dimensione di apertura della membrana. Brevemente, dopo istituisce cellula intera configurazione, il citoplasma diventa elettricamente continuo con la soluzione nel micropipetta e completamente isolato dal mezzo esterno. R s (o R a) proviene dalla resistenza dei current di fluire da pipetta citoplasma. Per alcune condizioni di ripresa (ad esempio, in modalità corrente-clamp o registrazione voltage-clamp di correnti ioniche voltaggio-dipendenti), R s deve essere compensato in modo appropriato (fare riferimento al Rif. 3,21-24 o guida manuale di amplificatore di risarcimento adeguato R s) .
Come descritto in figura 4, R s è particolarmente importante in quanto può influenzare notevolmente la forma d'onda del segnale elettrico, ad esempio, EPSC ampiezza. Tuttavia, R s devono essere attentamente monitorati per interpretazioni off-line di eventuali effetti osservati. Nel caso la membrana non sia stato rotto correttamente, punta micropipetta intasamento o richiusura della membrana può verificarsi, nel quale gli aumenti caso R s e polarizzazione della forma d'onda del segnale elettrico in studio (Figura 4B-D). In sintesi, i numerosi problemi si possono incontrare durante la registrazione, e di quelli di solito rientrano in tre categorie: i) il tessuto-correlato, Ad esempio, un aumento della mortalità delle cellule a causa della scarsa dissezione, disadattamento di ACSF osmolarità, e ipossia; ii) apparecchiature connesse, ad esempio, problemi di rumore e di messa a terra, il controllo della temperatura, fetta e micropipetta posizionamento, ecc.; e iii) interpretazione dei dati, ad esempio, i cambiamenti osservati possono essere il risultato di artefatti sperimentali indesiderate polarizzazione dati come i cambiamenti nei parametri di forma d'onda che alterano elettrici (R, R s, temperatura, vedi figura 3 e 4), piuttosto che il risultato sperimentale manipolazioni.
Anche se la registrazione a cellula intera in fettine di cervello è una tecnica potente per valutare la plasticità esperienza-dipendente, questo approccio limita l'interpretazione dei dati. In particolare, tre importanti limitazioni di tecnica di registrazione a cellula intera sono che: (i) i cambiamenti nei livelli di funzionalità e di espressione di proteine specifiche (ad esempio, canali ionici) non possono essere distinti; (Ii) perché questotecnica valuta flusso di corrente attraverso l'intera membrana (o parte sostanziale), non fornisce accurata localizzazione sub-cellulare delle correnti ioniche o cambiamenti che si osservano; e (iii) invasività della cellula intera configurazione porta alla dialisi del contenuto della cella, e quindi alla rottura del macchinario molecolare intracellulare necessario per alcuni fenomeni di sviluppare o espresse. Un modo per evitare la dialisi è quello di utilizzare le registrazioni elettrodo taglienti o la tecnica del patch perforato 3,21,23. Per quanto riguarda questi ultimi, formano pori molecole antibiotiche come nistatina può essere aggiunto alla soluzione pipetta. La formazione di questi pori permetterà la registrazione di correnti senza interrompere il secondo meccanismi messaggero all'interno della cellula. Tuttavia, i recenti progressi nel campo delle nanotecnologie e lo sviluppo di nanoelettrodi 36 offrono potenti strumenti per migliorare le registrazioni neuronali. Tale progresso tecnologico nel campo delle neuroscienze sono ancora in fase SVILUPPOt e sono ora mettendo a nostra portata la possibilità di effettuare registrazioni di patch-clamp e intracellulari con invasività minima, vale a dire, mantenendo intatto l'ambiente intracellulare, e indagare le funzioni dei canali ionici entro compartimenti sub-cellulari che erano finora non accessibili con la classica elettrodi di patch-clamp 37.
Divulgazioni
Nessuno degli autori hanno interessi concorrenti o interessi in conflitto.
Riconoscimenti
Questa ricerca è stata sostenuta da UT Southwestern fondi di avvio (SK).
Materiali
| Name | Company | Catalog Number | Comments |
| Isolated pulse stimulus generator | A.M.P.I | Master-8 | |
| Isolation unit (ISO-Flex) | A.M.P.I | ISO-Flex | |
| Computer controlled Amplifier | Molecular Devices | Multiclamp 700B | |
| Digital Acquisition system | Molecular Devices | Digidata 1500 | |
| Microscope | Olympus | BX-51 | |
| Micromanipulator | Sutter Instruments | MPC-200 | |
| Chamber and in-line Heater | Warner Instruments | TC-344B | |
| Vibratome Slicer | Leica | VT1000 S | |
| Micropipette Puller | Narishige | PC-10 | |
| Imaging Camera | Q Imaging | QIClick-F-M-12 | |
| Narishige pipette puller PC-10 | Narishige | PC-10 | |
| Glass capillaries | WPI | TW150F-3 | |
| Slice hold-down (harp) | Warner Instruments | 64-0255 | |
| Slice Chamber | Warner Instruments | RC-26 | |
| Nonmetallic syringe needle | World Precision Instruments | MF28G67-5 | |
| Syringe filters | Nalgene | 176-0045 | |
| Glue Gun | Home Depot | various | |
| Gas dispersion tube | Ace Glass Inc. | various | |
| Decapitation scissors | Home Depot | 100649198 | |
| Scalpel Handle #3 | World Precision Instruments | 500236 | |
| Small straight sharp tips scissors | World Precision Instruments | 14218 | |
| Vessel canulation forceps | World Precision Instruments | 500453 | |
| Curved hemostatic forceps | World Precision Instruments | 501288 | |
| Economy Tweezers #3 | World Precision Instruments | 501976-6 | |
| Spatula | Fisher Scientific | 14357Q | |
| Scooping spatula | Fisher Scientific | 14-357Q | |
| Petri dish | Fisher Scientific | 08-747B | |
| Filter paper | Lab Depot | CFP1-110 | |
| Solutions | |||
| Cs-Gluconate internal solution (pH 7.2–7.3, 280–290 mOsm) | |||
| D-gluconic acid 50% | Sigma Aldrich/various | G1951 | |
| Cesium-OH (CsOH) 50% | Sigma Aldrich/various | 232041 | |
| NaCl, 2.8 mM | Sigma Aldrich/various | S7653 | |
| HEPES, 20 mM | Sigma Aldrich/various | H3375 | |
| EGTA, 0.4 mM | Sigma Aldrich/various | E4378 | |
| tetraethylammonium-Cl, 5 mM | Sigma Aldrich/various | T2265 | |
| Na2GTP, 0.3 mM | Sigma Aldrich/various | G8877 | |
| MgATP, 2 mM | Sigma Aldrich/various | A9187 | |
| K-Gluconate internal solution (pH 7.2–7.3, 280–290 mOsm) | |||
| K D-gluconate, 120 mM | Sigma Aldrich/various | G4500 | |
| KCl, 20 mM | Sigma Aldrich/various | P3911 | |
| HEPES, 10 mM | Sigma Aldrich/various | H3375 | |
| EGTA, 0.2 mM | Sigma Aldrich/various | E4378 | |
| MgCl2 | Sigma Aldrich/various | M8266 | |
| Na2GTP, 0.3 mM | Sigma Aldrich/various | G8877 | |
| MgATP, 2 mM | Sigma Aldrich/various | A9187 | |
| Standard artificial cerebrospinal fluid (ACSF, osmolarity ≈ 300-310 mOsm) | |||
| KCl, 2.5 mM | Sigma Aldrich/various | P3911 | |
| NaCl, 119 mM | Sigma Aldrich/various | S7653 | |
| NaH2PO4•H2O, 1 mM | Sigma Aldrich/various | S9638 | |
| NaHCO3, 26.2 mM | Sigma Aldrich/various | S8875 | |
| Glucose, 11 mM | Sigma Aldrich/various | G8270 | |
| MgSO4-7H2O, 1.3 mM | Sigma Aldrich/various | 230391 | |
| CaCl2-2H2O, 2.5 mM | Sigma Aldrich/various | C3881 | |
| Additional compounds used for solutions preparation | |||
| KOH | various | ||
| Kynurenic acid | Sigma Aldrich/various | K3375 | |
Riferimenti
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibres. Nature. 260 (5554), 799-802 (1976).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annu Rev Physiol. 46, 455-472 (1984).
- Cahalan, M., Neher, E. Patch clamp techniques: an overview. Methods Enzymol. 207, 3-14 (1992).
- Staley, K. J., Otis, T. S., Mody, I. Membrane properties of dentate gyrus granule cells: comparison of sharp microelectrode and whole-cell recordings. J Neurophysiol. 67 (5), 1346-1358 (1992).
- Horn, R., Marty, A. Muscarinic activation of ionic currents measured by a new whole-cell recording method. J Gen Physiol. 92 (2), 145-159 (1988).
- Pusch, M., Neher, E. Rates of diffusional exchange between small cells and a measuring patch pipette. Pflugers Arch. 411 (2), 204-211 (1988).
- Kandel, E. R., Dudai, Y., Mayford, M. R. The molecular and systems biology of memory. Cell. 157 (1), 163-186 (2014).
- Kourrich, S., Bonci, A. Chapter 5: Synaptic and Neural plasticity. Neurobiology of Mental Illness. 4th edn. , (2013).
- Mozzachiodi, R., Byrne, J. H. More than synaptic plasticity: role of nonsynaptic plasticity in learning and memory. Trends Neurosci. 33 (1), 17-26 (2010).
- Zhang, W., Linden, D. J. The other side of the engram: experience-driven changes in neuronal intrinsic excitability. Nat Rev Neurosci. 4 (11), 885-900 (2003).
- Kourrich, S., Calu, D. J., Bonci, A. Intrinsic plasticity: an emerging player in addiction. Nat Rev Neurosci. 16 (3), 173-184 (2015).
- Luscher, C., Malenka, R. C. Drug-evoked synaptic plasticity in addiction: from molecular changes to circuit remodeling. Neuron. 69 (4), 650-663 (2011).
- McEwen, B. S., Morrison, J. H. The brain on stress: vulnerability and plasticity of the prefrontal cortex over the life course. Neuron. 79 (1), 16-29 (2013).
- Sandi, C., Haller, J. Stress and the social brain: behavioural effects and neurobiological mechanisms. Nat Rev Neurosci. 16 (5), 290-304 (2015).
- Kim, S. J., Linden, D. J. Ubiquitous plasticity and memory storage. Neuron. 56 (4), 582-592 (2007).
- Ganguly, K., Poo, M. M. Activity-dependent neural plasticity from bench to bedside. Neuron. 80 (3), 729-741 (2013).
- Kullmann, D. M., Moreau, A. W., Bakiri, Y., Nicholson, E. Plasticity of inhibition. Neuron. 75 (6), 951-962 (2012).
- Bar-Yehuda, D., Korngreen, A. Space-clamp problems when voltage clamping neurons expressing voltage-gated conductances. J Neurophysiol. 99 (3), 1127-1136 (2008).
- Williams, S. R., Mitchell, S. J. Direct measurement of somatic voltage clamp errors in central neurons. Nat Neurosci. 11 (7), 790-798 (2008).
- Neher, E. Correction for liquid junction potentials in patch clamp experiments. Methods Enzymol. 207, 123-131 (1992).
- Defelice, L. J. . Electrical Properties of Cells-Patch Clamp for Biologists. , (1997).
- Kornreich, B. G. The patch clamp technique: principles and technical considerations. J Vet Cardiol. 9 (1), 25-37 (2007).
- Molleman, A. . Patch Clamping: An Introductory Guide To Patch Clamp Electrophysiology. , (2003).
- Neher, E., Sakmann, B. The patch clamp technique. Sci Am. 266 (3), 44-51 (1992).
- Richerson, G. B., Messer, C. Effect of composition of experimental solutions on neuronal survival during rat brain slicing. Exp Neurol. 131 (1), 133-143 (1995).
- Tanaka, Y., Tanaka, Y., Furuta, T., Yanagawa, Y., Kaneko, T. The effects of cutting solutions on the viability of GABAergic interneurons in cerebral cortical slices of adult mice. J Neurosci Methods. 171 (1), 118-125 (2008).
- Ye, J. H., Zhang, J., Xiao, C., Kong, J. Q. Patch-clamp studies in the CNS illustrate a simple new method for obtaining viable neurons in rat brain slices: glycerol replacement of NaCl protects CNS neurons. J Neurosci Methods. 158 (2), 251-259 (2006).
- Kourrich, S., et al. Dynamic interaction between sigma-1 receptor and Kv1.2 shapes neuronal and behavioral responses to cocaine. Cell. 152 (1-2), 236-247 (2013).
- Kourrich, S., Klug, J. R., Mayford, M., Thomas, M. J. AMPAR-Independent Effect of Striatal aCaMKII Promotes the Sensitization of Cocaine Reward. J Neurosci. , (2012).
- Kourrich, S., Rothwell, P. E., Klug, J. R., Thomas, M. J. Cocaine experience controls bidirectional synaptic plasticity in the nucleus accumbens. J Neurosci. 27 (30), 7921-7928 (2007).
- Kourrich, S., Thomas, M. J. Similar neurons, opposite adaptations: psychostimulant experience differentially alters firing properties in accumbens core versus shell. J Neurosci. 29 (39), 12275-12283 (2009).
- Rothwell, P. E., Kourrich, S., Thomas, M. J. Environmental novelty causes stress-like adaptations at nucleus accumbens synapses: implications for studying addiction-related plasticity. Neuropharmacology. 61 (7), 1152-1159 (2011).
- Rothwell, P. E., Kourrich, S., Thomas, M. J. Synaptic adaptations in the nucleus accumbens caused by experiences linked to relapse. Biol Psychiatry. 69 (11), 1124-1126 (2011).
- Koya, E., et al. Silent synapses in selectively activated nucleus accumbens neurons following cocaine sensitization. Nat Neurosci. 15 (11), 1556-1562 (2012).
- Conrad, K. L., et al. Formation of accumbens GluR2-lacking AMPA receptors mediates incubation of cocaine craving. Nature. 454 (7200), 118-121 (2008).
- Kruskal, P. B., Jiang, Z., Gao, T., Lieber, C. M. Beyond the patch clamp: nanotechnologies for intracellular recording. Neuron. 86 (1), 21-24 (2015).
- Novak, P., et al. Nanoscale-targeted patch-clamp recordings of functional presynaptic ion channels. Neuron. 79 (6), 1067-1077 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Tutti i diritti riservati
Utilizziamo i cookies per migliorare la tua esperienza sul nostro sito web.
Continuando a utilizzare il nostro sito web o cliccando “Continua”, accetti l'utilizzo dei cookies.