Method Article
Mutlak Protein Niceleme Kütle Spektrometresi İzleme Seçilen Tepki
Bu Makalede
Özet
This protocol describes how to perform absolute quantification assays of target proteins within complex biological samples using selected reaction monitoring. It was used to accurately quantify proteins of the mouse macrophage chemotaxis signaling pathway. Target peptide selection, assay development, and qualitative and quantitative assays are described in detail.
Özet
Absolute quantification of target proteins within complex biological samples is critical to a wide range of research and clinical applications. This protocol provides step-by-step instructions for the development and application of quantitative assays using selected reaction monitoring (SRM) mass spectrometry (MS). First, likely quantotypic target peptides are identified based on numerous criteria. This includes identifying proteotypic peptides, avoiding sites of posttranslational modification, and analyzing the uniqueness of the target peptide to the target protein. Next, crude external peptide standards are synthesized and used to develop SRM assays, and the resulting assays are used to perform qualitative analyses of the biological samples. Finally, purified, quantified, heavy isotope labeled internal peptide standards are prepared and used to perform isotope dilution series SRM assays. Analysis of all of the resulting MS data is presented. This protocol was used to accurately assay the absolute abundance of proteins of the chemotaxis signaling pathway within RAW 264.7 cells (a mouse monocyte/macrophage cell line). The quantification of Gi2 (a heterotrimeric G-protein α-subunit) is described in detail.
Giriş
Kütle spektrometrisi (MS) kullanmak proteomik deneyler hedefli olmayan (av tüfeği) veya hedeflenen yöntemleri ya kullanmak için dizayn edilebilir. Keşif proteomik genellikle geleneksel veri bağımlı toplama modunu kullanarak, ya da (örneğin, MS E, SWATH) son zamanlarda geliştirilen veri bağımsız tekniklerden birini 1,2 kullanarak, ya aşağıdan yukarıya av tüfeği MS dayanır. Shotgun proteomik yüksek verimli peptit tanımlama ve nispi ölçümü için güçlü bir araçtır, ama mutlak ölçümü için veya proteinlerin küçük tanımlanan setler (~ onlarca) hedefleme için genellikle uygun değildir. En sık hedeflenen proteomik için kullanılan MS yöntemi nedeniyle yüksek hassasiyet, hız ve dinamik aralık 3-5 tepkisini izleme (SRM) seçilir. SRM alternatifleri yüksek çözünürlüklü, tam MS tarama 6 yararlanır paralel reaksiyon izleme içerir.
SRM genellikle nano-akış Rever kullanılarak gerçekleştirilirSED-fazlı yüksek-performanslı sıvı kromatografisi (nano RP-LC) nano-elektrosprey iyonizasyon bağlanmış cihaz üçlü dört kutuplu kütle spektrometresi (qqq-MS) takılmış bir (daha nano-ESI) iyon kaynağı. Tipik bir deneyde, örnek proteinler proteolitik olarak sindirilir ve elde edilen peptitler, kromatografik ayrıldı, desorbe ve iyonize edilebilir. Elde edilen öncül iyonları m / ilk kuadruple (Q1) tarafından filtre z ve çarpışma gazı ile çarpışarak tarafından ikinci kuadropol (q2) parçalanmış bulunmaktadır. Elde edilen fragman, iyonlarıdır m / z-süzüldü üçüncü dört kutuplu (Q3) ve bir dynode ile nicelendirildi. Her bir ön-madde ve fragman iyon çifti bir geçiş olarak ifade edilir ve her bir geçiş belirli bir süre (kalma süresi tipik olarak 2-50 msn) izlenir. LC-SRM sırasında geçişler önceden tanımlanmış bir liste üzerinden qqq-MS döngüleri (görev döngüsü genellikle ≤3 sn olan) ve her bir geçiş kromatogram üretilir.
Alternatif strategProtein ölçümü için ler, tipik olarak bu nokta, blotlar, Western blotlar, ELISA antikor mikrodizileri, ters fazlı protein mikrodizilerinin, mikroakışkan bağışıklık dijital ELISA ve mikroküre bazlı bağışıklık 7 olarak immün kullanımı. En iyi immünodeneyler LC-ARM önemli ölçüde daha fazla duyarlı olabilir ve bağışıklık örnek hacmi LC-SRM 5 önemli ölçüde daha yüksek olabilir. Ancak, gelişmekte olan immünoanalizler pahalı olabilir ve / veya zaman alıcı ve elde edilen analizler hücrenin / doku lizis / homojenizasyon yöntemleri ile uyumsuz, çapraz reaksiyon ve / veya müdahale savunmasız olabilir ve / veya uygun olmayan 5.8 multiplekslemesi için. Bu sorunlardan bazıları antikor ve MS tabanlı teknikler birleştirilmesi ele alınabilir. Örneğin, hedef proteinleri önce proteoliz ve LC-SRM 9-12 immunoprecipitation kullanılarak zenginleştirilebilir. Seçenek olarak ise, SISCAPA tekniği peptid leve de proteolize sonra imüno kullanmaktadırl 13,14. Buna ek olarak stratejiler immunoenrichment için, yüksek bolluk proteinlerin bağışıklık sistemine analitleri 15,16 elüsyona alarak paraziti azaltarak LC-SRM duyarlılığını artırmak için istihdam edilebilir.
MS-bazlı protein ölçümü etiket özgür ve izotop etiketleme (örneğin, metabolik etiketleme, etiketleme kimyasal ve ağır etiketli protein ve peptid iç standartlar) içine de göreli ve mutlak ölçümü ayrılır ve yapılabilir. Etiket serbest teknikler göreli protein ölçümü için yararlı olabilir, ancak kesin mutlak ölçümü için uygun değildir olabilir. Karşılaştırma olarak, etiketleme teknikleri numune hazırlama ve MS varyans ile ilişkili hata azaltmıştır, ve çoğu zaman görece protein miktarının 17 kullanılmaktadır. Örneğin, izotop etiketli proteome (SILAP) standartları, insan serumu 18 LC-ARM üzerinden olası biyolojik belirteçler nispi miktarını etkin kültürlenmiş insan hücre hattı kullanılarak hazırlandı. MS ile Doğru mutlak protein ölçümü saflaştırılmış, sayısal, izotopik olarak etiketlenmiş protein ya da peptid iç standartlar çivili-içine olması MS öncesinde biyolojik örnekler gerektirir. LC-SRM iş akışına ağır izotop etiketli dahili standartların dahil son derece tekrarlanabilir ve laboratuarlar 16,19 arasında transfer olduğu gösterilmiştir mutlak kantifikasyonunu sağlar.
MS ile saf protein ölçümü için izotop etiketli dahili standartlar peptid standartları, katı faz sentezi 20, birleştirilmiş proteaz klivaj peptid standartları 21 oluşan proteinler, ve tam uzunluktaki protein standartlarını 22 kullanılarak hazırlandı bulunmaktadır. Hedef protein kovalent modifikasyon ve eksik numune hazırlama (yani eksik örnek parçalama ve homojenizasyon ve eksik protein solübilizasyon, denatürasyonu, alkilasyon ve proteoliz) doğru kantifikasyon sarsar. İç protein standartlar bu potansiyel sorunların en etkilenecek en az olasıdır, ancak genellikle hazırlamak için en zor bulunmaktadır. Alternatif bir amino- ve karboksi-terminal ana kuşatan kalıntılarını içerecek şekilde tasarlanan çok sayıda dahili peptid standartları kullanılarak her bir hedef protein analiz etmektir. Ne olursa olsun, iç standart türü kullanıldığında bunlar, bu katkılı halinde gereken biyolojik örnekler gibi erken bir noktada mümkün olduğu numune hazırlama sırasında. Ayrıca, birden çok örnek hazırlama teknikleri (örneğin, farklı bir denatürasyon koşulları) test edilmelidir. Birden dik deneysel teknikler (deneysel çapraz doğrulama) kullanımı 23-25 zorluklar çoğu potansiyel kantifikasyon üstesinden gelmek için uygun bir stratejidir.
Proteinlerin LC-SRM miktar geniş bir uygulama yelpazesinde kullanılabilir olan son derece esnek bir tekniktir. Özellikle, bu içindeki peptid ve protein biyolojik işaretleri incelemek için kullanılmıştırBöyle serum, çekirdek biyopsiler ve ince iğne aspiratları 5 klinik örnekler. LC-SRM ayrıca, botulinum nörotoksinlerinin 27 tespit etmek için sinyal yolları 5 içinde protein fosforilasyon dinamikleri ölçmek için ve protein konformasyonuna 28 değişiklikleri ölçmek için, protein kompleksleri 5,26 stokiyometri ölçmek için kullanılmıştır.
Laboratuvarımız kemotaksis yolu simülasyonları gelişimini desteklemek için makrofaj kemotaksisini arabuluculuk sinyal proteinleri ölçmek için LC-SRM kullanıyor. protokol genel şeması (Şekil 1) kesin olmayan hedef peptidleri sıralaması ile başlar. Daha sonra, ham dış peptid standartları sentezlendi ve biyolojik numunelerin nitel analiz için LC-SRM tahlilleri geliştirmek için kullanılır. Biyolojik numune türetilen hedef peptid tespit edilirse, saflaştırılmış ağır etiketli dahili peptid standartları niceliksel LC-ARM hazırlanır. Bu protokol, ac için kullanılabilircurately biyolojik örneklerin çeşitli proteinleri ölçmek ve protein hedeflerinin çok çeşitli araştırmalar desteklemek.
Protokol
NOT: Bu yöntem, daha önce 56 tarif edilmiştir.
1. Peptid hedef seçimi
- Hedef proteinlerin bir listesini derlemek ve biyolojik örnekler arasında normalleştirme için konum idaresi proteinlerinin az sayıda içerir ve aynı zamanda bir iç protein standardı (örneğin ateşböceği lusiferaz) içerir. Böyle Protein Sindirim Simülatörü 29,30 gibi bir yazılım aracı kullanarak silico triptik peptidler içine hedef proteinleri sindirmek.
- Peptidler tam triptik ve hiçbir eksik tripsin bölünme siteleri içerdiğini gerektir. Potansiyel eksik tripsin sindirimi 31 önlemek için komşu tripsin bölünme siteleri ile peptidler kaçının.
- Her bir peptidin uzunluğu 5-20 kalıntıları olduğunu gerektirir. Daha uzun peptidler düşünün, ama genellikle sentezlenmesi için daha pahalı olduğunu not edin.
- Doğal bir genetik varyant (örneğin, tek nükleotid karşılık eğer bir peptit kaçınıne polimorfizmi). Ayrıca tripsin siteleri (1.2 Adım) etkilenmemiş olduğunu onaylayın.
- Bu Posttranslasyonel değişiklik (PTM) bir siteye karşılık eğer bir peptit kaçının. LC-MS numune hazırlama sırasında kimyasal modifikasyona yatkın olacaktır Benzer şekilde, bir peptit kaçının. Spesifik olarak, sistein ve metionin oksidasyon, asparagin ve glutamin deamidasyon ve piroglutamat amino-terminal glutamin oluşumuna eğilimli peptidler kaçının. Tripsin siteleri (1.2 Adım) etkilenmemiş olduğunu onaylayın.
- Ayrıca, protein, termini translasyon sonrası modifikasyonu (amino-terminal metionin kaybı ve asetilasyon ve karboksi-terminal amidasyon) eğilimli olduğu için, protein, amino-ve karboksi-termini kaynaklanan peptidler kaçının.
- Her hedef peptit, her hedef proteine özgü gerektirir. Eğer bu mümkün değilse, peptid izoformları / homologların bir dizi özgüdür gerektirir. Sadece lösin / izolösin ikamesi farklı peptidler davranınsanki bu LC-ARM sırasında neredeyse aynı performans nedeniyle peptid teklik belirlerken onlar aynıydı.
- Biyolojik numunelerin her kapsamlı transkriptomik analizi (örneğin, RNA-DİZ) gerçekleştirilmiş olması halinde, transkriptin siliko çevirileri kullanılan benzersiz peptid belirleme 32 yerine türlerin tüm Proteomun kullanılarak sekansları.
- Hedef peptidler Proteotypic gerektirir. Biyolojik örneklerin av tüfeği kütle spektrometresi 1,2 kullanarak Proteotypic peptidler tespit çalışılmaktadır. Alternatif olarak, NIST kütle spektrometresi gibi online proteomik veri tabanlarından Proteotypic peptidlerin peptid tanımlamaları kütüphanelerinde almak 33 (http://peptide.nist.gov/), Küresel Proteome Makinası 34 (X http HUNTER spektral kütüphaneleri: // www http://gpmdb.thegpm.org/ gelen .thegpm.org / HUNTER / index.html ve GPMDB peptid tanımlamaları), PeptideAtlas 35 yukarı (http://www.peptideatlas.org/) ve GURUR veritabanı 36 (http://www.ebi.ac.uk/pride/archive/).
- Kantitatif transkript düzeyinde yapılmıştır biyolojik örneklerin analizleri (örneğin, RNA-seq, qPCR), daha sonra nispeten düşük bolluk transkript karşılık peptitler hedefleyen kaçının.
- Hedef protein ortologlar LC-SRM deneyleri için kullanılabilir seçin hedef peptidleri gerekirse (örneğin, insan ve hedef proteinin fare biçimlerinin tahlil).
- (Mümkünse) hedef proteinin en az iki hedef peptidleri seçin.
Peptid Standartları 2. Hazırlık
Not: Protokolün bu kısmı alt analizler için yirmi liyofilili peptid standartları (miktar Her biri 1 nmol), bir dizi hazırlanmasını tarif etmektedir. Peptidlerin başka bir sayısı için, ya da farklı peptit miktarları için, buna göre ayarlanması gerekecektir.
- Böyle SPOT sentezi 20,37 gibi bir peptit sentezi teknolojisi kullanılarak liyofilize peptid standartları (≥1 nmol) hazırlayın.
- Carbamidomethylated harici peptid standartları sistein kalıntılarını (iyodoasetamid alkilasyon oluşturduğu kimyasal yapısı) sağlanması. Bunun aksine, dahili peptid standartları sistein kalıntıları modifiye edilmemiş sağlamak (bunlar, aşağıda tarif edilen numune hazırlama sırasında alkile olacaktır).
- Onlar amino ve karboksi-terminal yerli artıklarını yan içermesi, böylece iç peptid standartları Tasarım (tripsin sindirim verimliliği kontrol etmek için, her biri tipik 3-6 kalıntıları uzun).
- Onlar kararlı izotop etiketli böylece iç peptid standartları tasarlayın. Bir peptid etiketleme stratejisi seçerken hedef peptidin doğal izotopik profil ve MS kütle ölçüm doğruluğunu düşünün. Döteryumlu peptid standartları kullanmayın peptid dötertumlanma nedenleri ters fazlı LC tutma süresi nedeniyles 38 kaydırmak için.
Not: Genellikle, triptik dahili peptid standartları olarak saf ~% 98 kullanılarak sentezlendi: [13 C 6 15 K 4] Arg ve [13 C 6, 15 N2] karboksi-termini de dahil Lys. - HPLC 39 kullanılarak iç peptid standartları arındırmak ve bunları doğru bir şekilde ölçmek 40.
- H / h formik asit, liyofilize peptidin bir 10 uM peptit konsantrasyonu (kullanımı dikkat üretmek için her 1 nmol liyofilili peptid standart% 20 hac / hac asetonitril (ACN), çok düşük bir yoğunluğa sahip olabilir,% 0.1, 100 ul ekle ve) kolayca kaybolabilir. 2 dakika ve banyo için numuneler 5 dakika boyunca onları sonikasyon Girdap peptid çözünme tamamlanmasını sağlamak üzere.
- Çözülmüş peptidler havuz, 80 ul son hacim olması için bir vakum deriştirme aygıtı içinde, elde edilen karışımın konsantre edilir. Herhangi bir çökelmiş peptidi eritmek için ACN 20 ul ekle.
Not: örnek şimdi contains her peptit ve% 20 hac / hac ACN 10 uM. - İç peptid standartlar için, kantitatif LC-ARM için seyreltme dizi hazırlamak:
- 1 uM seyreltme 100 ul hazırlanması:% 20 h / h ACN 90 ul 10 uM peptid karışımı 10 ul birleştirir.
- 100 nM seyreltme 100 ul hazırlanması:% 20 h / h ACN 90 ul, 1 uM peptid karışımı 10 ul birleştirir.
- Dış peptid standartları için,% 0.1 v / v formik asit 90 ul 10 uM peptid karışımı 10 ul birleştirerek LC-MS için 1 uM seyreltme 100 ul hazırlar.
Not: Örnek 1 şimdi, her peptidin uM, hacim / hacim formik asit,% 0.1 ve% 2 v / v ACN içeren, ve LC-SRM tahlil geliştirme için kullanılmak üzere hazır hale gelir.
3. LC-SRM tahlil geliştirme
- Bir nano-akış HPL kullanarak MS tüfek ile dış peptid standartları (enjeksiyon başına her peptit kabaca 1-10 pmol) karışımları analizÜçlü dört kutuplu kütle spektrometresi (LC-qqq-MS (/ MS)) bağlanmış Cı sistemi.
- Cı-18 ortamı (≤5 um çapı, ~ 200 gözenekler, uzunluk ≥10 cm id = 50-100 um) ile dolu bir kılcal sütunu ile donatılmış bir LC-MS sistemi ve nano-ESI ucu (tipik olarak kullanılarak üretilen kullanın Bir lazer çektirmesi). Her bir LC-MS tarafından işletilen bir ~ 60 dakika doğrusal eğimi (tipik haliyle,% 0-40 Çözücü B) bir sütun rejenerasyon aşamasını (~% 80 Çözücü B) ve sütun yeniden dengeleme adım (~% 0 Çözücü B içeren emin olun ) (Çözücü A =% 0.1 hac / hac H formik asit 2, O, B Solventi =% 0.1 hac / hac ACN içinde formik asit, akış hızı = 200-800 Nl / min, ESI voltajı = 1800 V, Q3 yalıtım genişliği = 0,7 m / z, q2 argon basıncı = 1.5 mTorr).
- Her habercisi iyon tarama için, dinamik üst seçin ~ tandem kütle spektrometresi (MS / MS) 10 en yoğun habercisi iyonları. Optimal +2 habercisi iyonları parçalara için tasarlanmış bir ve diğer: İki farklı çarpışma enerjisi rampaları kullanıldığı böylece kopya halinde her bir numune çalıştırın3 için ön-madde 41 iyonları.
- LC-qqq-MS (/ MS) (q2 düşük enerji argon çarpışmaları sonucu habercisi iyon zirveleri kuyruklanmasını neden olabilir Q1 habercisi iyon tarama) Q3 habercisi iyon tarama kullanarak analizleri gerçekleştirin.
- LC-MS sistemi QC örnekleri ve teknik çoğaltır analiz ederek yeterli performans emin olun. Taze yapılmış LC sütunlar kullanılarak ve örnekler arasındaki çoklu boşlukları çalıştırarak örnek taşınmasını önlemek.
- Dış peptid standartlarının 42 dizileri karşı arama veritabanı kullanarak ortaya çıkan tüfek LC-qqq-MS (/ MS) verileri analiz edin. Eğer uygunsa, peptid kimlik güven puanları (örneğin, beklenti değerleri) veya istatistiksel modelleme 42 kullanılarak kullanarak muğlak peptid tanımlamaları atın. Ne olursa olsun, el hepsi açık olduğundan emin olmak için peptid kimlikleri 43 tüm gözden geçirin.
- Con av tüfeği, MS peptid tanımlamaları kullanınBöyle Skyline gibi bir yazılım programını kullanarak bir spektrum kütüphanesi struct.
- Öncül iyonu (başına 3-10 en yoğun geçişleri kullanarak LC-SRM geçiş listesini hazırlayın +2 ve +3 öncüsü iyonları +1 ve +2 fragmanı iyonları; y-, b- ve ≥2 kalıntıları olduğu bir-iyonları Uzun).
- Habercisi ve fragmanı iyon m / z değerleri qqq-MS kitle ölçüm hassasiyeti içinde çakışıyorsa habercisi iyon parçalanma tamamlanmamış bazen (bir geçiş atın, monoizotopik ve ağır doğal izotop formları yanı sıra etiketlenmemiş dikkate hatırlamak ve ) formları ağır etiketli.
- Parça iyon m / z aynı ön-madde iyonu farklı bir fragman iyonun örtüşür Benzer şekilde, bir geçiş atın.
- LC-SRM dış peptid standartları karışımların analizleri gerçekleştirmek için ortaya çıkan geçiş listelerini kullanın (Adım 3.1 anlatıldığı gibi kütle spektrometresi gerçekleştirmek, Q1 ve Q3 izolasyon width = 0,7 m / z; bekleme süresi = 2-50 msn).
- Annenually herhangi kötü performans analizleri (LC-SRM verilerin analizini Bölüm 5'te açıklanmıştır) elde edilen LC-SRM verileri gözden ve silin.
Biyolojik örnekler 4. LC-SRM Tahliller
- Kültürlü hücrelerin 44 yemekleri hazırlayın. Birden fazla deney koşulları, blok karşılaştırılmış ve olası sistematik önyargıları 45 azaltmak için numune rastgele yapılıyorsa.
- Hücrelerin her yemeğin için, serumsuz bir tampon 44 hücreleri atık ve askıya hücre kültür ortamı aspire. Gerekirse, herhangi bir kalan hücre dışı proteinin ayrılması için bir serumsuz tampon hücreleri yıkayın.
- Her numune için, bir canlılığı leke (örneğin, tripan mavi) ve bir hemositometre veya otomatik bir hücre sayacı 44 kullanarak uygulanabilir ve toplam hücre sayısını.
- Santrifüj hücreleri Pelet ve 44 atık süpernatantlar aspire (tipik hücre pelet hacmi 30 ul ~ is).
- (sırasıyla her bir hücre peleti (100 mM HEPES ∙ NaOH pH 8, hidroklorür bestatin, 10 uM, 10 uM pepstatin A, ve ya da 8 M üre veya% 0.1 ağ / hac yüzey aktif madde üre Liziz Tamponu veya yüzey aktif madde Lizis Tamponu 400 ul ekle ), taze hazırlanmış, bu tür RapiGest SF ya da PPS Sessiz yüzey aktif madde olarak, bir asit-labil MS uyumlu yüzey aktif madde kullanırlar). Diğer proteaz inhibitörleri kullanılarak, bunlar tripsin önleme yok olduğundan emin olun.
- Boncuklar sızıntı için ek kap tüpleri neden olduğuna dikkat (~ 0.1 mM zirkonya / silika boncuk 100 ul yumuşak pipetleme ile her bir örnek karıştırın ve (bir O-halkası ile bir vida kapak ile) 2 ml tüp, her bir aktarma ). Lyse tam hızda 5 dakika boyunca numune vorteks hücreler (bu boncuk dayaktan hücreleri lyses).
- Alternatif olarak, (bir Fransız basını ya da homojenleştirme ipuçlarını kullanarak, örneğin) bir farklı mekanik yöntemi kullanarak hücrelerin lize.
Not: Hücre lizatları santrifüj önlemek ot ki, bu çökelmiş proteinin pelet çünküherwise tryptically sindirilir ve LC-MS ile tespit edilebilir.
- Alternatif olarak, (bir Fransız basını ya da homojenleştirme ipuçlarını kullanarak, örneğin) bir farklı mekanik yöntemi kullanarak hücrelerin lize.
- Yüzey aktif cismi örnekleri için denatüre edilmiş, örnek homojenleştirme ve protein denatürasyonunu yardımcı olmak için, 10 dakika boyunca 90 ° C'de inkübe.
- Banyo homojenizasyon ve protein denatürasyonunu yardımcı olmak için, oda sıcaklığında 10 dakika boyunca ultrasonik titremeye maruz bırakılır örnekleri.
Not: lizatları ve lizis tamponu -80 ° C'de muhafaza edilebilir (lizis tamponu adımları 4.9 ve 4.13 için gerekli olacaktır). - Lisatlann protein konsantrasyonu, tahlil 46 (örneğin, bisinkoninik asit deneyi) uygulayın (ve bir kontrol deneyi olarak liziz tamponu).
- Taze bir 1.5 ml mikrosantrifüj tüp içine kalitatif analizler (yani, hiçbir iç peptid standartları çivili-içine edilecek numuneler) hücre lizatının, pipet 200 ug (protein kütlesi) için. Nicel analizler için, bir izotop seyreltme serisi için dört tür numunelerin hazırlanması.
- Her numune için, bir iç protein standardı (örneğin, / Em>)% 98 saf ateşböceği lusiferaz ~ ve ~ 5 pmol ekleyin.
- Nicel analizler için, iç peptid standartları eşmolar karışımının izotop seyreltme serisi ekleyin (örneğin, 0, 0,2, 2, her peptit 20 pmol) örnekleri.
- Buna paralel olarak, tek başına dahili peptid standartları kullanılarak kontrol numuneleri hazırlanması (örneğin, bir hücre lizatı) (örneğin, 0, 0.2, 2, her bir peptidin 20 pmol).
- Ayrıca iç ve dış peptid standartları kullanılarak kontrol numuneleri hazırlanması (örneğin: 2 her bir harici peptit standart pmol ve 0, 0.2, 2, ve her bir dahili peptid standardı 20 pmol).
Not: tripsin sindirim engel olabilecek peptid standartları formik asit içermeyen emin olun.
- Numunelerin hepsinin aynı miktarlar, böylece lizis tamponu ekleyin. Not: Tipik bir örnek hacmi 70 ul, bu nedenle bu hacmi bu protokol için kullanılacaktır.
- 0 ekleyerek protein sistein artıklarını azaltın.Her numune (son DTT konsantrasyon 10 mM) ve 30 dakika boyunca 60 ° C'de örneklerin inkübe edilmesi için (yeni hazırlanmış) 1 M DTT 7 ul.
- Alkilat proteini tamponlu iyodoasetamit 7 ul ekleyerek cystines (500 mM iyodoasetamit, 1 M HEPES NaOH pH 8 ∙, taze hazırlanmış) her bir örneğe (nihai konsantrasyon 50 mM iyodoasetamid) ve karanlıkta 20 dakika boyunca oda sıcaklığında örneklerin inkübe (iyodoasetamid duyarlı ışık). Gerekirse, 50 mM nihai konsantrasyona kadar DTT eklenerek geri kalan iodoasetamid gidermek.
- Numunelerin her üre kullanılarak denatüre için, (tripsin anlamlı> 1 M üre 47 de engellenir) nihai üre konsantrasyonu 1 M böylece 100 mM HEPES ∙ NaOH pH 8 482 ul ekleyin.
- Tryptically peptidler içine proteinleri sindirmek.
- Hücre lizatı içerir Her bir örnek için, 0.5 mg / ml dizileme gradlı modifiye tripsin 8 ul olacak şekilde ilave nihai tripsin concentrattripsin: Örnek, ve 18 saat 37 ° C'de inkübe örnek: İyon 1:50 (a Protein h) arasındadır.
- Hücre lizatı içermeyen her bir numune, 0.5 ug / ul dizileme gradlı modifiye tripsin 0.5 uL ekleyin ve 2 saat (bu numunelerin her kontrol deneyleri için, ve tipik olarak sadece 10 ng içeren 37 ° C 'de örnek inkübe için peptid + protein kütlesinin -10 ug).
- Üre denatüre örneklerin her biri için,% 2 v / v formik asit 440 ul (nihai formik asit konsantrasyonu,% 1 v / v). Bu örnekler, pH ~ 3 olduğunu doğrulayın.
- Yüzey aktif cismi, denatüre örneklerin her biri,% 0.5 v 914 ul için / TFA hac (nihai TFA konsantrasyonu% 0.5 v / v). Bu örnekler pH ~ 1.5 olduğunu onaylayın. 60 dakika yüzey aktif madde hidrolize etmek için 37 ° C 'de, bu örneklerin inkübe edin.
- Mikrosantrifüj örneklerinin her yüzey aktif madde uç grubu ve diğer Yağışlı pelet, oda sıcaklığında 20 dakika boyunca 21,000 x g'debir C-18 SPE kartuşu yapışmasına neden olur ipitates.
- Katı faz, bir tek C-18 SPE kartuşu kullanılarak süpernatanların her özü (Tampon A =% 0.1 hacim / hacim formik asit; Tampon B =% 0.1 h / h formik asit,% 80 h / h ACN; ~ 100 mg C- kartuş başına 18 reçine). Ya da 5 dakika için 10 x g'da 15 ml'lik bir santrifüj tüpüne kartuşu santrifüjle bir ekstraksiyon manifoldu kullanılarak, düz yüzeyli kauçuk ampulü kullanılarak C-18 SPE kartuşu içinden mobil fazlar zorla.
- Tampon B içinde 1 ml uygulayarak sütun Islak, iki kere tampon A ile 1 ml uygulayarak bunu dengeye örnek uygulanır ve iki kez tampon A ile 1 ml uygulayarak kartuşu yıkayın. Yavaş yavaş Tampon B 1 ml uygulamak (~ 2 dk) ile peptidler Zehir.
- ACN şekilde buharlaştırılır, 100 ul'lik nihai bir hacme kadar vakum yoğunlaştırıcısı her eluat konsantre edilir. Her bir örnek için, H2O 200 ul ekleyin ve olası yeniden uzaklıkta buharlaştırılması için 98 ul'lik nihai bir hacme kadar vakum yoğunlaştırıcısı her konsantreisti ACN ilave et.
- Her bir örnek için ACN içinde 2 uL% 5 h / h formik asit ilave edin (nihai numune konsantrasyonları,% 0.1 v / v formik asit,% 2 h / h ACN) vardır.
Not: Örnekler, -80 ° C'de saklanabilir. - (Adım 3.4 gibi) LC-SRM kullanarak örnekleri analiz edin. Nitel LC-SRM analizleri için, biyolojik örnekler ve dış peptid standartları çalıştırmak ve birlikte ortaya çıkan tüm verileri analiz eder. Kantitatif LC-SRM analizleri için, her biyolojik numunenin izotop seyreltme serisi çalıştırın ve aynı zamanda tek başına peptid standartları oluşan örnekleri çalıştırmak ve birlikte ortaya çıkan tüm verileri analiz eder.
5. LC-SRM Veri Analizi
NOT: Peptit tanımlama ve miktar oldukça basit ve kısmen böyle Skyline gibi yazılımları kullanarak otomatikleştirilmiş, ama yine de güçlü tüm veriler açıklama elle gözden geçirilmesi tavsiye edilmektedir edilebilir. Ayrıca, manuel Annot sırasında protein seviyesi bilgilerini dışlamak için en iyisiLC-SRM verilerinin tirme yanlılığı önlemek için.
- Her bir peptid tanımlaması için, her bir geçiş yapılan ayırma profilinin şekli yaklaşık Gauss olduğunu teyit etmektedir. Her bir geçiş için, elüsyon profili MS detektör tarafından ölçülen sinyallerin çok ürünü olduğunu teyit (yani, MS gürültü, bir ya da iki rasgele sivri ürünü değildir).
- Her peptid tanımlanması için tüm peptit elüsyon profili seçili olduğundan emin olun. Peptid tanımlanması (ağır etiketli peptid formunda, etiketsiz formu, bireysel habercisi iyonları ve bireysel geçişler) ve alt bileşenlerinin elüsyon profili sınırlarını ayarlama manuel kaçının.
- Her geçiş elüsyon profili, bir sinyal-gürültü oranı (s / n) ≥3 olduğunu doğrulayın. Not: "Gürültü" elüsyona analitlerden sinyal tekrarlanabilir değil, rastgele MS gürültü anlamına gelir. Kromatogram yumuşatma fonksiyonları büyük ölçüde gürültülü verilerin analizini yardımcı olabilir.
- Her bir peptid tanımlaması için,geçişler tüm neredeyse özdeş yıkama profillerine sahip olduğunu teyit (sadece eşit zirve tepe kez, elüsyon profilleri farklı amplitüdlere olabilir).
- LC-SRM peptid standartları (herbir peptidden tipik haliyle ≥100 fmol) büyük bir miktar analizleri için, karşılık gelen peptit elüsyon profilleri peptid tanımları net olduğunu ve (tipik olarak ≥100 N / S) yoğun olduğu teyit etmektedir. Not: Bu son derece güvenen tanımlamalar gelen biyolojik numune türetilen peptidler belirlenmesi için kritik olacak.
- Her peptid tanımlanması için, göreceli geçiş yoğunlukları güvenle tanımlanan peptid standardının eşleşen onaylayın. Gerekirse, gürültülü, nispeten düşük yoğunluklu geçiş elüsyon profilleri atmak, ama nispeten yoğun geçişlerin olduğu hiçbiri eksik onaylayın. Anlamlı ve açıkça bir eş etkilenen nispeten yoğun geçiş elüsyon profilleri göz ardıkirleticinin, elüsyon.
- Her peptid tanımlaması için, (elüsyona analitlere rasgele MS gürültü artı tekrarlanabilir sinyali) arka plan sinyali tarafından rastgele üretilen olasılığını tahmin ediyoruz.
- Tüm LC-SRM kromatogram inceleyerek ve her peptid kimlik benzersizliğini tahminine göre elle olasılığının tahmini. % 5 tahmini yanlış keşif oranı (FDR) sahiptir emin peptid teşhislerin bir dizi üretin. Sıkı kriterleri özdeşleşmeler set daha yüksek bir güven gerekiyorsa (gevşek kriterlerin kullanılması tavsiye edilmez) (örn FDR ≤1%) kullanın.
- Alternatif olarak, mProphet algoritması 48 veya denetim algoritması 49 kullanabilirsiniz, ancak elle sonuçları gözden geçirin.
- Her peptid tanımlanması için, gözlenen elüsyon zamanı (Skyline Bu hesaplamayı gerçekleştirmek için tasarlanmıştır) peptid hidrofobluğu tutarlı olduğunu teyit etmektedir.
- Her bir peptid için, onaylamakonun elüsyon zamanı LC çalışır tutarlı olduğunu.
NOT: LC-SRM bazen sistematik çalışmalar arasında çarpık olan elüsyon profilleri üretmek analizleri. Sistematik vardiya böyle bir sütun değiştirilmesi gibi enstrüman değişikliklerden sonra beklenmez. Ayrıca erken elüsyon peptidler (kolon kapasitesine yakın yerleştirildiğinden özellikle) kayması eğilimli olabilir, ve geç elüsyon peptidler Aynı zamanda, vites eğilimli olabilir. Peptid tanımlama tamamlanmıştır. - Peptid miktarının iyileştirmek için, her peptid kimlik reinspect ve peptid kimlik diğer geçiş elüsyon profilleri karşılaştırıldığında özellikle gürültülü ise geçiş elüsyon profili atın. Göreli geçiş yoğunluğu (peptid standardına göre) yanlış ise bir geçiş elüsyon profili atın.
- Her habercisi iyon ve geçiş elüsyon profili sınırlarını kontrol edin. Gerekirse, dikkatlice arka plan sinyalini uzak kırpmak için elüsyon profili sınırlarını ayarlayın (ya da improve Arka sinyal tahmini).
- Işık peptidin saptanabilir bir miktarı ile kirlenmiş olan, her bir iç peptid standardı için, (LC-SRM ile belirlenen, yukarıda tarif edilen, tek başına dahili peptid standartları analizleri) kontrol edin. Daha sonra, önemli ölçüde iç peptid standartları içinde ışık-peptid kirlenme tehlikeye edildi herhangi bir ışık peptid elüsyon profilleri atın.
- Onun LC pik alanı hesaplanarak, her geçiş elüsyon profili niceliğini. Eğer uygunsa, tahmin edilen plan sinyalini düşeriz. Karşılık gelen geçiş miktar değerler toplanarak her bir peptit elüsyon profilini niceliğini (bundan sonra bu "Sum_Peak_Area" değeri olarak ifade edilir). Iç veya dış peptid standartları her biyolojik numune peptid Sum_Peak_Area değeri, verileri kullanılarak biyolojik numune peptid molar bolluk hesaplamak LC-SRM (kullanım başarıyla hem biyolojik numune peptid tarafından ölçüldü sadece geçişlerLC-SRM ve peptid standardı o).
- Dış peptid standartları (önerilmez) kullanarak Niceleme:
- Dış peptid standart molar bolluk değerleri karşı dış peptid standart Sum_Peak_Area değerlerini çizilir. Verilere lineer regresyon uydurma bir standart eğri üretin (genellikle dinamik aralığının sadece doğrusal bileşeni kullanılması gerektiğini, herhangi bir doğrusal olmayan bileşen çok dikkatli kullanılmalıdır). Her biyolojik numune peptid Sum_Peak_Area değeri, peptit molar bolluk hesaplamak için standart eğri kullanın.
Not: biyolojik örnekler ve dış peptid standartları ayrı LC-SRM ile hazırlanır ve analiz edilir, çünkü örnek hazırlama ve LC-SRM demonstrability sağlam olması gerekir, çünkü bu miktar yöntem önerilmez. Ayrıca, matris etkilerinden (analit dışındaki bir örnek bileşenlerine bağlı etkiler) için hesap değil.
- Dış peptid standart molar bolluk değerleri karşı dış peptid standart Sum_Peak_Area değerlerini çizilir. Verilere lineer regresyon uydurma bir standart eğri üretin (genellikle dinamik aralığının sadece doğrusal bileşeni kullanılması gerektiğini, herhangi bir doğrusal olmayan bileşen çok dikkatli kullanılmalıdır). Her biyolojik numune peptid Sum_Peak_Area değeri, peptit molar bolluk hesaplamak için standart eğri kullanın.
- İç kullanarak Nicelemepeptid standartları (önerilir):
- Her biyolojik numune peptid Sum_Peak_Area değeri ve karşılık gelen ağır etiketli dahili peptid standart Sum_Peak_Area değeri, hafif / ağır oranı hesaplanır. Biyolojik numune peptidin mol miktarım hesaplamak için karşılık gelen hafif / ağır peptit mol bolluğu oranının bir ölçüsü olarak, bu oranı kullanın. Özellikle, biyolojik numune peptid molar bereket hafif / ağır Sum_Peak_Area oranı ile çarpılması iç peptid standart molar bolluk eşittir.
- Her biyolojik tekrarlanan ve hedef peptid için, lineer regresyon kullanılarak bir standart eğri oluşturarak LC-SRM ölçümü doğrusal aralığı belirlemek. Özellikle, ağır / hafif Sum_Peak_Area oranı değerleri karşı iç peptid standart molar bolluk değerlerini çizmek (biyolojik numune kütlesi veri kümesi boyunca sabit olduğunu unutmayın). Her bir biyolojik numune peptid Sum_Peak_Area değeri lineer aralıkta olduğunu (Typic gerektirirmüttefiki, dinamik aralığının sadece doğrusal bileşeni kullanılmalıdır; Herhangi bir doğrusal olmayan bileşen) çok dikkatli kullanılmalıdır. Aynı şekilde, her bir hedef peptid geçiş için bu adımı gerçekleştirin.
Not: LC-qqq-ARM tarafından analit miktar geniş bir dinamik aralık (~ 10.000) üzerinde doğrusal olmalıdır. Düşük sonunda, arka plan sinyali (rastgele MS gürültü artı elüsyona analitlerden tekrarlanabilir sinyali) ölçümü doğruluğu ve kesinliği azaltacaktır. Yüksek sonunda, dedektör doygunluğu (sonuçta bu yıkama profilleri, belirli bir sinyal yoğunluğu yassı bir başlangıç olmasına neden olabilir) lineer olmayan neden olacaktır.
- Dış peptid standartları (önerilmez) kullanarak Niceleme:
- Eğer uygunsa, önce iç peptid standartları spiking-in örnek miktarı hafif farklılıkları düzeltmek için, böyle bir merkezi eğilim normalleşme 50 örneklerin genelinde global bir normalleşme gerçekleştirin. Gerekirse, Adım 1.1 yalnızca temizlik proteinleri kullanın.
- Gerekirse, quantificat eksik imputeion 51,52 değer verir.
O bunu yaparken yapay miktar varyansı azaltacaktır çünkü basitçe miktarının (LLOQ) ya da algılama (LOD) yarım sınırının yarısı alt sınırı ile eksik değerleri değiştirmek için uygunsuz olduğu, ve (bir istatistik testi örneğin, bir ANOVA neden olabilir: Not ) yanlış pozitif sonuç üreten (bir tür hata). Ancak, eksik değerleri göz ardı da sorunlu olabilir. Yarım gerçek bolluk değerleri LOD altında, diğer yarısı LLOQ üstünde iseniz Örneğin, sonra ortalama gerçek bolluk demek abartma olur bolluk gözlendi. - Tahliller LC-SRM 23-25 için geniş kabul gören kuralları tatmin olduğundan emin olun. Özellikle, miktar değerleri varyasyon katsayısı tipik olarak klinik deneyler için ≤25 ve% klinik olmayan tahliller için 25 ≤35% olduğu gerektirir. Düzenleyici uygulaması için dikkate alınması gereken sağlık hizmetleri veya veterinerlik ürünleri veya hizmetleri ile ilgili LC-SRM tahlilleri içinroval, tahliller gibi deneyleri için sıkı hassas gereksinimlerini karşılamak gerektirir: "Her konsantrasyon seviyesinde belirlenir hassas bunun% 20'sini aşmamalıdır LLOQ hariç varyasyon katsayısı (CV)% 15 geçmemelidir CV "23,24.
Sonuçlar
sinyal iletim yollarının tahmini hesaplama modellerinin geliştirilmesi sistem biyolojisi 53 temel hedeflerinden biridir. Ne yazık ki, hatta yoğun çalışılan ve yüksek klinik öneme sahip olan sinyal yolları için, bu nicel tedirginlikler cevaben yolu davranışlarını tahmin etmek için genellikle hala mümkün değildir (örn bu MAPK / ERK yolu 54 için geçerlidir). Son zamanlarda, bir soruşturma yolunun 56 sinyal fare makrofaj kemotaksisini çalışmak için hedeflenen proteomik, transkriptomik ve hesaplamalı modelleme ve simülasyon kullandı. araştırmanın odağı RAW 264.7 hücreleri (fare monosit / makrofaj hücre çizgisi) ve sfingosin-1-fosfat dolayımlı kemotaksi oldu. Yol modelleme kolaylaştırmak için, LC-SRM deneyleri geliştirilmiş ve RAW 264.7 hücreleri içinde kemotaksis yolu proteinlerinin mutlak bolluğunu ölçmek için gerçekleştirildi. Ortaya çıkan bereket değerleri kullanımı vardıyolu model parametreleri olarak, d.
Genel deney şeması (Şekil 1) G I2, heterotrimerik G-proteini α-alt-birimi dahil, hedef proteinlerin bir listesi ile başladı. genel protokol başarısı gibi YDEAASYIQSK olarak Proteotypic ve quantotypic peptid hedefleri seçimi oldukça bağımlıdır. Dış peptid standartları karışımları hazırlanmış ve av tüfeği LC-qqq-MS (/ MS) ile analiz edilmiştir. Elde edilen YDEAASYIQSK tandem kütle spektrumu birçok parça iyonlarının oluşan ve düşük arka plan (Şekil 2) vardı. spektrumları habercisi iyonu başına ilk on en yoğun fragman iyonları içeren LC-SRM hedef listeleri oluşturmak için kullanıldı.
409 dış peptid standartları ("JPT409") ihtiva eden bir karışım, niteliksel LC-SRM ile üç kopya halinde analiz edilmiştir (veriler gösterilmemiştir). Bu örnek, üç G i2 peptidleri dahil, ve üçünün belirlenmesi olduemin olmak için değerlendirdi. Daha sonra, RAW 264.7 örnekleri (biyolojik çoğaltır "raw1" ve "raw2") ve JPT409 numunesi her kalitatif LC-ARM tarafından iki nüsha halinde (iki LC-SRM teknik çoğaltır) analiz edildi (bu altı LC-SRM benzer olarak analizleri yapılmıştır mümkün). (- C Şekil 3A) YDEAASYIQSK peptid güvenle altı analizlerde tespit edilmiştir. Altı LC-SRM analizleri karşısında YDEAASYIQSK geçiş yoğunluğu desenleri tutarlı ve bu av tüfeği LC-MS (/ MS) desen ("Kütüphane" Şekil 3C çoğaltmak) kabaca benzer.
Geçiş yoğunluklarının model tek başına her bir peptidin emin tanımlanması için yeterli değildir. Peptid hidrofobiklik ve ölçülen LC destekleme süresi tutarlı olmalıdır. Ayrıca, dış peptid standartları ve buna tekabül eden biyolojik numune peptidler yaklaşık olmalıdıreşit tutma süreleri. ve YDEAASYIQSK gözlemlenen bir tutma süresine (SSRCalc sürüm 3.0 100 A algoritması 55 ile tahmin) hidrofobiklik tutarlıdır (Şekil 4A) olduğu tespit edildi. Ayrıca, YDEAASYIQSK alıkoyma süresi RAW 264.7 analizler ve dış peptid standartları analiz her ikisini de kullanarak ölçüldü ve tutma süresi, tüm değerleri (Şekil 4B), yaklaşık olarak eşit idi.
Nitel LC-ARM çoğu biyolojik numunelerin analizi, çok ağır olarak etiketlenmiş, saflaştırılmış tekabül eden başarılı olan dahili peptid standartları hazırlanmış ve katkılı ham 264.7 hücre lizatları edildi miktarı. İzotop seyreltme serisi LC-SRM yalnız iç peptid standartları (örnek "R0"), iç ve dış peptid standartları (örnek "R1") ve altı RAW 264.7 biyolojik çoğaltır (örnekler "R2" oluşan örnekleri analiz etmek için kullanıldı - "R7"). İki different protein denaturanları ile çözünür, doğru hedef protein miktarının çürüten olası protein solübilizasyon, denatürasyon, alkilasyon, ve / veya sindirim sorunları için test etmek için kullanıldı (numune, R2-R4, üre kullanılabilir ve örnekler, R5-R7, RapiGest SF kullanılır). YDEAASYIQSK ışık ve ağır formları neredeyse aynı geçiş yoğunluğu desen ve yıkama profilleri (- C Şekil 5A) içeriyordu. LC-SRM tepe alanı oranları göreceli peptid bolluk bir ölçütü olarak kullanılmıştır ve YDEAASYIQSK oranları RAW 264.7 hücre başına kopya birimlerinde G i2 bolluğu değerlerini hesaplamak için kullanılmıştır özetlenebilir. Buna paralel olarak, ikinci bir G dahili peptid standardı (IAQSDYIPTQQDVLR) aynı RAW 264.7 örneklerin kantitatif G i2 LC-SRM deneyleri gerçekleştirmek için kullanıldı ve iki deney biyolojik çoğaltır tamamında oldukça benzer bir G i2 bolluğu ölçümleri üretilen i2 (Şekil 5D). İki G anlaşma i2 deneyleri hem peptidler quantotypic olduğu güçlü kanıtlar olduğunu ve nicel G i2 LC-SRM tahlillerin tüm doğru ve kesin idi.
Genel olarak, 35 proteinleri 58 dahili peptid standartları (Tablo 1) kullanılarak ölçüldü. Özellikle, iç protein standart LC-SRM deneyleri (ateşböceği lusiferaz; Adım 4.11) doğru ve kesin idi. Bu soruşturma Skyline verileri kapsamlı bir dizi (https://panoramaweb.org/labkey/project/NIH_NitaLazar/begin.view at Manes_RAW_Chemotaxis klasöründe) Panorama çevrimiçi LC-SRM veritabanı mevcuttur.
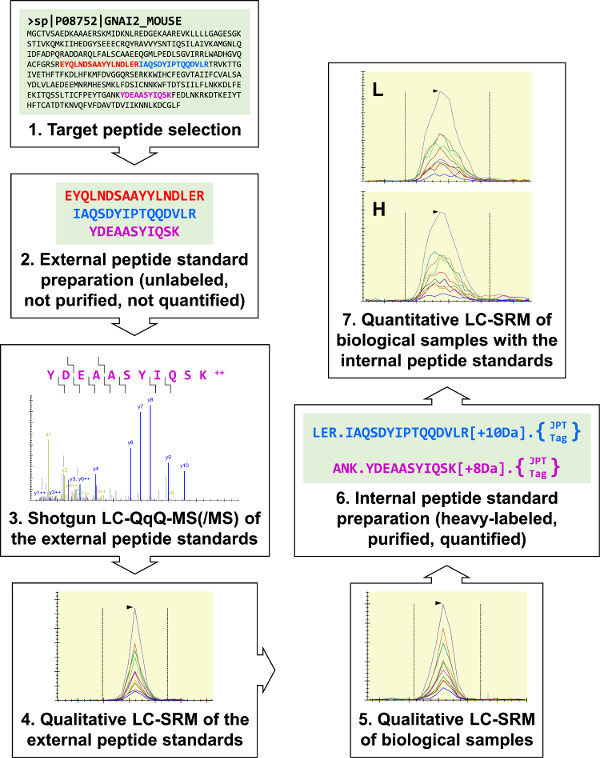
Şekil 1:. G i2 için protokol üç deneme hedef peptid genel görünümü (heterotrimerik G-proteini α-alt-birim) bu dış peptit, standart sentez için seçildi. Bunlar analy vardıÜç G i2 LC-SRM analiz geliştirme tüfek LC-MS (/ MS) zed ve bu deneyler, biyolojik örneklerin niteliksel analizler yapmak için kullanılmıştır. Her üç G i2 hedef peptidler belirlenmiştir ve iki iç peptid, standart hazırlanması için seçildi. Tripsin-bölünebilir "JPT-Tag" UV spektrofotometrisi kullanılarak dahili peptid standartları ölçmek için kullanılmıştır. İç peptid standartları RAW 264.7 örneklerin kantitatif G i2 LC-SRM deneyleri gerçekleştirmek için kullanılmıştır. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
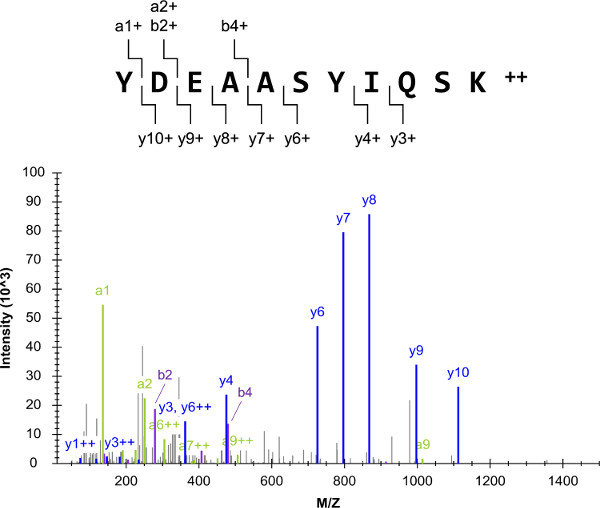
Şekil 2:. Av tüfeği LC-MS (/ MS) gösterilen kütle spektrumu G i2 dış peptid standartları (YDEAASYIQSK) birinin analizlerinden ortaya çıkmıştır. Bu ön-maddesiniilk on en yoğun geçişler (nedeniyle kısa uzunluğuna a1 1+ fragmanı iyonu hariç) LC-ARM için seçildi iyon. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
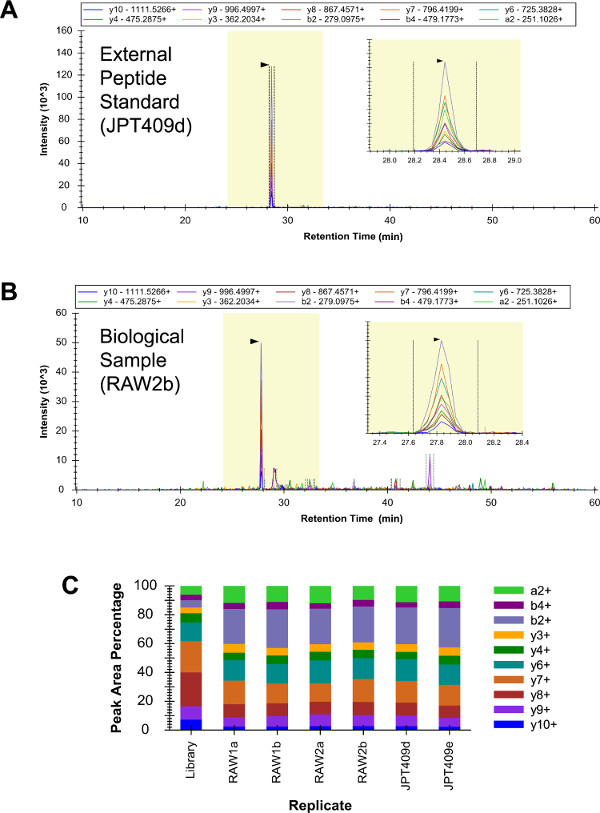
Şekil 3:. G i2 kalitatif LC-SRM JPT409 gelen YDEAASYIQSK kromatogramıdır çok düşük arka plan ihtiva analizleri ve peptit güvenle (A) tespit edilmiştir. İlgili RAW 264.7 analizler daha fazla arka plan sinyali sonuçlandı, ancak peptid kimlik hala kesin (B) idi. göreceli geçiş yoğunluğu desenleri altı LC-SRM (üç bağımsız örneklerin iki teknik çoğaltır) analizleri arasında tutarlı olduğunu ve bunlar kabaca simi edildiİlgili tüfek LC-MS (/ MS) desen ("Kütüphane" çoğaltmak) (C) lar. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Ishal boyunca Peptid alıkoyma süresi tahmini ve varyasyon bir doğrusal regresyon tahmini hidrofobikliğini kullanılarak hesaplandı ve onun hedef peptitlerle, tüm nitel LC-SRM ayrılma süresi ölçüldü ve YDEAASYIQSK öngörülen ve ölçülen elüsyon katı tutarlıdır (A): Şekil 4,. . Ayrıca, LC-SRM boyunca her bir peptidin gözlenen elüsyon süresi kıvamı belirlendi analizleri. YDEAASYIQSK elüsyonu süreleri kullanıldı LC-SRM aracının hassas ile tutarlıdır ~ 40 saniye, bir dizi (değerler yayılmışzirve apeks zaman +/- yarı max tam genişlikte ve aynı zamanda tepe tabanına) (B) tam genişlikte bulunmaktadır. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
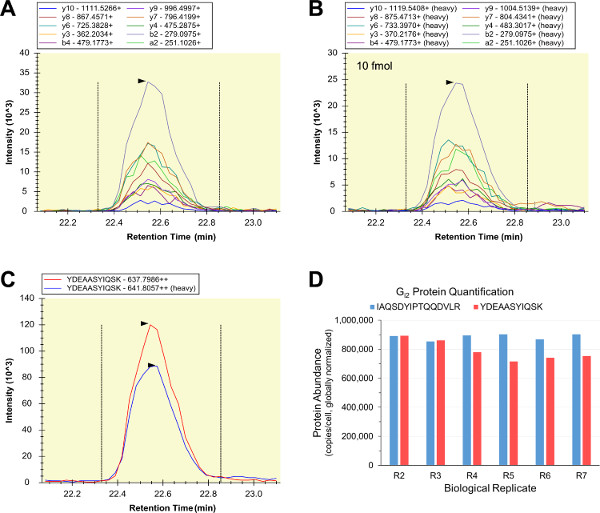
Şekil 5:. Tasvir G i2 kantitatif LC-SRM biyolojik numune peptidin (A) ve tutarlı bir nispi bir geçiş yoğunlukları vardı dahili peptid standardı (B) geçiş kromatogramları ve toplandı (C) ("R2" analizidir YDEAASYIQSK için), 10 fmol dahili peptid standardı kullanılarak. Hafif ve ağır elüsyon profilleri (C), tutarlı ve bu eğrilerin altındaki alan oranı lig bir ölçüsü olarak kullanılmıştırht / ağır peptit bolluğu. İkinci bir G i2 dahili peptid standardı (IAQSDYIPTQQDVLR) paralel kantitatif LC-SRM için kullanılmıştır ve sonuçta elde edilen G i2 bolluğu değerleri altı biyolojik çoğaltır ve genel olarak iki hedef peptidleri (her ikisi de tutarlı olduğu, n = 12 ve geçmiş = 8.38 %) (D). Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
| UniProt Katılım | Hedef protein | Hedef Peptid | Bolluk (fmol / ug) | Bolluk (kopya / hücre, normalize) | ÖZGEÇMİŞ |
| P08659 | Lusiferaz | (280 nm'de UV) | 23,824 | n / a | n / a |
| P08659 | Lusiferaz | VVDLDTGK | 24,103 | n / a | % 7 |
| P08659 | Lusiferaz | VVPFFEAK | 24,717 | n / a | % 4 |
| P60710 | Aktin, sitoplazmik 1 | IWHHTFYNELR | 760,448 | 61762598 | % 3 |
| P16858 | GAPDH | LISWYDNEYGYSNR | 357,803 | 28906524 | % 14 |
| P06151 | Laktat dehidrojenaz | LLIVSNPVDILTYVAWK | 129,623 | 10633145 | % 30 |
| P99024 | Tubulin β 5 | ALTVPELTQQVFDAK | 78,765 | 6398971 | % 3 |
| P20152 | Vimentin | SLYSSSPGGAYVTR | 121,100 | 9807488 | % 10 |
| P60766 | Cdc42 | DDPSTIEK | 86,647 | 6957317 | % 27 |
| P60766 | Cdc42 | QKPITPETAEK | 26,475 | 2153669 | % 6 |
| Q8C3J5 | DOCK2 | ETLYETIIGYFDK | 1,459 | 118.539 | % 15 |
| Q8C3J5 | DOCK2 | ISSSPTHSLYVFVR | 1,795 | 143.440 | % 33 |
| Q8BPU7 | ELMO1 | ALTTKPSSLDQFK | 2,302 | 186.754 | % 7 |
| Q8BPU7 | ELMO1 | SAIDISILQR | 1,244 | 99728 | % 25 |
| Q8BGM0 | FGR | GAYSLSIR | 1.099 | 89473 | % 17 |
| Q8BGM0 | FGR | WTAPEAALFGR | 0.319 | 24766 | % 6 |
| P27601 | Gα 13 | GIHEYDFEIK | 0,843 | 68467 | % 15 |
| P27601 | Gα 13 | VFLQYLPAIR | 1,295 | 106.176 | % 23 |
| P08752 | Gα: (i) 2 | IAQSDYIPTQQDVLR | 10,900 | 885.701 | % 2 |
| P08752 | Gα: (i) 2 | YDEAASYIQSK | 9,774 | 790.616 | % 9 |
| Q9DC51 | Gα (k) | EYQLNDSASYYLNDLDR | 6,574 | 537.862 | % 15 |
| Q9DC51 | Gα (k) | ISQTNYIPTQQDVLR | 3,504 | 285.784 | % 10 |
| P62874 | Gβ 1 | AGVLAGHDNR | 17,078 | 1385578 | % 4 |
| Q9CXP8 | Gγ 10 | DALLLGVPAGSNPFR | 2,167 | 179.178 | % 36 |
| P63213 | Gγ 2 | EDPLLTPVPASENPFR | 3,284 | 266.360 | % 8 |
| Q80SZ7 | Gγ 5 | VSQAAADLK | 6,087 | 493.512 | % 6 |
| P08103 | HCK | GPVYVPDPTSSSK | 1.143 | 93044 | % 12 |
| P08103 | HCK | IIEDNEYTAR | 0.944 | 77147 | % 19 |
| P43406 | İntegrin α V | AGTQLLAGLR | 0.276 | 22264 | % 32 |
| P43406 | İntegrin α V | SHQWFGASVR | 0,443 | 34235 | % 5 |
| P25911 | LYN | VIEDNEYTAR | 1,461 | 119.377 | % 13 |
| Q5SW28 | PI3K düzenleyici 5 | AGFPGILDTASPGK | 0.301 | 24331 | % 11 |
| Q8K3B3 | PI3K düzenleyici α | LYEEYTR | 0.472 | 38592 | % 16 |
| Q8K3B3 | PI3K düzenleyici α | TWNVGSSNR | 0.524 | 42697 | % 12 |
| Q8K3B3 | PI3K düzenleyici α | VLSEIFSPVLFR | 0.440 | 35902 | % 20 |
| Q5U3K7 | PI3K düzenleyici β | DTPDGTFLVR | 0.188 | 15262 | % 30 |
| Q5U3K7 | PI3K düzenleyici β | IAEIHESR | 0.282 | 22561 | % 13 |
| Q0VGQ5 | PI3K α | LINLTDILK | 0.102 | 8494 | % 38 |
| Q8CI98 | PI3K δ | HEVQEHFPEALAR | 0.178 | 14566 | % 22 |
| Q8CI98 | PI3K δ | ITEEEQLQLR | 0,481 | 38709 | % 24 |
| Q9ES52 | PIP3 5-fosfataz 1 | IVVLAKPEHENR | 0.486 | 39194 | % 19 |
| Q9ES52 | PIP3 5-fosfataz 1 | LSQLTSLLSSIEDK | 2,056 | 167.123 | % 7 |
| Q69ZK0 | PIP3 bağımlı Rac GEF 1 | DSVLSYTSVR | 0.647 | 52712 | % 32 |
| Q69ZK0 | PIP3 bağımlı Rac GEF 1 | NQLLLALLK | 0.354 | 27425 | % 5 |
| Q9CQE5 | RGS 10 | ASSQVNVEGQSR | 2.460 | 199.782 | % 4 |
| Q9CQE5 | RGS 10 | WASSLENLLEDPEGVQR | 20,647 | 206.005 | % 11 |
| Q9CX84 | RGS 19 | AEANQHVVDEK | 0.495 | 39753 | % 21 |
| Q9CX84 | RGS 19 | LIYEDYVSILSPK | 0,846 | 68481 | % 22 |
| B9EKC3 | Rho GAP 5 | DGLAQELANEIR | 0.448 | 34653 | % 10 |
| Q99PT1 | Rho GDI 1 | SIQEIQELDK | 3,156 | 267.063 | % 16 |
| Q99PT1 | Rho GDI 1 | VAVSADPNVPNVIVTR | 37,077 | 3006168 | % 5 |
| Q61599 | Rho GDI 2 | LNYKPPPQK | 37,975 | 3086596 | % 3 |
| Q61599 | Rho GDI 2 | YVQHTYR | 21,436 | 1711908 | % 47 |
| Q61210 | Rho GEF 1 | FDGAEGSWFQK | 2,149 | 176.139 | % 47 |
| Q61210 | Rho GEF 1 | SGLELEPEEPPGWR | 2,911 | 236.483 | % 8 |
| Q9QUI0 | RhoA | QVELALWDTAGQEDYDR | 43,500 | 3532438 | % 8 |
| P70336 | Rock2 | GAFGEVQLVR | 0.527 | 42800 | % 23 |
| P70336 | Rock2 | IYESIEEAK | 1.011 | 83794 | % 33 |
| P70336 | Rock2 | LEGWLSLPVR | 0.573 | 48259 | % 22 |
| Q8R0X7 | S1P liyaz 1 | AGYPLEKPFDFR | 1,787 | 147.043 | % 27 |
| Q8R0X7 | S1P liyaz 1 | TPEIVAPESAHAAFDK | 3,562 | 291.791 | % 18 |
Tablo 1: Kantitatif LC-SRM RAW 264.7 hücre proteinleri Otuz beş RAW 264.7 hücre proteinleri elli sekiz iç peptid standartları ve altı biyolojik çoğaltır kullanılarak ölçüldü.. Hedef proteinlerin Beş (aktin, GAPDH, laktat dehidrogenaz, tubulin ve vimentin) proteinleri temizlik edildi ve biyolojik örnekler (Adım 1.1) arasında normalleştirme sağlamak için ölçüldü. Buna ek olarak, bir iç standart protein (4,765 pmol her ateşböceği lusiferaz 200 ug numunesi, SDS-PAGE ile% 98 saf; 280 nm'de spektrofotometrik olarak ölçülmüştür; 4,11 Adım) LC-SRM ile her bir hücre lizat-çivili ve nicelleştirilmiştir. CV değerleri küresel normalize bolluğu değerlerini kullanarak altı biyolojik çoğaltır genelinde hesaplanmıştır (lusiferaz hariç; Adım 5.15).
Tartışmalar
Mutlak Protein ölçümü bu biyobelirteç doğrulama ve sinyal iletim yolu modelleme gibi biyomedikal uygulamalarda bir çok farklı aralık için gereklidir. Son zamanlarda, LC-SRM kullanılarak hedeflenen proteomik peptid standart hazırlama, HPLC, qqq-MS ve LC-SRM veri analizi de dahil olmak üzere çok sayıda teknolojilere iyileştirmeler yararlanmıştır. Sonuç olarak, bağışıklık karşı güçlü bir alternatif haline gelmiştir. Immünoanalizler ve / veya uygun değildir multiplekslemesi için, son derece hassas ve yüksek verimli olabilir, ama immünodeneyler hücre / doku lizis / homojenizasyon yöntemleri ile uyumsuz, çapraz reaksiyon ve / veya müdahale savunmasız olabilir çünkü sağlam bir immunoassay geliştirilmesi son derece zor olabilir 5,8. Örneğin, çapraz reaktivite açısından en kapsamlı testi hazırlamak için zor olabilir gen knock-out, kökenli numuneleri kullanılarak immünolojik test yapmaktır.
Bu protokol, hedef Pept açıklaride seçimi, LC-SRM tahlil geliştirme, nitel ve nicel LC-SRM ve LC-SRM veri analizi. Bu RAW 264.7 hücreleri 56 içinde 36 kemotaksis yolu proteinlerinin mutlak bolluğu ölçmek için kullanılan, ancak uygulanabilirliği kadar bu özel uygulama ötesine uzanır edildi. Bu hücre topakları olan proteinleri ölçmek için tasarlanmış olmasına rağmen, diğer biyolojik numuneler (örneğin, Biofluids) ve diğer SRM hedeflere (örneğin, fosfopeptidler) analizi için ayarlanabilir. Örneğin, homojenleştirme ve / veya protein sindirimi protokolünü değiştirerek önemli ölçüde, özellikle zor bir hedef proteinler (örneğin, zar proteinleri) çözünürlüğünü, denatürasyon, alkilasyon, sindirim ve miktarının geliştirilmesi, veya özellikle de zorlu numune (örneğin, numuneler, analiz sağlayabilecek içeren <100 ug protein kütlesi).
Hedef peptidler ilk seçim önemlidir ama zaman alıcı olabilir. Hundre içinhedef proteinlerin DS, ad hoc skor her kriter için kullanılan olabilir ve daha önce 56 yapıldığı gibi geçici hedef peptidler, puanları toplamına göre sıralanır edilebilir. Alternatif olarak, bu analiz PeptidePicker, büyük ölçüde hedef peptid seçimi 30 basitleştiren bir web arayüzü kullanılarak otomatik hale getirilebilir (http://mrmpeptidepicker.proteincentre.com/).
Hedef peptidler seçilmiştir ve LC-SRM deneyleri geliştirilmiş sonra, protein eksprese edilir bile son derece Proteotypic ve quantotypic peptid tespit olmayacaktır çünkü biyolojik örneklerin niteliksel LC-SRM deneyler yapılması önemlidir Aletin duyarlık eşiğin altında seviyeleri varsa veya arka parazit özellikle sorunludur. Ayrılık ikinci boyut proteomik derinliğini artırabilir (örn güçlü katyon değişim HPLC, yüksek pH HPLC ve jel içermeyen elektroforez ters fazlı), ancak gerektirirGösterge süresi ve veri analizi önemli ölçüde daha fazla. Alternatif olarak, bir zenginleştirme stratejisi (örneğin, Peptid ve protein düzeyinde immunoenrichment ve hücre parçalanması) proteomik derinliğini artırabilir ve son derece bol proteinlerin bağışıklık sistemine analitleri elüsyona alarak paraziti azaltmak için kullanılabilir.
Geçişler ~ yüzlerce ya da binlerce ~ için numunelerin onlarca tipik geniş enstrüman zaman gerektirir ~ LC-SRM. Bu çalışma için kullanılan değildi rağmen, LC-SRM (önceden belirlenmiş elüsyon zaman penceresi sırasında geçişler ölçüm) zamanlama koşmak başına daha fazla geçişler analizi sağlar. Ayrıca, zamanlama LC gradyanı nispeten boş dönemlerinde SRM hizmet döngüsünü azaltır ve bu geliştirilmiş peptid tespit edilmek ve nicelendirilmek neden olabilir. Ancak, zamanlama peptid elüsyon zamanı güvenle nitel LC-SRM analizinden tespit gerektirir. Numune hazırlama ince değişiklikler, LC-MS cihazı,veya LC-MS yöntemi zamanlama kırpmak ya da tamamen hedef peptitler kaçırmak neden olabilir. Örneğin, biyolojik numune YDEAASYIQSK elüsyon profilleri hafif dış peptit standart olan (Şekil 4B) göre, muhtemelen matriks etkileri kaydırılmıştır.
Özet olarak, adım adım protokolü mutlak protein miktarının için LC-SRM geliştirilmesi ve uygulanması için sunulmuştur. LC-SRM ile protein mutlak niceleme önce laboratuarlar 16,19 arasındaki tekrarlanabilir olduğu gösterilmiştir. Örneği (örn otomasyonu) hazırlık, sıvı kromatografisi, kütle spektrometresi ve veri analizi de dahil olmak üzere Proteomics teknolojileri, hızla gelişiyor ve büyük ölçekli araştırma ve klinik uygulamalar için pratik haline LC-SRM sağlıyor. kantitatif LC-SRM özgünlüğü, duyarlılık, doğruluk, tekrarlanabilir ve yüksek verimli temel araştırma ve biyomedikal için güçlü bir araçtır.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
This research was supported by the Intramural Research Program of the NIH, National Institute of Allergy and Infectious Diseases.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acetonitrile (ACN), LC-MS grade | Fisher | A955-1 | |
| BCA (bicinchoninic acid) protein assay kit | Fisher | 23235 | |
| Beads for bead beating, zirconia-silica, 0.1 mm | BioSpec Products | 11079101z | |
| Bestatin hydrochloride | Sigma | B8385-10MG | |
| Cell culture DMEM (with glucose, without L-glutamine) | Lonza | 12-614F | |
| Cell culture EDTA, 500 mM, pH8 | Gibco | 15575 | |
| Cell culture fetal bovine serum (FBS) | Atlanta Biologicals | S11550 | |
| Cell culture L-glutamine | Sigma | G8540-25G | |
| Cell culture phosphate buffered saline (PBS) pH 7.4 | Gibco | 10010-049 | |
| Cell culture Trypan Blue viability stain, 0.4% w/v | Lonza | 17-942E | |
| Cellometer Auto T4 cell counter | Nexcelom Bioscience | Cellometer Auto T4 | |
| Cellometer Auto T4 disposable counting chambers | Nexcelom Bioscience | CHT4-SD100-014 | |
| Dithiothreitol (DTT) | Sigma | D5545-5G | |
| Formic acid, LC-MS grade, ampules | Fisher | A117-10X1AMP | |
| Hemocytometer, Neubauer-improved, 0.1 mm deep | Marienfeld-Superior | 0640030 | |
| HEPES, 1 M, pH 7.2 | Mediatech | 25-060-CI | |
| Hydrochloric acid, 37% w/w | VWR | BDH3028-2.5LG | |
| Iodoacetamide | Sigma | I1149-5G | |
| Laser Based Micropipette Puller | Sutter Instrument Co. | P-2000 | |
| LC coated silica capillary, 50 µm id | Polymicro Technologies | 1068150017 | |
| LC vial, autosampler, 12 mm x 32 mm polypropylene | SUN SRI | 200-268 | |
| LC vial screw cap, autosampler, pre-slit PTFE/silicone | SUN SRI | 500-061 | |
| Luciferase, from Photinus pyralis | Sigma | L9506-1MG | |
| Pepstatin A | EMD Millipore | 516481-25MG | |
| pH strips colorpHast (pH 0.0-6.0) | EMD Chemicals | 9586-1 | |
| PhosStop phosphatase inhibitor cocktail | Roche | 04906837001 | |
| RapiGest SF | Waters | 186001861 | |
| Sep-Pak SPE, C18 1 ml 100 mg cartridge | Waters | WAT023590 | |
| Sep-Pak SPE, extraction manifold, 20 position | Waters | WAT200609 | |
| Sep-Pak SPE, flat-surfaced rubber bulb | Fisher | 03-448-25 | |
| Sodium hydroxide (NaOH) | Fisher | S318-500 | |
| SpeedVac vacuum concentrator | Fisher | SPD111V | |
| Trifluoroacetic acid (TFA), LC-MS grade | Fisher | A116-50 | |
| Trypsin, sequencing grade, modified | Promega | V5113 | |
| Tube decapper for Micronic tubes | USA Scientific | 1765-4000 | |
| Tubes, 2 ml microcentrifuge, o-ring screw-cap, sterile | Sarstedt | 72.694.006 | |
| Urea | Sigma | U0631-500g | |
| Water, LC-MS grade | Fisher | W6-1 |
Referanslar
- Cox, J., Mann, M. Quantitative high-resolution proteomics for data-driven systems biology. Annu Rev Biochem. 80, 273-299 (2011).
- Zhang, Y., Fonslow, B. R., Shan, B., Baek, M. C., Yates, J. R. 3rd Protein analysis by shotgun/bottom-up proteomics. Chem Rev. 113, 2343-2394 (2013).
- Boja, E. S., Rodriguez, H. Mass spectrometry-based targeted quantitative proteomics: achieving sensitive and reproducible detection of proteins. Proteomics. 12, 1093-1110 (2012).
- Gillette, M. A., Carr, S. A. Quantitative analysis of peptides and proteins in biomedicine by targeted mass spectrometry. Nat Methods. 10, 28-34 (2013).
- Picotti, P., Aebersold, R. Selected reaction monitoring-based proteomics: workflows, potential, pitfalls and future directions. Nat Methods. 9, 555-566 (2012).
- Lesur, A., Domon, B. Advances in high-resolution accurate mass spectrometry application to targeted proteomics. Proteomics. , (2015).
- Wild, D. The immunoassay handbook : theory and applications of ligand binding ELISA., and related techniques. , 4th edn, Elsevier. (2013).
- Sturgeon, C. M., Viljoen, A. Analytical error and interference in immunoassay: minimizing risk. Ann Clin Biochem. 48, 418-432 (2011).
- Adrait, A., et al. Development of a Protein Standard Absolute Quantification (PSAQ) assay for the quantification of Staphylococcus aureus enterotoxin A in serum. J Proteomics. 75, 3041-3049 (2012).
- Lin, D., Alborn, W. E., Slebos, R. J., Liebler, D. C. Comparison of protein immunoprecipitation-multiple reaction monitoring with ELISA for assay of biomarker candidates in plasma. J Proteome Res. 12, 5996-6003 (2013).
- Weiss, F., et al. Catch and measure-mass spectrometry-based immunoassays in biomarker research. Biochim Biophys Acta. 1844, 927-932 (2014).
- Yassine, H., et al. Mass spectrometric immunoassay and MRM as targeted MS-based quantitative approaches in biomarker development: potential applications to cardiovascular disease and diabetes. Proteomics Clin Appl. 7, 528-540 (2013).
- Zhao, L., et al. Quantification of proteins using peptide immunoaffinity enrichment coupled with mass spectrometry. J Vis Exp. , (2011).
- Becker, J. O., Hoofnagle, A. N. Replacing immunoassays with tryptic digestion-peptide immunoaffinity enrichment and LC-MS/MS. 4, 281-290 (2012).
- Wasinger, V. C., Zeng, M., Yau, Y. Current status and advances in quantitative proteomic mass spectrometry. Int J Proteomics. 2013, 180605(2013).
- Abbatiello, S. E., et al. Large-scale inter-laboratory study to develop, analytically validate and apply highly multiplexed, quantitative peptide assays to measure cancer-relevant proteins in plasma. Mol Cell Proteomics. , (2015).
- Rodriguez-Suarez, E., Whetton, A. D. The application of quantification techniques in proteomics for biomedical research. Mass Spectrom Rev. 32, 1-26 (2013).
- Wehr, A. Y., Hwang, W. T., Blair, I. A., Yu, K. H. Relative quantification of serum proteins from pancreatic ductal adenocarcinoma patients by stable isotope dilution liquid chromatography-mass spectrometry. J Proteome Res. 11, 1749-1758 (2012).
- Kennedy, J. J., et al. Demonstrating the feasibility of large-scale development of standardized assays to quantify human proteins. Nat Methods. 11, 149-155 (2014).
- Jensen, K. J., Shelton, P. T., Pedersen, S. L. Peptide synthesis and applications. , 2nd edn, Humana Press Springer. (2013).
- Pratt, J. M., et al. Multiplexed absolute quantification for proteomics using concatenated signature peptides encoded by QconCAT genes. Nat Protoc. 1, 1029-1043 (2006).
- Brun, V., et al. Isotope-labeled protein standards: toward absolute quantitative proteomics. Mol Cell Proteomics. 6, 2139-2149 (2007).
- Guidance for Industry: Bioanalytical Method Validation. , U.S. Food and Drug Administration. Available from: http://www.fda.gov/ucm/groups/fdagov-public/@fdagov-drugs-gen/documents/document/ucm070107.pdf (2001).
- Guidance for Industry: Bioanalytical Method Validation. , U.S. Food and Drug Administration; Revision 1 (draft). Available from: http://www.fda.gov/ucm/groups/fdagov-public/@fdagov-drugs-gen/documents/document/ucm368107.pdf (2013).
- Carr, S. A., et al. Targeted peptide measurements in biology and medicine: best practices for mass spectrometry-based assay development using a fit-for-purpose approach. Mol Cell Proteomics. 13, 907-917 (2014).
- Ori, A., Andres-Pons, A., Beck, M. The use of targeted proteomics to determine the stoichiometry of large macromolecular assemblies. Methods Cell Biol. 122, 117-146 (2014).
- Rosen, O., Feldberg, L., Gura, S., Zichel, R. A new peptide substrate for enhanced botulinum neurotoxin type B detection by endopeptidase-liquid chromatography-tandem mass spectrometry/multiple reaction monitoring assay. Anal Biochem. , (2015).
- Feng, Y., et al. Global analysis of protein structural changes in complex proteomes. Nat Biotechnol. 32, 1036-1044 (2014).
- MacLean, B., et al. Skyline: an open source document editor for creating and analyzing targeted proteomics experiments. Bioinformatics. 26, 966-968 (2010).
- Mohammed, Y., et al. PeptidePicker: a scientific workflow with web interface for selecting appropriate peptides for targeted proteomics experiments. J Proteomics. 106, 151-161 (2014).
- Rodriguez, J., Gupta, N., Smith, R. D., Pevzner, P. A. Does trypsin cut before proline. J Proteome Res. 7, 300-305 (2008).
- Min, X. J., Butler, G., Storms, R., Tsang, A. OrfPredictor: predicting protein-coding regions in EST-derived sequences. Nucleic Acids Res. 33, W677-W680 (2005).
- Lam, H., et al. Building consensus spectral libraries for peptide identification in proteomics. Nat Methods. 5, 873-875 (2008).
- Craig, R., Cortens, J. P., Beavis, R. C. Open source system for analyzing, validating, and storing protein identification data. J Proteome Res. 3, 1234-1242 (2004).
- Desiere, F., et al. The PeptideAtlas project. Nucleic Acids Res. 34, D655-D658 (2006).
- Vizcaino, J. A., et al. The PRoteomics IDEntifications (PRIDE) database and associated tools: status in 2013. Nucleic Acids Res. 41, D1063-D1069 (2013).
- Frank, R. The SPOT-synthesis technique. Synthetic peptide arrays on membrane supports--principles and applications. J Immunol Methods. 267, 13-26 (2002).
- Ong, S. E., Kratchmarova, I., Mann, M. Properties of 13C-substituted arginine in stable isotope labeling by amino acids in cell culture (SILAC). J Proteome Res. 2, 173-181 (2003).
- Mant, C. T., et al. HPLC analysis and purification of peptides. Methods Mol Biol. 386, 3-55 (2007).
- Alterman, M. A., Hunziker, P. Amino acid analysis : methods and protocols. , Humana Press. (2012).
- Maclean, B., et al. Effect of collision energy optimization on the measurement of peptides by selected reaction monitoring (SRM) mass spectrometry. Anal Chem. 82, 10116-10124 (2010).
- Nesvizhskii, A. I. A survey of computational methods and error rate estimation procedures for peptide and protein identification in shotgun proteomics. J Proteomics. 73, 2092-2123 (2010).
- Tabb, D. L., Friedman, D. B., Ham, A. J. Verification of automated peptide identifications from proteomic tandem mass spectra. Nat Protoc. 1, 2213-2222 (2006).
- Freshney, R. I. Culture of animal cells : a manual of basic technique and specialized applications. , 6th edn, Wiley-Blackwell. (2010).
- Oberg, A. L., Vitek, O. Statistical design of quantitative mass spectrometry-based proteomic experiments. J Proteome Res. 8, 2144-2156 (2009).
- Noble, J. E., Bailey, M. J. Quantitation of protein. Methods Enzymol. 463, 73-95 (2009).
- Kiser, J. Z., Post, M., Wang, B., Miyagi, M. Streptomyces erythraeus trypsin for proteomics applications. J Proteome Res. 8, 1810-1817 (2009).
- Reiter, L., et al. mProphet: automated data processing and statistical validation for large-scale SRM experiments. Nat Methods. 8, 430-435 (2011).
- Abbatiello, S. E., Mani, D. R., Keshishian, H., Carr, S. A. Automated detection of inaccurate and imprecise transitions in peptide quantification by multiple reaction monitoring mass spectrometry. Clin Chem. 56, 291-305 (2010).
- Callister, S. J., et al. Normalization approaches for removing systematic biases associated with mass spectrometry and label-free proteomics. J Proteome Res. 5, 277-286 (2006).
- Karpievitch, Y. V., Dabney, A. R., Smith, R. D. Normalization and missing value imputation for label-free LC-MS analysis. BMC Bioinformatics. 13, Suppl 16. S5(2012).
- Oh, S., Kang, D. D., Brock, G. N., Tseng, G. C. Biological impact of missing-value imputation on downstream analyses of gene expression profiles. Bioinformatics. 27, 78-86 (2011).
- Germain, R. N., Meier-Schellersheim, M., Nita-Lazar, A., Fraser, I. D. Systems biology in immunology: a computational modeling perspective. Annu Rev Immunol. 29, 527-585 (2011).
- Futran, A. S., Link, A. J., Seger, R., Shvartsman, S. Y. ERK as a model for systems biology of enzyme kinetics in cells. Curr Biol. 23, R972-R979 (2013).
- Krokhin, O. V. Sequence-specific retention calculator. Algorithm for peptide retention prediction in ion-pair RP-HPLC: application to 300- and 100-A pore size C18 sorbents. Anal Chem. 78, 7785-7795 (2006).
- Manes, N. P., Angermann, B. R., Koppenol-Raab, M., An, E., Sjoelund, V. H., Sun, J., Ishii, M., Germain, R. N., Meier-Schellersheim, M., Nita-Lazar, A. Targeted Proteomics-Driven Computational Modeling of Macrophage S1P Chemosensing. Mol Cell Proteomics. , Forthcoming.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır