Method Article
תגובה נבחרת ניטור ספקטרומטריית מסה לכימות חלבון מוחלט
In This Article
Summary
This protocol describes how to perform absolute quantification assays of target proteins within complex biological samples using selected reaction monitoring. It was used to accurately quantify proteins of the mouse macrophage chemotaxis signaling pathway. Target peptide selection, assay development, and qualitative and quantitative assays are described in detail.
Abstract
Absolute quantification of target proteins within complex biological samples is critical to a wide range of research and clinical applications. This protocol provides step-by-step instructions for the development and application of quantitative assays using selected reaction monitoring (SRM) mass spectrometry (MS). First, likely quantotypic target peptides are identified based on numerous criteria. This includes identifying proteotypic peptides, avoiding sites of posttranslational modification, and analyzing the uniqueness of the target peptide to the target protein. Next, crude external peptide standards are synthesized and used to develop SRM assays, and the resulting assays are used to perform qualitative analyses of the biological samples. Finally, purified, quantified, heavy isotope labeled internal peptide standards are prepared and used to perform isotope dilution series SRM assays. Analysis of all of the resulting MS data is presented. This protocol was used to accurately assay the absolute abundance of proteins of the chemotaxis signaling pathway within RAW 264.7 cells (a mouse monocyte/macrophage cell line). The quantification of Gi2 (a heterotrimeric G-protein α-subunit) is described in detail.
Introduction
ניסויי proteomic המשתמשים בספקטרומטר מסה (MS) יכולים להיות מתוכננים לשימוש או שאינם ממוקד (רובה) או שיטות ממוקדות. פרוטאומיקה גילוי בדרך כלל מסתמכת על הרובה מלמטה למעלה MS, או על ידי שימוש במצב רכישת הנתונים תלויים מסורתי, או על ידי שימוש באחת מטכניקות הנתונים עצמאיים שפותחו לאחרונה (למשל, MS E, רצועה) 1,2. פרוטאומיקה רובה היא כלי רב עוצמה לזיהוי פפטיד תפוקה גבוהה וכימות יחסי, אבל זה בדרך כלל אינו מתאים לכימות מוחלט או למיקוד קבוצות קטנות, מוגדרים (~ עשרות) של חלבונים. שיטת MS משמשת לרוב לפרוטאומיקה ממוקדת נבחרה תגובת ניטור (SRM) בגלל הרגישות גבוהה, המהירות, והטווח הדינמי שלה 3-5. חלופות לSRM כוללות ניטור תגובה מקביל, שמנצל ברזולוציה גבוהה, סריקה מלאה MS 6.
SRM מבוצע בדרך כלל באמצעות ננו-זרימת reverכרומטוגרפיה SED-שלב ביצועים גבוהים נוזלי (ננו-RP-LC) מכשיר מצמידים את יינון ננו electrospray יון מקור (ננו 'חדשות ארכיאולוגיות) מחובר לספקטרומטר מסת quadrupole משולש (QQQ-MS). בניסוי טיפוסי, חלבוני מדגם proteolytically מתעכלים, ופפטידים וכתוצאה מכך chromatographically מופרדים, desorbed, ומיוננים. היונים מבשר וכתוצאה מכך הם מ '/ z מסונן על ידי quadrupole הראשון (Q1) ומקוטע בquadrupole השני (Q2) על ידי התנגשותם עם גז התנגשות. יוני שבר כתוצאה הם מ '/ בquadrupole השלישי (Q3) ולכמת ידי dynode-מסונן z. כל זוג מבשר ויון בר נקרא מעבר, וכל מעבר הוא פיקוח לתקופה קצובה בזמן (הזמן להתעכב, בדרך כלל 2-50 אלפיות שנייה). במהלך LC-SRM, מחזורי QQQ-MS באמצעות רשימה מוגדרת מראש של מעברים (מחזור העבודה היא בדרך כלל ≤3 שניות), וchromatogram של כל מעבר מיוצר.
strateg האלטרנטיביies לכימות חלבון בדרך כלל להשתמש immunoassays כגון כתמי נקודה, כתמים מערביים, ELISAs, microarrays נוגדן, microarrays חלבון שלב הפוך, immunoassays microfluidic, ELISAs הדיגיטלי, וimmunoassays מבוסס microsphere 7. Immunoassays הטוב ביותר יכול להיות משמעותי יותר רגיש מאשר LC-SRM, ותפוקת מדגם של immunoassays יכולה להיות גבוהה באופן משמעותי מזה של LC-SRM 5. עם זאת, immunoassays פיתוח יכול להיות יקר ו / או זמן רב, וכתוצאה מכך יכולים להיות מבחני פגיעים לתגובה צולבת ו / או הפרעות, עולים בקנה אחד עם תא / תמוגה רקמה / שיטות הומוגניות, ו / או לא נוח לריבוב 5,8. חלק מבעיות אלה ניתן לטפל על ידי צימוד טכניקות antibody- ומבוסס MS. לדוגמא, ניתן להעשיר חלבוני היעד באמצעות immunoprecipitation לפני proteolysis וLC-SRM 9-12. לחלופין, טכניקת SISCAPA מעסיקה immunoprecipitation לאחר proteolysis בleve פפטידl 13,14. בנוסף לimmunoenrichment אסטרטגיות, immunodepletion של חלבוני שפע גבוהים יכול להיות מועסק על מנת להגביר את רגישות LC-SRM על ידי צמצום הפרעות על ידי coeluting analytes 15,16.
כימות חלבון מבוסס MS יכול להיות מחולק לכימות יחסי ומוחלט, וגם לתיוג ויציב ללא תווית איזוטופ (למשל, תיוג חילוף חומרים, תיוג כימי, וחלבון שכותרתו כבד ופפטיד סטנדרטים פנימיים). טכניקות ללא תווית יכולות להיות שימושיות עבור כימות חלבון יחסית, אך אינן מתאימים לכימות מדויק מוחלט. לשם השוואה, בטכניקות תיוג צמצמו שגיאה הקשורות להכנת מדגם ושונות MS, ולעתים קרובות משמשות לכימות חלבון ביחס 17. לדוגמא, proteome איזוטופ היציבה שכותרת סטנדרטים (SILAP) מוכנים באמצעות שורת תאי אדם בתרבית אפשרה כימות יחסי של סמנים ביולוגיים פוטנציאליים באמצעות LC-SRM של סרום אנושי 18. כימות מדויק חלבון מוחלט על ידי MS דורש כי סטנדרטים פנימיים חלבון מטוהר, לכמת, isotopically כותרת או הפפטיד להיות ממוסמרים-לדגימות ביולוגיות לפני טרשת נפוצה. השילוב של סטנדרטים הפנימיים שכותרתו איזוטופ הכבד לעבודת LC-SRM מאפשר כימות מוחלטות שהוכחה להיות לשחזור והעברה בין מעבדות 16,19 מאוד.
הסטנדרטים הפנימיים שכותרתו איזוטופ היציב לכימות חלבון מוחלט על ידי MS כוללים תקני פפטיד מוכנים באמצעות סינתזה מוצקה שלב 20, חלבונים מורכבים מתקני פפטיד בשרשור פרוטאז-cleavable 21, וסטנדרטים חלבון באורך מלא 22. יעד שינוי קוולנטיים חלבון והכנת מדגם חלקי (כלומר, תמוגה שלמה מדגם ולתפעול, וsolubilization חלבון שלם, denaturation, אלקילציה, וproteolysis) יכול לערער כימות מדויק. עמ 'הפנימיהסטנדרטים rotein הם הפחות סביר להיות מושפע מרוב הבעיות הפוטנציאליות אלה, אבל הם בדרך כלל הקשים ביותר להכנה. אלטרנטיבה היא לנתח כל חלבון מטרת שימוש בתקני פפטיד פנימיים רבים אשר נועדו כוללת שאריות ילידי איגוף amino- וcarboxy המסוף. לא משנה איזה סוג של התקן הפנימי מועסק, זה צריך להיות ממוסמר-לדגימות ביולוגיות כבתחילת שלב במהלך הכנת מדגם ככל האפשר. כמו כן, טכניקות מדגם מרובה הכנה (למשל, תנאי denaturation שונים) צריכים להיבדק. השימוש בטכניקות מרובות המאונכות ניסיוניות (אימות צולבת ניסיונית) הוא אסטרטגיה מעשית להתגברות על רוב כימות פוטנציאל אתגרי 23-25.
כימות LC-SRM של חלבונים הוא טכניקה גמישה מאוד שכבר בשימוש במגוון רחב של יישומים. יש לציין, זה כבר נעשה שימוש כדי ללמוד סמנים ביולוגיים פפטיד וחלבונים בתוךדגימות קליניות כגון סרום, ביופסיות ליבה, וaspirates מחט הדק 5. LC-SRM שימש גם כדי למדוד את ההרכב של קומפלקסי חלבונים 5,26, כדי לזהות עצביים בוטולינום 27, לכמת דינמיקת זרחון החלבון בתוך מסלולי איתות 5, ולכמת שינויים בקונפורמציה חלבון 28.
המעבדה שלנו היא באמצעות LC-SRM לכמת את חלבוני האיתות שלתווך chemotaxis מקרופאג כדי לתמוך בפיתוח של סימולציות מסלול chemotaxis. התכנית הכוללת של הפרוטוקול (איור 1) מתחילה בדירוג פפטידים היעד המהוסס. בהמשך לכך, סטנדרטים פפטיד חיצוניים גולמיים מסונתזים ומשמשים לפיתוח מבחני LC-SRM לניתוחים איכותיים של דגימות ביולוגיות. אם פפטיד היעד נגזר מדגם הביולוגי מזוהה, הסטנדרטים פפטיד מטוהרים שכותרתו כבדה פנימיים מוכנים לLC-SRM כמותיים. פרוטוקול זה יכול לשמש כדי ACצורה מדויקת לכמת חלבונים ממגוון רחב של דגימות ביולוגיות, ולתמוך בחקירות במגוון רחב של יעדי חלבון.
Protocol
הערה: שיטה זו תוארה בעבר 56.
1. פפטיד יעד בחירה
- ליצור רשימה של חלבוני היעד, וכולל מספר קטן של חלבוני משק לנורמליזציה פני דגימות ביולוגיות, וכולל גם תקן פנימי חלבון (לדוגמא, גחלילית בלוציפראז). לעכל חלבוני היעד לפפטידים tryptic בסיליקון ובאמצעות כלי תוכנה כגון חלבון עיכול Simulator 29,30.
- דרוש שפפטידים הם tryptic באופן מלא ואינו מכילים אתרי מחשוף טריפסין חסרים. הימנע פפטידים עם אתרי מחשוף טריפסין שכנים, כדי למנוע עיכול טריפסין פוטנציאל שלם 31.
- דורש כי אורכו של כל פפטיד הוא 5-20 שאריות. לשקול פפטידים ארוכים יותר, אבל שימו לב שהם בדרך כלל יקרים יותר לסנתז.
- הימנע פפטיד אם זה מתאים לגרסה טבעית גנטית (למשל, אחת-nucleotidפולימורפיזם ה). גם לאשר שאתרי טריפסין אינם מושפעים (שלב 1.2).
- הימנע פפטיד אם זה מתאים לאתר של שינוי posttranslational (PTM). כמו כן, להימנע מפפטיד אם זה יהיה נוטה שינוי כימי במהלך הכנת מדגם LC-MS. באופן ספציפי, למנוע פפטידים נוטים ציסטאין ומתיונין חמצון, asparagine וdeamidation גלוטמין, והיווצרות גלוטמין אמינו מסוף של pyroglutamate. ודא שאתרי טריפסין אינם מושפעים (שלב 1.2).
- יתר על כן, להימנע מפפטידים שמקורם amino- החלבון וcarboxy-טרמיני כי טרמיני החלבון נוטה שינוי posttranslational (הפסד מתיונין אמינו מסוף וacetylation, וamidation carboxy מסוף).
- דורש שכל פפטיד היעד הוא ייחודי לכל חלבון מטרה. אם זה לא אפשרי, דורש שפפטיד הוא ייחודי לקבוצה של isoforms / homologues. פנק את פפטידים שונים רק על ידי אוצין / החלפה isoleucineכאילו היו זהים בעת קביעת ייחוד פפטיד כי אלה לבצע כמעט זהים בLC-SRM.
- אם ניתוח transcriptomic מקיף של כל הדגימות הביולוגיות שבוצע (למשל, RNA-seq), לקבוע פפטיד ייחוד באמצעות בתרגומי סיליקון לפרוטוקול רצפי 32 במקום להשתמש בכל proteome של המינים.
- דרוש שפפטידים היעד הם proteotypic. לזהות פפטידים proteotypic באמצעות ספקטרומטר מסת רובה 1,2 של הדגימות הביולוגיות הנלמד. לחלופין, לאחזר הזדהויות פפטיד של פפטידים proteotypic ממאגרי מידע פרוטאומיקה המקוונת כגון ספקטרומטר מסת NIST ספריות ה33 (http://peptide.nist.gov/), גלובל Proteome מכונת 34 (X ספריות רפאים HUNTER מhttp: // www .thegpm.org / HUNTER / index.html, והזדהויות GPMDB פפטיד מhttp://gpmdb.thegpm.org/), PeptideAtlas 35 (http://www.peptideatlas.org/), ובסיס נתוני PRIDE 36 (http://www.ebi.ac.uk/pride/archive/).
- אם רמה-תמליל ניתוחים כמותיים של הדגימות הביולוגיות בוצעה (למשל, RNA-seq, qPCR), ולאחר מכן להימנע ממיקוד פפטידים שמתאימים לתמלילי שפע הנמוכים יחסית.
- במידת צורך, פפטידים יעד נבחרים שיכול לשמש עבור מבחני LC-SRM של orthologs חלבון המטרה (למשל, לassay שני בני אדם וצורות העכבר של חלבון מטרה).
- בחר לפחות שני פפטידים יעד לחלבון מטרה (אם אפשר).
2. הכנת פפטיד התקנים
הערה: חלק זה של הפרוטוקול מתארת את ההכנה של קבוצה של עשרים סטנדרטים lyophilized פפטיד (כל nmol 1 היא בכמות) לניתוחים במורד הזרם. למספר שונה של פפטידים, או לכמויות פפטיד שונות, זה צריך להיות בהתאם.
- הכן סטנדרטים lyophilized פפטיד (≥1 nmol) באמצעות טכנולוגית סינתזת פפטיד כגון סינתזת SPOT 20,37.
- ודא ששאריות ציסטאין תקני פפטיד החיצוניים carbamidomethylated (המבנה הכימי שנוצר על ידי אלקילציה iodoacetamide). לעומת זאת, להבטיח כי שאריות ציסטאין תקני פפטיד הפנימיים הן ללא שינוי (אלה יהיו alkylated במהלך הכנת מדגם, שיתוארו להלן).
- עיצוב הסטנדרטים פפטיד פנימיים כך שהם מכילים ילידי איגוף שאריות amino- וcarboxy המסוף (כדי לשלוט על יעילות עיכול טריפסין; כל אחד הוא בדרך כלל ארוך 05:57 שאריות).
- עיצוב סטנדרטים פפטיד פנימיים, כך שהם איזוטופ היציב שכותרתו. קחו למשל את הפרופיל הטבעי איזוטופים של פפטיד היעד ודיוק מדידת המסה של MS בעת בחירת אסטרטגית תיוג פפטיד. אל תשתמשו בסטנדרטי פפטיד deuterated בגלל סיבות deuteration פפטיד זמן שמירת LC-הפוך שלבים להעביר 38.
הערה: בדרך כלל, הסטנדרטים פפטיד הפנימיים tryptic מסונתזים באמצעות ~ 98% טהור [13 C 6, 15 N 4] Arg ו[ 13 C 6, 15 N 2] ליס התאגד בcarboxy-טרמיני. - לטהר סטנדרטים פפטיד פנימיים באמצעות HPLC 39, ובאופן מדויק לכמת אותם 40.
- להוסיף של 0.1% 100 μl נ / חומצה פורמית נ ', 20% אצטוניטריל V / V (ACN) לכל תקן פפטיד lyophilized 1 nmol לייצר ריכוז הפפטיד של 10 מיקרומטר (טיפול שימוש כפפטיד lyophilized יכולה להיות מאוד בצפיפות נמוכה ויכול ללכת לאיבוד בקלות). מערבולת הדגימות למשך 2 דקות ואמבטיה sonicate במשך 5 דקות על מנת להבטיח כי פירוק פפטיד הוא מלא.
- בריכת פפטידים המומסים, ולרכז את התערובת וכתוצאה מכך רכז ואקום לנפח סופי של 80 μl. הוסף 20 μl של ACN לפזר כל פפטיד זירז.
הערה: המדגם עכשיו שיתוףntains 10 מיקרומטר של כל פפטיד ו -20% ACN V / V. - לסטנדרטים פפטיד פנימיים, להכין סדרת דילול לLC-SRM כמותית:
- הכן של דילול 1 מיקרומטר 100 μl: לשלב 90 μl של 20% נ / ACN נ ו -10 μl של תערובת הפפטיד 10 מיקרומטר.
- הכן של דילול 100 ננומטר 100 μl: לשלב 90 μl של 20% נ / ACN נ ו -10 μl של תערובת הפפטיד 1 מיקרומטר.
- לסטנדרטי פפטיד חיצוניים, להכין של דילול 1 מיקרומטר לLC-MS 100 μl על ידי שילוב של 90 μl של 0.1% נ / חומצה פורמית נ ו -10 μl של תערובת הפפטיד 10 מיקרומטר.
הערה: המדגם מכיל כעת 1 מיקרומטר של כל פפטיד, 0.1% נ / חומצה פורמית נ ', ו -2% נ / ACN נ', והוא מוכן לשמש לפיתוח assay LC-SRM.
3. LC-SRM Assay פיתוח
- לנתח את התערובות של הסטנדרטים החיצוניים פפטיד (בערך 1-10 pmol של כל פפטיד להזרקה) על ידי רובה MS באמצעות ננו-זרימת HPLמערכת C מצמידים את ספקטרומטר מסת quadrupole משולש (LC-QQQ-MS (/ MS)).
- השתמש מערכת LC-MS מצויד בטור נימים צפופים עם C-18 תקשורת (≤5 קוטר מיקרומטר, ~ 200 נקבוביות A, אורך ≥10 סנטימטר, ID = 50-100 מיקרומטר) וקצה ננו 'חדשות ארכיאולוגיות (בדרך כלל מופק באמצעות לייזר-חולץ). ודא שכל ריצת LC-MS כוללת שיפוע ~ 60 דקות ליניארי (בדרך כלל, 0-40% B מרכך), צעד התחדשות טור (~ 80% B מרכך), וצעד מחדש איזון טור (~ 0% B מרכך ) (= 0.1% v / v חומצה פורמית בH 2 O, B מרכך = v 0.1% / V חומצה פורמית בACN, קצב זרימה = 200-800 / דקת NL, מתח מרכך ESI = 1,800 V, רוחב בידוד Q3 = 0.7 מ '/ z, לחץ ארגון Q2 = 1.5 mTorr).
- עבור כל סריקת יון מבשר, דינמי לבחור את הראש ~ 10 יונים מבשר אינטנסיביים ביותר לספקטרומטר מסת טנדם (MS / MS). הפעל כל דגימה בשני עותקים, כך ששתי רמפות אנרגיית התנגשות שונות משמשות: אחד שנועד לפצל בצורה אופטימלית +2 יונים מבשר, והשניל+3 מבשר היונים 41.
- בצע את LC-QQQ-MS (/ MS) ניתוחים באמצעות סריקת יון המבשרת Q3 (סריקת יון המבשר Q1 יכול לגרום עוקב של פסגות היון מבשר כתוצאה מהתנגשויות ארגון אנרגיה נמוכה בQ2).
- ודא כי מערכת LC-MS מבצעת כראוי על ידי ניתוח דגימות QC ומשכפל טכני. למנוע שריד מדגם באמצעות עמודות LC טריות ועל ידי הפעלת החסר מרובה בין דגימות.
- לנתח את נתוני הרובה LC-QQQ-MS (/ MS) וכתוצאה מכך באמצעות מסד נתוני חיפוש נגד הרצפים של הסטנדרטים פפטיד החיצוניים 42. אם מתאים, להשליך הזדהויות פפטיד מעורפלות באמצעות עשרות זיהוי פפטיד ביטחון (לדוגמא, ערכי ציפייה) או על ידי שימוש במודלים סטטיסטיים 42. ללא קשר, לבחון באופן ידני את כל הזדהויות פפטיד 43 כדי להבטיח שהם כולם חד-משמעיים.
- השתמש בהזדהויות פפטיד רובה MS להונותstruct ספריית ספקטרום באמצעות תוכנה כגון סקייליין.
- הכן רשימת מעבר LC-SRM באמצעות 3-10 המעברים אינטנסיביים ביותר ליון מבשר (+2 +3 ויונים מבשר; +1 ו+2 בר יונים; y-, B-, ו- יונים ש≥2 שאריות ארוך).
- בטל מעבר אם הערכים מ '/ z יון מבשר ובר חפיפה בתוך דיוק מדידת מסה של QQQ-MS (פיצול יון המבשר הוא לפעמים לא שלם; לזכור לשקול monoisotopic וצורות איזוטופ הטבעיים הכבדות, כמו גם ללא התווית ו כותרת כבדה צורות).
- באופן דומה, להשליך מעבר אם מ '/ z יון הבר חופף לזה של יון בר שונה מאותו היון המבשר.
- השתמש ברשימות המעבר וכתוצאה מכך לבצע LC-SRM ניתוחים של התערובות של הסטנדרטים פפטיד החיצוניים (לבצע ספקטרומטר מסה כפי שמתואר בשלב 3.1; Q1 ורוחב בידוד Q3 = 0.7 מ '/ z; להתעכב זמן = 2-50 אלפיות שני).
- מאnually לסקור את נתוני LC-SRM וכתוצאה מכך ולמחוק את כל מבחני ביצועים גרועים (הניתוח של נתונים LC-SRM מתואר בסעיף 5).
4. LC-SRM מבחני של דגימות ביולוגיות
- הכן את המנות של תאים בתרבית 44. אם תנאי ניסוי מרובים מושווים, בלוק ואקראי הדגימות כדי להפחית כל הטיות שיטתיות אפשריות 45.
- לכל מנה של תאים, לשאוב את מדיום תרבית תאים לבזבז ולהשעות את התאים במאגר סרום ללא 44. אם יש צורך, לשטוף את התאים במאגר סרום חופשי כדי להסיר כל חלבון תאי שנותר.
- עבור כל דגימה, לספור את מספר תאי קיימא והכוללים באמצעות כתם כדאיות (למשל, trypan כחול) וhemocytometer או נגד תא אוטומטי 44.
- גלולה התאים על ידי צנטריפוגה, ולשאוב supernatants לבזבז 44 (טיפוסי גלולה נפח תא הוא ~ 30 μl).
- להוסיף 400 μl של האוריאה תמוגה הצפת או פעיל שטח תמוגה מאגר לכל תא גלולה (100 pH HEPES מ"מ ∙ NaOH 8, 10 מיקרומטר bestatin הידרוכלוריד, 10 מיקרומטר pepstatin, וגם 8 מ 'אוריאה או 0.1% w / שטח V (בהתאמה ); מוכן טרי; להשתמש שטח MS-תואם חומצה יציבה כגון RapiGest SF או PPS השקט פעיל שטח). אם באמצעות מעכבי פרוטאז אחרים, להבטיח שהם לא לעכב טריפסין.
- מערבבים כל דגימה באמצעות pipetting העדין, ולהעביר את כל צינור 2 מיליליטר (עם כובע בורג עם טבעת O) המכיל ~ של 0.1 מ"מ zirconia / חרוזים סיליקה 100 μl (לציין כי חרוזים יכולים לגרום לצינורות Snap-כובע לדלוף ). Lyse את התאים על ידי vortexing הדגימות במשך 5 דקות במהירות מלאה (זה lyses התאים על ידי מכות חרוז).
- לחלופין, lyse התאים באמצעות שיטה מכאנית שונה (לדוגמא, באמצעות טיפים עיתונות או הומוגניות צרפתית).
הערה: הימנע מצנטריפוגה lysates תא משום שזה עלול גלולה חלבון זירז שיכולים םוריהherwise להתעכל tryptically וזוהה על ידי LC-MS.
- לחלופין, lyse התאים באמצעות שיטה מכאנית שונה (לדוגמא, באמצעות טיפים עיתונות או הומוגניות צרפתית).
- לדגימות מפוגלים פעילי השטח, דגירה אותם 90 מעלות צלזיוס במשך 10 דקות כדי לסייע הומוגניזציה מדגם וdenaturation חלבון.
- אמבט sonicate הדגימות למשך 10 דקות בטמפרטורת חדר כדי לסייע denaturation הומוגניזציה והחלבון.
הערה: חיץ lysates ותמוגה ניתן לאחסן ב -80 ° C (מאגר תמוגה יהיה צורך לשלבים 4.9 ו4.13). - בצע assay ריכוז חלבון 46 (לדוגמא, assay חומצת bicinchoninic) של lysates (ושל מאגר תמוגה כניסוי שליטה).
- עבור ניתוחים איכותיים (כלומר, אין סטנדרטים פפטיד פנימיים יהיו ממוסמרים-לדגימות), מיקרוגרם 200 פיפטה (מסת חלבון) של lysate תא לתוך צינור microcentrifuge טרי 1.5 מיליליטר. לניתוחים כמותיים, להכין ארבע דגימות כאלה לסדרת דילול איזוטופ יציבה.
- עבור כל דגימה, להוסיף חלבון סטנדרטי פנימי (למשל </ Em>, להוסיף ~ 5 pmol של ~ 98% לוציפראז גחלילית טהורה).
- לניתוחים כמותיים, להוסיף את סדרת דילול איזוטופ היציבה של תערובת equimolar של הסטנדרטים פפטיד הפנימיים (למשל, 0, 0.2, 2, 20 pmol של כל פפטיד) לדגימות.
- במקביל, להכין דגימות שליטה באמצעות הסטנדרטים פפטיד הפנימי בלבד (כלומר, לא lysate תא) (לדוגמא, 0, 0.2, 2, 20 pmol של כל פפטיד).
- כמו כן להכין דגימות שליטה באמצעות הסטנדרטים פפטיד פנימיים והחיצוניים (לדוגמא: 2 pmol של כל תקן פפטיד חיצוני, ו0, 0.2, 2, ו -20 pmol של כל תקן פפטיד הפנימי).
הערה: ודא שסטנדרטי פפטיד חופשיים של חומצה פורמית כפי שעלול להפריע לעיכול טריפסין.
- הוסף חוצץ תמוגה כך שכל הדגימות הם כרכים זהים. הערה: טיפוסי נפח דגימה הוא 70 μl, כך נפח זה ישמש לפרוטוקול זה.
- להפחית שאריות ציסטאין חלבון על ידי הוספת 0.7 μl של 1 M DTT (מוכנים טרי) לכל דגימה (ריכוז DTT הסופי הוא 10 מ"מ) ודוגרי הדגימות ב 60 מעלות צלזיוס במשך 30 דקות.
- cystines alkylate חלבון על ידי הוספת 7 μl של iodoacetamide נאגר (500 מ"מ pH iodoacetamide, M HEPES 1 ∙ NaOH 8; מוכנה טרי) לכל דגימה (ריכוז iodoacetamide הסופי הוא 50 מ"מ) ודוגרי הדגימות בטמפרטורת חדר למשך 20 דקות בחושך (Iodoacetamide הוא רגיש לאור). במידת צורך, להרוות את iodoacetamide שנותר על ידי הוספת DTT לריכוז סופי של 50 מ"מ.
- לכל אחת מהדגימות מפוגל באמצעות אוריאה, להוסיף 482 μl של 100 מ"מ HEPES ∙ pH NaOH 8, כך שריכוז האוריאה הסופי הוא 1 M (טריפסין מעוכב באופן משמעותי ב> 1 M אוריאה 47).
- Tryptically לעכל את החלבונים לפפטידים.
- עבור כל דגימה המכילה lysate תא, להוסיף 8 μl של טריפסין כיתה רצף / μl שונה 0.5 מיקרוגרם כך שתרכיזי טריפסין הסופייםיון הוא 01:50 (w חלבון: w) טריפסין: מדגם, ודגירת המדגם ב 37 מעלות צלזיוס במשך 18 שעות.
- עבור כל דגימה שאינו מכיל lysate תא, להוסיף 0.5 μL של 0.5 מיקרוגרם / טריפסין כיתה שונה רצף μl, דגירה המדגם ב 37 מעלות צלזיוס במשך שעה 2 (כל אחד מאלה הם דוגמאות לניסויי שליטה, ובדרך כלל מכיל רק 10 ng -10 מיקרוגרם של פפטיד + מסת חלבון).
- לכל אחת מהדגימות מפוגלים האוריאה, להוסיף 440 μl של 2% נ / חומצה פורמית נ (ריכוז החומצה פורמית הסופי הוא 1% V / V). ודא שדגימות אלה pH ~ 3.
- לכל אחת מהדגימות מפוגלים פעילי השטח, להוסיף 914 μl של 0.5% v / v TFA (ריכוז TFA הסופי הוא 0.5% V / V). ודא שדגימות אלה pH ~ 1.5. דגירה דגימות אלה על 37 מעלות צלזיוס למשך 60 דקות לhydrolyze פעילי השטח.
- Microcentrifuge כל הדגימות ב21,000 × גרם במשך 20 דקות בטמפרטורת חדר כדי גלולה קבוצת הזנב פעילי שטח וכל PreC אחרipitates שסותם מחסנית SPE C-18.
- שלב מוצק לחלץ כל אחד מsupernatants באמצעות מחסנית SPE חד פעמית C-18 (0.1% v / v חומצה פורמית הצפת =; הצפת B = 0.1% נ / חומצה פורמית נ ', 80% נ / ACN נ; ~ 100 מ"ג C- 18 שרף לכל מחסנית). לאלץ את השלבים הניידים באמצעות מחסנית SPE C-18 באמצעות הנורה גומי-עלה שטוחה, באמצעות סעפת חילוץ, או על ידי צנטריפוגה את המחסנית בצינור 15 מיליליטר צנטריפוגות ב 10 × גרם במשך 5 דקות.
- להרטיב את הטור על ידי יישום 1 מיליליטר של החיץ B, לאזן את זה על ידי החלת 1 מיליליטר של חיץ פעמיים, להחיל את המדגם, ולשטוף את המחסנית על ידי יישום 1 מיליליטר של חיץ פעמיים. Elute פפטידים על ידי יישום 1 מיליליטר של החיץ B לאט (~ 2 דקות).
- להתרכז כל eluate ברכז ואקום לנפח סופי של 100 μl להתאדות משם ACN. הוסף 200 μl של H 2 O לכל דגימה, ולהתרכז בכל רכז ואקום לנפח סופי של 98 μl להתאדות משם כל מחדש אפשריהנותר ACN.
- הוסף 2 נ / חומצה פורמית נ μL של 5% בACN מדגם זה (ריכוזי המדגם הסופיים הם 0.1% נ / חומצה פורמית v, 2% נ / ACN v).
הערה: ניתן לאחסן הדגימות ב -80 ° C. - לנתח דגימות באמצעות LC-SRM (כמו בשלב 3.4). לאיכותי LC-SRM הניתוחים, להפעיל את הדגימות ביולוגיות וסטנדרטי פפטיד החיצוניים, ולנתח את כל הנתונים וכתוצאה מכך יחד. לכמותיים LC-SRM ניתוחים, הפעל את סדרת דילול איזוטופ של כל דגימה ביולוגית, וגם להפעיל את הדגימות מורכבות מתקני פפטיד לבד, ולנתח את כל הנתונים וכתוצאה מכך יחד.
ניתוח 5. LC-SRM נתונים
הערה: זיהוי וכימות פפטיד ניתן לפשט מאוד וחלקי אוטומטי באמצעות תוכנה כגון סקייליין, אך הוא עדיין מומלץ מאוד שכל ביאור הנתונים ייבדק באופן ידני. כמו כן, עדיף שלא לכלול מידע ברמת החלבון בANNOT מדריך לני של נתונים LC-SRM כדי למנוע הטיה.
- עבור כל זיהוי פפטיד, לאשר כי את הצורה של כל פרופיל elution המעבר היא בערך גאוס. עבור כל מעבר, לוודא שפרופיל elution הוא התוצר של אותות מרובים שנמדדו על ידי גלאי MS (כלומר, אינו התוצר של קוצים אקראיים אחד או שניים של רעש MS).
- עבור כל זיהוי פפטיד, להבטיח כי פרופיל elution פפטיד כל נבחר. הימנע באופן ידני התאמת גבולות פרופיל elution של המשנה של זיהוי פפטיד (טופס פפטיד שכותרתו הכבד, את הטופס ללא תווית, יונים מבשר בודדים, ומעברים בודדים).
- ודא שיש כל פרופיל elution מעבר יחס אות לרעש (s / n) ≥3. הערה: "רעש" מתייחס לרעש MS אקראי, לא לשחזור אות מanalytes coeluting. פונקציות החלקת chromatogram יכולות לסייע באופן משמעותי את הניתוח של נתונים רועשים.
- עבור כל זיהוי פפטיד,לאשר כי כל המעברים יש פרופילי elution כמעט זהים (ולא רק פעמים שיא שיא שווים; ייתכן שיש לי פרופילי elution אמפליטודות שונות).
- עבור LC-SRM הניתוחים של כמות גדולה של הסטנדרטים פפטיד (בדרך כלל ≥100 fmol של כל פפטיד), לאשר את פרופילי elution פפטיד המקביל הם מאוד אינטנסיביים (בדרך כלל s / n ≥100), ושהזדהויות פפטיד הן חד-משמעיות. הערה: הזדהויות בטוחים מאוד אלה יהיו קריטיות לזיהוי פפטידים המופק ממדגם הביולוגיים המתאימים.
- עבור כל זיהוי פפטיד, לאשר כי עוצמות המעבר היחסית תואמות את אלה של תקן פפטיד זיהה בביטחון. במידת צורך, לבטל יחסית פרופילי elution המעבר רועשים, בעצימות נמוכות, אבל לאשר שאף אחד מהמעברים יחסית אינטנסיביים חסר. להתעלם פרופילי elution המעבר יחסית אינטנסיביים שמושפעים באופן משמעותי וחד-משמעי על ידי שיתוףמשחררי מזהמים.
- עבור כל זיהוי פפטיד, להעריך את ההסתברות שהופק באופן אקראי על ידי אות רקע (רעש MS האקראי בתוספת אות לשחזור מanalytes coeluting).
- להעריך הסתברות זו באופן ידני על ידי בחינת chromatogram LC-SRM כל והערכת הייחודיות של כל זיהוי פפטיד. לייצר סט של הזדהויות פפטיד בטוחים כי יש שיעור מוערך שווא גילוי (FDR) של 5%. השתמש בקריטריונים מחמירים (≤1% למשל, רוזוולט) אם נדרש ביטחון גבוה יותר להגדיר של הזדהויות (שימוש בקריטריונים רופפים יותר אינו מומלצים).
- לחלופין, להשתמש באלגוריתם mProphet 48 או אלגוריתם ביקורת 49, אבל לבחון באופן ידני את התוצאות.
- עבור כל זיהוי פפטיד, לאשר כי זמן elution הנצפה עולה בקנה אחד עם הידרופוביות של פפטיד (Skyline נועד לבצע חישוב זה).
- לכל פפטיד, אשר שזמן elution עקבי לאורך ריצות LC.
הערה: LC-SRM לפעמים ניתוחים לייצר פרופילי elution שמוטים באופן שיטתי בין ריצות. משמרות שיטתיות הן צפויות לאחר שינויי מכשיר כגון החלפת עמודה. כמו כן, פפטידים מוקדמים משחררי יכולים להיות מועדים להעברה (במיוחד אם הטור נטען קרוב לקיבולת), ופפטידים משחררי מאוחר יכולים להיות גם נוטים הסטה. זיהוי פפטיד הוא החברה מלא. - כדי לשפר את כימות פפטיד, reinspect כל זיהוי פפטיד וזורקי פרופיל elution מעבר אם זה רועש במיוחד בהשוואה לפרופילי elution מעברו השני של זיהוי פפטיד. מחק את פרופיל elution מעבר אם עוצמת מעברו היחסית היא לא נכונה (בהשוואה לסטנדרטית פפטיד).
- בדוק את הגבולות של כל פרופיל יון מבשר וelution המעבר. במידת צורך, להתאים בזהירות את גבולות פרופיל elution כדי לחתוך משם אות רקע (או לירקע mprove הערכת אות).
- לכל תקן פפטיד פנימי, לבדוק אם הוא נגוע בסכום זיהוי של פפטיד אור (שנקבע על ידי LC-SRM ניתוחים של הסטנדרטים פפטיד הפנימיים לבד, שתואר לעיל). בהמשך לכך, לבטל את כל פרופילי elution פפטיד אור שנפגעו באופן משמעותי על ידי זיהום האור-פפטיד בסטנדרטי פפטיד הפנימיים.
- לכמת כל פרופיל elution מעבר על ידי חישוב שטח שיא LC. אם מתאים, לנכות את אות רקע המוערכת. לכמת כל פרופיל elution פפטיד על ידי סיכום ערכי כימות מעבר המקביל (להלן, זה נקרא ערך "Sum_Peak_Area"). עבור כל ערך Sum_Peak_Area פפטיד המדגם ביולוגי, לחשב את השפע טוחנת פפטיד המדגם הביולוגי תוך שימוש בנתונים מLC-SRM של הסטנדרטים פפטיד פנימיים או חיצוניים (שימוש רק המעברים שהיו לכמת בהצלחה על ידי שני פפטיד המדגם הביולוגיLC-SRM וכי ברמת פפטיד).
- כימות באמצעות סטנדרטים פפטיד חיצוניים (לא מומלץ):
- עלילה ערכי Sum_Peak_Area הסטנדרטי פפטיד החיצוני לעומת ערכי שפע פפטיד החיצוני סטנדרטיים הטוחנות. לייצר עקומה סטנדרטית על ידי התאמת רגרסיה לינארית לנתונים (בדרך כלל, יש להשתמש ברכיב ליניארי רק של הטווח הדינמי; יש להשתמש בכל רכיב קוי בזהירות רבה). עבור כל ערך Sum_Peak_Area פפטיד המדגם ביולוגי, להשתמש בעקומה סטנדרטית לחישוב השפע טוחנת פפטיד.
הערה: שיטת כימות זו אינה מומלצת מכיוון שהיא דורשת כי הכנת המדגם וLC-SRM להיות יכולת הדגמה בחזקה כי הדגימות הביולוגיות והסטנדרטים פפטיד חיצוניים ערוכות ונותחו על ידי LC-SRM בנפרד. כמו כן, הוא אינו לוקח בחשבון השפעות מטריצה (השפעות בשל מרכיבי מדגם אחר מאשר אנליטי).
- עלילה ערכי Sum_Peak_Area הסטנדרטי פפטיד החיצוני לעומת ערכי שפע פפטיד החיצוני סטנדרטיים הטוחנות. לייצר עקומה סטנדרטית על ידי התאמת רגרסיה לינארית לנתונים (בדרך כלל, יש להשתמש ברכיב ליניארי רק של הטווח הדינמי; יש להשתמש בכל רכיב קוי בזהירות רבה). עבור כל ערך Sum_Peak_Area פפטיד המדגם ביולוגי, להשתמש בעקומה סטנדרטית לחישוב השפע טוחנת פפטיד.
- כימות באמצעות פנימיסטנדרטים פפטיד (מומלץ):
- עבור כל ערך ביולוגי פפטיד מדגם Sum_Peak_Area וערך Sum_Peak_Area הסטנדרטי המתאים שכותרתו כבדה פפטיד הפנימי, לחשב את האור / היחס כבד. השתמש יחס זה כמדד לאור / יחס שפע טוחנת פפטיד הכבד המתאים כדי לחשב את השפע טוחנת של פפטיד המדגם הביולוגי. באופן ספציפי, השפע טוחנת פפטיד המדגם הביולוגי שווה השפע טוחנת סטנדרטי פפטיד הפנימי מוכפל באור / יחס Sum_Peak_Area הכבד.
- לכל פפטיד לשכפל והיעד ביולוגי, לזהות את מגוון יניארי של כימות LC-SRM על ידי יצירת עקומה סטנדרטית באמצעות רגרסיה ליניארית. באופן ספציפי, העלילה ערכי שפע טוחנת סטנדרטיים פפטיד הפנימי לעומת הערכים הכבדים / אור Sum_Peak_Area יחס (שים לב שמסת המדגם הביולוגית היא קבועה על פני המערך). דורש שכל דגימת ערך Sum_Peak_Area פפטיד ביולוגי נמצא בטווח ליניארי (typicברית, יש להשתמש ברכיב ליניארי רק של הטווח הדינמי; יש להשתמש בכל רכיב קוי בזהירות רבה). כמו כן, לבצע שלב זה עבור כל מעבר פפטיד היעד.
הערה: אנליטי כימות על ידי LC-QQQ-SRM צריכה להיות לינארית על פני טווח דינמי רחב (~ 10,000). בקצה הנמוך, אות רקע (רעש MS האקראי בתוספת אות לשחזור מanalytes coeluting) תפחית דיוק כימות ודיוק. בקצה העליון, הרוויה גלאי תגרום הליניאריות (סופו של דבר, זה יכול לגרום לפרופילים elution להיות התחלה שטוחה בעוצמת אות ספציפית).
- כימות באמצעות סטנדרטים פפטיד חיצוניים (לא מומלץ):
- אם מתאים, לבצע נורמליזציה עולמית ברחבי הדגימות, כגון נורמליזציה נטייה מרכזית 50, לתיקון להבדלים קלים בכמות מדגם לפני spiking-בסטנדרטים של פפטיד הפנימיים. במידת צורך, להשתמש רק בחלבוני משק הבית מהשלב 1.1.
- במידת צורך, לזקוף חסר quantificatיון ערכי 51,52.
הערה: זה לא תקין פשוט להחליף ערכים חסרים במחצית הגבול התחתון של כימות (LLOQ) או חצי לגבול של זיהוי (לוד), כי כך היה באופן מלאכותי להפחית שונות כימות, ועלול לגרום למבחן סטטיסטי (למשל, ANOVA ) בהפקת תוצאה חיובית כוזבת (אני טעות מסוג). עם זאת, התעלמות ערכים חסרים יכולה גם להיות בעייתית. לדוגמא, אם מחצית ערכי השפע האמיתיים נמצאים מתחת ללוד, ואת החצי השני הוא מעל LLOQ, אז הממוצע שנצפה שפע היה להעריך את משמעות שפע אמיתי. - ודא שהמבחנים לספק הנחיות מקובלות באופן רחב לLC-SRM 23-25. יש לציין, שדורשים מקדם שונה של ערכי הכימות הוא בדרך כלל ≤25% עבור מבחני קליניים, ו≤35% עבור מבחני שאינם קליניים 25. עבור מבחני LC-SRM הקשורים למוצרים או שירותי בריאות או רפואה וטרינרית שכדי להיחשב ליישום רגולציהRoVaL, דורש כי מבחני לספק את דרישות דיוק מחמירות למבחנים כגון: "הדיוק נקבע בכל רמת ריכוז לא יעלה על 15% ממקדמים שונה (CV) למעט LLOQ, שבו לא יעלה על 20% מ קורות חיים "23,24.
תוצאות
הפיתוח של מודלים חישוביים חזוי של מסלולי העברת אותות הוא אחת ממטרות היסוד של ביולוגיה מערכות 53. למרבה הצער, גם למסלולי איתות שנחקרו רב ויש לו משמעות קלינית גבוהה, זה עדיין בדרך כלל לא ניתן לחזות התנהגות כמותית מסלול בתגובה להפרעות (למשל, זה נכון לMAPK ERK המסלול / 54). לאחרונה, בחקירה מועסק פרוטאומיקה ממוקדת, transcriptomics, ומודלים חישוביים וסימולציה ללמוד chemotaxis מקרופאג עכבר מסלול איתות 56. מוקד החקירה היה chemotaxis תיווך sphingosine-1-פוספט של RAW 264.7 תאים (קו תא מונוציטים עכבר / מקרופאג). כדי להקל על דוגמנות מסלול, מבחני LC-SRM פותחו ובוצעו כדי למדוד את השפע המוחלט של חלבוני מסלול chemotaxis בתוך RAW 264.7 תאים. ערכי שפע וכתוצאה מכך היו שימושד כפרמטרים של מודל המסלול.
התכנית הניסיונית הכוללת (איור 1) החלה עם רשימה של חלבוני היעד, שכללו I2 G, α-מקטע G-חלבון heterotrimeric. ההצלחה של הפרוטוקול הכולל תלויה מאוד בבחירת מטרות פפטיד שproteotypic וquantotypic, כגון YDEAASYIQSK. תערובות של סטנדרטים פפטיד חיצוניים הוכנו ונותחו על ידי הרובה LC-QQQ-MS (/ MS). ספקטרום מסת טנדם YDEAASYIQSK וכתוצאה מכך היה מורכב מכמה יונים שבר, והיה לו רקע נמוך (איור 2). הספקטרום שימש להלחין רשימות יעד LC-SRM מכילות עשרה יוני בר האינטנסיבי ביותר העליונים ליון מבשר.
תערובת של 409 תקני פפטיד חיצוניים ("JPT409") נותחה בשלושה עותקים על ידי איכותי LC-SRM (מידע לא מוצג). מדגם זה כלל שלושה פפטידים I2 G, וזיהוי של כל שלוש היהשפט להיות בטוח. בהמשך לכך, 264.7 דגימות RAW (משכפל ביולוגי "RAW1" ו- "RAW2") והמדגם JPT409 היו כל ניתחו בשני עותקים (שני משכפל טכני LC-SRM) על ידי LC-SRM האיכותי (אלה שישה LC-SRM ניתוחים בוצעו כדומה כ אפשרי). פפטיד YDEAASYIQSK זוהה בביטחון בכל ששת הניתוחים (איורים 3 א - ג). דפוסי עוצמת מעבר YDEAASYIQSK היו עקביים בשישה LC-SRM הניתוחים, ואלה היו דומים פחות או יותר לרובה LC-MS (/ MS) דפוס ("הספרייה" לשכפל של איור 3 ג).
הדפוס של עוצמות מעבר הוא לבד לא תמיד מספיק לזיהוי בטוח של פפטיד. הידרופוביות פפטיד וזמן שמירת LC נמדד חייבת להיות עקביות. כמו כן, בסטנדרטים פפטיד החיצוניים ופפטידים המדגם ביולוגיים המתאימים חייבים להיות כשימור פעמים שווה. הידרופוביות (נאמדה באמצעות הגרסה 3.0 SSRCalc 100 אלגוריתם 55) וזמן שמירה נצפה של YDEAASYIQSK נמצאה (איור 4 א) עולים בקנה אחד. כמו כן, זמן שמירת YDEAASYIQSK נמדד באמצעות שני הניתוחים RAW 264.7 וניתוחים של הסטנדרטים פפטיד החיצוניים, ואת כל ערכי זמן השמירה היו שווים כ (איור 4).
רוב LC-SRM האיכותי הניתוחים של הדגימות הביולוגיות היו מוצלחים, כל כך מתאים שכותרתו כבדה, מטוהר, לכמת סטנדרטים פפטיד פנימיים הוכנו וממוסמרים-לRAW 264.7 lysates תא. סדרת דילול איזוטופ LC-SRM שימש לנתח דגימות מורכבות מתקני פפטיד הפנימי בלבד (מדגם "R0"), הפנימי והחיצוניים הסטנדרטים פפטיד (מדגם "R1"), ושישה 264.7 משכפל ביולוגי RAW (דגימות "R2" - "R7"). שני differedenaturants חלבון NT שימש לבדיקה לכל נושאים solubilization חלבון, denaturation, אלקילציה, ו / או עיכול אפשריים שעלולה לערער את כימות חלבון המטרה מדויק (דגימות R2-R4 משמש אוריאה, ודגימות R5-R7 משמש RapiGest SF). הצורות קלות והכבדה של YDEAASYIQSK הכילו דפוסי עוצמת מעבר כמעט זהה ופרופילי elution (5A דמויות - C). LC-SRM סיכם יחסי שיא האזור שמשו כמדד לשפע פפטיד היחסי, ויחסי YDEAASYIQSK שמשו לחישוב ערכי שפע I2 G ביחידות של עותקים לכל תא 264.7 RAW. במקביל, G שני I2 סטנדרטי פפטיד הפנימי (IAQSDYIPTQQDVLR) שימש לביצוע מבחני LC-SRM I2 G כמותי של אותו 264.7 דגימות RAW, ושני מבחני מיוצרים מדידות שפע I2 G דומות מאוד על פני כל משכפל הביולוגי (איור 5D). הסכם של שני G מבחני I2 הוא ראיות חזקות כי שני פפטידים הם quantotypic, וכי כל מבחני LC-SRM I2 G הכמותי היו מדויקים ומדויקים.
בסך הכל, 35 חלבונים היו לכמת באמצעות 58 סטנדרטים פנימיים פפטיד (טבלת 1). יש לציין, מבחני LC-SRM של החלבון הסטנדרטי הפנימי (גחלילית בלוציפראז; שלב 4.11) היו מדויקים ומדויקים. המערך המקיף של נתונים Skyline מחקירה זו זמין במסד הנתונים מקוונים הפנורמה LC-SRM (בתיקיית Manes_RAW_Chemotaxis בhttps://panoramaweb.org/labkey/project/NIH_NitaLazar/begin.view).
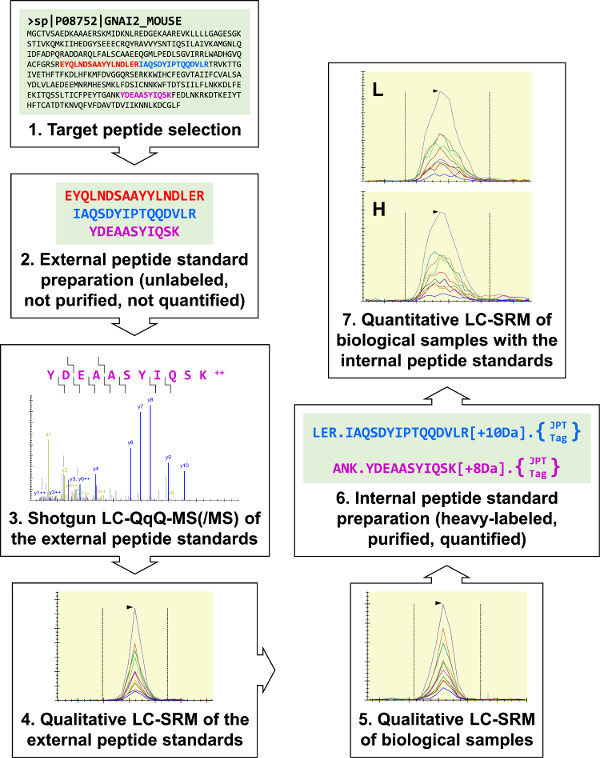
איור 1:. סקירה כללית של פרוטוקול שלושה פפטידים היעד המהוססים לI2 G (α-מקטע G-חלבון heterotrimeric) נבחרו לסינתזה סטנדרטית פפטיד החיצוני. אלה היו analyzed ידי הרובה LC-MS (/ MS) לפתח שלושה מבחני LC-SRM I2 G, ומבחנים אלה משמשים לביצוע ניתוחים איכותיים של דגימות ביולוגיות. כל שלושה פפטידים יעד I2 G זוהו, ושני, שנבחרו להכנה סטנדרטית פפטיד הפנימי. טריפסין-cleavable "JPT-תגיות" שימש לכמת את הסטנדרטים פפטיד הפנימיים באמצעות ספקטרופוטומטריה UV. הסטנדרטים פפטיד הפנימיים המשמשים לביצוע מבחני LC-SRM כמותיים I2 G של 264.7 דגימות RAW. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
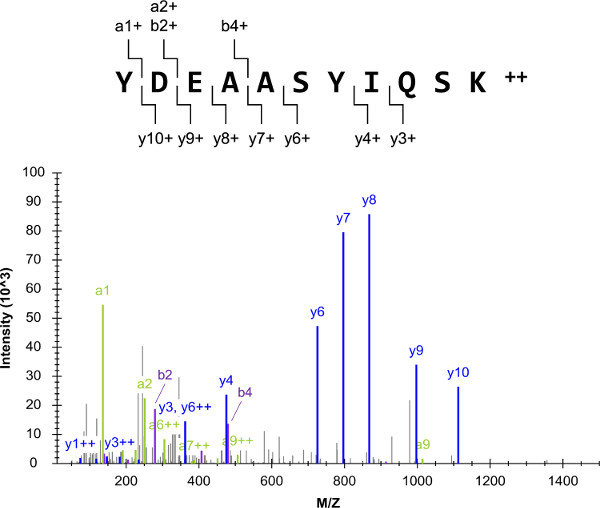
איור 2:. רובה LC-MS (/ MS) ספקטרום המסה המתואר נבע מהניתוחים של אחד מתקני G I2 החיצוניים פפטיד (YDEAASYIQSK). למבשר זהיון, עשרת המעברים אינטנסיביים ביותר העליונים, שנבחרו לLC-SRM (למעט יון A1 בר 1+ בשל אורכו הקצר). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
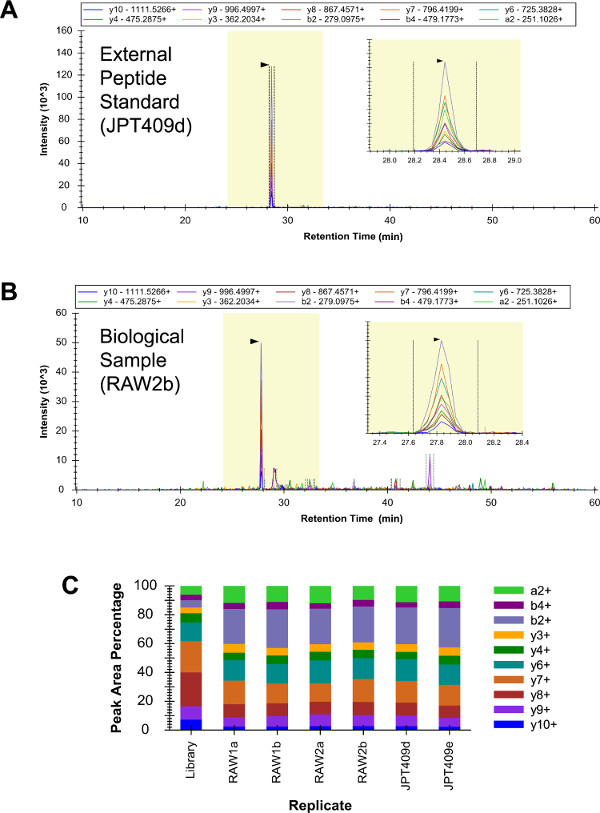
איור 3:. האיכותי LC-SRM של I2 G chromatogram YDEAASYIQSK מJPT409 ניתוחים הכיל רקע מאוד נמוך ופפטיד זוהה בביטחון (). 264.7 הניתוחים RAW המקבילים הביאו יותר אות רקע, אבל זיהוי פפטיד עדיין היה חד-משמעי (B). דפוסי העצמה יחסי המעבר היו עקביים בכל ששת LC-SRM ניתוחים (שני משכפל טכני של שלושה מדגמים בלתי תלויים), ואלה היו בערך סימיLar לרובה המקביל LC-MS (/ MS) הדפוס (לשכפל "הספרייה") (ג). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 4: תחזית פפטיד זמן שמירה ווריאציה על פני ריצות רגרסיה ליניארית חושב באמצעות מוערכת הידרופוביות ונמדדה זמן elution LC-SRM איכותי של כל פפטידים היעד, ופעמי elution חזו ונמדדות של YDEAASYIQSK היו עקביות (). . בנוסף, את העקביות של זמן elution נצפה של כל פפטיד פני LC-SRM ניתוחים נקבעה. הפעמים elution של YDEAASYIQSK הקיפו מגוון של ~ 40 שניות, שהייתה בקנה אחד עם הדיוק של מכשיר LC-SRM ששימש (ערכיםהם זמן שיא שיא +/- רוחב המלא בחץ המקסימום, וגם לכל הרוחב בבסיס השיא) (ב). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
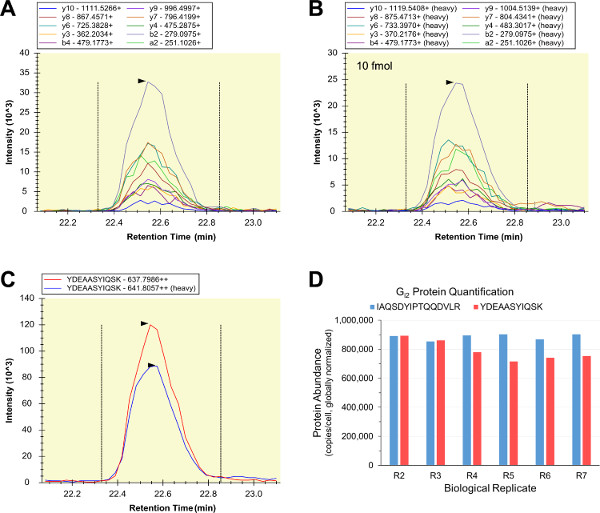
איור 5:. LC-SRM כמותי של I2 G chromatograms המעבר של פפטיד המדגם הביולוגי () וסטנדרטי פפטיד הפנימי (ב) היו בעוצמות מעבר יחסי עקביות, וסוכם (ג) (המתואר הוא הניתוח "R2" לYDEAASYIQSK באמצעות סטנדרטי פפטיד הפנימי 10 fmol). פרופילי elution הקל וכבדים היו עקביים (C), והיחס של אזור הנתון לעקומות אלה שימש כמדד לligHT / שפע פפטיד כבד. סטנדרטי שני G I2 פפטיד הפנימי (IAQSDYIPTQQDVLR) שימש לכמותיים LC-SRM במקביל, וערכי שפע I2 G וכתוצאה מכך היו עקביים בשני שש משכפל ביולוגי ופפטידים היעד שני (כולל, n = 12 וקורות חיים = 8.38 %) (ד). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
| הצטרפות UniProt | חלבון מטרה | היעד פפטיד | שפע (fmol / מיקרוגרם) | שפע (עותקים / תא, מנורמל) | קו"ח |
| P08659 | לוציפראז | (UV ב 280 ננומטר) | 23.824 | n / | n / |
| P08659 | לוציפראז | VVDLDTGK | 24.103 | n / | 7% |
| P08659 | לוציפראז | VVPFFEAK | 24.717 | n / | 4% |
| P60710 | אקטין, cytoplasmic 1 | IWHHTFYNELR | 760.448 | 61762598 | 3% |
| P16858 | GAPDH | LISWYDNEYGYSNR | 357.803 | 28906524 | 14% |
| P06151 | לקטט דהידרוגנאז | LLIVSNPVDILTYVAWK | 129.623 | 10633145 | 30% |
| P99024 | β טובולין 5 | ALTVPELTQQVFDAK | 78.765 | 6398971 | 3% |
| P20152 | Vimentin | SLYSSSPGGAYVTR | 121.100 | 9807488 | 10% |
| P60766 | Cdc42 | DDPSTIEK | 86.647 | 6957317 | 27% |
| P60766 | Cdc42 | QKPITPETAEK | 26.475 | 2153669 | 6% |
| Q8C3J5 | DOCK2 | ETLYETIIGYFDK | 1.459 | 118539 | 15% |
| Q8C3J5 | DOCK2 | ISSSPTHSLYVFVR | 1.795 | 143440 | 33% |
| Q8BPU7 | ELMO1 | ALTTKPSSLDQFK | 2.302 | 186754 | 7% |
| Q8BPU7 | ELMO1 | SAIDISILQR | 1.244 | 99728 | 25% |
| Q8BGM0 | FGR | GAYSLSIR | 1.099 | 89473 | 17% |
| Q8BGM0 | FGR | WTAPEAALFGR | 0.319 | 24766 | 6% |
| P27601 | 13 Gα | GIHEYDFEIK | .843 | 68467 | 15% |
| P27601 | 13 Gα | VFLQYLPAIR | 1.295 | 106176 | 23% |
| P08752 | Gα (i) 2 | IAQSDYIPTQQDVLR | 10.900 | 885701 | 2% |
| P08752 | Gα (i) 2 | YDEAASYIQSK | 9.774 | 790616 | 9% |
| Q9DC51 | Gα (k) | EYQLNDSASYYLNDLDR | 6.574 | 537862 | 15% |
| Q9DC51 | Gα (k) | ISQTNYIPTQQDVLR | 3.504 | 285784 | 10% |
| P62874 | 1 Gβ | AGVLAGHDNR | 17.078 | 1385578 | 4% |
| Q9CXP8 | Gγ 10 | DALLLGVPAGSNPFR | 2.167 | 179178 | 36% |
| P63213 | Gγ 2 | EDPLLTPVPASENPFR | 3.284 | 266360 | 8% |
| Q80SZ7 | Gγ 5 | VSQAAADLK | 6.087 | 493512 | 6% |
| P08103 | HCK | GPVYVPDPTSSSK | 1.143 | 93044 | 12% |
| P08103 | HCK | IIEDNEYTAR | .944 | 77147 | 19% |
| P43406 | Integrin α V | AGTQLLAGLR | 0.276 | 22264 | 32% |
| P43406 | Integrin α V | SHQWFGASVR | .443 | 34235 | 5% |
| P25911 | ד.נ. | VIEDNEYTAR | 1.461 | 119377 | 13% |
| Q5SW28 | 5 רגולציה PI3K | AGFPGILDTASPGK | .301 | 24331 | 11% |
| Q8K3B3 | α הרגולציה PI3K | LYEEYTR | .472 | 38592 | 16% |
| Q8K3B3 | α הרגולציה PI3K | TWNVGSSNR | .524 | 42697 | 12% |
| Q8K3B3 | α הרגולציה PI3K | VLSEIFSPVLFR | .440 | 35902 | 20% |
| Q5U3K7 | β הרגולציה PI3K | DTPDGTFLVR | 0.188 | 15262 | 30% |
| Q5U3K7 | β הרגולציה PI3K | IAEIHESR | .282 | 22561 | 13% |
| Q0VGQ5 | α PI3K | LINLTDILK | .102 | 8494 | 38% |
| Q8CI98 | δ PI3K | HEVQEHFPEALAR | .178 | 14566 | 22% |
| Q8CI98 | δ PI3K | ITEEEQLQLR | .481 | 38709 | 24% |
| Q9ES52 | PIP3 5-phosphatase 1 | IVVLAKPEHENR | .486 | 39194 | 19% |
| Q9ES52 | PIP3 5-phosphatase 1 | LSQLTSLLSSIEDK | 2.056 | 167123 | 7% |
| Q69ZK0 | PIP3 תלוי Rac GEF 1 | DSVLSYTSVR | .647 | 52712 | 32% |
| Q69ZK0 | PIP3 תלוי Rac GEF 1 | NQLLLALLK | .354 | 27425 | 5% |
| Q9CQE5 | הח"ן 10 | ASSQVNVEGQSR | 2.460 | 199782 | 4% |
| Q9CQE5 | הח"ן 10 | WASSLENLLEDPEGVQR | 20.647 | 206005 | 11% |
| Q9CX84 | הח"ן 19 | AEANQHVVDEK | .495 | 39753 | 21% |
| Q9CX84 | הח"ן 19 | LIYEDYVSILSPK | .846 | 68481 | 22% |
| B9EKC3 | GAP Rho 5 | DGLAQELANEIR | .448 | 34653 | 10% |
| Q99PT1 | Rho GDI 1 | SIQEIQELDK | 3.156 | 267063 | 16% |
| Q99PT1 | Rho GDI 1 | VAVSADPNVPNVIVTR | 37.077 | 3006168 | 5% |
| Q61599 | Rho GDI 2 | LNYKPPPQK | 37.975 | 3086596 | 3% |
| Q61599 | Rho GDI 2 | YVQHTYR | 21.436 | 1711908 | 47% |
| Q61210 | Rho GEF 1 | FDGAEGSWFQK | 2.149 | 176139 | 47% |
| Q61210 | Rho GEF 1 | SGLELEPEEPPGWR | 2.911 | 236483 | 8% |
| Q9QUI0 | RhoA | QVELALWDTAGQEDYDR | 43.500 | 3532438 | 8% |
| P70336 | ROCK2 | GAFGEVQLVR | .527 | 42800 | 23% |
| P70336 | ROCK2 | IYESIEEAK | 1.011 | 83794 | 33% |
| P70336 | ROCK2 | LEGWLSLPVR | .573 | 48259 | 22% |
| Q8R0X7 | אנזים זה S1P 1 | AGYPLEKPFDFR | 1.787 | 147043 | 27% |
| Q8R0X7 | אנזים זה S1P 1 | TPEIVAPESAHAAFDK | 3.562 | 291791 | 18% |
טבלת 1: חלבוני 264.7 תא כמותי LC-SRM של RAW שלושים וחמישה חלבוני תא RAW 264.7 היו לכמת באמצעות חמישים ושמונה תקני פפטיד פנימיים ושישה משכפל ביולוגי.. חמשת חלבוני המטרה היו ניהול משק בית חלבונים (אקטין, GAPDH, לקטט דהידרוגנאז, טובולין, וvimentin), והיו לכמת לאפשר נורמליזציה פני דגימות ביולוגיות (שלב 1.1). בנוסף, תקן חלבון פנימי ממוסמר-לכל lysate תא ולכמת ידי LC-SRM (4.765 pmol של לוציפראז גחלילית 200 מיקרוגרם לדוגמה; 98% טהורים על ידי SDS-עמוד; לכמת spectrophotometrically ב 280 ננומטר; שלב 4.11). ערכי קורות החיים חושבו על פני שישה משכפל ביולוגי באמצעות ערכי השפע בעולם המנורמל (למעט לוציפראז; שלב 5.15).
Discussion
כימות חלבון מוחלט חיוני למגוון מאוד רחב של יישומים ביו-רפואיים כגון אימות סמן ביולוגי ודוגמנות מסלול העברת אותות. לאחרונה, פרוטאומיקה ממוקדת באמצעות LC-SRM נהנתה משיפורים רבים בטכנולוגיות כולל הכנת פפטיד סטנדרטית, HPLC, QQQ-MS, וניתוח נתונים LC-SRM. כתוצאה מכך, היא הפכה חלופה רבת עוצמה לimmunoassays. Immunoassays יכול להיות מאוד רגיש ותפוקה גבוהה, אבל פיתוח immunoassay חזק יכול להיות מאוד מאתגר בגלל immunoassays יכול להיות פגיע לתגובה צולבת ו / או הפרעות, עולה בקנה אחד עם שיטות תמוגה / הומוגניזציה תא / רקמה, ו / או לא נוח לריבוב 5,8. לדוגמא, במבחן המקיף ביותר לתגובה צולבת הוא לבצע immunoassay באמצעות דגימות שמקורם knockouts הגן, שיכול להיות מאתגר להכנה.
פרוטוקול זה מתאר pept היעדבחירת IDE, פיתוח assay LC-SRM, LC-SRM האיכותי וכמותית, וניתוח נתונים LC-SRM. זה היה בשימוש כדי למדוד את השפע המוחלט של חלבוני מסלול 36 chemotaxis בתוך תאים 264.7 RAW 56, אבל תחולתו משתרעת הרבה מעבר ליישום ספציפי זה. למרות שזה נועד לכמת חלבונים בתוך כדורי תא, זה יכול להיות מותאם לניתוח של דגימות ביולוגיות אחרות (למשל, biofluids) ומטרות SRM אחרות (למשל, phosphopeptides). לדוגמא, שינוי פרוטוקול עיכול הומוגניזציה ו / או חלבון עשוי לשפר באופן משמעותי solubilization, denaturation, אלקילציה, עיכול, וכימות של חלבונים קשים במיוחד יעד (למשל, חלבוני קרום), או אולי לאפשר הניתוח של דגימות מאתגרות במיוחד (למשל, דגימות <המוני המכיל 100 מיקרוגרם חלבון).
הבחירה הראשונית של פפטידים היעד היא קריטית אבל יכולה להיות זמן רב. לhundreDS של חלבוני יעד, ציון אד הוק יכול לשמש עבור כל קריטריונים, ויכולים להיות מדורג פפטידים היעד המהוססים מבוססים על הסכום של עשרות, כפי שנעשה בעבר 56. לחלופין, ניתוח זה יכול להיות אוטומטי באמצעות PeptidePicker, ממשק אינטרנט שמאוד מפשט בחירת פפטיד היעד 30 (http://mrmpeptidepicker.proteincentre.com/).
לאחר פפטידים היעד נבחרו ומבחני LC-SRM פותחו, זה קריטי, כי מבחני LC-SRM איכותיים של הדגימות הביולוגיות להתבצע כי גם פפטיד proteotypic וquantotypic מאוד לא יהיה זיהוי אם החלבון מתבטא ב רמות מתחת לסף הרגישות של המכשיר, או אם את ההפרעה הרקע היא בעייתית במיוחד. ממד שני של הפרדה (למשל, HPLC חילופי קטיון החזק, גבוה pH הפוך-שלב HPLC, ו- ג'ל אלקטרופורזה חופשי) יכול להגדיל את עומק proteomic, אבל ידרושבאופן משמעותי יותר זמן מכשיר וניתוח נתונים. לחלופין, אסטרטגית העשרה (למשל, immunoenrichment peptide- ורמת חלבון וחלוקה של תאים) יכולה לשפר את עומק proteomic, וimmunodepletion של חלבונים בשפע מאוד יכול לשמש כדי להפחית הפרעות על ידי coeluting analytes.
LC-SRM של ~ עשרות דוגמאות ל~ ~ מאות או אלפי מעברים בדרך כלל דורש זמן מכשיר נרחב. למרות שזה לא היה בשימוש במחקר זה, LC-SRM תזמון (מדידת מעברים בחלונות זמן elution שהוגדר מראש) מאפשר הניתוח של יותר מעברים לריצה. כמו כן, תזמון מפחית את מחזור SRM בתקופות יחסית פנויות של שיפוע LC, וזה יכול לגרום לזיהוי פפטיד המשופר וכימות. עם זאת, תזמון דורש כי זמן elution פפטיד ייקבע בביטחון מניתוח LC-SRM איכותי. שינויים עדינים להכנת המדגם, מכשיר LC-MS,או שיטת LC-MS יכולה לגרום לתזמון כדי לחתוך או אפילו לגמרי לפספס פפטידים יעד. לדוגמא, פרופילי elution YDEAASYIQSK המדגם הביולוגיים היו מעט השתנו אולי בשל יחסית לסטנדרטים של פפטיד החיצוניים (איור 4), אפקטי מטריצה.
לסיכום, פרוטוקול צעד-אחר-צעד מוצג לפיתוח והיישום של LC-SRM לכימות חלבון מוחלט. quantitation המוחלט של חלבונים על ידי LC-SRM כבר הוכיח להיות לשעתק בין מעבדות 16,19. טכנולוגיות פרוטאומיקה, כולל הכנת מדגם (למשל, אוטומציה), כרומטוגרפיה נוזלית, ספקטרומטריית מסה, וניתוח נתונים, משתפרות במהירות, ומאפשרות לLC-SRM להפוך מעשי למחקר בקנה מידה גדולה ויישומים קליניים. הסגוליות, הרגישות, הדיוק, reproducibly, והתפוקה גבוהה של LC-SRM כמותיים הופכים אותו לכלי רב עוצמה למחקר ביו-רפואה ובסיסית.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This research was supported by the Intramural Research Program of the NIH, National Institute of Allergy and Infectious Diseases.
Materials
| Name | Company | Catalog Number | Comments |
| Acetonitrile (ACN), LC-MS grade | Fisher | A955-1 | |
| BCA (bicinchoninic acid) protein assay kit | Fisher | 23235 | |
| Beads for bead beating, zirconia-silica, 0.1 mm | BioSpec Products | 11079101z | |
| Bestatin hydrochloride | Sigma | B8385-10MG | |
| Cell culture DMEM (with glucose, without L-glutamine) | Lonza | 12-614F | |
| Cell culture EDTA, 500 mM, pH8 | Gibco | 15575 | |
| Cell culture fetal bovine serum (FBS) | Atlanta Biologicals | S11550 | |
| Cell culture L-glutamine | Sigma | G8540-25G | |
| Cell culture phosphate buffered saline (PBS) pH 7.4 | Gibco | 10010-049 | |
| Cell culture Trypan Blue viability stain, 0.4% w/v | Lonza | 17-942E | |
| Cellometer Auto T4 cell counter | Nexcelom Bioscience | Cellometer Auto T4 | |
| Cellometer Auto T4 disposable counting chambers | Nexcelom Bioscience | CHT4-SD100-014 | |
| Dithiothreitol (DTT) | Sigma | D5545-5G | |
| Formic acid, LC-MS grade, ampules | Fisher | A117-10X1AMP | |
| Hemocytometer, Neubauer-improved, 0.1 mm deep | Marienfeld-Superior | 0640030 | |
| HEPES, 1 M, pH 7.2 | Mediatech | 25-060-CI | |
| Hydrochloric acid, 37% w/w | VWR | BDH3028-2.5LG | |
| Iodoacetamide | Sigma | I1149-5G | |
| Laser Based Micropipette Puller | Sutter Instrument Co. | P-2000 | |
| LC coated silica capillary, 50 µm id | Polymicro Technologies | 1068150017 | |
| LC vial, autosampler, 12 mm x 32 mm polypropylene | SUN SRI | 200-268 | |
| LC vial screw cap, autosampler, pre-slit PTFE/silicone | SUN SRI | 500-061 | |
| Luciferase, from Photinus pyralis | Sigma | L9506-1MG | |
| Pepstatin A | EMD Millipore | 516481-25MG | |
| pH strips colorpHast (pH 0.0-6.0) | EMD Chemicals | 9586-1 | |
| PhosStop phosphatase inhibitor cocktail | Roche | 04906837001 | |
| RapiGest SF | Waters | 186001861 | |
| Sep-Pak SPE, C18 1 ml 100 mg cartridge | Waters | WAT023590 | |
| Sep-Pak SPE, extraction manifold, 20 position | Waters | WAT200609 | |
| Sep-Pak SPE, flat-surfaced rubber bulb | Fisher | 03-448-25 | |
| Sodium hydroxide (NaOH) | Fisher | S318-500 | |
| SpeedVac vacuum concentrator | Fisher | SPD111V | |
| Trifluoroacetic acid (TFA), LC-MS grade | Fisher | A116-50 | |
| Trypsin, sequencing grade, modified | Promega | V5113 | |
| Tube decapper for Micronic tubes | USA Scientific | 1765-4000 | |
| Tubes, 2 ml microcentrifuge, o-ring screw-cap, sterile | Sarstedt | 72.694.006 | |
| Urea | Sigma | U0631-500g | |
| Water, LC-MS grade | Fisher | W6-1 |
References
- Cox, J., Mann, M. Quantitative high-resolution proteomics for data-driven systems biology. Annu Rev Biochem. 80, 273-299 (2011).
- Zhang, Y., Fonslow, B. R., Shan, B., Baek, M. C., Yates, J. R. 3rd Protein analysis by shotgun/bottom-up proteomics. Chem Rev. 113, 2343-2394 (2013).
- Boja, E. S., Rodriguez, H. Mass spectrometry-based targeted quantitative proteomics: achieving sensitive and reproducible detection of proteins. Proteomics. 12, 1093-1110 (2012).
- Gillette, M. A., Carr, S. A. Quantitative analysis of peptides and proteins in biomedicine by targeted mass spectrometry. Nat Methods. 10, 28-34 (2013).
- Picotti, P., Aebersold, R. Selected reaction monitoring-based proteomics: workflows, potential, pitfalls and future directions. Nat Methods. 9, 555-566 (2012).
- Lesur, A., Domon, B. Advances in high-resolution accurate mass spectrometry application to targeted proteomics. Proteomics. , (2015).
- Wild, D. The immunoassay handbook : theory and applications of ligand binding ELISA., and related techniques. , 4th edn, Elsevier. (2013).
- Sturgeon, C. M., Viljoen, A. Analytical error and interference in immunoassay: minimizing risk. Ann Clin Biochem. 48, 418-432 (2011).
- Adrait, A., et al. Development of a Protein Standard Absolute Quantification (PSAQ) assay for the quantification of Staphylococcus aureus enterotoxin A in serum. J Proteomics. 75, 3041-3049 (2012).
- Lin, D., Alborn, W. E., Slebos, R. J., Liebler, D. C. Comparison of protein immunoprecipitation-multiple reaction monitoring with ELISA for assay of biomarker candidates in plasma. J Proteome Res. 12, 5996-6003 (2013).
- Weiss, F., et al. Catch and measure-mass spectrometry-based immunoassays in biomarker research. Biochim Biophys Acta. 1844, 927-932 (2014).
- Yassine, H., et al. Mass spectrometric immunoassay and MRM as targeted MS-based quantitative approaches in biomarker development: potential applications to cardiovascular disease and diabetes. Proteomics Clin Appl. 7, 528-540 (2013).
- Zhao, L., et al. Quantification of proteins using peptide immunoaffinity enrichment coupled with mass spectrometry. J Vis Exp. , (2011).
- Becker, J. O., Hoofnagle, A. N. Replacing immunoassays with tryptic digestion-peptide immunoaffinity enrichment and LC-MS/MS. 4, 281-290 (2012).
- Wasinger, V. C., Zeng, M., Yau, Y. Current status and advances in quantitative proteomic mass spectrometry. Int J Proteomics. 2013, 180605(2013).
- Abbatiello, S. E., et al. Large-scale inter-laboratory study to develop, analytically validate and apply highly multiplexed, quantitative peptide assays to measure cancer-relevant proteins in plasma. Mol Cell Proteomics. , (2015).
- Rodriguez-Suarez, E., Whetton, A. D. The application of quantification techniques in proteomics for biomedical research. Mass Spectrom Rev. 32, 1-26 (2013).
- Wehr, A. Y., Hwang, W. T., Blair, I. A., Yu, K. H. Relative quantification of serum proteins from pancreatic ductal adenocarcinoma patients by stable isotope dilution liquid chromatography-mass spectrometry. J Proteome Res. 11, 1749-1758 (2012).
- Kennedy, J. J., et al. Demonstrating the feasibility of large-scale development of standardized assays to quantify human proteins. Nat Methods. 11, 149-155 (2014).
- Jensen, K. J., Shelton, P. T., Pedersen, S. L. Peptide synthesis and applications. , 2nd edn, Humana Press Springer. (2013).
- Pratt, J. M., et al. Multiplexed absolute quantification for proteomics using concatenated signature peptides encoded by QconCAT genes. Nat Protoc. 1, 1029-1043 (2006).
- Brun, V., et al. Isotope-labeled protein standards: toward absolute quantitative proteomics. Mol Cell Proteomics. 6, 2139-2149 (2007).
- Guidance for Industry: Bioanalytical Method Validation. , U.S. Food and Drug Administration. Available from: http://www.fda.gov/ucm/groups/fdagov-public/@fdagov-drugs-gen/documents/document/ucm070107.pdf (2001).
- Guidance for Industry: Bioanalytical Method Validation. , U.S. Food and Drug Administration; Revision 1 (draft). Available from: http://www.fda.gov/ucm/groups/fdagov-public/@fdagov-drugs-gen/documents/document/ucm368107.pdf (2013).
- Carr, S. A., et al. Targeted peptide measurements in biology and medicine: best practices for mass spectrometry-based assay development using a fit-for-purpose approach. Mol Cell Proteomics. 13, 907-917 (2014).
- Ori, A., Andres-Pons, A., Beck, M. The use of targeted proteomics to determine the stoichiometry of large macromolecular assemblies. Methods Cell Biol. 122, 117-146 (2014).
- Rosen, O., Feldberg, L., Gura, S., Zichel, R. A new peptide substrate for enhanced botulinum neurotoxin type B detection by endopeptidase-liquid chromatography-tandem mass spectrometry/multiple reaction monitoring assay. Anal Biochem. , (2015).
- Feng, Y., et al. Global analysis of protein structural changes in complex proteomes. Nat Biotechnol. 32, 1036-1044 (2014).
- MacLean, B., et al. Skyline: an open source document editor for creating and analyzing targeted proteomics experiments. Bioinformatics. 26, 966-968 (2010).
- Mohammed, Y., et al. PeptidePicker: a scientific workflow with web interface for selecting appropriate peptides for targeted proteomics experiments. J Proteomics. 106, 151-161 (2014).
- Rodriguez, J., Gupta, N., Smith, R. D., Pevzner, P. A. Does trypsin cut before proline. J Proteome Res. 7, 300-305 (2008).
- Min, X. J., Butler, G., Storms, R., Tsang, A. OrfPredictor: predicting protein-coding regions in EST-derived sequences. Nucleic Acids Res. 33, W677-W680 (2005).
- Lam, H., et al. Building consensus spectral libraries for peptide identification in proteomics. Nat Methods. 5, 873-875 (2008).
- Craig, R., Cortens, J. P., Beavis, R. C. Open source system for analyzing, validating, and storing protein identification data. J Proteome Res. 3, 1234-1242 (2004).
- Desiere, F., et al. The PeptideAtlas project. Nucleic Acids Res. 34, D655-D658 (2006).
- Vizcaino, J. A., et al. The PRoteomics IDEntifications (PRIDE) database and associated tools: status in 2013. Nucleic Acids Res. 41, D1063-D1069 (2013).
- Frank, R. The SPOT-synthesis technique. Synthetic peptide arrays on membrane supports--principles and applications. J Immunol Methods. 267, 13-26 (2002).
- Ong, S. E., Kratchmarova, I., Mann, M. Properties of 13C-substituted arginine in stable isotope labeling by amino acids in cell culture (SILAC). J Proteome Res. 2, 173-181 (2003).
- Mant, C. T., et al. HPLC analysis and purification of peptides. Methods Mol Biol. 386, 3-55 (2007).
- Alterman, M. A., Hunziker, P. Amino acid analysis : methods and protocols. , Humana Press. (2012).
- Maclean, B., et al. Effect of collision energy optimization on the measurement of peptides by selected reaction monitoring (SRM) mass spectrometry. Anal Chem. 82, 10116-10124 (2010).
- Nesvizhskii, A. I. A survey of computational methods and error rate estimation procedures for peptide and protein identification in shotgun proteomics. J Proteomics. 73, 2092-2123 (2010).
- Tabb, D. L., Friedman, D. B., Ham, A. J. Verification of automated peptide identifications from proteomic tandem mass spectra. Nat Protoc. 1, 2213-2222 (2006).
- Freshney, R. I. Culture of animal cells : a manual of basic technique and specialized applications. , 6th edn, Wiley-Blackwell. (2010).
- Oberg, A. L., Vitek, O. Statistical design of quantitative mass spectrometry-based proteomic experiments. J Proteome Res. 8, 2144-2156 (2009).
- Noble, J. E., Bailey, M. J. Quantitation of protein. Methods Enzymol. 463, 73-95 (2009).
- Kiser, J. Z., Post, M., Wang, B., Miyagi, M. Streptomyces erythraeus trypsin for proteomics applications. J Proteome Res. 8, 1810-1817 (2009).
- Reiter, L., et al. mProphet: automated data processing and statistical validation for large-scale SRM experiments. Nat Methods. 8, 430-435 (2011).
- Abbatiello, S. E., Mani, D. R., Keshishian, H., Carr, S. A. Automated detection of inaccurate and imprecise transitions in peptide quantification by multiple reaction monitoring mass spectrometry. Clin Chem. 56, 291-305 (2010).
- Callister, S. J., et al. Normalization approaches for removing systematic biases associated with mass spectrometry and label-free proteomics. J Proteome Res. 5, 277-286 (2006).
- Karpievitch, Y. V., Dabney, A. R., Smith, R. D. Normalization and missing value imputation for label-free LC-MS analysis. BMC Bioinformatics. 13, Suppl 16. S5(2012).
- Oh, S., Kang, D. D., Brock, G. N., Tseng, G. C. Biological impact of missing-value imputation on downstream analyses of gene expression profiles. Bioinformatics. 27, 78-86 (2011).
- Germain, R. N., Meier-Schellersheim, M., Nita-Lazar, A., Fraser, I. D. Systems biology in immunology: a computational modeling perspective. Annu Rev Immunol. 29, 527-585 (2011).
- Futran, A. S., Link, A. J., Seger, R., Shvartsman, S. Y. ERK as a model for systems biology of enzyme kinetics in cells. Curr Biol. 23, R972-R979 (2013).
- Krokhin, O. V. Sequence-specific retention calculator. Algorithm for peptide retention prediction in ion-pair RP-HPLC: application to 300- and 100-A pore size C18 sorbents. Anal Chem. 78, 7785-7795 (2006).
- Manes, N. P., Angermann, B. R., Koppenol-Raab, M., An, E., Sjoelund, V. H., Sun, J., Ishii, M., Germain, R. N., Meier-Schellersheim, M., Nita-Lazar, A. Targeted Proteomics-Driven Computational Modeling of Macrophage S1P Chemosensing. Mol Cell Proteomics. , Forthcoming.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved