Method Article
Выбранный мониторинга реакций масс-спектрометрии для абсолютного белка количественной
В этой статье
Резюме
This protocol describes how to perform absolute quantification assays of target proteins within complex biological samples using selected reaction monitoring. It was used to accurately quantify proteins of the mouse macrophage chemotaxis signaling pathway. Target peptide selection, assay development, and qualitative and quantitative assays are described in detail.
Аннотация
Absolute quantification of target proteins within complex biological samples is critical to a wide range of research and clinical applications. This protocol provides step-by-step instructions for the development and application of quantitative assays using selected reaction monitoring (SRM) mass spectrometry (MS). First, likely quantotypic target peptides are identified based on numerous criteria. This includes identifying proteotypic peptides, avoiding sites of posttranslational modification, and analyzing the uniqueness of the target peptide to the target protein. Next, crude external peptide standards are synthesized and used to develop SRM assays, and the resulting assays are used to perform qualitative analyses of the biological samples. Finally, purified, quantified, heavy isotope labeled internal peptide standards are prepared and used to perform isotope dilution series SRM assays. Analysis of all of the resulting MS data is presented. This protocol was used to accurately assay the absolute abundance of proteins of the chemotaxis signaling pathway within RAW 264.7 cells (a mouse monocyte/macrophage cell line). The quantification of Gi2 (a heterotrimeric G-protein α-subunit) is described in detail.
Введение
Протеомные эксперименты, использующие масс-спектрометрии (MS) может быть предназначен для использования либо нецелевой (дробовик) или целевых методов. Discovery протеомика в целом опирается на снизу вверх дробовика MS, либо с помощью традиционного способа сбора данных, зависящих от или с помощью одной из недавно разработанных методик обработки данных независимые (например, MS E, валка) 1,2. Ружье протеомики является мощным инструментом для высокой пропускной идентификации пептидов и относительной количественной, но это, как правило, непригодны для абсолютного количественного или с прицелом на небольшие, определенные наборы (~ десятков) белков. Метод МС наиболее часто используется для целевых протеомики выбран реакцию мониторинга (SRM) из-за его высокой чувствительности, скорости и динамическим диапазоном 3-5. Альтернативы SRM включать мониторинг параллельной реакции, которая использует преимущества высокого разрешения, полный MS сканирования 6.
SRM обычно выполняется с использованием нано-REVER потокаSED-фазовой жидкостной хроматографии высокой производительности (нано-RP-LC) инструмента соединен с нано-ионизация электрораспылением (ESI-нано) источник ионов прикреплена к Тройной квадрупольный масс-спектрометр (QQQ-MS). В типичном эксперименте, образцы белки протеолитически перевариваются, и полученные пептиды хроматографически разделены, десорбируют и ионизируется. Полученные ионы-предшественники м / г фильтруется первым квадрупольного (Q1) и фрагментарные во второй квадрупольного (q2) при столкновении их с столкновения газа. Полученные ионы фрагмента м / г фильтруют в третьем квадрупольного (Q3) и количественно с помощью динода. Каждая пара предшественника и ионный фрагмент называется переходом, и каждый переход контролируется в течение определенного периода времени (выдержка времени; обычно 2-50 мс). Во LC-SRM, циклы Qqq-MS через предопределенного списка переходов (рабочий цикл, как правило, ≤3 сек), и хроматограмма каждого перехода производится.
Альтернативная STRATEGх годов для белка количественного обычно используют иммунологические, такие как точечные пятна, пятна, западным ИФА антител микрочипов, обратных белковых чипов фазе микрофлюидных иммунологических, цифровые ИФА и микросфер на основе иммунологических 7. Лучшие иммунологические может быть значительно более чувствительны, чем LC-SRM, и пропускная способность образца иммунологических может быть значительно выше, чем у LC-SRM 5. Тем не менее, развивающиеся иммунологические могут быть дорогими и / или времени, и в результате анализы могут быть уязвимы для кросс-реактивности и / или вмешательства, несовместимы с Cell / тканевой лизис / методов гомогенизации и / или не поддаются мультиплексирование 5,8. Некоторые из этих вопросов могут быть решены путем сочетания антитело и МС-основанные методы. Например, целевые белки могут быть обогащены с помощью иммунопреципитации до протеолиза и LC-SRM 9-12. Кроме того, этот метод использует SISCAPA иммунопреципитации последующее к протеолизу в пептидной Leveл 13,14. В дополнение к immunoenrichment стратегии, immunodepletion высоких белков численности могут быть использованы для повышения чувствительности LC-SRM посредством уменьшения перекрестных помех по coeluting аналитов 15,16.
МС на основе количественное белок может быть разделен на относительное и абсолютное количественное, а также в этикетки свободной и стабильной изотопной метки (например, метаболический маркировки, химической маркировки, и тяжелая-меченого белка и пептида внутренних стандартов). Методы маркировки свободной может быть полезным для относительного количественного белка, но не подходят для точного количественного абсолютной. Для сравнения, методы маркировки уменьшили ошибку, связанную с пробоподготовки и MS дисперсии, и часто используется для определения количества белка по отношению 17. Например, стабильный изотоп помечены протеома (SILAP) стандарты получены с использованием культивируемых клеток линии человеческой включить относительную количественную оценку потенциальных биомаркеров с помощью LC-SRM человеческой сыворотки 18, Точная количественная абсолютное белок РС требует, чтобы очищенная, количественно, изотопно-меченых белков или пептидов внутренние стандарты будут шипами-в биологических образцах до MS. Включение тяжелого изотопа меченых внутренних стандартов в LC-SRM позволяет процесса абсолютное количественное, что, как было показано, чтобы быть хорошо воспроизводимым и передаваться между лабораториями 16,19.
Стабильный изотоп меченые внутренние стандарты для абсолютного количественного белкового MS включают пептидные стандарты подготовлены в твердой фазе синтеза белков, 20, состоящие из сцепленных протеазы расщепл стандартов 21 пептидных и полнометражные стандартов 22 белка с помощью. Целевая модификация белка ковалентной и неполным пробоподготовки (т.е., неполная образец лизис и гомогенизации, и неполное растворение белков, денатурация, алкилирования, и протеолиз), может подорвать точную количественную. Внутренний рrotein стандарты мере могут быть затронуты большинство этих потенциальных проблем, но они, как правило, наиболее трудно получить. В качестве альтернативы можно анализировать каждый целевой белок с использованием нескольких внутренних стандартов пептидные которые предназначены, чтобы включать в себя амино- и карбоксильные-терминал родные фланкирующие остатки. Независимо от типа используемого внутреннего стандарта, следует шипами-в биологических образцах в качестве ранней точки при подготовке пробы, как это возможно. Кроме того, методы подготовки образцов несколько (например, различные условия денатурации) должны быть проверены. Использование нескольких ортогональных экспериментальных методов (экспериментальный кросс-валидации) является жизнеспособной стратегией для преодоления большинства потенциальных количественного проблемы 23-25.
LC-SRM количественное белков является очень гибким метод, который был использован в широком спектре приложений. Следует отметить, что он был использован для изучения пептидных и белковых биомаркеров вклинические образцы, такие как сыворотки, основных биопсии, и тонкой иглой аспирации 5. LC-SRM также используется для измерения стехиометрии белковых комплексов 5,26, для обнаружения нейротоксинов ботулина 27, количественно динамику фосфорилирования белков в сигнальных путей 5 и количественной оценки изменений в конформации белка 28.
Наша лаборатория использует LC-SRM для количественной оценки сигнальных белков, которые обеспечивают макрофагов хемотаксиса, чтобы поддержать развитие хемотаксис пути моделирования. Общая схема протокола (Рисунок 1) начинается с рейтинга предварительные целевые пептиды. Впоследствии, нефть внешние стандарты пептидные синтезированы и использованы для разработки LC-SRM анализов для качественных анализов биологических образцов. Если биологический образец, полученный целевой пептид обнаружено, очищенные тяжелые меченных внутренних стандартов пептидные готовят для количественного LC-SRM. Этот протокол может быть использован для ACcurately количественно белков из широкого спектра биологических образцов, а также поддерживать исследования в самых разнообразных белковых мишеней.
протокол
ПРИМЕЧАНИЕ: Этот метод был описан ранее 56.
1. Пептид Выбор цели
- Компиляции списка целевых белков, и включают в себя небольшое количество белков домашнего хозяйства для нормализации через биологические образцы, а также включают в себя внутренний стандарт белка (например, люциферазы светлячка). Дайджест целевых белков в триптических пептидов в кремнии с помощью программного инструмента, таких как переваривания белков Simulator 29,30.
- Требовать, что пептиды полностью триптического и не содержат недостающие участки трипсина расщепления. Избегайте пептиды с соседними трипсина сайтов расщепления, чтобы избежать потенциально неполное пищеварение трипсина 31.
- Требуется, чтобы длина каждого пептида 5-20 остатков. Рассмотрим более длинные пептиды, но отмечают, что они, как правило, дороже, чтобы синтезировать.
- Избегайте пептид, если он соответствует естественному генетического варианта (например, одного nucleotidе полиморфизм). Кроме того, убедитесь, что трипсин сайты не влияет (Шаг 1.2).
- Избегайте пептид, если он соответствует на сайт посттрансляционной модификации (PTM). Аналогично, во избежание пептид, если он будет склонен к химической модификации при подготовке пробы ЖХ-МС. В частности, во избежание пептиды, склонных к цистеина и метионина окисления, аспарагин и глутамин дезамидирования, и амино-терминал образования глутамина пироглутамата. Убедитесь, что трипсин сайты не влияет (Шаг 1.2).
- Кроме того, во избежание пептиды, которые исходят из белка амино- и карбокси-концах, потому что белок концы склонны к посттрансляционной модификации (амино-терминал потери метионина и ацетилирования и карбоксиконцевой амидированием).
- Требовать, чтобы каждая цель пептид является уникальным для каждого белка-мишени. Если это не возможно, потребуется, что пептид является уникальным для набора изоформ / гомологов. Лечить пептиды, отличающиеся только лейцина / изолейцина замещениякак если бы они были идентичны при определении пептид уникальность, потому что они выполняют почти одинаково во LC-SRM.
- Если комплексное транскриптомных анализ всех биологических образцов была выполнена (например, РНК-Seq), определить с помощью пептида Уникальность в переводах силиконового транскрипта последовательности 32, а не с использованием всего протеом вида.
- Требовать, чтобы целевые пептиды proteotypic. Определить proteotypic пептиды, используя дробовик масс-спектрометрии 1,2 из биологических образцов изучается. Кроме того, получить пептидные идентификацию proteotypic пептидов из онлайн баз данных протеомики, таких как масс-спектрометрии NIST библиотек 33 (http://peptide.nist.gov/), Глобальный Протеом машина 34 (Х HUNTER спектральные библиотеки из HTTP: // WWW .thegpm.org / ОХОТНИК / index.html, и GPMDB пептидные идентификации от http://gpmdb.thegpm.org/), PeptideAtlas 35 (http://www.peptideatlas.org/), и базы данных PRIDE 36 (http://www.ebi.ac.uk/pride/archive/).
- Если количественное транскрипт-уровень анализа биологических образцов были выполнены (например, РНК-SEQ, КПЦР), то во избежание ориентации пептиды, соответствующие относительно низких транскриптов численности.
- При необходимости, выберите целевые пептиды, которые могут быть использованы для LC-SRM анализов белковых ортологов целевых (например, для анализа как людские, так и формы мыши белка-мишени).
- Выберите по крайней мере, две целевые пептиды за белка-мишени (если это возможно).
2. Подготовка пептида стандартов
ПРИМЕЧАНИЕ: В этом разделе протокола описывает подготовку набора двадцати лиофилизированных стандартов пептид (каждый из которых 1 нмоль в количестве) для последующих анализов. При другом количестве пептидов, или для различных пептидных количествах, то нужно будет соответствующим образом скорректированы.
- Подготовка лиофилизированные стандарты пептид (≥1 нмоль), используя технологию синтеза пептидов, таких как SPOT синтеза 20,37.
- Убедитесь, что остатки цистеина внешних стандартов пептидных carbamidomethylated (химическая структура, образованная иодацетамида алкилирования). В отличие от этого, обеспечить цистеиновых остатков внутренних стандартов пептида немодифицированного (они будут алкилируют при подготовке пробы, описанные ниже).
- Конструкция внутренних стандартов пептидные, так что они содержат амино- и карбокси-концевые фланкирующие остатки родной (для контроля эффективности за усвоением трипсина, каждый, как правило, длиной 5:57 остатков).
- Конструкция внутренних стандартов пептидные, так что они являются стабильными изотопами помечены. Рассмотрим природный изотопный профиль целевого пептида и точность измерения массы MS при выборе стратегии пептид маркировки. Не используйте дейтерированные стандарты пептидные потому пептид Дейтерирование причин обращенной фазой времени удерживания LCс переложить 38.
Примечание: Как правило, триптические внутренние стандарты пептидные синтезированы с использованием ~ 98% чистой [13 С 6, 15, N 4] Арг и [13 С 6, 15, N 2] Лис включены в карбокси-концов. - Очищают внутренние стандарты пептидные используя ВЭЖХ 39, и точно количественно их 40.
- Добавить 100 мкл 0,1% об / об муравьиной кислоты, 20% об / об ацетонитрил (ACN) в каждой 1 нмоль лиофилизированного пептида стандарта для получения концентрации пептида 10 мкМ (использование в качестве помощи лиофилизированного пептида может иметь очень низкой плотности и может быть легко потеряны). Вихревой образцы в течение 2 мин и ванной разрушать ультразвуком их в течение 5 мин, чтобы гарантировать, что пептид полного растворения.
- Объединяют растворенные пептиды, и концентрировать полученную смесь в вакуумной концентратора до конечного объема 80 мкл. Добавьте 20 мкл ACN, чтобы растворить любой осажденный пептид.
Примечание: образец в настоящее время совместноntains 10 мкМ каждого пептида и 20% об / об ACN. - Для внутренних пептидных стандартам, подготовить серию разведений для количественного LC-SRM:
- Подготовьте 100 мкл разведения 1 мкМ: объединить 90 мкл 20% об / об ACN и 10 мкл 10 мкМ смеси пептидов.
- Подготовьте 100 мкл разведении 100 нм: объединить 90 мкл 20% об / об ACN и 10 мкл 1 мкМ пептида смеси.
- Для внешних стандартов пептидных подготовить 100 мкл разведения 1 мкМ для ЖХ-МС путем объединения 90 мкл 0,1% об / об муравьиной кислоты и 10 мкл 10 мкМ смеси пептидов.
Примечание: Образец теперь содержит 1 мкМ каждого пептида, 0,1% об / об муравьиной кислоты и 2% об / об ACN, и готов быть использованы для разработки LC-SRM анализа.
3. ЖК-SRM Анализ развития
- Анализ смесей внешних стандартов пептид (примерно 1-10 пмоль каждого пептида на инъекцию) в ружье MS с использованием нано-HPL потокаС системой в сочетании с тройной квадрупольный масс-спектрометр (ЖХ-МС-QQQ (/ MS)).
- Используйте систему LC-MS, оснащенный капиллярной колонкой, заполненной C-18 средств массовой информации (диаметром ≤5 мкм, ~ 200 в поры, длина ≥10 см, ID = 50-100 мкм) и наконечник нано-ESI (обычно производится с помощью лазерного съемника). Убедитесь, что каждый ЖХ-МС выполнения включает в себя ~ 60 мин линейный градиент (обычно, 0-40% растворитель В) стадию регенерации колонки (~ 80% растворитель В), и стадию колонны повторного установления равновесия (~ 0% растворитель В ) (растворитель А = 0,1% об / об муравьиной кислоты в H 2 O, растворитель В = 0,1% об / об Скорость муравьиной кислоты в ACN, расход = 200-800 нл / мин, напряжение ESI = 1,800 В, ширина изоляции Q3 = 0,7 м / г, Q2 давление аргона = 1,5 мТорр).
- Для каждого иона предшественником сканирования, динамически выбирать верхнюю ~ 10 наиболее интенсивные ионы-предшественники для тандемной масс-спектрометрии (МС / МС). Запуск каждого образца в двух экземплярах, так что два различных энергий столкновения пандусы используются: один предназначен для оптимального фрагмент 2 ионов-предшественников, и другиедля 3-предшественник ионов 41.
- Выполните LC-QQQ-МС (/ МС) анализа с использованием Q3 предшественника ионов сканирования (Q1 сканирования ионов предшественника может привести к затягиванию ионных пиков предшественником в результате столкновений аргона низких энергий в Q2).
- Убедитесь, что система ЖХ-МС выполняет надлежащим образом путем анализа образцов КК и технические повторов. Предотвращение уноса образец с помощью свежеприготовленные колонки LC и запустив несколько заготовок между образцами.
- Анализ полученных данных ружье LC-QQQ-МС (/ МС) с использованием поиска в базе данных в отношении последовательностей пептидных внешних стандартов 42. При необходимости, отказаться от неоднозначных пептидные идентификации, используя идентификационные пептид доверительные оценки (например, средние значения) или с помощью статистического моделирования 42. Несмотря на это, вручную просмотреть все пептидных идентификаций 43, чтобы обеспечить, что все они однозначны.
- Используйте дробовик MS пептидные идентификации подставитьструктуры библиотеки спектра, используя программу, таких как Skyline.
- Подготовьте список перехода LC-SRM с помощью 3-10 наиболее интенсивные переходы на ион предшественника (2 и 3 ионы-предшественники; +1 и +2 осколочные ионы; y, b- и ионы, которые ≥2 остатки длинный).
- Сбросьте переход, если значения M / Z предшественника и фрагмент ионные перекрываются с точностью измерения массы Qqq-МС (фрагментация ионов предшественника иногда неполный, помните, чтобы рассмотреть моноизотопном и тяжелые природные формы изотопов, а также немеченый и тяжелых форм помечены).
- Точно так же, отказаться от перехода, если ионный фрагмент м / г, накладывается на другой осколочного иона с той же иона-предшественника.
- Использование полученные списки перехода для выполнения LC-SRM анализы смесей внешних стандартов пептид (выполнить масс-спектрометрии, как описано в шаге 3.1; Q1 и Q3 ширина изоляции = 0,7 м / г; время выдержки = 2-50 мс).
- Массачусетсгодно рассмотреть полученные данные LC-SRM и удалять любые неэффективные анализы (анализ ЖХ-SRM данных, описанной в разделе 5).
4. LC-SRM Анализы биологических образцов
- Подготовьте посуду культивируемых клеток 44. Если несколько экспериментальных условий сравниваемых, блок и случайным образцы, чтобы уменьшить возможные систематические ошибки 45.
- Для каждого блюда клеток, аспирации клеток культуральной среды отходов и приостановить клетки в свободном буфере сыворотки 44. При необходимости, промыть клетки в бессывороточной буфера, чтобы удалить оставшиеся внеклеточный белок.
- Для каждого образца, подсчитывают количество жизнеспособных клеток и общего количества с помощью жизнеспособность пятно (например, трипанового синего) и гемоцитометра или автоматизированного счетчика клеток 44.
- Гранул клетки центрифугированием и аспирации супернатантов тратить 44 (типичный объем Осадок клеток ~ 30 мкл).
- Добавить 400 мкл лизирующего буфера мочевины или поверхностно лизирующего буфера для каждого клеточного осадка (100 мМ HEPES ∙ NaOH рН 8, 10 мкМ бестатин гидрохлорида, 10 мкМ пепстатин А и либо 8 М мочевины или 0,1% вес / объем поверхностно-активного вещества (соответственно ); свежеприготовленный; использовать кислотно-лабильный МС-совместимый, такие как поверхностно-активное вещество RapiGest SF или PPS Сайлент ПАВ). При использовании других ингибиторов протеазы, гарантировать, что они не ингибируют трипсин.
- Смешайте каждого образца осторожно пипеткой с помощью, и передавать друг к 2 мл пробирку (с винтовой крышкой с уплотнительным кольцом), содержащую ~ 100 мкл 0,1 мм циркония / кремнезема бисера (обратите внимание, что шарики могут вызвать оснастку крышки трубы к утечке ). Лизиса клеток путем встряхивания проб в течение 5 мин при полной скорости (это лизирует клетки в шаровой биение).
- Кроме того, лизировать клетки с помощью другого механического метода (например, с использованием французской прессе или гомогенизации советы).
Примечание: Не центрифугирования клеточных лизатов, потому что это может осадить осажденного белка, который может OTherwise быть tryptically переваривается и обнаруживается методом ЖХ-МС.
- Кроме того, лизировать клетки с помощью другого механического метода (например, с использованием французской прессе или гомогенизации советы).
- Для поверхностно денатурированных образцах, инкубировать их при 90 ° С в течение 10 мин, чтобы помочь образца гомогенизации и денатурации белка.
- Ванна разрушать ультразвуком образцов в течение 10 мин при комнатной температуре, чтобы помочь гомогенизации и денатурации белка.
Примечание: лизаты и буфера для лизиса можно хранить при -80 ° С (буфер для лизиса будут необходимы для шагов 4.9 и 4.13). - Выполнение концентрации белка анализа 46 (например, анализа бицинхониновой кислоты) из лизатов (и буфера для лизиса в контрольном эксперименте).
- Для качественного анализа (т.е., не внутренние стандарты пептидные не будет шипами-во образцов), пипеток 200 мкг (массовых белок) из клеточного лизата в свежем 1,5 мл микроцентрифужных трубки. Для количественных анализов, готовить четыре таких образцов для стабильной серии изотопного разбавления.
- Для каждого образца, добавить внутренний стандарт белка (например, </ EM>, добавьте ~ 5 пмоль ~ 98% чистой люциферазы светляков).
- Для количественного анализа, добавить стабильный изотоп серии разведений в эквимолярной смеси внутренних стандартов пептид (например, 0, 0,2, 2, 20 пмоль каждого пептида) с образцами.
- Параллельно готовят контрольные образцы с использованием стандартов внутреннего пептидные в одиночку (т.е. не Клеточный лизат) (например, 0, 0,2, 2, 20 пмоль каждого пептида).
- Также подготовьте контрольные пробы, используя внешние и внутренние стандарты пептид (например: 2 пмоль каждого внешнего стандарта пептида, и 0, 0,2, 2 и 20 пмоль каждого внутреннего стандарта пептида).
Примечание: Убедитесь, что стандарты пептидные бесплатно муравьиной кислоты, как это может помешать трипсина пищеварения.
- Добавить буфера для лизиса, так что все образцы имеют одинаковые объемы. Примечание: типичный объем выборки составляет 70 мкл, так что это объем будет использоваться для данного протокола.
- Сокращение белка остатков цистеина, добавив 0.7 мкл 1 М DTT (свежеприготовленный) к каждому образцу (конечная концентрация ДТТ 10 ммоль) и инкубации образцов при 60 ° С в течение 30 мин.
- Алкилата белка cystines путем добавления 7 мкл забуференного иодацетамидом (500 мМ иодацетамида, 1 М HEPES ∙ NaOH рН 8; свежеприготовленные) к каждому образцу (конечная концентрация иодацетамида 50 мМ) и инкубации образцов при комнатной температуре в течение 20 мин в темноте (йодацетамида светочувствительных). При необходимости, погасить оставшуюся иодацетамида добавлением DTT до конечной концентрации 50 мМ.
- Для каждого из образцов денатурированной использованием мочевины, добавить 482 мкл 100 мМ HEPES ∙ NaOH рН 8, так что конечная концентрация мочевины составляет 1 м (трипсин значительно ингибирует при> 1 М мочевины 47).
- Tryptically переварить белки до пептидов.
- Для каждого образца, содержащего клеточный лизат, добавить 8 мкл 0,5 мкг / мкл класса последовательности изменен трипсина, так что конечная трипсина Концентратион 1:50 (белок вес: вес) трипсином: образец, и инкубируют образец при 37 ° С в течение 18 часов.
- Для каждого образца, который не содержит клеточного лизата, добавляют 0,5 мкл 0,5 мкг / мкл последовательности класса трипсина изменен, и инкубируют образец при 37 ° C в течение 2 часов (каждый из этих образцов для контрольных экспериментов, и, как правило, содержат только 10 нг -10 мкг пептида + белковой массы).
- Для каждого из мочевины денатурированных образцах, добавить 440 мкл 2% об / об муравьиной кислоты (конечная концентрация муравьиной кислоты составляет 1% об / об). Убедитесь, что эти образцы являются рН ~ 3.
- Для каждого из поверхностно-денатурированных образцах, добавить 914 мкл 0,5% об / об TFA (конечная концентрация ТФК составляет 0,5% об / об). Убедитесь, что эти образцы являются рН ~ 1,5. Инкубируйте эти образцы при 37 ° С в течение 60 мин, чтобы гидролизовать ПАВ.
- Микроцентрифуга всех образцах при 21000 × г в течение 20 мин при комнатной температуре для осаждения поверхностно хвостовую группу и любую другую PRECipitates, что бы закупоривают С-18 SPE картридж.
- Твердофазный извлечь каждый из супернатантов с помощью одноразового С-18 SPE картридж (буфер А = 0,1% об / об муравьиной кислоты; Буфер Б = 0,1% об / об муравьиной кислоты, 80% об / об ACN; ~ 100 мг C- 18 смолы в картридже). Принудительное подвижных фаз через C-18 SPE картридж с помощью плоской поверхностью резинового баллона, используя экстракционный трубопровод или центрифугированием картридж в 15 мл центрифужную пробирку на 10 × г в течение 5 мин.
- Влажный колонки путем нанесения 1 мл буфера В, уравновесить его с применением 1 мл буфера А в два раза, наносить образец, и мыть картридж с применением 1 мл буфера А в два раза. Элюируйте пептиды с применением 1 мл буфера В медленно (~ 2 мин).
- Концентрат каждый элюат в вакуумной концентратора до конечного объема 100 мкл с испариться ACN. Добавить 200 мкл H 2 O к каждому образцу, и концентрат друг в вакуумной концентратора до конечного объема 98 мкл, чтобы испарить от любого возможного повторногоостальной ее ACN.
- Добавить 2 мкл 5% об / об муравьиной кислоты в ACN к каждому образцу (конечные концентрации образца составляет 0,1% об / об муравьиной кислоты, 2% об / об ACN).
Примечание: Образцы можно хранить при -80 ° С. - Анализ образцов, используя LC-SRM (как в шаге 3.4). Для качественного ЖК-SRM анализов, запускать биологические образцы и внешние стандарты пептидные и анализировать всю полученную данные вместе. Для количественного LC-SRM анализ, запустить серию изотопного разбавления каждого биологического образца, а также запускать образцы, состоящие из одних стандартов пептидных и анализировать всю полученную данные вместе.
5. Анализ LC-SRM данных
ПРИМЕЧАНИЕ: Пептид идентификация и количественное определение может быть весьма упрощены и частично автоматизированы с помощью программного обеспечения, таких, как Skyline, но он по-прежнему настоятельно рекомендуется, чтобы все аннотации данных вручную рассмотрены. Кроме того, лучше всего, чтобы исключить информацию об уровне белка при ручном Аннования данных LC-SRM для предотвращения смещения.
- Для каждого пептида идентификации, подтверждения того, что форма каждого профиля переход элюирования примерно гауссовой. Для каждого перехода, убедитесь, что профиль элюирования продукта из нескольких сигналов, измеренных детектором MS (т.е., не продукт из одного или двух случайных всплесков шума MS).
- Для каждого пептида идентификации, убедитесь, что выбран весь профиль пептид элюирование. Избегайте ручной регулировки границы Профиль элюции подкомпонентами идентификации пептидов (тяжелой форме меченных пептидов, намеченного форме отдельных ионов, прекурсоров, и отдельных переходов).
- Убедитесь, что каждый профиль элюирования переход имеет отношение сигнал-шум (S / N) ≥3. Примечание: "Шум" относится к случайным шумом MS, не воспроизводимые сигнал от coeluting веществ. Хроматограмм сглаживания функции могут существенно помочь анализ зашумленных данных.
- Для каждого пептида идентификации,подтверждают, что все переходы имеют почти идентичные профили элюировани (не только равные пиковых апексных раз; профили элюции может иметь различные амплитуды).
- Для LC-SRM анализа большого количества пептидных стандартам (обычно ≥100 фмоль каждого пептида), подтверждают, что соответствующие профили элюции пептида очень интенсивны (обычно S / N ≥100), и что пептид идентификации являются однозначными. Примечание: Эти чрезвычайно уверенные отождествления будет иметь решающее значение для идентификации соответствующих биологических образцов пептидов, полученных.
- Для каждого пептида идентификации, подтверждения того, что относительные интенсивности переходов совпадают с уверенностью определены стандартом пептидов. При необходимости, отказаться от шумных относительно низкой интенсивности профилей переход элюирования, но подтверждают, что ни один из относительно интенсивных переходов не хватает. Не обращайте внимания на относительно интенсивные профили переход элюирования, что значительно и однозначно сказаться на сотрудничествеэлюирование примеси.
- Для каждого пептида идентификации, оценки вероятности того, что она была произведена случайным фонового сигнала (случайная MS шума плюс воспроизводимого сигнала от coeluting анализируемых).
- Оцените эту вероятность вручную путем изучения весь LC-SRM хроматограмму и оценки уникальность каждого идентификации пептидов. Производить набор уверенных пептидных идентификаций, что, по оценкам ложных обнаружения (FDR) 5%. Используйте жесткие критерии (например, ФРГ ≤1%), если выше уверенность набор идентификаций требуется (использование рыхлых критериев не рекомендуется).
- Кроме того, использование алгоритма mProphet 48 или алгоритм аудита 49, но вручную проанализировать результаты.
- Для каждого пептида идентификации, подтверждения того, что наблюдаемое время элюирования согласуется с гидрофобности пептида (Skyline предназначен для выполнения этого расчета).
- Для каждого пептида, подтверждают, чтоего время элюирования согласуется через LC трасс.
ПРИМЕЧАНИЕ: LC-SRM анализ иногда производят элюирования профили, которые систематически перекос между запусками. Систематические изменения следует ожидать после инструментальных изменений, таких как замена колонка. Кроме того, в начале элюируя пептиды могут быть склонны к смещение (особенно, если столбец загружен почти на полную мощность), и поздние элюируя пептиды также могут быть склонны к смещение. Идентификация пептида завершена. - Для улучшения количественной пептид, reinspect каждый идентификации пептидов и отбросить профиль элюции переход, если это особенно шумным по сравнению с другими переход элюирования профилей идентификации пептидов. Отменить профиль элюции переход, если его относительная интенсивность перехода является неправильным (по сравнению со стандартом пептида).
- Осмотрите границы каждого иона предшественником и переход элюирования профиль. При необходимости, тщательно отрегулировать границы Профиль элюции, чтобы обрезать от фонового сигнала (или Improve фон оценка сигнала).
- Для каждого внутреннего стандарта пептида, проверить, если он загрязнен определяемом количестве света пептида (определяется LC-SRM анализ внутренних стандартов пептидных одна, описано выше). Впоследствии, отказаться от любых световых профили элюции пептида, которые были значительно скомпрометировали загрязнения светло-пептида в пределах внутренних стандартов пептидных.
- Количественно каждый переход профиль элюции путем расчета его LC площадь пика. При необходимости, вычесть расчетную фонового сигнала. Количественно каждый пептид профиль элюции путем суммирования соответствующих значений перехода количественной (далее, это называется как значение "Sum_Peak_Area"). Для каждого биологической ценности Sum_Peak_Area образец пептида, вычислить биологический пептидный образец молярное изобилие, используя данные из LC-SRM внутренних или внешних стандартов пептидных (использование только переходы, которые были успешно количественно и биологическая пептид образцаLC-SRM и стандарта пептида).
- Количественное с использованием внешних стандартов пептид (не рекомендуется):
- Участок внешней пептидные стандартные значения Sum_Peak_Area против внешнего пептидных стандартных молярных величин численности. Продукция стандартную кривую путем подгонки линейную регрессию к данным (обычно, должны быть использованы только линейный компонент динамического диапазона; любой нелинейный компонент должен быть использован с особой осторожностью). Для каждого биологической ценности Sum_Peak_Area образец пептида, использовать стандартную кривую для расчета молярной пептид изобилие.
Примечание: Этот метод количественного не рекомендуется, потому что она требует, чтобы подготовка проб и LC-SRM быть доказательности устойчивой, так как биологические образцы и внешние стандарты пептидные подготовлены и проанализированы с помощью ЖХ-SRM отдельно. Кроме того, он не учитывает матричных эффектов (эффектов, обусловленных компонентов пробы, кроме аналита).
- Участок внешней пептидные стандартные значения Sum_Peak_Area против внешнего пептидных стандартных молярных величин численности. Продукция стандартную кривую путем подгонки линейную регрессию к данным (обычно, должны быть использованы только линейный компонент динамического диапазона; любой нелинейный компонент должен быть использован с особой осторожностью). Для каждого биологической ценности Sum_Peak_Area образец пептида, использовать стандартную кривую для расчета молярной пептид изобилие.
- Количественное с использованием внутреннихпептидные стандарты (рекомендуется):
- Для каждого биологической ценности Sum_Peak_Area образец пептида и соответствующей тяжелой меченных внутреннего пептида стоимости стандартной Sum_Peak_Area, рассчитать легкая / тяжелая соотношение. Использование этого отношения в качестве меры соответствующего легкой / тяжелой пептида молярное соотношение численности вычислить мол рное изобилие биологической пробы пептида. В частности, биологический образец пептида молярное обилие равна внутренней пептидной стандарт молярное изобилие, умноженная на легкой / тяжелой соотношении Sum_Peak_Area.
- Для каждого биологического воспроизведения и целевой пептид, определить линейный диапазон LC-SRM количественного путем создания стандартной кривой с использованием линейной регрессии. В частности, участок внутреннего пептидные стандартные значения молярной изобилие против тяжелых / легких значениями отношения Sum_Peak_Area (обратите внимание, что масса биологический образец является постоянным по набору данных). Требовать, чтобы каждый биологическая ценность пептид Sum_Peak_Area образец находится в пределах линейного диапазона (Typicсоюзник, только линейный компонент динамического диапазона следует использовать; любой нелинейный компонент должен быть использован с особой осторожностью). Точно так же, выполнить этот шаг для каждой целевой пептида перехода.
Примечание: Аналит количественная ЖХ-QQQ-SRM должна быть линейной в широком динамическом диапазоне (~ 10000). На нижнем конце, фоновый сигнал (случайный шум МС плюс воспроизводимый сигнал от coeluting анализируемых) снизит точность количественного и точность. В верхнем конце, насыщение детектора будет вызывать нелинейность (конечном счете, это может привести к профили элюции, чтобы быть плоской, начиная с определенной интенсивности сигнала).
- Количественное с использованием внешних стандартов пептид (не рекомендуется):
- При необходимости, выполнить нормализацию глобальную через образцов, таких как центральной тенденции нормализации 50, для коррекции небольших различий в количестве образца до начала заезда пики внутренних стандартов пептида. Если необходимо, используйте только служебная белки с шага 1.1.
- При необходимости, приписывает отсутствующие quantificatионная значения 51,52.
Примечание: Это неприлично просто заменить отсутствующие значения с половиной нижнего предела количественного (LLOQ) или половины предела обнаружения (LOD), так как это будет искусственно снизить количественного дисперсию, и может привести к статистического теста (например, ANOVA ) производит ложное положительный результат (типа я ошибка). Тем не менее, не обращая внимания недостающие значения также может быть проблематичным. Например, если половина истинные значения численности находятся ниже LOD, и другая половина выше LLOQ, то средняя наблюдаемая изобилие бы переоценивать в виду истинное изобилие. - Убедитесь, что анализы удовлетворить общепринятых принципов для LC-SRM 23-25. Следует отметить, что требуется, чтобы коэффициент вариации значений количественного обычно ≤25% для клинических анализов и ≤35% для не-клинических анализов 25. Для LC-SRM анализов, связанных с медицинскими или ветеринарных продуктов или услуг, которые должны быть рассмотрены в течение нормативного приложенияroval, требуют, чтобы анализы удовлетворить строгие требования к точности для таких анализов: "Точность определяется на каждом уровне концентрация не должна превышать 15% от коэффициента вариации (CV) для LLOQ, где он не должен превышать 20% от исключением CV "23,24.
Результаты
Развитие интеллектуального вычислительных моделей сигнальных путей трансдукции является одним из основных целей системной биологии 53. К сожалению, даже для путей, которые были изучены и имеют высокую клиническую значимость сигнализации, он по-прежнему в целом не возможно количественно предсказать тропинка поведение в ответ на возмущения (например, это верно для МАРК / ERK пути 54). Недавно расследование занятых целевых протеомики, транскриптомика и численное моделирование и моделирование для изучения мыши макрофагов хемотаксиса путь 56 сигнализации. В центре внимания исследования было сфингозина-1-фосфат, опосредованные хемотаксис RAW 264.7 клеток (линии мыши моноцитов / макрофагов клетки). Для облегчения тропинка моделирование, LC-SRM анализы были разработаны и выполнены для измерения абсолютного изобилия хемотаксис пути белков внутри RAW 264.7 клеток. Полученные значения численности были использованиеd в качестве параметров модели пути.
Общая схема эксперимента (рис 1) начал со списком целевых белков, которые включали G I2, а гетеротримерных G-белка α-субъединицы. Успех общей протокола в значительной степени зависит от выбора пептидных мишеней, которые proteotypic и quantotypic, таких как YDEAASYIQSK. Смеси внешних стандартов пептидных были подготовлены и проанализированы с помощью дробовика LC-QQQ-МС (/ МС). Полученную массу спектр YDEAASYIQSK тандем, состоящий из нескольких осколочных ионов, и это был низкий фон (рисунок 2). Спектры были использованы для составления LC-SRM целевые списки, содержащие десятку наиболее интенсивные ионы фрагментов за иона предшественника.
Смесь 409 внешних стандартов пептид ("JPT409») анализировали в трех повторностях качественными LC-SRM (данные не показаны). Этот образец включал три G i2 пептиды, и идентификация всех трех былсудить быть уверенным. Впоследствии RAW 264.7 пробы (биологических повторяет "raw1" и "raw2") и образец JPT409 были друг проанализированы в двух экземплярах (два технических повторяет LC-SRM) с помощью качественного LC-SRM (эти шесть LC-SRM анализ проводили, как же, как возможное). YDEAASYIQSK пептид уверенно определены во всех шести анализов (3А - С). Модели интенсивности переходных YDEAASYIQSK согласуются по шесть LC-SRM анализы, и они были примерно похож на ружье LC-MS (/ MS), рисунок ("Библиотеки" повторить в рисунке 3C).
Модель интенсивностей переходов в одиночку не всегда достаточно для уверенной идентификации пептида. Пептид гидрофобность и измеряется LC время удерживания должно быть последовательным. Кроме того, внешние стандарты пептидные и соответствующие биологические пептиды образец должен иметь примерноравные времена удерживания. Гидрофобность (оценивается с использованием версии 3.0 SSRCalc 100 алгоритма A 55) и наблюдали время удерживания YDEAASYIQSK были найдены в соответствие (4А). Кроме того, время удерживания YDEAASYIQSK измеряли с использованием как RAW 264.7 анализы и анализы внешних стандартов пептидных и все значения времени удерживания приблизительно равны (4В).
Большинство качественного LC-SRM анализа биологических образцов были успешными, так что соответствующие тяжелых помечены, очищенный, количественно внутренние стандарты пептидные были подготовлены и шипами-в RAW 264.7 клеточных лизатов. Серия изотопного разбавления LC-SRM был использован для анализа образцов, состоящих из одних стандартов внутреннего пептидных (образец "R0"), внутренние и внешние стандарты пептидные (образец "R1"), и шесть RAW 264.7 биологических повторяет (образцы "R2" - "R7"). Два differeNT белка денатурирующим были использованы для проверки каких-либо возможных проблем белок растворение, денатурации, алкилирования, и / или с пищеварением, которые могут подорвать точную количественную целевого белка (образцы R2-R4 используется мочевину, и образцы R5-R7 используется RapiGest SF). Легкие и тяжелые формы YDEAASYIQSK содержатся шаблоны интенсивности почти идентичны перехода и элюирования профилей (рис 5А - C). LC-SRM подведены отношения площади пика были использованы в качестве меры относительного изобилия пептида, и отношения YDEAASYIQSK были использованы для расчета G значения I2 изобилие в единицах экземпляров в RAW 264.7 клетки. Параллельно, второй G i2 внутренний стандарт пептид (IAQSDYIPTQQDVLR) был использован для выполнения количественных G i2 SRM LC-анализов тех же образцов RAW 264.7, и два анализы производятся высоко аналогичные измерения G i2 изобилие во всех биологических повторностях (Рисунок 5D). Соглашение из двух G i2 анализы убедительные доказательства, что оба пептида являются quantotypic, и что все количественные G i2 SRM LC-анализов были точны и точным.
В целом, 35 белки количественно с использованием 58 внутренних стандартов пептид (таблица 1). Следует отметить, что LC-SRM анализы внутреннего стандарта белка (люциферазы светляков; Шаг 4,11) были точными и точными. Полный набор данных на горизонт от этого расследования можно найти на интернет-базе данных LC-SRM Панорама (в папке Manes_RAW_Chemotaxis в https://panoramaweb.org/labkey/project/NIH_NitaLazar/begin.view).
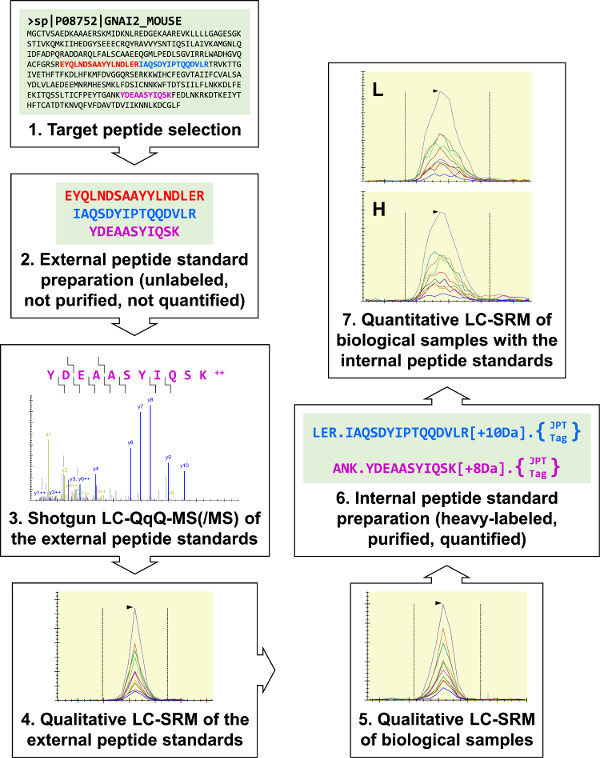
Рисунок 1:. Обзор протокола Три предварительных целевых пептидов для G i2 (гетеротримерный G-белок α-субъединица) были выбраны для внешнего пептида стандартного синтеза. Они были аназед от дробовика ЖХ-МС (/ МС) разработать три G i2 LC-SRM анализов, и эти анализы были использованы для выполнения качественный анализ биологических образцов. Все три G I2 целевые пептиды были идентифицированы, и два были выбраны для внутреннего пептида стандартного препарата. Трипсин-расщепляться "JPT-теги", были использованы для количественной оценки внутренних стандартов пептидные используя УФ-спектрофотометрии. Внутренние стандарты пептидные были использованы для выполнения количественных G i2 SRM LC-анализы RAW 264.7 образцов. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
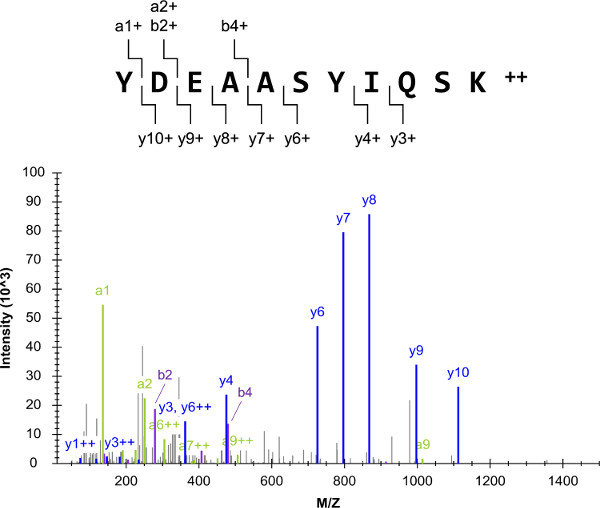
Рисунок 2:. Ружье ЖХ-МС (/ МС) изображен масс-спектр возникла из анализа одного из G i2 внешних стандартов пептид (YDEAASYIQSK). Для этого предшественникаион, в первую десятку наиболее интенсивные переходы были отобраны для LC-SRM (исключая ион а1 1+ фрагмент из-за его малой длины). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
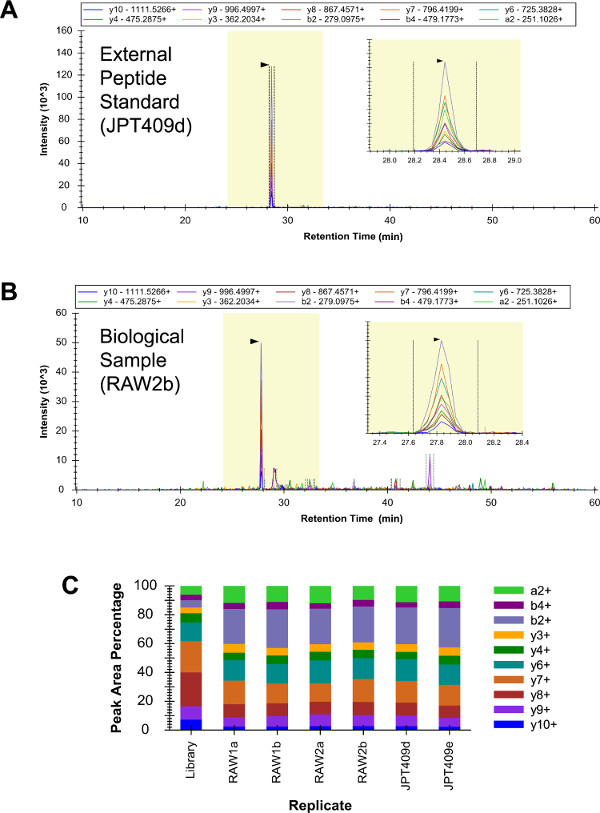
Рисунок 3:. Качественный LC-SRM из G i2 YDEAASYIQSK хроматограмму с JPT409 анализа содержал очень низкие фон и пептид с уверенностью определены (A). Соответствующие RAW 264.7 анализы привело к более фонового сигнала, но идентификация пептид был еще однозначным (В). Относительные интенсивности переходных моделей согласуются по всем шести LC-SRM анализируются (два технических повторов трех независимых выборок), и они были примерно СимиLAR в соответствующий дробовика LC-MS / MS () шаблон ("Библиотека") репликатов (C). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: Пептид предсказания времени удерживания и вариации по трасс линейной регрессии рассчитывали, используя оценочную гидрофобность и измеряется качественный LC-SRM временем элюции всех целевых пептидов, и предсказанные и измеренные времена элюирования YDEAASYIQSK согласуются (А). , Кроме того, последовательность наблюдаемого времени элюирования каждого пептида через LC-SRM анализа было определено. Времена элюирования YDEAASYIQSK охватывали диапазон ~ 40 сек, что согласуется с точностью прибора LC-SRM, который был использован (значенияявляются вершиной пика Время +/- полная ширина на половине максимальной, а также полная ширина у основания пика) (B). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
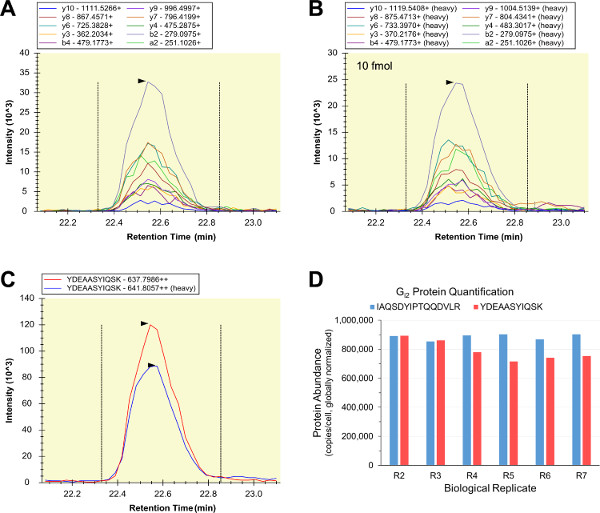
Рисунок 5:. Количественный LC-SRM из G i2 Переходные хроматограммы биологического образца пептида (А) и стандарта внутреннего пептида (B) были последовательные относительные интенсивности переходов, и были подведены (С) (изображены является анализ "R2" для YDEAASYIQSK с использованием 10 фмоль стандарт внутренняя пептид). Легкой и тяжелой профили элюции последовательно (С), а отношение площади под этими кривыми был использован в качестве меры по осветиHT / тяжелая пептид изобилие. Второй G i2 внутренний пептид стандарт (IAQSDYIPTQQDVLR) был использован для количественного LC-SRM параллельно, и полученные значения численности G i2 согласуются по обе шести биологических повторяет и двух целевых пептидов (в целом, п = 12 и CV = 8,38 %) (D). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| UniProt Присоединение | Белка-мишени | Целевая пептида | Изобилие (фмоль / мкг) | Изобилие (копий / клеток, нормализуется) | РЕЗЮМЕ |
| P08659 | Люциферазы | (УФ при 280 нм) | 23,824 | н / | н / |
| P08659 | Люциферазы | VVDLDTGK | 24,103 | н / | 7% |
| P08659 | Люциферазы | VVPFFEAK | 24,717 | н / | 4% |
| P60710 | Актина, цитоплазматическая 1 | IWHHTFYNELR | 760,448 | 61762598 | 3% |
| P16858 | GAPDH | LISWYDNEYGYSNR | 357,803 | 28906524 | 14% |
| P06151 | Лактатдегидрогеназа | LLIVSNPVDILTYVAWK | 129,623 | 10633145 | 30% |
| P99024 | Тубулин β 5 | ALTVPELTQQVFDAK | 78,765 | 6398971 | 3% |
| P20152 | Виментин | SLYSSSPGGAYVTR | 121,100 | 9807488 | 10% |
| P60766 | Cdc42 | DDPSTIEK | 86,647 | 6957317 | 27% |
| P60766 | Cdc42 | QKPITPETAEK | 26,475 | 2153669 | 6% |
| Q8C3J5 | DOCK2 | ETLYETIIGYFDK | 1.459 | 118539 | 15% |
| Q8C3J5 | DOCK2 | ISSSPTHSLYVFVR | 1.795 | 143440 | 33% |
| Q8BPU7 | ELMO1 | ALTTKPSSLDQFK | 2.302 | 186754 | 7% |
| Q8BPU7 | ELMO1 | SAIDISILQR | 1.244 | 99728 | 25% |
| Q8BGM0 | ФРГ | GAYSLSIR | 1.099 | 89473 | 17% |
| Q8BGM0 | ФРГ | WTAPEAALFGR | 0,319 | 24766 | 6% |
| P27601 | Gα 13 | GIHEYDFEIK | 0.843 | 68467 | 15% |
| P27601 | Gα 13 | VFLQYLPAIR | 1.295 | 106176 | 23% |
| P08752 | Gα (я) 2 | IAQSDYIPTQQDVLR | 10.900 | 885701 | 2% |
| P08752 | Gα (я) 2 | YDEAASYIQSK | 9.774 | 790616 | 9% |
| Q9DC51 | Gα (к) | EYQLNDSASYYLNDLDR | 6,574 | 537862 | 15% |
| Q9DC51 | Gα (к) | ISQTNYIPTQQDVLR | 3,504 | 285784 | 10% |
| P62874 | £ В 1 | AGVLAGHDNR | 17,078 | 1385578 | 4% |
| Q9CXP8 | Gγ 10 | DALLLGVPAGSNPFR | 2.167 | 179178 | 36% |
| P63213 | Gγ 2 | EDPLLTPVPASENPFR | 3.284 | 266360 | 8% |
| Q80SZ7 | Gγ 5 | VSQAAADLK | 6,087 | 493512 | 6% |
| P08103 | HCK | GPVYVPDPTSSSK | 1.143 | 93044 | 12% |
| P08103 | HCK | IIEDNEYTAR | 0.944 | 77147 | 19% |
| P43406 | Интегрин α V | AGTQLLAGLR | 0,276 | 22264 | 32% |
| P43406 | Интегрин α V | SHQWFGASVR | 0.443 | 34235 | 5% |
| P25911 | LYN | VIEDNEYTAR | 1.461 | 119377 | 13% |
| Q5SW28 | PI3K нормативно 5 | AGFPGILDTASPGK | 0,301 | 24331 | 11% |
| Q8K3B3 | PI3K нормативно α | LYEEYTR | 0.472 | 38592 | 16% |
| Q8K3B3 | PI3K нормативно α | TWNVGSSNR | 0,524 | 42697 | 12% |
| Q8K3B3 | PI3K нормативно α | VLSEIFSPVLFR | 0.440 | 35902 | 20% |
| Q5U3K7 | PI3K нормативно β | DTPDGTFLVR | 0,188 | 15262 | 30% |
| Q5U3K7 | PI3K нормативно β | IAEIHESR | 0.282 | 22561 | 13% |
| Q0VGQ5 | PI3K α | LINLTDILK | 0,102 | 8494 | 38% |
| Q8CI98 | PI3K δ | HEVQEHFPEALAR | 0,178 | 14566 | 22% |
| Q8CI98 | PI3K δ | ITEEEQLQLR | 0,481 | 38709 | 24% |
| Q9ES52 | PIP3 5-фосфатазы 1 | IVVLAKPEHENR | 0,486 | 39194 | 19% |
| Q9ES52 | PIP3 5-фосфатазы 1 | LSQLTSLLSSIEDK | 2.056 | 167123 | 7% |
| Q69ZK0 | PIP3 зависит от Rac ГЭФ 1 | DSVLSYTSVR | 0,647 | 52712 | 32% |
| Q69ZK0 | PIP3 зависит от Rac ГЭФ 1 | NQLLLALLK | 0,354 | 27425 | 5% |
| Q9CQE5 | РГС 10 | ASSQVNVEGQSR | 2.460 | 199782 | 4% |
| Q9CQE5 | РГС 10 | WASSLENLLEDPEGVQR | 20,647 | 206005 | 11% |
| Q9CX84 | РГС 19 | AEANQHVVDEK | 0,495 | 39753 | 21% |
| Q9CX84 | РГС 19 | LIYEDYVSILSPK | 0.846 | 68481 | 22% |
| B9EKC3 | Ро GAP 5 | DGLAQELANEIR | 0,448 | 34653 | 10% |
| Q99PT1 | Ро GDI 1 | SIQEIQELDK | 3.156 | 267063 | 16% |
| Q99PT1 | Ро GDI 1 | VAVSADPNVPNVIVTR | 37,077 | 3006168 | 5% |
| Q61599 | Ро GDI 2 | LNYKPPPQK | 37,975 | 3086596 | 3% |
| Q61599 | Ро GDI 2 | YVQHTYR | 21,436 | 1711908 | 47% |
| Q61210 | Ро ГЭФ 1 | FDGAEGSWFQK | 2.149 | 176139 | 47% |
| Q61210 | Ро ГЭФ 1 | SGLELEPEEPPGWR | 2.911 | 236483 | 8% |
| Q9QUI0 | RhoA | QVELALWDTAGQEDYDR | 43.500 | 3532438 | 8% |
| P70336 | ROCK2 | GAFGEVQLVR | 0,527 | 42,800 | 23% |
| P70336 | ROCK2 | IYESIEEAK | 1.011 | 83794 | 33% |
| P70336 | ROCK2 | LEGWLSLPVR | 0,573 | 48259 | 22% |
| Q8R0X7 | С1Ф лиазы 1 | AGYPLEKPFDFR | 1.787 | 147043 | 27% |
| Q8R0X7 | С1Ф лиазы 1 | TPEIVAPESAHAAFDK | 3.562 | 291791 | 18% |
Таблица 1: Количественные LC-SRM сырьевых 264,7 клеточные белки Тридцать пять RAW 264.7 клеток белки количественно, используя пятьдесят восемь внутренних стандартов пептидные и шесть биологических повторяет.. Пять из белков-мишеней были Уборка белки (актин, GAPDH, лактатдегидрогеназы, тубулина и виментин), и количественно, с тем чтобы нормализации через биологические образцы (Шаг 1.1). Кроме того, внутренний стандарт белка шипами-во лизата каждой клетки и количественно методом ЖХ-SRM (4,765 пмоль люциферазы светлячка в 200 мкг образца; 98% чистоты по данным SDS-PAGE; количественно спектрофотометрически при 280 нм; Шаг 4.11). Значения CV были рассчитаны по шести биологических повторяет использованием глобально нормированные значения численности (для люциферазы кроме; Шаг 5.15).
Обсуждение
Абсолютная количественное белок имеет важное значение для очень широкого круга биомедицинских применений, таких как проверка биомаркеров и моделирования затрагивающего пути передачи сигнала. Недавно целевые протеомика, использующие LC-SRM пользовался улучшений многочисленных технологий, включая пептида стандартного препарата, ВЭЖХ, QQQ-МС и анализа данных LC-SRM. Следовательно, она стала мощной альтернативой иммунологических. Иммунологические может быть чрезвычайно чувствительны и высокой пропускной, но развитие прочной иммуноанализа может быть чрезвычайно сложной задачей, поскольку иммунологические может быть подвержены перекрестной реактивности и / или помех, несовместимые с клетки / ткани методами лизиса / гомогенизации, и / или не поддаются мультиплексированию 5,8. Например, наиболее полный тест для кросс-реактивности для выполнения иммуноферментного анализа с использованием образцов, которые возникли из генных нокаутов, которые могут быть сложным, чтобы подготовиться.
Этот протокол описывает целевую PeptВыбор язь, развитие LC-SRM анализ, качественный и количественный LC-SRM, и анализ данных LC-SRM. Он был использован для измерения абсолютного изобилия 36 хемотаксиса пути белков в RAW 264.7 клеток 56, но его применимость простирается далеко за пределы этого конкретного применения. Хотя он был разработан, чтобы количественно белков в клеточных гранул, он может быть отрегулирован для анализа других биологических образцов (например, biofluids) и других целей SRM (например, фосфопептиды). Например, изменение протокола гомогенизации и / или белок пищеварение может значительно улучшить растворимость, денатурации, алкилирования, пищеварение, и количественно особо сложных белков-мишеней (например, мембранные белки), или, возможно, позволит анализ особо сложных образцов (например, образцы содержащий <100 мкг масса белка).
Первоначальный отбор целевых пептидов является критическим, но может занять много времени. Для hundreDS целевых белков, специальная оценка может быть использована для каждого критерия, а предварительные целевые пептиды могут быть ранжированы по сумме баллов, как это было сделано ранее 56. Кроме того, этот анализ может быть автоматизирован с помощью PeptidePicker, веб-интерфейс, который значительно упрощает выбор 30 целевой пептид (http://mrmpeptidepicker.proteincentre.com/).
После целевые пептиды были отобраны и LC-SRM анализы были разработаны, важно, что качественные LC-SRM анализы биологических образцов быть выполнена, поскольку даже очень proteotypic и quantotypic пептид не будет обнаружено, если белок экспрессируется в Уровни ниже порога чувствительности прибора, или если фон помех особенно проблематичным. Второй аспект разделения (например, сильной катионообменной ВЭЖХ, высокого рН обращенно-фазовой ВЭЖХ и гель-электрофорез) может увеличить глубину Протеомические, но потребуетзначительно больше времени инструмент и анализа данных. Кроме того, стратегия обогащения (например, пептидные и белка на уровне immunoenrichment и сотовый фракционирования) может улучшить Протеомические глубину и immunodepletion высоко обильных белков можно использовать для уменьшения помех от coeluting аналитов.
LC-SRM из ~ десятки образцов для ~ ~ сотни или тысячи переходов, как правило, требуется обширное время инструмент. Хотя она не была использована в данном исследовании, планировании LC-SRM (измерение переходы во заранее определенные временные окна элюирования) позволяет анализ более переходов в перспективе. Кроме того, планирование уменьшает скважность SRM в течение относительно свободных периодов LC градиента, и это может привести к улучшению идентификации и количественного пептида. Тем не менее, планирование требует, чтобы пептид Время элюции с уверенностью определено из качественного анализа LC-SRM. Тонкие изменения к подготовке проб, инструмент ЖХ-МС,или метод ЖХ-МС может вызвать планирование обрезать или даже полностью пропустить целевых пептидов. Например, биологические профили элюции образца YDEAASYIQSK были слегка смещены относительно тех внешнего стандарта пептида (4В), возможно из-за матричных эффектов.
В целом, протокол шаг за шагом представлена для разработки и применения LC-SRM для абсолютного количественного белка. Абсолютное определение количества белков по LC-SRM уже было продемонстрировано, что воспроизводимая между лабораториями 16,19. Протеомики технологии, включая подготовку образца (например, автоматизация), жидкостной хроматографии, масс-спектрометрии и анализа данных, быстро улучшается, и позволяет LC-SRM стать практичным для масштабного исследования и клинического применения. Точность, чувствительность, точность, воспроизводимость и высокая пропускная способность количественного LC-SRM позволяет мощный инструмент для проведения фундаментальных исследований и биомедицины.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This research was supported by the Intramural Research Program of the NIH, National Institute of Allergy and Infectious Diseases.
Материалы
| Name | Company | Catalog Number | Comments |
| Acetonitrile (ACN), LC-MS grade | Fisher | A955-1 | |
| BCA (bicinchoninic acid) protein assay kit | Fisher | 23235 | |
| Beads for bead beating, zirconia-silica, 0.1 mm | BioSpec Products | 11079101z | |
| Bestatin hydrochloride | Sigma | B8385-10MG | |
| Cell culture DMEM (with glucose, without L-glutamine) | Lonza | 12-614F | |
| Cell culture EDTA, 500 mM, pH8 | Gibco | 15575 | |
| Cell culture fetal bovine serum (FBS) | Atlanta Biologicals | S11550 | |
| Cell culture L-glutamine | Sigma | G8540-25G | |
| Cell culture phosphate buffered saline (PBS) pH 7.4 | Gibco | 10010-049 | |
| Cell culture Trypan Blue viability stain, 0.4% w/v | Lonza | 17-942E | |
| Cellometer Auto T4 cell counter | Nexcelom Bioscience | Cellometer Auto T4 | |
| Cellometer Auto T4 disposable counting chambers | Nexcelom Bioscience | CHT4-SD100-014 | |
| Dithiothreitol (DTT) | Sigma | D5545-5G | |
| Formic acid, LC-MS grade, ampules | Fisher | A117-10X1AMP | |
| Hemocytometer, Neubauer-improved, 0.1 mm deep | Marienfeld-Superior | 0640030 | |
| HEPES, 1 M, pH 7.2 | Mediatech | 25-060-CI | |
| Hydrochloric acid, 37% w/w | VWR | BDH3028-2.5LG | |
| Iodoacetamide | Sigma | I1149-5G | |
| Laser Based Micropipette Puller | Sutter Instrument Co. | P-2000 | |
| LC coated silica capillary, 50 µm id | Polymicro Technologies | 1068150017 | |
| LC vial, autosampler, 12 mm x 32 mm polypropylene | SUN SRI | 200-268 | |
| LC vial screw cap, autosampler, pre-slit PTFE/silicone | SUN SRI | 500-061 | |
| Luciferase, from Photinus pyralis | Sigma | L9506-1MG | |
| Pepstatin A | EMD Millipore | 516481-25MG | |
| pH strips colorpHast (pH 0.0-6.0) | EMD Chemicals | 9586-1 | |
| PhosStop phosphatase inhibitor cocktail | Roche | 04906837001 | |
| RapiGest SF | Waters | 186001861 | |
| Sep-Pak SPE, C18 1 ml 100 mg cartridge | Waters | WAT023590 | |
| Sep-Pak SPE, extraction manifold, 20 position | Waters | WAT200609 | |
| Sep-Pak SPE, flat-surfaced rubber bulb | Fisher | 03-448-25 | |
| Sodium hydroxide (NaOH) | Fisher | S318-500 | |
| SpeedVac vacuum concentrator | Fisher | SPD111V | |
| Trifluoroacetic acid (TFA), LC-MS grade | Fisher | A116-50 | |
| Trypsin, sequencing grade, modified | Promega | V5113 | |
| Tube decapper for Micronic tubes | USA Scientific | 1765-4000 | |
| Tubes, 2 ml microcentrifuge, o-ring screw-cap, sterile | Sarstedt | 72.694.006 | |
| Urea | Sigma | U0631-500g | |
| Water, LC-MS grade | Fisher | W6-1 |
Ссылки
- Cox, J., Mann, M. Quantitative high-resolution proteomics for data-driven systems biology. Annu Rev Biochem. 80, 273-299 (2011).
- Zhang, Y., Fonslow, B. R., Shan, B., Baek, M. C., Yates, J. R. Protein analysis by shotgun/bottom-up proteomics. Chem Rev. 113, 2343-2394 (2013).
- Boja, E. S., Rodriguez, H. Mass spectrometry-based targeted quantitative proteomics: achieving sensitive and reproducible detection of proteins. Proteomics. 12, 1093-1110 (2012).
- Gillette, M. A., Carr, S. A. Quantitative analysis of peptides and proteins in biomedicine by targeted mass spectrometry. Nat Methods. 10, 28-34 (2013).
- Picotti, P., Aebersold, R. Selected reaction monitoring-based proteomics: workflows, potential, pitfalls and future directions. Nat Methods. 9, 555-566 (2012).
- Lesur, A., Domon, B. Advances in high-resolution accurate mass spectrometry application to targeted proteomics. Proteomics. , (2015).
- Wild, D. . The immunoassay handbook : theory and applications of ligand binding ELISA., and related techniques. , (2013).
- Sturgeon, C. M., Viljoen, A. Analytical error and interference in immunoassay: minimizing risk. Ann Clin Biochem. 48, 418-432 (2011).
- Adrait, A., et al. Development of a Protein Standard Absolute Quantification (PSAQ) assay for the quantification of Staphylococcus aureus enterotoxin A in serum. J Proteomics. 75, 3041-3049 (2012).
- Lin, D., Alborn, W. E., Slebos, R. J., Liebler, D. C. Comparison of protein immunoprecipitation-multiple reaction monitoring with ELISA for assay of biomarker candidates in plasma. J Proteome Res. 12, 5996-6003 (2013).
- Weiss, F., et al. Catch and measure-mass spectrometry-based immunoassays in biomarker research. Biochim Biophys Acta. 1844, 927-932 (2014).
- Yassine, H., et al. Mass spectrometric immunoassay and MRM as targeted MS-based quantitative approaches in biomarker development: potential applications to cardiovascular disease and diabetes. Proteomics Clin Appl. 7, 528-540 (2013).
- Zhao, L., et al. Quantification of proteins using peptide immunoaffinity enrichment coupled with mass spectrometry. J Vis Exp. , (2011).
- Becker, J. O., Hoofnagle, A. N. Replacing immunoassays with tryptic digestion-peptide immunoaffinity enrichment and LC-MS/MS. 4, 281-290 (2012).
- Wasinger, V. C., Zeng, M., Yau, Y. Current status and advances in quantitative proteomic mass spectrometry. Int J Proteomics. 2013, 180605 (2013).
- Abbatiello, S. E., et al. Large-scale inter-laboratory study to develop, analytically validate and apply highly multiplexed, quantitative peptide assays to measure cancer-relevant proteins in plasma. Mol Cell Proteomics. , (2015).
- Rodriguez-Suarez, E., Whetton, A. D. The application of quantification techniques in proteomics for biomedical research. Mass Spectrom Rev. 32, 1-26 (2013).
- Wehr, A. Y., Hwang, W. T., Blair, I. A., Yu, K. H. Relative quantification of serum proteins from pancreatic ductal adenocarcinoma patients by stable isotope dilution liquid chromatography-mass spectrometry. J Proteome Res. 11, 1749-1758 (2012).
- Kennedy, J. J., et al. Demonstrating the feasibility of large-scale development of standardized assays to quantify human proteins. Nat Methods. 11, 149-155 (2014).
- Jensen, K. J., Shelton, P. T., Pedersen, S. L. . Peptide synthesis and applications. , (2013).
- Pratt, J. M., et al. Multiplexed absolute quantification for proteomics using concatenated signature peptides encoded by QconCAT genes. Nat Protoc. 1, 1029-1043 (2006).
- Brun, V., et al. Isotope-labeled protein standards: toward absolute quantitative proteomics. Mol Cell Proteomics. 6, 2139-2149 (2007).
- . . Guidance for Industry: Bioanalytical Method Validation. , (2001).
- . . Guidance for Industry: Bioanalytical Method Validation. , (2013).
- Carr, S. A., et al. Targeted peptide measurements in biology and medicine: best practices for mass spectrometry-based assay development using a fit-for-purpose approach. Mol Cell Proteomics. 13, 907-917 (2014).
- Ori, A., Andres-Pons, A., Beck, M. The use of targeted proteomics to determine the stoichiometry of large macromolecular assemblies. Methods Cell Biol. 122, 117-146 (2014).
- Rosen, O., Feldberg, L., Gura, S., Zichel, R. A new peptide substrate for enhanced botulinum neurotoxin type B detection by endopeptidase-liquid chromatography-tandem mass spectrometry/multiple reaction monitoring assay. Anal Biochem. , (2015).
- Feng, Y., et al. Global analysis of protein structural changes in complex proteomes. Nat Biotechnol. 32, 1036-1044 (2014).
- MacLean, B., et al. Skyline: an open source document editor for creating and analyzing targeted proteomics experiments. Bioinformatics. 26, 966-968 (2010).
- Mohammed, Y., et al. PeptidePicker: a scientific workflow with web interface for selecting appropriate peptides for targeted proteomics experiments. J Proteomics. 106, 151-161 (2014).
- Rodriguez, J., Gupta, N., Smith, R. D., Pevzner, P. A. Does trypsin cut before proline. J Proteome Res. 7, 300-305 (2008).
- Min, X. J., Butler, G., Storms, R., Tsang, A. OrfPredictor: predicting protein-coding regions in EST-derived sequences. Nucleic Acids Res. 33, W677-W680 (2005).
- Lam, H., et al. Building consensus spectral libraries for peptide identification in proteomics. Nat Methods. 5, 873-875 (2008).
- Craig, R., Cortens, J. P., Beavis, R. C. Open source system for analyzing, validating, and storing protein identification data. J Proteome Res. 3, 1234-1242 (2004).
- Desiere, F., et al. The PeptideAtlas project. Nucleic Acids Res. 34, D655-D658 (2006).
- Vizcaino, J. A., et al. The PRoteomics IDEntifications (PRIDE) database and associated tools: status in 2013. Nucleic Acids Res. 41, D1063-D1069 (2013).
- Frank, R. The SPOT-synthesis technique. Synthetic peptide arrays on membrane supports--principles and applications. J Immunol Methods. 267, 13-26 (2002).
- Ong, S. E., Kratchmarova, I., Mann, M. Properties of 13C-substituted arginine in stable isotope labeling by amino acids in cell culture (SILAC). J Proteome Res. 2, 173-181 (2003).
- Mant, C. T., et al. HPLC analysis and purification of peptides. Methods Mol Biol. 386, 3-55 (2007).
- Alterman, M. A., Hunziker, P. . Amino acid analysis : methods and protocols. , (2012).
- Maclean, B., et al. Effect of collision energy optimization on the measurement of peptides by selected reaction monitoring (SRM) mass spectrometry. Anal Chem. 82, 10116-10124 (2010).
- Nesvizhskii, A. I. A survey of computational methods and error rate estimation procedures for peptide and protein identification in shotgun proteomics. J Proteomics. 73, 2092-2123 (2010).
- Tabb, D. L., Friedman, D. B., Ham, A. J. Verification of automated peptide identifications from proteomic tandem mass spectra. Nat Protoc. 1, 2213-2222 (2006).
- Freshney, R. I. . Culture of animal cells : a manual of basic technique and specialized applications. , (2010).
- Oberg, A. L., Vitek, O. Statistical design of quantitative mass spectrometry-based proteomic experiments. J Proteome Res. 8, 2144-2156 (2009).
- Noble, J. E., Bailey, M. J. Quantitation of protein. Methods Enzymol. 463, 73-95 (2009).
- Kiser, J. Z., Post, M., Wang, B., Miyagi, M. Streptomyces erythraeus trypsin for proteomics applications. J Proteome Res. 8, 1810-1817 (2009).
- Reiter, L., et al. mProphet: automated data processing and statistical validation for large-scale SRM experiments. Nat Methods. 8, 430-435 (2011).
- Abbatiello, S. E., Mani, D. R., Keshishian, H., Carr, S. A. Automated detection of inaccurate and imprecise transitions in peptide quantification by multiple reaction monitoring mass spectrometry. Clin Chem. 56, 291-305 (2010).
- Callister, S. J., et al. Normalization approaches for removing systematic biases associated with mass spectrometry and label-free proteomics. J Proteome Res. 5, 277-286 (2006).
- Karpievitch, Y. V., Dabney, A. R., Smith, R. D. Normalization and missing value imputation for label-free LC-MS analysis. BMC Bioinformatics. 13, S5 (2012).
- Oh, S., Kang, D. D., Brock, G. N., Tseng, G. C. Biological impact of missing-value imputation on downstream analyses of gene expression profiles. Bioinformatics. 27, 78-86 (2011).
- Germain, R. N., Meier-Schellersheim, M., Nita-Lazar, A., Fraser, I. D. Systems biology in immunology: a computational modeling perspective. Annu Rev Immunol. 29, 527-585 (2011).
- Futran, A. S., Link, A. J., Seger, R., Shvartsman, S. Y. ERK as a model for systems biology of enzyme kinetics in cells. Curr Biol. 23, R972-R979 (2013).
- Krokhin, O. V. Sequence-specific retention calculator. Algorithm for peptide retention prediction in ion-pair RP-HPLC: application to 300- and 100-A pore size C18 sorbents. Anal Chem. 78, 7785-7795 (2006).
- Manes, N. P., Angermann, B. R., Koppenol-Raab, M., An, E., Sjoelund, V. H., Sun, J., Ishii, M., Germain, R. N., Meier-Schellersheim, M., Nita-Lazar, A. Targeted Proteomics-Driven Computational Modeling of Macrophage S1P Chemosensing. . Mol Cell Proteomics. , .
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены