Method Article
Трехмерный локационный подход с помощью лапароскопической сегментэктомии под контролем шелковой нити при опухоли печени
В этой статье
Резюме
Использование 3D-реконструкции и виртуального моделирования в предоперационном планировании резекции печени представляет собой значительный прогресс в хирургической онкологии. Метод 3D-LAST (трехмерный подход к местоположению с шелковой нитью) нашей команды обеспечивает безопасное, эффективное и точное удаление опухоли с практической интраоперационной навигацией, что обещает широкое медицинское внедрение.
Аннотация
При проведении гепатэктомии для лечения опухолей печени первостепенное значение имеет точное определение края резекции и обеспечение адекватности остаточной паренхимы печени. В настоящее время часто используются методы интраоперационного ультразвука и индоцианиновой зеленой флуоресцентной навигации. Однако определенные технические ограничения препятствуют их широкому применению. Мы разработали методику 3D-LAST для точной резекции опухоли печени. Этот метод использует компьютерную постобработку для извлечения особенностей из снимков компьютерной томографии (КТ) и создания объемных изображений, создавая трехмерные (3D) визуализации. Это является ценным ресурсом для принятия клинических решений, поскольку позволяет наглядно отображать сложные внутренние анатомические структуры в интуитивно понятной и стереоскопической манере. В данном исследовании было проведено предоперационное 3D-позиционирование пациентов с одной опухолью печени для выявления анатомических ориентиров и расчета диапазона резекции. Во время хирургической процедуры были установлены краевые линии длины, рассчитанные с помощью предоперационного 3D-программного обеспечения, а для обозначения краев использовалась шелковая нить. Такой подход обеспечивает экономящий время и точный способ определения оптимальной плоскости реза. Целью данной статьи является демонстрация целесообразности применения 3D-LAST в лапароскопической сегментэктомии при опухолях печени. Результаты исследования свидетельствуют о том, что 3D-LAST является безопасным, эффективным и практичным новым методом интраоперационной навигации печени и имеет большой потенциал для широкомасштабного продвижения.
Введение
Гепатэктомия остается краеугольным камнем лечения опухолей печени. За последние десятилетия хирургические подходы эволюционировали от нерегулярных резекций к точным анатомическим резекциям, что обусловлено достижениями в области вспомогательных технологий, таких как интраоперационное ультразвуковое исследование (ИОИ) и флуоресцентная визуализация индоцианинового зеленого (ICG) 1,2. Несмотря на эти инновации, достижение оптимальных границ резекции при сохранении достаточного функционального объема печени остается критической задачей. Общая цель предложенного нами метода 3D-LAST (трехмерный подход к определению местоположения с шелковой нитью) заключается в том, чтобы обеспечить точный, экономически эффективный и общедоступный метод интраоперационной навигации для резекции опухоли печени, сводя к минимуму зависимость от специализированного оборудования при одновременном повышении пространственной точности.
Обоснование для разработки 3D-LAST вытекает из ограничений существующих технологий. ИОО, хотя и ценна для локализации опухоли в реальном времени, требует квалифицированных сонографистов для интерпретации изображений и испытывает трудности с двумерной (2D) пространственной визуализацией, часто продлевая операционное время 3,4. Флуоресцентная навигация ICG, хотя и эффективна для поверхностных опухолей, ограничена ограниченной глубиной проникновения в ткани (5-10 мм), что делает ее ненадежной при более глубоких поражениях 5,6. Оба метода зависят от дорогостоящего специализированного оборудования, что ограничивает их применение в условиях ограниченных ресурсов.
Преимущества 3D-LAST перед существующими методиками многогранны. Трехмерная визуализация, полученная на основе предоперационной компьютерной томографии (КТ), преодолевает пространственную неоднозначность 2D-визуализации, обеспечивая стереоскопическое анатомическое руководство. В отличие от ICG, которому не хватает разрешения по глубине, 3D-LAST позволяет точно планировать объемную резекцию, снижая риск положительных краев или чрезмерной потери паренхимы. Кроме того, использование шелковой нити для интраоперационной маркировки устраняет необходимость в устройствах визуализации в режиме реального времени, оптимизируя рабочий процесс и снижая затраты.
3D-LAST особенно подходит для центров, в которых отсутствует передовая инфраструктура визуализации или опыт работы со сложной интраоперационной навигацией. Он идеально подходит для резекции одной опухоли, когда анатомические ориентиры могут быть определены на предоперационной КТ и где приоритет отдается минимизации сложности процедуры. Устраняя ограничения существующих методов и используя проверенные 3D-технологии, 3D-LAST представляет собой прагматичный шаг вперед в достижении прецизионной хирургии печени с широкой клинической адаптацией.
Описание клинического случая:
У 59-летнего мужчины с дискомфортом в верхней части живота была диагностирована опухоль печени размером 2,7 см х 1,6 см в правой печени. Ранее у пациента была диагностирована аденокарцинома желудка и проведена радикальная гастрэктомия по поводу рака желудка с последующей плановой химиотерапией. На предоперационной компьютерной томографии с контрастированием не было обнаружено внепеченочных метастазов. CA19-9, CA15-3, CA72-4, AFP и CEA были в норме.
протокол
Исследование было одобрено обзорной комиссией Западно-Китайской больницы Сычуаньского университета. Перед операцией было получено информированное согласие пациента.
1. Предоперационная подготовка
- Получите компьютерную томографию печени пациента с высоким разрешением в формате DICOM (рис. 1A).
- Запустите программное обеспечение Mimics, создайте новый проект и импортируйте файлы DICOM, чтобы убедиться, что все данные изображения правильно загружены для 3D-реконструкции и анализа.
- Реконструируйте трехмерную структуру печени, сосудов и опухоли. Отметьте печень розовым цветом, воротную вену — синим, артерию — красным, печеночную вену и нижнюю полую вену — синим, а опухоль — желтым (рисунок 1B).
- Поместите три маленькие виртуальные палочки на 3D-модель печени и получите четыре ключевые точки (S1, S2, S3, S4) на поверхности печени (рис. 2A-B).
- Эти виртуальные палочки действуют как цифровые ориентиры, направляя хирурга в определении точного местоположения и ориентации предполагаемого разреза. Поместите виртуальную палочку для маркировки точки резекции на расстоянии 1 см от края опухоли и средней точки края печени на дне желчного пузыря.
ПРИМЕЧАНИЕ: Отмечая эти ключевые точки, хирурги могут гарантировать, что они останутся сфокусированными на целевой области во время операции, сводя к минимуму риск ненужного повреждения тканей.
- Эти виртуальные палочки действуют как цифровые ориентиры, направляя хирурга в определении точного местоположения и ориентации предполагаемого разреза. Поместите виртуальную палочку для маркировки точки резекции на расстоянии 1 см от края опухоли и средней точки края печени на дне желчного пузыря.
- Соедините четыре ключевые точки линиями на поверхности печени и измерьте их длину (S1-S2 = 9,8 см, S1-S3 = 7,2 см, S2-S3 = 10,4 см, S4-S2 = 8,2 см, S4-S3 = 6,5 см), как показано на рисунке 2C-D. Эти линии представляют собой предполагаемый путь резекции, направляя хирурга при визуализации формы и контура печени после резекции.
- Тщательно измерьте длину каждой линии, чтобы обеспечить точность и согласованность. Это измерение имеет решающее значение, поскольку оно позволяет хирургам подготовить шелковые нити точно такой же длины, которые будут использоваться во время операции для направления разреза печени.
2. Оперативная процедура
- Расположите пациента на спине, расставив ноги и наклонив их вправо (рисунок 3А). Проводить стандартную общую анестезию, включая интубацию трахеи и контролируемую вентиляцию легких.
- Продезинфицируйте кожу 0,5% йодным скрабом 3 раза в области межсоскового соединения, лобкового симфиза, правой средней подмышечной и левой среднеключичной линий.
- Организуйте хирургическую бригаду так, чтобы хирург находился справа, а ассистент — слева. Расположите камеру по центру между местами расположения троакара, держатель камеры также должен стоять посередине.
- Сделайте разрез 12 мм ниже пупка в качестве лапароскопического отверстия (H1), один разрез 12 мм и один изогнутый разрез 5 мм (H2 и H3) в качестве основных операционных отверстий, еще один 12 мм и один 5 мм (H4 и H5) в качестве вспомогательных операционных отверстий (рис. 3B).
- Вставьте пять троакаров (12 мм, 12 мм, 12 мм, 5 мм и 5 мм) в разрезы, как показано на рисунке 3B. Включите систему пневмоперитонеума и впрыскивайте через троакар 100% углекислый газ для поддержания давления в пневмоперитонеуме около 12 мм рт.ст.
- Проведите обзорное обследование брюшной полости, начиная с левого эпигастрия и двигаясь вправо вниз к гипогастрию, чтобы обнаружить наличие асцита, цирроза печени и метастазов.
- Освободите брюшные спайки, отделите круглую связку печени, освободите правую печеночную связку и спайки, а также полностью обнажите V сегмент печени с помощью ультразвукового ножа.
- С помощью ультразвукового ножа рассеките треугольник желчного пузыря, обнажая проток желчного пузыря и артерию. Затем перевязайте эти структуры небольшими зажимами с гемозамком перед иссечением желчного пузыря.
- Подготовьте три шелковые нити длиной S1-S2 = 9,8 см, S1-S3 = 7,2 см и S2-S3 = 10,4 см соответственно. Точка S4 расположена в горлышке желчного пузыря, поэтому не подготавливайте шелковые нити для S4-S2 = 8,2 см и S4-S3 = 6,5 см.
- Поместите три шелковые нити в анатомическое положение на поверхности печени, соответствующее предоперационно запланированному пути резекции, как показано на рисунке 4. Используя шелковые нити в качестве физического ориентира, хирурги могут визуализировать и следовать запланированному пути резекции с большей точностью во время операции.
ПРИМЕЧАНИЕ: Этот шаг устраняет разрыв между виртуальным планированием и реальной хирургической процедурой. - С помощью электрического ножа прижгите печень, вырезав маркеры вдоль шелковой нити на поверхности печени (рисунок 4D) и пришейте на печень резинку для вытяжения (рисунок 5A).
- С помощью ультразвукового ножа пересеките паренхиму печени по маркерным линиям. Разрежьте сосуды, которые встречаются при обрезке home-o-lock, используйте аспиратор для отсасывания крови и используйте биполярные щипцы для остановки кровотечения (рисунок 5B).
- Поместите образец в пакет и сделайте 4-сантиметровый разрез скальпелем в верхней части живота, чтобы удалить образец. Подтвердить отсутствие активного кровотечения в брюшной полости, поместить гемостатические материалы на поверхность пересечения печени и одну дренажную трубку, выходящую из правой нижней части живота.
- Снимите разрезы троакара и швов по 3-0 рассасывающихся швов слой за слоем. Исследуйте образец, чтобы убедиться в целостности опухолевой капсулы и измерить размер опухоли (рисунок 5C-D).
3. Лечение после гепатэктомии
- После успешного восстановления после анестезии переведите пациента в палату и наблюдайте за жизненно важными показателями пациента с помощью непрерывного мониторинга сердца в течение начального 24-часового периода восстановления после операции.
- Проводить профилактическую антимикробную терапию путем внутривенной инфузии в течение1-х суток после операции для снижения возможных септических осложнений.
- Удалите катетеризацию мочевого пузыря через 24 часа после процедуры. Проведите обычную компьютерную томографию через 72 ч после операции (Рисунок 6). Вакуумируйте хирургические дренажи через 4 дня после операции без массивного асцита и подтекания желчи.
Результаты
Общее время операции составило 150 мин, при этом 50 мл кровопотери не потребовали переливания крови. Объем интраоперационной мочи составил 500 мл, а объем интраоперационной инфузии – 800 мл. На1-е сутки после операции результаты анализа крови показали незначительное повышение уровня трансаминаз. Компьютерная томография брюшной полости показала полную резекцию опухоли печени и отсутствие значительного асцита через 3 дня после операции. Дренаж был удален на 4 день после операции. Пациентка протекала без осложнений после операции и была выписана на5-е сутки после операции. Послеоперационный общий патологический образец показал, что размер опухоли составил 1,5 см х 1,5 см, что подтверждает резекцию R0, как показано в таблице 1.
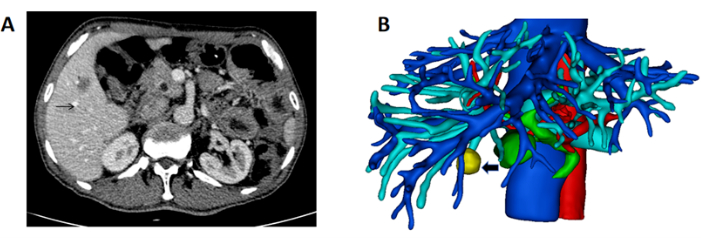
Рисунок 1: КТ, показывающая новообразование, и 3D-реконструкция печени и образования. (A) Компьютерная томография, показывающая опухоль, расположенную в правой печени (черная стрелка указывает на массу). (B) 3D-реконструкция печени, сосудов и массы (черная стрелка указывает на массу). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Отметьте линию резекции на 3D-модели. (A-D) Реконструируйте структуру внутрипеченочного протока и опухоль в 3D и отметьте ключевые точки (S1, S2, S3, S4) режущей кромки с помощью небольшой палочки. Нарисуйте линии печени по ключевым точкам на поверхности виртуальной модели печени и измерьте длину каждой линии (S1-S2 = 9,8 см, S1-S3 = 7,2 см, S2-S3 = 10,4 см, S4-S2 = 8,2 см, S4-S3 = 6,5 см). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Интраоперационная схема размещения хирурга, пациента и троакара. (А) Оперирующий хирург находится справа, ассистент слева, а оператор находится между ног. (B) Процедура лапароскопической гепатэктомии выполняется с использованием пятипортовой техники. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Во время операции на печени используйте шелковую нить для обозначения режущего края, подготавливайте шелковые нити одинаковой длины и размещайте их в анатомическом положении на поверхности печени. Форма, заключенная в шелковую нить, является линией разреза печени. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Резекция печени и образец. (А) Пришейте резиновую ленту на печень для вытяжения. (Б) Обнажите среднюю печеночную вену в плоскости резекции печени (черная стрелка указывает на среднюю печеночную вену). (К-Д) Полная резекция массы печени (черная стрелка), поперечное сечение, показывающее, что опухолевый край не поврежден и соответствует предоперационно запланированному краю. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Послеоперационная компьютерная томография. Компьютерная томография показала успешное удаление опухоли без накопления околопеченочной жидкости на 3-е сутки после операции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Параметры | Результаты |
| Длительность операции | 150 мин |
| Кровопотеря | 50 мл |
| Послеоперационная функция печени | ALT 222 IU/L, AST 217 IU/L |
| Послеоперационное КТ повторное обследование | КАПСУЛА 3 |
| Движение дренажной трубки | КАПСУЛА 4 |
| День выписки | КАПСУЛА 5 |
| Размер опухоли | 1,5 см х 1,5 см |
| Патологический тип | Аденокарцинома |
Таблица 1: Результаты хирургического вмешательства пациента. Сокращения: АЛТ = аланинаминотрансфераза; AST = Аспартатаминотрансфераза; POD = Послеоперационный день.
Обсуждение
С развитием технологий и накоплением опыта лапароскопическая резекция печени становится все более распространенной, а ее показания почти столь же обширны, как и при открытой хирургии. По сравнению с лапаротомией, лапароскопическая резекция печени имеет много преимуществ, таких как меньшая боль, меньшее количество периоперационных осложнений и более быстрое восстановление 7,8,9. Тем не менее, лапароскопическая резекция печени также сталкивается с некоторыми трудностями. Отсутствие тактильного восприятия и восприятия глубины, ограниченное рабочее пространство и ограниченное поле зрения создают проблемы для его широкого использования 10,11,12. Для решения этих проблем в последние годы в качестве инструментов навигации в реальном времени используются флуоресцентные изображения IOUS и ICG. ИООС при нанесении непосредственно на поверхность печени может повысить точность обнаружения и локализации поражения13,14.
Однако, поскольку его обычно оперируют сонографисты, хирургам часто приходится делать паузу в операции, чтобы дождаться их, что не только продлевает время операции, но и увеличивает зависимость от ультразвуковых технологий. Кроме того, при циррозе печени ИУС может ошибочно интерпретировать регенеративные узлы как опухоли, что приводит к гипердиагностике 15,16,17. ICG, безвредный водорастворимый флуоресцентный агент ближнего инфракрасного диапазона, может помочь визуализировать анатомические структуры во время операции с помощью специальных эндоскопов. Его высокая чувствительность и четкий контраст делают его популярным инструментом для хирургической навигации при различных операциях на печени. Однако из-за ограниченного проникновения ближнего инфракрасного света в ткани (до 10 мм) его применение в выявлении глубоко расположенных поражений печени ограничено. Более того, чрезмерная доза ICG может привести к ложноположительным результатам, а успех окрашивания опухоли связан с такими факторами, как кровоснабжение, цирроз печени и некроз 18,19,20. Таким образом, разработка инновационного, эффективного и точного метода локализации глубоко расположенных опухолей печени имеет большое клиническое значение.
В данном исследовании предоперационное 3D-позиционирование использовалось для определения анатомических ориентиров и расчета площади резекции у пациентов с одиночными опухолями печени. Во время операции были организованы линии краев длины, рассчитанные с помощью предоперационного 3D-программного обеспечения, а для обозначения краев использовалась шелковая нить. Этот метод обеспечивает эффективный и точный способ навигации по оптимальной плоскости реза21. Время операции в нашем исследовании было значительно короче, чем в исследованиях с использованием ИУС и гепатэктомии под контролем ICG. Такой подход снижает зависимость от ИООС, экономя хирургическое время и снижая технические и условные требования. Его можно применять в различных ситуациях навигации по опухоли печени, независимо от размера и глубины опухоли.
Несмотря на свои преимущества, такой подход имеет свои ограничения. Во-первых, его точность зависит от качества предоперационной визуализации; Артефакты движения или сканы с низким разрешением могут поставить под угрозу точность 3D-модели. Во-вторых, этот метод предполагает статическую анатомию печени, в то время как дыхательные движения или хирургические манипуляции могут изменить положение опухоли, что требует корректировки в режиме реального времени. В-третьих, кривая обучения работе с 3D-программным обеспечением и интраоперационной пространственной трансляцией может ограничить внедрение в хирургии без специализированной подготовки. Кроме того, размер выборки этого исследования относительно невелик, и для дальнейшей проверки эффективности этого метода необходимы будущие крупномасштабные проспективные исследования. Разработка простой и широко применимой программы 3D-реконструкции также является важной целью для будущих исследований.
Раскрытие информации
Авторы не сообщают о конфликте интересов.
Благодарности
Эта работа была поддержана проектом Научно-технического фонда Комиссии по здравоохранению провинции Гуйчжоу (gzwkj2025-300), проектом Департамента науки и технологий провинции Гуйчжоу (Qian Ke He Cheng Guo, LC[2024]109).
Материалы
| Name | Company | Catalog Number | Comments |
| BiClamp LAP | ERBE Company | No.20195-132 | |
| Laparoscopic system | Olympus | VISERA OTV-S400 | |
| Ultrasonic knife | Johnson and Johnson MedTech | ETHICON HARMONIC |
Ссылки
- Fan, S. T., et al. Continuous improvement of survival outcomes of resection of hepatocellular carcinoma: a 20-year experience. Ann Surg. 253 (5), 745-758 (2011).
- Torzilli, G., et al. "Radical but conservative" is the main goal for ultrasonography-guided liver resection: prospective validation of this approach. J Am Coll Surg. 201 (5), 517-528 (2005).
- Torzilli, G., et al. Contrast-enhanced intraoperative ultrasonography during surgery for hepatocellular carcinoma in liver cirrhosis: is it useful or useless? A prospective cohort study of our experience. Ann Surg Oncol. 14 (4), 1347-1355 (2007).
- Leen, E., et al. Potential value of contrast-enhanced intraoperative ultrasonography during partial hepatectomy for metastases: an essential investigation before resection. Ann Surg. 243 (2), 236-240 (2006).
- Ishizawa, T., et al. Real-time identification of liver cancers by using indocyanine green fluorescent imaging. Cancer. 115 (12), 2491-2504 (2009).
- Gotoh, K., et al. A novel image-guided surgery of hepatocellular carcinoma by indocyanine green fluorescence imaging navigation. J Surg Oncol. 100 (7), 75-79 (2009).
- Nguyen, K. T., Gamblin, T. C., Geller, D. A. World review of laparoscopic liver resection-2,804 patients. Ann Surg. 250 (5), 831-841 (2009).
- Abu Hilal, M., et al. The Southampton Consensus Guidelines for laparoscopic liver surgery: from indication to implementation. Ann Surg. 268 (1), 11-18 (2018).
- Ciria, R., Cherqui, D., Geller, D. A., Briceno, J., Wakabayashi, G. Comparative short-term benefits of laparoscopic liver resection: 9000 cases and climbing. Ann Surg. 263 (4), 761-777 (2016).
- Schneider, C., et al. Comparison of manual and semi-automatic registration in augmented reality image-guided liver surgery: a clinical feasibility study. Surg Endosc. 34 (10), 4702-4711 (2020).
- Lwin, T. Z., Sicklick, J. K., Hoffman, R. M., Bouvet, M. Fluorescence-guided laparoscopic hepatectomy. Ann Laparosc Endosc Surg. 1, 10(2016).
- Ziogas, I. A., Tsoulfas, G. Advances and challenges in laparoscopic surgery in the management of hepatocellular carcinoma. World J Gastrointest Surg. 9 (12), 233-245 (2017).
- Cai, X., et al. Does using indocyanine green fluorescence imaging for tumors help in determining the safe surgical margin in real-time navigation of laparoscopic hepatectomy? A retrospective study. Ann Surg Oncol. 30 (6), 1981-1987 (2023).
- Nishino, H., et al. Real-time navigation for liver surgery using projection mapping with indocyanine green fluorescence: development of the novel medical imaging projection system. Ann Surg. 267 (6), 1134-1140 (2018).
- Ishizawa, T., et al. Impact of intraoperative ultrasonography on surgical strategy and prognosis after hepatic resection for hepatocellular carcinoma. Ann Surg Oncol. 15 (13), 3665-3673 (2008).
- Solbiati, L., et al. Percutaneous sono-guided radio-frequency ablation of liver metastases: a multi-centre study. Eur Radiol. 11 (10), 1947-1954 (2001).
- Yang, T., et al. The role of intraoperative ultrasonography in laparoscopic liver resection for hepatocellular carcinoma: a propensity score-matched analysis. Surg Endosc. 34 (5), 2137-2144 (2020).
- van Manen, L., et al. A practical guide for the use of indocyanine green and methylene blue in fluorescence-guided abdominal surgery. J Surg Oncol. 118 (2), 283-300 (2018).
- Yoo, K. Y., et al. Intravenously administered indocyanine green may cause falsely high near-infrared cerebral oximetry readings. Anesthesiology. 120 (6), 1374-1379 (2014).
- Kimura, F., et al. Clinical impact of indocyanine green fluorescence imaging for liver tumor surgery: a single-center experience. Surgery. 161 (2), 475-481 (2017).
- Zhang, Z. H., Feng, Q. B., Jiang, C., Huang, J. W., Li, J. X. Three-dimensional location approach with silk thread guided hepatectomy for liver tumor. World J Gastroenterol. 31 (8), 10262(2025).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены