Method Article
丝线引导腹腔镜椎段切除术治疗肝肿瘤的三维定位方法
摘要
在肝切除术的术前计划中使用 3D 重建和虚拟模拟代表了外科肿瘤学的重大进步。我们团队的 3D-LAST(丝线三维定位方法)技术通过实用的术中导航实现安全、高效、精确的肿瘤切除,有望得到广泛的医疗应用。
摘要
在进行肝切除术治疗肝肿瘤时,准确确定切缘并确保残余肝实质的充分性至关重要。目前,术中超声和吲哚菁绿荧光导航是常用的方法。然而,某些技术限制阻碍了它们的广泛应用。我们开发了用于精确肝肿瘤切除的 3D-LAST 技术。该技术利用计算机后处理从计算机断层扫描 (CT) 扫描中提取特征并生成体积图像,从而创建三维 (3D) 可视化。这为临床决策提供了宝贵的资源,因为它可以直观和立体的方式生动地展示复杂的内部解剖结构。在本研究中,对单个肝肿瘤患者进行术前 3D 定位,以确定解剖标志并计算切除范围。在手术过程中,建立术前 3D 软件计算的长度边缘线,并使用丝线标记边缘。这种方法提供了一种省时且准确的方法来确定最佳切割平面。本文的目的是证明 3D-LAST 在腹腔镜肝段切除术中的应用可行性。研究结果表明,3D-LAST 是一种安全、有效、实用的术中肝脏导航新方法,具有巨大的大规模推广潜力。
引言
肝切除术仍然是肝肿瘤的基础治疗方法。近几十年来,在术中超声 (IOUS) 和吲哚菁绿 (ICG) 荧光成像等辅助技术的进步的推动下,手术方法已经从不规则切除发展为精确解剖切除 1,2。尽管有这些创新,但在保持足够功能性肝脏体积的同时实现最佳切除切缘仍然是一个关键挑战。我们提出的 3D-LAST(丝线三维定位方法)技术的总体目标是为肝肿瘤切除提供一种精确、经济高效且普遍可用的术中导航方法,最大限度地减少对专用设备的依赖,同时提高空间精度。
开发 3D-LAST 的基本原理源于当前技术的局限性。IOUS 虽然对实时肿瘤定位很有价值,但需要熟练的超声医师进行图像解释,并且难以进行二维 (2D) 空间可视化,通常会延长手术时间 3,4。ICG 荧光导航虽然对浅表肿瘤有效,但受到其有限的组织穿透深度 (5-10 mm) 的限制,使其对较深的病变不可靠 5,6。这两种方法都依赖于昂贵的专用硬件,这限制了它们在资源受限环境中的采用。
与现有技术相比,3D-LAST 的优势是多方面的。源自术前计算机断层扫描 (CT) 重建的三维可视化通过提供立体解剖学引导克服了 2D 成像的空间模糊性。与缺乏深度分辨率的 ICG 不同,3D-LAST 可实现精确的体积切除计划,降低切缘阳性或实质过度损失的风险。此外,使用丝线进行术中标记消除了对实时成像设备的需求,简化了工作流程并降低了成本。
3D-LAST 特别适用于缺乏先进成像基础设施或复杂术中导航专业知识的中心。它非常适合单肿瘤切除术,其中解剖标志可在术前 CT 上识别,并且优先考虑将手术复杂性降至最低。通过解决当前方法的局限性并利用经过验证的 3D 技术,3D-LAST 代表了实现精确肝脏手术的实用进步,具有广泛的临床适应性。
案例介绍:
一名 59 岁男性上腹部不适,诊断为右肝 2.7 cm x 1.6 cm 的肝肿瘤。患者既往被诊断患有胃腺癌,因胃癌接受了根治性胃切除术,随后接受了常规化疗。术前对比增强 CT 扫描未发现肝外转移,CA19-9 、 CA15-3 、 CA72-4 、 AFP 和 CEA 正常。
研究方案
该研究得到了四川大学华西医院评审委员会的批准。手术前获得患者的知情同意。
1. 术前准备
- 以 DICOM 格式获得患者肝脏的高分辨率 CT 扫描(图 1A)。
- 启动 Mimics 软件,创建一个新项目,并导入 DICOM 文件,以确保正确加载所有图像数据以进行 3D 重建和分析。
- 重建肝脏、血管和肿瘤的三维结构。用粉红色标记肝脏,用蓝色标记门静脉,用红色标记动脉,用蓝色标记肝静脉和下腔静脉,用黄色标记肿瘤(图 1B)。
- 在 3D 肝脏模型上放置三个小虚拟棒,并在肝脏表面获得四个关键点(S1、S2、S3、S4)(图 2A-B)。
- 这些虚拟棒充当数字地标,指导外科医生确定预期切口的精确位置和方向。将切除点的虚拟棒标记放置在距肿瘤边缘 1 cm 处,将肝脏边缘的中点放在胆囊底部。
注意:通过标记这些关键点,外科医生可以确保他们在手术过程中始终专注于目标区域,从而最大限度地降低不必要组织损伤的风险。
- 这些虚拟棒充当数字地标,指导外科医生确定预期切口的精确位置和方向。将切除点的虚拟棒标记放置在距肿瘤边缘 1 cm 处,将肝脏边缘的中点放在胆囊底部。
- 将四个关键点用肝脏表面的线条连接起来,测量它们的长度(S1-S2 = 9.8 cm,S1-S3 = 7.2 cm,S2-S3 = 10.4 cm,S4-S2 = 8.2 cm,S4-S3 = 6.5 cm),如图 2C-D 所示。这些线条代表建议的切除路径,指导外科医生在切除后可视化肝脏的形状和轮廓。
- 仔细测量每条线的长度,以确保准确性和一致性。这种测量至关重要,因为它允许外科医生准备完全相同长度的丝线,这些丝线将在术中用于引导肝脏切割。
2. 手术程序
- 将患者仰卧,双腿张开并向右倾斜(图 3A)。实施标准的全身麻醉,包括气管插管和受控通气。
- 用 0.5% 碘基磨砂膏对间连接、耻骨联合、右腋中部和左锁骨中线区域进行 3 次皮肤消毒。
- 安排手术团队,外科医生在右边,助手在左边。将摄像头放置在穿刺器部位的中央,摄像头支架也位于中间。
- 在脐部下方做一个 12 毫米的切口作为腹腔镜孔 (H1),一个 12 毫米和一个 5 毫米的弯曲切口(H2 和 H3)作为主要手术孔,另一个 12 毫米和一个 5 毫米(H4 和 H5)作为辅助手术孔(图 3B)。
- 如图 3B 所示,将五个套管针(12 mm、12 mm、12 mm、5 mm 和 5 mm)插入切口。打开气腹系统,通过套管针注入 100% 二氧化碳气体,以将气腹维持在约 12 mmHg 的压力。
- 对腹腔进行探查性检查,从左上腹部开始,向右向下移动至下腹部,以检测是否存在腹水、肝硬化和转移。
- 使用超声刀释放腹部粘连,分离肝脏的圆韧带,释放右肝韧带和粘连,并完全暴露肝脏段 V。
- 使用超声刀解剖胆囊三角,露出胆囊管和动脉。随后,在切除胆囊之前,用小的止血夹结扎这些结构。
- 准备三根丝线,长度分别为 S1-S2 = 9.8 厘米、S1-S3 = 7.2 厘米和 S2-S3 = 10.4 厘米。S4 点位于胆囊颈部,因此不要为 S4-S2 = 8.2 cm 和 S4-S3 = 6.5 cm 准备丝线。
- 将三根丝线放在肝脏表面的解剖位置,对应术前计划的切除路径,如图 4 所示。通过使用丝线作为物理导向,外科医生可以在手术过程中更精确地可视化并遵循计划的切除路径。
注意:此步骤弥合了虚拟计划和实际外科手术之间的差距。 - 使用电刀沿肝脏表面的丝线切割标记来烧灼肝脏(图 4D),并在肝脏上缝制橡皮筋进行牵引(图 5A)。
- 使用超声刀沿标记线横切肝实质。切开 home-o-lock 夹住遇到的血管,使用抽吸器吸血,并使用双极镊子止血(图 5B)。
- 将标本放入袋子中,用手术刀在上腹部切开 4 厘米,取出标本。确认腹腔无活动性出血,将止血材料放在肝横断面上,并从右下腹部引出一根引流管。
- 逐层拆除 3-0 根可吸收缝合线,去除套管针和缝合切口。检查标本以验证肿瘤包膜的完整性并测量肿瘤的大小(图 5C-D)。
3. 肝切除术后管理
- 从麻醉中成功恢复后将患者转移到病房,并在手术后最初的 24 小时恢复期内使用不间断的心脏监测观察患者的生命体征。
- 在整个术后第 1 天通过静脉输注实施预防性抗菌治疗,以减少潜在的脓毒性并发症。
- 术后 24 小时去除导尿管。手术后 72 小时进行普通计算机断层扫描(图 6)。手术后 4 天排空手术引流管,无大量腹水和胆汁渗漏。
结果
总手术时间为 150 min,失血量为 50 mL,无需输血。术中尿量 500 mL,术中输注量 800 mL。手术后第 1 天,血液检查结果显示转氨酶水平轻度升高。腹部 CT 扫描显示肝肿瘤完全切除,术后 3 天无明显腹水。术后第 4 天移除引流管。患者术后病程平安无事,术后第5 天出 院。术后大体病理标本显示肿瘤大小为 1.5 cm x 1.5 cm,证实了 R0 切除,如 表 1 所示。
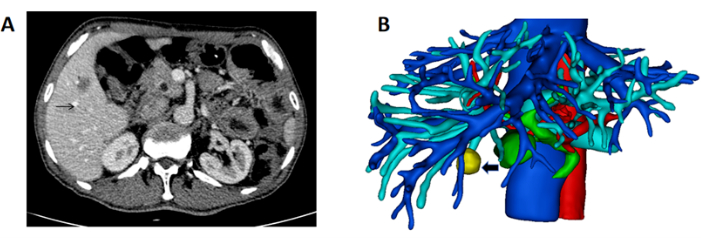
图 1:CT 显示肝脏和肿块的肿块和 3D 重建。 (A) CT 扫描显示位于右肝的肿瘤(黑色箭头表示肿块)。(B) 肝脏、血管和肿块的 3D 重建(黑色箭头表示肿块)。 请单击此处查看此图的较大版本。

图 2:在 3D 模型上标记切除线。 (A-D) 在 3D 中重建肝内导管结构和肿瘤,并用小棍子标记切削刃的关键点(S1、S2、S3、S4)。沿着虚拟肝脏模型表面的关键点画肝线,并测量每条线的长度(S1-S2 = 9.8 cm,S1-S3 = 7.2 cm,S2-S3 = 10.4 cm,S4-S2 = 8.2 cm,S4-S3 = 6.5 cm)。 请单击此处查看此图的较大版本。

图 3:外科医生、患者和套管针放置的术中布局。 (A) 手术外科医生在右侧,助手在左侧,摄像师在两腿之间。(B) 腹腔镜肝切除术使用五端口技术进行。 请单击此处查看此图的较大版本。

图 4:标记切除线的丝线。 (A-D) 在肝脏手术中,用丝线标记切削刃,准备相同长度的丝线,并将它们放置在肝脏表面的解剖位置。由丝线包围的形状是肝脏的切割线。 请单击此处查看此图的较大版本。

图 5:肝脏切除和标本。 (A) 在肝脏上缝上橡皮筋以牵引。(B) 在肝脏切除平面中暴露肝中静脉(黑色箭头表示肝中静脉)。(C-D)肝脏肿块完全切除(黑色箭头),横截面显示肿瘤边缘完整,与术前计划的切缘相匹配。 请单击此处查看此图的较大版本。

图 6:术后 CT 扫描。 CT 扫描显示术后第 3 天肿瘤切除成功,无肝周积液。 请单击此处查看此图的较大版本。
| 参数 | 结果 |
| 手术时间 | 150 分钟 |
| 失血 | 50 毫升 |
| 术后肝功能 | ALT 222 IU/L,AST 217 IU/L |
| 术后 CT 复查 | 接线盒 3 |
| 引流管移动 | 接线盒 4 |
| 出院当天 | 接线盒 5 |
| 肿瘤大小 | 1.5 厘米 x 1.5 厘米 |
| 病理型 | 腺癌 |
表 1:患者的手术结果。 缩写:ALT = 丙氨酸氨基转移酶;AST = 天冬氨酸氨基转移酶;POD = 术后日。
讨论
随着技术的发展和经验的积累,腹腔镜肝切除术越来越普遍,其适应症几乎与开放手术一样广泛。与剖腹手术相比,腹腔镜肝切除术具有许多优点,例如疼痛更小、围手术期并发症更少、恢复更快 7,8,9。然而,腹腔镜肝切除术也面临一些固有的困难。缺乏触觉和深度感知、有限的作空间和有限的视野对其广泛使用构成了挑战 10,11,12。为了解决这些问题,近年来,IOUS 和 ICG 荧光成像已被用作实时导航工具。当 IOUS 直接应用于肝脏表面时,可以提高病变检测和定位的准确性13,14。
但是,由于通常由超声医师进行手术,外科医生经常需要暂停手术等待他们,这不仅延长了手术时间,也增加了对超声技术的依赖。此外,在肝硬化中,IOUS 可能会将再生结节误解为肿瘤,从而导致过度诊断 15,16,17。ICG 是一种无害的水溶性近红外荧光剂,可以帮助在手术过程中通过特殊内窥镜观察解剖结构。其高灵敏度和清晰的对比度使其成为各种肝脏手术中手术导航的流行工具。然而,由于近红外光(高达 10 mm)的组织穿透性有限,其在检测深部肝脏病变中的应用受到限制。此外,过量的 ICG 可能会导致假阳性结果,肿瘤染色的成功与血液供应、肝硬化和坏死等因素有关 18,19,20。因此,开发一种创新、高效、准确的定位深部肝脏肿瘤的方法具有重要的临床意义。
在本研究中,术前 3D 定位用于识别孤立性肝肿瘤患者的解剖标志并计算切除面积。术中安排术前 3D 软件计算出的长度切缘线,用丝线标记边缘。这种方法提供了一种省时且准确的方法来导航最佳切割平面21。我们研究中的手术时间明显短于使用 IOUS 和 ICG 引导下肝切除术的研究。这种方法减少了对 IOUS 的依赖,节省了手术时间并降低了技术和条件要求。它可以应用于各种肝肿瘤导航情况,无论肿瘤的大小和深度如何。
尽管有其优点,但这种方法也有局限性。首先,其准确性取决于术前成像质量;运动伪影或低分辨率扫描可能会影响 3D 模型的保真度。其次,该技术采用静态肝脏解剖结构,而呼吸运动或手术作可以改变肿瘤位置,需要实时调整。第三,3D 软件作和术中空间翻译的学习曲线可能会限制在没有专门培训的情况下在手术中的采用。此外,本研究的样本量相对较小,未来需要大规模的前瞻性研究来进一步验证该方法的有效性。开发一个简单且广泛适用的 3D 重建程序也是未来研究的一个重要目标。
披露声明
作者报告没有利益冲突。
致谢
这项工作得到了贵州省卫健委科技基金项目(GZWKJ2025-300)和贵州省科技厅项目(钱科和程国,LC[2024]109)的支持。
材料
| Name | Company | Catalog Number | Comments |
| BiClamp LAP | ERBE Company | No.20195-132 | |
| Laparoscopic system | Olympus | VISERA OTV-S400 | |
| Ultrasonic knife | Johnson and Johnson MedTech | ETHICON HARMONIC |
参考文献
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。