Method Article
Abordagem de localização tridimensional com segmentectomia laparoscópica guiada por fio de seda para tumor hepático
Neste Artigo
Resumo
A utilização de reconstrução 3D e simulações virtuais no planejamento pré-operatório de ressecções hepáticas representa um avanço significativo na oncologia cirúrgica. A técnica 3D-LAST (abordagem de localização tridimensional com o fio de seda) de nossa equipe permite a remoção segura, eficiente e precisa do tumor com navegação intraoperatória prática, prometendo ampla adoção médica.
Resumo
Ao realizar a hepatectomia para tratar tumores hepáticos, determinar com precisão a margem de ressecção e garantir a adequação do parênquima hepático residual são de extrema importância. Atualmente, o ultrassom intraoperatório e a navegação por fluorescência verde de indocianina são métodos frequentemente utilizados. No entanto, certas restrições técnicas impedem sua aplicação extensiva. Desenvolvemos a técnica 3D-LAST para ressecção precisa de tumores hepáticos. Essa técnica faz uso de pós-processamento computacional para extrair características de tomografias computadorizadas (TC) e gerar imagens volumétricas, criando visualizações tridimensionais (3D). Isso fornece um recurso valioso para a tomada de decisões clínicas, pois pode exibir vividamente estruturas anatômicas internas complexas de maneira intuitiva e estereoscópica. Neste estudo, o posicionamento 3D pré-operatório foi realizado em pacientes com um único tumor hepático para identificar pontos anatômicos e calcular o intervalo de ressecção. Durante o procedimento cirúrgico, foram montadas linhas de margem de comprimentos calculados pelo software 3D pré-operatório e fio de seda foi utilizado para marcar as bordas. Essa abordagem oferece uma maneira precisa e com economia de tempo para determinar o plano de corte ideal. O objetivo deste artigo é demonstrar a viabilidade da aplicação do 3D-LAST na segmentectomia laparoscópica para tumores hepáticos. Os resultados da pesquisa indicam que o 3D-LAST é um novo método seguro, eficaz e prático para navegação intraoperatória do fígado e tem grande potencial para promoção em larga escala.
Introdução
A hepatectomia continua sendo um tratamento fundamental para tumores hepáticos. Nas últimas décadas, as abordagens cirúrgicas evoluíram de ressecções irregulares para ressecções anatômicas precisas, impulsionadas por avanços em tecnologias assistivas, como ultrassom intraoperatório (IOUS) e fluorescência verde de indocianina (ICG) 1,2. Apesar dessas inovações, alcançar margens de ressecção ideais, preservando o volume hepático funcional suficiente, continua sendo um desafio crítico. O objetivo geral de nossa técnica 3D-LAST (abordagem de localização tridimensional com fio de seda) proposta é fornecer um método de navegação intraoperatória preciso, econômico e universalmente acessível para ressecção de tumor hepático, minimizando a dependência de equipamentos especializados e melhorando a precisão espacial.
A justificativa para o desenvolvimento do 3D-LAST decorre das limitações das técnicas atuais. O IOUS, embora valioso para a localização do tumor em tempo real, requer ultrassonografistas qualificados para interpretação de imagens e luta com a visualização espacial bidimensional (2D), muitas vezes prolongando o tempo operatório 3,4. A navegação por fluorescência do ICG, embora eficaz para tumores superficiais, é limitada por sua profundidade limitada de penetração tecidual (5-10 mm), tornando-a pouco confiável para lesões mais profundas 5,6. Ambos os métodos dependem de hardware especializado e caro, limitando sua adoção em ambientes com recursos limitados.
As vantagens do 3D-LAST sobre as técnicas existentes são multifacetadas. A visualização tridimensional, derivada de reconstruções pré-operatórias de tomografia computadorizada (TC), supera a ambiguidade espacial da imagem 2D, fornecendo orientação anatômica estereoscópica. Ao contrário do ICG, que não possui resolução de profundidade, o 3D-LAST permite um planejamento preciso da ressecção volumétrica, reduzindo o risco de margens positivas ou perda excessiva do parênquima. Além disso, o uso de fio de seda para marcação intraoperatória elimina a necessidade de dispositivos de imagem em tempo real, simplificando o fluxo de trabalho e reduzindo custos.
O 3D-LAST é particularmente adequado para centros que não possuem infraestrutura avançada de imagem ou experiência em navegação intraoperatória complexa. É ideal para ressecções de tumor único em que os marcos anatômicos são identificáveis na TC pré-operatória e onde a minimização da complexidade do procedimento é priorizada. Ao abordar as limitações dos métodos atuais e alavancar tecnologias 3D validadas, o 3D-LAST representa um avanço pragmático na obtenção de cirurgia hepática de precisão com ampla adaptabilidade clínica.
Apresentação do caso:
Um homem de 59 anos com desconforto abdominal superior foi diagnosticado com um tumor hepático de 2,7 cm x 1,6 cm no fígado direito. O paciente foi previamente diagnosticado com adenocarcinoma gástrico e submetido a gastrectomia radical para câncer gástrico, seguida de quimioterapia de rotina. Nenhuma metástase extra-hepática foi encontrada na tomografia computadorizada pré-operatória com contraste. CA19-9, CA15-3, CA72-4, AFP e CEA foram normais.
Protocolo
O estudo foi aprovado pelo comitê de revisão do Hospital da China Ocidental da Universidade de Sichuan. O consentimento informado foi obtido do paciente antes da cirurgia.
1. Preparo pré-operatório
- Obtenha tomografias computadorizadas de alta resolução do fígado do paciente no formato DICOM (Figura 1A).
- Inicie o software Mimics, crie um novo projeto e importe os arquivos DICOM para garantir que todos os dados da imagem sejam carregados corretamente para reconstrução e análise 3D.
- Reconstrua a estrutura tridimensional do fígado, vasos e tumor. Marque o fígado em rosa, a veia porta em azul, a artéria em vermelho, a veia hepática e a veia cava inferior em azul e o tumor em amarelo (Figura 1B).
- Coloque três pequenos palitos virtuais no modelo 3D do fígado e obtenha quatro pontos-chave (S1, S2, S3, S4) na superfície do fígado (Figura 2A-B).
- Esses bastões virtuais atuam como marcos digitais, orientando o cirurgião na determinação da localização e orientação precisas do corte pretendido. Coloque a marcação virtual do ponto de ressecção a 1 cm da margem do tumor e o ponto médio da borda do fígado na parte inferior da vesícula biliar.
NOTA: Ao marcar esses pontos-chave, os cirurgiões podem garantir que permaneçam focados na área-alvo durante a cirurgia, minimizando o risco de danos desnecessários aos tecidos.
- Esses bastões virtuais atuam como marcos digitais, orientando o cirurgião na determinação da localização e orientação precisas do corte pretendido. Coloque a marcação virtual do ponto de ressecção a 1 cm da margem do tumor e o ponto médio da borda do fígado na parte inferior da vesícula biliar.
- Conecte os quatro pontos-chave com linhas na superfície do fígado e meça seus comprimentos (S1-S2 = 9,8 cm, S1-S3 = 7,2 cm, S2-S3 = 10,4 cm, S4-S2 = 8,2 cm, S4-S3 = 6,5 cm), conforme mostrado na Figura 2C-D. Essas linhas representam o trajeto de ressecção proposto, orientando o cirurgião na visualização da forma e contorno do fígado após a ressecção.
- Meça o comprimento de cada linha meticulosamente para garantir precisão e consistência. Essa medida é crucial, pois permite que os cirurgiões preparem fios de seda exatamente do mesmo comprimento, que serão usados no intraoperatório para guiar o corte do fígado.
2. Procedimento operatório
- Posicione o paciente em decúbito dorsal, com as pernas abertas e inclinadas para a direita (Figura 3A). Administre anestesia geral padrão, incluindo intubação traqueal e ventilação controlada.
- Desinfete a pele com esfoliante à base de iodo a 0,5% 3x na área de conexão entre mamilos, sínfise púbica, axilar médio direito e linhas hemiclaviculares esquerdas.
- Organize a equipe cirúrgica com o cirurgião à direita e o assistente à esquerda. Posicione a câmera centralmente entre os locais do trocarte, com o suporte da câmera também no meio.
- Faça uma incisão de 12 mm abaixo do umbigo como orifício laparoscópico (H1), uma incisão curva de 12 mm e uma de 5 mm (H2 e H3) como orifícios de operação principais, outra de 12 mm e uma de 5 mm (H4 e H5) como orifícios de operação auxiliares (Figura 3B).
- Insira cinco trocartes (12 mm, 12 mm, 12 mm, 5 mm e 5 mm) nas incisões conforme ilustrado na Figura 3B. Ligue o sistema pneumoperitônio e injete gás 100% de dióxido de carbono através do trocarte para manter o pneumoperitônio a uma pressão de cerca de 12 mmHg.
- Realize um exame exploratório da cavidade abdominal, começando do epigástrio esquerdo e movendo-se para a direita até o hipogástrio, para detectar qualquer presença de ascite, cirrose e metástase.
- Libere aderências abdominais, descole o ligamento redondo do fígado, libere o ligamento hepático direito e as aderências e exponha totalmente o segmento V do fígado usando uma faca ultrassônica.
- Use uma faca ultrassônica para dissecar o triângulo da vesícula biliar, revelando o ducto e a artéria da vesícula biliar. Em seguida, ligue essas estruturas com pequenos clipes de hemo-lock antes de extirpar a vesícula biliar.
- Prepare três fios de seda com comprimentos de S1-S2 = 9,8 cm, S1-S3 = 7,2 cm e S2-S3 = 10,4 cm, respectivamente. O ponto S4 está localizado no colo da vesícula biliar, portanto, não prepare fios de seda para S4-S2 = 8,2 cm e S4-S3 = 6,5 cm.
- Colocar os três fios de seda na posição anatômica na superfície do fígado, correspondendo ao trajeto de ressecção planejado no pré-operatório, conforme mostrado na Figura 4. Ao usar fios de seda como guia físico, os cirurgiões podem visualizar e seguir o caminho de ressecção planejado com maior precisão durante a cirurgia.
NOTA: Esta etapa preenche a lacuna entre o planejamento virtual e o procedimento cirúrgico real. - Use uma faca elétrica para cauterizar o fígado cortando marcadores ao longo do fio de seda na superfície do fígado (Figura 4D) e costure um elástico no fígado para tração (Figura 5A).
- Use uma faca ultrassônica para transeccionar o parênquima hepático ao longo das linhas marcadoras. Corte os vasos encontrados pelo corte home-o-lock, use um aspirador para aspirar o sangue e use uma pinça bipolar para parar o sangramento (Figura 5B).
- Coloque a amostra em um saco e faça uma incisão de 4 cm com bisturi na parte superior do abdômen para remover a amostra. Confirme se não há sangramento ativo na cavidade abdominal, coloque materiais hemostáticos na superfície de transecção do fígado e um tubo de drenagem saindo do abdome inferior direito.
- Remova o trocarte e as incisões de sutura por 3-0 suturas absorvíveis camada por camada. Examine a amostra para verificar a integridade da cápsula tumoral e medir o tamanho do tumor (Figura 5C-D).
3. Manejo pós-hepatectomia
- Transfira o paciente para a enfermaria após a recuperação bem-sucedida da anestesia e observe os sinais vitais do paciente usando monitoramento cardíaco ininterrupto durante o período inicial de recuperação de 24 horas após a cirurgia.
- Implemente terapia antimicrobiana profilática por infusão intravenosa durante o1º dia de pós-operatório para reduzir possíveis complicações sépticas.
- Remova o cateterismo urinário 24 horas após o procedimento. Realize uma tomografia computadorizada simples 72 h após a cirurgia (Figura 6). Evacue os drenos cirúrgicos 4 dias após a operação sem ascite maciça e vazamento de bile.
Resultados
O tempo total de operação foi de 150 min, com 50 mL de perda sanguínea que não necessitou de transfusão sanguínea. O volume urinário intraoperatório foi de 500 mL e o volume de infusão intraoperatória foi de 800 mL. No1º dia após a cirurgia, os resultados dos exames de sangue mostraram um leve aumento nos níveis de transaminases. A tomografia computadorizada de abdome mostrou ressecção completa do tumor hepático e sem ascite significativa 3 dias após a cirurgia. O dreno foi removido no 4º dia de pós-operatório. O paciente evoluiu sem intercorrências no pós-operatório e recebeu alta hospitalar no5º dia de pós-operatório. A amostra patológica macroscópica pós-operatória demonstrou que o tamanho do tumor era de 1,5 cm x 1,5 cm, confirmando a ressecção R0 conforme mostrado na Tabela 1.
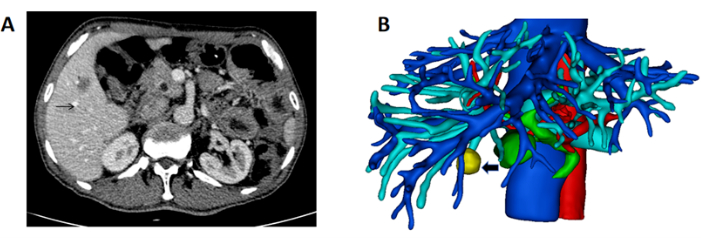
Figura 1: Tomografia computadorizada mostrando a massa e reconstrução 3D do fígado e massa. (A) A tomografia computadorizada mostrando o tumor localizado no fígado direito (seta preta indicando massa). (B) Reconstrução 3D do fígado, vaso e massa (seta preta indicando massa). Clique aqui para ver uma versão maior desta figura.

Figura 2: Marque a linha de ressecção no modelo 3D. (A-D) Reconstrua a estrutura do ducto intra-hepático e o tumor em 3D e marque os pontos-chave (S1, S2, S3, S4) da aresta de corte com uma pequena vara. Desenhe linhas de fígado ao longo dos pontos-chave na superfície do modelo virtual de fígado e meça o comprimento de cada linha (S1-S2 = 9,8 cm, S1-S3 = 7,2 cm, S2-S3 = 10,4 cm, S4-S2 = 8,2 cm, S4-S3 = 6,5 cm). Clique aqui para ver uma versão maior desta figura.

Figura 3: Layout intraoperatório do cirurgião, paciente e colocação do trocarte. (A) O cirurgião está à direita, o assistente à esquerda e o cinegrafista entre as pernas. (B) O procedimento de hepatectomia laparoscópica é realizado usando uma técnica de cinco portas. Clique aqui para ver uma versão maior desta figura.

Figura 4: Fio de seda marcando a linha de ressecção. (A-D) Durante a cirurgia hepática, use fio de seda para marcar a aresta de corte, prepare fios de seda do mesmo comprimento e coloque-os na posição anatômica na superfície do fígado. A forma delimitada pelo fio de seda é a linha de corte para o fígado. Clique aqui para ver uma versão maior desta figura.

Figura 5: Ressecção hepática e amostra. (A) Costure um elástico no fígado para tração. (B) Exponha a veia hepática média no plano de ressecção do fígado (seta preta indicando a veia hepática média). (CD) Ressecção completa da massa hepática (seta preta), a visão transversal mostrando que a margem do tumor está intacta e compatível com a margem planejada no pré-operatório. Clique aqui para ver uma versão maior desta figura.

Figura 6: Tomografia computadorizada pós-operatória. A tomografia computadorizada indicou remoção bem-sucedida do tumor sem acúmulo de líquido peri-hepático no 3º dia de pós-operatório. Clique aqui para ver uma versão maior desta figura.
| Parâmetros | Resultados |
| Duração da cirurgia | 150 minutos |
| Perda de sangue | 50 mL |
| Função hepática pós-operatória | ALT 222 UI/L, AST 217 UI/L |
| Reexame de TC pós-operatório | POD 3 |
| Movimento do tubo de drenagem | POD 4 |
| Dia da alta | POD 5 |
| Tamanho do tumor | 1,5 cm x 1,5 cm |
| Tipo patológico | Adenocarcinoma |
Tabela 1: Resultados cirúrgicos do paciente. Abreviaturas: ALT = Alanina Aminotransferase; AST = Aspartato Aminotransferase; DPO = Dia de Pós-Operatório.
Discussão
Com o desenvolvimento da tecnologia e o acúmulo de experiência, a ressecção hepática laparoscópica tornou-se cada vez mais comum, e suas indicações são quase tão extensas quanto as da cirurgia aberta. Em comparação com a laparotomia, a ressecção hepática laparoscópica tem muitas vantagens, como menos dor, menos complicações perioperatórias e recuperação mais rápida 7,8,9. No entanto, a ressecção hepática laparoscópica também enfrenta algumas dificuldades inerentes. A falta de percepção tátil e de profundidade, o espaço operacional limitado e o campo visual restrito representam desafios para seu uso generalizado 10,11,12. Para resolver esses problemas, as imagens de fluorescência IOUS e ICG têm sido usadas como ferramentas de navegação em tempo real nos últimos anos. A USIO, quando aplicada diretamente na superfície do fígado, pode melhorar a precisão da detecção e localização da lesão 13,14.
No entanto, como geralmente é operado por ultrassonografistas, os cirurgiões geralmente precisam pausar a operação para esperar por eles, o que não apenas prolonga o tempo de operação, mas também aumenta a dependência da tecnologia de ultrassom. Além disso, em fígados cirróticos, a USIO pode interpretar erroneamente os nódulos regenerativos como tumores, levando ao sobrediagnóstico 15,16,17. O ICG, um agente fluorescente inofensivo de infravermelho próximo solúvel em água, pode ajudar a visualizar estruturas anatômicas durante a operação por meio de escopos especiais. Sua alta sensibilidade e contraste claro o tornam uma ferramenta popular para navegação cirúrgica em várias cirurgias hepáticas. No entanto, devido à penetração tecidual limitada da luz infravermelha próxima (até 10 mm), sua aplicação na detecção de lesões hepáticas profundas é restrita. Além disso, uma dose excessiva de ICG pode causar resultados falso-positivos, e o sucesso da coloração tumoral está relacionado a fatores como suprimento sanguíneo, cirrose hepática e necrose 18,19,20. Portanto, o desenvolvimento de um método inovador, eficiente e preciso para localizar tumores hepáticos profundos é de grande importância clínica.
Neste estudo, o posicionamento 3D pré-operatório foi usado para identificar pontos anatômicos e calcular a área de ressecção para pacientes com tumores hepáticos solitários. Durante a operação, foram dispostas linhas de margem de comprimentos calculados por software 3D pré-operatório e fio de seda foi utilizado para marcar as bordas. Este método fornece uma maneira eficiente e precisa de navegar no plano de corte ideal21. O tempo de operação em nosso estudo foi significativamente menor do que o relatado em estudos usando IOUS e hepatectomia guiada por ICG. Essa abordagem reduz a dependência de IOUS, economizando tempo cirúrgico e diminuindo os requisitos técnicos e condicionais. Pode ser aplicado a várias situações de navegação de tumores hepáticos, independentemente do tamanho e profundidade do tumor.
Apesar de suas vantagens, essa abordagem tem limitações. Primeiro, sua precisão depende da qualidade da imagem pré-operatória; artefatos de movimento ou varreduras de baixa resolução podem comprometer a fidelidade do modelo 3D. Em segundo lugar, a técnica assume anatomia estática do fígado, enquanto os movimentos respiratórios ou a manipulação cirúrgica podem mudar as posições do tumor, necessitando de ajustes em tempo real. Em terceiro lugar, a curva de aprendizado para operação de software 3D e translação espacial intraoperatória pode limitar a adoção em cirurgia sem treinamento especializado. Além disso, o tamanho da amostra deste estudo é relativamente pequeno e futuros estudos prospectivos em larga escala são necessários para verificar ainda mais a eficácia desse método. Desenvolver um programa de reconstrução 3D simples e amplamente aplicável também é um objetivo importante para pesquisas futuras.
Divulgações
Os autores relatam não haver conflito de interesses.
Agradecimentos
Este trabalho foi apoiado pelo Projeto do Fundo de Ciência e Tecnologia da Comissão Provincial de Saúde de Guizhou (gzwkj2025-300), o Projeto do Departamento de Ciência e Tecnologia da Província de Guizhou (Qian Ke He Cheng Guo, LC [2024] 109).
Materiais
| Name | Company | Catalog Number | Comments |
| BiClamp LAP | ERBE Company | No.20195-132 | |
| Laparoscopic system | Olympus | VISERA OTV-S400 | |
| Ultrasonic knife | Johnson and Johnson MedTech | ETHICON HARMONIC |
Referências
- Fan, S. T., et al. Continuous improvement of survival outcomes of resection of hepatocellular carcinoma: a 20-year experience. Ann Surg. 253 (5), 745-758 (2011).
- Torzilli, G., et al. "Radical but conservative" is the main goal for ultrasonography-guided liver resection: prospective validation of this approach. J Am Coll Surg. 201 (5), 517-528 (2005).
- Torzilli, G., et al. Contrast-enhanced intraoperative ultrasonography during surgery for hepatocellular carcinoma in liver cirrhosis: is it useful or useless? A prospective cohort study of our experience. Ann Surg Oncol. 14 (4), 1347-1355 (2007).
- Leen, E., et al. Potential value of contrast-enhanced intraoperative ultrasonography during partial hepatectomy for metastases: an essential investigation before resection. Ann Surg. 243 (2), 236-240 (2006).
- Ishizawa, T., et al. Real-time identification of liver cancers by using indocyanine green fluorescent imaging. Cancer. 115 (12), 2491-2504 (2009).
- Gotoh, K., et al. A novel image-guided surgery of hepatocellular carcinoma by indocyanine green fluorescence imaging navigation. J Surg Oncol. 100 (7), 75-79 (2009).
- Nguyen, K. T., Gamblin, T. C., Geller, D. A. World review of laparoscopic liver resection-2,804 patients. Ann Surg. 250 (5), 831-841 (2009).
- Abu Hilal, M., et al. The Southampton Consensus Guidelines for laparoscopic liver surgery: from indication to implementation. Ann Surg. 268 (1), 11-18 (2018).
- Ciria, R., Cherqui, D., Geller, D. A., Briceno, J., Wakabayashi, G. Comparative short-term benefits of laparoscopic liver resection: 9000 cases and climbing. Ann Surg. 263 (4), 761-777 (2016).
- Schneider, C., et al. Comparison of manual and semi-automatic registration in augmented reality image-guided liver surgery: a clinical feasibility study. Surg Endosc. 34 (10), 4702-4711 (2020).
- Lwin, T. Z., Sicklick, J. K., Hoffman, R. M., Bouvet, M. Fluorescence-guided laparoscopic hepatectomy. Ann Laparosc Endosc Surg. 1, 10(2016).
- Ziogas, I. A., Tsoulfas, G. Advances and challenges in laparoscopic surgery in the management of hepatocellular carcinoma. World J Gastrointest Surg. 9 (12), 233-245 (2017).
- Cai, X., et al. Does using indocyanine green fluorescence imaging for tumors help in determining the safe surgical margin in real-time navigation of laparoscopic hepatectomy? A retrospective study. Ann Surg Oncol. 30 (6), 1981-1987 (2023).
- Nishino, H., et al. Real-time navigation for liver surgery using projection mapping with indocyanine green fluorescence: development of the novel medical imaging projection system. Ann Surg. 267 (6), 1134-1140 (2018).
- Ishizawa, T., et al. Impact of intraoperative ultrasonography on surgical strategy and prognosis after hepatic resection for hepatocellular carcinoma. Ann Surg Oncol. 15 (13), 3665-3673 (2008).
- Solbiati, L., et al. Percutaneous sono-guided radio-frequency ablation of liver metastases: a multi-centre study. Eur Radiol. 11 (10), 1947-1954 (2001).
- Yang, T., et al. The role of intraoperative ultrasonography in laparoscopic liver resection for hepatocellular carcinoma: a propensity score-matched analysis. Surg Endosc. 34 (5), 2137-2144 (2020).
- van Manen, L., et al. A practical guide for the use of indocyanine green and methylene blue in fluorescence-guided abdominal surgery. J Surg Oncol. 118 (2), 283-300 (2018).
- Yoo, K. Y., et al. Intravenously administered indocyanine green may cause falsely high near-infrared cerebral oximetry readings. Anesthesiology. 120 (6), 1374-1379 (2014).
- Kimura, F., et al. Clinical impact of indocyanine green fluorescence imaging for liver tumor surgery: a single-center experience. Surgery. 161 (2), 475-481 (2017).
- Zhang, Z. H., Feng, Q. B., Jiang, C., Huang, J. W., Li, J. X. Three-dimensional location approach with silk thread guided hepatectomy for liver tumor. World J Gastroenterol. 31 (8), 10262(2025).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados