Method Article
肝腫瘍に対する絹糸ガイド付き腹腔鏡下センボ切除術による三次元ロケーションアプローチ
要約
肝臓切除術の術前計画における3D再構成と仮想シミュレーションの利用は、外科腫瘍学における大きな進歩を表しています。当チームの3D-LAST(絹糸による3次元位置決めアプローチ)技術は、実用的な術中ナビゲーションによる安全、効率的、正確な腫瘍除去を可能にし、幅広い医療採用が期待されています。
要約
肝腫瘍の治療のために肝切除術を行う際には、切除断端を正確に決定し、残存肝実質の妥当性を確保することが最も重要です。現在、術中超音波検査とインドシアニングリーン蛍光ナビゲーションが頻繁に利用されている方法です。ただし、特定の技術的な制約により、広範な適用が妨げられます。私たちは、肝臓腫瘍の精密切除のための3D-LAST技術を開発しました。この手法では、コンピューターの後処理を利用して、コンピューター断層撮影(CT)スキャンから特徴を抽出し、ボリューム画像を生成して、3次元(3D)視覚化を作成します。これは、複雑な内部解剖学的構造を直感的かつ立体的に鮮やかに表示することができるため、臨床上の意思決定に貴重なリソースを提供します。この研究では、単一の肝腫瘍を有する患者に対して術前3Dポジショニングを実施し、解剖学的ランドマークを特定し、切除範囲を計算しました。手術では、術前の3Dソフトで計算された長さのマージンラインを設定し、絹糸で縁に印をつけました。このアプローチにより、最適な切断面を決定するための時間を節約し、正確に行うことができます。この記事の目的は、肝腫瘍の腹腔鏡下セグメント切除術に3D-LASTを適用することの実行可能性を実証することです。研究の結果は、3D-LASTが術中肝臓ナビゲーションのための安全で効果的かつ実用的な新しい方法であり、広く普及する大きな可能性を秘めていることを示しています。
概要
肝切除術は、依然として肝腫瘍の基礎となる治療法です。ここ数十年で、外科的アプローチは、術中超音波(IOUS)やインドシアニングリーン(ICG)蛍光イメージング1,2などの支援技術の進歩により、不規則な切除から正確な解剖学的切除へと進化してきました。これらの革新にもかかわらず、十分な機能的な肝臓容積を維持しながら最適な切除マージンを達成することは、依然として重要な課題です。私たちが提案する3D-LAST(絹糸による3次元位置アプローチ)技術の全体的な目標は、肝臓腫瘍切除のための正確で費用対効果が高く、普遍的にアクセス可能な術中ナビゲーション方法を提供することです。
3D-LASTを開発する根拠は、現在の技術の限界に起因しています。IOUSは、リアルタイムの腫瘍の局在化には価値がありますが、画像の解釈には熟練した超音波検査技師が必要であり、2次元(2D)空間視覚化に苦労し、多くの場合、手術時間を延長します3,4。ICG蛍光ナビゲーションは、表在性腫瘍には効果的ですが、組織浸透深さが限られている(5〜10 mm)ため、より深い病変には信頼性がありません5,6。どちらの方法も、高価な特殊なハードウェアに依存しているため、リソースに制約のある環境での採用は限られています。
既存の技術に対する3D-LASTの利点は多面的です。術前のコンピューター断層撮影(CT)再構成から導き出された3次元視覚化は、立体的な解剖学的ガイダンスを提供することにより、2Dイメージングの空間的曖昧さを克服します。深さ分解能に欠けるICGとは異なり、3D-LASTは正確な容積切除計画を可能にし、マージンが陽性であったり、過度の実質損失のリスクを軽減します。さらに、術中マーキングに絹糸を使用することで、リアルタイムイメージングデバイスが不要になり、ワークフローが合理化され、コストが削減されます。
3D-LASTは、高度なイメージングインフラストラクチャや複雑な術中ナビゲーションの専門知識が不足しているセンターに特に適しています。術前CTで解剖学的なランドマークが特定でき、手続きの複雑さを最小限に抑えることが優先される単一腫瘍切除に最適です。現在の方法の限界に対処し、検証済みの3D技術を活用することで、3D-LASTは、幅広い臨床的適応性を備えた精密な肝臓手術を達成するための実用的な進歩を表しています。
ケースプレゼンテーション:
上腹部に不快感を訴えた59歳の男性が、右肝臓に2.7cm×1.6cmの肝臓腫瘍と診断されました。この患者は以前に胃腺癌と診断され、胃癌に対して根治的胃切除術を受け、その後定期的な化学療法を受けました。術前の造影CTスキャンでは肝外転移は認められず、CA19-9、CA15-3、CA72-4、AFP、CEAは正常であった。
プロトコル
この研究は、四川大学西中国病院の審査委員会によって承認されました。手術前に患者からインフォームドコンセントが得られました。
1. 術前準備
- DICOM形式で患者の肝臓の高解像度CTスキャンを取得します(図1A)。
- Mimicsソフトウェアを起動し、新しいプロジェクトを作成し、DICOMファイルをインポートして、すべての画像データが3D再構築と分析のために正しくロードされていることを確認します。
- 肝臓、血管、腫瘍の三次元構造を再構築します。肝臓をピンク色、門脈を青色、動脈を赤色、肝静脈と下大静脈を青色、腫瘍を黄色でマークします(図1B)。
- 3D肝臓モデルに3本の小さな仮想スティックを配置し、肝臓の表面に4つのキーポイント(S1、S2、S3、S4)を取得します(図2A-B)。
- これらの仮想スティックはデジタルランドマークとして機能し、外科医が意図したカットの正確な位置と向きを決定するように導きます。切除点の仮想スティックマーキングを腫瘍縁から1cm、肝臓の端の中点を胆嚢の底に配置します。
注:これらの重要なポイントをマークすることで、外科医は手術中にターゲット領域に集中し続けることができ、不必要な組織損傷のリスクを最小限に抑えることができます。
- これらの仮想スティックはデジタルランドマークとして機能し、外科医が意図したカットの正確な位置と向きを決定するように導きます。切除点の仮想スティックマーキングを腫瘍縁から1cm、肝臓の端の中点を胆嚢の底に配置します。
- 図2C-Dに示すように、肝臓表面に4つのキーポイントを線で接続し、その長さ(S1-S2 = 9.8 cm、S1-S3 = 7.2 cm、S2-S3 = 10.4 cm、S4-S2 = 8.2 cm、S4-S3 = 6.5 cm)を測定します。これらの線は、提案された切除経路を表し、外科医が切除後の肝臓の形状と輪郭を視覚化する際のガイドです。
- 各線の長さを細心の注意を払って測定し、精度と一貫性を確保します。この測定は、外科医がまったく同じ長さの絹糸を準備することを可能にするため、非常に重要です。
2.手術手順
- 患者の足を広げて右に傾けて、患者を仰臥位に置きます(図3A)。気管挿管や制御換気など、標準的な全身麻酔を投与します。
- 乳首間接続、恥骨結合、右中腋窩、および左鎖骨中部の領域に0.5%ヨウ素ベースのスクラブ3xで皮膚を消毒します。.
- 外科チームを、外科医を右側に、助手を左側に配置して配置します。カメラをトロカールサイトの中央に配置し、カメラホルダーも中央に立たせます。
- 腹腔鏡穴(H1)として臍の下12mmを切開し、主な手術穴として12mmと5mmの湾曲切開(H2とH3)を1つ、補助手術穴として12mmと5mm(H4とH5)を1つ(図3B)として行います。
- 図3Bに示すように、5つのトロカール(12 mm、12 mm、12 mm、5 mm、および5 mm)を切開に挿入します。気腹システムをオンにし、トロカールを介して100%二酸化炭素ガスを注入して、気腹を約12mmHgの圧力に保ちます。
- 腹水、肝硬変、転移の存在を検出するために、左上腹部から始まり、右下腹部まで腹腔の探索的検査を実施します。
- 腹部の癒着を解消し、肝臓の丸い靭帯を剥離し、右の肝臓の靭帯と癒着を解放し、超音波ナイフを使用して肝臓セグメントVを完全に露出させます。
- 超音波ナイフを使用して胆嚢の三角形を解剖し、胆嚢管と動脈を明らかにします。その後、胆嚢を切除する前に、これらの構造を小さなヘモロッククリップで結紮します。
- 長さがS1-S2=9.8cm、S1-S3=7.2cm、S2-S3=10.4cmの絹糸を3本用意します。ポイントS4は胆嚢の首に位置しているので、S4-S2 = 8.2 cmおよびS4-S3 = 6.5 cmには絹糸を準備しないでください。
- 図4に示すように、3本の絹糸を肝臓表面の解剖学的位置に配置し、術前に計画された切除経路に対応します。絹糸を物理的なガイドとして使用することで、外科医は手術中に計画された切除経路をより正確に視覚化し、追跡することができます。
注:このステップは、仮想計画と実際の外科的処置との間のギャップを埋めます。 - 電動ナイフを使用して、肝臓の表面にある絹糸に沿ってマーカーを切って肝臓を焼灼し(図4D)、牽引のために肝臓に輪ゴムを縫います(図5A)。
- 超音波ナイフを使用して、マーカー線に沿って肝実質を横断します。home-o-lockクリッピングで遭遇した血管を切断し、吸引器を使用して血液を吸引し、バイポーラ鉗子を使用して出血を止めます(図5B)。
- 検体を袋に入れ、上腹部にメスで4cmの切開をして検体を取り出します。腹腔内に活発な出血がないことを確認し、肝臓の切断面に止血物質を置き、右下腹部から出る1本のドレナージチューブを置きます。
- トロカールと縫合糸の切開部を3-0吸収性縫合糸で層ごとに取り除きます。標本を検査して腫瘍嚢の完全性を確認し、腫瘍のサイズを測定します(図5C-D)。
3. 肝切除術後の管理
- 麻酔からの回復が成功した後、患者を病棟に移し、手術後の最初の24時間の回復期間中に中断のない心臓モニタリングを使用して患者のバイタルサインを観察します。
- 潜在的な敗血症性合併症を減らすために、術後 1日目 を通して静脈内注入による予防的抗菌療法を実施します。
- 処置後24時間で尿道カテーテルを切除します。手術の72時間後に単純なコンピューター断層撮影スキャンを実施します(図6)。手術後4日で大量の腹水や胆汁漏れのない外科用ドレーンを避難させます。
結果
総手術時間は150分で、輸血を必要としない50mLの失血がありました。術中尿量は500mL、術中輸液量は800mLであった。手術後1日目の 血液検査の結果、トランスアミナーゼ濃度が軽度に上昇しました。腹部のCTスキャンでは、手術の3日後に肝臓腫瘍の完全切除が示され、重大な腹水は認められませんでした。ドレーンは術後 4 日目に除去されました。術後経過は順調で、術後5日目に 退院した。術後の肉眼的病理標本では、腫瘍の大きさが1.5cm×1.5cmであることが示され、 表1に示すようにR0切除が確認された。
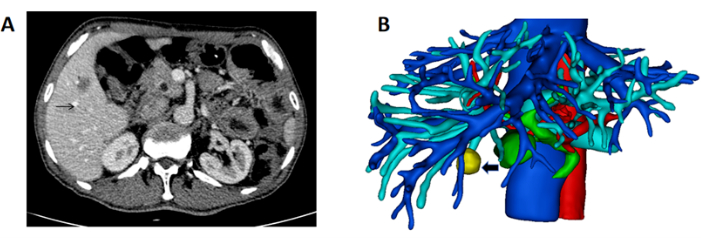
図1:肝臓と腫瘤の腫瘤と3D再構成を示すCT (A)右肝臓に位置する腫瘍を示すCTスキャン(黒矢印は腫瘤を示す)。(B)肝臓、血管、および腫瘤の3D再構成(黒矢印は質量を示す)。 この図の拡大版を表示するには、ここをクリックしてください。

図2:3Dモデル上に切除線をマークします。 (A-D)肝管構造と腫瘍を3Dで再構築し、刃先のキーポイント(S1、S2、S3、S4)を小さな棒でマークします。仮想肝臓モデルの表面上の重要なポイントに沿って肝臓の線を引き、各線の長さを測定します(S1-S2 = 9.8 cm、S1-S3 = 7.2 cm、S2-S3 = 10.4 cm、S4-S2 = 8.2 cm、S4-S3 = 6.5 cm)。 この図の拡大版を表示するには、ここをクリックしてください。

図3:外科医、患者、およびトロカールの配置の術中レイアウト(A)手術医は右側に、助手は左側に、カメラマンは脚の間にいます。(B)腹腔鏡下肝切除術は、5ポート技術を使用して行われます。この図の拡大版を表示するには、ここをクリックしてください。

図4:切除線をマーキングする絹糸(A-D)肝臓の手術中は、絹糸を使用して刃先に印を付け、同じ長さの絹糸を準備し、肝臓の表面の解剖学的位置に配置します。絹糸で囲まれた形が肝臓の切断線です。この図の拡大版を表示するには、ここをクリックしてください。

図5:肝臓の切除と標本 (A) 牽引のために肝臓に輪ゴムを縫い付けます。(B)肝臓切除面に中静脈を露出させます(中静脈を示す黒矢印)。(C-D)肝臓の腫瘤の完全切除(黒矢印)、腫瘍の縁が無傷であることを示す断面図は、術前に計画されたマージンと一致しています。 この図の拡大版を表示するには、ここをクリックしてください。

図6:術後CTスキャン。 CTスキャンでは、術後3日目に肝周囲液の蓄積を伴わずに腫瘍の切除が成功したことが示されました。 この図の拡大版を表示するには、ここをクリックしてください。
| パラメーター | 業績 |
| 手術期間 | 150分 |
| 失血 | 50ミリリットル |
| 術後肝機能 | ALT 222 IU/L、AST 217 IU/L |
| 術後CT再検査 | ポッド 3 |
| ドレナージチューブの移動 | ポッド 4 |
| 退院日 | ポッド5 |
| 腫瘍の大きさ | 1.5cm×1.5cm |
| 病理型 | 腺癌 |
表1:患者の手術結果。 略語:ALT =アラニンアミノトランスフェラーゼ;AST = アスパラギン酸アミノトランスフェラーゼ;POD = 術後の日。
ディスカッション
技術の発展と経験の蓄積により、腹腔鏡下肝臓切除術はますます一般的になり、その適応症は開腹手術とほぼ同じくらい広範囲に及んでいます。開腹術と比較して、腹腔鏡下肝切除術には、痛みが少ない、周術期合併症が少ない、回復が早いなど、多くの利点があります7,8,9。しかし、腹腔鏡下肝切除術には、いくつかの固有の困難も直面しています。触覚と奥行き知覚の欠如、限られた操作スペース、および限られた視野は、その広範な使用に課題をもたらします10,11,12。これらの問題に対処するために、近年、リアルタイムナビゲーションツールとしてIESおよびICG蛍光イメージングが使用されています。IESは、肝臓表面に直接適用すると、病変の検出および局在化の精度を向上させることができる13,14。
しかし、通常は超音波検査技師が操作するため、外科医は手術を一時停止して待つ必要があり、手術時間が長くなるだけでなく、超音波技術への依存度も高まります。さらに、肝硬変性肝では、IESが再生性結節を腫瘍と誤解し、過剰診断につながることがあります15,16,17。ICGは、無害な水溶性近赤外蛍光剤で、特殊なスコープにより手術中の解剖学的構造を可視化することができます。その高い感度とクリアなコントラストにより、様々な肝臓手術における外科的ナビゲーションに人気のあるツールとなっています。しかし、近赤外光(最大10mm)の組織浸透は限られているため、深部肝病変の検出への応用は制限されています。さらに、ICGの過剰投与は偽陽性の結果を引き起こす可能性があり、腫瘍染色の成功は、血液供給、肝硬変、および壊死などの要因に関連しています18,19,20。したがって、深部肝腫瘍を局在化するための革新的で効率的かつ正確な方法を開発することは、臨床的に非常に重要です。
この研究では、術前の 3D ポジショニングを使用して、解剖学的ランドマークを特定し、孤立性肝腫瘍患者の切除面積を計算しました。手術中は、術前の3Dソフトで算出した長さのマージンラインを配置し、絹糸で縁に印をつけました。この方法は、最適な切断面21をナビゲートするための時間効率の良い正確な方法を提供する。私たちの研究の手術時間は、IOUS および ICG ガイド下肝切除術を使用した研究で報告された時間よりも大幅に短かった。このアプローチにより、IESへの依存度が減り、手術時間が節約され、技術的要件と条件付き要件が軽減されます。腫瘍の大きさや深さに関係なく、さまざまな肝臓腫瘍のナビゲーション状況に適用できます。
その利点にもかかわらず、このアプローチには制限があります。まず、その精度は術前の画像品質に依存します。モーションアーティファクトや低解像度のスキャンは、3Dモデルの忠実度を損なう可能性があります。第二に、この手法は静的な肝臓の解剖学的構造を前提としていますが、呼吸運動や外科的操作は腫瘍の位置をずらす可能性があるため、リアルタイムの調整が必要になります。第三に、3Dソフトウェア操作と術中空間変換の学習曲線は、専門的なトレーニングなしでは手術への採用を制限する可能性があります。また、本研究のサンプルサイズは比較的小さく、本手法の有効性をさらに検証するためには、今後の大規模な前向き研究が必要である。シンプルで広く適用可能な3D再構築プログラムを開発することも、将来の研究の重要な目標です。
開示事項
著者らは、利益相反を報告していない。
謝辞
本研究は、貴州省衛生委員会科学技術基金プロジェクト(gzwkj2025-300)、貴州省科学技術局プロジェクト(Qian Ke He Cheng Guo, LC[2024]109)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| BiClamp LAP | ERBE Company | No.20195-132 | |
| Laparoscopic system | Olympus | VISERA OTV-S400 | |
| Ultrasonic knife | Johnson and Johnson MedTech | ETHICON HARMONIC |
参考文献
- Fan, S. T., et al. Continuous improvement of survival outcomes of resection of hepatocellular carcinoma: a 20-year experience. Ann Surg. 253 (5), 745-758 (2011).
- Torzilli, G., et al. "Radical but conservative" is the main goal for ultrasonography-guided liver resection: prospective validation of this approach. J Am Coll Surg. 201 (5), 517-528 (2005).
- Torzilli, G., et al. Contrast-enhanced intraoperative ultrasonography during surgery for hepatocellular carcinoma in liver cirrhosis: is it useful or useless? A prospective cohort study of our experience. Ann Surg Oncol. 14 (4), 1347-1355 (2007).
- Leen, E., et al. Potential value of contrast-enhanced intraoperative ultrasonography during partial hepatectomy for metastases: an essential investigation before resection. Ann Surg. 243 (2), 236-240 (2006).
- Ishizawa, T., et al. Real-time identification of liver cancers by using indocyanine green fluorescent imaging. Cancer. 115 (12), 2491-2504 (2009).
- Gotoh, K., et al. A novel image-guided surgery of hepatocellular carcinoma by indocyanine green fluorescence imaging navigation. J Surg Oncol. 100 (7), 75-79 (2009).
- Nguyen, K. T., Gamblin, T. C., Geller, D. A. World review of laparoscopic liver resection-2,804 patients. Ann Surg. 250 (5), 831-841 (2009).
- Abu Hilal, M., et al. The Southampton Consensus Guidelines for laparoscopic liver surgery: from indication to implementation. Ann Surg. 268 (1), 11-18 (2018).
- Ciria, R., Cherqui, D., Geller, D. A., Briceno, J., Wakabayashi, G. Comparative short-term benefits of laparoscopic liver resection: 9000 cases and climbing. Ann Surg. 263 (4), 761-777 (2016).
- Schneider, C., et al. Comparison of manual and semi-automatic registration in augmented reality image-guided liver surgery: a clinical feasibility study. Surg Endosc. 34 (10), 4702-4711 (2020).
- Lwin, T. Z., Sicklick, J. K., Hoffman, R. M., Bouvet, M. Fluorescence-guided laparoscopic hepatectomy. Ann Laparosc Endosc Surg. 1, 10(2016).
- Ziogas, I. A., Tsoulfas, G. Advances and challenges in laparoscopic surgery in the management of hepatocellular carcinoma. World J Gastrointest Surg. 9 (12), 233-245 (2017).
- Cai, X., et al. Does using indocyanine green fluorescence imaging for tumors help in determining the safe surgical margin in real-time navigation of laparoscopic hepatectomy? A retrospective study. Ann Surg Oncol. 30 (6), 1981-1987 (2023).
- Nishino, H., et al. Real-time navigation for liver surgery using projection mapping with indocyanine green fluorescence: development of the novel medical imaging projection system. Ann Surg. 267 (6), 1134-1140 (2018).
- Ishizawa, T., et al. Impact of intraoperative ultrasonography on surgical strategy and prognosis after hepatic resection for hepatocellular carcinoma. Ann Surg Oncol. 15 (13), 3665-3673 (2008).
- Solbiati, L., et al. Percutaneous sono-guided radio-frequency ablation of liver metastases: a multi-centre study. Eur Radiol. 11 (10), 1947-1954 (2001).
- Yang, T., et al. The role of intraoperative ultrasonography in laparoscopic liver resection for hepatocellular carcinoma: a propensity score-matched analysis. Surg Endosc. 34 (5), 2137-2144 (2020).
- van Manen, L., et al. A practical guide for the use of indocyanine green and methylene blue in fluorescence-guided abdominal surgery. J Surg Oncol. 118 (2), 283-300 (2018).
- Yoo, K. Y., et al. Intravenously administered indocyanine green may cause falsely high near-infrared cerebral oximetry readings. Anesthesiology. 120 (6), 1374-1379 (2014).
- Kimura, F., et al. Clinical impact of indocyanine green fluorescence imaging for liver tumor surgery: a single-center experience. Surgery. 161 (2), 475-481 (2017).
- Zhang, Z. H., Feng, Q. B., Jiang, C., Huang, J. W., Li, J. X. Three-dimensional location approach with silk thread guided hepatectomy for liver tumor. World J Gastroenterol. 31 (8), 10262(2025).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved