Method Article
Approccio di localizzazione tridimensionale con segmentectomia laparoscopica guidata da filo di seta per tumore epatico
In questo articolo
Riepilogo
L'utilizzo della ricostruzione 3D e delle simulazioni virtuali nella pianificazione preoperatoria per le resezioni epatiche rappresenta un progresso significativo nell'oncologia chirurgica. La tecnica 3D-LAST (approccio di localizzazione tridimensionale con il filo di seta) del nostro team consente una rimozione sicura, efficiente e precisa del tumore con una pratica navigazione intraoperatoria, promettendo un'ampia adozione medica.
Abstract
Quando si esegue l'epatectomia per il trattamento dei tumori epatici, è della massima importanza determinare con precisione il margine di resezione e garantire l'adeguatezza del parenchima epatico residuo. Attualmente, l'ecografia intraoperatoria e la navigazione a fluorescenza con verde indocianina sono metodi frequentemente utilizzati. Tuttavia, alcuni vincoli tecnici ne impediscono l'ampia applicazione. Abbiamo sviluppato la tecnica 3D-LAST per una resezione precisa del tumore al fegato. Questa tecnica utilizza la post-elaborazione al computer per estrarre le caratteristiche dalle scansioni di tomografia computerizzata (TC) e generare immagini volumetriche, creando visualizzazioni tridimensionali (3D). Ciò fornisce una risorsa preziosa per il processo decisionale clinico, in quanto può visualizzare in modo vivido strutture anatomiche interne complesse in modo intuitivo e stereoscopico. In questo studio, il posizionamento 3D preoperatorio è stato effettuato su pazienti con un singolo tumore epatico per identificare i punti di riferimento anatomici e calcolare l'intervallo di resezione. Durante la procedura chirurgica, sono state impostate linee di margine di lunghezze calcolate dal software 3D preoperatorio e il filo di seta è stato utilizzato per contrassegnare i bordi. Questo approccio offre un modo rapido e accurato per determinare il piano di taglio ottimale. L'obiettivo di questo articolo è dimostrare la fattibilità dell'applicazione di 3D-LAST nella segmentectomia laparoscopica per i tumori del fegato. I risultati della ricerca indicano che 3D-LAST è un nuovo metodo sicuro, efficace e pratico per la navigazione epatica intraoperatoria e ha un grande potenziale per la promozione su larga scala.
Introduzione
L'epatectomia rimane un trattamento fondamentale per i tumori del fegato. Negli ultimi decenni, gli approcci chirurgici si sono evoluti da resezioni irregolari a resezioni anatomiche precise, guidate dai progressi nelle tecnologie assistive come l'ecografia intraoperatoria (IOUS) e l'imaging a fluorescenza con verde indocianina (ICG) 1,2. Nonostante queste innovazioni, ottenere margini di resezione ottimali preservando un volume epatico funzionale sufficiente rimane una sfida critica. L'obiettivo generale della nostra tecnica 3D-LAST (approccio di localizzazione tridimensionale con filo di seta) è quello di fornire un metodo di navigazione intraoperatoria preciso, economico e universalmente accessibile per la resezione del tumore epatico, riducendo al minimo la dipendenza da apparecchiature specializzate e migliorando l'accuratezza spaziale.
La logica per lo sviluppo di 3D-LAST deriva dai limiti delle tecniche attuali. L'IOUS, sebbene prezioso per la localizzazione del tumore in tempo reale, richiede ecografisti qualificati per l'interpretazione delle immagini e fatica con la visualizzazione spaziale bidimensionale (2D), spesso prolungando il tempo operatorio 3,4. La navigazione della fluorescenza ICG, sebbene efficace per i tumori superficiali, è limitata dalla sua limitata profondità di penetrazione tissutale (5-10 mm), che la rende inaffidabile per le lesioni più profonde 5,6. Entrambi i metodi dipendono da hardware costoso e specializzato, limitandone l'adozione in contesti con risorse limitate.
I vantaggi di 3D-LAST rispetto alle tecniche esistenti sono molteplici. La visualizzazione tridimensionale, derivata da ricostruzioni preoperatorie di tomografia computerizzata (TC), supera l'ambiguità spaziale dell'imaging 2D fornendo una guida anatomica stereoscopica. A differenza dell'ICG, che manca di risoluzione in profondità, 3D-LAST consente una pianificazione precisa della resezione volumetrica, riducendo il rischio di margini positivi o di eccessiva perdita parenchimale. Inoltre, l'uso del filo di seta per la marcatura intraoperatoria elimina la necessità di dispositivi di imaging in tempo reale, semplificando il flusso di lavoro e riducendo i costi.
3D-LAST è particolarmente adatto per i centri che non dispongono di un'infrastruttura di imaging avanzata o di competenze nella navigazione intraoperatoria complessa. È ideale per le resezioni di un singolo tumore in cui i punti di riferimento anatomici sono identificabili alla TC preoperatoria e dove è prioritaria la riduzione al minimo della complessità procedurale. Affrontando i limiti dei metodi attuali e sfruttando le tecnologie 3D convalidate, 3D-LAST rappresenta un progresso pragmatico nel raggiungimento di una chirurgia epatica di precisione con un'ampia adattabilità clinica.
Presentazione del caso:
A un uomo di 59 anni con fastidio addominale superiore è stato diagnosticato un tumore al fegato di 2,7 cm x 1,6 cm nel fegato destro. Al paziente era stato precedentemente diagnosticato un adenocarcinoma gastrico ed era stato sottoposto a gastrectomia radicale per cancro gastrico, seguita da chemioterapia di routine. Non sono state riscontrate metastasi extraepatiche alla TC con mezzo di contrasto preoperatoria. CA19-9, CA15-3, CA72-4, AFP e CEA erano normali.
Protocollo
Lo studio è stato approvato dal comitato di revisione del West China Hospital dell'Università del Sichuan. Il consenso informato è stato ottenuto dal paziente prima dell'intervento chirurgico.
1. Preparazione preoperatoria
- Ottenere scansioni TC ad alta risoluzione del fegato del paziente in formato DICOM (Figura 1A).
- Avvia il software Mimics, crea un nuovo progetto e importa i file DICOM per assicurarti che tutti i dati dell'immagine siano caricati correttamente per la ricostruzione e l'analisi 3D.
- Ricostruisci la struttura tridimensionale del fegato, dei vasi e del tumore. Segna il fegato in rosa, la vena porta in blu, l'arteria in rosso, la vena epatica e la vena cava inferiore in blu e il tumore in giallo (Figura 1B).
- Posiziona tre piccoli bastoncini virtuali sul modello 3D del fegato e ottieni quattro punti chiave (S1, S2, S3, S4) sulla superficie del fegato (Figura 2A-B).
- Questi bastoncini virtuali fungono da punti di riferimento digitali, guidando il chirurgo nel determinare la posizione e l'orientamento precisi del taglio previsto. Posizionare la marcatura virtuale del bastoncino del punto di resezione a 1 cm dal margine del tumore e dal punto medio del bordo del fegato nella parte inferiore della cistifellea.
NOTA: Contrassegnando questi punti chiave, i chirurghi possono assicurarsi di rimanere concentrati sull'area target durante l'intervento chirurgico, riducendo al minimo il rischio di danni ai tessuti non necessari.
- Questi bastoncini virtuali fungono da punti di riferimento digitali, guidando il chirurgo nel determinare la posizione e l'orientamento precisi del taglio previsto. Posizionare la marcatura virtuale del bastoncino del punto di resezione a 1 cm dal margine del tumore e dal punto medio del bordo del fegato nella parte inferiore della cistifellea.
- Collega i quattro punti chiave con linee sulla superficie del fegato e misura le loro lunghezze (S1-S2 = 9,8 cm, S1-S3 = 7,2 cm, S2-S3 = 10,4 cm, S4-S2 = 8,2 cm, S4-S3 = 6,5 cm) come mostrato nella Figura 2C-D. Queste linee rappresentano il percorso di resezione proposto, guidando il chirurgo nella visualizzazione della forma e del contorno del fegato dopo la resezione.
- Misura meticolosamente la lunghezza di ogni linea per garantire precisione e coerenza. Questa misurazione è fondamentale in quanto consente ai chirurghi di preparare fili di seta della stessa identica lunghezza, che verranno utilizzati intraoperatoriamente per guidare il taglio del fegato.
2. Procedimento operativo
- Posizionare il paziente in posizione supina, con le gambe divaricate e inclinate a destra (Figura 3A). Somministrare l'anestesia generale standard, compresa l'intubazione tracheale e la ventilazione controllata.
- Disinfettare la pelle con uno scrub a base di iodio allo 0,5% 3 volte sull'area di connessione tra capezzoli, sinfisi pubica, linea medioascellare destra e medioclavicolare sinistra.
- Organizzare l'équipe chirurgica con il chirurgo a destra e l'assistente a sinistra. Posizionare la telecamera al centro tra i siti del trocar, con il supporto della telecamera al centro.
- Praticare un'incisione di 12 mm sotto l'ombelico come foro laparoscopico (H1), un'incisione curva da 12 mm e una da 5 mm (H2 e H3) come fori operatori principali, un'altra da 12 mm e una da 5 mm (H4 e H5) come fori operatori ausiliari (Figura 3B).
- Inserire cinque trocar (12 mm, 12 mm, 12 mm, 5 mm e 5 mm) nelle incisioni come illustrato nella Figura 3B. Accendere il sistema pneumoperitoneo e iniettare il 100% di anidride carbonica attraverso il trocar per mantenere il pneumoperitoneo a una pressione di circa 12 mmHg.
- Condurre un esame esplorativo della cavità addominale, partendo dall'epigastrio sinistro e scendendo verso destra fino all'ipogastrio, per rilevare l'eventuale presenza di ascite, cirrosi e metastasi.
- Libera le aderenze addominali, stacca il legamento rotondo del fegato, libera il legamento epatico destro e le aderenze ed espone completamente il segmento V del fegato utilizzando un coltello ad ultrasuoni.
- Usa un coltello a ultrasuoni per sezionare il triangolo della cistifellea, rivelando il dotto e l'arteria della cistifellea. Successivamente, legare queste strutture con piccole clip di blocco dell'emo prima di asportare la cistifellea.
- Prepara tre fili di seta con lunghezze rispettivamente di S1-S2 = 9,8 cm, S1-S3 = 7,2 cm e S2-S3 = 10,4 cm. Il punto S4 si trova sul collo della cistifellea, quindi non preparare fili di seta per S4-S2 = 8,2 cm e S4-S3 = 6,5 cm.
- Posizionare i tre fili di seta in posizione anatomica sulla superficie del fegato, corrispondente al percorso di resezione pianificato prima dell'intervento, come mostrato nella Figura 4. Utilizzando i fili di seta come guida fisica, i chirurghi possono visualizzare e seguire il percorso di resezione pianificato con maggiore precisione durante l'intervento chirurgico.
NOTA: Questo passaggio colma il divario tra la pianificazione virtuale e la procedura chirurgica vera e propria. - Usa un coltello elettrico per cauterizzare il fegato tagliando dei pennarelli lungo il filo di seta sulla superficie del fegato (Figura 4D) e cuci un elastico sul fegato per la trazione (Figura 5A).
- Usa un coltello a ultrasuoni per sezionare il parenchima epatico lungo le linee del marcatore. Tagliare i vasi che si incontrano con l'home-o-lock clipping, utilizzare un aspiratore per aspirare il sangue e utilizzare una pinza bipolare per fermare l'emorragia (Figura 5B).
- Metti il campione in un sacchetto e fai un'incisione di 4 cm con un bisturi nella parte superiore dell'addome per rimuovere il campione. Verificare l'assenza di sanguinamento attivo nella cavità addominale, posizionare il materiale emostatico sulla superficie di transezione epatica e un tubo di drenaggio che esce dall'addome inferiore destro.
- Rimuovere il trocar e le incisioni di sutura con suture riassorbibili 3-0 strato per strato. Esaminare il campione per verificare l'integrità della capsula tumorale e misurare le dimensioni del tumore (Figura 5C-D).
3. Gestione post-epatectomia
- Trasferire il paziente in reparto dopo il successo del recupero dall'anestesia e osservare i segni vitali del paziente utilizzando il monitoraggio cardiaco ininterrotto durante il periodo di recupero iniziale di 24 ore dopo l'intervento chirurgico.
- Implementare la terapia antimicrobica profilattica mediante infusione endovenosa durante il 1° giorno postoperatorio per ridurre le potenziali complicanze settiche.
- Rimuovere il cateterismo urinario 24 ore dopo la procedura. Eseguire una tomografia computerizzata 72 ore dopo l'intervento chirurgico (Figura 6). Evacuare i drenaggi chirurgici 4 giorni dopo l'operazione senza ascite massiccia e perdite biliari.
Risultati
Il tempo totale dell'operazione è stato di 150 minuti, con 50 ml di perdita di sangue che non hanno richiesto una trasfusione di sangue. Il volume delle urine intraoperatorie era di 500 ml e il volume di infusione intraoperatoria era di 800 ml. Il 1° giorno dopo l'intervento, i risultati degli esami del sangue hanno mostrato un lieve aumento dei livelli di transaminasi. La TAC dell'addome ha mostrato una resezione completa del tumore epatico e nessuna ascite significativa 3 giorni dopo l'intervento chirurgico. Il drenaggio è stato rimosso il giorno 4 postoperatorio. Il paziente ha avuto un decorso postoperatorio tranquillo ed è stato dimesso il 5° giorno dopo l'operazione. Il campione patologico macroscopico postoperatorio ha dimostrato che la dimensione del tumore era di 1,5 cm x 1,5 cm, confermando la resezione R0 come mostrato nella Tabella 1.
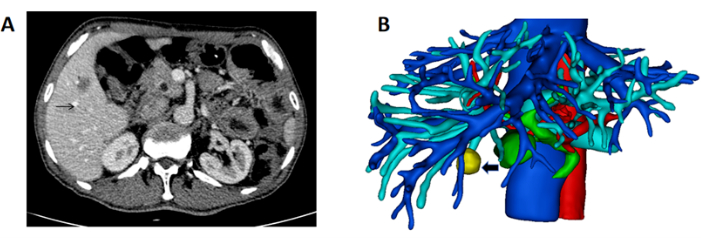
Figura 1: TC che mostra la massa e la ricostruzione 3D del fegato e della massa. (A) La TAC che mostra il tumore localizzato nel fegato destro (freccia nera che indica la massa). (B) Ricostruzione 3D di fegato, vaso e massa (freccia nera che indica la massa). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Segnare la linea di resezione sul modello 3D. (A-D) Ricostruire la struttura del dotto intraepatico e il tumore in 3D e segnare i punti chiave (S1, S2, S3, S4) del tagliente con un bastoncino. Disegna le linee del fegato lungo i punti chiave sulla superficie del modello virtuale del fegato e misura la lunghezza di ciascuna linea (S1-S2 = 9,8 cm, S1-S3 = 7,2 cm, S2-S3 = 10,4 cm, S4-S2 = 8,2 cm, S4-S3 = 6,5 cm). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Layout intraoperatorio del chirurgo, del paziente e posizionamento del trocar. (A) Il chirurgo operativo è a destra, l'assistente a sinistra e il cameraman tra le gambe. (B) La procedura di epatectomia laparoscopica viene eseguita utilizzando una tecnica a cinque porte. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Filo di seta che segna la linea di resezione. (A-D) Durante l'intervento chirurgico al fegato, utilizzare il filo di seta per contrassegnare il tagliente, preparare fili di seta della stessa lunghezza e posizionarli in posizione anatomica sulla superficie del fegato. La forma racchiusa dal filo di seta è la linea di taglio per il fegato. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Resezione epatica e campione. (A) Cucire un elastico sul fegato per la trazione. (B) Esporre la vena epatica media nel piano di resezione epatica (freccia nera che indica la vena epatica media). (C-D) Resezione completa della massa epatica (freccia nera), la vista in sezione trasversale che mostra che il margine tumorale è intatto e corrisponde al margine pianificato prima dell'intervento. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: TAC postoperatoria. La TAC ha indicato il successo della rimozione del tumore senza accumulo di liquido periepatico il giorno 3 postoperatorio. Clicca qui per visualizzare una versione più grande di questa figura.
| Parametri | Risultati |
| Durata dell'intervento | 150 minuti |
| Perdita di sangue | 50 ml |
| Funzionalità epatica postoperatoria | ALT 222 IU/L, AST 217 IU/L |
| Riesame TC postoperatorio | POD 3 |
| Movimento del tubo di drenaggio | POD 4 |
| Giorno di dimissione | POD 5 |
| Dimensione del tumore | 1,5 cm x 1,5 cm |
| Tipo patologico | Adenocarcinoma |
Tabella 1: Gli esiti chirurgici del paziente. Abbreviazioni: ALT = Alanina Aminotransferasi; AST = Aspartato Aminotransferasi; POD = Giorno postoperatorio.
Discussione
Con lo sviluppo della tecnologia e l'accumulo di esperienza, la resezione epatica laparoscopica è diventata sempre più comune e le sue indicazioni sono quasi altrettanto estese di quelle della chirurgia a cielo aperto. Rispetto alla laparotomia, la resezione epatica laparoscopica presenta molti vantaggi, come meno dolore, meno complicanze perioperatorie e un recupero più rapido 7,8,9. Tuttavia, la resezione epatica laparoscopica incontra anche alcune difficoltà intrinseche. La mancanza di percezione tattile e della profondità, lo spazio operativo limitato e il campo visivo ristretto pongono sfide al suo uso diffuso 10,11,12. Per affrontare questi problemi, negli ultimi anni sono stati utilizzati IOUS e ICG come strumenti di navigazione in tempo reale. IOUS, se applicato direttamente sulla superficie del fegato, può migliorare l'accuratezza del rilevamento e della localizzazione delle lesioni13,14.
Tuttavia, poiché di solito viene operato dagli ecografisti, i chirurghi spesso devono mettere in pausa l'operazione per aspettarli, il che non solo prolunga il tempo dell'operazione, ma aumenta anche la dipendenza dalla tecnologia a ultrasuoni. Inoltre, nei fegati cirrotici, la IOUS può interpretare erroneamente i noduli rigenerativi come tumori, portando a una sovradiagnosi 15,16,17. L'ICG, un innocuo agente fluorescente solubile in acqua nel vicino infrarosso, può aiutare a visualizzare le strutture anatomiche durante l'operazione attraverso appositi endoscopi. La sua elevata sensibilità e il chiaro contrasto lo rendono uno strumento popolare per la navigazione chirurgica in vari interventi chirurgici al fegato. Tuttavia, a causa della limitata penetrazione nei tessuti della luce nel vicino infrarosso (fino a 10 mm), la sua applicazione nel rilevamento di lesioni epatiche profonde è limitata. Inoltre, una dose eccessiva di ICG può causare risultati falsi positivi e il successo della colorazione del tumore è correlato a fattori come l'afflusso di sangue, la cirrosi epatica e la necrosi 18,19,20. Pertanto, lo sviluppo di un metodo innovativo, efficiente e accurato per localizzare i tumori epatici profondi è di grande importanza clinica.
In questo studio, il posizionamento 3D preoperatorio è stato utilizzato per identificare i punti di riferimento anatomici e calcolare l'area di resezione per i pazienti con tumori epatici solitari. Durante l'operazione, sono state disposte le linee di margine delle lunghezze calcolate dal software 3D preoperatorio e il filo di seta è stato utilizzato per contrassegnare i bordi. Questo metodo fornisce un modo rapido e preciso per navigare nel piano di taglio ottimale21. Il tempo operatorio nel nostro studio è stato significativamente più breve di quello riportato negli studi che utilizzano IOUS ed epatectomia guidata da ICG. Questo approccio riduce la dipendenza dall'IOUS, risparmiando tempo chirurgico e abbassando i requisiti tecnici e condizionali. Può essere applicato a varie situazioni di navigazione del tumore al fegato, indipendentemente dalle dimensioni e dalla profondità del tumore.
Nonostante i suoi vantaggi, questo approccio ha dei limiti. Innanzitutto, la sua accuratezza dipende dalla qualità dell'imaging preoperatorio; Gli artefatti di movimento o le scansioni a bassa risoluzione possono compromettere la fedeltà del modello 3D. In secondo luogo, la tecnica presuppone un'anatomia epatica statica, mentre i movimenti respiratori o la manipolazione chirurgica possono spostare le posizioni del tumore, richiedendo aggiustamenti in tempo reale. In terzo luogo, la curva di apprendimento per il funzionamento del software 3D e la traduzione spaziale intraoperatoria possono limitare l'adozione in chirurgia senza una formazione specializzata. Inoltre, la dimensione del campione di questo studio è relativamente piccola e sono necessari futuri studi prospettici su larga scala per verificare ulteriormente l'efficacia di questo metodo. Lo sviluppo di un programma di ricostruzione 3D semplice e ampiamente applicabile è anche un obiettivo importante per la ricerca futura.
Divulgazioni
Gli autori non segnalano alcun conflitto di interessi.
Riconoscimenti
Questo lavoro è stato sostenuto dal progetto del Fondo per la scienza e la tecnologia della Commissione sanitaria provinciale del Guizhou (gzwkj2025-300), dal progetto del Dipartimento provinciale di scienza e tecnologia del Guizhou (Qian Ke He Cheng Guo, LC[2024]109).
Materiali
| Name | Company | Catalog Number | Comments |
| BiClamp LAP | ERBE Company | No.20195-132 | |
| Laparoscopic system | Olympus | VISERA OTV-S400 | |
| Ultrasonic knife | Johnson and Johnson MedTech | ETHICON HARMONIC |
Riferimenti
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon