Method Article
Abordaje de localización tridimensional con segmentectomía laparoscópica guiada por hilo de seda para el tumor hepático
En este artículo
Resumen
La utilización de la reconstrucción 3D y las simulaciones virtuales en la planificación preoperatoria de las resecciones hepáticas representa un avance significativo en la oncología quirúrgica. La técnica 3D-LAST (enfoque de localización tridimensional con hilo de seda) de nuestro equipo permite la extirpación segura, eficiente y precisa del tumor con una navegación intraoperatoria práctica, lo que promete una amplia adopción médica.
Resumen
Al realizar una hepatectomía para tratar tumores hepáticos, es de suma importancia determinar con precisión el margen de resección y garantizar la idoneidad del parénquima hepático residual. En la actualidad, la ecografía intraoperatoria y la navegación con fluorescencia verde de indocianina son métodos frecuentemente utilizados. Sin embargo, ciertas limitaciones técnicas impiden su aplicación extensiva. Hemos desarrollado la técnica 3D-LAST para la resección precisa de tumores hepáticos. Esta técnica hace uso del posprocesamiento informático para extraer características de las tomografías computarizadas (TC) y generar imágenes volumétricas, creando visualizaciones tridimensionales (3D). Esto proporciona un recurso valioso para la toma de decisiones clínicas, ya que puede mostrar vívidamente estructuras anatómicas internas complejas de una manera intuitiva y estereoscópica. En este estudio, se llevó a cabo un posicionamiento preoperatorio en 3D en pacientes con un solo tumor hepático para identificar puntos de referencia anatómicos y calcular el rango de resección. Durante el procedimiento quirúrgico, se establecieron líneas de márgenes de longitudes calculadas por software 3D preoperatorio, y se utilizó hilo de seda para marcar los bordes. Este enfoque ofrece una forma precisa y rápida de determinar el plano de corte óptimo. El objetivo de este artículo es demostrar la viabilidad de la aplicación de 3D-LAST en la segmentectomía laparoscópica de tumores hepáticos. Los resultados de la investigación indican que 3D-LAST es un nuevo método seguro, eficaz y práctico para la navegación hepática intraoperatoria, y tiene un gran potencial para la promoción a gran escala.
Introducción
La hepatectomía sigue siendo un tratamiento fundamental para los tumores hepáticos. En las últimas décadas, los abordajes quirúrgicos han evolucionado de resecciones irregulares a resecciones anatómicas precisas, impulsadas por los avances en tecnologías de asistencia como el ultrasonido intraoperatorio (IOUS) y las imágenes de fluorescencia de verde de indocianina (ICG) 1,2. A pesar de estas innovaciones, lograr márgenes de resección óptimos mientras se conserva un volumen hepático funcional suficiente sigue siendo un desafío crítico. El objetivo general de nuestra técnica propuesta 3D-LAST (enfoque de localización tridimensional con hilo de seda) es proporcionar un método de navegación intraoperatorio preciso, rentable y universalmente accesible para la resección de tumores hepáticos, minimizando la dependencia de equipos especializados y mejorando la precisión espacial.
La justificación para el desarrollo de 3D-LAST se deriva de las limitaciones de las técnicas actuales. La IOUS, si bien es valiosa para la localización de tumores en tiempo real, requiere ecografistas capacitados para la interpretación de imágenes y dificultades con la visualización espacial bidimensional (2D), lo que a menudo prolonga el tiempo operatorio 3,4. La navegación por fluorescencia ICG, aunque eficaz para los tumores superficiales, está limitada por su limitada profundidad de penetración en el tejido (5-10 mm), lo que la hace poco fiable para las lesiones más profundas 5,6. Ambos métodos dependen de hardware costoso y especializado, lo que limita su adopción en entornos con recursos limitados.
Las ventajas de 3D-LAST sobre las técnicas existentes son multifacéticas. La visualización tridimensional, derivada de las reconstrucciones preoperatorias de tomografía computarizada (TC), supera la ambigüedad espacial de las imágenes 2D al proporcionar orientación anatómica estereoscópica. A diferencia de ICG, que carece de resolución de profundidad, 3D-LAST permite una planificación precisa de la resección volumétrica, lo que reduce el riesgo de márgenes positivos o pérdida excesiva del parénquima. Además, el uso de hilo de seda para el marcado intraoperatorio elimina la necesidad de dispositivos de imagen en tiempo real, lo que agiliza el flujo de trabajo y reduce los costes.
3D-LAST es especialmente adecuado para centros que carecen de una infraestructura de imagen avanzada o de experiencia en navegación intraoperatoria compleja. Es ideal para resecciones de un solo tumor en las que los puntos de referencia anatómicos son identificables en la TC preoperatoria y en las que se prioriza minimizar la complejidad del procedimiento. Al abordar las limitaciones de los métodos actuales y aprovechar las tecnologías 3D validadas, 3D-LAST representa un avance pragmático para lograr una cirugía hepática de precisión con una amplia adaptabilidad clínica.
Presentación del caso:
Un hombre de 59 años con molestias en la parte superior del abdomen fue diagnosticado con un tumor hepático de 2,7 cm x 1,6 cm en el hígado derecho. El paciente fue diagnosticado previamente con adenocarcinoma gástrico y se sometió a una gastrectomía radical por cáncer gástrico, seguida de quimioterapia de rutina. No se encontraron metástasis extrahepáticas en la TC preoperatoria con contraste. CA19-9, CA15-3, CA72-4, AFP y CEA fueron normales.
Protocolo
El estudio fue aprobado por el comité de revisión del Hospital de China Occidental de la Universidad de Sichuan. Se obtuvo el consentimiento informado del paciente antes de la cirugía.
1. Preparación preoperatoria
- Obtener tomografías computarizadas de alta resolución del hígado del paciente en formato DICOM (Figura 1A).
- Inicie el software Mimics, cree un nuevo proyecto e importe los archivos DICOM para asegurarse de que todos los datos de la imagen se carguen correctamente para la reconstrucción y el análisis en 3D.
- Reconstruir la estructura tridimensional del hígado, los vasos y el tumor. Marque el hígado en rosa, la vena porta en azul, la arteria en rojo, la vena hepática y la vena cava inferior en azul y el tumor en amarillo (Figura 1B).
- Coloque tres pequeños palos virtuales en el modelo 3D del hígado y obtenga cuatro puntos clave (S1, S2, S3, S4) en la superficie del hígado (Figura 2A-B).
- Estos palitos virtuales actúan como puntos de referencia digitales, guiando al cirujano en la determinación de la ubicación y orientación precisas del corte previsto. Coloque la marca de adherencia virtual del punto de resección a 1 cm del margen del tumor y el punto medio del borde del hígado en la parte inferior de la vesícula biliar.
NOTA: Al marcar estos puntos clave, los cirujanos pueden asegurarse de permanecer enfocados en el área objetivo durante la cirugía, minimizando el riesgo de daño tisular innecesario.
- Estos palitos virtuales actúan como puntos de referencia digitales, guiando al cirujano en la determinación de la ubicación y orientación precisas del corte previsto. Coloque la marca de adherencia virtual del punto de resección a 1 cm del margen del tumor y el punto medio del borde del hígado en la parte inferior de la vesícula biliar.
- Conecte los cuatro puntos clave con líneas en la superficie del hígado y mida sus longitudes (S1-S2 = 9,8 cm, S1-S3 = 7,2 cm, S2-S3 = 10,4 cm, S4-S2 = 8,2 cm, S4-S3 = 6,5 cm) como se muestra en la Figura 2C-D. Estas líneas representan la ruta de resección propuesta, guiando al cirujano en la visualización de la forma y el contorno del hígado después de la resección.
- Mida la longitud de cada línea meticulosamente para garantizar la precisión y la consistencia. Esta medición es crucial, ya que permite a los cirujanos preparar hilos de seda de exactamente la misma longitud, que se utilizarán intraoperatoriamente para guiar el corte del hígado.
2. Procedimiento operativo
- Colocar al paciente en decúbito supino, con las piernas abiertas e inclinadas hacia la derecha (Figura 3A). Administrar anestesia general estándar, incluyendo intubación traqueal y ventilación controlada.
- Desinfecte la piel con un exfoliante a base de yodo al 0,5% 3 veces en el área de conexión entre pezones, sínfisis del pubis, líneas del medioeje derecho y del medioclavicular izquierdo.
- Organice el equipo quirúrgico con el cirujano a la derecha y el asistente a la izquierda. Coloque la cámara en el centro entre los sitios del trócar, con el soporte de la cámara también en el medio.
- Realizar una incisión de 12 mm por debajo del ombligo como orificio laparoscópico (H1), una incisión curva de 12 mm y otra curva de 5 mm (H2 y H3) como orificios quirúrgicos principales, otra de 12 mm y otra de 5 mm (H4 y H5) como orificios auxiliares (Figura 3B).
- Inserte cinco trócares (12 mm, 12 mm, 12 mm, 5 mm y 5 mm) en las incisiones como se muestra en la Figura 3B. Encienda el sistema de neumoperitoneo e inyecte gas 100% de dióxido de carbono a través del trócar para mantener el neumoperitoneo a una presión de aproximadamente 12 mmHg.
- Realizar un examen exploratorio de la cavidad abdominal, comenzando desde el epigastrio izquierdo y descendiendo hacia la derecha hasta el hipogastrio, para detectar cualquier presencia de ascitis, cirrosis y metástasis.
- Adherencias abdominales libres, desprender el ligamento redondo del hígado, liberar el ligamento hepático derecho y las adherencias, y exponer completamente el segmento V del hígado con un bisturí ultrasónico.
- Use un cuchillo ultrasónico para diseccionar el triángulo de la vesícula biliar, revelando el conducto y la arteria de la vesícula biliar. Posteriormente, ligar estas estructuras con pequeños clips hemo-lock antes de extirpar la vesícula biliar.
- Prepare tres hilos de seda con longitudes de S1-S2 = 9,8 cm, S1-S3 = 7,2 cm y S2-S3 = 10,4 cm respectivamente. El punto S4 se encuentra en el cuello de la vesícula biliar, por lo que no prepare hilos de seda para S4-S2 = 8,2 cm y S4-S3 = 6,5 cm.
- Coloque los tres hilos de seda en la posición anatómica de la superficie hepática, correspondiente a la trayectoria de resección planificada antes de la operación, como se muestra en la figura 4. Mediante el uso de hilos de seda como guía física, los cirujanos pueden visualizar y seguir la ruta de resección planificada con mayor precisión durante la cirugía.
NOTA: Este paso cierra la brecha entre la planificación virtual y el procedimiento quirúrgico real. - Use un cuchillo eléctrico para cauterizar el hígado cortando marcadores a lo largo del hilo de seda en la superficie del hígado (Figura 4D) y cosa una banda elástica en el hígado para la tracción (Figura 5A).
- Utilice un bisturí ultrasónico para seccionar el parénquima hepático a lo largo de las líneas marcadoras. Cortar los vasos que se encuentren por el clipaje casero, use un aspirador para succionar la sangre y use pinzas bipolares para detener el sangrado (Figura 5B).
- Coloque el espécimen en una bolsa y haga una incisión de 4 cm con bisturí en la parte superior del abdomen para extraer el espécimen. Confirmar que no hay sangrado activo en la cavidad abdominal, colocar materiales hemostáticos en la superficie de la transección hepática y un tubo de drenaje que salga por la parte inferior derecha del abdomen.
- Retirar el trócar y las incisiones de sutura mediante suturas reabsorbibles 3-0 capa por capa. Examinar el espécimen para verificar la integridad de la cápsula tumoral y medir el tamaño del tumor (Figura 5C-D).
3. Manejo post-hepatectomía
- Transfiera al paciente a la sala después de una recuperación exitosa de la anestesia y observe los signos vitales del paciente mediante monitoreo cardíaco ininterrumpido durante el período inicial de recuperación de 24 horas después de la cirugía.
- Implementar terapia antimicrobiana profiláctica por infusión intravenosa durante todo el1er día postoperatorio para reducir las posibles complicaciones sépticas.
- Retirar el cateterismo urinario a las 24 h post-procedimiento. Realizar una tomografía computarizada simple 72 h después de la cirugía (Figura 6). Evacuar los drenajes quirúrgicos 4 días después de la operación sin ascitis masiva ni fugas de bilis.
Resultados
El tiempo total de la operación fue de 150 min, con 50 mL de pérdida de sangre que no requirió transfusión de sangre. El volumen de orina intraoperatorio fue de 500 mL y el volumen de infusión intraoperatoria fue de 800 mL. Alprimer día después de la cirugía, los resultados de los análisis de sangre mostraron un leve aumento de los niveles de transaminasas. La tomografía computarizada de abdomen mostró resección completa del tumor hepático y sin ascitis significativa a los 3 días de la cirugía. El drenaje se retiró el día 4 del postoperatorio. El paciente evolucionó sin complicaciones y fue dado de alta al5º día de la intervención. La muestra patológica macroscópica postoperatoria demostró que el tamaño del tumor era de 1,5 cm x 1,5 cm, lo que confirmó la resección R0 como se muestra en la Tabla 1.
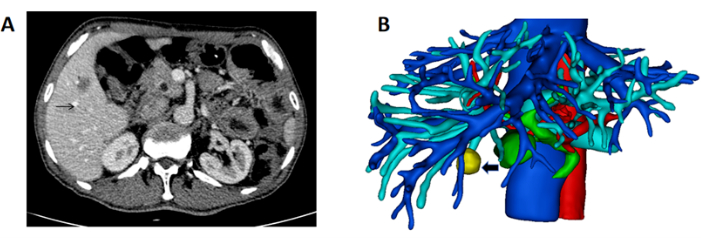
Figura 1: Tomografía computarizada que muestra la masa y reconstrucción en 3D del hígado y la masa. (A) La tomografía computarizada que muestra el tumor ubicado en el hígado derecho (flecha negra que indica masa). (B) Reconstrucción en 3D del hígado, el vaso y la masa (flecha negra que indica la masa). Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Marque la línea de resección en el modelo 3D. (A-D) Reconstruya la estructura del conducto intrahepático y el tumor en 3D, y marque los puntos clave (S1, S2, S3, S4) del borde cortante con un palo pequeño. Dibuje líneas de hígado a lo largo de los puntos clave de la superficie del modelo de hígado virtual y mida la longitud de cada línea (S1-S2 = 9,8 cm, S1-S3 = 7,2 cm, S2-S3 = 10,4 cm, S4-S2 = 8,2 cm, S4-S3 = 6,5 cm). Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Disposición intraoperatoria del cirujano, el paciente y la colocación del trocar. (A) El cirujano que opera está a la derecha, el asistente a la izquierda y el camarógrafo entre las piernas. (B) El procedimiento de hepatectomía laparoscópica se realiza mediante una técnica de cinco puertos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Hilo de seda que marca la línea de resección. (A-D) Durante la cirugía de hígado, use hilo de seda para marcar el borde cortante, prepare hilos de seda de la misma longitud y colóquelos en la posición anatómica en la superficie del hígado. La forma encerrada por el hilo de seda es la línea de corte para el hígado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Resección y muestra del hígado. (A) Cose una banda elástica en el hígado para la tracción. (B) Exponga la vena hepática media en el plano de resección hepática (flecha negra que indica la vena hepática media). (C-D) Resección completa de la masa hepática (flecha negra), la vista transversal que muestra que el margen tumoral está intacto y coincide con el margen planificado antes de la operación. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Tomografía computarizada postoperatoria. La tomografía computarizada indicó una extirpación exitosa del tumor sin acumulación de líquido perihepático en el día 3 del postoperatorio. Haga clic aquí para ver una versión más grande de esta figura.
| Parámetros | Resultados |
| Duración de la cirugía | 150 minutos |
| Pérdida de sangre | 50 mL |
| Función hepática postoperatoria | ALT 222 UI/L, AST 217 UI/L |
| Reexamen postoperatorio de la TC | POD 3 |
| Movimiento del tubo de drenaje | POD 4 |
| Día de alta | POD 5 |
| Tamaño del tumor | 1,5 cm x 1,5 cm |
| Tipo patológico | Adenocarcinoma |
Tabla 1: Evolución quirúrgica del paciente. Abreviaturas: ALT = Alanina Aminotransferasa; AST = aspartato aminotransferasa; POD = Día postoperatorio.
Discusión
Con el desarrollo de la tecnología y la acumulación de experiencia, la resección hepática laparoscópica se ha vuelto cada vez más común y sus indicaciones son casi tan extensas como las de la cirugía abierta. En comparación con la laparotomía, la resección hepática laparoscópica tiene muchas ventajas, como menos dolor, menos complicaciones perioperatorias y una recuperación más rápida 7,8,9. Sin embargo, la resección hepática laparoscópica también enfrenta algunas dificultades inherentes. La falta de percepción táctil y de profundidad, el espacio operativo limitado y el campo visual restringido plantean desafíos para su uso generalizado 10,11,12. Para abordar estos problemas, en los últimos años se han utilizado imágenes de fluorescencia IOUS e ICG como herramientas de navegación en tiempo real. La IOUS, cuando se aplica directamente sobre la superficie hepática, puede mejorar la precisión de la detección y localización de lesiones13,14.
Sin embargo, dado que generalmente es operado por ecografistas, los cirujanos a menudo necesitan pausar la operación para esperarlos, lo que no solo prolonga el tiempo de la operación, sino que también aumenta la dependencia de la tecnología de ultrasonido. Además, en los hígados cirróticos, la IOUS puede malinterpretar los nódulos regenerativos como tumores, lo que lleva a un sobrediagnóstico 15,16,17. ICG, un agente fluorescente inofensivo soluble en agua del infrarrojo cercano, puede ayudar a visualizar las estructuras anatómicas durante la operación a través de visores especiales. Su alta sensibilidad y claro contraste lo convierten en una herramienta popular para la navegación quirúrgica en diversas cirugías hepáticas. Sin embargo, debido a la limitada penetración tisular de la luz infrarroja cercana (hasta 10 mm), su aplicación en la detección de lesiones hepáticas profundas está restringida. Además, una dosis excesiva de ICG puede causar resultados falsos positivos, y el éxito de la tinción tumoral se relaciona con factores como la irrigación sanguínea, la cirrosis hepática y la necrosis 18,19,20. Por lo tanto, el desarrollo de un método innovador, eficiente y preciso para la localización de tumores hepáticos profundos es de gran importancia clínica.
En este estudio, se utilizó el posicionamiento 3D preoperatorio para identificar puntos de referencia anatómicos y calcular el área de resección para pacientes con tumores hepáticos solitarios. Durante la operación, se dispusieron líneas de márgenes de longitudes calculadas por software 3D preoperatorio, y se utilizó hilo de seda para marcar los bordes. Este método proporciona una forma precisa y eficiente en tiempo de navegar por el plano de corte óptimo21. El tiempo quirúrgico en nuestro estudio fue significativamente más corto que el reportado en los estudios que utilizaron hepatectomía guiada por IOUS e ICG. Este enfoque reduce la dependencia de IOUS, lo que ahorra tiempo quirúrgico y reduce los requisitos técnicos y condicionales. Se puede aplicar a diversas situaciones de navegación del tumor hepático, independientemente del tamaño y la profundidad del tumor.
A pesar de sus ventajas, este enfoque tiene limitaciones. En primer lugar, su precisión depende de la calidad de las imágenes preoperatorias; Los artefactos de movimiento o los escaneos de baja resolución pueden comprometer la fidelidad del modelo 3D. En segundo lugar, la técnica asume una anatomía hepática estática, mientras que los movimientos respiratorios o la manipulación quirúrgica pueden cambiar las posiciones del tumor, lo que requiere ajustes en tiempo real. En tercer lugar, la curva de aprendizaje para el funcionamiento del software 3D y la traducción espacial intraoperatoria puede limitar la adopción en cirugía sin formación especializada. Además, el tamaño de la muestra de este estudio es relativamente pequeño, y se necesitan futuros estudios prospectivos a gran escala para verificar aún más la eficacia de este método. El desarrollo de un programa de reconstrucción 3D sencillo y ampliamente aplicable también es un objetivo importante para futuras investigaciones.
Divulgaciones
Los autores no reportan ningún conflicto de intereses.
Agradecimientos
Este trabajo fue apoyado por el Proyecto del Fondo de Ciencia y Tecnología de la Comisión Provincial de Salud de Guizhou (gzwkj2025-300), el Proyecto del Departamento Provincial de Ciencia y Tecnología de Guizhou (Qian Ke He Cheng Guo, LC [2024] 109 ).
Materiales
| Name | Company | Catalog Number | Comments |
| BiClamp LAP | ERBE Company | No.20195-132 | |
| Laparoscopic system | Olympus | VISERA OTV-S400 | |
| Ultrasonic knife | Johnson and Johnson MedTech | ETHICON HARMONIC |
Referencias
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados