Method Article
نهج تحديد الموقع ثلاثي الأبعاد مع استئصال المقطعين بالمنظار الموجه بخيط الحرير لورم الكبد
In This Article
Summary
يمثل استخدام إعادة البناء ثلاثية الأبعاد والمحاكاة الافتراضية في التخطيط قبل الجراحة لاستئصال الكبد تقدما كبيرا في جراحة الأورام. تتيح تقنية 3D-LAST (نهج تحديد المواقع ثلاثي الأبعاد مع الخيط الحريري) لفريقنا إزالة الورم بشكل آمن وفعال ودقيق من خلال الملاحة العملية أثناء الجراحة ، مما يعد باعتماد طبي واسع النطاق.
Abstract
عند إجراء استئصال الكبد لعلاج أورام الكبد ، فإن تحديد هامش الاستئصال بدقة والتأكد من كفاية حمة الكبد المتبقية أمر في غاية الأهمية. في الوقت الحاضر ، يتم استخدام طرق الملاحة بالموجات فوق الصوتية أثناء الجراحة والإندوسيانين الفلوري الأخضر. ومع ذلك، فإن بعض القيود التقنية تحول دون تطبيقها على نطاق واسع. لقد قمنا بتطوير تقنية 3D-LAST لاستئصال ورم الكبد بدقة. تستفيد هذه التقنية من المعالجة اللاحقة للكمبيوتر لاستخراج الميزات من عمليات التصوير المقطعي المحوسب (CT) وإنشاء صور حجمية ، مما يؤدي إلى إنشاء تصورات ثلاثية الأبعاد (ثلاثية الأبعاد). يوفر هذا موردا قيما لاتخاذ القرارات السريرية ، حيث يمكنه عرض الهياكل التشريحية الداخلية المعقدة بوضوح بطريقة بديهية ومجسمة. في هذه الدراسة ، تم إجراء تحديد المواقع ثلاثية الأبعاد قبل الجراحة على المرضى الذين يعانون من ورم كبد واحد لتحديد المعالم التشريحية وحساب نطاق الاستئصال. أثناء العملية الجراحية ، تم إعداد خطوط هامش للأطوال المحسوبة بواسطة برنامج ثلاثي الأبعاد قبل الجراحة ، وتم استخدام خيط الحرير لتمييز الحواف. يوفر هذا النهج طريقة دقيقة وموفرة للوقت لتحديد مستوى القطع الأمثل. الهدف من هذه المقالة هو إثبات جدوى تطبيق 3D-LAST في استئصال القطعات بالمنظار لأورام الكبد. تشير نتائج البحث إلى أن 3D-LAST هي طريقة جديدة آمنة وفعالة وعملية لملاحة الكبد أثناء الجراحة ، ولديها إمكانات كبيرة للترويج على نطاق واسع.
Introduction
يظل استئصال الكبد علاجا أساسيا لأورام الكبد. على مدى العقود الأخيرة ، تطورت الأساليب الجراحية من الاستئصال غير المنتظم إلى الاستئصال التشريحي الدقيق ، مدفوعة بالتقدم في التقنيات المساعدة مثل الموجات فوق الصوتية أثناء الجراحة (IOUS) والتصوير الفلوري باللون الأخضر الإندوسيانين (ICG)1،2. على الرغم من هذه الابتكارات ، فإن تحقيق هوامش الاستئصال المثلى مع الحفاظ على حجم الكبد الوظيفي الكافي لا يزال يمثل تحديا بالغ الأهمية. الهدف العام لتقنية 3D-LAST المقترحة (نهج تحديد المواقع ثلاثي الأبعاد بخيط الحرير) هو توفير طريقة ملاحة دقيقة وفعالة من حيث التكلفة ويمكن الوصول إليها عالميا أثناء الجراحة لاستئصال ورم الكبد ، مما يقلل من الاعتماد على المعدات المتخصصة مع تحسين الدقة المكانية.
ينبع الأساس المنطقي لتطوير 3D-LAST من قيود التقنيات الحالية. IOUS ، على الرغم من قيمته لتوطين الورم في الوقت الفعلي ، إلا أنه يتطلب مصورين بالموجات فوق الصوتية المهرة لتفسير الصور ويكافح مع التصور المكاني ثنائي الأبعاد (2D) ، وغالبا ما يطيل وقت العملية3،4. على الرغم من أن التنقل الفلوري ICG فعال للأورام السطحية ، إلا أنه مقيد بعمق اختراق الأنسجة المحدود (5-10 مم) ، مما يجعله غير موثوق به للآفات العميقة5،6. تعتمد كلتا الطريقتين على أجهزة متخصصة ومكلفة ، مما يحد من اعتمادها في البيئات المحدودة الموارد.
مزايا 3D-LAST على التقنيات الحالية متعددة الأوجه. يتغلب التصور ثلاثي الأبعاد ، المستمد من إعادة بناء التصوير المقطعي المحوسب قبل الجراحة (CT) ، على الغموض المكاني للتصوير ثنائي الأبعاد من خلال توفير إرشادات تشريحية مجسمية. على عكس ICG ، التي تفتقر إلى دقة العمق ، تتيح 3D-LAST تخطيطا دقيقا للاستئصال الحجمي ، مما يقلل من مخاطر الهوامش الإيجابية أو الخسارة المتني المفرطة. علاوة على ذلك ، فإن استخدام خيوط الحرير للتمييز أثناء الجراحة يلغي الحاجة إلى أجهزة التصوير في الوقت الفعلي ، مما يبسط سير العمل ويقلل من التكاليف.
3D-LAST مناسب بشكل خاص للمراكز التي تفتقر إلى البنية التحتية المتقدمة للتصوير أو الخبرة في الملاحة المعقدة أثناء الجراحة. إنه مثالي لاستئصال الورم الفردي حيث يمكن تحديد المعالم التشريحية في التصوير المقطعي المحوسب قبل الجراحة وحيث يتم إعطاء الأولوية لتقليل التعقيد الإجرائي. من خلال معالجة قيود الأساليب الحالية والاستفادة من تقنيات 3D التي تم التحقق من صحتها ، تمثل 3D-LAST تقدما عمليا في تحقيق جراحة الكبد الدقيقة مع القدرة على التكيف السريري الواسع.
عرض الحالة:
تم تشخيص رجل يبلغ من العمر 59 عاما يعاني من عدم الراحة في الجزء العلوي من البطن بورم في الكبد الأيمن 2.7 سم × 1.6 سم. تم تشخيص المريض سابقا بسرطان غدي في المعدة وخضع لاستئصال المعدة الجذري لسرطان المعدة ، تلاه العلاج الكيميائي الروتيني. لم يتم العثور على ورم خبيث خارج الكبد في الفحص المقطعي المحوسب المعزز بالتباين قبل الجراحة. CA19-9 و CA15-3 و CA72-4 و AFP و CEA كانت طبيعية.
Protocol
تمت الموافقة على الدراسة من قبل لجنة المراجعة في مستشفى غرب الصين بجامعة سيتشوان. تم الحصول على موافقة مستنيرة من المريض قبل الجراحة.
1. التحضير قبل الجراحة
- الحصول على فحوصات التصوير المقطعي المحوسب عالية الدقة لكبد المريض بتنسيق DICOM (الشكل 1 أ).
- قم بتشغيل برنامج Mimics ، وإنشاء مشروع جديد ، واستيراد ملفات DICOM لضمان تحميل جميع بيانات الصورة بشكل صحيح لإعادة بناء وتحليل 3D.
- إعادة بناء الهيكل ثلاثي الأبعاد للكبد والأوعية والورم. ضع علامة على الكبد باللون الوردي ، والوريد البابي باللون الأزرق ، والشريان باللون الأحمر ، والوريد الكبدي والوريد الأجوف السفلي باللون الأزرق ، والورم باللون الأصفر (الشكل 1 ب).
- ضع ثلاث عصي افتراضية صغيرة على نموذج الكبد ثلاثي الأبعاد واحصل على أربع نقاط رئيسية (S1 ، S2 ، S3 ، S4) على سطح الكبد (الشكل 2 أ - ب).
- تعمل هذه العصي الافتراضية كمعالم رقمية ، وتوجه الجراح في تحديد الموقع الدقيق واتجاه القطع المقصود. ضع علامة العصا الافتراضية لنقطة الاستئصال على بعد 1 سم من هامش الورم ونقطة منتصف حافة الكبد في أسفل المرارة.
ملاحظة: من خلال تحديد هذه النقاط الرئيسية ، يمكن للجراحين التأكد من أنهم يظلون يركزون على المنطقة المستهدفة أثناء الجراحة ، مما يقلل من خطر تلف الأنسجة غير الضروري.
- تعمل هذه العصي الافتراضية كمعالم رقمية ، وتوجه الجراح في تحديد الموقع الدقيق واتجاه القطع المقصود. ضع علامة العصا الافتراضية لنقطة الاستئصال على بعد 1 سم من هامش الورم ونقطة منتصف حافة الكبد في أسفل المرارة.
- قم بتوصيل النقاط الرئيسية الأربع بخطوط على سطح الكبد وقم بقياس أطوالها (S1-S2 = 9.8 سم ، S1-S3 = 7.2 سم ، S2-S3 = 10.4 سم ، S4-S2 = 8.2 سم ، S4-S3 = 6.5 سم) كما هو موضح في الشكل 2C-D. تمثل هذه الخطوط مسار الاستئصال المقترح ، وتوجه الجراح في تصور شكل ومحيط الكبد بعد الاستئصال.
- قم بقياس طول كل سطر بدقة لضمان الدقة والاتساق. هذا القياس مهم لأنه يسمح للجراحين بإعداد خيوط حريرية بنفس الطول بالضبط ، والتي سيتم استخدامها أثناء الجراحة لتوجيه قطع الكبد.
2. الإجراء الجراحي
- ضع المريض مستلقا ، مع انتشار ساقيه ومائلتين إلى اليمين (الشكل 3 أ). إدارة التخدير العام القياسي، بما في ذلك التنبيب الرغامي والتهوية الخاضعة للرقابة.
- تطهير الجلد بمقشر 0.5٪ من اليود 3x على منطقة الاتصال بين الحلمة ، والارتفاق العانة ، والخطوط الوسطى الإبطية اليمنى ، والخطوط الوسطى الترقوة اليسرى.
- رتب الفريق الجراحي مع الجراح على اليمين والمساعد على اليسار. ضع الكاميرا في منتصف مواقع المبازل ، مع وضع حامل الكاميرا في المنتصف أيضا.
- قم بعمل شق 12 مم أسفل السرة مثل ثقب بالمنظار (H1) ، شق منحني 12 مم وواحد 5 مم (H2 و H3) كفتحات تشغيل رئيسية ، وآخر 12 مم وواحد 5 مم (H4 و H5) كفتحات تشغيل مساعدة (الشكل 3 ب).
- أدخل خمسة مبازل (12 مم ، 12 مم ، 12 مم ، 5 مم ، و 5 مم) في شقوق كما هو موضح في الشكل 3 ب. قم بتشغيل نظام الصفاق الرئوي وحقن غاز ثاني أكسيد الكربون بنسبة 100٪ من خلال المبزل للحفاظ على الصفاق الرئوي عند ضغط حوالي 12 مم زئبق.
- قم بإجراء فحص استكشافي لتجويف البطن ، بدءا من الشرسوفين الأيسر والتحرك إلى اليمين إلى قصور المعدة ، للكشف عن أي وجود للاستسقاء وتليف الكبد والورم الخبيث.
- التصاقات البطن الحرة ، وفصل الرباط المستدير للكبد ، وتحرير الرباط الكبدي الأيمن والالتصاقات ، وتعريض جزء الكبد V بالكامل باستخدام سكين بالموجات فوق الصوتية.
- استخدم سكينا بالموجات فوق الصوتية لتشريح مثلث المرارة ، والكشف عن قناة المرارة والشريان. بعد ذلك ، قم بربط هذه الهياكل بمشابك صغيرة لقفل الدماغية قبل استئصال المرارة.
- تحضير ثلاثة خيوط حريرية بأطوال S1-S2 = 9.8 سم ، S1-S3 = 7.2 سم ، و S2-S3 = 10.4 سم على التوالي. تقع النقطة S4 عند عنق المرارة ، لذا لا تحضر خيوطا حريرية ل S4-S2 = 8.2 سم و S4-S3 = 6.5 سم.
- ضع خيوط الحرير الثلاثة في الموضع التشريحي على سطح الكبد ، بما يتوافق مع مسار الاستئصال المخطط له قبل الجراحة ، كما هو موضح في الشكل 4. باستخدام خيوط الحرير كدليل مادي ، يمكن للجراحين تصور مسار الاستئصال المخطط له واتباعه بدقة أكبر أثناء الجراحة.
ملاحظة: تعمل هذه الخطوة على سد الفجوة بين التخطيط الافتراضي والإجراء الجراحي الفعلي. - استخدم سكينا كهربائيا لكي الكبد عن طريق قطع أقلام التحديد على طول خيط الحرير على سطح الكبد (الشكل 4 د) وخياطة شريط مطاطي على الكبد للجر (الشكل 5 أ).
- استخدم سكينا بالموجات فوق الصوتية لتمرير حمة الكبد على طول خطوط العلامة. قم بقطع الأوعية التي تصادفها قص المنزل ، واستخدم شفاطة لشفط الدم ، واستخدم ملقطا ثنائي القطب لوقف النزيف (الشكل 5 ب).
- ضع العينة في كيس وقم بعمل شق 4 سم بواسطة مشرط في الجزء العلوي من البطن لإزالة العينة. تأكد من عدم وجود نزيف نشط في تجويف البطن ، ووضع مواد مرقئ على سطح قطع الكبد وأنبوب تصريف واحد يخرج من أسفل البطن الأيمن.
- قم بإزالة شقوق المبزل والخياطة بواسطة 3-0 خيوط قابلة للامتصاص طبقة تلو الأخرى. افحص العينة للتحقق من سلامة كبسولة الورم وقياس حجم الورم (الشكل 5C-D).
3. إدارة ما بعد استئصال الكبد
- نقل المريض إلى الجناح بعد التعافي الناجح من التخدير ومراقبة العلامات الحيوية للمريض باستخدام مراقبة القلب دون انقطاع خلال فترة التعافي الأولية البالغة 24 ساعة بعد الجراحة.
- تنفيذ العلاج الوقائي المضاد للميكروبات عن طريق التسريب الوريدي طوال يومما بعد الجراحة الأول لتقليل مضاعفات الإنتان المحتملة.
- إزالة القسطرة البولية بعد 24 ساعة من الإجراء. قم بإجراء فحص التصوير المقطعي المحوسب العادي بعد 72 ساعة من الجراحة (الشكل 6). إخلاء المصارف الجراحية بعد 4 أيام من العملية دون استسقاء هائل وتسرب صفراوي.
النتائج
كان إجمالي وقت العملية 150 دقيقة ، مع 50 مل من فقدان الدم الذي لا يتطلب نقل الدم. كان حجم البول أثناء الجراحة 500 مل ، وكان حجم التسريب أثناء الجراحة 800 مل. فياليوم الأول بعد الجراحة ، أظهرت نتائج فحص الدم زيادة طفيفة في مستويات الترانساميناز. أظهر التصوير المقطعي المحوسب للبطن استئصالا كاملا لورم الكبد ولم يكن هناك استسقاء كبير بعد 3 أيام من الجراحة. تمت إزالة الصرف في اليوم 4 بعد الجراحة. كان المريض قد خضع لدورة هادئة بعد الجراحة وخرج في اليومالخامس بعد العملية. أظهرت العينة المرضية الإجمالية بعد الجراحة أن حجم الورم كان 1.5 سم × 1.5 سم ، مما يؤكد استئصال R0 كما هو موضح في الجدول 1.
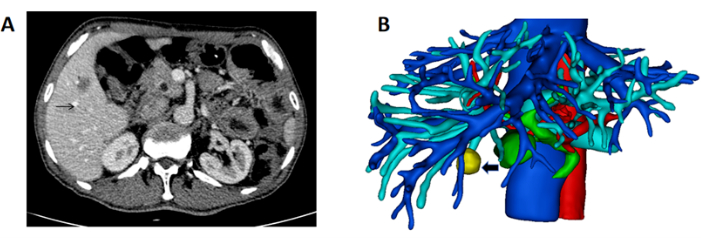
الشكل 1: التصوير المقطعي المحوسب يوضح الكتلة وإعادة بناء 3D للكبد والكتلة. (أ) التصوير المقطعي المحوسب الذي يظهر الورم الموجود في الكبد الأيمن (السهم الأسود يشير إلى الكتلة). (ب) إعادة بناء ثلاثية الأبعاد للكبد والأوعية الدموية والكتلة (سهم أسود يشير إلى الكتلة). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: ضع علامة على خط الاستئصال في النموذج ثلاثي الأبعاد. (A-D) أعد بناء بنية القناة داخل الكبد والورم في 3D ، وحدد النقاط الرئيسية (S1 ، S2 ، S3 ، S4) لحافة القطع بعصا صغيرة. ارسم خطوط الكبد على طول النقاط الرئيسية على سطح نموذج الكبد الافتراضي وقم بقياس طول كل خط (S1-S2 = 9.8 سم ، S1-S3 = 7.2 سم ، S2-S3 = 10.4 سم ، S4-S2 = 8.2 سم ، S4-S3 = 6.5 سم). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: التخطيط أثناء الجراحة لوضع الجراح والمريض والمبزل. (أ) جراح العملية على اليمين ، والمساعد على اليسار ، والمصور بين الساقين. (ب) يتم إجراء عملية استئصال الكبد بالمنظار باستخدام تقنية ذات خمسة منافذ. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: خيط حرير يشير إلى خط الاستئصال. (A-D) أثناء جراحة الكبد ، استخدم خيطا حريريا لتمييز حافة القطع ، وقم بإعداد خيوط الحرير من نفس الطول ، ووضعها في الوضع التشريحي على سطح الكبد. الشكل المحاط بخيط الحرير هو خط القطع للكبد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: استئصال الكبد والعينة. (أ) خياطة شريط مطاطي على الكبد للجر. (ب) كشف الوريد الكبدي الأوسط في مستوى استئصال الكبد (سهم أسود يشير إلى الوريد الكبدي الأوسط). (C-D) استئصال كامل لكتلة الكبد (السهم الأسود) ، وعرض المقطع العرضي الذي يظهر هامش الورم سليما ويتطابق مع الهامش المخطط له قبل الجراحة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: الأشعة المقطعية بعد الجراحة. أشار الفحص المقطعي المحوسب إلى إزالة الورم بنجاح دون تراكم السوائل حول الكبد في اليوم 3 بعد الجراحة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| البارامترات | النتائج |
| مدة الجراحة | 150 دقيقة |
| فقدان الدم | 50 مل |
| وظائف الكبد بعد الجراحة | ALT 222 وحدة دولية / لتر ، ASTM 217 وحدة دولية / لتر |
| إعادة فحص التصوير المقطعي المحوسب بعد الجراحة | POD 3 |
| حركة أنبوب الصرف | POD 4 |
| يوم الخروج | POD 5 |
| حجم الورم | 1.5 سم × 1.5 سم |
| النوع المرضي | السرطان الغدي |
الجدول 1: النتائج الجراحية للمريض. الاختصارات: ALT = Alanine Aminotransferase; AST = أسبارتات أمينوترانسفيراز; POD = يوم ما بعد الجراحة.
Discussion
مع تطور التكنولوجيا وتراكم الخبرة ، أصبح استئصال الكبد بالمنظار أكثر شيوعا ، ومؤشراته واسعة النطاق تقريبا مثل تلك الخاصة بالجراحة المفتوحة. بالمقارنة مع شق البطن ، فإن استئصال الكبد بالمنظار له العديد من المزايا ، مثل ألم أقل ، ومضاعفات أقل في الفترة المحيطة بالجراحة ، والتعافي بشكل أسرع7،8،9. ومع ذلك ، يواجه استئصال الكبد بالمنظار أيضا بعض الصعوبات المتأصلة. يشكل الافتقار إلى الإدراك اللمسي والعمق ، ومساحة التشغيل المحدودة ، والمجال البصري المحدود تحديات لاستخدامه على نطاقواسع 10،11،12. لمعالجة هذه المشكلات ، تم استخدام التصوير الفلوري IOUS و ICG كأدوات ملاحة في الوقت الفعلي في السنوات الأخيرة. IOUS ، عند تطبيقه مباشرة على سطح الكبد ، يمكن أن يحسن دقة اكتشاف الآفة وتوطينها13،14.
ومع ذلك ، نظرا لأنه يتم تشغيله عادة بواسطة أخصائيي الموجات فوق الصوتية ، غالبا ما يحتاج الجراحون إلى إيقاف العملية مؤقتا لانتظارهم ، مما لا يطيل وقت العملية فحسب ، بل يزيد أيضا من الاعتماد على تقنية الموجات فوق الصوتية. بالإضافة إلى ذلك ، في الكبد التليف ، قد يسيء IOUS تفسير العقيدات التجديدية على أنها أورام ، مما يؤدي إلى الإفراط في التشخيص15،16،17. يمكن أن يساعد ICG ، وهو عامل فلورسنت قريب من الأشعة تحت الحمراء غير ضار قابل للذوبان في الماء ، في تصور الهياكل التشريحية أثناء العملية من خلال نطاقات خاصة. حساسيته العالية وتباينه الواضح يجعله أداة شائعة للملاحة الجراحية في جراحات الكبد المختلفة. ومع ذلك ، نظرا لمحدودية تغلغل الأنسجة لضوء الأشعة تحت الحمراء القريبة (حتى 10 مم) ، فإن تطبيقه في الكشف عن آفات الكبد العميقة الجذور مقيد. علاوة على ذلك ، قد تؤدي الجرعة الزائدة من ICG إلى نتائج إيجابية كاذبة ، ويرتبط نجاح تلطيخ الورم بعوامل مثل إمدادات الدم وتليف الكبد والنخر18،19،20. لذلك ، فإن تطوير طريقة مبتكرة وفعالة ودقيقة لتوطين أورام الكبد العميقة الجذور له أهمية سريرية كبيرة.
في هذه الدراسة ، تم استخدام تحديد المواقع ثلاثية الأبعاد قبل الجراحة لتحديد المعالم التشريحية وحساب منطقة الاستئصال للمرضى الذين يعانون من أورام الكبد الانفرادية. أثناء العملية ، تم ترتيب خطوط الهامش للأطوال المحسوبة بواسطة برنامج ثلاثي الأبعاد قبل الجراحة ، وتم استخدام خيط الحرير لتمييز الحواف. توفر هذه الطريقة طريقة دقيقة وفعالة من حيث الوقت للتنقل في مستوى القطع الأمثل21. كان وقت العملية في دراستنا أقصر بكثير من ذلك الذي تم الإبلاغ عنه في الدراسات التي استخدمت IOUS واستئصال الكبد الموجه ب ICG. يقلل هذا النهج من الاعتماد على IOUS ، مما يوفر الوقت الجراحي ويقلل من المتطلبات الفنية والشرطية. يمكن تطبيقه على حالات التنقل المختلفة في أورام الكبد ، بغض النظر عن حجم الورم وعمقه.
على الرغم من مزاياه ، فإن هذا النهج له قيود. أولا ، تعتمد دقتها على جودة التصوير قبل الجراحة. قد تؤدي القطع الأثرية للحركة أو عمليات المسح منخفضة الدقة إلى الإضرار بدقة النموذج ثلاثي الأبعاد. ثانيا ، تفترض هذه التقنية تشريح الكبد الثابت ، في حين أن حركات الجهاز التنفسي أو التلاعب الجراحي يمكن أن تغير مواضع الورم ، مما يستلزم تعديلات في الوقت الفعلي. ثالثا ، قد يحد منحنى التعلم لتشغيل البرامج ثلاثية الأبعاد والترجمة المكانية أثناء الجراحة من التبني في الجراحة دون تدريب متخصص. بالإضافة إلى ذلك ، فإن حجم عينة هذه الدراسة صغير نسبيا ، وهناك حاجة إلى دراسات مستقبلية واسعة النطاق للتحقق من فعالية هذه الطريقة بشكل أكبر. يعد تطوير برنامج إعادة بناء ثلاثي الأبعاد بسيط وقابل للتطبيق على نطاق واسع أيضا هدفا مهما للبحث المستقبلي.
Disclosures
أفاد المؤلفون بعدم وجود تضارب في المصالح.
Acknowledgements
تم دعم هذا العمل من قبل مشروع صندوق العلوم والتكنولوجيا التابع للجنة الصحة بمقاطعة قويتشو (gzwkj2025-300) ، ومشروع إدارة العلوم والتكنولوجيا بمقاطعة قويتشو (Qian Ke He Cheng Guo ، LC [2024] 109).
Materials
| Name | Company | Catalog Number | Comments |
| BiClamp LAP | ERBE Company | No.20195-132 | |
| Laparoscopic system | Olympus | VISERA OTV-S400 | |
| Ultrasonic knife | Johnson and Johnson MedTech | ETHICON HARMONIC |
References
- Fan, S. T., et al. Continuous improvement of survival outcomes of resection of hepatocellular carcinoma: a 20-year experience. Ann Surg. 253 (5), 745-758 (2011).
- Torzilli, G., et al. "Radical but conservative" is the main goal for ultrasonography-guided liver resection: prospective validation of this approach. J Am Coll Surg. 201 (5), 517-528 (2005).
- Torzilli, G., et al. Contrast-enhanced intraoperative ultrasonography during surgery for hepatocellular carcinoma in liver cirrhosis: is it useful or useless? A prospective cohort study of our experience. Ann Surg Oncol. 14 (4), 1347-1355 (2007).
- Leen, E., et al. Potential value of contrast-enhanced intraoperative ultrasonography during partial hepatectomy for metastases: an essential investigation before resection. Ann Surg. 243 (2), 236-240 (2006).
- Ishizawa, T., et al. Real-time identification of liver cancers by using indocyanine green fluorescent imaging. Cancer. 115 (12), 2491-2504 (2009).
- Gotoh, K., et al. A novel image-guided surgery of hepatocellular carcinoma by indocyanine green fluorescence imaging navigation. J Surg Oncol. 100 (7), 75-79 (2009).
- Nguyen, K. T., Gamblin, T. C., Geller, D. A. World review of laparoscopic liver resection-2,804 patients. Ann Surg. 250 (5), 831-841 (2009).
- Abu Hilal, M., et al. The Southampton Consensus Guidelines for laparoscopic liver surgery: from indication to implementation. Ann Surg. 268 (1), 11-18 (2018).
- Ciria, R., Cherqui, D., Geller, D. A., Briceno, J., Wakabayashi, G. Comparative short-term benefits of laparoscopic liver resection: 9000 cases and climbing. Ann Surg. 263 (4), 761-777 (2016).
- Schneider, C., et al. Comparison of manual and semi-automatic registration in augmented reality image-guided liver surgery: a clinical feasibility study. Surg Endosc. 34 (10), 4702-4711 (2020).
- Lwin, T. Z., Sicklick, J. K., Hoffman, R. M., Bouvet, M. Fluorescence-guided laparoscopic hepatectomy. Ann Laparosc Endosc Surg. 1, 10(2016).
- Ziogas, I. A., Tsoulfas, G. Advances and challenges in laparoscopic surgery in the management of hepatocellular carcinoma. World J Gastrointest Surg. 9 (12), 233-245 (2017).
- Cai, X., et al. Does using indocyanine green fluorescence imaging for tumors help in determining the safe surgical margin in real-time navigation of laparoscopic hepatectomy? A retrospective study. Ann Surg Oncol. 30 (6), 1981-1987 (2023).
- Nishino, H., et al. Real-time navigation for liver surgery using projection mapping with indocyanine green fluorescence: development of the novel medical imaging projection system. Ann Surg. 267 (6), 1134-1140 (2018).
- Ishizawa, T., et al. Impact of intraoperative ultrasonography on surgical strategy and prognosis after hepatic resection for hepatocellular carcinoma. Ann Surg Oncol. 15 (13), 3665-3673 (2008).
- Solbiati, L., et al. Percutaneous sono-guided radio-frequency ablation of liver metastases: a multi-centre study. Eur Radiol. 11 (10), 1947-1954 (2001).
- Yang, T., et al. The role of intraoperative ultrasonography in laparoscopic liver resection for hepatocellular carcinoma: a propensity score-matched analysis. Surg Endosc. 34 (5), 2137-2144 (2020).
- van Manen, L., et al. A practical guide for the use of indocyanine green and methylene blue in fluorescence-guided abdominal surgery. J Surg Oncol. 118 (2), 283-300 (2018).
- Yoo, K. Y., et al. Intravenously administered indocyanine green may cause falsely high near-infrared cerebral oximetry readings. Anesthesiology. 120 (6), 1374-1379 (2014).
- Kimura, F., et al. Clinical impact of indocyanine green fluorescence imaging for liver tumor surgery: a single-center experience. Surgery. 161 (2), 475-481 (2017).
- Zhang, Z. H., Feng, Q. B., Jiang, C., Huang, J. W., Li, J. X. Three-dimensional location approach with silk thread guided hepatectomy for liver tumor. World J Gastroenterol. 31 (8), 10262(2025).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved