Method Article
Эффективная ретровирусная трансдукция и конкурентный хоуминг для исследования GPCR-опосредованной локализации Т-клеток в различных тканевых микросредах
В этой статье
Резюме
Мы представляем усовершенствованные протоколы ретровирусной трансдукции рецепторов транспорта и конкурентного хоуминга для изучения рецептор-опосредованного позиционирования лимфоцитов, специфичного для органов и микроокружения. Этот метод дает ценную информацию о механизмах транспортировки иммунных клеток и имеет потенциальное применение в будущих фундаментальных и терапевтических исследованиях.
Аннотация
Понимание того, как экспрессия рецептора, сопряженного с G-белком (GPCR), влияет на позиционирование клеток в различных тканевых микроокружениях, имеет важное значение для выяснения механизмов транспортировки иммунных клеток. Мы представляем конкурентный хоуминговый анализ, предназначенный для изучения GPCR-опосредованной локализации Т-клеток в органах, экспрессирующих родственные им хемоаттрактантные лиганды, применимый как для краткосрочных, так и для долгосрочных исследований. Этот подход включает в себя усовершенствованный протокол рекомбинантной трансдукции Т-клеток вирусом мышиных стволовых клеток (MSCV) для экспрессии интересующего GPCR или контрольной конструкции с последующим конкурентным хоумингом у мышей-реципиентов. Распределение клеток по различным органам анализируется с помощью проточной цитометрии и/или конфокальной микроскопии. В краткосрочных экспериментах (10-12 ч) конфокальная микроскопия выявила различные закономерности локализации клеток, в том числе в альвеолах, подслизистых оболочках бронхов, венозных участках и интерстиции в легких, а также в эпителии, выстилающем трахею, желудок и рог матки. В долгосрочных исследованиях (1-7 недель) проточная цитометрия позволила получить представление о преимущественном накоплении клеток, выявив динамические изменения и потенциальное созревание или изменение положения в тканях с течением времени. Этот конкурентный анализ самонаведения является надежным инструментом для изучения GPCR-опосредованного позиционирования клеток, предлагая ценную информацию о тканеспецифическом распределении и потенциальном применении в иммунологии и терапевтических исследованиях.
Введение
Рецепторы, сопряженные с G-белком (GPCR), играют основополагающую роль в регулировании различных клеточных процессов, включая передачу сигналов, нейротрансмиссию, гормональную регуляциюи миграцию иммунных клеток. Они играют решающую роль в пространственно-временном контроле миграции и локализации лимфоцитов2. Во время фазы прайминга иммунных реакций местное микроокружение и клеточные взаимодействия побуждают Т-лимфоциты экспрессировать уникальный набор молекул адгезии и хемокиновых рецепторов, известных как самонаводящиеся рецепторы. Эта адаптация позволяет Т-клеткам, испытывающим антигены, взаимодействовать с органоспецифическими эндотелиальными клетками (ЭК) и мигрировать в различные ткани-мишени. Способность Т-клеток приобретать тканевый тропизм жизненно важна для эффективных реакций на отзыв, особенно в контексте рецидивирующих инфекций, поражающих один и тот же орган 3,4.
GPCR направляют иммунные клетки к определенным тканям и органам, где они выполняют критически важные функции, такие как направление CD8+ Т и NK-клеток к опухолевым участкам для цитотоксического действия или помощь CD4+ Т-клеткам в организации иммунных реакций, поддерживая активацию других иммунных клеток. Понимание того, как GPCR направляют Т-клетки к их точному местоположению, имеет важное значение для продвижения таргетной иммунотерапии 5,6. Проблема, однако, заключается в моделировании этих сложных взаимодействий in vitro, поскольку одновременная репликация как пространственно ограниченных сигналов, так и направленных хемотаксических сигналов затруднена.
Выяснение роли специфических лейкоцитарных рецепторов также часто является сложной задачей из-за их ограниченной частоты экспрессии в эндогенных популяциях и того факта, что эти рецепторы обычно украшают различные типы клеток. Такая сложность затрудняет выделение роли специфического рецептора из других механизмов, специфичных для клеточного подмножества. В идеале методы должны сравнивать сходные популяции, отличающиеся только рецептором, представляющим интерес, чтобы обеспечить четкое понимание.
Чтобы преодолеть эти проблемы, мы приняли конкурентный хоуминг-анализ, в котором используется рекомбинантная ретровирусная трансдукция MSCV для эффективной экспрессии GPCR в Т-клетках. Ретровирусные векторы MSCV, которые сочетают в себе элементы векторов MESV на основе вируса миелопролиферативной саркомы (PCMV) и векторов LN на основе вируса мышиной лейкемии Moloney (MMLV), включают расширенный гибридный упаковочный сигнал, полученный из векторов LN7. Эта модификация повышает эффективность доставки генов, позволяя проводить как краткосрочные, так и долгосрочные исследования локализации Т-клеток in vivo. Используя ретровирусные частицы с высоким титром и конфокальную микроскопию, этот подход позволяет точно визуализировать позиционирование Т-клеток и взаимодействия в сложных тканевых средах. Мы представляем подробные протоколы ретровирусной трансдукции тракционных рецепторов и проведения внутренне контролируемых (так называемых конкурентных) хоуминговых анализов для изучения рецептор-опосредованного органо- и микроокруженного позиционирования лимфоцитов. Общая цель этого метода заключается в том, чтобы получить ценную информацию о механизмах транспортировки иммунных клеток и обеспечить возможность их применения в будущем как в фундаментальных исследованиях, так и в терапевтических разработках.
протокол
Все мыши в этом исследовании содержались в специфических свободных от патогенов (SPF) учреждениях в системе здравоохранения Пало-Альто по делам ветеранов (VAPAHCS). Мыши B6/SJL Prprc Pep3BoyJ (CD45.1), C57B6/J (CD45.2) и Rag1-/- были приобретены в Jackson Laboratories. Хотя мы использовали PepBoy для получения клеток CD45.1, мы рекомендуем использовать JAXBoy (C57BL/6J-Ptprcem6Lutzy/J). JAXBoy — это полностью коизогенный штамм, полученный с помощью CRISPR вместо традиционного обратного скрещивания, что улучшает генетическую стабильность. Исторически сложилось так, что исследования, маркированные аллотипом CD45 на мышах PepBoy (CD45.1), которые не являются полностью генетическими, включали контрольные анализы хоуминга и рециркуляции со сравнением дикого типа (WT/WT) для учета потенциальной изменчивости. Теперь, когда мыши JAXBoy доступны в качестве полностью изогенной альтернативы, эти дополнительные средства контроля могут больше не требоваться. Исследователи все же должны учитывать, что различия между вариантами CD45.1 и CD45.2, такие как их роль в качестве протеинтирозинфосфатаз, могут влиять на клеточное поведение и паттерны хоуминга. Все протоколы, обсуждаемые в тексте и ниже, были одобрены или соответствуют рекомендациям аккредитованного Департамента медицины лабораторных животных и Административной группы по уходу за лабораторными животными в системе здравоохранения VA Palo Alto Health Care System (VAPAHCS). Животных приносили в жертву с использованием утвержденных процедур. В эксперименты были включены мыши обоего пола в возрасте 8-12 недель.
1. Векторная подготовка МСЦВ
- Приобретите ретровирусный вектор MSCV-IRES-Thy1.1 с кодирующей областью интересующего гена мыши (GOI) или ORF_Stuffer (отрицательный контроль ORF)
ПРИМЕЧАНИЕ: Эта конструкция включает в себя поверхностный маркер Thy1.1 вместе с интересующим геном GPCR. Линкер с внутренним сайтом входа рибосом (IRES) обеспечивает совместную экспрессию GPCR с Thy1.1, облегчая идентификацию трансдуцированных клеток с помощью проточной цитометрии или очистки и выделения с помощью магнитных шариков. Это особенно полезно, когда антитела, специфичные к GPCR, недоступны, как это часто бывает в случае плохо изученных GPCR. - Приобретайте плазмиду MSCV в бактериальной форме и культуре путем инокуляции бульона Лурии-Бертани (LB) с добавлением соответствующего антибиотика, подобранного на основе гена резистентности, кодируемого плазмидой (например, ампициллином, канамицином или хлорамфениколом). Среда LB состоит из триптона (10 г/л), дрожжевого экстракта (5 г/л) и NaCl (10 г/л), доведенных до pH 7,0 и стерилизованных автоклавированием. Инкубируйте культуру при температуре 37 °C в встряхивающем инкубаторе (220 об/мин) в течение ночи.
- Подготовьте плазмиды с использованием стандартных методов молекулярной биологии с помощью набора для подготовки ДНК.
- После выделения ДНК измерьте концентрацию ДНК с помощью спектрофотометра и приготовьте рабочие растворы плазмид в концентрации 1 мкг/мкл. Храните плазмиды при температуре -20 °C для дальнейшего использования.
2. Создание культуры упаковочной клеточной линии
ПРИМЕЧАНИЕ: Мы использовали клетки Platinum E (Plat-E) от Cell Biolabs. Клетки Plat-E представляют собой клеточную линию на основе 293T с промотором EF1α, который обеспечивает стабильную и высокопродуктивную экспрессию ретровирусных структурных белков (генов gag, pol и env), что позволяет упаковывать ретровирусы с помощью одной трансфекции плазмиды8. Хотя могут быть использованы и другие клеточные линии, такие как NIH-3T3 или 293T, мы не тестировали эти альтернативы.
- Приготовьте клеточную среду Plat-E путем добавления DMEM, 10% FBS, 1% пенициллина/стрептомицина, бластицидина (10 мкг/мл) и пуромицина (1 мкг/мл). Используйте бластицидин и пуромицин для поддержания клеток, но исключите их во время и после трансфекции.
- Пластинчатые клетки Plat-E поставляются замороженными в 1,0 мл при >3 x 106 клеток/мл в DMEM, 20% FBS и 10% DMSO. Быстро разморозьте их на водяной бане при температуре 37 °C. Перенесите все размороженные клетки в коническую пробирку объемом 15 мл с питательной средой Plat-E.
- Центрифугируйте при 450 x g в течение 5 мин при 4 °C. Ресуспендируйте клеточную таблетку в 1 мл среды Plat-E путем осторожного пипетирования до получения одноклеточной суспензии.
- Добавьте 9 мл среды Plat-E в чашку для культур диаметром 10 см, затем перенесите 1 мл ресуспендированных клеток в чашку. Подтвердите, что размороженные клетки жизнеспособны, смешав равное количество клеточной суспензии и Trypan Blue и подсчитав жизнеспособные (неокрашенные) и мертвые (окрашенные в синий цвет) клетки с помощью гемоцитометра или счетчика клеток, стремясь к жизнеспособности >70%.
- Инкубируйте клетки при температуре 37 °C в увлажненном инкубаторе с 5%CO2. Не меняйте носитель в течение первых 3 дней; Нормально наблюдать плавающие и мертвые клетки после первой оттепели.
- Когда конфлюенция клеток достигнет 85%-90%, промойте с помощью DMEM/PBS Ca-/Mg-. Отделите клетки с помощью 2 мл 0,05% трипсина/0,5 мМ ЭДТА и инкубируйте в течение 3 минут при 37 °C. Добавьте 8 мл среды Plat-E, соберите клетки в коническую пробирку объемом 15 мл и центрифугируйте при 450 x g в течение 5 минут при 4 °C.
- Разделите в соотношении поверхности 1:10 или 1:5 (т.е. засейте новые тарелки с 1/10 или 1/5 от общего объема от исходного блюда). Ресуспендировать в конечном объеме 10 мл среды Plat-E и инкубировать при 37 °C в увлажненном инкубаторе с 5%CO2.
- Остальные клетки аликвотировать в 1 мл FBS с 10% ДМСО и заморозить при -80 °С, а затем в жидком азоте для длительного использования.
ПРИМЕЧАНИЕ: Обрабатывайте клетки, как описано выше, когда их слияние близко к 85%. Чтобы поддерживать оптимальное здоровье клеток, избегайте чрезмерной конфлюенции и стремитесь к 3-дневным сплитам с разведением 1:10. Если рост замедляется, используйте свежий аликвоту. Производительность клеток обычно снижается при последующих пассажах. Для достижения наилучших результатов мы рекомендуем использовать клетки для трансфекции между проходами 4 и 15.
3. Производство трансдуцированных клеток
- День 1: Seed Plat E клетки
ПРИМЕЧАНИЕ: Рассчитайте необходимое количество ячеек и пластин Plat E. Мы использовали 1 мл вирусной надосадочной жидкости на лунку в 24-луночном планшете для трансфекции клеток в 2 раза. Обычно мы используем примерно две 10-сантиметровые трансфицированные чашки Петри с клетками Plate-E на 24-луночный планшет с Т-клетками в культуре.- Начните с покрытия 10-сантиметровых планшетов для культивирования тканей 50 мл поли-D-лизина 50 мкл в стерильной воде. Выдерживать при комнатной температуре в течение 45 минут. Промойте 2 раза стерильным PBS Ca-/Mg, чтобы убедиться, что не осталось остатков.
ПРИМЕЧАНИЕ: Мы рекомендуем наносить покрытие на планшеты, так как клетки Plat-E имеют тенденцию отделяться после трансфекции, что приводит к снижению производительности клеток и снижению выработки титров вирусов. - Отделите клетки Plat-E, как описано выше на шаге 2.6, и проведите анализ исключения трипанового синего для обеспечения жизнеспособности. Смешайте равное количество клеточной суспензии и Трипана Синего. Подсчитайте жизнеспособные (неокрашенные) и мертвые (окрашенные в синий цвет) клетки с помощью гемоцитометра/счетчика клеток. Засейте 3 x 10⁶ живые клетки в 10-сантиметровой тканевой культуре чашки Петри с безантибиотиковой средой Plat-E.
ПРИМЕЧАНИЕ: Засеянные пластины должны достичь 85%-90% слияния на следующий день. Если этого не достигнуто, рассмотрите возможность использования другой ячейки аликвоты. Регулируйте густоту посева в зависимости от сроков нанесения покрытия; Для вечерней облицовки можно использовать 3,5 х 106 ячеек.
- Начните с покрытия 10-сантиметровых планшетов для культивирования тканей 50 мл поли-D-лизина 50 мкл в стерильной воде. Выдерживать при комнатной температуре в течение 45 минут. Промойте 2 раза стерильным PBS Ca-/Mg, чтобы убедиться, что не осталось остатков.
- День 2: Трансфекция Plat-E клеток и покрытие Т-клеток анти-CD3 и анти-CD28 антителами
- Замените среду на клеточных культурах Plat-E 6,5 мл восстановленной сывороточной среды.
- Приготовьте трансфекционную смесь в соответствии с инструкциями производителя для реагента Липофектамин (в данном исследовании использовался Липофектамин 2000).
- Для каждой пластины смешайте 45 мкл липофектамина 2000 с 210 мкл восстановленной сывороточной среды в одной пробирке и 15 г ДНК с 235 мкл восстановленной сывороточной среды в другой пробирке. Соедините содержимое пробирок пипетированием 3х-4х.
- Инкубируйте смесь в течение 5-20 минут при комнатной температуре, чтобы образовались комплексы липофектамин/ДНК, затем добавьте по каплям в планшеты. Инкубируйте планшеты в течение 16 часов при 37 °C.
- Лунки для активации Т-клеток: покрыть 24-луночные планшеты 5 мкг/мл антимышиного CD28 (37,51) и 10 мкг/мл антимышиного CD3 (145-2c11) в дозе 375 мкл/лунка PBS в течение ночи при 4 °C или в течение 3-4 ч в инкубаторе при 37 °C на 3-й день.
ПРИМЕЧАНИЕ: При инкубации в течение ночи оберните пластины прозрачной пленкой, чтобы предотвратить испарение. Активатор мыши Dynabeads CD3/CD28 может быть использован в качестве альтернативы с сопоставимыми результатами.
- День 3: Смена среды Plat-E и выделение и активация Т-клеток
- Утром замените среду для трансфекции Plat-E на 14 мл полной среды DMEM. Приготовьте Т-клеточную среду путем добавления RPMI-10: RPMI 1640 с L-глутамином, 10% FBS, 1% пенициллина/стрептомицина, 1x заменимых аминокислот MEM, 1 мМ пирувата натрия, 50 мкМ β-меркаптоэтанола и 1 мМ HEPES.
- Усыпить мышей JAXBoy (CD45.1) и C57B6/J (CD45.2) с помощью ингаляции CO2с последующим вывихом шейки матки. Изолируйте селезенку и лимфатические узлы в стерильных условиях.
- Аккуратно разомните селезенку на нейлоновом сетчатом сетчатом ситечке размером 100 мкм со средой RPMI в 6-луночном планшете с помощью поршня шприца.
- Переведите раствор через нейлоновое сетчатое сетчатое сетчатое ситечко для суспензии одиночных клеток в коническую пробирку объемом 50 мл. Центрифугируйте при 450 x g в течение 5 минут при 4 °C и промойте их PBS Ca-/Mg-.
- Выполните отбор магнитных негативов с помощью изоляционного набора Mouse T/T CD4 в соответствии с инструкциями производителя или отсортируйте клетки с помощью стерильного FACS
- Подсчитайте количество Т-клеток с помощью счетчика клеток и поместите их в лунки для активации Т-клеток в соотношении 1-1,5 x 106 на лунку в 1 мл среды RPMI-10 на лунку. Инкубируйте клетки при 37 °C с 5% CO₂ во увлажненном инкубаторе. Подождите 24-48 часов для правильной активации, как это было оценено под микроскопом, как описано в примечаниях ниже.
Примечание: Сшивка CD3 и CD28 эффективно активирует Т-клетки в этой конфигурации. Из одной селезенки мыши обычно получается примерно 1 x 108 спленоцитов. CD4+ Т-клетки обычно составляют около 10% от общей популяции спленоцитов. Таким образом, для приготовления 24-луночного планшета с 1-1,5 x 106 CD4+ Т-клетками на лунку, по оценкам, будет достаточно клеток от 2-3 мышей.
- День 4: Трансдукция
- Проверьте Т-клетки через 24 ч под микроскопом. Перед трансдукцией убедитесь, что Т-клетки находятся в взрывном состоянии (образуют кластеры и кажутся увеличенными из-за активации). Взрыв Т-клеток обеспечивает их нахождение в деловом состоянии, что имеет решающее значение для трансдукции MSCV9.
- Соберите ~10 мл вирусной надосадочной жидкости из 10-сантиметровых пластин в коническую пробирку. Замените планшеты для культивирования Plat-E еще 10 мл среды Plat-E без антибиотиков, чтобы обеспечить достаточное количество среды для получения большего количества сред для повторной трансдукции на следующий день. Регулируйте объем среды в планшетах PLAT-E в зависимости от количества лунок Т-клеток, которые необходимо трансфицировать на следующий день.
ПРИМЕЧАНИЕ: Двукратное преобразование значительно повышает эффективность. - Отфильтруйте вирусную надосадочную жидкость, пропустив через шприцевой фильтр 0,45 мкм. Добавьте 8 мкг/мл полибрена и 1:100 HEPES.
- Вращайте 24-луночный планшет с Т-клетками в течение 7 минут при давлении 950 x g. Тщательно соберите и сохраните надосадочную жидкость, не смещая клетки. Эта надосадочная жидкость содержит цитокины и другие факторы, секретируемые Т-клетками после активации и заменяемые этим надосадочной жидкостью после спенинфекции для поддержания цитокинового профиля и профиля факторов для поддержки пролиферации и роста Т-клеток.
- Проведите спазинфекцию, добавив 1 мл вирусной надосадочной жидкости в каждую лунку и вращая при 1150 x g в течение 4 ч при 32 °C. Заклейте пластины полиэтиленовой пленкой во время дезинфекции.
- После спаринфекции осторожно замените среду на ранее сохраненную надосадочную жидкость Т-клеток.
- День 5: Повторная трансдукция
- Повторите трансфекцию, как описано на 4-й день. При необходимости смешайте сохраненный надосадочный слой на шаге 3.4.3 из первоначально активированных Т-клеток со свежей средой в соотношении 1:1, если среда кажется исчерпанной.
- День 6: Промойте ячейки и расширяйте
- Промойте ячейки PBS Ca+/Mg+. и перенесите их в новую культуральную тарелку со 130 Ед/мл мышиного IL2 и 10 нг/мл мышиного IL7. Инкубируйте клетки в течение не менее 2 дней или до тех пор, пока они не достигнут желаемого уровня расширения, в зависимости от количества клеток, необходимых для инъекции.
- День 8: Сбор урожая и очищение
- Соберите клетки и очистите их с помощью градиента плотности Histopaque 1.077.
ПРИМЕЧАНИЕ: Этот метод помогает изолировать жизнеспособные клетки (например, лимфоциты или другие иммунные клетки) из мертвых клеток или мусора. Мертвые клетки, которые имеют более высокую плотность, оседают на дне трубки, в то время как жизнеспособные клетки обычно остаются в слое интерфейса. - Добавьте 5 мл Histopaque 1.077 в 15 мл пробирки. Соберите клетки путем центрифугирования при 450 x g в течение 5 минут при 4 °C для гранулирования клеток.
- Ресуспендируйте клеточную таблетку в 5 мл PBS Ca+/Mg+. Осторожно нанесите клеточную суспензию поверх 5 мл Histopaque 1.077 в центрифужной пробирке.
- Центрифугируйте при давлении 400-500 x g в течение 20 минут при комнатной температуре, следя за тем, чтобы разрыв/ускорение центрифуги было равно нулю.
- После центрифугирования клетки разделяются на отдельные слои в зависимости от плотности. Желаемые ячейки обычно находятся на границе между Histopaque и верхней средой, в то время как мертвые клетки располагаются внизу. Осторожно соберите клеточный слой на границе раздела с помощью пипетки, не допуская загрязнения другими слоями. Теперь собранные клетки готовы и чисты для инъекций.
- Оцените эффективность трансдукции путем проведения окрашивания Thy1.1 и анализа проточной цитометрии. Стратегия стробирования показана на рисунке 1.
Примечание: После трансдукции клетки могут быть использованы в анализах хемотаксиса для оценки их миграции к специфическим хемокинам по сравнению с клетками контрольных векторов для функционального подтверждения их активности in vitro перед продолжением инъекций.
- Соберите клетки и очистите их с помощью градиента плотности Histopaque 1.077.
- Долгосрочный анализ локализации in vivo
- Для долгосрочного хоуминга используйте CD45.1 для интересующей мыши GPCR и CD45.2 для пустых векторных (или наоборот) трансдуцированных клеток. Смешайте две популяции клеток в соотношении 1:1.
- Введите внутривенно 20-30 x 10 по6 клеток на каждую взрослую мышь-реципиента Rag1-/- для 1-недельной тропики и 5 x 106 для 7-недельной тропиза. Мы используем реципиентов Rag1-/- с дефицитом лимфоцитов для снижения конкуренции с эндогенными Т-клетками.
- Через 1–7 недель (в зависимости от исследования) введите антитела к CD45 внутривенно (в/в) мышам за 5 минут до сбора для мечения клеток, передающихся через кровь.
- Усыпьте мышей с помощью ингаляцииCO2 с последующим вывихом шейки матки.
ПРИМЕЧАНИЕ: Были проведены исследования продолжительностью 1 неделя и 7 недель; Более длительные исследования возможны, но их еще предстоит проверить. - Собирайте клетки из различных органов, представляющих интерес и контролирующих органы. Переваривают ткани в соответствии со стандартными протоколами подготовки лимфоцитов для каждого органа10,11.
- Окрашивание собранных клеток моноклональными антителами (mAb) для проведения проточного цитометрического анализа.
- Краткосрочное конкурентное хоуминг: позиционирование и визуализация Т-клеток
- Мы рекомендуем использовать мышей C57B6/J в качестве доноров, учитывая, что мы будем флуоресцентно мечить клетки. Тем не менее, для очень коротких самонаводящихся анализов продолжительностью до нескольких часов можно использовать любой штамм.
- На 8-й день культивирования магнитно изолируют трансдуцированные (Thy1.1+) клетки с использованием микрогранул CD90.1 в соответствии с инструкцией производителя12.
- После этого момента в культуре следует поддерживать только трансдуцированные клетки (чистота >95%) в течение 2 дней под контролем IL2 и IL7, как указано выше, и дать им расшириться. Микрогранулы биоразлагаемы и через 48 ч не нарушают нормальную функцию клеток.
- На 11-й день пометьте клетки, экспрессирующие интересующий GPCR, карбоксифлуоресцеином сукцинимидиловым эфиром (CFSE — краситель для окрашивания флуоресцентных клеток). Для ячеек Stuffer используйте желтый флуоресцентный краситель, или наоборот. Вы можете использовать альтернативные красители, если предпочитаете.
- Приготовьте клеточную суспензию в концентрации 1 x 106 клеток/мл в RPMI с 2% FBS. Инкубировать клетки с красителем в конечной концентрации 5 мкМ при 37 °C на водяной бане с легким перемешиванием в течение 20 минут. Чтобы получить сопоставимые результаты, чередуйте назначения красителей в отдельных экспериментах. В качестве альтернативы можно использовать один краситель для обозначения общего типа клеток в качестве внутреннего стандарта, включая экспериментальные и контрольные клетки у разных реципиентов.
- Промойте помеченные ячейки и смешайте их в соотношении 1:1. Оцените концентрацию клеток с помощью счетчика клеток. Введите 15-30 x 106 клеток внутривенно мышам-реципиентам (WT или трансгенным мышам-реципиентам, в зависимости от цели эксперимента).
- Примерно через 10-12 ч вводите мышам антитела против CD31 (например, меченый DyLight 633, клон 390), которые следует ввести за 10-15 мин до жертвоприношения, чтобы разграничить кровеносные сосуды и отличить внутрисосудистые клетки от экстравазированных.
- Усыпьте мышей с помощью ингаляцииCO2 с последующим вывихом шейки матки. Анализируйте локализацию клеток с помощью FACS клеточных суспензий, как описано в шаге 3.8 выше, или путем визуализации целых тканей, как в шаге 3.9.8 или шаге 3.9.7 для органов, представляющих интерес, с помощью конфокальной микроскопии.
- Для тонких органов, таких как трахея, маточный рог или лимфатические узлы, подготовьте крепления для кабачков. Поместите салфетку на предметное стекло с помощью двустороннего скотча по бокам, добавьте несколько капель монтажного раствора Fluoromount-G, накройте покровным слипом и аккуратно и равномерно прижмите, чтобы зафиксировать покровное стекло к ленте с помощью отдельного предметного стекла или другого плоского предмета.
- Для замороженных срезов поместите ткань в состав с оптимальной температурой резки (OCT). Для легких перфузия с 50% ОКТ/ПБС перед внедрением.
- Используйте проточную цитометрию для контрольных органов, таких как периферические лимфатические узлы (PLN), селезенка или кровь, для оценки эффективности трансдукции (% Thy1,1+), как показано на рисунке 1 , и нормализации результатов. Визуализируйте PLN с помощью креплений или секций для сквоша с помощью конфокальной микроскопии. Подсчитывайте клетки с помощью конфокальной микроскопии с программным обеспечением Imiris.
- Определите соотношение GPCR-трансдуцированных клеток к контрольным клеткам (трансдуцированным Stuffer) в целых органах или в конкретных компартментах органов. Нормализуйте до соотношения входных данных, определенных с помощью FACS, и/или до соотношения, полученного от контрольных органов, в которых GPCR известен или считается нерелевантным.
- Для анализа локализации микроокружения в легких измерьте расстояние между клетками до гистологических ориентиров (например, базальных мембран бронхов или вен) с помощью программного обеспечения Imiris.
Результаты
В данном исследовании мы представляем подробный протокол исследования способности специфических рецепторов к прямой локализации Т-клеток in vivo. В качестве демонстрации этого протокола мы использовали GPR2513. Мы можем достичь 30%-40% эффективности трансдукции, используя этот протокол, что оценивается окрашиванием Thy1.1 с помощью проточной цитометрии. Мы выполнили анализ хемотаксиса in vitro на основе трансвелла с использованием GPR25-трансдуцированных клеток вместе с контролем наполнителя, проверяя их миграцию в сторону hCXCL17, mCXCL17 и CXCL12 в качестве положительного контроля. GPR25-трансдуцированные Т-клетки эффективно мигрировали в CXCL17 по сравнению с фаршер-трансдуцированными клетками, подтверждая успешную трансдукцию и функциональную экспрессию рецептора (рис. 2).
Долгосрочное самонаведение
Рисунок 1 изображает стратегию стробирования для анализа Т-клеток в различных органах. Антитела к CD45 вводили за 5 минут до забора тканей для исключения внутрисосудистых клеток из анализа. В исследование были включены только клетки TCRβ+ CD4+ Thy1.1+, свидетельствующие об успешной трансдукции. Для каждого органа рассчитывали соотношение GPCR-экспрессирующих клеток к клеткам с пустым вектором. Эти результаты были нормализованы до исходного процента трансдукции (% Thy1,1+) пула входных клеток.
После инъекции мышам-реципиентам GPR25-трансдуцированные клетки преимущественно заселяли некишечные слизистые ткани (NIMT), такие как мочеполовой тракт (ГУ), желудок и трахея — органы, богатые GPR25LG (рис. 3). Наши исследования показали значительное обогащение GPR25-трансдуцированных клеток в цельных изолятах легких через 7 недель, но не через 1 неделю после инъекции, что свидетельствует о потенциальном созревании или изменении положения в легком с течением времени (Рисунок 3). Эти результаты подчеркивают важность выбора подходящей продолжительности исследования.
Краткосрочное самонаведение
Чтобы исследовать локализацию GPR25 in vivo и его роль в самонаведении из кровотока в NIMT, мы провели краткосрочные анализы хоуминга. GPR25-трансдуцированные Т-клетки вводили совместно с контрольными вектор-трансдуцированными клетками и анализировали через 10-12 ч после внутривенного переноса мышам дикого типа (WT) и CXCL17-/- (рис. 4). Анти-CD31 вводили за 20 минут до жертвоприношения, чтобы отличить внутрисосудистые клетки от экстравазированных. У реципиентов WT экспрессия GPR25 давала преимущество в хоуминге богатым CXCL17 органам, таким как трахея, желудок, язык, желчный пузырь и слизистые оболочки матки, но не кишечнику, лимфатическим узлам или селезенке, где CXCL17 не экспрессируется (рис. 4A-C). Интересно, что конфокальная визуализация и количественное определение показали, что трансдуцированные Т-клетки GPR25 были обогащены не только среди экстравазированных клеток, но и среди клеток, все еще прикрепленных к эндотелию сосудов в пределах NIMT, что позволяет предположить, что этот путь способствует первоначальной остановке эндотелия, а также проникновению в ткани-мишени и миграции в эпителий слизистой оболочки. Преимущество GPR25-трансдуцированных Т-клеток по сравнению с фарш-трансдуцированными клетками было устранено при введении реципиентам CXCL17-/-.
В перибронховаскулярном интерстиции легкого GPR25-трансдуцированные клетки преимущественно локализовались в бронхах, в то время как контрольные клетки чаще обнаруживались вблизи вен (рисунок 4D). Этот паттерн предполагает GPR25-зависимую репозицию клеток из венозных участков в подслизистую оболочку бронхов. Тем не менее, GPR25-трансдуцированные клетки не проявляли предпочтения в отношении бронхиол и не смогли отделиться от контрольных клеток у реципиентов CXCL17-/-. Эти результаты указывают на то, что хемоаффинность GPR25 специфически стимулирует локализацию в легочных бронхах, в то время как первоначальная экстравазация может быть независимой от GPR25 и опосредована альтернативными механизмами.
Наша методика позволила нам сделать вывод о том, что ось GPR25-CXCL17 специфически опосредует рекрутирование лимфоцитов в органы дыхания, верхние отделы желудочно-кишечного тракта, желчевыводящие и мочеполовые пути. Описанный здесь протокол определил роль GPR25 в тканеспецифическом хоуминге, способствуя более глубокому пониманию того, как этот ранее орфанный рецептор влияет на локализацию Т-клеток в различных тканевых микросредах.
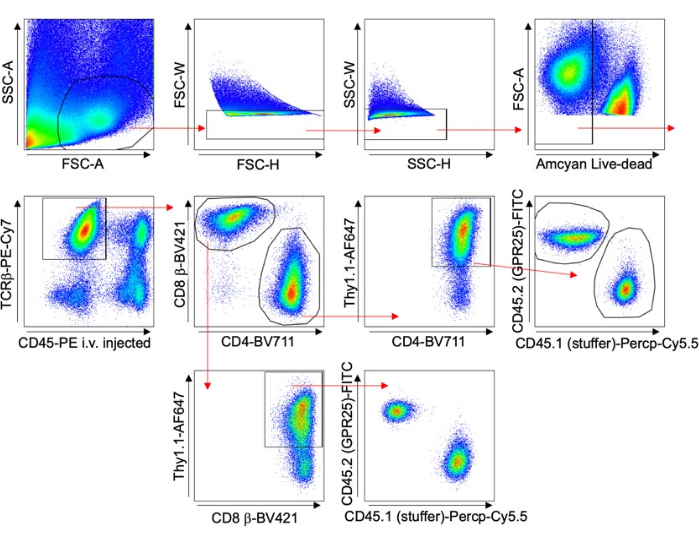
Рисунок 1: Репрезентативная стратегия стробирования. График FACS, показывающий стратегию стробирования, используемую для экспериментов по трансдукции Т-клеток мышей, в частности, для долгосрочного исследования хоуминга (пример с Lung). Внутривенно вводимый CD45-PE и окрашивание Thy1.1 использовали для исключения внутрисосудистых клеток и специфического анализа трансдуцированных клеток. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
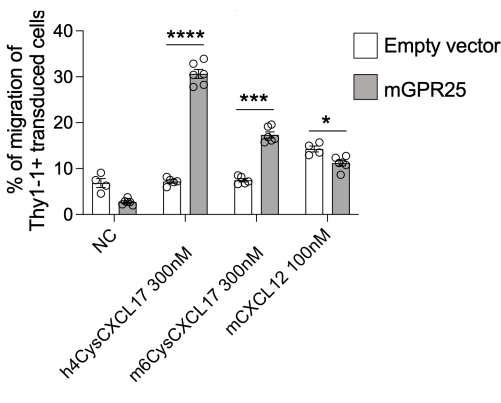
Рисунок 2: Хемотаксис трансдуцированных клеток для проверки их функции. Клетки, трансдуцированные mGPR25, но не пустые векторные аналоги, надежно хемотаксис по отношению к CXCL17 мыши и человека in vitro в анализах миграции на основе трансвелла. Результаты представлены в виде среднего значения ± SEM по крайней мере двух независимых экспериментов. P < 0,0001 по сравнению с отсутствием контроля хемокином (двухсторонний t-критерий). Эта цифра была изменена с13. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Результаты FACS для долгосрочного самонаведения. Соотношение GPR25-трансдуцированных и контрольных вектор-трансдуцированных клеток в тканях через 1 и 7 недель после инъекции мышам Rag1-/-. GPR25 и контрольные клетки различали по аллотипу CD45.1 и CD45.2, переключали в различных экспериментах, анализировали с помощью проточной цитометрии и нормализовали по отношению к входу. Результаты, полученные в трех независимых экспериментах (2-3 мыши на эксперимент), представлены как среднее значение ± SEM. *P < 0,05, **P < 0,01, ***P < 0,001 (двуххвостый Т-критерий). N/A указывает на низкое извлечение клеток для анализа. Эта цифра была изменена с13. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
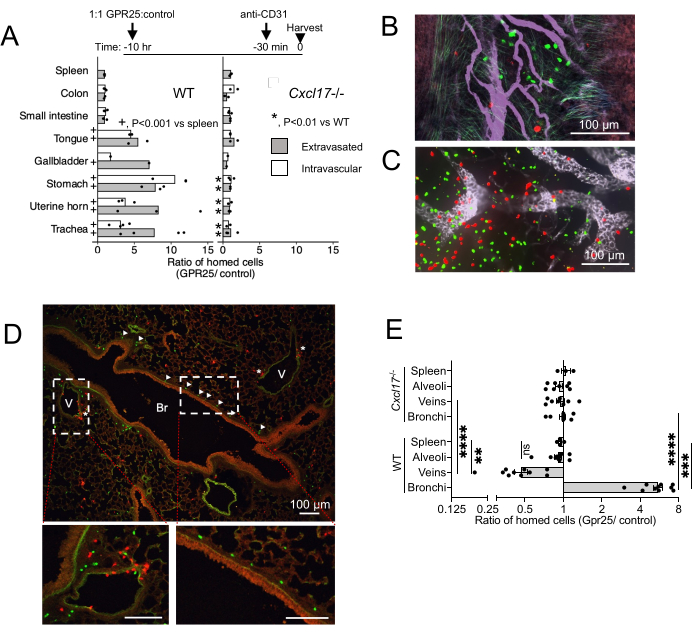
Рисунок 4: Конфокальная визуализация является результатом кратковременного хоуминга. (A) Отношение GPR25 к контрольным клеткам через 10-12 ч после инъекции, определенное с помощью конфокальной микроскопии целых тканей или замороженных срезов. Соотношения в контрольной селезенке определяли методом проточной цитометрии. P-значения, полученные в результате точного теста Фишера, сравнивающего количество клеток в указанных тканях-мишенях и селезенке у реципиентов WT (+) или сравнивая количество клеток в тканях-мишенях у реципиентов CXCL17-/- и реципиентов WT (*). Подсчет клеток объединяется из 1 (желчного пузыря) или 2-4 независимых экспериментов с одной мышью в каждом условии и эксперименте. Приведены средние отношения. (Б-Г) Репрезентативные изображения трахеи (B), PLN (C) и поперечных срезов легких (D) через 10 ч после инъекции, показывающие GPR25 (зеленые) и контрольные (красные) CD4 Т-клетки. Стрелки на рисунке (D) указывают на клетки GPR25, локализованные в бронхах (Br); звездочками обозначены клетки рядом с венами (V). (E) Отношение GPR25 к контрольным донорским клеткам в указанных легочных микросредах: бронхи: в пределах 30 мкм от базальной мембраны бронхов. Вена: в пределах 30 мкм от венозного эндотелия или в контакте с ним. Альвеолы: в пределах альвеолярных пространств, не примыкающих к венам или бронхам. Каждая точка представляет собой соотношение в пределах 2-4 независимых полей 10x для WT и CXCL17, представляющее ~ 4 мм2. Соотношения селезенки дублировались из (B) для сравнения. Результаты показали 3 независимых эксперимента с 1-2 мышами в каждом эксперименте и показали среднее значение ± SEM. *P < 0,05, **P < 0,01, ***P < 0,001, ****P < 0,0001 против селезенки; WT против CXCL17-/- (двухсторонний t-образный тест). Эта цифра была изменена с13. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Внутренне контролируемый анализ самонаведения, описанный в этом исследовании, представляет собой комплексный метод изучения GPCR-опосредованного транспорта и позиционирования Т-клеток в различных органах и тканевых микросредах. Этот подход объединяет несколько критически важных оптимизаций для повышения воспроизводимости, точности и эффективности.
Важнейшим аспектом этого протокола является эффективная трансдукция Т-клеток с использованием ретровирусных векторов MSCV, чему способствует использование Plat-E клеток для производства вируса. Ключевые оптимизации включают поддержание Plat-E клеток на соответствующей конфлюенции, использование пластин, покрытых поли-D-лизином, для усиления вирусной трансфекции и использование стратегии двойной трансдукции для максимизации экспрессии GPCR. Поскольку векторы MSCV требуют активного деления клеток для эффективной интеграции генома, индуцирование вхождения в клеточный цикл через активацию Т-клеток значительно повышает эффективность ретровирусной трансдукции. Высокие концентрации анти-CD3 и CD28 антител имеют решающее значение для обеспечения активации и бластинга Т-клеток, которые, как показали наши исследования, более эффективны, чем более низкие концентрации, о которых сообщалось в других местах14. Мы также обнаружили, что включение цитокинов IL-2 и IL-7 в культуральную среду жизненно важно для поддержания жизнеспособности Т-клеток и стимулирования их экспансии, обеспечивая устойчивую популяцию здоровых трансдуцированных Т-клеток, необходимую для точных исследований миграции и хоуминга.
В дополнение к оптимизации ретровирусной трансдукции, протокол позволяет проводить долгосрочные исследования хоуминга с использованием маркеров CD45.1/CD45.2 для дифференциации между GPCR-трансдуцированными и контрольными клетками в конкурентных экспериментах в пределах одного хозяина. Такой подход гарантирует, что клетки подвергаются воздействию одних и тех же физиологических сигналов. Включение маркера Thy1.1 имеет важное значение для различения трансдуцированных и нетрансдуцированных Т-клеток, особенно в тех случаях, когда специфические антитела к орфанным GPCR недоступны. Альтернативой, подходящей для некоторых применений, может быть использование флуоресцентного белка вместо кассеты Thy1.1.
Для анализа гомезированных клеток с помощью FACS в протоколе используются антитела против CD45, введенные за 5 минут до забора ткани, чтобы различать циркулирующие и тканевые-резидентные клетки, предотвращая неправильную интерпретацию данных хоуминга. Для конфокальной микроскопии анти-CD31-антитела вводили за 10-30 минут до жертвоприношения для маркировки кровеносных сосудов, что позволяло точно визуализировать локализацию Т-клеток и различать клетки, прикрепленные к эндотелию сосудов, и экстравазированные клетки. Анализ изображений с помощью программного обеспечения Imaris позволяет количественно оценить расстояние клеток от гистологических ориентиров, что дает подробное представление об их локализации и взаимодействии в микроокружении.
Сила этого протокола заключается в параллельном сравнении поведения идентичных клеток, которые отличаются только экспрессией трансдуцированного рецептора. Хотя мы используем общепринятый термин «конкурентное хоуминг» для описания совместной инжекции и последующего хоуминга контрольных и компараторных ячеек, мы признаем, что этот термин технически является неправильным. В краткосрочных анализах механизмы рекрутирования тканей, вероятно, находятся в избытке, что делает фактическую конкуренцию между клеточными популяциями маловероятной. Более точным термином было бы сравнительное самонаведение или внутренне контролируемое самонаведение, поскольку протокол оценивает поведение самонаведения контролируемым и сравнительным образом. Кроме того, физиологическая миграция и хоуминг могут включать интегрированный вклад нескольких хемоаттрактантных рецепторов, которые могут действовать одновременно или последовательно для прямой многоступенчатой миграции клеток в сложных полях аттрактантов, существующих in vivo15. Т-клетки, активированные in vitro в условиях, которые мы используем, спонтанно экспрессируют CXCR3 и, вероятно, другие GPCR, которые, посредством координации с трансдуцированным рецептором, могут влиять на конечную локализацию клеток. Ретровирусная трансдукция обычно приводит к сверхэкспрессии гена-мишени, и следует учитывать, что уровень экспрессии рецептора также может влиять на хоуминг. Более того, сверхэкспрессия рецептора теоретически может изменять свойства клетки независимо от взаимодействия рецептор-лиганд. Чтобы решить эту проблему, мы провели комплементарную экспрессию с использованием мышей CXCL17-/-, у которых отсутствует лиганд для GPR25. Этот подход помогает гарантировать, что наблюдаемые нами эффекты опосредованы распознаванием родственных лигандов. Исследователи, у которых нет доступа к конкретным нокаутным штаммам, могут использовать методы shRNA или CRISPR для подавления или нокаутирования конкретных GPCR в Т-клетках. Эта адаптация может еще больше повысить универсальность протокола для изучения функции GPCR в Т-клетках.
В то время как ретровирусная трансдукция обеспечивает высокую эффективность, она требует активного деления клеток, которые могут неточно отражать поведение неподвижных клеток. Некоторые хемокиновые рецепторы проявляют дифференциальную активность в зависимости от пролиферативного статуса клетки, хотя их специфичность остается неизменной. Альтернативный метод, неоновая электропорация, продемонстрировал высокую эффективность трансфекции в Т-клетках, хотя ивременно16. Этого может быть достаточно для краткосрочных анализов, в то время как MSCV может давать стабильную экспрессию, что делает его пригодным как для краткосрочных, так и для долгосрочных исследований. Тем не менее, нам не удалось найти литературу, указывающую на то, что эта система использовалась для исследований самонаведения. Если эффективность трансфекции низкая, нам может потребоваться выбрать клетки с помощью видимого маркера, например, котрансфекция с GFP.
Этот протокол обеспечивает статический снимок клеточного трафика, ограничивая понимание клеточного поведения и подвижности в реальном времени. Он также имеет присущие ему ограничения разрешения, особенно для наблюдения за субклеточными структурами и мелкомасштабной архитектурой тканей. Для решения этих проблем мы предлагаем использовать передовые методы визуализации, такие как многофотонная микроскопия, визуализация живых клеток и прижизненная микроскопия. Эти методы обеспечивают более высокое пространственное разрешение, более глубокое проникновение в ткани и возможность динамической визуализации клеточных процессов. Прижизненная микроскопия, в частности, позволяет отслеживать поведение Т-клеток in vivo в режиме реального времени, что позволяет наблюдать за миграцией клеток, взаимодействиями и реакцией на стимулы в их естественном контексте. Этот подход особенно эффективен для оценки хоуминга Т-клеток и локализации тканей, показывая, как клетки динамически адаптируются к различным микросредам. Интегрируя эти передовые методы визуализации, будущие исследования могут достичь более полного понимания подвижности Т-клеток, взаимодействий и GPCR-опосредованного хоуминга, что значительно улучшит понимание их поведения в тканях.
Протокол, который мы предоставляем, поможет в изучении функций GPCR в хоуминге иммунных клеток и имеет широкое применение в иммунотерапии, воспалении и аутоиммунитете. Кроме того, он предлагает новые возможности для обнаружения терапевтических мишеней и улучшения иммунных реакций за счет изучения ранее не охарактеризованных GPCR в раке, нацеленных на Т-клетки, и решения проблемы неадекватного хоуминга Т-клеток при аутоиммунных заболеваниях.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
При поддержке грантов NIH R01 AI178113 и R01 AI047822, гранта 1903-03787 от Благотворительного фонда Леоны М. и Гарри Б. Хелмсли и грантов Программы исследований заболеваний, связанных с табаком (TRDRP) T31IP1880 и T33IR6609 для E.C.B.; Y.B. был поддержан премией научных сотрудников Американского фонда Крона и колита (835171). Б.О. была поддержана стипендией для постдокторантуры Фонда Рамона Аресеса (Мадрид, Испания) и премией научных сотрудников Американского фонда Крона и колита (574148). А.А. был поддержан Калифорнийским институтом регенеративной медицины (CIRM) - EDUC2-12677.
Материалы
| Name | Company | Catalog Number | Comments |
| AF647 anti mouse CD90.1-Thy1.1 (OX-7) | Biolegend | 202507 | |
| anti-CD31 (DyLight 633, clone 390) | InvivoMab | BE0377 | |
| anti-mouse CD28 37.51 | eBiosciences | ||
| anti-mouse CD3 145-2c11 | eBiosciences | ||
| APCCy7 anti mouse CD3 (145-2c11) | Biolegend | 100329 | |
| BV421 anti mouse CD8b (Ly-3) | Biolegend | 126629 | |
| BV711 anti mouse CD4 (RM4-5) | Biolegend | 100549 | |
| CD90.1 microbeads | Miltenyi | 130-121-273 | |
| CFSE | Thermoscientific | C34554 | |
| FITC anti mouse CD45.2 (104) | BD | AB_395041 | |
| mouse IL2 | Peprotech | 200-02-50UG | |
| mouse IL7 | Peprotech | 217-17-10UG | |
| Mouse T CD4 isolation kit | STEMCELL technologies | 18000 | |
| MSCV-IRES- Thy1.1 GPR25 | Vectorbuilder | ||
| MSCV-IRES- Thy1.1 Stuffer | Vectorbuilder | ||
| PE-CD45 (30-F11) antibody | Biolegend | 103105 | |
| PECy7 anti mouse TCRb (H57-597) | Tonbo | ||
| PercpCy5.5 anti mouse CD45.1 (A20) | eBiosciences | ||
| Platinum-E (Plat-E) | cell Biolabs. Inc | RV-101 | |
| Yellow fluorescent dye | Thermoscientific |
Ссылки
- Cheng, L., et al. Structure, function and drug discovery of GPCR signaling. MolBiomed. 4 (1), 46 (2023).
- Lammermann, T., Kastenmuller, W. Concepts of GPCR-controlled navigation in the immune system. Immunol Rev. 289 (1), 205-231 (2019).
- Fu, H., Ward, E. J., Marelli-Berg, F. M. Mechanisms of t cell organotropism. Cell Mol Life Sci. 73 (16), 3009-3033 (2016).
- Cinalli, R. M., et al. T cell homeostasis requires g protein-coupled receptor-mediated access to trophic signals that promote growth and inhibit chemotaxis. Eur J Immunol. 35 (3), 786-795 (2005).
- Wu, V., et al. Illuminating the onco-GPCRome: Novel g protein-coupled receptor-driven oncocrine networks and targets for cancer immunotherapy. J Biol Chem. 294 (29), 11062-11086 (2019).
- Wu, V. H., et al. The GPCR-alpha(s)-pka signaling axis promotes T-cell dysfunction and cancer immunotherapy failure. Nat Immunol. 24 (8), 1318-1330 (2023).
- Ramezani, A., Hawley, T. S., Hawley, R. G. Stable gammaretroviral vector expression during embryonic stem cell-derived in vitro hematopoietic development. Mol Ther. 14 (2), 245-254 (2006).
- . . Plat-E retroviral packaging cells (RV-101) user manual. , (2024).
- Anderson, J., Hope, T. Intracellular trafficking of retroviral vectors: obstacles and advances. Gene Ther. 12, 1667-1678 (2005).
- Kim, E., et al. Isolation and analyses of lamina propria lymphocytes from mouse intestines. STAR Protoc. 3 (2), 101366 (2022).
- Steinert, E. M., et al. Quantifying Memory CD8 T Cells Reveals Regionalization of Immunosurveillance. Cell. 161 (4), 737-749 (2015).
- Miltenyi Biotec. . CD90.1 MicroBeads mouse and rat. , (2024).
- Ocón, B., et al. A lymphocyte chemoaffinity axis for lung, non-intestinal mucosae and CNS. Nature. 635, 736-745 (2024).
- Sumida, H., et al. Gpr55 regulates intraepithelial lymphocyte migration dynamics and susceptibility to intestinal damage. Sci Immunol. 2 (18), eaao1135 (2017).
- Foxman, E. F., Campbell, J. J., Butcher, E. C. Multistep navigation and the combinatorial control of leukocyte chemotaxis. J. Cell Biol. 139 (5), 1349-1360 (1997).
- Alawar, N., et al. A solution for highly efficient electroporation of primary cytotoxic T lymphocytes. BMC Biotechnol. 24 (1), 16 (2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены