Method Article
高效的逆转录病毒转导和竞争归巢,用于研究 GPCR 介导的 T 细胞在不同组织微环境中的定位
摘要
我们提出了改进的转运受体逆转录病毒转导和竞争归巢方案,以研究受体介导的器官和微环境特异性淋巴细胞定位。该方法为免疫细胞运输机制提供了有价值的见解,并在未来的基础和治疗研究中具有潜在的应用。
摘要
了解 G 蛋白偶联受体 (GPCR) 表达如何影响不同组织微环境中的细胞定位,对于阐明免疫细胞运输机制至关重要。我们提出了一种竞争性归巢测定法,旨在研究 GPCR 介导的 T 细胞定位到表达其同源化学引诱配体的器官,适用于短期和长期研究。该方法涉及一种改进的重组鼠干细胞病毒 (MSCV) 转导 T 细胞以表达目标 GPCR 或对照构建体的方案,然后在受体小鼠中竞争性归巢。使用流式细胞术和/或共聚焦显微镜分析细胞在不同器官中的分布。在短期实验 (10-12 h) 中,共聚焦显微镜揭示了不同的细胞定位模式,包括肺泡、支气管粘膜下层、静脉部位和肺间质,以及气管、胃和子宫角内壁的上皮。在长期研究 (1-7 周) 中,流式细胞术提供了对优先细胞积累的见解,揭示了随着时间的推移,组织内的动态变化和潜在的成熟或重新定位。这种竞争性归巢检测是研究 GPCR 介导的细胞定位的可靠工具,为组织特异性分布和免疫学和治疗研究中的潜在应用提供了有价值的见解。
引言
G 蛋白偶联受体 (GPCR) 是调节多种细胞过程的基础,包括信号转导、神经传递、激素调节和免疫细胞迁移1。它们在淋巴细胞迁移和定位的时空控制中起着至关重要的作用2。在免疫反应的启动阶段,局部微环境和细胞相互作用促使 T 淋巴细胞表达一组独特的粘附分子和趋化因子受体,称为归巢受体。这种适应使抗原经验的 T 细胞能够与器官特异性内皮细胞 (EC) 结合并迁移到不同的靶组织。T 细胞获得组织趋向性的能力对于有效的回忆反应至关重要,尤其是在影响同一器官的反复感染的情况下 3,4。
GPCR 将免疫细胞引导至特定的组织和器官,在那里它们执行关键功能,例如将 CD8+ T 和 NK 细胞引导至肿瘤部位进行细胞毒作用,或通过支持其他免疫细胞的激活来帮助 CD4+ T 细胞协调免疫反应。了解 GPCR 如何将 T 细胞引导至其精确位置对于推进靶向免疫治疗至关重要 5,6。然而,挑战在于在体外模拟这些复杂的相互作用,因为同时复制空间受限线索和定向趋化信号是很困难的。
阐明特异性白细胞受体的作用通常也具有挑战性,因为它们在内源性群体中的表达频率有限,而且这些受体通常装饰不同的细胞类型。这种复杂性使得很难将特定受体的作用与其他细胞亚群特异性机制分离。理想情况下,方法应该比较相似的群体,仅在感兴趣的受体上有所不同,以提供清晰的见解。
为了克服这些挑战,我们采用了一种竞争性的归巢测定法,该测定法采用重组 MSCV 逆转录病毒转导在 T 细胞中实现 GPCR 的高效表达。MSCV 逆转录病毒载体结合了基于骨髓增生性肉瘤病毒 (PCMV) 的 MESV 载体和基于莫洛尼鼠白血病病毒 (MMLV) 的 LN 载体的元件,并结合了源自 LN 载体7 的扩展杂交包装信号。这种修饰提高了基因递送的效率,使 体内 T 细胞定位的短期和长期研究成为可能。通过利用高滴度逆转录病毒颗粒和共聚焦显微镜,该方法可以精确可视化复杂组织环境中的 T 细胞定位和相互作用。我们提出了运输受体逆转录病毒转导的详细方案和内部控制(所谓的竞争性)归巢测定的性能,以研究受体介导的器官和微环境特异性淋巴细胞定位。该方法的总体目标是为免疫细胞运输机制提供有价值的见解,并在基础研究和治疗开发中实现未来的应用。
研究方案
本研究中的所有小鼠均维持在退伍军人事务部帕洛阿尔托医疗保健系统 (VAPAHCS) 的特定无病原体 (SPF) 设施中。B6/SJL Prprc Pep3BoyJ (CD45.1) 、 C57B6/J (CD45.2) 和 Rag1-/- 小鼠购自 Jackson Laboratories。虽然我们使用 PepBoy 获得 CD45.1 细胞,但我们建议使用 JAXBoy (C57BL/6J-Ptprcem6Lutzy/J)。JAXBoy 是通过 CRISPR 而不是传统的回交产生的完全同源菌株,从而提高了遗传一致性。从历史上看,使用 PepBoy 小鼠 (CD45.1) 的 CD45 同种异型标记研究(并非完全先天性)包括对照归巢和再循环测定与野生型 (WT/WT) 比较,以解决潜在的变异性。随着 JAXBoy 小鼠现在作为完全同基因替代品提供,这些额外的对照可能不再需要。研究人员仍应考虑到 CD45.1 和 CD45.2 变体之间的差异(例如它们作为蛋白质酪氨酸磷酸酶的作用)会影响细胞行为和归巢模式。文本和下面讨论的所有方案均已获得批准或符合经认可的实验动物医学系和弗吉尼亚州帕洛阿尔托医疗保健系统 (VAPAHCS) 实验动物护理管理小组的指导方针。使用批准的程序处死动物。实验包括 8-12 周龄的两性小鼠。
1. MSCV 载体制备
- 购买具有目标小鼠基因 (GOI) 编码区或 ORF_Stuffer(阴性 ORF 对照)的 MSCV-IRES-Thy1.1 逆转录病毒载体
注:该构建体包括 Thy1.1 表面标记物以及感兴趣的 GPCR 基因。内部核糖体进入位点 (IRES) 接头允许 GPCR 与 Thy1.1 共表达,便于通过流式细胞术或磁珠纯化和分离来鉴定转导的细胞。当无法获得 GPCR 特异性抗体时,这尤其有用,研究不足的 GPCR 通常就是这种情况。 - 通过接种 Luria-Bertani (LB) 肉汤来获得细菌形式的 MSCV 质粒并培养物,该肉汤补充有基于质粒编码的抗性基因(例如氨苄青霉素、卡那霉素或氯霉素)的适当抗生素选择。LB 培养基由胰蛋白胨 (10 g/L)、酵母提取物 (5 g/L) 和 NaCl (10 g/L) 组成,调节至 pH 7.0 并通过高压灭菌。将培养物在 37 °C 下在振荡培养箱 (220 RPM) 中孵育过夜。
- 使用 DNA 制备试剂盒,使用标准分子生物学技术制备质粒储备液。
- DNA 分离后,用分光光度计测量 DNA 浓度,并制备浓度为 1 μg/μL 的工作质粒溶液。将质粒储存在 -20 °C 以备将来使用。
2. 建立包装细胞系培养
注意:我们使用了来自 Cell Biolabs 的 Platinum E (Plat-E) 细胞。Plat-E 细胞是一种基于 293T 的细胞系,具有 EF1α 启动子,可提供稳定且高产量的逆转录病毒结构蛋白(gag、pol 和 env 基因)表达,从而能够使用单个质粒转染进行逆转录病毒包装8。尽管可以使用其他细胞系,例如 NIH-3T3 或 293T,但我们尚未测试这些替代方案。
- 通过添加 DMEM、10% FBS、1% 青霉素/链霉素、杀稻瘟菌素 (10 μg/mL) 和嘌呤霉素 (1 μg/mL) 来制备 Plat-E 细胞培养基。使用杀稻瘟菌素和嘌呤霉素维持细胞,但在转染期间和转染后省略它们。
- 板式 Plat-E 细胞以 1.0 mL、>3 x 106 个细胞/mL 的 DMEM、20% FBS 和 10% DMSO 冷冻运输。在 37 °C 水浴中快速解冻。将所有解冻的细胞转移到含有 Plat-E 培养基的 15 mL 锥形管中。
- 在 4 °C 下以 450 x g 离心 5 分钟。 轻轻移液,将细胞沉淀重悬于 1 mL Plat-E 培养基中,以制备单细胞悬液。
- 将 9 mL Plat-E 培养基添加到 10 cm 培养皿中,然后将 1 mL 重悬细胞转移到培养皿中。通过混合等体积的细胞悬液和台盼蓝,并使用血细胞计数器或细胞计数仪对活细胞(未染色)和死细胞(蓝色染色)进行计数,以达到 >70% 的活力来确认解冻的细胞是活的。
- 将细胞在 37 °C 下在 5% CO2 的加湿培养箱中孵育。前 3 天不要更换培养基;在第一次解冻时观察到漂浮和死细胞是正常的。
- 当细胞达到 85%-90% 汇合时,用 DMEM/PBS Ca-/Mg- 洗涤。使用 2 mL 0.05% 胰蛋白酶/0.5 mM EDTA 分离细胞,并在 37 °C 下孵育 3 分钟。 加入 8 mL Plat-E 培养基,将细胞收集到 15 mL 锥形管中,并在 4 °C 下以 450 x g 离心 5 分钟。
- 以 1:10 或 1:5 的表面比例分液(即,用原始培养皿总体积的 1/10 或 1/5 接种新板)。重悬于终体积为 10 mL 的 Plat-E 培养基中,并在 37 °C 下在含 5% CO2 的加湿培养箱中孵育。
- 将其余细胞分装在 1 mL 含 10% DMSO 的 FBS 中,并在 -80 °C 下冷冻,随后在液氮中冷冻以供长期使用。
注:当接近 85% 汇合时,如上所述处理细胞。为了保持最佳的细胞健康,请避免过度汇合,并以 1:10 稀释度进行 3 天的分流。如果生长减慢,请使用新的等分试样。细胞性能通常会随着后续传代而降低。我们建议在第 4 代和第 15 代之间使用细胞进行转染,以获得最佳结果。
3. 转导细胞的生产
- 第 1 天:Seed Plat E 细胞
注:计算所需的 Plat E 细胞和板的数量。我们在 24 孔板中每孔使用 1 mL 病毒上清液转染细胞 2 次。我们通常使用大约两个 10 cm 培养皿转染板,每个 24 孔板使用 Plate-E 细胞,培养 T 细胞。- 首先在无菌水中用 5 mL 50 μg/mL 聚-D-赖氨酸包被 10 cm 组织培养板。在室温下孵育 45 分钟。用无菌 PBS Ca-/Mg 洗涤 2 次,以确保没有残留物。
注:我们建议包被板,因为 Plat-E 细胞在转染后往往会分离,从而导致细胞性能不佳和病毒滴度降低。 - 如上文步骤 2.6 所述分离 Plat-E 细胞,并进行台盼蓝排阻测定以确保活力。混合等体积的细胞悬液和台盼蓝。使用血细胞计数器/细胞计数器对活细胞(未染色)和死细胞(蓝色染色)进行计数。用不含抗生素的 Plat-E 培养基在 10 cm 组织培养培养皿中接种 3 x 10 ⁶活细胞。
注意:接种板第二天应达到 85%-90% 汇合度。如果无法实现这一点,请考虑使用不同的细胞等分试样。根据电镀时间调整种子密度;对于晚上铺板,可以使用 3.5 x 106 个细胞。
- 首先在无菌水中用 5 mL 50 μg/mL 聚-D-赖氨酸包被 10 cm 组织培养板。在室温下孵育 45 分钟。用无菌 PBS Ca-/Mg 洗涤 2 次,以确保没有残留物。
- 第 2 天:用抗 CD3 和抗 CD28 抗体转染 Plat-E 细胞和 T 细胞包被板
- 用 6.5 mL 还原血清培养基替换 Plat-E 细胞培养物上的培养基。
- 根据制造商的 Lipofectamine 试剂说明制备转染混合物(本研究中使用了 Lipofectamine 2000)。
- 对于每个板,将 45 μL Lipofectamine 2000 与 210 μL 减血清培养基混合在一个试管中,将 15 μg DNA 与 235 μL 减血清培养基混合在另一个试管中。通过移液 3 次-4 次来合并试管的内容物。
- 在室温下孵育混合物 5-20 分钟,以形成 Lipofectamine/DNA 复合物,然后逐滴添加到板中。将板在 37 °C 下孵育 16 小时。
- T 细胞活化孔:在 24 孔板中涂覆 5 μg/mL 的抗小鼠 CD28 (37.51) 和 10 μg/mL 的抗小鼠 CD3 (145-2c11) 在 375 μL/孔 PBS 中,在 4 °C 下过夜或在第 3 天的培养箱中在 37 °C 的培养箱中包被 3-4 小时。
注意:如果孵育过夜,请用透明薄膜包裹板以防止蒸发。Dynabeads 小鼠激活剂 CD3/CD28 可用作替代药物,结果相当。
- 第 3 天:更换 Plat-E 培养基,分离并激活 T 细胞
- 早上将 Plat-E 转染培养基更换为 14 mL DMEM 完全培养基。通过添加 RPMI-10:RPMI 1640 与 L-谷氨酰胺、10% FBS、1% 青霉素/链霉素、1x MEM 非必需氨基酸、1 mM 丙酮酸钠、50 μM β-巯基乙醇和 1 mM HEPES 制备 T 细胞培养基。
- 使用 CO2吸入对 JAXBoy (CD45.1) 和 C57B6/J (CD45.2) 小鼠实施安乐死,然后进行颈椎脱位。在无菌条件下隔离脾脏和淋巴结。
- 使用注射器柱塞在 6 孔板中含有 RPMI 培养基的 100 μm 尼龙网状细胞过滤器上轻轻捣碎脾脏。
- 将溶液通过 40 μm 尼龙网孔过滤器转移到 50 mL 锥形管中,用于单细胞悬液。在 4 °C 下以 450 x g 离心 5 分钟,并用 PBS Ca-/Mg-洗涤。
- 按照制造商的说明使用小鼠 T/T CD4 分离试剂盒进行磁性阴性选择,或者使用无菌 FACS 对细胞进行分类
- 使用细胞计数器计数 T 细胞,并以每孔 1-1.5 x 106 的浓度将它们接种在 T 细胞活化孔中,每孔 1 mL RPMI-10 培养基中。在 37 °C 和 5% CO₂ 的加湿培养箱中孵育细胞。如下面的注释所述,允许 24-48 小时进行适当激活,如下面的注释所示。
注:CD3 和 CD28 的交联可有效激活此设置中的 T 细胞。一个小鼠脾脏通常产生大约 1 x 108 个脾细胞。CD4+ T 细胞通常占总脾细胞群的 10% 左右。因此,要制备每孔 1-1.5 x 106 个 CD4 + T 细胞的 24 孔板,估计 2-3 只小鼠的细胞就足够了。
- 第 4 天:转导
- 24 小时后在显微镜下检查 T 细胞。在转导前,确保 T 细胞处于爆破状态(形成簇并因激活而显得增大)。爆破 T 细胞确保它们处于分裂状态,这对 MSCV 转导9 至关重要。
- 从锥形管中的 10 cm 板中收集 ~10 mL 病毒上清液。用另外 10 mL 不含抗生素的 Plat-E 培养基替换 Plat-E 培养板,以确保有足够的培养基产生更多培养基,用于第二天的第二次转导。根据第二天需要转染的 T 细胞孔数调整 PLAT-E 板中的培养基体积。
注意:转导 2 倍可显著提高效率。 - 通过 0.45 μm 注射器过滤器过滤病毒上清液。添加 8 μg/mL 聚凝胺和 1:100 HEPES。
- 将 24 孔 T 细胞板以 950 x g 旋转 7 分钟。小心收集并保存上清液,不要移动细胞。该上清液含有 T 细胞活化后分泌的细胞因子和其他因子,并在感染后被该上清液取代,以维持细胞因子和因子谱,以支持 T 细胞增殖和生长。
- 通过向每个孔中加入 1 mL 病毒上清液并在 32 °C 下以 1,150 x g 旋转 4 小时来进行消毒。 感染期间用保鲜膜密封板。
- 感染后,小心地用先前保存的 T 细胞上清液更换培养基。
- 第 5 天:重复转导
- 按照第 4 天所述重复转染。或者,如果培养基似乎耗尽,则将初始活化的 T 细胞的步骤 3.4.3 中保存的上清液与新鲜培养基以 1:1 的比例混合。
- 第 6 天:洗涤细胞并扩增
- 用 PBS Ca+/Mg+洗涤细胞。并将它们转移到含有 130 U/mL 小鼠 IL2 和 10 ng/mL 小鼠 IL7 的新培养板中。根据注射所需的细胞数量,将细胞孵育至少 2 天或直到它们达到所需的扩增水平。
- 第 8 天:收获和净化
- 收获细胞并使用 Histopaque 1.077 密度梯度进行纯化。
注:该技术有助于从死细胞或碎片中分离出活细胞(如淋巴细胞或其他免疫细胞)。具有更高密度的死细胞将沉淀在试管底部,而活细胞通常留在界面层。 - 将 5 mL Histopaque 1.077 添加到 15 mL 试管中。通过在 4 °C 下以 450 x g 离心 5 分钟以沉淀细胞来收获细胞。
- 将细胞沉淀重悬于 5 mL PBS Ca+/Mg+.将细胞悬液小心地铺在离心管中的 5 mL Histopaque 1.077 上。
- 在室温下以 400-500 x g 离心 20 分钟,确保离心机的断裂/加速设置为零。
- 离心后,细胞将根据密度分离成不同的层。所需的细胞通常位于组织蛋白和上层培养基之间的界面层,而死细胞将沉淀在底部。使用移液器小心地收集界面层的细胞层,避免与其他层污染。收集的细胞现在已准备好进行注射。
- 通过进行 Thy1.1 染色和流式细胞术分析来评估转导效率。参见 图 1 中的门控策略。
注:转导后,细胞可用于趋化性测定,与对照载体细胞相比,细胞可评估其向特定趋化因子的迁移, 从而在进行 注射之前在体外功能上确认其活性。
- 收获细胞并使用 Histopaque 1.077 密度梯度进行纯化。
- 长期 体内定位 测定
- 对于长期归巢,将 CD45.1 用于感兴趣的小鼠 GPCR,将 CD45.2 用于空载体 (反之亦然)转导细胞。以 1:1 的比例混合两个细胞群。
- 为每只 Rag1 - / - 成年受体小鼠静脉注射 20-30 x 106 个总细胞,用于 1 周的趋向性,以及 5 x 106 个细胞,用于 7 周的趋向性。我们使用淋巴细胞缺陷型 Rag1-/- 受体来减少与内源性 T 细胞的竞争。
- 1 至 7 周后(取决于研究),在收获前 5 分钟静脉注射 (i.v.) 向小鼠注射抗 CD45 抗体以标记血源性细胞。
- 使用 CO2 吸入对小鼠实施安乐死,然后进行颈椎脱位。
注意:已经进行了 1 周和 7 周的研究;可能进行更长时间的研究,但尚未进行测试。 - 从不同的目标器官和对照器官中收获细胞。根据每个器官的标准淋巴细胞制备方案消化组织10,11。
- 用单克隆抗体 (mAb) 对收集的细胞进行染色,用于流式细胞术分析。
- 短期竞争归巢:T 细胞定位和成像
- 我们建议使用 C57B6/J 小鼠作为供体,因为我们将对细胞进行荧光标记。然而,对于长达几个小时的非常短的归巢测定,可以使用任何菌株。
- 在培养的第 8 天,根据制造商的说明,使用 CD90.1 微珠磁性分离转导的 (Thy1.1+) 细胞12。
- 如上所述,在此之后,在 IL2 和 IL7 下仅将转导的细胞(纯度为 >95% 纯度)在培养物中维持 2 天,并允许扩增。微珠是可生物降解的,48 小时后不会损害正常的细胞功能。
- 在第 11 天,用羧基荧光素琥珀酰亚胺酯(CFSE 是一种荧光细胞染色染料)标记表达目标 GPCR 的细胞。对于 Stuffer 细胞,使用黄色荧光染料,反之亦然。如果愿意,您可以使用替代染料。
- 在含 2% FBS 的 RPMI 中制备浓度为 1 x 106 个细胞/mL 的细胞悬液。将细胞与终浓度为 5 μM 的染料在 37 °C 下在水浴中孵育 20 分钟,并轻轻搅拌。为确保结果可比较,请在单独的实验中交替使用染料分配。或者,使用单一染料将常见细胞类型标记为内标,包括不同受体中的实验细胞和对照细胞。
- 洗涤标记的细胞并以 1:1 的比例混合。使用细胞计数器估计细胞浓度。将 15-30 x 106 个细胞静脉注射到受体小鼠(WT 或转基因受体小鼠,取决于实验目的)中。
- 大约 10-12 小时后,向小鼠注射抗 CD31 (例如,DyLight 633 标记,克隆 390) 抗体,应在处死前 10-15 分钟注射,以描绘血管并区分血管内细胞和外渗细胞。
- 使用 CO2 吸入对小鼠实施安乐死,然后进行颈椎脱位。如上文步骤 3.8 所述,通过细胞悬液的 FACS 分析细胞定位,或如步骤 3.9.8 或步骤 3.9.7 中所示,使用共聚焦显微镜对感兴趣的器官进行组织整体成像。
- 对于气管、子宫角或淋巴结等较薄的器官,请准备南瓜支架。将纸巾放在侧面贴有双面胶带的载玻片上,加入几滴 Fluoromount-G 封固液,用盖玻片盖住,然后轻轻均匀地按压,使用单独的载玻片或其他平面物体将盖玻片固定在胶带上。
- 对于冷冻切片,将组织包埋在最佳切割温度 (OCT) 化合物中。对于肺,在包埋前用 50% OCT/PBS 灌注。
- 使用流式细胞术检测外周淋巴结 (PLN)、脾脏或血液等对照器官,以评估转导效率 (% Thy1.1+),如图 1 所示,并将结果标准化。使用共聚焦显微镜通过挤压支架或切片可视化 PLN。使用 Imaris 软件的共聚焦显微镜对细胞进行计数。
- 确定 GPCR 转导的细胞与整个器官或特定器官区室中的对照(Stuffer 转导)细胞的比例。标准化为由 FACS 确定的输入比率和/或从 GPCR 已知或假定无关紧要的对照器官中恢复的比率。
- 为了分析肺部的微环境定位,使用 Imaris 软件测量细胞与组织学标志(例如,支气管基底膜或静脉)的距离。
结果
在这项研究中,我们提出了一个详细的方案,用于研究特异性受体在体内指导 T 细胞定位的能力。作为该协议的演示,我们使用了 GPR2513。我们能够使用该方案实现 30%-40% 的转导效率,如流式细胞术的 Thy1.1 染色所评估的那样。我们使用 GPR25 转导的细胞和填充剂对照进行了基于 体外 transwell 的趋化性测定,测试它们向 hCXCL17、mCXCL17 和 CXCL12 作为阳性对照的迁移。与填充体转导的细胞相比,GPR25 转导的 T 细胞有效地迁移到 CXCL17,证实了受体的成功转导和功能表达(图 2)。
长期归位
图 1 描述了分析各种器官中 T 细胞的门控策略。在组织收获前 5 分钟注射抗 CD45 抗体,以从分析中排除血管内细胞。仅纳入表明转导成功的 TCRβ + CD4 + Thy1.1 + 细胞。计算每个器官表达 GPCR 的细胞与具有空载体的细胞的比率。将这些结果归一化为输入细胞池的原始转导百分比 (% Thy1.1+)。
注射到受体小鼠后,GPR25 转导的细胞优先填充非肠粘膜组织 (NIMT),例如富含GPR25LG的泌尿生殖道 (GU)、胃和气管器官(图 3)。我们的研究显示,在注射后 7 周而不是 1 周时,全肺分离株中 GPR25 转导的细胞显着富集,这表明随着时间的推移,肺内可能成熟或重新定位(图 3)。这些发现强调了选择合适的研究长度的重要性。
短期归位
为了研究 GPR25 的体内定位及其在从血流归巢到 NIMT 中的作用,我们进行了短期归巢测定。将 GPR25 转导的 T 细胞与对照载体转导的细胞共同注射,并在静脉内转移至野生型 (WT) 和 CXCL17 - / - 小鼠后 10-12 小时进行分析(图 4)。在处死前 20 分钟施用抗 CD31 以区分血管内细胞和外渗细胞。在 WT 受体中,GPR25 表达赋予富含 CXCL17 的器官(如气管、胃、舌、胆囊和子宫粘膜)归巢优势,但不赋予 CXCL17 不表达的肠道、淋巴结或脾脏(图 4A-C)。有趣的是,共聚焦成像和定量显示,GPR25 转导的 T 细胞不仅在外渗细胞中富集,而且在 NIMT 内仍附着在血管内皮的细胞中富集,这表明该途径有助于内皮的初始停滞以及进入靶组织和迁移到粘膜上皮。当注射到 CXCL17 - / - 受体中时,GPR25 转导的 T 细胞相对于填充体转导的细胞的优势被消除。
在肺的支气管血管周围间质内,GPR25 转导的细胞主要位于支气管,而对照细胞更常出现在静脉附近(图 4D)。这种模式表明细胞从静脉部位到支气管粘膜下层的 GPR25 依赖性重新定位。然而,GPR25 转导的细胞没有表现出对细支气管的偏好,并且未能与 CXCL17 - / - 受体的对照细胞分离。这些发现表明,GPR25 化学亲和力特异性驱动定位到肺支气管,而初始外渗可能不依赖于 GPR25 并由替代机制介导。
我们的技术使我们能够得出结论,GPR25-CXCL17 轴特异性介导淋巴细胞募集到呼吸道、上消化道、胆道和泌尿生殖道。此处详述的方案定义了 GPR25 在组织特异性归巢中的作用,有助于更深入地了解这种先前的孤儿受体如何影响不同组织微环境中的 T 细胞定位。
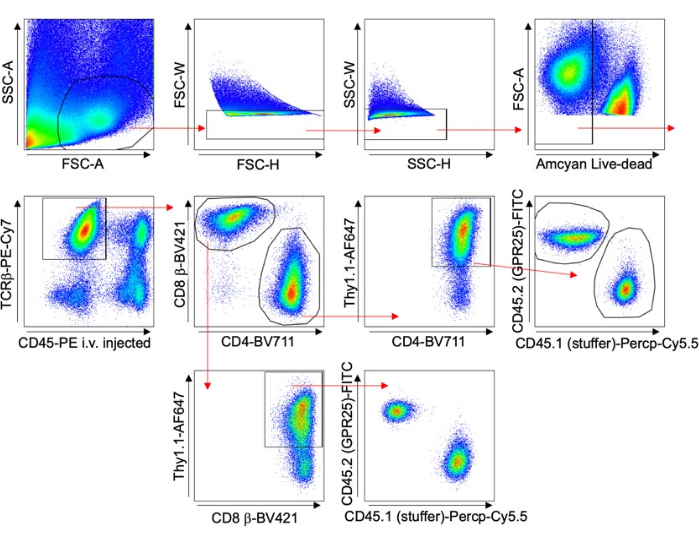
图 1:代表性的门控策略。 FACS 图显示了用于小鼠 T 细胞转导实验的门控策略,特别是用于长期归巢研究(肺示例)。静脉注射 CD45-PE 和 Thy1.1 染色用于排除血管内细胞并特异性分析转导细胞。 请单击此处查看此图的较大版本。
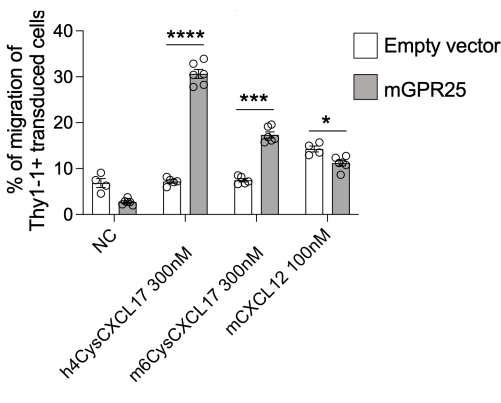
图 2:转导细胞的趋化性以检查其功能。 在基于 transwell 的迁移测定中,mGPR25 转导的细胞(而不是空载体转导的对应细胞) 在体外 对小鼠和人 CXCL17 具有强大的趋化性。结果以来自至少两个独立实验的平均 ± SEM 表示。P < 0.0001 与无趋化因子对照(双尾 t 检验)。此数字已从13 修改。 请单击此处查看此图的较大版本。

图 3:长期归巢的 FACS 结果。注射到 Rag1 - / - 小鼠中注射后 1 周和 7 周组织中 GPR25 转导与对照载体转导细胞的比率。通过 CD45.1 与 CD45.2 同种异型区分 GPR25 和对照细胞,在不同的实验中切换,通过流式细胞术分析,并归一化为输入比。从三个独立实验(每个实验 2-3 只小鼠)汇总的结果显示为 SEM ±平均值。*P < 0.05,**P < 0.01,***P < 0.001(双尾 T 检验)。N/A 表示用于分析的细胞回收率低。此数字已从13 修改。 请单击此处查看此图的较大版本。
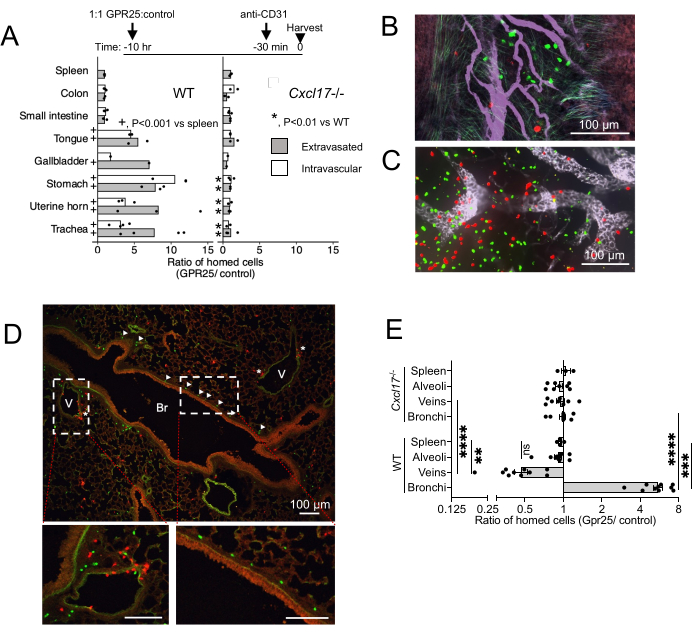
图 4:短期归巢的共聚焦成像结果。 (A) 注射后 10-12 小时 GPR25 与对照供体细胞的比率,通过整个安装组织或冷冻切片的共聚焦显微镜确定。通过流式细胞术测定对照脾中的比率。P 值来自 Fisher 精确检验得出的 P 值,该检验比较了 WT 受体 (+) 中指示靶组织中的细胞计数与脾脏,或比较 了 CXCL17-/- 与 WT 受体 (*) 中靶组织的细胞计数。从 1 个(胆囊)或 2-4 个独立实验中合并的细胞计数,每个条件和实验一只小鼠。显示平均比率。(B - D)注射后 10 小时气管 (B)、PLN (C) 和肺横截面 (D) 的代表性图像,显示 GPR25(绿色)和对照(红色)CD4 T 细胞。(D) 中的箭头表示定位于支气管 (Br) 的 GPR25 细胞;星号表示静脉附近的细胞 (V)。(E) GPR25 与指定肺部微环境中对照供体细胞的比率:支气管:支气管基底膜 30 μm 以内。静脉:距离静脉内皮 30 μm 以内或与静脉内皮接触。肺泡:在与静脉或支气管不相邻的肺泡空间内。每个点是 WT 和 CXCL17 的 2-4 个独立 10x 场内的比率,代表 ~ 4 mm2。从 (B) 中复制脾比值进行比较。结果显示 3 个独立实验,每个实验 1-2 只小鼠,显示为平均 ± SEM。*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001 vs 脾脏;WT 与 CXCL17-/- (双尾 t 检验)。此数字已从13 修改。 请单击此处查看此图的较大版本。
讨论
本研究中概述的内部控制归巢测定是一种用于检查 GPCR 介导的 T 细胞在不同器官和组织微环境中的运输和定位的综合方法。这种方法集成了几项关键优化,以提高可重复性、准确性和效率。
该方案的一个关键方面是使用 MSCV 逆转录病毒载体高效转导 T 细胞,这通过使用 Plat-E 细胞进行病毒生产而得到促进。关键优化包括将 Plat-E 细胞维持在适当的汇合度,使用多聚-D-赖氨酸包被的板来增强病毒转染,以及采用双转导策略来最大化 GPCR 表达。由于 MSCV 载体需要主动细胞分裂才能有效整合基因组,因此通过 T 细胞活化诱导细胞周期进入可显著提高逆转录病毒转导效率。高浓度的抗 CD3 和 CD28 抗体对于确保 T 细胞活化和爆破至关重要,我们的研究发现,这比其他地方报道的较低浓度更有效14。我们还发现,在培养基中加入细胞因子 IL-2 和 IL-7 对于维持 T 细胞活力和促进其扩增至关重要,从而确保准确迁移和归巢研究所需的健康转导 T 细胞群。
除了优化逆转录病毒转导外,该方案还允许使用 CD45.1/CD45.2 标记物进行长期归巢研究,以区分同一宿主内的竞争性实验中 GPCR 转导的细胞和对照细胞。这种方法确保细胞暴露于相同的生理线索。Thy1.1 标志物的加入对于区分转导和未转导的 T 细胞很有价值,尤其是在没有针对孤儿 GPCR 的特异性抗体时。适用于某些应用的替代方案是使用荧光蛋白代替 Thy1.1 盒。
对于通过 FACS 分析归巢细胞,该方案采用在组织收获前 5 分钟注射抗 CD45 抗体来区分循环细胞和组织驻留细胞,防止对归巢数据的误解。对于共聚焦显微镜检查,在处死前 10-30 分钟注射抗 CD31 抗体以标记血管,从而精确观察 T 细胞定位并区分附着在血管内皮上的细胞和外渗细胞。使用 Imaris 软件进行图像分析可量化细胞与组织学标志的距离,从而提供对其微环境定位和相互作用的详细见解。
该方案的优势在于并排比较其他相同细胞的行为,这些细胞仅在转导受体的表达上有所不同。虽然我们使用传统术语竞争性归巢来描述对照细胞和对照细胞的共注入和随后的归巢,但我们承认该术语在技术上用词不当。在短期检测中,组织募集机制可能过多,这使得细胞群之间的实际竞争不太可能。更准确的术语是比较归巢或内部控制的归巢,因为该协议以受控和比较的方式评估归巢行为。此外,生理迁移和归巢可能涉及多种化学引诱受体的综合贡献,这些受体可以同时或依次作用,以指导体内存在的引诱剂复杂区域中的细胞多步迁移 15。在我们采用的条件下,T 细胞在体外激活自发表达 CXCR3 和可能的其他 GPCR,它们通过与转导受体的协调,可能影响细胞的最终定位。逆转录病毒转导通常会导致靶基因的过表达,并且必须考虑到受体表达水平也会影响归巢。此外,理论上,受体的过表达可以独立于受体-配体相互作用而改变细胞特性。为了解决这个问题,我们使用缺乏 GPR25 配体的 CXCL17-/-小鼠进行了互补表达。这种方法有助于确保我们观察到的效果是由同源配体识别介导的。无法获得特定敲除菌株的研究人员可以结合 shRNA 或 CRISPR 技术来敲低或敲除 T 细胞中的特定 GPCR。这种适应可以进一步增强研究 T 细胞中 GPCR 功能的方案的多功能性。
虽然逆转录病毒转导效率高,但它需要活跃分裂的细胞,这可能无法准确反映静止细胞的行为。一些趋化因子受体根据细胞的增殖状态表现出不同的活性,尽管它们的特异性保持不变。另一种方法,氖离子电穿孔,已在 T 细胞中显示出高转染效率,尽管是瞬时的16。这对于短期检测可能足够,而 MSCV 可以产生稳定的表达,使其适用于短期和长期研究。然而,我们找不到表明该系统已被用于归巢研究的文献。如果转染效率低,我们可能需要使用可见标记物选择细胞,例如与 GFP 共转染。
该协议提供了细胞运输的静态快照,限制了对实时细胞行为和运动的洞察。它还具有固有的分辨率限制,特别是对于观察亚细胞结构和精细组织结构。为了应对这些挑战,我们建议使用先进的成像技术,例如多光子显微镜、活细胞成像和活体显微镜。这些方法提供了更高的空间分辨率、更深的组织渗透性以及动态可视化细胞过程的能力。特别是活体显微镜,可以实时跟踪体内 T 细胞的行为,从而能够在其天然环境中观察细胞迁移、相互作用和对刺激的反应。这种方法对于评估 T 细胞归巢和组织定位特别强大,揭示了细胞如何动态适应不同的微环境。通过整合这些先进的成像技术,未来的研究可以更全面地了解 T 细胞的运动、相互作用和 GPCR 介导的归巢,从而显着增强对它们在组织内行为的了解。
我们提供的方案将有助于研究免疫细胞归巢中的 GPCR 功能,并在免疫疗法、炎症和自身免疫方面具有广泛的应用。此外,它通过探索靶向癌症的 T 细胞中以前未表征的 GPCR 和解决自身免疫性疾病中不适当的 T 细胞归巢,为发现治疗靶点和改善免疫反应提供了新的机会。
披露声明
作者没有什么可披露的。
致谢
由NIH赠款R01 AI178113和R01 AI047822支持,来自Leona M. & Harry B. Helmsley慈善信托的赠款1903-03787,以及烟草相关疾病研究计划(TRDRP)向E.C.B.提供T31IP1880和T33IR6609的赠款;Y.B. 得到了美国克罗恩病和结肠炎基金会 (835171) 的研究员奖的支持。B.O. 得到了 Ramon Areces 基金会(西班牙马德里)的博士后奖学金和美国克罗恩病和结肠炎基金会 (574148) 的研究员奖的支持。A.A. 得到了加州再生医学研究所 (CIRM) 的支持 - EDUC2-12677。
材料
| Name | Company | Catalog Number | Comments |
| AF647 anti mouse CD90.1-Thy1.1 (OX-7) | Biolegend | 202507 | |
| anti-CD31 (DyLight 633, clone 390) | InvivoMab | BE0377 | |
| anti-mouse CD28 37.51 | eBiosciences | ||
| anti-mouse CD3 145-2c11 | eBiosciences | ||
| APCCy7 anti mouse CD3 (145-2c11) | Biolegend | 100329 | |
| BV421 anti mouse CD8b (Ly-3) | Biolegend | 126629 | |
| BV711 anti mouse CD4 (RM4-5) | Biolegend | 100549 | |
| CD90.1 microbeads | Miltenyi | 130-121-273 | |
| CFSE | Thermoscientific | C34554 | |
| FITC anti mouse CD45.2 (104) | BD | AB_395041 | |
| mouse IL2 | Peprotech | 200-02-50UG | |
| mouse IL7 | Peprotech | 217-17-10UG | |
| Mouse T CD4 isolation kit | STEMCELL technologies | 18000 | |
| MSCV-IRES- Thy1.1 GPR25 | Vectorbuilder | ||
| MSCV-IRES- Thy1.1 Stuffer | Vectorbuilder | ||
| PE-CD45 (30-F11) antibody | Biolegend | 103105 | |
| PECy7 anti mouse TCRb (H57-597) | Tonbo | ||
| PercpCy5.5 anti mouse CD45.1 (A20) | eBiosciences | ||
| Platinum-E (Plat-E) | cell Biolabs. Inc | RV-101 | |
| Yellow fluorescent dye | Thermoscientific |
参考文献
- Cheng, L., et al. Structure, function and drug discovery of GPCR signaling. MolBiomed. 4 (1), 46 (2023).
- Lammermann, T., Kastenmuller, W. Concepts of GPCR-controlled navigation in the immune system. Immunol Rev. 289 (1), 205-231 (2019).
- Fu, H., Ward, E. J., Marelli-Berg, F. M. Mechanisms of t cell organotropism. Cell Mol Life Sci. 73 (16), 3009-3033 (2016).
- Cinalli, R. M., et al. T cell homeostasis requires g protein-coupled receptor-mediated access to trophic signals that promote growth and inhibit chemotaxis. Eur J Immunol. 35 (3), 786-795 (2005).
- Wu, V., et al. Illuminating the onco-GPCRome: Novel g protein-coupled receptor-driven oncocrine networks and targets for cancer immunotherapy. J Biol Chem. 294 (29), 11062-11086 (2019).
- Wu, V. H., et al. The GPCR-alpha(s)-pka signaling axis promotes T-cell dysfunction and cancer immunotherapy failure. Nat Immunol. 24 (8), 1318-1330 (2023).
- Ramezani, A., Hawley, T. S., Hawley, R. G. Stable gammaretroviral vector expression during embryonic stem cell-derived in vitro hematopoietic development. Mol Ther. 14 (2), 245-254 (2006).
- . . Plat-E retroviral packaging cells (RV-101) user manual. , (2024).
- Anderson, J., Hope, T. Intracellular trafficking of retroviral vectors: obstacles and advances. Gene Ther. 12, 1667-1678 (2005).
- Kim, E., et al. Isolation and analyses of lamina propria lymphocytes from mouse intestines. STAR Protoc. 3 (2), 101366 (2022).
- Steinert, E. M., et al. Quantifying Memory CD8 T Cells Reveals Regionalization of Immunosurveillance. Cell. 161 (4), 737-749 (2015).
- Miltenyi Biotec. . CD90.1 MicroBeads mouse and rat. , (2024).
- Ocón, B., et al. A lymphocyte chemoaffinity axis for lung, non-intestinal mucosae and CNS. Nature. 635, 736-745 (2024).
- Sumida, H., et al. Gpr55 regulates intraepithelial lymphocyte migration dynamics and susceptibility to intestinal damage. Sci Immunol. 2 (18), eaao1135 (2017).
- Foxman, E. F., Campbell, J. J., Butcher, E. C. Multistep navigation and the combinatorial control of leukocyte chemotaxis. J. Cell Biol. 139 (5), 1349-1360 (1997).
- Alawar, N., et al. A solution for highly efficient electroporation of primary cytotoxic T lymphocytes. BMC Biotechnol. 24 (1), 16 (2024).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。