Method Article
다양한 조직 미세환경에서 GPCR 매개 T 세포 국소화 연구를 위한 효율적인 레트로바이러스 형질도입 및 경쟁력 있는 호밍(Competitive Homing)
요약
우리는 수용체 매개 장기 및 미세환경 특이적 림프구 위치를 연구하기 위해 트래픽 수용체의 레트로바이러스 전달과 경쟁적 귀환을 위한 개선된 프로토콜을 제시합니다. 이 방법은 면역 세포 이동 메커니즘에 대한 귀중한 통찰력을 제공하며 향후 기초 및 치료 연구에 잠재적으로 응용될 수 있습니다.
초록
G-단백질 결합 수용체(GPCR) 발현이 다양한 조직 미세환경 내에서 세포 위치에 어떻게 영향을 미치는지 이해하는 것은 면역 세포 이동 메커니즘을 밝히는 데 필수적입니다. 당사는 동족 화학유인 리간드를 발현하는 장기에 대한 GPCR 매개 T 세포 국소화를 연구하기 위해 고안된 경쟁력 있는 homing assay를 제시하며, 이는 단기 및 장기 연구 모두에 적용할 수 있습니다. 이 접근법은 관심 GPCR 또는 대조 구조를 발현하기 위해 T 세포의 재조합 쥐 줄기 세포 바이러스(MSCV) 형질도입을 위한 개선된 프로토콜과 수용 마우스에서 경쟁적 귀환을 포함합니다. 서로 다른 장기에 걸친 세포 분포는 유세포 분석 및/또는 컨포칼 현미경을 사용하여 분석됩니다. 단기 실험(10-12시간)에서 컨포칼 현미경은 폐포, 기관지 점막하, 정맥 부위 및 폐의 간질뿐만 아니라 기관, 위 및 자궁 뿔을 둘러싸고 있는 상피를 포함하여 뚜렷한 세포 국소화 패턴을 보여주었습니다. 장기 연구(1-7주)에서 유세포 분석은 선호 세포 축적에 대한 통찰력을 제공하여 시간이 지남에 따라 조직 내 동적 변화와 잠재적인 성숙 또는 재배치를 밝혔습니다. 이 경쟁력 있는 homing assay는 GPCR 매개 세포 포지셔닝을 연구하기 위한 강력한 도구로, 면역학 및 치료 연구에서 조직 특이적 분포 및 잠재적 응용 분야에 대한 귀중한 통찰력을 제공합니다.
서문
G-단백질 결합 수용체(GPCR)는 신호 전달, 신경 전달, 호르몬 조절, 면역 세포 이동을 포함한 다양한 세포 과정을 조절하는 데 필수적입니다1. 그들은 림프구 이동 및 국소화의 시공간 조절에 중요한 역할을 합니다2. 면역 반응의 프라이밍 단계(priming phase) 동안, 국소 미세환경과 세포 상호작용은 T 림프구가 귀환 수용체(homing receptor)로 알려진 독특한 접착 분자와 케모카인 수용체를 발현하도록 유도합니다. 이러한 적응을 통해 항원 경험이 있는 T 세포가 장기 특이적 내피 세포(EC)와 결합하여 별개의 표적 조직으로 이동할 수 있습니다. T 세포가 조직 영양성을 획득하는 능력은 특히 동일한 장기에 영향을 미치는 재발성 감염의 맥락에서 효과적인 회상 반응에 필수적입니다 3,4.
GPCR은 면역 세포를 특정 조직 및 장기로 유도하여 CD8+ T 및 NK 세포를 종양 부위로 유도하여 세포독성 작용을 하도록 하거나 CD4+ T 세포가 다른 면역 세포의 활성화를 지원함으로써 면역 반응을 조정하도록 돕는 것과 같은 중요한 기능을 수행합니다. GPCR이 어떻게 T 세포를 정확한 위치로 유도하는지 이해하는 것은 표적 면역 요법을 발전시키는 데 필수적입니다 5,6. 그러나 문제는 공간적으로 제한된 신호와 방향성 화학주성 신호를 동시에 복제하는 것이 어렵기 때문에 이러한 복잡한 상호 작용을 in vitro에서 모델링하는 데 있습니다.
특정 백혈구 수용체의 역할을 밝히는 것도 내인성 집단에서 발현 빈도가 제한적이고 이러한 수용체가 일반적으로 별개의 세포 유형을 장식한다는 사실로 인해 어려운 경우가 많습니다. 이러한 복잡성으로 인해 특정 수용체의 역할을 다른 세포 하위 집합 특이적 메커니즘과 분리하기가 어렵습니다. 이상적으로, 방법은 명확한 통찰력을 제공하기 위해 관심 수용체만 다른 유사한 집단을 비교해야 합니다.
이러한 문제를 극복하기 위해 당사는 T 세포에서 효율적인 GPCR 발현을 위해 재조합 MSCV 레트로바이러스 형질도입을 사용하는 경쟁력 있는 homing assay를 채택했습니다. 골수증식성 육종 바이러스(PCMV) 기반 MESV 벡터와 Moloney 쥐 백혈병 바이러스(MMLV) 기반 LN 벡터의 요소를 결합한 MSCV 레트로바이러스 벡터는 LN 벡터7에서 파생된 확장된 하이브리드 패키징 신호를 통합합니다. 이러한 변형은 유전자 전달의 효율성을 향상시켜 in vivo에서 T 세포 국소화에 대한 단기 및 장기 연구를 모두 가능하게 합니다. 고역가 레트로바이러스 입자와 컨포칼 현미경을 활용함으로써 이 접근 방식을 통해 복잡한 조직 환경 내에서 T 세포 위치 및 상호 작용을 정밀하게 시각화할 수 있습니다. 우리는 수용체 매개 장기 및 미세환경 특이적 림프구 위치를 연구하기 위해 교통 수용체의 레트로바이러스 전달과 내부 제어(소위 경쟁적) 귀환 분석의 수행에 대한 자세한 프로토콜을 제시합니다. 이 방법의 전반적인 목표는 면역 세포 이동 메커니즘에 대한 귀중한 통찰력을 제공하고 기초 연구 및 치료 개발 모두에서 향후 응용 프로그램을 가능하게 하는 것입니다.
프로토콜
이 연구의 모든 마우스는 VAPAHCS(Veterans Affairs Palo Alto Health Care System)의 특정 병원체가 없는(SPF) 시설에서 유지되었습니다. B6/SJL Prprc Pep3BoyJ(CD45.1), C57B6/J(CD45.2) 및 Rag1-/- 마우스는 Jackson Laboratories에서 구입했습니다. CD45.1 셀을 얻기 위해 PepBoy를 사용했지만 JAXBoy(C57BL/6J-Ptprcem6Lutzy/J)를 사용하는 것이 좋습니다. JAXBoy는 기존의 역교차(backcrossing) 대신 CRISPR을 통해 생성된 완전 공생(coisogenic) 균주로, 유전적 일관성을 향상시킵니다. 역사적으로 완전히 선천적이지 않은 PepBoy 마우스(CD45.1)를 사용한 CD45 동종형 표시 연구에는 잠재적인 변동성을 해결하기 위해 야생형(WT/WT) 비교를 통한 대조군 귀환 및 재순환 분석이 포함되었습니다. JAXBoy 마우스가 이제 완전한 동종 대안으로 제공됨에 따라 이러한 추가 제어가 더 이상 필요하지 않을 수 있습니다. 연구자들은 단백질 티로신 인산가수분해효소(tyrosine phosphatases)로서의 역할과 같은 CD45.1 변이체와 CD45.2 변이체의 차이점이 세포 행동과 귀환 패턴에 영향을 미칠 수 있다는 점을 고려해야 합니다. 본문 및 아래에서 논의된 모든 프로토콜은 VA Palo Alto Health Care System(VAPAHCS)의 공인 실험실 동물 의학부 및 실험실 동물 관리에 대한 관리 패널의 승인을 받았거나 지침을 충족합니다. 동물은 승인된 절차에 따라 희생되었습니다. 8-12주 된 남녀 모두의 쥐가 실험에 포함되었습니다.
1. MSCV 벡터 준비
- 마우스 관심 유전자(GOI) 또는 ORF_Stuffer(음성 ORF 대조군)의 코딩 영역이 있는 MSCV-IRES-Thy1.1 레트로바이러스 벡터를 구매합니다.
참고: 이 구성물에는 관심 GPCR 유전자와 함께 Thy1.1 표면 마커가 포함됩니다. IRES(Internal Ribosome Entry Site) 링커는 GPCR과 Thy1.1의 동시 발현을 가능하게 하여 유세포 분석 또는 자기 비드에 의한 정제 및 분리를 통한 형질도입된 세포의 식별을 용이하게 합니다. 이는 GPCR에 특이적인 항체를 사용할 수 없을 때, 즉 제대로 연구되지 않은 GPCR의 경우와 같이 특히 유용합니다. - 플라스미드에 의해 암호화된 내성 유전자(예: 암피실린, 카나마이신 또는 클로람페니콜)에 따라 적절한 항생제를 선별하여 보충된 Luria-Bertani(LB) 배지를 접종하여 MSCV 플라스미드를 박테리아 형태로 조달하고 배양합니다. LB 배지는 트립톤(10g/L), 효모 추출물(5g/L) 및 NaCl(10g/L)로 구성되며 pH 7.0으로 조정되고 오토클레이브로 멸균됩니다. 37°C의 진탕 인큐베이터(220 RPM)에서 밤새 배양합니다.
- DNA Preparation Kit를 사용하여 표준 분자 생물학 기법을 사용하여 플라스미드 스톡을 준비합니다.
- DNA 분리 후 분광 광도계로 DNA의 농도를 측정하고 1 μg/μL의 농도로 작동 중인 플라스미드 용액을 준비합니다. 나중에 사용할 수 있도록 -20 °C에서 플라스미드를 보관합니다.
2. 패키징 세포주 배양 확립
참고: Cell Biolabs의 Platinum E(Plat-E) 세포를 사용했습니다. Plat-E 세포는 EF1α promoter를 가진 293T 기반 세포주로, 레트로바이러스 구조 단백질(gag, pol 및 env 유전자)의 안정적이고 높은 수율 발현을 제공하여 단일 plasmid transfection8로 레트로바이러스 패키징을 가능하게 합니다. NIH-3T3 또는 293T와 같은 다른 세포주를 사용할 수 있지만 이러한 대안을 테스트하지 않았습니다.
- DMEM, 10% FBS, 1% 페니실린/스트렙토마이신, 블라스티시딘(10μg/mL) 및 퓨로마이신(1μg/mL)을 첨가하여 Plat-E 세포 배지를 준비합니다. 세포 유지를 위해 blasticidin과 puromycin을 사용하되 transfection 중과 후에는 생략합니다.
- Plate Plat-E 세포는 1.0mL, >3 x 106 cells/mL의 DMEM, 20% FBS 및 10% DMSO로 냉동 배송됩니다. 37°C 수조에서 빠르게 해동하십시오. 해동된 모든 세포를 Plat-E 배양 배지가 들어 있는 15mL 원뿔형 튜브로 옮깁니다.
- 450 x g 에서 4°C에서 5분간 원심분리기. 세포 펠렛을 1mL의 Plat-E 배지에 부드럽게 피펫팅하여 단일 세포 현탁액을 생성하여 재현탁합니다.
- 10cm 배양 접시에 Plat-E 배지 9mL를 첨가한 다음 재현탁 세포 1mL를 접시에 옮깁니다. 동일한 부피의 세포 현탁액과 Trypan Blue를 혼합하고 혈구계 또는 세포 계수기를 사용하여 생존 가능한(염색되지 않은) 세포와 죽은(파란색 염색) 세포를 계수하여 >70%의 생존율을 목표로 해동된 세포가 생존 가능한지 확인합니다.
- 37 ° C의 가습 인큐베이터에서 5 % CO2로 세포를 배양합니다. 처음 3일 동안은 매체를 변경하지 마십시오. 첫 번째 해동 시 떠다니는 세포와 죽은 세포를 관찰하는 것은 정상입니다.
- 세포가 85%-90% 포화도에 도달하면 DMEM/PBS Ca-/Mg-로 세척합니다.2mL의 0.05% 트립신/0.5mM EDTA를 사용하여 세포를 분리하고 37°C에서 3분 동안 배양합니다. Plat-E 배지 8mL를 첨가하고 15mL 원추형 튜브에 세포를 모은 다음 4°C에서 5분 동안 450 x g 로 원심분리합니다.
- 1:10 또는 1:5 표면 비율로 분할합니다(즉, 원래 접시 총 부피의 1/10 또는 1/5로 새 접시를 시드). 최종 부피 10mL의 Plat-E 배지에 재현탁하고 5% CO2로 가습된 인큐베이터에서 37°C에서 배양합니다.
- 1mL의 FBS에 나머지 세포를 10% DMSO로 분취하고 -80°C에서 동결한 후 장기간 사용을 위해 액체 질소에 동결합니다.
참고: 85% 농도에 가까울 때 위에서 설명한 대로 세포를 처리합니다. 최적의 세포 건강을 유지하려면 과도한 포화를 피하고 1:10 희석으로 3일 분할을 목표로 합니다. 성장이 느려지면 신선한 부분 표본을 사용하십시오. 셀 성능은 일반적으로 후속 계대에 따라 감소합니다. 최상의 결과를 위해 4번 경과 15번 사이의 transfection을 위해 세포를 사용하는 것이 좋습니다.
3. 형질도입된 세포의 생산
- 1일차: Seed Plat E 세포
참고: 필요한 Plat E 세포 및 플레이트의 수를 계산합니다. 24웰 플레이트에 웰당 1mL의 바이러스 상등액을 사용하여 세포를 2x transfection했습니다. 당사는 일반적으로 배양에서 T 세포가 있는 24웰 플레이트당 Plate-E 세포가 있는 약 2개의 10cm Petri dish transfected plate를 사용합니다.- 먼저 10cm 조직 배양 플레이트를 멸균수에 5mL의 50μg/mL 폴리-D-라이신으로 코팅합니다. 실온에서 45분 동안 배양합니다. 멸균 PBS Ca-/Mg로 2회 세척하여 잔여물이 남지 않도록 합니다.
참고: 형질주입 후 Plat-E 세포가 분리되는 경향이 있어 세포 성능이 저하되고 바이러스 역가 생성이 감소하므로 플레이트를 코팅하는 것이 좋습니다. - 2.6단계에서 위에서 설명한 대로 Plat-E 세포를 분리하고 trypan blue exclusion assay를 수행하여 생존력을 보장합니다. 동일한 부피의 세포 현탁액과 Trypan Blue를 혼합합니다. 혈구계/세포 계수기를 사용하여 생존 가능한(염색되지 않은) 세포와 죽은(파란색 염색된) 세포를 계산합니다. 3 x 10⁶살아있는 세포를 항생제가 없는 Plat-E 배지로 10cm 조직 배양 페트리 접시에 파종합니다.
참고: 파종된 플레이트는 다음날 85%-90% 포화도에 도달해야 합니다. 이렇게 되지 않으면 다른 세포 분취량을 사용하는 것이 좋습니다. 도금의 타이밍에 따라 파종 밀도를 조정하십시오. 저녁 도금의 경우 3.5 x 106 셀을 사용할 수 있습니다.
- 먼저 10cm 조직 배양 플레이트를 멸균수에 5mL의 50μg/mL 폴리-D-라이신으로 코팅합니다. 실온에서 45분 동안 배양합니다. 멸균 PBS Ca-/Mg로 2회 세척하여 잔여물이 남지 않도록 합니다.
- 2일차: Plat-E 세포의 transfection과 anti-CD3 및 anti-CD28 항체를 이용한 T 세포용 코팅 플레이트
- Plat-E 세포 배양의 배지를 6.5mL의 환원된 혈청 배지로 교체합니다.
- 리포펙타민 시약에 대한 제조업체의 지침에 따라 형질주입 혼합물을 준비합니다(이 연구에서는 Lipofectamine 2000이 사용됨).
- 각 플레이트에 대해 한 튜브에서 45μL의 Lipofectamine 2000과 210μL의 환원된 혈청 배지를 혼합하고, 다른 튜브에서 15μg의 DNA와 235μL의 환원된 혈청 배지를 혼합합니다. 3x-4x를 피펫팅하여 튜브의 내용물을 결합합니다.
- 혼합물을 실온에서 5-20분 동안 배양하여 Lipofectamine/DNA 복합체가 형성되도록 한 다음 플레이트에 적가합니다. 플레이트를 37°C에서 16시간 동안 배양합니다.
- T 세포 활성화 웰: 24웰 플레이트를 375μL/웰 PBS에 5μg/mL의 안티 마우스 CD28(37.51) 및 10μg/mL의 안티 마우스 CD3(145-2c11)로 하룻밤 동안 4°C에서 하룻밤 동안 또는 3일차에 37°C의 인큐베이터에서 3-4시간 동안 코팅합니다.
알림: 증발을 방지하기 위해 밤새 배양하는 경우 플레이트를 투명 필름으로 감싸십시오. Dynabeads 마우스 활성제 CD3/CD28을 대안으로 사용할 수 있으며 비슷한 결과를 얻을 수 있습니다.
- 3일차: Plat-E 배지 변경 및 T 세포 분리 및 활성화
- 아침에 Plat-E transfection 배지를 14mL의 DMEM 완전 배지로 변경합니다. RPMI-10을 첨가하여 T 세포 배지를 준비합니다: L-글루타민, 10% FBS, 1% 페니실린/스트렙토마이신, 1x MEM 비필수 아미노산, 1mM 피루브산 나트륨, 50μM β-메르캅토에탄올 및 1mM HEPES가 포함된 RPMI 1640.
- CO2흡입 후 경추 탈구를 사용하여 JAXBoy(CD45.1) 및 C57B6/J(CD45.2) 마우스를 안락사시킵니다. 비장과 림프절을 무균 상태에서 격리합니다.
- 주사기 플런저를 사용하여 100μm 나일론 메쉬 셀 스트레이너와 RPMI 배지를 6웰 플레이트에 넣고 비장을 부드럽게 으깬다.
- 단일 셀 현탁액을 위한 40μm 나일론 메쉬 셀 스트레이너를 통해 용액을 50mL 코니컬 튜브로 옮깁니다. 450 x g 에서 4 °C에서 5분 동안 원심분리기를 하고 PBS Ca-/Mg-로 세척합니다.
- 제조업체의 지침에 따라 Mouse T/T CD4 Isolation Kit를 사용하여 자기 음성 선택을 수행하거나 멸균 FACS를 사용하여 셀을 정렬합니다.
- 세포 계수기를 사용하여 T 세포를 계수하고 웰당 1mL의 RPMI-10 배지 중 웰당 1-1.5 x 106 으로 T 세포 활성화 웰에 플레이트화합니다. 가습된 인큐베이터에서 37°C에서 5% CO₂로 세포를 배양합니다. 아래 참고 사항에 설명된 대로 현미경으로 평가한 대로 적절한 활성화를 위해 24-48시간을 허용합니다.
참고: CD3와 CD28의 가교결합은 이 설정에서 T 세포를 효과적으로 활성화합니다. 하나의 마우스 비장은 일반적으로 약 1 x 108 개의 비장 세포를 생성합니다. CD4+ T 세포는 일반적으로 전체 비장 세포 집단의 약 10%를 차지합니다. 따라서, 웰당 1-1.5 x 106 CD4+ T 세포를 갖는 24-웰 플레이트를 제조하기 위해서는 2-3 마우스의 세포로 충분할 것으로 추정된다.
- 4일차: 형질전환
- 현미경으로 24시간 후 T 세포를 확인합니다. 형질도입 전에 T 세포가 blasting 상태(클러스터를 형성하고 활성화로 인해 확대된 것처럼 보임)에 있는지 확인합니다. 블라스팅 T 세포는 분열 상태에 있도록 하며, 이는 MSCV transduction9에 매우 중요합니다.
- 원뿔형 튜브의 10cm 플레이트에서 ~10mL의 바이러스 상등액을 수집합니다. Plat-E 배양 플레이트를 항생제가 없는 다른 10mL의 Plat-E 배지로 교체하여 다음 날 두 번째 형질도입을 위해 더 많은 배지를 생성하기에 충분한 배지를 확보합니다. 다음 날 transfection해야 하는 T cell well의 수에 따라 PLAT-E 플레이트의 배지 부피를 조정합니다.
참고: 2배를 전송하면 효율성이 크게 향상됩니다. - 0.45μm 주사기 필터를 통과하여 바이러스 상층액을 여과합니다. 8μg/mL의 폴리브레렌과 1:100 HEPES를 추가합니다.
- 24웰 T 셀 플레이트를 950 x g에서 7분 동안 회전시킵니다. 세포를 제거하지 않고 상층액을 조심스럽게 수집하고 보관하십시오. 이 상등액은 활성화 후 T 세포에서 분비되는 사이토카인 및 기타 인자를 포함하고 있으며 감염 후 이 상등액으로 대체되어 사이토카인 및 인자 프로파일을 유지하여 T 세포 증식 및 성장을 지원합니다.
- 각 웰에 1mL의 바이러스 상등액을 첨가하고 32°C에서 4시간 동안 1,150 x g 으로 회전하여 감염을 수행합니다. 감염 중에는 플라스틱 랩으로 플레이트를 밀봉하십시오.
- 감염 후 배지를 이전에 저장한 T 세포 상층액으로 조심스럽게 교체합니다.
- 5일차: 반복 형질전환
- 4일차에 설명된 대로 transfection을 반복합니다. 선택적으로, 초기에 활성화된 T 세포의 3.4.3단계에서 저장된 상등액을 배지가 소진된 것처럼 보이는 경우 1:1 비율로 새로운 배지와 혼합합니다.
- 6일차: 세포 세척 및 확장
- PBS Ca+/Mg+로 세포를 세척합니다. 130 U/mL 마우스 IL2 및 10 ng/mL 마우스 IL7이 포함된 새 배양 플레이트로 옮깁니다. 최소 2일 동안 또는 주입에 필요한 세포 수에 따라 원하는 확장 수준에 도달할 때까지 세포를 배양합니다.
- 8일차: 수확과 정화
- 세포를 수확하고 Histopaque 1.077 밀도 구배로 정제합니다.
참고: 이 기술은 생존 가능한 세포(예: 림프구 또는 기타 면역 세포)를 죽은 세포나 파편에서 분리하는 데 도움이 됩니다. 밀도가 더 높은 죽은 세포는 튜브 바닥에 가라앉는 반면, 생존 가능한 세포는 일반적으로 계면층에 남아 있습니다. - 15mL 튜브에 Histopaque 1.077 5mL를 추가합니다. 450 x g 에서 4°C에서 5분 동안 원심분리하여 세포를 펠릿화하여 세포를 수확합니다.
- 세포 펠릿을 5mL의 PBS Ca+/Mg+에 재현탁합니다. 원심분리 튜브에 있는 5mL의 Histopaque 1.077 위에 세포 현탁액을 조심스럽게 겹칩니다.
- 실온에서 20분 동안 400-500 x g 의 원심분리기를 사용하여 원심분리기의 차단/가속이 0으로 설정되도록 합니다.
- 원심분리 후 세포는 밀도에 따라 별개의 층으로 분리됩니다. 원하는 세포는 일반적으로 히스토파크와 상부 매체 사이의 계면 층에 있고 죽은 세포는 하단에 정착합니다. 피펫을 사용하여 계면층에서 세포층을 조심스럽게 수집하여 다른 층으로 오염되지 않도록 합니다. 수집된 세포는 이제 주사를 맞을 준비가 되고 깨끗해졌습니다.
- Thy1.1 염색 및 유세포 분석을 수행하여 transduction efficiency를 평가합니다. 그림 1의 게이팅 전략을 참조하십시오.
참고: transduction 후, 세포는 chemotaxis assay에 사용되어 대조군 벡터 세포와 비교하여 특정 chemokine으로의 이동을 평가하여 주입을 진행하기 전에 in vitro 에서 활성을 기능적으로 확인할 수 있습니다.
- 세포를 수확하고 Histopaque 1.077 밀도 구배로 정제합니다.
- 장기 in vivo 국소화 분석
- 장기 homing의 경우 관심 있는 마우스 GPCR에는 CD45.1을 사용하고 빈 벡터(또는 그 반대로) 형질도입된 세포에는 CD45.2를 사용합니다. 두 세포 집단을 1:1 비율로 혼합합니다.
- 각 Rag1-/- 성인 수혜자 마우스에 대해 1주일 트로피즘 및 7주 길이의 트로피즘에 대해 5 x 106개의 총 세포 20-30 x 106개를 정맥 주사합니다. 우리는 내인성 T 세포와의 경쟁을 줄이기 위해 림프구 결핍 Rag1-/- 수용자를 사용합니다.
- 1-7주 후(연구에 따라 다름), 수확 5분 전에 항-CD45 항체를 마우스에 정맥 주사(i.v.)하여 혈액 매개 세포를 라벨링합니다.
- CO2 흡입 후 경추 탈구를 사용하여 마우스를 안락사시킵니다.
참고: 1주일과 7주에 대한 연구가 수행되었습니다. 더 긴 연구가 가능할 수 있지만 아직 테스트되지 않았습니다. - 관심 기관과 대조군의 다양한 기관에서 세포를 수확합니다. 각 장기에 대한 표준 림프구 준비 프로토콜에 따라 조직을 소화하십시오10,11.
- 유세포 분석을 위해 수집된 세포를 단클론 항체(mAb)로 염색합니다.
- 단기 경쟁력 있는 호밍(homing): T 세포 포지셔닝 및 이미징
- C57B6/J 마우스를 기증자로 사용하는 것이 좋으며, 세포를 형광 표지할 예정이므로 이를 권장합니다. 그러나 최대 몇 시간까지의 매우 짧은 원점 복귀 분석의 경우 모든 균주를 사용할 수 있습니다.
- 배양 8일차에 제조업체의 지침에 따라 CD90.1 마이크로비즈를 사용하여 형질도입된(Thy1.1+) 세포를 자기적으로 분리합니다12.
- 이 시점 이후 배양에서 형질도입된 세포(>95% 순도)만 위에 표시된 바와 같이 IL2 및 IL7 하에서 2일 동안 유지하고 팽창시킵니다. 마이크로비즈는 생분해성이며 48시간 후에도 정상적인 세포 기능을 손상시키지 않습니다.
- 11일차에 관심 GPCR을 발현하는 세포에 Carboxyfluorescein succinimidyl ester(CFSE는 형광 세포 염색 염료)를 표시합니다. 스터퍼 세포의 경우 노란색 형광 염료를 사용하거나 그 반대의 경우도 마찬가지입니다. 원하는 경우 대체 염료를 사용할 수 있습니다.
- 2% FBS를 사용하여 RPMI에서 1 x 106 cells/mL의 농도로 세포 현탁액을 준비합니다. 37°C에서 5μM의 최종 농도로 염료를 주입하여 수조에서 20분 동안 부드럽게 교반하여 세포를 배양합니다. 비교 가능한 결과를 보장하려면 별도의 실험에서 염료 할당을 번갈아 가며 수행하십시오. 또는 단일 염료를 사용하여 서로 다른 수용체의 실험 및 대조 세포를 포함하는 일반적인 세포 유형을 내부 표준물질로 표시합니다.
- 라벨링된 세포를 세척하고 1:1 비율로 혼합합니다. 세포 계수기를 사용하여 세포 농도를 추정합니다. 15-30 x 106 세포를 수용 마우스(실험 목적에 따라 WT 또는 형질전환 수용 마우스)에 정맥 주사합니다.
- 약 10-12시간 후, 생쥐에 항-CD31(예: DyLight 633 라벨, 클론 390) 항체를 주입하며, 이는 혈관을 묘사하고 혈관 내 세포와 외출된 세포를 구별하기 위해 희생하기 10-15분 전에 해야 합니다.
- CO2 흡입 후 경추 탈구를 사용하여 마우스를 안락사시킵니다. 위의 3.8단계에서 설명한 대로 세포 현탁액의 FACS로 세포 국소화를 분석하거나 컨포칼 현미경을 사용하여 관심 장기에 대해 3.9.8단계 또는 3.9.7단계와 같이 조직 전체 마운트를 이미징하여 세포 국소화를 분석합니다.
- 기관, 자궁 뿔 또는 림프절과 같은 얇은 장기의 경우 스쿼시 마운트를 준비합니다. 측면에 양면 테이프가 있는 슬라이드에 티슈를 놓고 Fluoromount-G 마운팅 솔루션 몇 방울을 넣고 커버 슬립으로 덮고 별도의 슬라이드나 다른 평평한 물체를 사용하여 커버 슬립을 테이프에 고정하기 위해 부드럽고 균일하게 누릅니다.
- 동결된 부분의 경우 조직을 최적 절단 온도(OCT) 화합물에 삽입하십시오. 폐의 경우 임베인딩하기 전에 50% OCT/PBS로 관류합니다.
- 말초 림프절(PLN), 비장 또는 혈액과 같은 제어 기관에 대한 유세포 분석을 사용하여 그림 1 과 같이 전달 효율(% Thy1.1+)을 평가하고 결과를 정규화합니다. 컨포칼 현미경을 사용하여 스쿼시 마운트 또는 단면으로 PLN을 시각화합니다. Imaris 소프트웨어와 함께 컨포칼 현미경을 사용하여 세포를 계수합니다.
- 전체 장기 또는 특정 장기 구획에서 대조군(Stuffer 형질전환) 세포에 대한 GPCR 형질도입 세포의 비율을 결정합니다. FACS에 의해 결정된 입력 비율 및/또는 GPCR이 관련이 없는 것으로 알려지거나 관련이 없는 것으로 추정되는 제어 기관에서 회수된 비율로 정규화합니다.
- 폐의 미세환경 국소화를 분석하기 위해 Imaris 소프트웨어를 사용하여 조직학적 랜드마크(예: 기관지 기저막 또는 정맥)까지 세포의 거리를 측정합니다.
결과
이 연구에서는 생체 내에서 T 세포 국소화를 지시하는 특정 수용체의 능력을 조사하기 위한 자세한 프로토콜을 제시합니다. 이 프로토콜의 데모로 GPR2513을 사용했습니다. 유세포 분석에 의한 Thy1.1 염색으로 평가된 바와 같이 이 프로토콜을 사용하여 30%-40%의 transduction efficiency를 달성할 수 있습니다. 당사는 스터퍼 대조군과 함께 GPR25 형질 주입 세포를 사용하여 체외 트랜스웰 기반 화학주성 분석을 수행하여 양성 대조군인 hCXCL17, mCXCL17 및 CXCL12로의 이동을 테스트했습니다. GPR25 형질도입 T 세포는 스터퍼 형질주입 세포에 비해 CXCL17로 효율적으로 이동하여, 수용체의 성공적인 형질도입 및 기능적 발현을 확인했습니다(그림 2).
장기 원점 복귀
그림 1 다양한 장기에 걸쳐 T 세포를 분석하기 위한 게이팅 전략을 묘사합니다. 조직 채취 5분 전에 항-CD45 항체를 주입하여 혈관 내 세포를 분석에서 제외했습니다. 성공적인 형질도입을 나타내는 TCRβ+ CD4+ Thy1.1+ 세포만 포함되었습니다. GPCR 발현 세포와 빈 벡터를 가진 세포의 비율을 각 장기에 대해 계산했습니다. 이러한 결과는 입력 세포 풀의 원래 형질 도입 비율(% Thy1.1+)로 정규화되었습니다.
수용 마우스에 주입한 후, GPR25 형질 도입 세포는 비뇨생식기(GU), 위 및 GPR25LG이 풍부한 기관 기관과 같은 비장 점막 조직(NIMT)을 우선적으로 채웠습니다(그림 3). 우리의 연구는 주입 후 1주가 아닌 7주에 전체 폐 분리물에서 GPR25 형질 도입 세포의 상당한 농축을 보여주었으며, 이는 시간이 지남에 따라 폐 내에서 잠재적인 성숙 또는 재배치를 시사합니다(그림 3). 이러한 결과는 적절한 연구 기간을 선택하는 것이 중요하다는 점을 강조합니다.
단기 원점 복귀
GPR25의 in vivo 국소화와 혈류에서 NIMT로의 homing에 대한 역할을 조사하기 위해 단기 homing assay를 수행했습니다. GPR25 형질도입 T 세포를 대조군 벡터 형질도입 세포와 함께 주입하고 야생형(WT) 및 CXCL17-/- 마우스로 정맥 주사 후 10-12시간 동안 분석했습니다(그림 4). 혈관 내 세포와 유출된 세포를 구별하기 위해 희생 20분 전에 항-CD31을 투여했습니다. WT 이식자에서 GPR25 발현은 기관, 위, 혀, 담낭 및 자궁 점막과 같은 CXCL17이 풍부한 기관에 귀환 이점을 제공했지만 CXCL17이 발현되지 않는 장, 림프절 또는 비장에는 그렇지 않았습니다(그림 4A-C). 흥미롭게도, 컨포칼 이미징 및 정량화는 GPR25 형질도입 T 세포가 외출된 세포뿐만 아니라 NIMT 내의 혈관 내피에 여전히 부착된 세포 사이에서도 풍부하다는 것을 보여주었으며, 이는 이 경로가 내피에서의 초기 정지뿐만 아니라 표적 조직으로의 진입 및 점막 상피로의 이동에 기여한다는 것을 시사합니다. 스터퍼 형질주입 세포에 비해 GPR25 형질도입 T 세포의 장점은 CXCL17-/- 수용자에 주입할 때 제거되었습니다.
폐의 기관지주위 혈관 간질 내에서 GPR25 형질 주입 세포는 주로 기관지에 국한된 반면, 대조 세포는 정맥 근처에서 더 자주 발견되었습니다(그림 4D). 이 패턴은 GPR25에 따라 정맥 부위에서 기관지 점막하로 세포의 재배치를 시사합니다. 그러나 GPR25 형질도입 세포는 세기관지에 대한 선호를 나타내지 않았으며 CXCL17-/- 수용자의 대조 세포에서 분리하지 못했습니다. 이러한 결과는 GPR25 화학친화성이 특이적으로 폐기관지로의 국소화를 유도하는 반면, 초기 유출은 GPR25와 독립적이고 대체 메커니즘에 의해 매개될 수 있음을 나타냅니다.
우리의 기술을 통해 GPR25-CXCL17 축이 호흡기, 상부 위장관, 담도 및 비뇨생식관으로의 림프구 모집을 특이적으로 매개한다는 결론을 내릴 수 있었습니다. 여기에 자세히 설명된 프로토콜은 조직 특이적 귀환에서 GPR25의 역할을 정의하여 이전에 고아 수용체였던 이 수용체가 별개의 조직 미세환경 내에서 T 세포 국소화에 어떻게 영향을 미치는지에 대한 더 깊은 이해에 기여했습니다.
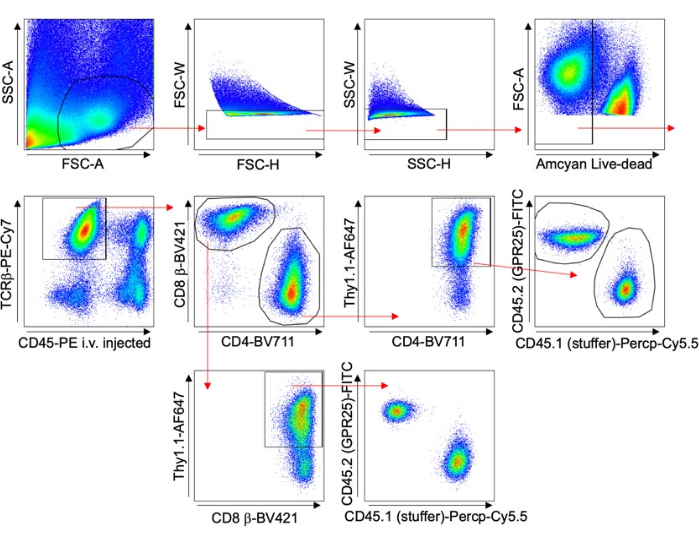
그림 1: 대표적인 게이팅 전략. 마우스 T 세포 형질도입 실험, 특히 장기 귀환 연구(Lung 예)에 사용되는 게이팅 전략을 보여주는 FACS 플롯. 정맥 주사된 CD45-PE 및 Thy1.1 염색을 사용하여 혈관 내 세포를 배제하고 형질도입된 세포를 특이적으로 분석했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
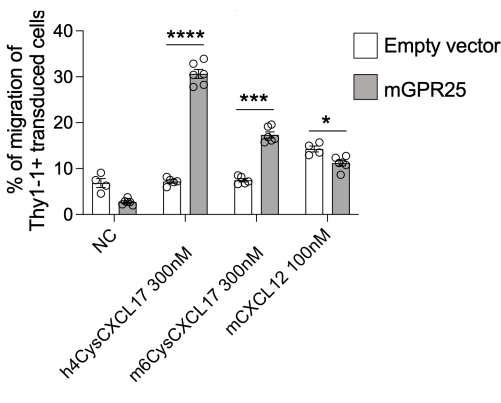
그림 2: 기능을 확인하기 위한 형질도입된 세포의 화학주성. mGPR25 형질도입 세포(빈 벡터 형질주입 세포가 아님)는 트랜스웰 기반 이동 분석에서 마우스 및 인간 CXCL17 in vitro 에 대한 강력한 화학주성입니다. 결과는 적어도 두 개의 독립적인 실험에서 SEM± 평균으로 제시됩니다. P < 0.0001 대 케모카인 대조군 없음(양측 t-검정). 이 수치는13에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 장기 원점 복귀에 대한 FACS 결과. Rag1-/- 마우스에 주입 후 1주 및 7주 후 조직에서 벡터 형질도입된 세포를 제어하기 위한 GPR25 형질도입의 비율. GPR25 및 대조군 세포는 CD45.1 대 CD45.2 동종형으로 구별되고, 다른 실험에서 전환되고, 유세포 분석으로 분석되고, 입력 비율로 정규화되었습니다. 3개의 독립적인 실험(실험당 2-3마리의 마우스)에서 풀링된 결과는 평균 ± SEM으로 표시됩니다. *P < 0.05, **P < 0.01, ***P < 0.001(양측 T-검정). N/A는 분석을 위한 세포 회수율이 낮음을 나타냅니다. 이 수치는13에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
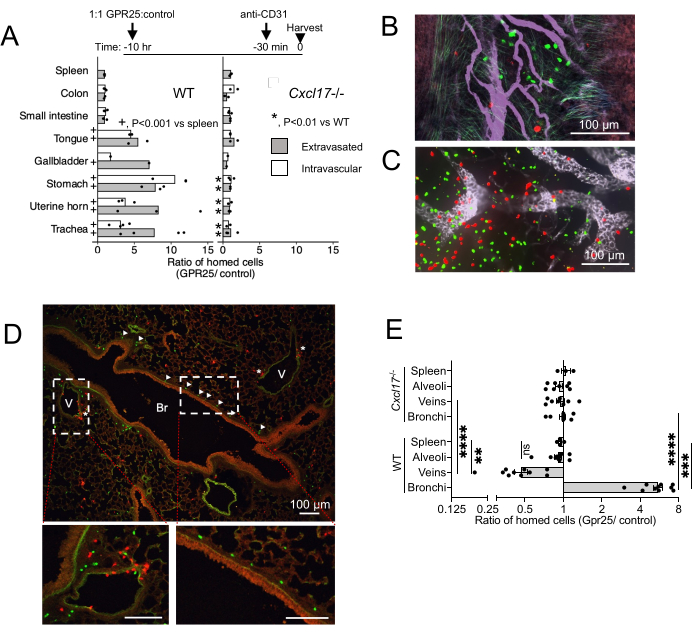
그림 4: 컨포칼 이미징은 단기 homing의 결과입니다. (A) 주입 후 10-12시간 동안 기증자 세포를 제어하기 위한 GPR25의 비율, 전체 마운트 조직 또는 동결 절편의 컨포칼 현미경 검사에 의해 결정됨. 대조군 비장의 비율은 유세포 분석에 의해 결정되었습니다. 표시된 표적 조직의 세포 수와 WT 수용자(+)의 비장 대 세포 수를 비교하거나 CXCL17-/- 과 WT 수용자(*)의 표적 조직 수를 비교하는 Fisher의 정확한 테스트에서 파생된 P-값. 조건 및 실험당 하나의 마우스를 사용한 1개(담낭) 또는 2-4개의 독립적인 실험에서 풀링된 세포 수. 평균 비율이 표시됩니다. (B-D) 주입 후 10시간 후 기관(B), PLN(C) 및 폐 단면(D)의 대표 이미지, GPR25(녹색) 및 대조군(빨간색) CD4 T 세포를 보여줍니다. (D)의 화살촉은 기관지 (Br)에 국한된 GPR25 세포를 나타냅니다. 별표는 정맥(V) 근처의 세포를 나타냅니다. (E) 표시된 폐 미세환경 내에서 기증자 세포를 제어하기 위한 GPR25의 비율: 기관지: 기관지 기저막에서 30μm 이내. 정맥: 정맥 내피의 30μm 이내 또는 정맥 내피와 접촉. 폐포: 정맥이나 기관지에 인접하지 않은 폐포 공간 내. 각 점은 WT 및 CXCL17 에 대해 2-4개의 독립적인 10x 필드 내의 비율이며, 이는 ~ 4mm2를 나타냅니다. 비장 비율은 비교를 위해 (B)와 중복되었습니다. 결과는 실험당 1-2마리의 마우스를 대상으로 한 3개의 독립적인 실험을 보여주며 평균 ± SEM으로 표시됩니다. *P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.0001 vs 비장; WT 대 CXCL17-/- (양측 t-검정). 이 수치는13에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
본 연구에서 개괄한 내부 제어 귀환 분석법은 다양한 장기 및 조직 미세환경 내에서 GPCR 매개 T 세포 이동 및 포지셔닝을 조사하기 위한 포괄적인 방법입니다. 이 접근 방식은 몇 가지 중요한 최적화를 통합하여 재현성, 정확성 및 효율성을 향상시킵니다.
이 프로토콜의 중요한 측면은 MSCV 레트로바이러스 벡터를 사용하여 T 세포를 효율적으로 형질도입하는 것이며, 이는 바이러스 생산을 위해 Plat-E 세포를 사용함으로써 촉진됩니다. 주요 최적화에는 Plat-E 세포를 적절한 포화 상태로 유지하고, poly-D-lysine으로 코팅된 플레이트를 사용하여 바이러스 transfection을 강화하고, GPCR 발현을 최대화하기 위한 이중 transduction 전략을 사용하는 것이 포함됩니다. MSCV 벡터는 효과적인 유전체 통합을 위해 활발한 세포 분열이 필요하기 때문에 T 세포 활성화를 통해 세포주기 진입을 유도하면 레트로바이러스 형질전환 효율이 크게 향상됩니다. 고농도의 항-CD3 및 CD28 항체는 T 세포 활성화 및 블라스팅을 보장하는 데 중요하며, 본 연구는 다른 곳에서 보고된 낮은 농도보다 더 효과적인 것으로 밝혀졌다14. 또한 배양 배지에 사이토카인 IL-2 및 IL-7을 포함하는 것이 T 세포의 생존력을 유지하고 성장을 촉진하여 정확한 이동 및 귀환 연구에 필요한 건강한 형질도입 T 세포의 강력한 집단을 보장하는 데 필수적이라는 것을 발견했습니다.
이 프로토콜은 레트로바이러스 형질도입을 최적화하는 것 외에도 CD45.1/CD45.2 마커를 사용하여 동일한 숙주 내에서 경쟁적인 실험에서 GPCR 형질도입 세포와 대조 세포를 구별하는 장기 호밍 연구를 가능하게 합니다. 이 접근 방식은 세포가 동일한 생리학적 신호에 노출되도록 합니다. Thy1.1 마커의 포함은 특히 희귀 GPCR에 대한 특이 항체를 사용할 수 없는 경우 형질도입된 T 세포와 비형질 주입된 T 세포를 구별하는 데 유용합니다. 일부 응용 분야에 적합한 대안은 Thy1.1 카세트 대신 형광 단백질을 사용하는 것입니다.
FACS에 의한 홈(homed) 세포 분석을 위해 이 프로토콜은 조직 채취 5분 전에 주입되는 항-CD45 항체를 사용하여 순환 세포와 조직 상주 세포를 구별하여 원점 복귀 데이터의 잘못된 해석을 방지합니다. 컨포칼 현미경 검사의 경우, 혈관 표지를 위해 희생하기 10-30분 전에 항-CD31 항체를 주입하여 T 세포 국소화를 정밀하게 시각화하고 혈관 내피에 부착된 세포와 혈관 외출된 세포를 구별할 수 있었습니다. Imaris 소프트웨어를 사용한 이미지 분석은 조직학적 랜드마크에서 세포까지의 거리를 정량화하여 미세환경 국소화 및 상호 작용에 대한 자세한 통찰력을 제공합니다.
이 프로토콜의 강점은 형질도입된 수용체의 발현에서만 다른 동일한 세포의 행동을 나란히 비교하는 것입니다. 우리는 대조군 및 비교기 세포의 동시 주입 및 후속 원점 복귀를 설명하기 위해 기존의 용어인 경쟁적 호밍(competitive hoing)이라는 용어를 사용하지만, 이 용어가 기술적으로 잘못된 명칭임을 인정합니다. 단기 분석에서는 조직 동원 메커니즘이 과도할 가능성이 높기 때문에 세포 집단 간의 실제 경쟁이 불가능합니다. 보다 정확한 용어는 비교 원점 복귀 또는 내부 제어 원점 복귀이며, 프로토콜은 통제되고 비교되는 방식으로 원점 복귀 행동을 평가합니다. 또한, 생리학적 이동 및 귀환(homing)은 여러 화학유인물질 수용체(chemoattractant receptor)의 통합적 기여를 포함할 수 있으며, 이는 생체내에 존재하는 유인물질의 복잡한 장(場)에서 세포의 다단계 이동을 지시하기 위해 동시에 또는 순차적으로 작용할 수 있다 15. 우리가 사용하는 조건에서 시험관 내에서 활성화된 T 세포는 CXCR3 및 다른 GPCR을 자발적으로 발현하며, 이는 형질도입된 수용체와의 조정을 통해 세포의 궁극적인 국소화에 영향을 미칠 수 있습니다. 레트로바이러스 형질도입은 일반적으로 표적 유전자의 과발현을 초래하며, 수용체 발현 수준도 homing에 영향을 미칠 수 있다는 점을 고려해야 합니다. 더욱이, 수용체의 과발현은 이론적으로 수용체-리간드 상호작용과 독립적으로 세포 특성을 변화시킬 수 있습니다. 이 문제를 해결하기 위해 GPR25에 대한 리간드가 없는 CXCL17-/- 마우스를 사용하여 보완 발현을 수행했습니다. 이 접근법은 관찰된 효과가 동족 리간드 인식에 의해 매개되도록 하는 데 도움이 됩니다. 특정 knockout 균주에 접근할 수 없는 연구자는 shRNA 또는 CRISPR 기술을 통합하여 T 세포의 특정 GPCR을 knockdown하거나 knock-out할 수 있습니다. 이러한 적응은 T 세포에서 GPCR 기능을 연구하기 위한 프로토콜의 다양성을 더욱 향상시킬 수 있습니다.
레트로바이러스 형질도입은 높은 효율을 제공하지만, 세포를 활발하게 분열시켜야 하기 때문에 정지된 세포의 행동을 정확하게 반영하지 못할 수 있습니다. 일부 케모카인 수용체는 세포의 증식 상태에 따라 차등 활성을 나타내지만 특이성은 변하지 않습니다. 대안적인 방법인 neon electroporation은 비록 일시적이기는 하지만 T 세포에서 높은 transfection 효율을 입증했습니다16. 이는 단기 분석에 충분할 수 있는 반면, MSCV는 안정적인 발현을 생성할 수 있어 단기 및 장기 연구 모두에 적합합니다. 그러나 이 시스템이 귀환 연구에 사용되었음을 나타내는 문헌을 찾을 수 없었습니다. transfection 효율이 낮으면 GFP와의 co-transfection과 같은 가시적 마커를 사용하여 세포를 선택해야 할 수 있습니다.
이 프로토콜은 세포 이동에 대한 정적 스냅샷을 제공하여 실시간 세포 행동 및 운동성에 대한 통찰력을 제한합니다. 또한 특히 세포 내 구조와 미세한 조직 구조를 관찰하기 위해 고유한 해상도 제한이 있습니다. 이러한 문제를 해결하기 위해 다광자 현미경, 라이브 셀 이미징 및 생체 내 현미경과 같은 고급 이미징 기술의 사용을 제안합니다. 이러한 방법은 더 높은 공간 해상도, 더 깊은 조직 침투 및 세포 과정을 동적으로 시각화할 수 있는 기능을 제공합니다. 특히 생체 내 현미경 검사는 생체 내 T 세포 행동을 실시간으로 추적할 수 있어 세포 이동, 상호 작용 및 자극에 대한 반응을 본래의 맥락 내에서 관찰할 수 있습니다. 이 접근 방식은 T 세포 귀환 및 조직 국소화를 평가하는 데 특히 강력하며, 세포가 다양한 미세 환경에 어떻게 동적으로 적응하는지 밝힙니다. 이러한 고급 이미징 기술을 통합함으로써 향후 연구는 T 세포 운동성, 상호 작용 및 GPCR 매개 원점 복귀에 대한 보다 포괄적인 이해를 달성하여 조직 내 T 세포 행동에 대한 통찰력을 크게 향상시킬 수 있습니다.
우리가 제공하는 프로토콜은 면역 세포 유도에서 GPCR 기능을 연구하는 데 도움이 될 것이며 면역 요법, 염증 및 자가면역에 광범위하게 적용됩니다. 또한, 암을 표적으로 하는 T 세포에서 이전에 특성화되지 않은 GPCR을 탐색하고 자가면역 질환에서 부적절한 T 세포 귀환을 해결함으로써 치료 표적을 발견하고 면역 반응을 개선할 수 있는 새로운 기회를 제공합니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
NIH 보조금 R01 AI178113 및 R01 AI047822, Leona M. & Harry B. Helmsley 자선 신탁의 보조금 1903-03787, 담배 관련 질병 연구 프로그램(TRDRP) 보조금 T31IP1880 및 T33IR6609 E.C.B.; Y.B.는 미국 크론병 및 대장염 재단(Crohn's and Colitis Foundation of America, 835171)의 Research Fellows Award의 지원을 받았습니다. B.O.는 Ramon Areces Foundation(스페인 마드리드)의 박사후 연구원과 미국 크론병 및 대장염 재단(574148)의 Research Fellows Award의 지원을 받았습니다. A.A.는 CIRM(California Institute for Regenerative Medicine) - EDUC2-12677의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| AF647 anti mouse CD90.1-Thy1.1 (OX-7) | Biolegend | 202507 | |
| anti-CD31 (DyLight 633, clone 390) | InvivoMab | BE0377 | |
| anti-mouse CD28 37.51 | eBiosciences | ||
| anti-mouse CD3 145-2c11 | eBiosciences | ||
| APCCy7 anti mouse CD3 (145-2c11) | Biolegend | 100329 | |
| BV421 anti mouse CD8b (Ly-3) | Biolegend | 126629 | |
| BV711 anti mouse CD4 (RM4-5) | Biolegend | 100549 | |
| CD90.1 microbeads | Miltenyi | 130-121-273 | |
| CFSE | Thermoscientific | C34554 | |
| FITC anti mouse CD45.2 (104) | BD | AB_395041 | |
| mouse IL2 | Peprotech | 200-02-50UG | |
| mouse IL7 | Peprotech | 217-17-10UG | |
| Mouse T CD4 isolation kit | STEMCELL technologies | 18000 | |
| MSCV-IRES- Thy1.1 GPR25 | Vectorbuilder | ||
| MSCV-IRES- Thy1.1 Stuffer | Vectorbuilder | ||
| PE-CD45 (30-F11) antibody | Biolegend | 103105 | |
| PECy7 anti mouse TCRb (H57-597) | Tonbo | ||
| PercpCy5.5 anti mouse CD45.1 (A20) | eBiosciences | ||
| Platinum-E (Plat-E) | cell Biolabs. Inc | RV-101 | |
| Yellow fluorescent dye | Thermoscientific |
참고문헌
- Cheng, L., et al. Structure, function and drug discovery of GPCR signaling. MolBiomed. 4 (1), 46 (2023).
- Lammermann, T., Kastenmuller, W. Concepts of GPCR-controlled navigation in the immune system. Immunol Rev. 289 (1), 205-231 (2019).
- Fu, H., Ward, E. J., Marelli-Berg, F. M. Mechanisms of t cell organotropism. Cell Mol Life Sci. 73 (16), 3009-3033 (2016).
- Cinalli, R. M., et al. T cell homeostasis requires g protein-coupled receptor-mediated access to trophic signals that promote growth and inhibit chemotaxis. Eur J Immunol. 35 (3), 786-795 (2005).
- Wu, V., et al. Illuminating the onco-GPCRome: Novel g protein-coupled receptor-driven oncocrine networks and targets for cancer immunotherapy. J Biol Chem. 294 (29), 11062-11086 (2019).
- Wu, V. H., et al. The GPCR-alpha(s)-pka signaling axis promotes T-cell dysfunction and cancer immunotherapy failure. Nat Immunol. 24 (8), 1318-1330 (2023).
- Ramezani, A., Hawley, T. S., Hawley, R. G. Stable gammaretroviral vector expression during embryonic stem cell-derived in vitro hematopoietic development. Mol Ther. 14 (2), 245-254 (2006).
- . . Plat-E retroviral packaging cells (RV-101) user manual. , (2024).
- Anderson, J., Hope, T. Intracellular trafficking of retroviral vectors: obstacles and advances. Gene Ther. 12, 1667-1678 (2005).
- Kim, E., et al. Isolation and analyses of lamina propria lymphocytes from mouse intestines. STAR Protoc. 3 (2), 101366 (2022).
- Steinert, E. M., et al. Quantifying Memory CD8 T Cells Reveals Regionalization of Immunosurveillance. Cell. 161 (4), 737-749 (2015).
- Miltenyi Biotec. . CD90.1 MicroBeads mouse and rat. , (2024).
- Ocón, B., et al. A lymphocyte chemoaffinity axis for lung, non-intestinal mucosae and CNS. Nature. 635, 736-745 (2024).
- Sumida, H., et al. Gpr55 regulates intraepithelial lymphocyte migration dynamics and susceptibility to intestinal damage. Sci Immunol. 2 (18), eaao1135 (2017).
- Foxman, E. F., Campbell, J. J., Butcher, E. C. Multistep navigation and the combinatorial control of leukocyte chemotaxis. J. Cell Biol. 139 (5), 1349-1360 (1997).
- Alawar, N., et al. A solution for highly efficient electroporation of primary cytotoxic T lymphocytes. BMC Biotechnol. 24 (1), 16 (2024).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유