Method Article
多様な組織微小環境におけるGPCR媒介T細胞局在の研究のための効率的なレトロウイルス形質導入と競合的ホーミング
要約
私たちは、トランスフォーミング受容体のレトロウイルス形質導入と、受容体媒介性臓器および微小環境特異的リンパ球のポジショニングを研究するための競合的ホーミングのための改善されたプロトコルを提示します。この方法は、免疫細胞の輸送メカニズムに関する貴重な洞察を提供し、将来の基礎研究や治療研究への応用が期待されています。
要約
Gタンパク質共役受容体(GPCR)の発現が多様な組織微小環境における細胞のポジショニングにどのように影響するかを理解することは、免疫細胞の輸送メカニズムを解明するために不可欠です。私たちは、GPCRを介したT細胞の同族の走化性リガンドを発現する臓器への局在を研究するために設計された競争力のあるホーミングアッセイを提示します。これは、短期および長期の研究に適用できます。このアプローチでは、遺伝子組換えマウス幹細胞ウイルス(MSCV)によるT細胞の形質導入による目的のGPCRまたは制御コンストラクトの発現のための改良されたプロトコルと、それに続くレシピエントマウスでの競合的ホーミングが含まれます。異なる臓器にわたる細胞分布は、フローサイトメトリーおよび/または共焦点顕微鏡法を用いて解析されます。短期実験(10-12時間)では、共焦点顕微鏡法により、肺胞、気管支粘膜下組織、静脈部位、肺間質、気管、胃、子宮角の内側を覆う上皮など、明確な細胞局在パターンが明らかになりました。長期研究(1〜7週間)では、フローサイトメトリーは優先的な細胞蓄積に関する洞察を提供し、動的な変化と組織内での成熟または再配置の可能性を明らかにしました。この競合するホーミングアッセイは、GPCRを介した細胞のポジショニングを研究するための堅牢なツールであり、組織特異的な分布と免疫学および治療研究への潜在的なアプリケーションに関する貴重な洞察を提供します。
概要
Gタンパク質共役受容体(GPCR)は、シグナル伝達、神経伝達、ホルモン調節、免疫細胞の遊走など、さまざまな細胞プロセスの制御に不可欠です1。それらは、リンパ球の移動と局在2の時空間制御において重要な役割を果たします。免疫応答のプライミング段階では、局所的な微小環境と細胞の相互作用により、Tリンパ球はホーミング受容体として知られる独自の接着分子とケモカイン受容体のセットを発現します。この適応により、抗原経験T細胞は臓器特異的内皮細胞(EC)と関与し、異なる標的組織に移動することができます。T細胞が組織指向性を獲得する能力は、特に同じ臓器に影響を与える再発性感染症の状況において、効果的な想起応答に不可欠です3,4。
GPCRは、免疫細胞を特定の組織や臓器に誘導し、CD8+ T細胞やNK細胞を腫瘍部位に誘導して細胞傷害作用を働かせたり、CD4+ T細胞が他の免疫細胞の活性化をサポートして免疫応答をオーケストレートするのを助けたりするなど、重要な機能を果たします。GPCRがどのようにしてT細胞をその正確な位置に誘導するかを理解することは、標的免疫療法を進歩させるために不可欠です5,6。しかし、これらの複雑な相互作用をin vitroでモデル化することには課題があり、空間的に制限された手がかりと方向性のある走化性シグナルの両方を同時に再現することは困難です。
また、特定の白血球受容体の役割を解明することは、内因性集団における発現頻度が限られていることや、これらの受容体が通常、異なる細胞型を特徴づけるという事実から、しばしば困難を伴います。この複雑さにより、特定の受容体の役割を他の細胞サブセット特異的メカニズムから分離することが困難になります。理想的には、方法としては、明確な洞察を得るために、関心のある受容体のみが異なる類似の集団を比較する必要があります。
これらの課題を克服するために、T細胞での効率的なGPCR発現のために、組換えMSCVレトロウイルス形質導入を採用した競争力のあるホーミングアッセイを採用しました。骨髄増殖性肉腫ウイルス(PCMV)ベースのMESVベクターとモロニーマウス白血病ウイルス(MMLV)ベースのLNベクターの要素を組み合わせたMSCVレトロウイルスベクターは、LNベクター7に由来する拡張ハイブリッドパッケージングシグナルを組み込んでいます。この修飾により、遺伝子導入の効率が向上し、 in vivoでのT細胞局在の短期および長期の研究が可能になります。このアプローチでは、高力価のレトロウイルス粒子と共焦点顕微鏡法を利用することで、複雑な組織環境内でのT細胞の位置と相互作用を正確に可視化することができます。私たちは、トランスフォーミング受容体のレトロウイルス形質導入と、受容体媒介性臓器および微小環境特異的リンパ球のポジショニングを研究するための内部制御(いわゆる競合)ホーミングアッセイのパフォーマンスに関する詳細なプロトコルを提示します。この方法の全体的な目標は、免疫細胞の輸送メカニズムに関する貴重な洞察を提供し、基礎研究と治療法開発の両方で将来の応用を可能にすることです。
プロトコル
この研究のすべてのマウスは、退役軍人省パロアルトヘルスケアシステム(VAPAHCS)の特定の病原体フリー(SPF)施設で飼育されました。B6/SJL Prprc Pep3BoyJ (CD45.1)、C57B6/J (CD45.2)、およびRag1-/-マウスをJackson Laboratoriesから購入しました。CD45.1細胞の採取にはPepBoyを使用しましたが、JAXBoy(C57BL/6J-Ptprcem6Lutzy/J)の使用を推奨します。JAXBoyは、従来の戻し交配の代わりにCRISPRによって生成される完全に共同質の菌株であり、遺伝的一貫性を向上させます。歴史的に、PepBoyマウス(CD45.1)を使用したCD45アロタイプマーク研究は、完全には一致していませんが、潜在的な変動性に対処するために、野生型(WT / WT)の比較を伴うコントロールホーミングおよび再循環アッセイが含まれていました。JAXBoyマウスが完全に同質遺伝子の代替手段として利用可能になったため、これらの追加の制御は不要になる可能性があります。研究者は、CD45.1とCD45.2の変異体の違い(タンパク質チロシンホスファターゼとしての役割など)が細胞の挙動やホーミングパターンに影響を与える可能性があることを引き続き考慮する必要があります。本文および以下で説明しているすべてのプロトコルは、認定された実験動物医学部門およびVAパロアルトヘルスケアシステム(VAPAHCS)の実験動物ケアに関する管理パネルのガイドラインを承認または満たしています。動物は承認された手順を使用して犠牲にされました。8〜12週齢の男女のマウスを実験に含めました。
1. MSCVベクターの調製
- MSCV-IRES-Thy1.1レトロウイルスベクターを、目的遺伝子(GOI)またはORF_Stuffer(ORFネガティブコントロール)のコード領域とともに購入する
注:このコンストラクトには、目的のGPCR遺伝子と並んでThy1.1表面マーカーが含まれています。Internal Ribosome Entry Site(IRES)リンカーは、GPCRとThy1.1の共発現を可能にし、フローサイトメトリーによる形質導入細胞の同定や、磁気ビーズによる精製および単離を容易にします。これは、GPCRに特異的な抗体が入手できない場合、例えば研究が不十分なGPCRによく見られる場合に特に有用です。 - プラスミドによってコードされる耐性遺伝子に基づいて適切な抗生物質選択を補充したLuria-Bertani(LB)ブロスを接種することにより、MSCVプラスミドを細菌の形態および培養で調達します(例:.、アンピシリン、カナマイシン、またはクロラムフェニコール)。LB培地は、トリプトン(10 g/L)、酵母抽出物(5 g/L)、NaCl(10 g/L)をpH 7.0に調整し、オートクレーブ滅菌したものです。培養物を37°Cの振とうインキュベーター(220 RPM)で一晩インキュベートします。
- DNA Preparation kitを使用して、標準的な分子生物学的手法を用いてプラスミドストックを調製します。
- DNA単離後、分光光度計でDNAの濃度を測定し、1 μg/μLの濃度で作業用プラスミド溶液を調製します。
2. パッケージング細胞株培養の確立
注:Cell BiolabsのPlatinum E(Plat-E)細胞を使用しました。Plat-E細胞は、EF1αプロモーターを持つ293Tベースの細胞株であり、レトロウイルス構造タンパク質(gag、pol、およびenv遺伝子)の安定的かつ高収量の発現を提供し、単一のプラスミドトランスフェクション8によるレトロウイルスパッケージングを可能にします。NIH-3T3や293Tなどの他の細胞株も使用できますが、これらの代替細胞は試験していません。
- DMEM、10% FBS、1%ペニシリン/ストレプトマイシン、ブラストシジン(10 μg/mL)、およびピューロマイシン(1 μg/mL)を添加して、Plat-E細胞培地を調製します。細胞の維持にはブラストシジンとピューロマイシンを使用しますが、トランスフェクション中およびトランスフェクション後にこれらを省略します。
- Plate Plat-E細胞は、DMEM、20% FBS、および10% DMSOで、>3 x 106 細胞/mLで1.0 mLで凍結して出荷されました。37°Cの水浴で急速に解凍します。解凍したすべての細胞を、Plat-E培地が入った15 mLのコニカルチューブに移します。
- 450 x g で4°Cで5分間遠心分離します。 細胞ペレットを1 mLのPlat-E培地に再懸濁し、ピペッティングで穏やかに行い、シングルセル懸濁液を作製します。
- 10 cmの培養皿に9 mLのPlat-E培地を加え、再懸濁した細胞1 mLを皿に移します。細胞懸濁液とトリパンブルーを等量混合し、血球計算盤またはセルカウンターを用いて生細胞(未染色)細胞と死細胞(青色染色)細胞をカウントし、>70%の生存率を目指して、解凍した細胞が生存可能であることを確認します。
- 細胞を加湿インキュベーターで37°Cでインキュベートし、5%CO2を加えます。最初の3日間は媒体を変更しないでください。最初の解凍時に浮遊細胞や死細胞が観察されるのは正常です。
- 細胞が85%-90%の密度に達したら、DMEM/PBS Ca-/Mg-で洗浄し、0.05%トリプシン/0.5 mM EDTAを2 mL使用して細胞を剥離し、37°Cで3分間インキュベートします。 8 mLのPlat-E培地を加え、細胞を15 mLのコニカルチューブに集め、450 x g で4°Cで5分間遠心分離します。
- 1:10または1:5の表面比で分割します(つまり、元の皿から総体積の1/10または1/5で新しいプレートを播種します)。最終容量の10 mLのPlat-E培地に再懸濁し、加湿インキュベーターで5% CO2を含む加湿インキュベーターで37°Cでインキュベートします。
- 残りの細胞を10% DMSOを含む1 mLのFBSに分注し、-80°Cで凍結した後、液体窒素で凍結して長期間使用します。
注:85%のコンフルエントに近い場合は、上記のように細胞を処理します。最適な細胞の健康状態を維持するには、過度のコンフルエントを避け、1:10の希釈で3日間の分割を目指します。成長が鈍化した場合は、新鮮なアリコートを使用してください。細胞の性能は、通常、その後の継代とともに低下します。最良の結果を得るために、継代4と15の間のトランスフェクションに細胞を使用することをお勧めします。
3. 形質導入細胞の作製
- 1日目:シードプラットE細胞
注:必要なPlat Eセルとプレートの数を計算します。24ウェルプレートに1ウェルあたり1 mLのウイルス上清を使用して、細胞を2回トランスフェクションしました。通常、培養中のT細胞を含む24ウェルプレートあたり、Plate-E細胞を含む10 cmペトリディッシュトランスフェクトプレートを約2枚使用します。- まず、10 cmの組織培養プレートを5 mLの50 μg/mLポリ-D-リジンを滅菌水でコーティングします。室温で45分間インキュベートします。滅菌PBS Ca-/Mgで2回洗浄し、残留物が残らないようにします。
注:Plat-E細胞はトランスフェクション後に剥離する傾向があり、細胞の性能が低下し、ウイルス力価産生が減少するため、プレートをコーティングすることをお勧めします。 - 上記のステップ2.6で説明したようにPlat-E細胞を分離し、トリパンブルー排除アッセイを実施して生存率を確保します。等量の細胞懸濁液とトリパンブルーを混合します。生細胞(未染色)細胞と死細胞(青色染色)を、血球計算盤/細胞カウンターでカウントします。抗生物質を含まないPlat-E培地を用いた10 cm組織培養シャーレに3 x 10⁶生細胞を播種します。
注:播種されたプレートは、翌日に85%〜90%の合流点に達するはずです。これが達成されない場合は、別のセルアリコートの使用を検討してください。メッキのタイミングに基づいて播種密度を調整します。夕方のめっきのために、3.5 x 106 セルを使用してもよい。
- まず、10 cmの組織培養プレートを5 mLの50 μg/mLポリ-D-リジンを滅菌水でコーティングします。室温で45分間インキュベートします。滅菌PBS Ca-/Mgで2回洗浄し、残留物が残らないようにします。
- 2日目:Plat-E細胞とT細胞用コーティングプレートに抗CD3抗体と抗CD28抗体をトランスフェクション
- Plat-E細胞培養液の培地を6.5 mLの低血清培地と交換します。
- Lipofectamine 試薬の製造元の指示に従ってトランスフェクションミックスを調製します(この研究では Lipofectamine 2000 を使用しました)。
- 各プレートについて、1本のチューブに45 μLのLipofectamine 2000と210 μLの還元型血清培地を混合し、15 μgのDNAと235 μLの還元型血清培地を別のチューブに混合します。チューブの内容物を3x-4xピペッティングして組み合わせます。
- 混合物を室温で5〜20分間インキュベートして、リポフェクタミン/ DNA複合体が形成されるのを待ってから、プレートに滴下します。プレートを37°Cで16時間インキュベートします。
- T細胞活性化ウェル:24ウェルプレートに5 μg/mLの抗マウスCD28 (37.51) と10 μg/mLの抗マウスCD3 (145-2c11) を375 μL/ウェルPBSで4 °Cで一晩、または3日目にインキュベーターの37 °Cで3-4時間コーティングします。
注:一晩インキュベートする場合は、蒸発を防ぐためにプレートを透明フィルムで包んでください。Dynabeads マウスアクチベーター CD3/CD28 は、同等の結果が得られる代替として使用できます。
- 3日目:Plat-E培地を交換し、T細胞を単離して活性化する
- 午前中にPlat-Eトランスフェクション培地を14 mLのDMEM完全培地に交換します。RPMI-10を添加してT細胞培地を調製します:RPMI 1640とL-グルタミン、10%FBS、1%ペニシリン/ストレプトマイシン、1x MEM非必須アミノ酸、1 mMピルビン酸ナトリウム、50 μM β-メルカプトエタノール、および1 mM HEPESを添加します。
- CO2吸入とそれに続く頸部脱臼を使用して、JAXBoy(CD45.1)およびC57B6 / J(CD45.2)マウスを安楽死させます。無菌条件下で脾臓とリンパ節を分離します。
- シリンジプランジャーを使用して、6ウェルプレート内のRPMI培地と100μmナイロンメッシュセルストレーナーで脾臓を穏やかにマッシュします。
- 溶液を40 μmのナイロンメッシュセルストレーナーに通し、シングルセル懸濁液として50 mLのコニカルチューブに移します。450 x g で4°Cで5分間遠心分離し、PBS Ca-/Mg-で洗浄します。
- 製造元の指示に従ってMouse T/T CD4 Isolation Kitを使用して磁気陰性選択を行うか、または滅菌FACSを使用して細胞を選別します
- セルカウンターを使用してT細胞をカウントし、T細胞活性化ウェルに1ウェルあたり1-1.5 x 106 、ウェルあたり1 mLのRPMI-10培地にプレートします。加湿インキュベーターで細胞を5%CO₂と共に37°Cでインキュベートします。以下の注で説明されているように、顕微鏡で評価されるように、適切な活性化のために24〜48時間待ちます。
注:CD3とCD28の架橋は、この設定でT細胞を効果的に活性化します。1匹のマウス脾臓は、典型的には、約1×108 個の脾細胞を産生する。CD4+ T細胞は、一般に、全脾細胞集団の約10%を占めています。したがって、ウェル当たり1〜1.5×10個の6 個のCD4+ T細胞を有する24ウェルプレートを調製するには、2〜3匹のマウス由来の細胞で十分であると推定される。
- 4日目:形質導入
- 24時間後に顕微鏡でT細胞を確認します。形質導入前に、T細胞がブラスト状態(クラスターを形成し、活性化により拡大して見える)にあることを確認してください。T細胞をブラストすることで、分裂状態にあることが確認されますが、これはMSCV形質導入に重要です9。
- 円錐形のチューブ内の10cmプレートから~10mLのウイルス上清を採取します。Plat-Eカルチャープレートを抗生物質を含まない別の10 mLのPlat-E培地と交換して、翌日の2回目の形質導入のためにより多くの培地を生成するのに十分な培地を確保します。PLAT-Eプレートの培地容量は、翌日にトランスフェクションが必要なT細胞ウェルの数に基づいて調整します。
注:2xを形質導入すると、効率が大幅に向上します。 - 0.45 μmシリンジフィルターを通過してウイルス上清をろ過します。8 μg/mL のポリブレンと 1:100 HEPES を添加します。
- 24ウェルT細胞プレートを950 x gで7分間回転させます。細胞を剥がさずに上清を慎重に収集して保存します。この上清には、活性化後にT細胞から分泌されるサイトカインやその他の因子が含まれており、発芽後にこの上清に置換されるため、T細胞の増殖と増殖をサポートするためのサイトカインと因子プロファイルが維持されます。
- 各ウェルに1 mLのウイルス上清を添加し、1,150 x g で32°Cで4時間遠心することにより、核分裂を行います。 播種中はプレートをラップで密封します。
- 核感染後、培地を以前に保存したT細胞上清と慎重に交換します。
- 5日目:形質導入を繰り返す
- 4日目に説明したようにトランスフェクションを繰り返します。必要に応じて、最初に活性化されたT細胞のステップ3.4.3で保存した上清を、培地が使い果たされているように見える場合は、新鮮な培地と1:1の比率で混合します。
- 6日目:細胞を洗浄して拡大する
- 細胞をPBS Ca+/Mg+で洗浄します。130 U/mLのマウスIL2と10 ng/mLのマウスIL7を入れた新しい培養プレートに移します。細胞を少なくとも2日間、または注入に必要な細胞数に基づいて目的の増殖レベルに達するまでインキュベートします。
- 8日目:収穫と浄化
- 細胞を回収し、Histopaque 1.077密度勾配で精製します。
注:この技術は、死んだ細胞や破片から生存細胞(リンパ球や他の免疫細胞など)を分離するのに役立ちます。密度の高い死細胞はチューブの底に沈殿しますが、生存細胞は通常、界面層に留まります。 - 15 mLチューブにHistopaque 1.077 5 mLを加えます。450 x g で4°Cで5分間遠心分離し、細胞をペレット化して細胞を回収します。
- 細胞ペレットを5 mLのPBS Ca+/Mg+に再懸濁します。遠心チューブ内の5 mLのHistopaque 1.077の上に細胞懸濁液を慎重に重ねます。
- 400-500 x g で室温で20分間遠心分離し、遠心分離機のブレーク/加速がゼロに設定されていることを確認します。
- 遠心分離後、細胞は密度に基づいて異なる層に分離します。目的の細胞は通常、Histopaqueと上部培地の間の界面層にあり、死んだ細胞は下部に沈殿します。ピペットを使用して界面層で細胞層を慎重に収集し、他の層との汚染を避けます。採取した細胞は、注射の準備が整い、きれいになりました。
- Thy1.1染色およびフローサイトメトリー解析を行うことにより、形質導入効率を評価します。 図 1 のゲーティング・ストラテジーを参照してください。
注:形質導入後、細胞を走化性アッセイで使用して、特定のケモカインへの移動を対照ベクター細胞と比較して評価し、注射を進める前に in vitro でそれらの活性を機能的に確認することができます。
- 細胞を回収し、Histopaque 1.077密度勾配で精製します。
- 長期 in vivo ローカリゼーションアッセイ
- 長期ホーミングには、目的のマウスGPCRにCD45.1を使用し、空のベクター( またはその逆)形質導入細胞にCD45.2を使用します。2つの細胞集団を1:1の比率で混合します。
- 各Rag1-/-成体レシピエントマウスに対して合計20-30 x 106個の細胞を1週間の対性で、5 x 106で7週間の長い向性を静脈内注射します。リンパ球欠損Rag1-/-レシピエントを使用して、内因性T細胞との競争を減らします。
- 1〜7週間後(研究によって異なります)、採取の5分前に抗CD45抗体をマウスに静脈内(i.v.)注射して、血液媒介細胞を標識します。
- CO2 吸入とそれに続く子宮頸部脱臼を使用してマウスを安楽死させます。
注:1週間と7週間の研究が行われています。より長い研究は可能かもしれませんが、まだ検証されていません。 - さまざまな対象臓器とコントロールから細胞を採取します。各臓器の標準的なリンパ球調製プロトコルに従って組織を消化します10,11。
- 採取した細胞をモノクローナル抗体(mAb)で染色し、フローサイトメトリー解析を行います。
- 短期競合ホーミング:T細胞のポジショニングとイメージング
- C57B6/Jマウスをドナーとして使用することを推奨します。これは、細胞を蛍光標識するためです。ただし、数時間までの非常に短いホーミングアッセイには、任意の株を使用できます。
- 培養の8日目に、メーカーの指示に従って、CD90.1マイクロビーズを使用して形質導入(Thy1.1+)細胞を磁気的に分離します12。
- この時点以降、形質導入細胞(純度>95%)のみを上記のようにIL2およびIL7下で2日間培養中に保持し、増殖させます。マイクロビーズは生分解性であり、48時間後に正常な細胞機能を損なうことはありません。
- 11日目に、目的のGPCRを発現する細胞をカルボキシフルオレセインスクシンイミジルエステル(CFSEは蛍光細胞染色色素)で標識します。スタッファー細胞には黄色の蛍光色素を使用し、その逆も同様です。必要に応じて、代替染料を使用することもできます。
- 1 x 106 細胞/mLの濃度で、RPMIと2% FBSの細胞懸濁液を調製します。細胞を最終濃度5 μM、37°Cの水浴中で20分間穏やかに撹拌しながら、色素とインキュベートします。同等の結果を得るには、別々の実験で色素の割り当てを交互に行います。あるいは、単一の色素を使用して、異なるレシピエントの実験細胞とコントロール細胞を含む一般的な細胞タイプを内部標準として標識します。
- 標識した細胞を洗浄し、1:1の比率で混合します。セルカウンターを使用して細胞濃度を推定します。15-30 x 106 細胞をレシピエントマウス(実験の目的に応じてWTまたはトランスジェニックレシピエントマウス)に静脈内注射します。
- 約10〜12時間後、マウスに抗CD31抗体(例:.、DyLight 633標識、クローン390)抗体を注射します。これは、血管を描写し、血管内細胞と血管外細胞を区別するために犠牲になる10〜15分前にする必要があります。
- CO2 吸入とそれに続く子宮頸部脱臼を使用してマウスを安楽死させます。上記のステップ3.8で説明したように、FACSによる細胞懸濁液の細胞局在を解析するか、ステップ3.9.8またはステップ3.9.7のように、共焦点顕微鏡を使用して目的の臓器の組織全体のマウントをイメージングします。
- 気管、子宮角、リンパ節などの細い臓器の場合は、スカッシュマウントを準備します。両面テープを貼ったスライドにティッシュを載せ、Fluoromount-Gマウント液を数滴加え、カバースリップで覆い、別のスライドなどの平らなものを使ってカバースリップをテープに優しく均等に押し付けて固定します。
- 凍結切片の場合は、最適な切断温度(OCT)コンパウンドに組織を埋め込みます。肺の場合は、埋め込む前に50%OCT/PBSで灌流します。
- 末梢リンパ節(PLN)、脾臓、血液などの制御臓器にフローサイトメトリーを使用して、 図1 に示すように形質導入効率(%Thy1.1+)を評価し、結果を正規化します。スカッシュマウントまたは共焦点顕微鏡を使用して切片でPLNを視覚化します。Imarisソフトウェアを使用した共焦点顕微鏡法を使用して細胞をカウントします。
- GPCR形質導入細胞と制御(スタッファー形質導入)細胞の比率を、全臓器または特定の臓器コンパートメントで決定します。FACS によって決定されたインプット比、および/または GPCR が既知または無関係と推定される対照臓器から回収された比率に正規化します。
- 肺内の微小環境局在を解析するには、Imarisソフトウェアを使用して、組織学的ランドマーク(気管支基底膜や静脈など)までの細胞の距離を測定します。
結果
この研究では、特定の受容体がin vivoでT細胞の局在を指示する能力を調査するための詳細なプロトコルを提示します。このプロトコルのデモンストレーションとして、GPR2513を使用しました。このプロトコルを使用して、フローサイトメトリーによるThy1.1染色によって評価されるように、30%〜40%の形質導入効率を達成することができます。GPR25形質導入細胞とスタッファーコントロールを併用して、 in vitro トランスウェルベースの走化性アッセイを実施し、ポジティブコントロールとしてhCXCL17、mCXCL17、およびCXCL12への移動をテストしました。GPR25形質導入T細胞は、スタッファー形質導入細胞と比較して効率的にCXCL17に移行し、受容体の形質導入と機能発現の成功を確認しました(図2)。
長期ホーミング
図 1 は、さまざまな臓器にわたるT細胞を分析するためのゲーティング戦略を示しています。抗CD45抗体は、組織採取の5分前に注入して、血管内細胞を分析から除外しました。形質導入が成功したことを示すTCRβ+ CD4+ Thy1.1+細胞のみが含まれていました。GPCR発現細胞と空ベクター細胞の比率を臓器ごとに計算しました。これらの結果は、インプット細胞プールの元の形質導入率(% Thy1.1+)に正規化されました。
レシピエントマウスへの注射後、GPR25形質導入細胞は、尿道生殖器(GU)トラクト、胃、GPR25LGが豊富な気管器官などの非腸粘膜組織(NIMT)に優先的に装着しました(図3)。私たちの研究では、注射後7週間で肺分離株全体でGPR25形質導入細胞が有意に濃縮されることが示されましたが、注射後1週間ではそうではないことが示され、時間の経過とともに肺内で成熟または再配置される可能性があることが示唆されました(図3)。これらの知見は、適切な研究期間を選択することの重要性を浮き彫りにしている。
短期ホーミング
GPR25のin vivo局在と血流からNIMTへのホーミングにおけるその役割を調べるために、短期ホーミングアッセイを実施しました。GPR25形質導入T細胞を対照ベクター形質導入細胞に同時注入し、野生型(WT)およびCXCL17-/-マウスへの静脈内投与後10〜12時間で分析しました(図4)。抗CD31は、血管内細胞と血管外漏出細胞を区別するために、犠牲の20分前に投与されました。WTレシピエントでは、GPR25の発現は、気管、胃、舌、胆嚢、子宮粘膜などのCXCL17に富む臓器にホーミングの利点をもたらしましたが、CXCL17が発現していない腸、リンパ節、または脾臓にはホーミングの利点を与えませんでした(図4A-C)。興味深いことに、共焦点イメージングと定量により、GPR25形質導入T細胞は、血管外に放出された細胞だけでなく、NIMT内の血管内皮にまだ付着している細胞にも濃縮されていることが示され、この経路が内皮の初期停止だけでなく、標的組織への侵入や粘膜上皮への移動にも寄与していることが示唆されました。GPR25形質導入T細胞がスタッファー形質導入細胞よりも優れていることは、CXCL17-/-レシピエントに注射すると廃止されました。
肺の気管支血管周囲間質内では、GPR25形質導入細胞は主に気管支に局在していましたが、対照細胞は静脈の近くにより頻繁に見られました(図4D)。このパターンは、GPR25依存性による静脈部位から気管支粘膜下組織への細胞の再配置を示唆しています。しかし、GPR25形質導入細胞は細気管支を好むことを示さず、 CXCL17-/-レシピエントの対照細胞から分離できませんでした。これらの知見は、GPR25のケモアフィニティーが特異的に肺気管支への局在化を促進する一方で、初期の血管外漏出はGPR25に依存せず、代替のメカニズムによって媒介される可能性があることを示しています。
私たちの技術により、GPR25-CXCL17軸は、呼吸器、上部消化管、胆道、および泌尿生殖器へのリンパ球の動員を特異的に仲介すると結論付けることができました。ここで詳述したプロトコルは、組織特異的ホーミングにおけるGPR25の役割を定義し、この以前は孤児であった受容体が異なる組織微小環境内でT細胞の局在にどのように影響するかをより深く理解することに貢献しました。
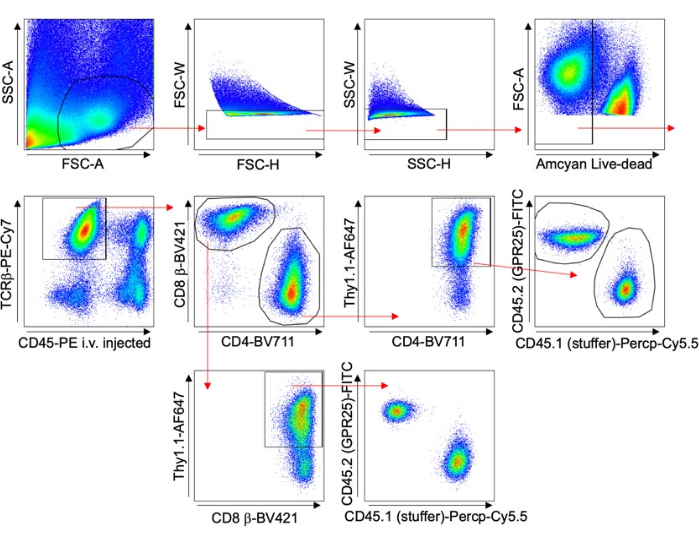
図1:代表的なゲーティング戦略。 マウスT細胞形質導入実験、特に長期ホーミング研究に用いたゲーティング戦略を示すFACSプロット(肺の例)。静脈内注射されたCD45-PEおよびThy1.1染色を使用して、血管内細胞を除外し、形質導入細胞を特異的に分析しました。 この図の拡大版を表示するには、ここをクリックしてください。
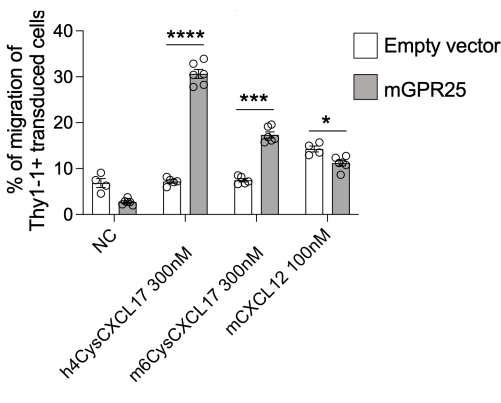
図2:形質導入細胞の機能を確認するための走化性。 mGPR25形質導入細胞は、空のベクター形質導入細胞ではなく、トランスウェルベースの遊走アッセイでin vitro でマウスおよびヒトCXCL17に対して強力に走化性を示します。結果は、少なくとも2つの独立した実験からの平均±SEMとして提示されます。P < 0.0001 対 ケモカインコントロールなし(両側t検定)。この数値は13から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。

図3:長期ホーミングのFACS結果。Rag1-/-マウスへの注射後1週間および7週間の組織におけるGPR25形質導入細胞と制御ベクター形質導入細胞の比率。GPR25と対照細胞は、CD45.1とCD45.2の同種型によって区別され、異なる実験で切り替えられ、フローサイトメトリーによって分析され、インプット比に正規化されました。3つの独立した実験(実験ごとに2〜3匹のマウス)からプールされた結果を平均±SEMとして示します。 *P < 0.05、**P < 0.01、***P < 0.001(両側T検定)。N/Aは、解析のための細胞回収率が低いことを示します。この数値は13から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。
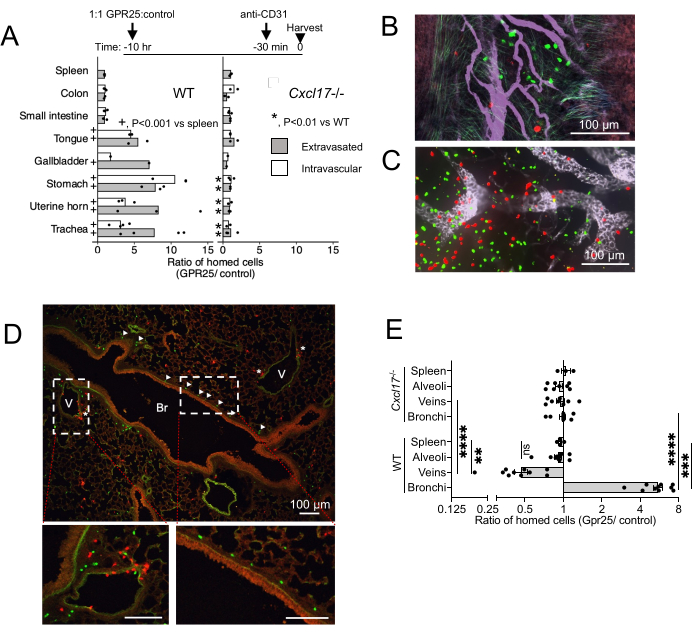
(A)注入後10-12時間におけるGPR25の対照ドナー細胞に対する比率は、ホールマウント組織または凍結切片の共焦点顕微鏡法によって決定される。対照脾臓の比率は、フローサイトメトリーによって決定されました。WTレシピエント(+)の適応標的組織の細胞数と脾臓の細胞数を比較する、またはCXCL17-/-とWTレシピエント(*)の標的組織のカウントを比較するフィッシャーの正確確率検定から導き出されたP値。1 つの条件および実験ごとに 1 匹のマウスを使用した 1 つ (胆嚢) または 2 から 4 の独立した実験からプールされた細胞数。平均比が表示されます。(B-D)注入後10時間の気管(B)、PLN(C)、および肺の断面(D)の代表的な画像で、GPR25(緑)とコントロール(赤)CD4 T細胞を示しています。(D)の矢印は、気管支(Br)に局在するGPR25細胞を示しています。アスタリスクは静脈の近くの細胞を示します(V)。(E) 示された肺微小環境内のドナー細胞を制御するための GPR25 の比率: 気管支: 気管支基底膜から 30 μm 以内。静脈:静脈内皮から30μm以内または静脈内皮と接触している。肺胞:静脈や気管支に隣接していない肺胞腔内。各ドットは、WTとCXCL17の2-4独立した10xフィールド内の比率であり、~4 mm2を表します。比較のため、脾臓比を(B)から複製した。結果は、実験ごとに1〜2匹のマウスを使用した3つの独立した実験を示し、SEMの平均として示±。 *P < 0.05、**P < 0.01、***P < 0.001、****P < 0.0001 vs 脾臓;WT対CXCL17-/-(両側t検定)。この数値は13から修正されています。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
本研究で概説した内部制御ホーミングアッセイは、GPCRを介したT細胞の輸送と多様な臓器や組織微小環境内でのポジショニングを調べるための包括的な方法です。このアプローチでは、いくつかの重要な最適化を統合して、再現性、精度、および効率を向上させます。
このプロトコルの重要な側面は、MSCVレトロウイルスベクターを使用したT細胞の効率的な形質導入であり、これはウイルス産生のためのPlat-E細胞の使用によって促進されます。主な最適化には、Plat-E細胞を適切なコンフルエンシーに維持すること、ポリ-D-リジンコーティングプレートを使用してウイルストランスフェクションを強化すること、GPCR発現を最大化するためのダブルトランスダクション戦略を採用することなどがあります。MSCVベクターは、効果的なゲノム統合のために活発な細胞分裂を必要とするため、T細胞の活性化による細胞周期の侵入を誘導すると、レトロウイルスの形質導入効率が大幅に向上します。高濃度の抗CD3およびCD28抗体は、T細胞の活性化とブラストを確保するために重要であり、私たちの研究では、他の場所で報告された低濃度よりも効果的であることがわかっています14。また、サイトカインIL-2およびIL-7を培地に含めることは、T細胞の生存率を維持し、その増殖を促進するために不可欠であり、正確な遊走およびホーミング研究に必要な健康な形質導入T細胞の強固な集団を確保することもわかりました。
このプロトコルでは、レトロウイルス形質導入の最適化に加えて、CD45.1/CD45.2マーカーを使用した長期ホーミング研究が可能になり、同じ宿主内の競合実験でGPCR形質導入細胞と制御細胞を区別できます。このアプローチにより、細胞は同じ生理学的手がかりにさらされます。Thy1.1マーカーの包含は、特にオーファンGPCRの特異的抗体が利用できない場合に、形質導入されたT細胞と形質導入されていないT細胞を区別するために価値があります。一部のアプリケーションに適した代替手段は、Thy1.1カセットの代わりに蛍光タンパク質を使用することです。
FACSによるホーム細胞の解析では、このプロトコルでは、組織採取の5分前に注入された抗CD45抗体を使用して、循環細胞と組織常在細胞を区別し、ホーミングデータの誤解を防ぎます。共焦点顕微鏡法では、血管を標識するために犠牲になる10〜30分前に抗CD31抗体を注入し、T細胞の局在を正確に可視化し、血管内皮に付着した細胞と血管外に放出された細胞とを区別しました。Imarisソフトウェアによる画像解析は、組織学的ランドマークからの細胞の距離を定量化し、それらの微小環境局在と相互作用に関する詳細な洞察を提供します。
このプロトコルの強みは、形質導入された受容体の発現のみが異なる他の点では同一の細胞の挙動を並べて比較することです。従来の用語である競合的ホーミングは、制御細胞および比較細胞の同時注入とその後のホーミングを説明するために使用していますが、この用語は技術的には誤った名称であることを認識しています。短期アッセイでは、組織の動員メカニズムが過剰である可能性が高く、細胞集団間での実際の競争は起こりそうにありません。より正確な用語は、プロトコルが制御された比較方法でホーミング動作を評価するため、比較ホーミングまたは内部制御ホーミングです。また、生理学的遊走およびホーミングは、複数の化学誘引性受容体の統合的な寄与を含むことがあり、これらは同時にまたは連続的に作用して、in vivoに存在する誘引物質の複雑な場における細胞の多段階遊走を指示することができる15。私たちが採用した条件下でin vitroで活性化されたT細胞は、CXCR3およびおそらく他のGPCRを自発的に発現し、これらは形質導入された受容体との調整を通じて、細胞の最終的な局在に影響を与える可能性があります。レトロウイルス形質導入は、通常、標的遺伝子の過剰発現をもたらし、受容体の発現レベルもホーミングに影響を与える可能性があることを考慮する必要があります。さらに、受容体の過剰発現は、理論的には受容体-リガンド相互作用とは無関係に細胞特性を変化させる可能性があります。これに対処するために、GPR25のリガンドを欠くCXCL17-/-マウスを使用して相補的発現を行いました。このアプローチは、観察された影響が同族のリガンド認識によって媒介されることを確実にするのに役立ちます。特定のノックアウト株にアクセスできない研究者は、shRNAまたはCRISPR技術を組み込んで、T細胞の特定のGPCRをノックダウンまたはノックアウトすることができます。この適応により、T細胞のGPCR機能を研究するためのプロトコルの汎用性がさらに高まる可能性があります。
レトロウイルス形質導入は高い効率を提供しますが、細胞を活発に分裂させる必要があり、これは静止細胞の挙動を正確に反映していない可能性があります。一部のケモカイン受容体は、細胞の増殖状態に応じて異なる活性を示しますが、特異性は変わりません。別の方法であるネオンエレクトロポレーションは、一過性ではありますが、T細胞で高いトランスフェクション効率を示しています16。これは短期的なアッセイには十分かもしれませんが、MSCVは安定した発現をもたらすことができるため、短期および長期の研究に適しています。しかし、このシステムがホーミング研究に使用されていることを示す文献は見つかりませんでした。トランスフェクション効率が低い場合は、GFPとの同時トランスフェクションなど、目に見えるマーカーを使用して細胞を選択する必要があるかもしれません。
このプロトコルは、細胞輸送の静的なスナップショットを提供し、リアルタイムの細胞の挙動と運動性に関する洞察を制限します。また、特に細胞内構造や微細な組織構造の観察には、固有の分解能制限があります。これらの課題に対処するために、多光子顕微鏡、生細胞イメージング、生体内顕微鏡などの高度なイメージング技術の使用を提案します。これらの方法は、より高い空間分解能、より深い組織浸透、および細胞プロセスを動的に視覚化する機能を提供します。特に生体内顕微鏡法では、in vivoでのT細胞の挙動をリアルタイムで追跡できるため、細胞の移動、相互作用、および刺激に対する応答を本来の状況で観察できます。このアプローチは、T細胞のホーミングと組織局在を評価するのに特に強力であり、細胞がさまざまな微小環境にどのように動的に適応するかを明らかにします。これらの高度なイメージング技術を統合することで、今後の研究では、T細胞の運動性、相互作用、およびGPCRを介したホーミングをより包括的に理解することができ、組織内でのT細胞の挙動に関する洞察が大幅に向上します。
私たちが提供するプロトコルは、免疫細胞のホーミングにおけるGPCR機能の研究に役立ち、免疫療法、炎症、および自己免疫に幅広く応用できます。さらに、がんを標的とするT細胞のこれまで特徴付けられていなかったGPCRを探索し、自己免疫疾患における不適切なT細胞ホーミングに対処することにより、治療標的を発見し、免疫応答を改善する新たな機会を提供します。
開示事項
著者は何も開示していません。
謝辞
NIHの助成金R01 AI178113およびR01 AI047822、The Leona M. & Harry B. Helmsley Charitable Trustからの助成金1903-03787、およびタバコ関連疾患研究プログラム(TRDRP)の助成金によるE.C.B.へのT31IP1880およびT33IR6609の支援を受けています。Y.B.は、Crohn's and Colitis Foundation of America(835171)のResearch Fellows Awardの支援を受けました。B.O.は、Ramon Areces Foundation(スペイン、マドリッド)のポスドクフェローシップと、Crohn's and Colitis Foundation of America(574148)のリサーチフェロー賞の支援を受けました。AAは、California Institute for Regenerative Medicine(CIRM)-EDUC2-12677の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| AF647 anti mouse CD90.1-Thy1.1 (OX-7) | Biolegend | 202507 | |
| anti-CD31 (DyLight 633, clone 390) | InvivoMab | BE0377 | |
| anti-mouse CD28 37.51 | eBiosciences | ||
| anti-mouse CD3 145-2c11 | eBiosciences | ||
| APCCy7 anti mouse CD3 (145-2c11) | Biolegend | 100329 | |
| BV421 anti mouse CD8b (Ly-3) | Biolegend | 126629 | |
| BV711 anti mouse CD4 (RM4-5) | Biolegend | 100549 | |
| CD90.1 microbeads | Miltenyi | 130-121-273 | |
| CFSE | Thermoscientific | C34554 | |
| FITC anti mouse CD45.2 (104) | BD | AB_395041 | |
| mouse IL2 | Peprotech | 200-02-50UG | |
| mouse IL7 | Peprotech | 217-17-10UG | |
| Mouse T CD4 isolation kit | STEMCELL technologies | 18000 | |
| MSCV-IRES- Thy1.1 GPR25 | Vectorbuilder | ||
| MSCV-IRES- Thy1.1 Stuffer | Vectorbuilder | ||
| PE-CD45 (30-F11) antibody | Biolegend | 103105 | |
| PECy7 anti mouse TCRb (H57-597) | Tonbo | ||
| PercpCy5.5 anti mouse CD45.1 (A20) | eBiosciences | ||
| Platinum-E (Plat-E) | cell Biolabs. Inc | RV-101 | |
| Yellow fluorescent dye | Thermoscientific |
参考文献
- Cheng, L., et al. Structure, function and drug discovery of GPCR signaling. MolBiomed. 4 (1), 46 (2023).
- Lammermann, T., Kastenmuller, W. Concepts of GPCR-controlled navigation in the immune system. Immunol Rev. 289 (1), 205-231 (2019).
- Fu, H., Ward, E. J., Marelli-Berg, F. M. Mechanisms of t cell organotropism. Cell Mol Life Sci. 73 (16), 3009-3033 (2016).
- Cinalli, R. M., et al. T cell homeostasis requires g protein-coupled receptor-mediated access to trophic signals that promote growth and inhibit chemotaxis. Eur J Immunol. 35 (3), 786-795 (2005).
- Wu, V., et al. Illuminating the onco-GPCRome: Novel g protein-coupled receptor-driven oncocrine networks and targets for cancer immunotherapy. J Biol Chem. 294 (29), 11062-11086 (2019).
- Wu, V. H., et al. The GPCR-alpha(s)-pka signaling axis promotes T-cell dysfunction and cancer immunotherapy failure. Nat Immunol. 24 (8), 1318-1330 (2023).
- Ramezani, A., Hawley, T. S., Hawley, R. G. Stable gammaretroviral vector expression during embryonic stem cell-derived in vitro hematopoietic development. Mol Ther. 14 (2), 245-254 (2006).
- . . Plat-E retroviral packaging cells (RV-101) user manual. , (2024).
- Anderson, J., Hope, T. Intracellular trafficking of retroviral vectors: obstacles and advances. Gene Ther. 12, 1667-1678 (2005).
- Kim, E., et al. Isolation and analyses of lamina propria lymphocytes from mouse intestines. STAR Protoc. 3 (2), 101366 (2022).
- Steinert, E. M., et al. Quantifying Memory CD8 T Cells Reveals Regionalization of Immunosurveillance. Cell. 161 (4), 737-749 (2015).
- Miltenyi Biotec. . CD90.1 MicroBeads mouse and rat. , (2024).
- Ocón, B., et al. A lymphocyte chemoaffinity axis for lung, non-intestinal mucosae and CNS. Nature. 635, 736-745 (2024).
- Sumida, H., et al. Gpr55 regulates intraepithelial lymphocyte migration dynamics and susceptibility to intestinal damage. Sci Immunol. 2 (18), eaao1135 (2017).
- Foxman, E. F., Campbell, J. J., Butcher, E. C. Multistep navigation and the combinatorial control of leukocyte chemotaxis. J. Cell Biol. 139 (5), 1349-1360 (1997).
- Alawar, N., et al. A solution for highly efficient electroporation of primary cytotoxic T lymphocytes. BMC Biotechnol. 24 (1), 16 (2024).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved