Method Article
Transdução retroviral eficiente e homing competitivo para investigar a localização de células T mediadas por GPCR em diversos microambientes teciduais
Neste Artigo
Resumo
Apresentamos protocolos aprimorados para transdução retroviral de receptores de tráfego e homing competitivo para estudar o posicionamento de linfócitos específicos de órgãos e microambientes mediados por receptores. Este método oferece informações valiosas sobre os mecanismos de tráfego de células imunes e tem aplicações potenciais em futuras pesquisas básicas e terapêuticas.
Resumo
Compreender como a expressão do receptor acoplado à proteína G (GPCR) afeta o posicionamento celular em diversos microambientes teciduais é essencial para elucidar os mecanismos de tráfego de células imunes. Apresentamos um ensaio de homing competitivo projetado para estudar a localização de células T mediadas por GPCR em órgãos que expressam seus ligantes quimioatraentes cognatos, aplicável a estudos de curto e longo prazo. A abordagem envolve um protocolo aprimorado para transdução de células T pelo vírus de células-tronco murinas recombinantes (MSCV) para expressar o GPCR de interesse ou uma construção de controle, seguido de homing competitivo em camundongos receptores. A distribuição celular em diferentes órgãos é analisada usando citometria de fluxo e/ou microscopia confocal. Em experimentos de curto prazo (10-12 h), a microscopia confocal revelou padrões distintos de localização celular, incluindo alvéolos, submucosa brônquica, locais venosos e interstício no pulmão, bem como o epitélio que reveste a traqueia, estômago e corno uterino. Em estudos de longo prazo (1-7 semanas), a citometria de fluxo forneceu informações sobre o acúmulo preferencial de células, revelando mudanças dinâmicas e potencial maturação ou reposicionamento dentro dos tecidos ao longo do tempo. Este ensaio de homing competitivo é uma ferramenta robusta para estudar o posicionamento celular mediado por GPCR, oferecendo informações valiosas sobre a distribuição específica do tecido e aplicações potenciais em imunologia e pesquisa terapêutica.
Introdução
Os receptores acoplados à proteína G (GPCRs) são fundamentais na regulação de uma variedade de processos celulares, incluindo transdução de sinal, neurotransmissão, regulação hormonal e migração de células imunes1. Eles desempenham um papel crucial no controle espaço-temporal da migração e localização de linfócitos2. Durante a fase de preparação das respostas imunes, o microambiente local e as interações celulares levam os linfócitos T a expressar um conjunto único de moléculas de adesão e receptores de quimiocinas conhecidos como receptores de homing. Essa adaptação permite que as células T com experiência em antígeno se envolvam com células endoteliais (CEs) específicas de órgãos e migrem para tecidos-alvo distintos. A capacidade das células T de adquirir tropismo tecidual é vital para respostas efetivas de recordação, particularmente no contexto de infecções recorrentes que afetam o mesmo órgão 3,4.
Os GPCRs guiam as células imunes para tecidos e órgãos específicos, onde desempenham funções críticas - como direcionar as células T CD8 + e NK para locais tumorais para ação citotóxica ou ajudar as células T CD4 + a orquestrar respostas imunes, apoiando a ativação de outras células imunes. Compreender como os GPCRs direcionam as células T para seus locais precisos é essencial para o avanço das imunoterapias direcionadas 5,6. O desafio, no entanto, está em modelar essas interações complexas in vitro, já que é difícil replicar pistas espacialmente restritas e sinais quimiotáticos direcionais simultaneamente.
Elucidar os papéis de receptores leucocitários específicos também é frequentemente desafiador devido à sua frequência limitada de expressão em populações endógenas e ao fato de que esses receptores normalmente decoram tipos de células distintas. Essa complexidade dificulta o isolamento do papel de um receptor específico de outros mecanismos específicos de subconjuntos celulares. Idealmente, os métodos devem comparar populações semelhantes, diferindo apenas no receptor de interesse para fornecer insights claros.
Para superar esses desafios, adotamos um ensaio de homing competitivo que emprega transdução retroviral MSCV recombinante para expressão eficiente de GPCR em células T. Os vetores retrovirais MSCV, que combinam elementos dos vetores MESV baseados no vírus do sarcoma mieloproliferativo (PCMV) e dos vetores LN baseados no vírus da leucemia murina de Moloney (MMLV), incorporam um sinal de empacotamento híbrido estendido derivado dos vetores LN7. Essa modificação aumenta a eficiência da entrega de genes, permitindo estudos de curto e longo prazo da localização de células T in vivo. Ao utilizar partículas retrovirais de alto título e microscopia confocal, a abordagem permite a visualização precisa do posicionamento e das interações das células T em ambientes complexos de tecidos. Apresentamos protocolos detalhados para a transdução retroviral de receptores de tráfego e a realização de ensaios de homing controlados internamente (chamados competitivos) para estudar o posicionamento de linfócitos específicos de órgãos e microambientes mediados por receptores. O objetivo geral deste método é fornecer informações valiosas sobre os mecanismos de tráfego de células imunes e permitir aplicações futuras tanto na pesquisa básica quanto no desenvolvimento terapêutico.
Protocolo
Todos os camundongos neste estudo foram mantidos em instalações específicas livres de patógenos (SPF) no Veterans Affairs Palo Alto Health Care System (VAPAHCS). Os camundongos B6 / SJL Prprc Pep3BoyJ (CD45.1), C57B6 / J (CD45.2) e Rag1-/- foram adquiridos da Jackson Laboratories. Embora tenhamos usado o PepBoy para obter células CD45.1, recomendamos o uso do JAXBoy (C57BL/6J-Ptprcem6Lutzy/J). JAXBoy é uma cepa totalmente coisogênica gerada por CRISPR em vez do retrocruzamento tradicional, o que melhora a consistência genética. Historicamente, os estudos marcados com o alótipo CD45 usando camundongos PepBoy (CD45.1), que não são totalmente congênicos, incluíram ensaios de controle e recirculação com comparações de tipo selvagem (WT / WT) para abordar a variabilidade potencial. Com os camundongos JAXBoy agora disponíveis como uma alternativa totalmente isogênica, esses controles adicionais podem não ser mais necessários. Os pesquisadores ainda devem considerar que as diferenças entre as variantes CD45.1 e CD45.2 - como seus papéis como proteínas tirosina fosfatases - podem influenciar o comportamento celular e os padrões de homing. Todos os protocolos discutidos no texto e abaixo foram aprovados ou atendem às diretrizes do credenciado Departamento de Medicina de Animais de Laboratório e do Painel Administrativo de Cuidados com Animais de Laboratório do VA Palo Alto Health Care System (VAPAHCS). Os animais foram sacrificados usando procedimentos aprovados. Camundongos de ambos os sexos, com idades entre 8 e 12 semanas, foram incluídos nos experimentos.
1. Preparação do vetor MSCV
- Compre o vetor retroviral MSCV-IRES-Thy1.1 com a região codificadora do gene de interesse do camundongo (GOI) ou um ORF_Stuffer (controle ORF negativo)
NOTA: Esta construção inclui o marcador de superfície Thy1.1 ao lado do gene GPCR de interesse. O ligante Internal Ribosome Entry Site (IRES) permite a co-expressão do GPCR com o Thy1.1, facilitando a identificação de células transduzidas por citometria de fluxo ou purificação e isolamento por esferas magnéticas. Isso é particularmente útil quando anticorpos específicos para o GPCR não estão disponíveis, como costuma ser o caso de GPCRs mal estudados. - Adquira o plasmídeo MSCV na forma bacteriana e cultura inoculando o caldo Luria-Bertani (LB) suplementado com seleção antibiótica apropriada com base no gene de resistência codificado pelo plasmídeo (por exemplo, ampicilina, canamicina ou cloranfenicol). O meio LB consiste em triptona (10 g/L), extrato de levedura (5 g/L) e NaCl (10 g/L), ajustado para pH 7,0 e esterilizado em autoclavagem. Incubar a cultura a 37 °C numa incubadora agitável (220 RPM) durante a noite.
- Prepare estoques de plasmídeos usando técnicas padrão de biologia molecular usando um kit de preparação de DNA.
- Após o isolamento do ADN, medir a concentração de ADN com um espectrofotómetro e preparar soluções de plasmídeos funcionais a uma concentração de 1 μg/μl. Armazenar os plasmídeos a -20 °C para utilização futura.
2. Estabelecimento de cultura de linha celular de embalagem
NOTA: Usamos células Platinum E (Plat-E) da Cell Biolabs. As células Plat-E são uma linhagem celular baseada em 293T com um promotor EF1α, que fornece uma expressão estável e de alto rendimento de proteínas estruturais retrovirais (genes gag, pol e env), permitindo o empacotamento retroviral com uma única transfecção de plasmídeo8. Embora outras linhagens celulares, como NIH-3T3 ou 293T, possam ser usadas, não testamos essas alternativas.
- Prepare o meio celular Plat-E adicionando DMEM, 10% de FBS, 1% de penicilina/estreptomicina, blasticidina (10 μg/mL) e puromicina (1 μg/mL). Use blasticidina e puromicina para manutenção celular, mas omita-os durante e após a transfecção.
- Células Plate Plat-E enviadas congeladas em 1,0 mL, a >3 x 106 células/mL em DMEM, 20% FBS e 10% DMSO. Descongele-os rapidamente em banho-maria a 37 °C. Transfira todas as células descongeladas para um tubo cônico de 15 mL contendo meio de cultura Plat-E.
- Centrifugue a 450 x g durante 5 min a 4 °C. Ressuspenda o pellet celular em 1 mL de meio Plat-E pipetando suavemente para criar uma suspensão de célula única.
- Adicione 9 mL de meio Plat-E a uma placa de cultura de 10 cm e, em seguida, transfira 1 mL de células ressuspensas para a placa. Confirme se as células descongeladas são viáveis misturando um volume igual de suspensão celular e azul de tripano e contando as células viáveis (não coradas) e mortas (coradas com azul) usando um hemocitômetro ou contador de células, visando >70% de viabilidade.
- Incubar as células a 37 °C em uma incubadora umidificada com 5% de CO2. Não troque o meio nos primeiros 3 dias; É normal observar células flutuantes e mortas no primeiro degelo.
- Quando as células atingirem 85% -90% de confluência, lave com DMEM / PBS Ca- / Mg-. Separe as células usando 2 mL de tripsina a 0,05% / EDTA 0,5 mM e incube por 3 min a 37 ° C. Adicione 8 mL de meio Plat-E, colete as células em um tubo cônico de 15 mL e centrifugue a 450 x g por 5 min a 4 ° C.
- Divida em uma proporção de superfície de 1:10 ou 1:5 (ou seja, semeie novas placas com 1/10 ou 1/5 do volume total do prato original). Ressuspender em um volume final de 10 mL de meio Plat-E e incubar a 37 ° C em uma incubadora umidificada com 5% de CO2.
- Alíquota do resto das células em 1 mL de FBS com 10% de DMSO e congelar a -80 °C e, posteriormente, em nitrogênio líquido para uso a longo prazo.
NOTA: Trate as células conforme descrito acima quando estiverem próximas de 85% confluentes. Para manter a saúde celular ideal, evite a confluência excessiva e procure divisões de 3 dias com diluição de 1:10. Se o crescimento diminuir, use uma alíquota nova. O desempenho celular normalmente diminui com as passagens subsequentes. Recomendamos o uso de células para transfecção entre as passagens 4 e 15 para obter melhores resultados.
3. Produção de células transduzidas
- Dia 1: Células Seed Plat E
NOTA: Calcule o número de células e placas Plat E necessárias. Usamos 1 mL de sobrenadante viral por poço em uma placa de 24 poços para transfectar células 2x. Normalmente usamos aproximadamente duas placas transfectadas em placa de Petri de 10 cm com células Plate-E por placa de 24 poços com células T em cultura.- Comece revestindo placas de cultura de tecidos de 10 cm com 5 mL de poli-D-lisina de 50 μg/mL em água estéril. Incubar em temperatura ambiente por 45 min. Lave 2x com PBS Ca-/Mg estéril - para garantir que nenhum resíduo permaneça.
NOTA: Recomendamos revestir as placas, pois as células Plat-E tendem a se desprender após a transfecção, levando a um desempenho celular ruim e à redução da produção de títulos virais. - Separar as células Plat-E conforme descrito acima no passo 2.6 e realizar um ensaio de exclusão de azul de tripano para garantir a viabilidade. Misture um volume igual de suspensão celular e Trypan Blue. Conte as células viáveis (não coradas) e mortas (coradas de azul) usando um hemocitômetro/contador de células. Semeie 3 x 10⁶ células vivas em uma placa de Petri de cultura de tecidos de 10 cm com meio Plat-E livre de antibióticos.
NOTA: As placas semeadas devem atingir 85%-90% de confluência no dia seguinte. Se isso não for alcançado, considere usar uma alíquota de célula diferente. Ajuste a densidade de semeadura com base no tempo de revestimento; Para revestimento noturno, podem ser usadas 3,5 x 106 células.
- Comece revestindo placas de cultura de tecidos de 10 cm com 5 mL de poli-D-lisina de 50 μg/mL em água estéril. Incubar em temperatura ambiente por 45 min. Lave 2x com PBS Ca-/Mg estéril - para garantir que nenhum resíduo permaneça.
- Dia 2: Transfecção de células Plat-E e placas de revestimento para células T com anticorpos anti-CD3 e anti-CD28
- Substitua o meio nas culturas de células Plat-E por 6,5 mL de meio sérico reduzido.
- Prepare a mistura de transfecção de acordo com as instruções do fabricante para o reagente de lipofectamina (Lipofectamine 2000 foi usado neste estudo).
- Para cada placa, misture 45 μL de Lipofectamine 2000 com 210 μL de meio de soro reduzido em um tubo e 15 μg de DNA com 235 μL de meio de soro reduzido em outro tubo. Combine o conteúdo dos tubos pipetando 3x-4x.
- Incube a mistura por 5-20 min em temperatura ambiente para permitir a formação de complexos de lipofectamina / DNA e, em seguida, adicione gota a gota nas placas. Incubar as placas durante 16 h a 37 °C.
- Poços de ativação de células T: Revestir placas de 24 poços com 5 μg/mL de CD28 anti-camundongo (37,51) e 10 μg/mL de CD3 anti-camundongo (145-2c11) em 375 μL/poço PBS durante a noite a 4 °C ou por 3-4 h na incubadora a 37 °C no Dia 3.
NOTA: Embrulhe as placas em filme transparente se incubar durante a noite para evitar a evaporação. O ativador de camundongo Dynabeads CD3 / CD28 pode ser usado como uma alternativa com resultados comparáveis.
- Dia 3: Altere a mídia Plat-E e isole e ative as células T
- Troque o meio de transfecção Plat-E para 14 mL de meio completo DMEM pela manhã. Prepare a mídia de células T adicionando RPMI-10: RPMI 1640 com L-glutamina, 10% de FBS, 1% de penicilina/estreptomicina, 1x MEM de aminoácidos não essenciais, 1 mM de piruvato de sódio, 50 μM de β-mercaptoetanol e 1 mM de HEPES.
- Eutanasiar camundongos JAXBoy (CD45.1) e C57B6/J (CD45.2) usando inalação de CO2seguida de luxação cervical. Isole os baços e os gânglios linfáticos em condições estéreis.
- Amasse suavemente os baços em um filtro de células de malha de nylon de 100 μm com meio RPMI em uma placa de 6 poços usando um êmbolo de seringa.
- Transfira a solução através de um filtro de células de malha de nylon de 40 μm para uma suspensão de célula única para um tubo cônico de 50 mL. Centrifugar a 450 x g durante 5 min a 4 °C e lavá-los com PBS Ca-/Mg-.
- Execute a seleção magnética negativa usando o kit de isolamento T / T CD4 do mouse seguindo as instruções do fabricante ou, alternativamente, classifique as células usando FACS estéril
- Conte as células T usando um contador de células e coloque-as nos poços de ativação de células T a 1-1,5 x 106 por poço em 1 mL de meio RPMI-10 por poço. Incubar as células a 37 °C com 5% de CO₂ em uma incubadora umidificada. Aguarde 24-48 h para ativação adequada, conforme avaliado ao microscópio, conforme explicado nas notas abaixo.
NOTA: A reticulação de CD3 e CD28 ativa efetivamente as células T nesta configuração. Um baço de camundongo normalmente produz aproximadamente 1 x 108 esplenócitos. As células T CD4+ geralmente constituem cerca de 10% da população total de esplenócitos. Portanto, para preparar uma placa de 24 poços com 1-1,5 x 106 células T CD4 + por poço, estima-se que células de 2-3 camundongos sejam suficientes.
- Dia 4: Transdução
- Verifique as células T após 24 h ao microscópio. Certifique-se de que as células T estejam em um estado de jateamento (formando aglomerados e aparecendo ampliadas devido à ativação) antes da transdução. As células T de explosão garantem que estão em um estado de divisão, o que é crucial para a transdução de MSCV9.
- Colete ~ 10 mL de sobrenadante viral das placas de 10 cm em um tubo cônico. Substitua as placas de cultura Plat-E por mais 10 mL de meio Plat-E sem antibióticos para garantir meio suficiente para gerar mais meio para uma segunda transdução no dia seguinte. Ajuste o volume do meio em placas PLAT-E com base no número de poços de células T que precisam ser transfectados no dia seguinte.
NOTA: A transdução de 2x melhora significativamente a eficiência. - Filtrar o sobrenadante viral passando por um filtro de seringa de 0,45 μm. Adicione 8 μg/mL de polibreno e HEPES 1:100.
- Gire a placa de célula T de 24 poços por 7 min a 950 x g. Colete e guarde cuidadosamente o sobrenadante sem desalojar as células. Este sobrenadante contém citocinas e outros fatores secretados pelas células T após a ativação e substituídos por este sobrenadante após a spinfecção para manter o perfil de citocinas e fatores para apoiar a proliferação e o crescimento das células T.
- Realize a spinfecção adicionando 1 mL de sobrenadante viral a cada poço e girando a 1.150 x g por 4 h a 32 ° C. Sele as placas com filme plástico durante a infecção.
- Após a spinfecção, substitua cuidadosamente o meio pelo sobrenadante de células T salvo anteriormente.
- Dia 5: Repita a transdução
- Repita a transfecção conforme descrito no Dia 4. Opcionalmente, misture o sobrenadante salvo na etapa 3.4.3 de células T inicialmente ativadas com mídia fresca em uma proporção de 1:1 se a mídia parecer esgotada.
- Dia 6: Lave as células e expanda
- Lave as células com PBS Ca+/Mg+. e transferi-los para uma nova placa de cultura com 130 U/mL de IL2 de camundongo e 10 ng/mL de IL7 de camundongo. Incube as células durante pelo menos 2 dias ou até atingirem o nível de expansão desejado, com base no número de células necessárias para a injeção.
- Dia 8: Colheita e purificação
- Colha as células e purifique com um gradiente de densidade Histopaque 1.077.
NOTA: Esta técnica ajuda a isolar células viáveis (como linfócitos ou outras células imunológicas) de células mortas ou detritos. As células mortas, que têm uma densidade mais alta, se depositam no fundo do tubo, enquanto as células viáveis normalmente permanecem na camada de interface. - Adicione 5 mL de Histopaque 1.077 a um tubo de 15 mL. Colha as células centrifugando a 450 x g durante 5 min a 4 °C para peletar as células.
- Ressuspenda o pellet celular em 5 mL de PBS Ca+/Mg+. Coloque a suspensão celular cuidadosamente em cima de 5 mL de Histopaque 1.077 no tubo de centrífuga.
- Centrifugue a 400-500 x g por 20 min em temperatura ambiente, garantindo que a quebra/aceleração da centrífuga seja zerada.
- Após a centrifugação, as células se separarão em camadas distintas com base na densidade. As células desejadas normalmente estarão na camada de interface entre o Histopaque e o meio superior, enquanto as células mortas se depositarão na parte inferior. Colete cuidadosamente a camada de células na camada de interface usando uma pipeta, evitando a contaminação com outras camadas. As células coletadas agora estão prontas e limpas para injeções.
- Avalie a eficiência da transdução realizando coloração Thy1.1 e análise de citometria de fluxo. Veja a estratégia de gating na Figura 1.
NOTA: Após a transdução, as células podem ser usadas em ensaios de quimiotaxia para avaliar sua migração para quimiocinas específicas em comparação com as células vetoriais de controle para confirmar funcionalmente sua atividade in vitro antes de prosseguir com as injeções.
- Colha as células e purifique com um gradiente de densidade Histopaque 1.077.
- Ensaio de localização in vivo de longo prazo
- Para homing de longo prazo, use CD45.1 para o GPCR de camundongo de interesse e CD45.2 para células transduzidas de vetor vazio (ou vice-versa). Misture as duas populações de células na proporção de 1:1.
- Injete por via intravenosa 20-30 x 106 células totais para cada camundongo receptor adulto Rag1 - / - para 1 semana de tropismo e 5 x 106 para tropismo de 7 semanas. Usamos receptores Rag1-/- deficientes em linfócitos para reduzir a competição com células T endógenas.
- Após 1 a 7 semanas (dependendo do estudo), injete o anticorpo anti-CD45 por via intravenosa (i.v.) nos camundongos 5 minutos antes da colheita para rotular as células transmitidas pelo sangue.
- Eutanasiar os camundongos usando inalação de CO2 seguida de luxação cervical.
NOTA: Estudos de 1 semana e 7 semanas foram realizados; estudos mais longos podem ser possíveis, mas ainda não foram testados. - Colha células de diferentes órgãos de interesse e controles. Digerir os tecidos de acordo com os protocolos padrão de preparação de linfócitos para cada órgão10,11.
- Corar as células coletadas com anticorpos monoclonais (mAbs) para análise por citometria de fluxo.
- Homing competitivo de curto prazo: posicionamento e imagem de células T
- Recomendamos o uso de camundongos C57B6/J como doadores, uma vez que estaremos marcando as células com fluorescência. No entanto, para ensaios de homing muito curtos de até algumas horas, qualquer cepa pode ser usada.
- No 8º dia de cultura, isolar magneticamente as células transduzidas (Thy1.1+) usando microesferas CD90.1, de acordo com as instruções do fabricante12.
- Manter apenas as células transduzidas (pureza >95%) em cultura após este ponto durante 2 dias sob IL2 e IL7 conforme indicado acima e deixar expandir. As microesferas são biodegradáveis e após 48 h não prejudicam a função celular normal.
- No dia 11, rotule as células que expressam o GPCR de interesse com éster succinimidílico de carboxifluoresceína (CFSE é um corante de coloração de células fluorescentes). Para células Stuffer, use um corante fluorescente amarelo ou vice-versa. Você pode usar corantes alternativos, se preferir.
- Prepare uma suspensão celular na concentração de 1 x 106 células / mL em RPMI com 2% de FBS. Incubar as células com o corante a uma concentração final de 5 μM a 37 °C em banho-maria com agitação suave durante 20 min. Para garantir resultados comparáveis, alterne as atribuições de corante em experimentos separados. Como alternativa, use um único corante para rotular um tipo de célula comum como um padrão interno, incluindo células experimentais e de controle em diferentes recipientes.
- Lave as células rotuladas e misture-as na proporção de 1:1. Estime a concentração de células usando um contador de células. Injetar 15-30 x 106 células por via intravenosa em camundongos receptores (WT ou camundongos receptores transgênicos, dependendo do objetivo do experimento).
- Aproximadamente 10-12 h depois, injete os camundongos com anticorpo anti-CD31 (por exemplo, DyLight 633 marcado, clone 390), que deve ser 10-15 min antes do sacrifício para delinear os vasos sanguíneos e discriminar as células intravasculares das extravasadas.
- Eutanasiar os camundongos usando inalação de CO2 seguida de luxação cervical. Analise a localização celular por FACS de suspensões celulares conforme descrito na etapa 3.8 acima ou por imagens de montagens inteiras de tecido como na etapa 3.9.8 ou etapa 3.9.7 para órgãos de interesse usando microscopia confocal.
- Para órgãos finos, como traqueia, corno uterino ou gânglios linfáticos, prepare montagens de abóbora. Coloque o tecido em uma lâmina com fita dupla-face nas laterais, adicione algumas gotas da solução de montagem Fluoromount-G, cubra com uma lamínula e pressione suave e uniformemente para fixar a lamínula à fita usando uma lâmina separada ou outro objeto plano.
- Para seções congeladas, incorpore o tecido no composto de temperatura de corte ideal (OCT). Para os pulmões, perfunda com 50% de OCT/PBS antes de incorporar.
- Use citometria de fluxo para órgãos de controle, como linfonodo periférico (PLN), baço ou sangue, para avaliar a eficiência da transdução (% Thy1.1+) conforme mostrado na Figura 1 e normalizar os resultados. Visualize PLN com montagens ou seções de squash usando microscopia confocal. Conte as células usando microscopia confocal com o software Imaris.
- Determine a proporção de células transduzidas por GPCR para células de controle (transduzidas por Stuffer) em órgãos inteiros ou compartimentos de órgãos específicos. Normalizar para as taxas de entrada determinadas pelo FACS e / ou para a proporção recuperada dos órgãos de controle onde o GPCR é conhecido ou presumido como irrelevante.
- Para análise da localização microambiental nos pulmões, meça a distância das células aos pontos histológicos (por exemplo, membranas ou veias basais brônquicas) usando o software Imaris.
Resultados
Neste estudo, apresentamos um protocolo detalhado para investigar a capacidade de receptores específicos de direcionar a localização de células T in vivo. Como demonstração desse protocolo, utilizamos o GPR2513. Somos capazes de atingir 30%-40% de eficiência de transdução usando este protocolo, conforme avaliado pela coloração Thy1.1 por citometria de fluxo. Realizamos ensaios de quimiotaxia baseados em transwell in vitro usando células transduzidas por GPR25 ao lado de controles de preenchimento, testando sua migração para hCXCL17, mCXCL17 e CXCL12 como controle positivo. As células T transduzidas por GPR25 migraram eficientemente para CXCL17 em comparação com as células transduzidas por stuffer, confirmando a transdução bem-sucedida e a expressão funcional do receptor (Figura 2).
Homing de longo prazo
Figura 1 descreve a estratégia de gating para analisar células T em vários órgãos. O anticorpo anti-CD45 foi injetado 5 minutos antes da coleta do tecido para excluir células intravasculares da análise. Apenas células TCRβ+ CD4+ Thy1.1+, indicativas de transdução bem-sucedida, foram incluídas. A proporção de células que expressam GPCR para aquelas com o vetor vazio foi calculada para cada órgão. Esses resultados foram normalizados para a porcentagem de transdução original (% Thy1.1+) do pool de células de entrada.
Após a injeção em camundongos receptores, as células transduzidas por GPR25 povoaram preferencialmente tecidos da mucosa não intestinal (NIMT), como o trato geniturinário (GU), estômago e traqueia - órgãos ricos em GPR25LG (Figura 3). Nossos estudos revelaram enriquecimento significativo de células transduzidas por GPR25 em isolados de pulmão inteiro em 7 semanas, mas não em 1 semana após a injeção, sugerindo potencial maturação ou reposicionamento dentro do pulmão ao longo do tempo (Figura 3). Esses achados destacam a importância de selecionar uma duração de estudo apropriada.
Homing de curto prazo
Para investigar a localização in vivo do GPR25 e seu papel no homing da corrente sanguínea para o NIMT, realizamos ensaios de homing de curto prazo. As células T transduzidas por GPR25 foram co-injetadas com células transduzidas por vetor de controle e analisadas 10-12 h após a transferência intravenosa para camundongos selvagens (WT) e CXCL17-/- (Figura 4). O anti-CD31 foi administrado 20 minutos antes do sacrifício para distinguir as células intravasculares daquelas extravasadas. Em receptores de WT, a expressão de GPR25 conferiu uma vantagem de homing a órgãos ricos em CXCL17, como traqueia, estômago, língua, vesícula biliar e mucosas uterinas, mas não aos intestinos, linfonodos ou baço, onde CXCL17 não é expresso ( Figura 4A-C ). Curiosamente, a imagem confocal e a quantificação mostraram que as células T transduzidas por GPR25 não foram apenas enriquecidas entre as células extravasadas, mas também entre as células ainda ligadas ao endotélio vascular dentro do NIMT, sugerindo que a via contribui para a parada inicial no endotélio, bem como para a entrada nos tecidos-alvo e migração para o epitélio da mucosa. A vantagem das células T transduzidas por GPR25 sobre as células transduzidas por stuffer foi abolida quando injetadas em receptores CXCL17-/-.
Dentro do interstício peribroncovascular do pulmão, as células transduzidas por GPR25 localizaram-se predominantemente nos brônquios, enquanto as células de controle foram encontradas com mais frequência perto das veias (Figura 4D). Esse padrão sugere o reposicionamento dependente de GPR25 de células de locais venosos para a submucosa brônquica. No entanto, as células transduzidas por GPR25 não mostraram preferência por bronquíolos e não conseguiram segregar das células de controle em receptores CXCL17-/-. Esses achados indicam que a quimioafinidade GPR25 impulsiona especificamente a localização para brônquios pulmonares, enquanto o extravasamento inicial pode ser independente de GPR25 e mediado por mecanismos alternativos.
Nossa técnica nos permitiu concluir que o eixo GPR25-CXCL17 medeia especificamente o recrutamento de linfócitos para os tratos respiratório, gastrointestinal superior, biliar e geniturinário. O protocolo detalhado aqui definiu o papel do GPR25 no homing específico do tecido, contribuindo para uma compreensão mais profunda de como esse receptor anteriormente órfão influencia a localização das células T em microambientes de tecido distintos.
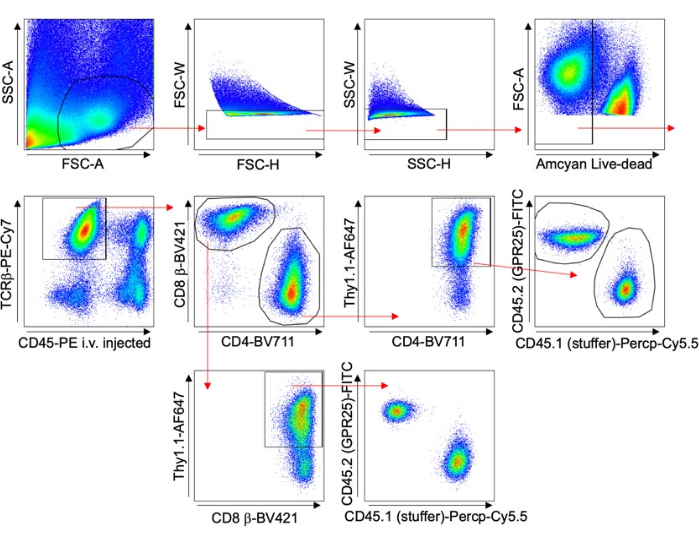
Figura 1: Estratégia de gating representativa. Gráfico FACS mostrando a estratégia de gating usada para experimentos de transdução de células T de camundongos, especificamente para o estudo de homing de longo prazo (exemplo do pulmão). A coloração CD45-PE e Thy1.1 injetada por via intravenosa foi usada para excluir células intravasculares e analisar especificamente as células transduzidas. Clique aqui para ver uma versão maior desta figura.
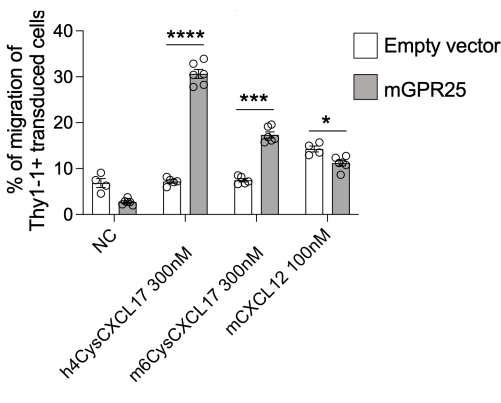
Figura 2: Quimiotaxia das células transduzidas para verificar sua função. Células transduzidas por mGPR25, mas não contrapartes transduzidas por vetores vazias, quimitaxia robusta em direção a CXCL17 de camundongos e humanos in vitro em ensaios de migração baseados em transwell. Os resultados são apresentados como média ± SEM de pelo menos dois experimentos independentes. P < 0,0001 vs. nenhum controle de quimiocinas (teste t bicaudal). Este número foi modificado de13. Clique aqui para ver uma versão maior desta figura.

Figura 3: Resultados do FACS para homing de longo prazo. Proporção de GPR25-transduzido para controlar células transduzidas por vetor em tecidos 1 e 7 semanas após a injeção em camundongos Rag1-/-. As células GPR25 e controle foram distinguidas pelo alótipo CD45.1 vs. CD45.2, comutadas em diferentes experimentos, analisadas por citometria de fluxo e normalizadas para taxas de entrada. Os resultados agrupados de três experimentos independentes (2-3 camundongos por experimento) são mostrados como média ± SEM. *P < 0,05, **P < 0,01, ***P < 0,001 (teste T bicaudal). N/A indica baixa recuperação celular para análise. Este número foi modificado de13. Clique aqui para ver uma versão maior desta figura.
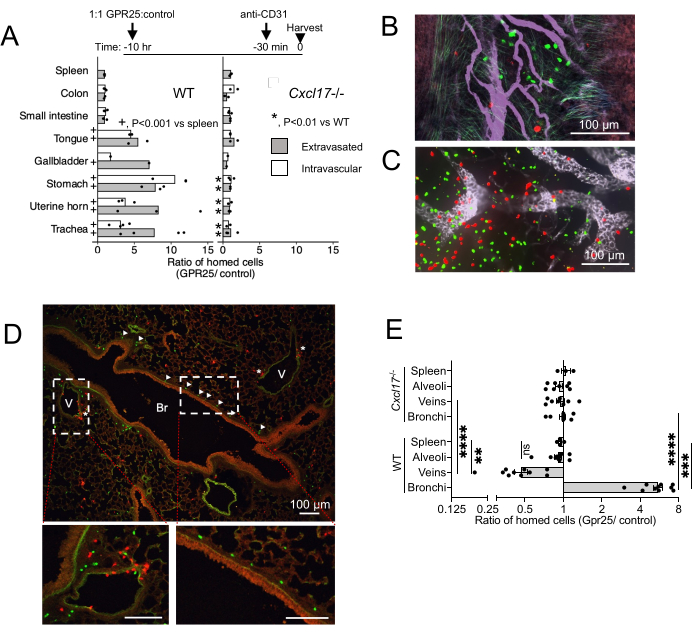
Figura 4: Resultados da imagem confocal de homing de curto prazo. (A) Proporção de GPR25 para células de controle do doador 10-12 h após a injeção, determinada por microscopia confocal de tecidos inteiros ou cortes congelados. As proporções no baço controle foram determinadas por citometria de fluxo. Valores de p derivados do teste exato de Fisher comparando a contagem de células em tecidos-alvo indicados versus baço em receptores WT (+) ou comparando contagens em tecidos-alvo em receptores CXCL17-/- vs WT (*). Contagens de células agrupadas de 1 (vesícula biliar) ou 2-4 experimentos independentes com um camundongo por condição e experimento. As razões médias são mostradas. (BD) Imagens representativas das seções transversais da traqueia (B), PLN (C) e pulmão (D) 10 h após a injeção, mostrando células T CD4 GPR25 (verde) e controle (vermelho). As pontas das setas em (D) indicam células GPR25 localizadas no brônquio (Br); os asteriscos indicam células próximas às veias (V). (E) A proporção de GPR25 para controlar as células doadoras dentro dos microambientes pulmonares indicados: Bronquios: dentro de 30 μm da membrana basal brônquica. Veia: dentro de 30 μm ou em contato com o endotélio venoso. Alvéolos: dentro de espaços alveolares não adjacentes a veias ou brônquios. Cada ponto é a razão dentro de 2-4 campos independentes de 10x para WT e CXCL17, representando ~ 4 mm2. As proporções do baço foram duplicadas de (B) para comparação. Os resultados mostram 3 experimentos independentes com 1-2 camundongos por experimento e mostrados como média ± SEM. *P < 0,05, **P < 0,01, ***P < 0,001, ****P < 0,0001 vs baço; WT vs CXCL17-/- (teste t bicaudal). Este número foi modificado de13. Clique aqui para ver uma versão maior desta figura.
Discussão
O ensaio de homing controlado internamente descrito neste estudo é um método abrangente para examinar o tráfego e o posicionamento de células T mediadas por GPCR em diversos órgãos e microambientes teciduais. Essa abordagem integra várias otimizações críticas para melhorar a reprodutibilidade, a precisão e a eficiência.
Um aspecto crítico deste protocolo é a transdução eficiente de células T usando vetores retrovirais MSCV, o que é facilitado pelo uso de células Plat-E para produção viral. As principais otimizações incluem a manutenção de células Plat-E na confluência apropriada, o uso de placas revestidas de poli-D-lisina para aumentar a transfecção viral e o emprego de uma estratégia de transdução dupla para maximizar a expressão de GPCR. Como os vetores MSCV requerem divisão celular ativa para uma integração efetiva do genoma, induzir a entrada no ciclo celular por meio da ativação de células T aumenta significativamente a eficiência da transdução retroviral. Altas concentrações de anticorpos anti-CD3 e CD28 são essenciais para garantir a ativação e blasting das células T, que nossos estudos descobriram ser mais eficazes do que concentrações mais baixas relatadas em outros lugares14. Também descobrimos que a inclusão das citocinas IL-2 e IL-7 no meio de cultura é vital para manter a viabilidade das células T e promover sua expansão, garantindo uma população robusta de células T saudáveis e transduzidas necessárias para estudos precisos de migração e homing.
Além de otimizar a transdução retroviral, o protocolo permite estudos de homing de longo prazo usando marcadores CD45.1 / CD45.2 para diferenciar entre células transduzidas por GPCR e células de controle em experimentos competitivos dentro do mesmo hospedeiro. Essa abordagem garante que as células sejam expostas aos mesmos sinais fisiológicos. A inclusão do marcador Thy1.1 é valiosa para distinguir entre células T transduzidas e não transduzidas, particularmente quando anticorpos específicos para GPCRs órfãos não estão disponíveis. Uma alternativa adequada para algumas aplicações seria o uso de proteína fluorescente no lugar do Thy1.1.
Para análises de células alojadas por FACS, o protocolo emprega anticorpos anti-CD45 injetados 5 minutos antes da coleta do tecido para distinguir entre células circulantes e residentes no tecido, evitando interpretações errôneas dos dados de homing. Para microscopia confocal, anticorpos anti-CD31 foram injetados 10-30 min antes do sacrifício para marcar os vasos sanguíneos, permitindo a visualização precisa da localização das células T e distinguindo entre células ligadas ao endotélio vascular e células extravasadas. A análise de imagens com o software Imaris quantifica a distância das células dos pontos de referência histológicos, fornecendo informações detalhadas sobre sua localização e interações microambientais.
A força deste protocolo é a comparação lado a lado do comportamento de células idênticas que diferem apenas na expressão do receptor transduzido. Embora usemos o termo convencional homing competitivo para descrever a co-injeção e subsequente homing de células de controle e comparação, reconhecemos que esse termo é tecnicamente um nome impróprio. Em ensaios de curto prazo, os mecanismos de recrutamento de tecidos provavelmente estão em excesso, tornando improvável a competição real entre as populações de células. Um termo mais preciso seria homing comparativo ou homing controlado internamente, pois o protocolo avalia os comportamentos de homing de maneira controlada e comparativa. Além disso, a migração fisiológica e o homing podem envolver contribuições integradas de múltiplos receptores quimioatraentes, que podem atuar simultânea ou sequencialmente para direcionar a migração celular em várias etapas nos campos complexos de atrativos que existem in vivo15. As células T ativadas in vitro sob as condições que empregamos expressam espontaneamente CXCR3 e provavelmente outros GPCRs, que, por meio da coordenação com o receptor transduzido, podem influenciar a localização final das células. A transdução retroviral normalmente resulta em superexpressão do gene alvo, e deve-se considerar que o nível de expressão do receptor também pode afetar o homing. Além disso, a superexpressão de um receptor poderia teoricamente alterar as propriedades celulares independentemente das interações receptor-ligante. Para resolver isso, conduzimos a expressão complementar usando camundongos CXCL17-/-, que não possuem o ligante para GPR25. Essa abordagem ajuda a garantir que nossos efeitos observados sejam mediados pelo reconhecimento de ligantes cognatos. Os pesquisadores que não têm acesso a cepas nocaute específicas podem incorporar técnicas de shRNA ou CRISPR para derrubar ou nocautear GPCRs específicos em células T. Essa adaptação pode aumentar ainda mais a versatilidade do protocolo para estudar a função do GPCR em células T.
Embora a transdução retroviral ofereça alta eficiência, ela requer células em divisão ativa, o que pode não refletir com precisão o comportamento das células quiescentes. Alguns receptores de quimiocinas exibem atividade diferencial dependendo do estado proliferativo da célula, embora sua especificidade permaneça inalterada. Um método alternativo, a eletroporação de néon, demonstrou alta eficiência de transfecção em células T, embora transitoriamente16. Isso pode ser suficiente para ensaios de curto prazo, enquanto o MSCV pode produzir expressão estável, tornando-o adequado para estudos de curto e longo prazo. No entanto, não encontramos literatura indicando que esse sistema tenha sido usado para estudos de homing. Se a eficiência da transfecção for baixa, podemos precisar selecionar células usando um marcador visível, como co-transfecção com GFP.
Esse protocolo fornece um instantâneo estático do tráfego celular, limitando os insights sobre o comportamento e a motilidade celular em tempo real. Ele também tem limitações de resolução inerentes, particularmente para observar estruturas subcelulares e arquitetura de tecido em escala fina. Para enfrentar esses desafios, propomos o uso de técnicas avançadas de imagem, como microscopia multifotônica, imagem de células vivas e microscopia intravital. Esses métodos oferecem maior resolução espacial, penetração mais profunda do tecido e a capacidade de visualizar dinamicamente os processos celulares. A microscopia intravital, em particular, permite o rastreamento em tempo real do comportamento das células T in vivo, permitindo a observação da migração celular, interações e respostas a estímulos dentro de seu contexto nativo. Essa abordagem é especialmente poderosa para avaliar o homing de células T e a localização do tecido, revelando como as células se adaptam dinamicamente a diferentes microambientes. Ao integrar essas técnicas avançadas de imagem, estudos futuros podem alcançar uma compreensão mais abrangente da motilidade das células T, interações e homing mediado por GPCR, melhorando significativamente os insights sobre seu comportamento nos tecidos.
O protocolo que fornecemos ajudará no estudo das funções do GPCR no homing de células imunes e tem amplas aplicações em imunoterapia, inflamação e autoimunidade. Além disso, oferece novas oportunidades para descobrir alvos terapêuticos e melhorar as respostas imunológicas, explorando GPCRs anteriormente não caracterizados em células T direcionadas ao câncer e abordando o homing inadequado de células T em doenças autoimunes.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Apoiado pelo NIH concede R01 AI178113 e R01 AI047822, Grant 1903-03787 do The Leona M. & Harry B. Helmsley Charitable Trust e o Tobacco-Related Disease Research Program (TRDRP) concede T31IP1880 e T33IR6609 ao ECB; Y.B. foi apoiado por um Prêmio de Bolsas de Pesquisa da Crohn's and Colitis Foundation of America (835171). B.O. foi apoiado por uma bolsa de pós-doutorado da Fundação Ramon Areces (Madri, Espanha) e um Prêmio de Bolsas de Pesquisa da Crohn's and Colitis Foundation of America (574148). A.A. foi apoiado pelo Instituto de Medicina Regenerativa da Califórnia (CIRM) - EDUC2-12677.
Materiais
| Name | Company | Catalog Number | Comments |
| AF647 anti mouse CD90.1-Thy1.1 (OX-7) | Biolegend | 202507 | |
| anti-CD31 (DyLight 633, clone 390) | InvivoMab | BE0377 | |
| anti-mouse CD28 37.51 | eBiosciences | ||
| anti-mouse CD3 145-2c11 | eBiosciences | ||
| APCCy7 anti mouse CD3 (145-2c11) | Biolegend | 100329 | |
| BV421 anti mouse CD8b (Ly-3) | Biolegend | 126629 | |
| BV711 anti mouse CD4 (RM4-5) | Biolegend | 100549 | |
| CD90.1 microbeads | Miltenyi | 130-121-273 | |
| CFSE | Thermoscientific | C34554 | |
| FITC anti mouse CD45.2 (104) | BD | AB_395041 | |
| mouse IL2 | Peprotech | 200-02-50UG | |
| mouse IL7 | Peprotech | 217-17-10UG | |
| Mouse T CD4 isolation kit | STEMCELL technologies | 18000 | |
| MSCV-IRES- Thy1.1 GPR25 | Vectorbuilder | ||
| MSCV-IRES- Thy1.1 Stuffer | Vectorbuilder | ||
| PE-CD45 (30-F11) antibody | Biolegend | 103105 | |
| PECy7 anti mouse TCRb (H57-597) | Tonbo | ||
| PercpCy5.5 anti mouse CD45.1 (A20) | eBiosciences | ||
| Platinum-E (Plat-E) | cell Biolabs. Inc | RV-101 | |
| Yellow fluorescent dye | Thermoscientific |
Referências
- Cheng, L., et al. Structure, function and drug discovery of GPCR signaling. MolBiomed. 4 (1), 46 (2023).
- Lammermann, T., Kastenmuller, W. Concepts of GPCR-controlled navigation in the immune system. Immunol Rev. 289 (1), 205-231 (2019).
- Fu, H., Ward, E. J., Marelli-Berg, F. M. Mechanisms of t cell organotropism. Cell Mol Life Sci. 73 (16), 3009-3033 (2016).
- Cinalli, R. M., et al. T cell homeostasis requires g protein-coupled receptor-mediated access to trophic signals that promote growth and inhibit chemotaxis. Eur J Immunol. 35 (3), 786-795 (2005).
- Wu, V., et al. Illuminating the onco-GPCRome: Novel g protein-coupled receptor-driven oncocrine networks and targets for cancer immunotherapy. J Biol Chem. 294 (29), 11062-11086 (2019).
- Wu, V. H., et al. The GPCR-alpha(s)-pka signaling axis promotes T-cell dysfunction and cancer immunotherapy failure. Nat Immunol. 24 (8), 1318-1330 (2023).
- Ramezani, A., Hawley, T. S., Hawley, R. G. Stable gammaretroviral vector expression during embryonic stem cell-derived in vitro hematopoietic development. Mol Ther. 14 (2), 245-254 (2006).
- . . Plat-E retroviral packaging cells (RV-101) user manual. , (2024).
- Anderson, J., Hope, T. Intracellular trafficking of retroviral vectors: obstacles and advances. Gene Ther. 12, 1667-1678 (2005).
- Kim, E., et al. Isolation and analyses of lamina propria lymphocytes from mouse intestines. STAR Protoc. 3 (2), 101366 (2022).
- Steinert, E. M., et al. Quantifying Memory CD8 T Cells Reveals Regionalization of Immunosurveillance. Cell. 161 (4), 737-749 (2015).
- Miltenyi Biotec. . CD90.1 MicroBeads mouse and rat. , (2024).
- Ocón, B., et al. A lymphocyte chemoaffinity axis for lung, non-intestinal mucosae and CNS. Nature. 635, 736-745 (2024).
- Sumida, H., et al. Gpr55 regulates intraepithelial lymphocyte migration dynamics and susceptibility to intestinal damage. Sci Immunol. 2 (18), eaao1135 (2017).
- Foxman, E. F., Campbell, J. J., Butcher, E. C. Multistep navigation and the combinatorial control of leukocyte chemotaxis. J. Cell Biol. 139 (5), 1349-1360 (1997).
- Alawar, N., et al. A solution for highly efficient electroporation of primary cytotoxic T lymphocytes. BMC Biotechnol. 24 (1), 16 (2024).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados