Method Article
Effiziente retrovirale Transduktion und kompetitives Homing zur Untersuchung der GPCR-vermittelten T-Zell-Lokalisierung in verschiedenen Gewebemikroumgebungen
In diesem Artikel
Zusammenfassung
Wir stellen verbesserte Protokolle für die retrovirale Transduktion von Transportrezeptoren und kompetitives Homing vor, um die Rezeptor-vermittelte organ- und mikroumgebungsspezifische Lymphozytenpositionierung zu untersuchen. Diese Methode bietet wertvolle Einblicke in die Mechanismen des Transports von Immunzellen und hat potenzielle Anwendungen in der zukünftigen Grundlagen- und Therapieforschung.
Zusammenfassung
Das Verständnis, wie die Expression des G-Protein-gekoppelten Rezeptors (GPCR) die Zellpositionierung in verschiedenen Gewebemikroumgebungen beeinflusst, ist für die Aufklärung der Mechanismen des Immunzelltransports unerlässlich. Wir präsentieren einen kompetitiven Homing-Assay, der entwickelt wurde, um die GPCR-vermittelte T-Zell-Lokalisierung in Organen zu untersuchen, die ihre verwandten Chemoattraktant-Liganden exprimieren, und der sowohl für Kurzzeit- als auch für Langzeitstudien geeignet ist. Der Ansatz beinhaltet ein verbessertes Protokoll für die Transduktion von T-Zellen durch rekombinante murine Stammzellviren (MSCV), um das interessierende GPCR oder ein Kontrollkonstrukt zu exprimieren, gefolgt von kompetitivem Homing in Empfängermäusen. Die Zellverteilung in verschiedenen Organen wird mittels Durchflusszytometrie und/oder konfokaler Mikroskopie analysiert. In Kurzzeitexperimenten (10-12 h) zeigte die konfokale Mikroskopie deutliche Zelllokalisationsmuster, u.a. in den Lungenbläschen, den Bronchien submukosa, den venösen Stellen und dem Interstitium in der Lunge sowie im Epithel, das die Luftröhre, den Magen und das Uterushorn auskleidet. In Langzeitstudien (1-7 Wochen) lieferte die Durchflusszytometrie Einblicke in die bevorzugte Zellakkumulation und zeigte so dynamische Veränderungen und eine mögliche Reifung oder Neupositionierung innerhalb des Gewebes im Laufe der Zeit. Dieser kompetitive Homing-Assay ist ein robustes Werkzeug zur Untersuchung der GPCR-vermittelten Zellpositionierung und bietet wertvolle Einblicke in die gewebespezifische Verteilung und potenzielle Anwendungen in der Immunologie und therapeutischen Forschung.
Einleitung
G-Protein-gekoppelte Rezeptoren (GPCRs) sind von grundlegender Bedeutung für die Regulierung einer Vielzahl von zellulären Prozessen, einschließlich Signaltransduktion, Neurotransmission, Hormonregulation und Immunzellmigration1. Sie spielen eine entscheidende Rolle bei der räumlich-zeitlichen Kontrolle der Migration und Lokalisation von Lymphozyten2. Während der Priming-Phase der Immunantwort veranlassen die lokale Mikroumgebung und zelluläre Wechselwirkungen die T-Lymphozyten, eine einzigartige Gruppe von Adhäsionsmolekülen und Chemokinrezeptoren zu exprimieren, die als Homing-Rezeptoren bekannt sind. Diese Anpassung ermöglicht es antigenerfahrenen T-Zellen, mit organspezifischen Endothelzellen (ECs) in Kontakt zu treten und in unterschiedliche Zielgewebe zu wandern. Die Fähigkeit von T-Zellen, Gewebetropismus zu erwerben, ist entscheidend für effektive Recall-Reaktionen, insbesondere im Zusammenhang mit wiederkehrenden Infektionen, die dasselbe Organ betreffen 3,4.
GPCRs leiten Immunzellen zu bestimmten Geweben und Organen, wo sie kritische Funktionen erfüllen - wie z. B. die Leitung von CD8+ T- und NK-Zellen zu Tumorstellen für eine zytotoxische Wirkung oder die Unterstützung von CD4+ T-Zellen bei der Orchestrierung von Immunantworten, indem sie die Aktivierung anderer Immunzellen unterstützen. Zu verstehen, wie GPCRs T-Zellen an ihre genauen Orte leiten, ist für die Weiterentwicklung zielgerichteter Immuntherapien unerlässlich 5,6. Die Herausforderung liegt jedoch darin, diese komplexen Wechselwirkungen in vitro zu modellieren, da es schwierig ist, sowohl räumlich eingeschränkte Signale als auch gerichtete chemotaktische Signale gleichzeitig zu replizieren.
Die Aufklärung der Rolle spezifischer Leukozytenrezeptoren ist auch oft schwierig, da sie in endogenen Populationen nur begrenzt exprimiert werden und diese Rezeptoren typischerweise unterschiedliche Zelltypen schmücken. Diese Komplexität macht es schwierig, die Rolle eines spezifischen Rezeptors von anderen zellspezifischen Mechanismen zu isolieren. Im Idealfall sollten die Methoden ähnliche Populationen vergleichen, die sich nur im interessierenden Rezeptor unterscheiden, um klare Erkenntnisse zu liefern.
Um diese Herausforderungen zu meistern, haben wir einen kompetitiven Homing-Assay eingeführt, der rekombinante retrovirale MSCV-Transduktion für eine effiziente GPCR-Expression in T-Zellen einsetzt. Retrovirale MSCV-Vektoren, die Elemente aus den auf dem myeloproliferativen Sarkomvirus (PCMV) basierenden MESV-Vektoren und den auf dem Moloney-Mausleukämievirus (MMLV) basierenden LN-Vektoren kombinieren, enthalten ein erweitertes hybrides Verpackungssignal, das von den LN-Vektoren abgeleitet ist7. Diese Modifikation erhöht die Effizienz der Genverabreichung und ermöglicht sowohl Kurzzeit- als auch Langzeitstudien zur T-Zell-Lokalisierung in vivo. Durch die Verwendung von retroviralen Partikeln mit hohem Titer und konfokaler Mikroskopie ermöglicht der Ansatz eine präzise Visualisierung der Positionierung und Wechselwirkungen von T-Zellen in komplexen Gewebeumgebungen. Wir stellen detaillierte Protokolle für die retrovirale Transduktion von Transportrezeptoren und die Durchführung von intern kontrollierten (sogenannten kompetitiven) Homing-Assays vor, um die rezeptorvermittelte organ- und mikroumgebungsspezifische Lymphozytenpositionierung zu untersuchen. Das übergeordnete Ziel dieser Methode ist es, wertvolle Einblicke in die Mechanismen des Immunzelltransports zu liefern und zukünftige Anwendungen sowohl in der Grundlagenforschung als auch in der therapeutischen Entwicklung zu ermöglichen.
Protokoll
Alle Mäuse in dieser Studie wurden in spezifischen pathogenfreien (SPF) Einrichtungen des Veterans Affairs Palo Alto Health Care System (VAPAHCS) gehalten. B6/SJL Prprc Pep3BoyJ (CD45.1), C57B6/J (CD45.2) und Rag1-/- Mäuse wurden von Jackson Laboratories gekauft. Während wir PepBoy zur Gewinnung von CD45.1-Zellen verwendet haben, empfehlen wir die Verwendung von JAXBoy (C57BL/6J-Ptprcem6Lutzy/J). JAXBoy ist ein vollständig coisogener Stamm, der durch CRISPR anstelle von herkömmlicher Rückkreuzung erzeugt wird, was die genetische Konsistenz verbessert. In der Vergangenheit umfassten CD45-Allotyp-markierte Studien mit PepBoy-Mäusen (CD45.1), die nicht vollständig kongenisch sind, Kontroll-Homing- und Rezirkulations-Assays mit Wildtyp-Vergleichen (WT/WT), um potenzielle Variabilität zu berücksichtigen. Da JAXBoy-Mäuse jetzt als vollständig isogene Alternative verfügbar sind, sind diese zusätzlichen Kontrollen möglicherweise nicht mehr erforderlich. Die Forscher sollten dennoch berücksichtigen, dass Unterschiede zwischen CD45.1- und CD45.2-Varianten - wie ihre Rolle als Protein-Tyrosin-Phosphatasen - das zelluläre Verhalten und die Homing-Muster beeinflussen können. Alle Protokolle, die im Text und im Folgenden besprochen werden, wurden genehmigt oder entsprechen den Richtlinien der akkreditierten Abteilung für Labortiermedizin und des Verwaltungsgremiums für die Versorgung von Labortieren am VA Palo Alto Health Care System (VAPAHCS). Die Tiere wurden nach anerkannten Verfahren getötet. Mäuse beiderlei Geschlechts im Alter von 8-12 Wochen wurden in die Experimente eingeschlossen.
1. Vorbereitung des MSCV-Vektors
- Kauf eines retroviralen Vektors MSCV-IRES-Thy1.1 mit der kodierenden Region des interessierenden Maus-Gens (GOI) oder einer ORF_Stuffer (negative ORF-Kontrolle)
HINWEIS: Dieses Konstrukt enthält den Oberflächenmarker Thy1.1 neben dem interessierenden GPCR-Gen. Der IRES-Linker (Internal Ribosome Entry Site) ermöglicht die Co-Expression des GPCR mit dem Thy1.1 und erleichtert so die Identifizierung transduzierter Zellen durch Durchflusszytometrie oder die Reinigung und Isolierung durch magnetische Beads. Dies ist besonders nützlich, wenn keine für den GPCR spezifischen Antikörper verfügbar sind, wie es bei schlecht untersuchten GPCRs oft der Fall ist. - Beschaffung des MSCV-Plasmids in bakterieller Form und Kultur durch Inokulation von Luria-Bertani (LB)-Brühe, die mit einer geeigneten Antibiotikaauswahl auf der Grundlage des vom Plasmid kodierten Resistenzgens (z. B. Ampicillin, Kanamycin oder Chloramphenicol) ergänzt wurde. Das LB-Medium besteht aus Trypton (10 g/L), Hefeextrakt (5 g/L) und NaCl (10 g/L), wird auf pH 7,0 eingestellt und durch Autoklavieren sterilisiert. Inkubieren Sie die Kultur bei 37 °C in einem Schüttelinkubator (220 U/min) über Nacht.
- Bereiten Sie Plasmidstämme mit molekularbiologischen Standardtechniken unter Verwendung eines DNA-Präparationskits vor.
- Nach der DNA-Isolierung ist die DNA-Konzentration mit einem Spektralphotometer zu messen und Arbeitsplasmidlösungen mit einer Konzentration von 1 μg/μl herzustellen. Lagern Sie die Plasmide bei -20 °C für die zukünftige Verwendung.
2. Etablierung der Verpackung von Zelllinienkulturen
HINWEIS: Wir haben Platinum E (Plat-E) Zellen von Cell Biolabs verwendet. Plat-E-Zellen sind eine 293T-basierte Zelllinie mit einem EF1α-Promotor, der eine stabile und ertragreiche Expression von retroviralen Strukturproteinen (gag-, pol- und env-Gene) ermöglicht und so eine retrovirale Verpackung mit einer einzigen Plasmidtransfektionermöglicht 8. Obwohl andere Zelllinien wie NIH-3T3 oder 293T verwendet werden könnten, haben wir diese Alternativen nicht getestet.
- Bereiten Sie Plat-E-Zellmedien durch Zugabe von DMEM, 10 % FBS, 1 % Penicillin/Streptomycin, Blasticidin (10 μg/ml) und Puromycin (1 μg/ml) vor. Verwenden Sie Blasticidin und Puromycin zur Zellerhaltung, lassen Sie sie jedoch während und nach der Transfektion weg.
- Platten-Plat-E-Zellen werden gefroren in 1,0 ml geliefert, zu >3 x 106 Zellen/ml in DMEM, 20 % FBS und 10 % DMSO. Tauen Sie sie schnell in einem 37 °C warmen Wasserbad auf. Übertragen Sie alle aufgetauten Zellen in ein konisches 15-ml-Röhrchen mit Plat-E-Kulturmedium.
- Zentrifugieren Sie bei 450 x g für 5 min bei 4 °C. Resuspendieren Sie das Zellpellet in 1 mL Plat-E-Medium, indem Sie es vorsichtig pipettieren, um eine Einzelzellsuspension herzustellen.
- Geben Sie 9 ml Plat-E-Medium in eine 10-cm-Kulturschale und geben Sie dann die 1 ml der resuspendierten Zellen in die Schale. Bestätigen Sie, dass die aufgetauten Zellen lebensfähig sind, indem Sie ein gleiches Volumen Zellsuspension und Trypanblau mischen und die lebensfähigen (ungefärbten) und toten (blau gefärbten) Zellen mit einem Hämozytometer oder Zellzähler zählen, um eine Lebensfähigkeit von >70 % zu erreichen.
- Inkubieren Sie die Zellen bei 37 °C in einem befeuchteten Inkubator mit 5 % CO2. Wechseln Sie das Medium in den ersten 3 Tagen nicht. Es ist normal, schwimmende und tote Zellen beim ersten Auftauen zu beobachten.
- Wenn die Zellen eine Konfluenz von 85 % bis 90 % erreichen, waschen Sie sie mit DMEM/PBS Ca-/Mg-. Trennen Sie die Zellen mit 2 mL 0,05 % Trypsin/0,5 mM EDTA und inkubieren Sie 3 Minuten lang bei 37 °C. Geben Sie 8 mL Plat-E-Medium hinzu, sammeln Sie die Zellen in ein konisches 15-ml-Röhrchen und zentrifugieren Sie 5 Minuten lang bei 4 °C bei 450 x g .
- Im Oberflächenverhältnis 1:10 oder 1:5 teilen (d. h. neue Platten mit 1/10 oder 1/5 des Gesamtvolumens der ursprünglichen Schale aussäen). In einem Endvolumen von 10 mL Plat-E-Medium resuspendieren und bei 37 °C in einem befeuchteten Inkubator mit 5 % CO2 inkubieren.
- Den Rest der Zellen aliquotieren Sie in 1 mL FBS mit 10 % DMSO und frieren Sie bei -80 °C und anschließend in flüssigem Stickstoff für den Langzeitgebrauch ein.
HINWEIS: Behandeln Sie Zellen wie oben beschrieben, wenn sie zu fast 85 % konfluent sind. Um eine optimale Zellgesundheit zu erhalten, vermeiden Sie eine übermäßige Konfluenz und streben Sie 3-Tage-Splits mit einer Verdünnung von 1:10 an. Wenn sich das Wachstum verlangsamt, verwenden Sie ein frisches Aliquot. Die Zellleistung nimmt in der Regel mit den nachfolgenden Passagen ab. Wir empfehlen, Zellen für die Transfektion zwischen den Passagen 4 und 15 zu verwenden, um die besten Ergebnisse zu erzielen.
3. Herstellung von transduzierten Zellen
- Tag 1: Seed Plat E Zellen
HINWEIS: Berechnen Sie die Anzahl der erforderlichen Plat E-Zellen und -Platten. Wir verwendeten 1 ml Virusüberstand pro Vertiefung in einer 24-Well-Platte, um Zellen 2x zu transfizieren. In der Regel verwenden wir etwa zwei 10-cm-Petrischalen-transfizierte Platten mit Plate-E-Zellen pro 24-Well-Platte mit T-Zellen in Kultur.- Beginnen Sie damit, 10 cm große Gewebekulturplatten mit 5 mL 50 μg/mL Poly-D-Lysin in sterilem Wasser zu beschichten. Bei Raumtemperatur 45 min inkubieren. 2x mit sterilem PBS Ca-/Mg waschen -- um sicherzustellen, dass keine Rückstände zurückbleiben.
HINWEIS: Wir empfehlen, die Platten zu beschichten, da Plat-E-Zellen dazu neigen, sich nach der Transfektion abzulösen, was zu einer schlechten Zellleistung und einer verminderten Virustiterproduktion führt. - Entfernen Sie die Plat-E-Zellen wie oben in Schritt 2.6 beschrieben und führen Sie einen Trypanblau-Ausschlussassay durch, um die Lebensfähigkeit sicherzustellen. Mischen Sie ein gleiches Volumen aus Zellsuspension und Trypanblau. Zählen Sie die lebensfähigen (ungefärbten) und toten (blau gefärbten) Zellen mit einem Hämozytometer/Zellzähler. 3 x 10⁶lebende Zellen in einer 10 cm großen Gewebekultur-Petrischale mit antibiotikafreiem Plat-E-Medium säen.
HINWEIS: Gesäte Platten sollten am nächsten Tag eine Konfluenz von 85 % bis 90 % erreichen. Wenn dies nicht erreicht wird, sollten Sie die Verwendung eines anderen Zellaliquots in Betracht ziehen. Passen Sie die Aussaatdichte basierend auf dem Zeitpunkt der Beschichtung an. Für die abendliche Plattierung können 3,5 x 106 Zellen verwendet werden.
- Beginnen Sie damit, 10 cm große Gewebekulturplatten mit 5 mL 50 μg/mL Poly-D-Lysin in sterilem Wasser zu beschichten. Bei Raumtemperatur 45 min inkubieren. 2x mit sterilem PBS Ca-/Mg waschen -- um sicherzustellen, dass keine Rückstände zurückbleiben.
- Tag 2: Transfektion von Plat-E-Zellen und Beschichtung von T-Zellen mit Anti-CD3- und Anti-CD28-Antikörpern
- Ersetzen Sie das Medium auf Plat-E-Zellkulturen durch 6,5 ml reduziertes Serummedium.
- Bereiten Sie die Transfektionsmischung gemäß den Herstellerangaben für das Lipofectamine-Reagenz vor (Lipofectamine 2000 wurde in dieser Studie verwendet).
- Mischen Sie für jede Platte 45 μl Lipofectamine 2000 mit 210 μl reduziertem Serummedium in einem Röhrchen und 15 μg DNA mit 235 μl reduziertem Serummedium in einem anderen Röhrchen. Kombinieren Sie den Inhalt der Röhrchen, indem Sie 3x-4x pipettieren.
- Inkubieren Sie die Mischung 5-20 Minuten lang bei Raumtemperatur, damit sich Lipofectamine/DNA-Komplexe bilden können, und geben Sie sie dann tropfenweise auf die Platten. Die Platten 16 h bei 37 °C inkubieren.
- T-Zell-Aktivierungs-Wells: Beschichten Sie 24-Well-Platten mit 5 μg/ml Anti-Maus-CD28 (37,51) und 10 μg/ml Anti-Maus-CD3 (145-2c11) in 375 μl/Well-PBS über Nacht bei 4 °C oder an Tag 3 bis 3 Stunden im Inkubator bei 37 °C.
HINWEIS: Wickeln Sie die Platten in transparente Folie ein, wenn Sie über Nacht inkubieren, um eine Verdunstung zu verhindern. Der Dynabeads Mausaktivator CD3/CD28 kann als Alternative mit vergleichbaren Ergebnissen verwendet werden.
- Tag 3: Plat-E Medien wechseln und T-Zellen isolieren und aktivieren
- Wechseln Sie das Transfektionsmedium von Plat-E morgens auf 14 mL DMEM-Vollmedium. Bereiten Sie T-Zell-Medien vor, indem Sie RPMI-10 hinzufügen: RPMI 1640 mit L-Glutamin, 10 % FBS, 1 % Penicillin/Streptomycin, 1x MEM Nicht-essentielle Aminosäuren, 1 mM Natriumpyruvat, 50 μM β-Mercaptoethanol und 1 mM HEPES.
- Euthanasieren Sie JAXBoy (CD45.1) und C57B6/J (CD45.2) Mäuse durch CO2-Inhalation, gefolgt von einer Zervixluxation. Milz und Lymphknoten unter sterilen Bedingungen isolieren.
- Die Milz auf einem 100-μm-Nylonnetz-Zellsieb mit RPMI-Medium in einer 6-Well-Platte mit einem Spritzenkolben vorsichtig zerdrücken.
- Übertragen Sie die Lösung durch ein 40-μm-Nylonnetz-Zellsieb für eine Einzelzellsuspension in ein konisches 50-ml-Röhrchen. Bei 450 x g für 5 min bei 4 °C zentrifugieren und mit PBS Ca-/Mg- waschen.
- Führen Sie eine magnetische Negativauswahl mit dem Maus T/T CD4-Isolationskit gemäß den Anweisungen des Herstellers durch oder sortieren Sie die Zellen alternativ mit sterilem FACS
- Zählen Sie die T-Zellen mit einem Zellzähler und plätieren Sie sie in den T-Zell-Aktivierungswells bei 1-1,5 x 106 pro Well in 1 ml RPMI-10-Medium pro Well. Inkubieren Sie die Zellen bei 37 °C mit 5 % CO₂ in einem befeuchteten Inkubator. Warten Sie 24-48 Stunden für die ordnungsgemäße Aktivierung, wie unter dem Mikroskop beurteilt, wie in den folgenden Hinweisen erläutert.
HINWEIS: Durch die Vernetzung von CD3 und CD28 werden die T-Zellen in diesem Setup effektiv aktiviert. Eine Milz einer Maus ergibt typischerweise etwa 1 x 108 Splenozyten. CD4+ T-Zellen machen im Allgemeinen etwa 10 % der gesamten Splenozytenpopulation aus. Daher wird geschätzt, dass für die Herstellung einer 24-Well-Platte mit 1-1,5 x 106 CD4+ T-Zellen pro Well Zellen von 2-3 Mäusen ausreichend sind.
- Tag 4: Transduktion
- Kontrollieren Sie die T-Zellen nach 24 h unter dem Mikroskop. Stellen Sie sicher, dass sich die T-Zellen vor der Transduktion in einem strahlenden Zustand befinden (Cluster bilden und aufgrund der Aktivierung vergrößert erscheinen). Die Sprengung von T-Zellen stellt sicher, dass sie sich in einem sich teilenden Zustand befinden, der für die MSCV-Transduktion entscheidend ist9.
- Sammeln Sie ~10 mL Virusüberstand von den 10 cm Platten in einem konischen Röhrchen. Ersetzen Sie die Plat-E-Kulturplatten durch weitere 10 mL Plat-E-Medium ohne Antibiotika, um sicherzustellen, dass genügend Medien vorhanden sind, um mehr Medien für eine zweite Transduktion am nächsten Tag zu erzeugen. Passen Sie das Medienvolumen in PLAT-E-Platten basierend auf der Anzahl der T-Zell-Wells an, die am nächsten Tag transfiziert werden müssen.
HINWEIS: Die 2-fache Übertragung verbessert den Wirkungsgrad erheblich. - Filtrieren Sie den Virusüberstand durch einen 0,45-μm-Spritzenvorsatzfilter. Fügen Sie 8 μg/mL Polybren und 1:100 HEPES hinzu.
- Drehen Sie die 24-Well-T-Zellplatte 7 Minuten lang bei 950 x g. Sammeln Sie den Überstand vorsichtig und bewahren Sie ihn auf, ohne die Zellen zu entfernen. Dieser Überstand enthält Zytokine und andere Faktoren, die von den T-Zellen nach der Aktivierung sezerniert und nach der Infektion durch diesen Überstand ersetzt werden, um das Zytokin- und Faktorenprofil zur Unterstützung der T-Zellproliferation und des T-Zellwachstums aufrechtzuerhalten.
- Führen Sie eine Desinfektion durch, indem Sie 1 ml Virusüberstand in jede Vertiefung geben und 4 Stunden lang bei 32 °C bei 1.150 x g drehen. Verschließen Sie die Platten während der Desinfektion mit Plastikfolie.
- Ersetzen Sie das Medium nach der Desinfektion vorsichtig durch den zuvor gespeicherten T-Zell-Überstand.
- Tag 5: Wiederholung der Transduktion
- Wiederholen Sie die Transfektion wie an Tag 4 beschrieben. Optional kann der in Schritt 3.4.3 gespeicherte Überstand der initial aktivierten T-Zellen im Verhältnis 1:1 mit frischem Medium gemischt werden, wenn das Medium erschöpft erscheint.
- Tag 6: Zellen waschen und erweitern
- Waschen Sie die Zellen mit PBS Ca+/Mg+. und übertragen Sie sie auf eine neue Kulturplatte mit 130 U/ml Maus-IL2 und 10 ng/ml Maus-IL7. Inkubieren Sie die Zellen mindestens 2 Tage lang oder bis sie das gewünschte Expansionsniveau erreichen, basierend auf der Anzahl der für die Injektion benötigten Zellen.
- Tag 8: Ernte und Reinigung
- Ernten Sie Zellen und reinigen Sie sie mit einem histopaken Dichtegradienten von 1,077.
HINWEIS: Diese Technik hilft, lebensfähige Zellen (wie Lymphozyten oder andere Immunzellen) aus toten Zellen oder Ablagerungen zu isolieren. Tote Zellen, die eine höhere Dichte aufweisen, setzen sich am Boden des Röhrchens ab, während lebensfähige Zellen in der Regel in der Grenzschicht verbleiben. - Geben Sie 5 mL Histopaque 1.077 in ein 15 mL Röhrchen. Ernten Sie die Zellen durch Zentrifugieren bei 450 x g für 5 min bei 4 °C, um die Zellen zu pelletieren.
- Resuspendieren Sie das Zellpellet in 5 mL PBS Ca+/Mg+. Schichten Sie die Zellsuspension vorsichtig auf 5 mL Histopaque 1.077 im Zentrifugenröhrchen.
- Zentrifugieren Sie bei 400-500 x g für 20 Minuten bei Raumtemperatur und stellen Sie sicher, dass die Unterbrechung/Beschleunigung der Zentrifuge auf Null eingestellt ist.
- Nach der Zentrifugation trennen sich die Zellen je nach Dichte in unterschiedliche Schichten. Die gewünschten Zellen befinden sich in der Regel an der Grenzschicht zwischen dem Histopaken und dem oberen Medium, während sich tote Zellen am unteren Rand absetzen. Entnehmen Sie die Zellschicht vorsichtig mit einer Pipette an der Grenzschicht, um eine Kontamination mit anderen Schichten zu vermeiden. Die gesammelten Zellen sind nun bereit und sauber für die Injektion.
- Beurteilen Sie die Transduktionseffizienz durch Durchführung von Thy1.1-Färbung und Durchflusszytometrie-Analyse. Siehe die Gating-Strategie in Abbildung 1.
HINWEIS: Nach der Transduktion können Zellen in Chemotaxis-Assays verwendet werden, um ihre Migration zu spezifischen Chemokinen im Vergleich zu Kontrollvektorzellen zu beurteilen und ihre Aktivität in vitro funktionell zu bestätigen, bevor mit der Injektion fortgefahren wird.
- Ernten Sie Zellen und reinigen Sie sie mit einem histopaken Dichtegradienten von 1,077.
- Langzeit-In-vivo-Lokalisierungsassay
- Verwenden Sie für die Langzeithoming CD45.1 für den interessierenden Maus-GPCR und CD45.2 für leere Vektorzellen (oder umgekehrt), die transduziert wurden. Mischen Sie die beiden Zellpopulationen im Verhältnis 1:1.
- Injizieren Sie intravenös 20-30 x 10 insgesamt6 Zellen für jede Rag1-/- adulte Empfängermaus für 1 Woche Tropismus und 5 x 106 für einen 7-wöchigen Tropismus. Wir verwenden lymphozytendefiziente Rag1-/- Empfänger, um die Konkurrenz mit endogenen T-Zellen zu reduzieren.
- Nach 1 bis 7 Wochen (je nach Studie) injizieren Sie den Mäusen 5 Minuten vor der Entnahme intravenös (i.v.) Anti-CD45-Antikörper, um die im Blut übertragenen Zellen zu markieren.
- Euthanasieren Sie die Mäuse durch CO2 -Inhalation, gefolgt von einer Gebärmutterhalsluxation.
HINWEIS: Es wurden Studien von 1 Woche und 7 Wochen durchgeführt; Längere Studien könnten möglich sein, müssen aber noch getestet werden. - Entnahme von Zellen aus verschiedenen Organen von Interesse und Kontrollen. Verdauen Sie das Gewebe gemäß den Standardprotokollen zur Lymphozytenvorbereitung für jedes Organ10,11.
- Färben Sie die gesammelten Zellen mit monoklonalen Antikörpern (mAbs) für die durchflusszytometrische Analyse.
- Kurzfristiges kompetitives Homing: T-Zell-Positionierung und Bildgebung
- Wir empfehlen, C57B6/J-Mäuse als Spender zu verwenden, da wir die Zellen fluoreszenz markieren werden. Für sehr kurze Homing-Assays von bis zu einigen Stunden kann jedoch jeder Stamm verwendet werden.
- Isolieren Sie am 8. Tag der Kultur transduzierte (Thy1.1+) Zellen magnetisch mit CD90.1-Mikrokügelchen gemäß den Anweisungen des Herstellers12.
- Halten Sie nur transduzierte Zellen (>95% Reinheit) nach diesem Zeitpunkt 2 Tage lang unter IL2 und IL7 in Kultur, wie oben angegeben, und lassen Sie sie expandieren. Die Mikrokügelchen sind biologisch abbaubar und beeinträchtigen nach 48 h die normale Zellfunktion nicht.
- An Tag 11 markieren Sie die Zellen, die den interessierenden GPCR exprimieren, mit Carboxyfluorescein-Succinimidylester (CFSE ist ein Färbefarbstoff für fluoreszierende Zelle). Verwenden Sie für Stuffer-Zellen einen gelben Fluoreszenzfarbstoff oder umgekehrt. Sie können auf Wunsch alternative Farbstoffe verwenden.
- Bereiten Sie eine Zellsuspension in einer Konzentration von 1 x 106 Zellen/ml in RPMI mit 2 % FBS vor. Inkubieren Sie die Zellen mit dem Farbstoff bei einer Endkonzentration von 5 μM bei 37 °C in einem Wasserbad unter sanftem Rühren für 20 min. Um vergleichbare Ergebnisse zu gewährleisten, wechseln Sie die Farbstoffzuordnungen in separaten Experimenten ab. Alternativ können Sie einen einzigen Farbstoff verwenden, um einen gemeinsamen Zelltyp als internen Standard zu markieren, einschließlich Versuchs- und Kontrollzellen bei verschiedenen Empfängern.
- Waschen Sie die markierten Zellen und mischen Sie sie im Verhältnis 1:1. Schätzen Sie die Zellkonzentration mit einem Zellzähler. Injizieren Sie 15-30 x 106 Zellen intravenös in Empfängermäuse (WT oder transgene Empfängermäuse, je nach Zweck des Experiments).
- Etwa 10-12 Stunden später injizieren Sie den Mäusen Anti-CD31-Antikörper (z. B. DyLight 633 markiert, Klon 390), was 10-15 Minuten vor der Tötung sein sollte, um Blutgefäße abzugrenzen und intravaskuläre von extravasierten Zellen zu unterscheiden.
- Euthanasieren Sie die Mäuse durch CO2 -Inhalation, gefolgt von einer Gebärmutterhalsluxation. Analysieren Sie die Zelllokalisierung mittels FACS von Zellsuspensionen, wie in Schritt 3.8 oben beschrieben, oder durch Bildgebung ganzer Gewebehalterungen wie in Schritt 3.9.8 oder Schritt 3.9.7 für Organe von Interesse mittels konfokaler Mikroskopie.
- Bereiten Sie für dünne Organe wie Luftröhre, Gebärmutterhorn oder Lymphknoten Kürbishalterungen vor. Legen Sie das Taschentuch auf einen Objektträger mit doppelseitigem Klebeband an den Seiten, fügen Sie ein paar Tropfen Fluoromount-G-Montagelösung hinzu, decken Sie es mit einem Deckglas ab und drücken Sie vorsichtig und gleichmäßig, um das Deckglas mit einem separaten Objektträger oder einem anderen flachen Gegenstand am Klebeband zu befestigen.
- Bei Schnellschnitten betten Sie das Gewebe in die Verbindung mit optimaler Schnitttemperatur (OCT) ein. Bei der Lunge vor dem Einbetten mit 50 % OCT/PBS perfundieren.
- Verwenden Sie die Durchflusszytometrie für Kontrollorgane wie periphere Lymphknoten (PLN), Milz oder Blut, um die Transduktionseffizienz (% Thy1,1+) zu beurteilen, wie in Abbildung 1 gezeigt, und um die Ergebnisse zu normalisieren. Visualisieren Sie PLN mit Quetschhalterungen oder -schnitten mit konfokaler Mikroskopie. Zählen Sie Zellen mit konfokaler Mikroskopie mit der Imaris-Software.
- Bestimmen Sie das Verhältnis von GPCR-transduzierten Zellen zu Kontrollzellen (Stuffer-transduzierten) Zellen in ganzen Organen oder spezifischen Organkompartimenten. Normalisieren Sie auf die durch FACS ermittelten Input-Verhältnisse und/oder auf das Verhältnis, das von Kontrollorganen gewonnen wurde, bei denen der GPCR bekannt ist oder von dem angenommen wird, dass er irrelevant ist.
- Zur Analyse der Mikroumgebungslokalisation in der Lunge messen Sie mit der Imaris-Software den Abstand von Zellen zu histologischen Orientierungspunkten (z. B. bronchiale Basalmembranen oder Venen).
Ergebnisse
In dieser Studie stellen wir ein detailliertes Protokoll vor, um die Fähigkeit spezifischer Rezeptoren zu untersuchen, die T-Zell-Lokalisierung in vivo zu steuern. Als Demonstration dieses Protokolls haben wir GPR2513 verwendet. Mit diesem Protokoll sind wir in der Lage, eine Transduktionseffizienz von 30 % bis 40 % zu erreichen, wie durch Thy1.1-Färbung mittels Durchflusszytometrie beurteilt wird. Wir führten in vitro Transwell-basierte Chemotaxis-Assays mit GPR25-transduzierten Zellen zusammen mit Stuffer-Kontrollen durch und testeten deren Migration zu hCXCL17, mCXCL17 und CXCL12 als Positivkontrolle. GPR25-transduzierte T-Zellen migrierten im Vergleich zu Stuffer-transduzierten Zellen effizient zu CXCL17, was die erfolgreiche Transduktion und funktionelle Expression des Rezeptors bestätigt (Abbildung 2).
Langfristiges Homing
Abbildung 1 zeigt die Gating-Strategie zur Analyse von T-Zellen über verschiedene Organe hinweg. Der Anti-CD45-Antikörper wurde 5 Minuten vor der Gewebeentnahme injiziert, um intravaskuläre Zellen von der Analyse auszuschließen. Es wurden nur TCRβ+ CD4+ Thy1.1+ Zellen eingeschlossen, die auf eine erfolgreiche Transduktion hinweisen. Für jedes Organ wurde das Verhältnis der GPCR-exprimierenden Zellen zu denen mit dem leeren Vektor berechnet. Diese Ergebnisse wurden auf den ursprünglichen Transduktionsprozentsatz (% Thy1,1+) des Eingabezellenpools normalisiert.
Nach der Injektion in Empfängermäuse besiedelten GPR25-transduzierte Zellen bevorzugt nicht-intestinale Schleimhautgewebe (NIMT) wie den Urogenitaltrakt (GU), den Magen und die Luftröhrenorgane, die reich an GPR25LG sind (Abbildung 3). Unsere Studien zeigten eine signifikante Anreicherung von GPR25-transduzierten Zellen in ganzen Lungenisolaten nach 7 Wochen, aber nicht 1 Woche nach der Injektion, was auf eine mögliche Reifung oder Neupositionierung in der Lunge im Laufe der Zeit hindeutet (Abbildung 3). Diese Ergebnisse unterstreichen, wie wichtig es ist, eine geeignete Studienlänge zu wählen.
Kurzfristige Zielsuche
Um die in vivo Lokalisation von GPR25 und seine Rolle beim Homing aus dem Blutkreislauf zum NIMT zu untersuchen, führten wir Kurzzeit-Homing-Assays durch. GPR25-transduzierte T-Zellen wurden zusammen mit Kontrollvektor-transduzierten Zellen injiziert und 10-12 Stunden nach dem intravenösen Transfer in Wildtyp- (WT) und CXCL17-/- Mäuse analysiert (Abbildung 4). Anti-CD31 wurde 20 Minuten vor der Tötung verabreicht, um intravaskuläre Zellen von extravasierten Zellen zu unterscheiden. Bei WT-Empfängern verschaffte die GPR25-Expression CXCL17-reichen Organen wie Luftröhre, Magen, Zunge, Gallenblase und Uterusschleimhaut einen Homing-Vorteil, nicht aber dem Darm, den Lymphknoten oder der Milz, wo CXCL17 nicht exprimiert wird (Abbildung 4A-C). Interessanterweise zeigten konfokale Bildgebung und Quantifizierung, dass GPR25-transduzierte T-Zellen nicht nur unter extravasierten Zellen angereichert waren, sondern auch unter Zellen, die noch an das vaskuläre Endothel innerhalb des NIMT gebunden waren, was darauf hindeutet, dass der Signalweg sowohl zum anfänglichen Stillstand des Endothels als auch zum Eintritt in das Zielgewebe und zur Migration in das Schleimhautepithel beiträgt. Der Vorteil von GPR25-transduzierten T-Zellen gegenüber Stuffer-transduzierten Zellen wurde aufgehoben, wenn sie in CXCL17-/- Empfänger injiziert wurden.
Im peribronchovaskulären Interstitium der Lunge waren GPR25-transduzierte Zellen überwiegend in den Bronchien lokalisiert, während Kontrollzellen häufiger in der Nähe von Venen zu finden waren (Abbildung 4D). Dieses Muster deutet auf eine GPR25-abhängige Repositionierung von Zellen von venösen Stellen zur bronchialen Submukosa hin. GPR25-transduzierte Zellen zeigten jedoch keine Präferenz für Bronchiolen und konnten sich bei CXCL17-/--Empfängern nicht von Kontrollzellen trennen. Diese Ergebnisse deuten darauf hin, dass die GPR25-Chemoaffinität spezifisch die Lokalisation in den Lungenbronchien steuert, während die anfängliche Extravasation GPR25-unabhängig sein und durch alternative Mechanismen vermittelt werden kann.
Unsere Technik erlaubte es uns zu schlussfolgern, dass die GPR25-CXCL17-Achse spezifisch die Rekrutierung von Lymphozyten in die Atemwege, den oberen Magen-Darm-Trakt, den Gallentrakt und den Urogenitaltrakt vermittelt. Das hier beschriebene Protokoll definiert die Rolle von GPR25 bei der gewebespezifischen Homing und trägt zu einem tieferen Verständnis bei, wie dieser zuvor verwaiste Rezeptor die T-Zell-Lokalisierung in verschiedenen Gewebemikroumgebungen beeinflusst.
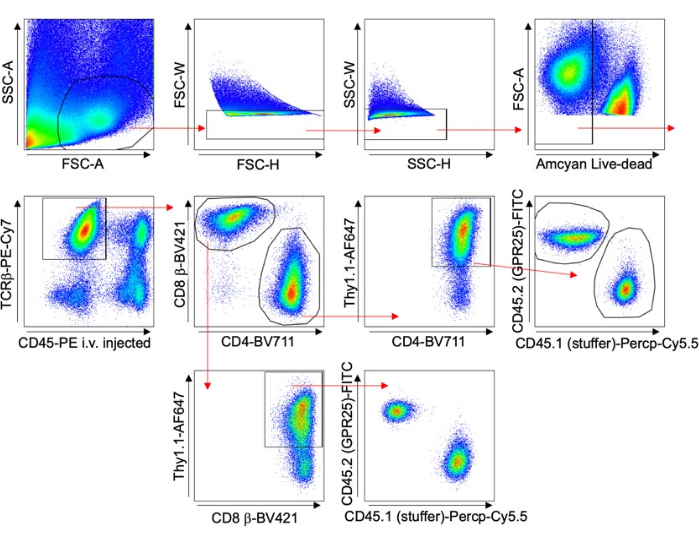
Abbildung 1: Repräsentative Gating-Strategie. FACS-Diagramm, das die Gating-Strategie zeigt, die für T-Zell-Transduktionsexperimente der Maus verwendet wurde, insbesondere für die Langzeit-Homing-Studie (Lungenbeispiel). Intravenös injizierte CD45-PE- und Thy1.1-Färbungen wurden verwendet, um intravaskuläre Zellen auszuschließen und transduzierte Zellen spezifisch zu analysieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
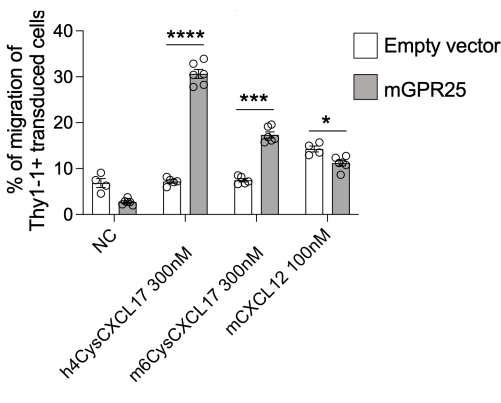
Abbildung 2: Chemotaxis von transduzierten Zellen zur Überprüfung ihrer Funktion. mGPR25-transduzierte Zellen, aber keine leeren vektortransduzierten Gegenstücke, chemotaxis in vitro robust gegenüber mausischem und humanem CXCL17 in vitro in transwell-basierten Migrationsassays. Die Ergebnisse werden als Mittelwerte ± SEM aus mindestens zwei unabhängigen Experimenten dargestellt. P < 0,0001 vs. keine Chemokinkontrolle (zweiseitiger t-Test). Diese Zahl wurde von13 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: FACS-Ergebnisse für das langfristige Homing. Verhältnis von GPR25-transduzierten zu Kontrollvektor-transduzierten Zellen in Geweben 1 und 7 Wochen nach der Injektion in Rag1-/- Mäuse. GPR25- und Kontrollzellen wurden nach CD45.1- und CD45.2-Allotyp unterschieden, in verschiedenen Experimenten umgeschaltet, mittels Durchflusszytometrie analysiert und auf Input-Verhältnisse normalisiert. Die Ergebnisse aus drei unabhängigen Experimenten (2-3 Mäuse pro Experiment) werden als Mittelwert ± SEM dargestellt. *P < 0,05, **P < 0,01, ***P < 0,001 (zweiseitiger T-Test). N/A zeigt eine geringe Zellausbeute für die Analyse an. Diese Zahl wurde von13 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
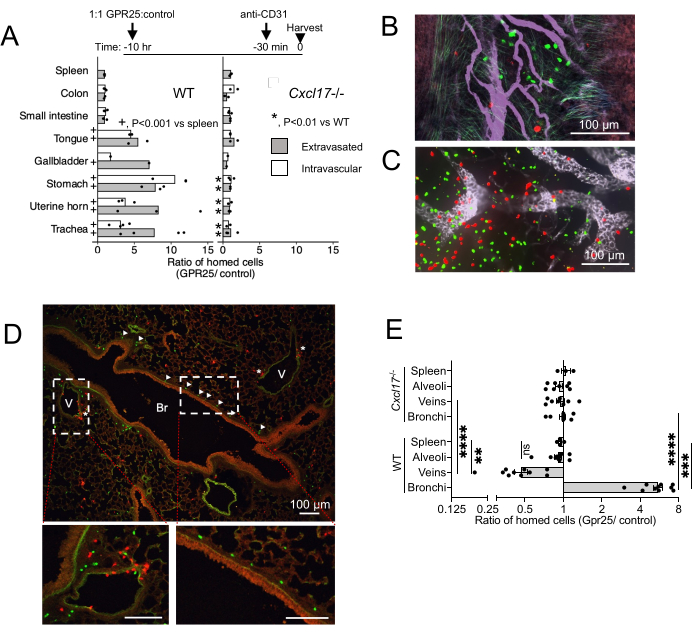
Abbildung 4: Konfokale Bildgebungsergebnisse aus dem Kurzzeit-Homing. (A) Verhältnis von GPR25 zu Kontrollspenderzellen 10-12 h nach der Injektion, bestimmt durch konfokale Mikroskopie von ganzen Mount-Geweben oder Schnellschnitten. Die Verhältnisse in der Kontrollmilz wurden mittels Durchflusszytometrie bestimmt. p-Werte, die aus dem exakten Fisher-Test abgeleitet wurden, bei dem die Zellzahlen in den angegebenen Zielgeweben mit denen der Milz bei WT-Empfängern (+) verglichen wurden, oder die Zahlen in den Zielgeweben bei CXCL17-/- mit WT-Empfängern verglichen wurden (*). Die Zellzahlen wurden aus 1 (Gallenblase) oder 2-4 unabhängigen Experimenten mit einer Maus pro Bedingung und Experiment gepoolt. Die mittleren Verhältnisse werden angezeigt. (B-D) Repräsentative Bilder der Luftröhre (B), PLN (C) und der Lungenquerschnitte (D) 10 h nach der Injektion, die GPR25- (grün) und Kontrollzellen (rot) CD4-T-Zellen zeigen. Pfeilspitzen in (D) zeigen GPR25-Zellen an, die im Bronchus (Br) lokalisiert sind; Sternchen kennzeichnen Zellen in der Nähe von Venen (V). (E) Das Verhältnis von GPR25 zur Kontrolle von Spenderzellen in indizierten pulmonalen Mikroumgebungen: Bronchien: innerhalb von 30 μm um die bronchiale Basalmembran. Vene: innerhalb von 30 μm um oder in Kontakt mit venösem Endothel. Alveolen: innerhalb der Alveolarräume, die nicht an Venen oder Bronchien angrenzen. Jeder Punkt ist das Verhältnis innerhalb von 2-4 unabhängigen 10x-Feldern für WT und CXCL17, was ~ 4 mm2 entspricht. Die Milzverhältnisse wurden zum Vergleich von (B) dupliziert. Die Ergebnisse zeigen 3 unabhängige Experimente mit 1-2 Mäusen pro Experiment und als Mittelwert ± REM. *P < 0,05, **P < 0,01, ***P < 0,001, ****P < 0,0001 vs. Milz; WT vs. CXCL17-/- (zweiseitiger t-Test). Diese Zahl wurde von13 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Der in dieser Studie beschriebene intern kontrollierte Homing-Assay ist eine umfassende Methode zur Untersuchung des GPCR-vermittelten T-Zelltransports und der Positionierung in verschiedenen Organen und Gewebemikroumgebungen. Dieser Ansatz integriert mehrere kritische Optimierungen, um die Reproduzierbarkeit, Genauigkeit und Effizienz zu verbessern.
Ein kritischer Aspekt dieses Protokolls ist die effiziente Transduktion von T-Zellen unter Verwendung von retroviralen MSCV-Vektoren, die durch die Verwendung von Plat-E-Zellen für die Virusproduktion erleichtert wird. Zu den wichtigsten Optimierungen gehören die Aufrechterhaltung einer angemessenen Konfluenz der Plat-E-Zellen, die Verwendung von Poly-D-Lysin-beschichteten Platten zur Verbesserung der viralen Transfektion und der Einsatz einer doppelten Transduktionsstrategie zur Maximierung der GPCR-Expression. Da MSCV-Vektoren für eine effektive Genomintegration eine aktive Zellteilung erfordern, erhöht die Induktion des Zellzykluseintritts durch T-Zellaktivierung die Effizienz der retroviralen Transduktion erheblich. Hohe Konzentrationen von Anti-CD3- und CD28-Antikörpern sind entscheidend, um die Aktivierung und das Strahlen von T-Zellen zu gewährleisten, was sich in unseren Studien als wirksamer erwiesen hat als niedrigere Konzentrationen, die an anderer Stelle berichtet wurden14. Wir fanden auch heraus, dass die Aufnahme der Zytokine IL-2 und IL-7 in das Kulturmedium für die Aufrechterhaltung der Lebensfähigkeit von T-Zellen und die Förderung ihrer Expansion von entscheidender Bedeutung ist, um eine robuste Population gesunder, transduzierter T-Zellen zu gewährleisten, die für genaue Migrations- und Homing-Studien erforderlich ist.
Neben der Optimierung der retroviralen Transduktion ermöglicht das Protokoll Langzeit-Homing-Studien mit CD45.1/CD45.2-Markern zur Unterscheidung zwischen GPCR-transduzierten und Kontrollzellen in kompetitiven Experimenten innerhalb desselben Wirts. Dieser Ansatz stellt sicher, dass die Zellen den gleichen physiologischen Hinweisen ausgesetzt sind. Die Einbeziehung des Thy1.1-Markers ist wertvoll für die Unterscheidung zwischen transduzierten und nicht transduzierten T-Zellen, insbesondere wenn keine spezifischen Antikörper für Orphan-GPCRs verfügbar sind. Eine Alternative, die für einige Anwendungen geeignet ist, wäre die Verwendung von fluoreszierendem Protein anstelle der Thy1.1-Kassette.
Für die Analyse von homedierten Zellen mittels FACS verwendet das Protokoll Anti-CD45-Antikörper, die 5 Minuten vor der Gewebeentnahme injiziert werden, um zwischen zirkulierenden und geweberesidenten Zellen zu unterscheiden und so eine Fehlinterpretation der Homing-Daten zu verhindern. Für die konfokale Mikroskopie wurden Anti-CD31-Antikörper 10-30 Minuten vor der Opferung injiziert, um Blutgefäße zu markieren, was eine präzise Visualisierung der T-Zell-Lokalisierung und die Unterscheidung zwischen Zellen, die an das vaskuläre Endothel gebunden sind, und extravasierten Zellen ermöglicht. Die Bildanalyse mit der Imaris-Software quantifiziert die Entfernung von Zellen zu histologischen Orientierungspunkten und liefert detaillierte Einblicke in ihre Lokalisierung und Wechselwirkungen in der Mikroumgebung.
Die Stärke dieses Protokolls liegt im direkten Vergleich des Verhaltens ansonsten identischer Zellen, die sich nur in der Expression des transduzierten Rezeptors unterscheiden. Während wir den konventionellen Begriff kompetitives Homing verwenden, um die Co-Injektion und das anschließende Homing von Kontroll- und Vergleichszellen zu beschreiben, räumen wir ein, dass dieser Begriff technisch gesehen eine falsche Bezeichnung ist. Bei Kurzzeit-Assays sind die Mechanismen der Geweberekrutierung wahrscheinlich im Übermaß, was einen tatsächlichen Wettbewerb zwischen den Zellpopulationen unwahrscheinlich macht. Ein genauerer Begriff wäre vergleichendes Homing oder intern gesteuertes Homing, da das Protokoll das Homing-Verhalten kontrolliert und vergleichend bewertet. Außerdem können physiologische Migration und Homing integrierte Beiträge mehrerer Chemolockstoffrezeptoren beinhalten, die gleichzeitig oder nacheinander wirken können, um die mehrstufige Migration der Zellen in den komplexen Feldern von Lockstoffen, die in vivo existieren, zu steuern 15. T-Zellen, die in vitro unter den von uns verwendeten Bedingungen aktiviert werden, exprimieren spontan CXCR3 und wahrscheinlich andere GPCRs, die durch Koordination mit dem transduzierten Rezeptor die endgültige Lokalisierung von Zellen beeinflussen können. Retrovirale Transduktion führt typischerweise zu einer Überexpression des Zielgens, und es muss berücksichtigt werden, dass das Niveau der Rezeptorexpression auch das Homing beeinflussen kann. Darüber hinaus könnte die Überexpression eines Rezeptors theoretisch die Zelleigenschaften unabhängig von Rezeptor-Liganden-Wechselwirkungen verändern. Um dies zu beheben, führten wir eine komplementäre Expression mit CXCL17-/- Mäusen durch, denen der Ligand für GPR25 fehlt. Dieser Ansatz trägt dazu bei, dass unsere beobachteten Effekte durch die Erkennung verwandter Liganden vermittelt werden. Forscher, die keinen Zugang zu spezifischen Knockout-Stämmen haben, könnten shRNA- oder CRISPR-Techniken einsetzen, um spezifische GPCRs in T-Zellen abzuschalten oder auszuschalten. Diese Anpassung könnte die Vielseitigkeit des Protokolls zur Untersuchung der GPCR-Funktion in T-Zellen weiter verbessern.
Die retrovirale Transduktion bietet zwar eine hohe Effizienz, erfordert aber aktiv sich teilende Zellen, die das Verhalten ruhender Zellen möglicherweise nicht genau widerspiegeln. Einige Chemokinrezeptoren zeigen eine unterschiedliche Aktivität, abhängig vom proliferativen Status der Zelle, obwohl ihre Spezifität unverändert bleibt. Eine alternative Methode, die Neon-Elektroporation, hat eine hohe Transfektionseffizienz in T-Zellen gezeigt, wenn auch nur vorübergehend16. Dies kann für Kurzzeit-Assays ausreichend sein, während MSCV eine stabile Expression liefern kann, wodurch es sowohl für Kurz- als auch für Langzeitstudien geeignet ist. Wir konnten jedoch keine Literatur finden, die darauf hinweist, dass dieses System für Homing-Studien verwendet wurde. Wenn die Transfektionseffizienz gering ist, müssen wir möglicherweise Zellen anhand eines sichtbaren Markers auswählen, z. B. der Co-Transfektion mit GFP.
Dieses Protokoll liefert eine statische Momentaufnahme des Zellhandels und schränkt die Einblicke in das zelluläre Verhalten und die Motilität in Echtzeit ein. Es weist auch inhärente Auflösungseinschränkungen auf, insbesondere bei der Beobachtung subzellulärer Strukturen und feinskaliger Gewebearchitekturen. Um diesen Herausforderungen zu begegnen, schlagen wir den Einsatz fortschrittlicher bildgebender Verfahren wie Multiphotonenmikroskopie, Lebendzell-Imaging und Intravitalmikroskopie vor. Diese Methoden bieten eine höhere räumliche Auflösung, eine tiefere Gewebepenetration und die Möglichkeit, zelluläre Prozesse dynamisch zu visualisieren. Insbesondere die Intravitalmikroskopie ermöglicht die Echtzeit-Verfolgung des Verhaltens von T-Zellen in vivo und ermöglicht die Beobachtung der Zellmigration, der Interaktionen und der Reaktionen auf Reize in ihrem nativen Kontext. Dieser Ansatz ist besonders leistungsfähig für die Beurteilung des T-Zell-Homings und der Gewebelokalisierung, da er zeigt, wie sich Zellen dynamisch an verschiedene Mikroumgebungen anpassen. Durch die Integration dieser fortschrittlichen Bildgebungsverfahren können zukünftige Studien ein umfassenderes Verständnis der T-Zell-Motilität, der Wechselwirkungen und des GPCR-vermittelten Homings erlangen und so die Einblicke in ihr Verhalten im Gewebe erheblich verbessern.
Das von uns bereitgestellte Protokoll wird bei der Untersuchung der GPCR-Funktionen beim Homing von Immunzellen helfen und hat breite Anwendungen in der Immuntherapie, Entzündung und Autoimmunität. Darüber hinaus bietet es neue Möglichkeiten zur Entdeckung therapeutischer Ziele und zur Verbesserung der Immunantwort, indem bisher nicht charakterisierte GPCRs in T-Zellen erforscht werden, die auf Krebs abzielen, und inadäquates T-Zell-Homing bei Autoimmunerkrankungen angegangen wird.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Unterstützt durch die NIH-Zuschüsse R01 AI178113 und R01 AI047822, Zuschuss 1903-03787 vom Leona M. & Harry B. Helmsley Charitable Trust und Zuschüsse des Tobacco-Related Disease Research Program (TRDRP) T31IP1880 und T33IR6609 an E.C.B.; Y.B. wurde durch einen Research Fellows Award der Crohn's and Colitis Foundation of America (835171) unterstützt. B.O. wurde durch ein Postdoktorandenstipendium der Ramon Areces Stiftung (Madrid, Spanien) und einen Research Fellows Award der Crohn's and Colitis Foundation of America (574148) unterstützt. AA wurde vom California Institute for Regenerative Medicine (CIRM) - EDUC2-12677 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| AF647 anti mouse CD90.1-Thy1.1 (OX-7) | Biolegend | 202507 | |
| anti-CD31 (DyLight 633, clone 390) | InvivoMab | BE0377 | |
| anti-mouse CD28 37.51 | eBiosciences | ||
| anti-mouse CD3 145-2c11 | eBiosciences | ||
| APCCy7 anti mouse CD3 (145-2c11) | Biolegend | 100329 | |
| BV421 anti mouse CD8b (Ly-3) | Biolegend | 126629 | |
| BV711 anti mouse CD4 (RM4-5) | Biolegend | 100549 | |
| CD90.1 microbeads | Miltenyi | 130-121-273 | |
| CFSE | Thermoscientific | C34554 | |
| FITC anti mouse CD45.2 (104) | BD | AB_395041 | |
| mouse IL2 | Peprotech | 200-02-50UG | |
| mouse IL7 | Peprotech | 217-17-10UG | |
| Mouse T CD4 isolation kit | STEMCELL technologies | 18000 | |
| MSCV-IRES- Thy1.1 GPR25 | Vectorbuilder | ||
| MSCV-IRES- Thy1.1 Stuffer | Vectorbuilder | ||
| PE-CD45 (30-F11) antibody | Biolegend | 103105 | |
| PECy7 anti mouse TCRb (H57-597) | Tonbo | ||
| PercpCy5.5 anti mouse CD45.1 (A20) | eBiosciences | ||
| Platinum-E (Plat-E) | cell Biolabs. Inc | RV-101 | |
| Yellow fluorescent dye | Thermoscientific |
Referenzen
- Cheng, L., et al. Structure, function and drug discovery of GPCR signaling. MolBiomed. 4 (1), 46 (2023).
- Lammermann, T., Kastenmuller, W. Concepts of GPCR-controlled navigation in the immune system. Immunol Rev. 289 (1), 205-231 (2019).
- Fu, H., Ward, E. J., Marelli-Berg, F. M. Mechanisms of t cell organotropism. Cell Mol Life Sci. 73 (16), 3009-3033 (2016).
- Cinalli, R. M., et al. T cell homeostasis requires g protein-coupled receptor-mediated access to trophic signals that promote growth and inhibit chemotaxis. Eur J Immunol. 35 (3), 786-795 (2005).
- Wu, V., et al. Illuminating the onco-GPCRome: Novel g protein-coupled receptor-driven oncocrine networks and targets for cancer immunotherapy. J Biol Chem. 294 (29), 11062-11086 (2019).
- Wu, V. H., et al. The GPCR-alpha(s)-pka signaling axis promotes T-cell dysfunction and cancer immunotherapy failure. Nat Immunol. 24 (8), 1318-1330 (2023).
- Ramezani, A., Hawley, T. S., Hawley, R. G. Stable gammaretroviral vector expression during embryonic stem cell-derived in vitro hematopoietic development. Mol Ther. 14 (2), 245-254 (2006).
- . . Plat-E retroviral packaging cells (RV-101) user manual. , (2024).
- Anderson, J., Hope, T. Intracellular trafficking of retroviral vectors: obstacles and advances. Gene Ther. 12, 1667-1678 (2005).
- Kim, E., et al. Isolation and analyses of lamina propria lymphocytes from mouse intestines. STAR Protoc. 3 (2), 101366 (2022).
- Steinert, E. M., et al. Quantifying Memory CD8 T Cells Reveals Regionalization of Immunosurveillance. Cell. 161 (4), 737-749 (2015).
- Miltenyi Biotec. . CD90.1 MicroBeads mouse and rat. , (2024).
- Ocón, B., et al. A lymphocyte chemoaffinity axis for lung, non-intestinal mucosae and CNS. Nature. 635, 736-745 (2024).
- Sumida, H., et al. Gpr55 regulates intraepithelial lymphocyte migration dynamics and susceptibility to intestinal damage. Sci Immunol. 2 (18), eaao1135 (2017).
- Foxman, E. F., Campbell, J. J., Butcher, E. C. Multistep navigation and the combinatorial control of leukocyte chemotaxis. J. Cell Biol. 139 (5), 1349-1360 (1997).
- Alawar, N., et al. A solution for highly efficient electroporation of primary cytotoxic T lymphocytes. BMC Biotechnol. 24 (1), 16 (2024).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten