Method Article
نقل فعال للفيروسات القهقرية والتوجيه التنافسي للتحقيق في توطين الخلايا التائية بوساطة GPCR في البيئات الدقيقة المتنوعة للأنسجة
In This Article
Summary
نقدم بروتوكولات محسنة لنقل الفيروسات القهقرية لمستقبلات الاتجار والتوجيه التنافسي لدراسة وضع الخلايا الليمفاوية الخاصة بالأعضاء والبيئة المكروية بوساطة المستقبلات. تقدم هذه الطريقة رؤى قيمة حول آليات الاتجار بالخلايا المناعية ولها تطبيقات محتملة في البحوث الأساسية والعلاجية المستقبلية.
Abstract
يعد فهم كيفية تأثير تعبير المستقبلات المقترنة ببروتين G (GPCR) على وضع الخلية داخل البيئات الدقيقة المتنوعة للأنسجة أمرا ضروريا لتوضيح آليات تهريب الخلايا المناعية. نقدم مقايسة موجهة تنافسية مصممة لدراسة توطين الخلايا التائية بوساطة GPCR للأعضاء التي تعبر عن روابط الجذب الكيميائي المماثلة ، والتي تنطبق على كل من الدراسات قصيرة وطويلة المدى. يتضمن النهج بروتوكولا محسنا لنقل فيروس الخلايا الجذعية المؤتلف للفئران (MSCV) للخلايا التائية للتعبير عن GPCR ذي الأهمية أو بنية التحكم ، متبوعا بتوجيه تنافسي في الفئران المتلقية. يتم تحليل توزيع الخلايا عبر الأعضاء المختلفة باستخدام قياس التدفق الخلوي و / أو الفحص المجهري متحد البؤر. في تجارب قصيرة المدى (10-12 ساعة) ، كشف الفحص المجهري متحد البؤر عن أنماط توطين الخلايا المميزة ، بما في ذلك الحويصلات الهوائية ، وتحت المخاطية للقصبات الهوائية ، والمواقع الوريدية ، والخلال في الرئة ، بالإضافة إلى الظهارة المبطنة للقصبة الهوائية والمعدة وقرن الرحم. في الدراسات طويلة المدى (1-7 أسابيع) ، قدم قياس التدفق الخلوي رؤى حول تراكم الخلايا التفضيلي ، وكشف عن التغيرات الديناميكية والنضج المحتمل أو إعادة التموضع داخل الأنسجة بمرور الوقت. يعد اختبار التوجيه التنافسي هذا أداة قوية لدراسة تحديد المواقع الخلوية بوساطة GPCR ، مما يوفر رؤى قيمة حول التوزيع الخاص بالأنسجة والتطبيقات المحتملة في علم المناعة والبحوث العلاجية.
Introduction
تعتبر المستقبلات المقترنة ببروتين G (GPCRs) أساسية في تنظيم مجموعة متنوعة من العمليات الخلوية ، بما في ذلك نقل الإشارات ، والنقل العصبي ، وتنظيم الهرمونات ، وهجرة الخلايا المناعية1. يلعبون دورا مهما في التحكم الزماني المكاني لهجرة الخلايا الليمفاويةوتوطينها 2. خلال مرحلة التحضير للاستجابات المناعية ، تدفع البيئة المكروية المحلية والتفاعلات الخلوية الخلايا الليمفاوية التائية للتعبير عن مجموعة فريدة من جزيئات الالتصاق ومستقبلات الكيموكينات المعروفة باسم مستقبلات الموجهة. يمكن هذا التكيف الخلايا التائية ذات الخبرة في المستضد من الانخراط مع الخلايا البطانية الخاصة بالأعضاء (ECs) والهجرة إلى الأنسجة المستهدفة المتميزة. تعد قدرة الخلايا التائية على اكتساب استحاء الأنسجة أمرا حيويا لاستجابات الاستدعاء الفعالة ، لا سيما في سياق الالتهابات المتكررة التي تؤثر على نفس العضو3،4.
توجه GPCRs الخلايا المناعية إلى أنسجة وأعضاء معينة حيث تؤدي وظائف حاسمة - مثل توجيه خلايا CD8 + T و NK إلى مواقع الورم للعمل السامة للخلايا أو مساعدة خلايا CD4 + T في تنسيق الاستجابات المناعية من خلال دعم تنشيط الخلايا المناعية الأخرى. يعد فهم كيفية توجيه GPCRs للخلايا التائية إلى مواقعها الدقيقة أمرا ضروريا لتطوير العلاجات المناعية المستهدفة5،6. ومع ذلك ، يكمن التحدي في نمذجة هذه التفاعلات المعقدة في المختبر ، حيث يصعب تكرار كل من الإشارات المقيدة مكانيا والإشارات الكيميائية الاتجاهية في وقت واحد.
غالبا ما يكون توضيح أدوار مستقبلات الكريات البيض المحددة أمرا صعبا أيضا نظرا لتكرارها المحدود للتعبير في التجمعات الذاتية وحقيقة أن هذه المستقبلات تزين عادة أنواعا مميزة من الخلايا. يجعل هذا التعقيد من الصعب عزل دور مستقبلات معينة عن الآليات الأخرى الخاصة بالمجموعة الفرعية للخلية. من الناحية المثالية ، يجب أن تقارن الطرق بين مجموعات سكانية متشابهة ، تختلف فقط في المستقبل ذي الأهمية لتوفير رؤى واضحة.
للتغلب على هذه التحديات ، اعتمدنا مقايسة موجهة تنافسية تستخدم نقل الفيروسات القهقرية المؤتلف MSCV للتعبير الفعال عن GPCR في الخلايا التائية. تتضمن نواقل الفيروسات القهقرية MSCV ، التي تجمع بين عناصر من ناقلات MESV القائمة على فيروس الساركوما النخاعية التكاثرية (PCMV) ونواقل LN القائمة على فيروس سرطان الدم الفئران مولوني (MMLV) ، إشارة تغليف هجينة ممتدة مشتقة من نواقل LN7. يعزز هذا التعديل كفاءة توصيل الجينات ، مما يتيح إجراء دراسات قصيرة وطويلة الأجل لتوطين الخلايا التائية في الجسم الحي. من خلال استخدام جزيئات الفيروسات القهقرية عالية العيار والفحص المجهري متحد البؤر ، يسمح النهج بالتصور الدقيق لتحديد موقع الخلايا التائية والتفاعلات داخل بيئات الأنسجة المعقدة. نقدم بروتوكولات مفصلة لنقل الفيروسات القهقرية لمستقبلات الاتجار وأداء فحوصات التوجيه التي يتم التحكم فيها داخليا (ما يسمى بالتنافسية) لدراسة وضع الخلايا الليمفاوية الخاصة بالأعضاء والبيئة المكروية بوساطة المستقبلات. الهدف العام من هذه الطريقة هو توفير رؤى قيمة حول آليات الاتجار بالخلايا المناعية وتمكين التطبيقات المستقبلية في كل من البحث الأساسي والتطوير العلاجي.
Protocol
تم الاحتفاظ بجميع الفئران في هذه الدراسة في مرافق محددة خالية من مسببات الأمراض (SPF) في نظام الرعاية الصحية لشؤون المحاربين القدامى بالو ألتو (VAPAHCS). تم شراء الفئران B6 / SJL Prc Pep3BoyJ (CD45.1) و C57B6 / J (CD45.2) و Rag1 - / - من مختبرات جاكسون. بينما استخدمنا PepBoy للحصول على خلايا CD45.1 ، نوصي باستخدام JAXBoy (C57BL / 6J-Ptprcem6Lutzy / J). JAXBoy عبارة عن سلالة متشابكة بالكامل يتم إنشاؤها من خلال CRISPR بدلا من التهجين الخلفي التقليدي ، مما يحسن الاتساق الجيني. تاريخيا ، تضمنت دراسات CD45 التي تحمل علامة النمط الخيفي باستخدام فئران PepBoy (CD45.1) ، والتي ليست مولدة تماما ، فحوصات التحكم في توجيه التوجيه وإعادة التدوير مع مقارنات النوع البري (WT / WT) لمعالجة التباين المحتمل. مع توفر فئران JAXBoy الآن كبديل متساوي الجين بالكامل ، قد لا تكون هذه الضوابط الإضافية ضرورية. لا يزال يتعين على الباحثين التفكير في أن الاختلافات بين متغيرات CD45.1 و CD45.2 - مثل أدوارها كبروتين التيروزين فوسفاتيز - يمكن أن تؤثر على السلوك الخلوي وأنماط التوجيه. تمت الموافقة على جميع البروتوكولات التي تمت مناقشتها في النص وأدناه أو تفي بإرشادات قسم طب المختبر المعتمد واللجنة الإدارية للرعاية بحيوانات المختبر في نظام الرعاية الصحية VA Palo Alto (VAPAHCS). تم التضحية بالحيوانات باستخدام الإجراءات المعتمدة. تم تضمين الفئران من كلا الجنسين ، التي تتراوح أعمارها بين 8 و 12 أسبوعا ، في التجارب.
1. إعداد ناقلات MSCV
- شراء ناقل الفيروس القهقري MSCV-IRES-Thy1.1 مع منطقة ترميز جين الفأر محل الاهتمام (GOI) أو ORF_Stuffer (تحكم سلبي في ORF)
ملاحظة: يتضمن هذا البناء علامة السطح Thy1.1 جنبا إلى جنب مع جين GPCR المعني. يسمح رابط موقع دخول الريبوسوم الداخلي (IRES) بالتعبير المشترك ل GPCR مع Thy1.1 ، مما يسهل تحديد الخلايا المنقولة عن طريق قياس التدفق الخلوي أو التنقية والعزل بواسطة الخرز المغناطيسي. يكون هذا مفيدا بشكل خاص عندما تكون الأجسام المضادة الخاصة ب GPCR غير متوفرة ، كما هو الحال غالبا مع GPCRs التي لم تتم دراستها بشكل جيد. - قم بشراء بلازميد MSCV في شكل بكتيري ومزرعة عن طريق تلقيح مرق Luria-Bertani (LB) المكمل باختيار المضادات الحيوية المناسبة بناء على جين المقاومة المشفر بواسطة البلازميد (على سبيل المثال ، الأمبيسلين أو الكاناميسين أو الكلورامفينيكول). يتكون وسط LB من التربتون (10 جم / لتر) ، ومستخلص الخميرة (5 جم / لتر) ، وكلوريد الصوديوم (10 جم / لتر) ، معدلة إلى درجة الحموضة 7.0 وتعقيمها عن طريق التعقيم. احتضان المزرعة عند 37 درجة مئوية في حاضنة اهتزاز (220 دورة في الدقيقة) طوال الليل.
- قم بإعداد مخزون البلازميد باستخدام تقنيات البيولوجيا الجزيئية القياسية باستخدام مجموعة تحضير الحمض النووي.
- بعد عزل الحمض النووي ، قم بقياس تركيز الحمض النووي باستخدام مقياس الطيف الضوئي وقم بإعداد محاليل البلازميد العاملة بتركيز 1 ميكروغرام / ميكرولتر ، قم بتخزين البلازميدات عند -20 درجة مئوية للاستخدام في المستقبل.
2. إنشاء ثقافة خط خلايا التعبئة والتغليف
ملاحظة: استخدمنا خلايا Platinum E (Plat-E) من Cell Biolabs. خلايا Plat-E عبارة عن خط خلوي قائم على 293T مع محفز EF1α ، والذي يوفر تعبيرا مستقرا وعالي الغلة للبروتينات الهيكلية الفيروسية القهقرية (جينات gag و pol و env) ، مما يتيح التعبئة والتغليف الفيروسي القهقري مع تعداء بلازميد واحد8. على الرغم من أنه يمكن استخدام خطوط خلايا أخرى ، مثل NIH-3T3 أو 293T ، إلا أننا لم نختبر هذه البدائل.
- قم بإعداد وسائط خلية Plat-E عن طريق إضافة DMEM و 10٪ FBS و 1٪ Penicillin / Streptomycin و Blasticidin (10 ميكروغرام / مل) و Puromycin (1 ميكروغرام / مل). استخدم بلاستيسيدين وبورومايسين لصيانة الخلايا ولكن حذفهما أثناء وبعد التعافي
- يتم شحن خلايا Plat-E المجمدة في 1.0 مل ، بمعدل >3 × 106 خلايا / مل في DMEM ، و 20٪ FBS ، و 10٪ DMSO. قم بإذابة الثلج بسرعة في حمام مائي 37 درجة مئوية. انقل جميع الخلايا المذابة إلى أنبوب مخروطي سعة 15 مل يحتوي على وسط ثقافة Plat-E.
- جهاز طرد مركزي عند 450 × جم لمدة 5 دقائق عند 4 درجات مئوية. أعد تعليق حبيبات الخلية في 1 مل من وسط Plat-E عن طريق سحب العينة برفق لإنشاء تعليق أحادي الخلية.
- أضف 9 مل من وسط Plat-E إلى طبق ثقافة مقاس 10 سم ، ثم انقل 1 مل من الخلايا المعلقة إلى الطبق. تأكد من أن الخلايا المذابة قابلة للحياة عن طريق خلط حجم متساو من تعليق الخلية و Trypan Blue وحساب الخلايا القابلة للحياة (غير الملطخة) والميتة (الملطخة باللون الأزرق) باستخدام مقياس كثافة الدم أو عداد الخلايا ، بهدف >70٪ من الجدوى.
- احتضان الخلايا عند 37 درجة مئوية في حاضنة رطبة مع 5٪ ثاني أكسيد الكربون2. لا تغير الوسيط لأول 3 أيام. من الطبيعي ملاحظة الخلايا العائمة والميتة عند الذوبان الأول.
- عندما تصل الخلايا إلى 85٪ -90٪ من التقاء ، اغسل باستخدام DMEM / PBS Ca- / Mg-. افصل الخلايا باستخدام 2 مل من 0.05٪ تريبسين / 0.5 ملي EDTA واحتضانها لمدة 3 دقائق عند 37 درجة مئوية. أضف 8 مل من وسط Plat-E ، واجمع الخلايا في أنبوب مخروطي سعة 15 مل ، وجهاز طرد مركزي عند 450 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- انقسم بنسبة سطح 1:10 أو 1: 5 (أي أطباق جديدة بذرة مع 1/10 أو 1/5 من الحجم الكلي من الطبق الأصلي). أعد التعليق في حجم نهائي قدره 10 مل من وسط Plat-E واحتضانه عند 37 درجة مئوية في حاضنة رطبة بنسبة 5٪ ثاني أكسيد الكربون2.
- قم بتقسيم باقي الخلايا في 1 مل من FBS مع 10٪ DMSO وتجميدها عند -80 درجة مئوية ثم في النيتروجين السائل للاستخدام طويل الأمد.
ملاحظة: عالج الخلايا كما هو موضح أعلاه عندما تكون قريبة من 85٪. للحفاظ على صحة الخلايا المثلى ، تجنب الإفراط في التقاء واستهدف الانقسامات لمدة 3 أيام مع التخفيف بنسبة 1:10. إذا تباطأ النمو ، فاستخدم حصة جديدة. عادة ما ينخفض أداء الخلية مع المقاطع اللاحقة. نوصي باستخدام الخلايا للتعداء بين الممرات 4 و 15 للحصول على أفضل النتائج.
3. إنتاج الخلايا المنقولة
- اليوم 1: خلايا Seed Plat E
ملاحظة: احسب عدد خلايا وألواح Plat E المطلوبة. استخدمنا 1 مل من المادة الطافية الفيروسية لكل بئر في صفيحة مكونة من 24 بئرا لنقل الخلايا 2x. نستخدم عادة ما يقرب من لوحين من أطباق بتري مقاس 10 سم مع خلايا Plate-E لكل صفيحة 24 بئرا مع خلايا T في المزرعة.- ابدأ بطلاء ألواح زراعة الأنسجة مقاس 10 سم ب 5 مل من 50 ميكروغرام / مل بولي دي ليسين في ماء معقم. احتضن في درجة حرارة الغرفة لمدة 45 دقيقة. اغسل 2x باستخدام PBS Ca- / Mg المعقم - لضمان عدم وجود بقايا.
ملاحظة: نوصي بطلاء الألواح لأن خلايا Plat-E تميل إلى الانفصال بعد التعدي ، مما يؤدي إلى ضعف أداء الخلايا وتقليل إنتاج العيار الفيروسي. - افصل خلايا Plat-E كما هو موضح أعلاه في الخطوة 2.6 وقم بإجراء اختبار استبعاد الtrypan blue لضمان الجدوى. امزج حجما متساويا من تعليق الخلية و Trypan Blue. عد الخلايا القابلة للحياة (غير الملطخة) والميتة (الملطخة باللون الأزرق) باستخدام مقياس الدم / عداد الخلايا. بذور 3 × 10 خلايا حية في طبق بتري لزراعة الأنسجة مقاس 10 سم مع وسط Plat-E خال من المضادات الحيوية.
ملاحظة: يجب أن تصل التقاء الألواح المصنفة إلى 85٪ -90٪ في اليوم التالي. إذا لم يتحقق ذلك ، ففكر في استخدام حصة خلية مختلفة. اضبط كثافة البذر بناء على توقيت الطلاء ؛ للطلاء المسائي ، يمكن استخدام 3.5 × 106 خلايا.
- ابدأ بطلاء ألواح زراعة الأنسجة مقاس 10 سم ب 5 مل من 50 ميكروغرام / مل بولي دي ليسين في ماء معقم. احتضن في درجة حرارة الغرفة لمدة 45 دقيقة. اغسل 2x باستخدام PBS Ca- / Mg المعقم - لضمان عدم وجود بقايا.
- اليوم 2: تعداء خلايا Plat-E وألواح الطلاء للخلايا التائية مع الأجسام المضادة ل CD3 ومضادة ل CD28
- استبدل الوسط الموجود في مزارع خلايا Plat-E ب 6.5 مل من وسائط المصل المختزلة.
- تحضير مزيج التعدي وفقا لتعليمات الشركة المصنعة لكاشف الليبوفيكتامين (تم استخدام ليبوفيكتامين 2000 في هذه الدراسة).
- لكل طبق ، امزج 45 ميكرولتر من ليبوفيكتامين 2000 مع 210 ميكرولتر من وسط المصل المختزل في أنبوب واحد ، و 15 ميكروغرام من الحمض النووي مع 235 ميكرولتر من وسط المصل المختزل في أنبوب آخر. اجمع محتويات الأنابيب عن طريق سحب العينات 3x-4x.
- احتضان الخليط لمدة 5-20 دقيقة في درجة حرارة الغرفة للسماح بتكوين مجمعات الليبوفيكتامين / الحمض النووي ، ثم أضفه بالتنقيط إلى الألواح. احتضان الألواح لمدة 16 ساعة عند 37 درجة مئوية.
- آبار تنشيط الخلايا التائية: قم بتغطية 24 لوحا جيدا ب 5 ميكروغرام / مل من CD28 المضاد للفأر (37.51) و 10 ميكروغرام / مل من CD3 المضاد للفأر (145-2c11) في 375 ميكرولتر / بئر PBS بين عشية وضحاها عند 4 درجات مئوية أو لمدة 3-4 ساعات في الحاضنة عند 37 درجة مئوية في اليوم 3.
ملاحظة: لف الألواح بغشاء شفاف في حالة الحضانة طوال الليل لمنع التبخر. يمكن استخدام منشط الماوس CD3 / CD28 من Dynabeads كبديل بنتائج مماثلة.
- اليوم 3: تغيير وسائط Plat-E وعزل الخلايا التائية وتنشيطها
- قم بتغيير وسائط الإرسال Plat-E إلى 14 مل من وسط DMEM الكامل في الصباح. تحضير وسائط الخلايا التائية عن طريق إضافة RPMI-10: RPMI 1640 مع L-glutamine ، و 10٪ FBS ، و 1٪ بنسلين / ستربتومايسين ، و 1x MEM من الأحماض الأمينية غير الأساسية ، و 1 ملي مولار بيروفات الصوديوم ، و 50 ميكرومتر β-ميركابتو إيثانول ، و 1 ملي مولار هيبس.
- القتل الرحيم للفئران JAXBoy (CD45.1) و C57B6 / J (CD45.2) باستخدام استنشاق ثاني أكسيد الكربون2متبوعا بخلع عنق الرحم. عزل الطحال والغدد الليمفاوية في ظروف معقمة.
- اهرسي الطحال برفق على مصفاة خلية شبكية من النايلون 100 ميكرومتر مع وسط RPMI في صفيحة 6 آبار باستخدام مكبس حقنة.
- انقل المحلول من خلال مصفاة خلية شبكية من النايلون 40 ميكرومتر لتعليق أحادي الخلية إلى أنبوب مخروطي سعة 50 مل. جهاز طرد مركزي عند 450 × جم لمدة 5 دقائق عند 4 درجات مئوية واغسلها باستخدام PBS Ca- / Mg-.
- قم بإجراء التحديد المغناطيسي السلبي باستخدام مجموعة عزل Mouse T / T CD4 باتباع تعليمات الشركة المصنعة ، أو بدلا من ذلك ، قم بفرز الخلايا باستخدام FACS المعقم
- عد الخلايا التائية باستخدام عداد الخلايا وقم بوضعها في آبار تنشيط الخلايا التائية عند 1-1.5 × 106 لكل بئر في 1 مل من وسط RPMI-10 لكل بئر. احتضان الخلايا عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون في حاضنة مرطبة. اترك 24-48 ساعة للتنشيط المناسب ، كما تم تقييمه تحت المجهر ، كما هو موضح في الملاحظات أدناه.
ملاحظة: يعمل الربط المتبادل بين CD3 و CD28 على تنشيط الخلايا التائية في هذا الإعداد بشكل فعال. ينتج طحال فأر واحد عادة ما يقرب من 1 × 108 خلايا طحال. تشكل خلايا CD4 + T بشكل عام حوالي 10٪ من إجمالي خلايا الطحال. لذلك ، لتحضير صفيحة مكونة من 24 بئرا تحتوي على 1-1.5 × 106 خلايا CD4 + T لكل بئر ، تشير التقديرات إلى أن الخلايا من 2-3 فئران ستكون كافية.
- اليوم 4: التنبيغ
- افحص الخلايا التائية بعد 24 ساعة تحت المجهر. تأكد من أن الخلايا التائية في حالة تفجير (تشكل مجموعات وتظهر متضخمة بسبب التنشيط) قبل التنبيغ. يضمن تفجير الخلايا التائية أنها في حالة انقسام ، وهو أمر بالغ الأهمية لنقل MSCV9.
- اجمع ~ 10 مل من المادة الطافية الفيروسية من الألواح 10 سم في أنبوب مخروطي الشكل. استبدل ألواح استزراع Plat-E ب 10 مل أخرى من وسط Plat-E بدون مضادات حيوية لضمان وسائط كافية لتوليد المزيد من الوسائط لنقل ثان في اليوم التالي. اضبط حجم الوسائط في ألواح PLAT-E بناء على عدد آبار الخلايا التائية التي تحتاج إلى نقلها في اليوم التالي.
ملاحظة: يؤدي تحويل 2x إلى تحسين الكفاءة بشكل كبير. - قم بتصفية المادة الطافية الفيروسية عن طريق المرور عبر مرشح حقنة 0.45 ميكرومتر. أضف 8 ميكروغرام / مل من البوليبرين و 1: 100 HEPES.
- قم بتدوير صفيحة الخلية التائية المكونة من 24 بئرا لمدة 7 دقائق عند 950 × جم. اجمع المادة الطافية وحفظها بعناية دون إزاحة الخلايا. يحتوي هذا المادة الطافية على السيتوكينات وعوامل أخرى تفرزها الخلايا التائية بعد التنشيط ويتم استبدالها بهذا المادة الطافية بعد التلوث للحفاظ على ملف تعريف السيتوكين والعوامل لدعم تكاثر الخلايا التائية ونموها.
- قم بإجراء التنقية عن طريق إضافة 1 مل من المادة الطافية الفيروسية إلى كل بئر والدوران عند 1,150 × جم لمدة 4 ساعات عند 32 درجة مئوية. أغلق الألواح بغلاف بلاستيكي أثناء التعثر.
- بعد التجحيم ، استبدل الوسائط بعناية بمادة طافية للخلايا التائية المحفوظة مسبقا.
- اليوم 5: تكرار التنبيغ
- كرر التعداء كما هو موضح في اليوم 4. اختياريا، قم بمزج المادة الطافية المحفوظة في الخطوة 3.4.3 من الخلايا التائية التي تم تنشيطها في البداية مع وسائط جديدة بنسبة 1:1 إذا بدت الوسائط مستنفدة.
- اليوم 6: غسل الخلايا وتوسيع
- اغسل الخلايا باستخدام PBS Ca + / Mg +. ونقلها إلى لوحة ثقافة جديدة مع 130 وحدة / مل من الماوس IL2 و 10 نانوغرام / مل من الماوس IL7. احتضان الخلايا لمدة يومين على الأقل أو حتى تصل إلى مستوى التمدد المطلوب ، بناء على عدد الخلايا اللازمة للحقن.
- يوم 8: الحصاد والتنقية
- حصاد الخلايا وتنقيتها بتدرج كثافة Histopaque 1.077.
ملاحظة: تساعد هذه التقنية في عزل الخلايا القابلة للحياة (مثل الخلايا الليمفاوية أو الخلايا المناعية الأخرى) من الخلايا الميتة أو الحطام. ستستقر الخلايا الميتة ، ذات الكثافة العالية ، في قاع الأنبوب ، بينما تبقى الخلايا القابلة للحياة عادة في طبقة الواجهة. - أضف 5 مل من Histopaque 1.077 إلى أنبوب 15 مل. حصاد الخلايا عن طريق الطرد المركزي عند 450 × جم لمدة 5 دقائق عند 4 درجات مئوية لحبيبات الخلايا.
- أعد تعليق حبيبات الخلية في 5 مل من PBS Ca +/Mg +. ضع طبقة من تعليق الخلية بعناية فوق 5 مل من Histopaque 1.077 في أنبوب الطرد المركزي.
- جهاز طرد مركزي عند 400-500 × جم لمدة 20 دقيقة في درجة حرارة الغرفة ، مما يضمن ضبط كسر / تسارع جهاز الطرد المركزي على الصفر.
- بعد الطرد المركزي ، ستنفصل الخلايا إلى طبقات مميزة بناء على الكثافة. عادة ما تكون الخلايا المرغوبة في طبقة الواجهة بين الهيستوباك والوسط العلوي ، بينما تستقر الخلايا الميتة في الأسفل. اجمع طبقة الخلية بعناية في طبقة الواجهة باستخدام ماصة ، وتجنب التلوث بالطبقات الأخرى. الخلايا التي تم جمعها جاهزة ونظيفة الآن للحقن.
- قم بتقييم كفاءة التنبيغ من خلال إجراء تحليل تلطيخ Thy1.1 وقياس التدفق الخلوي. انظر استراتيجية البوابات في الشكل 1.
ملاحظة: بعد التنبيغ ، يمكن استخدام الخلايا في فحوصات الانجذاب الكيميائي لتقييم هجرتها نحو كيموكينات معينة مقارنة بالخلايا الناقلة للتحكم لتأكيد نشاطها وظيفيا في المختبر قبل متابعة الحقن.
- حصاد الخلايا وتنقيتها بتدرج كثافة Histopaque 1.077.
- مقايسة التوطين في الجسم الحي على المدى الطويل
- للموجه على المدى الطويل ، استخدم CD45.1 للماوس GPCR ذي الأهمية و CD45.2 للخلايا المتجهة الفارغة (أو العكس). امزج مجموعتي الخلية بنسبة 1: 1.
- حقن 20-30 × 10 6خلايا إجمالية لكل فأر متلقي Rag1 - / - بالغ لمدة أسبوع واحد من الانتحاء و 5 × 106 لمدة 7 أسابيع. نحن نستخدم متلقي Rag1 - / - الذين يعانون من نقص الخلايا الليمفاوية لتقليل المنافسة مع الخلايا التائية الذاتية.
- بعد 1 إلى 7 أسابيع (حسب الدراسة) ، قم بحقن الأجسام المضادة ل CD45 عن طريق الوريد (IV) في الفئران قبل 5 دقائق من الحصاد لتسمية الخلايا المنقولة بالدم.
- قتل الفئران باستخدام استنشاق ثاني أكسيد الكربون2 متبوعا بخلع عنق الرحم.
ملاحظة: تم إجراء دراسات لمدة أسبوع واحد و 7 أسابيع. قد تكون الدراسات الأطول ممكنة ولكن لم يتم اختبارها بعد. - حصاد الخلايا من مختلف الأجهزة ذات الأهمية والضوابط. هضم الأنسجة وفقا لبروتوكولات تحضير الخلايا الليمفاوية القياسية لكل عضو10،11.
- تلطيخ الخلايا المجمعة بالأجسام المضادة وحيدة النسيلة (mAbs) لتحليل التدفق الخلوي.
- توجيه تنافسي قصير المدى: تحديد المواقع والتصوير للخلايا التائية
- نوصي باستخدام الفئران C57B6 / J كمتبرعين ، نظرا لأننا سنقوم بوضع علامات على الخلايا بالفلورسنت. ومع ذلك ، بالنسبة لمقايسات التوجيه القصيرة جدا التي تصل إلى بضع ساعات ، يمكن استخدام أي سلالة.
- في اليوم الثامن من الثقافة ، قم بعزل الخلايا المنقولة مغناطيسيا (Thy1.1+) باستخدام ميكروبيدات CD90.1 ، وفقا لتعليمات الشركة المصنعة12.
- الحفاظ على الخلايا المنقولة فقط (نقاء >95٪) في الثقافة بعد هذه النقطة لمدة يومين تحت IL2 و IL7 كما هو موضح أعلاه والسماح بالتوسع. الميكروبيدات قابلة للتحلل البيولوجي وبعد 48 ساعة لن تضعف وظيفة الخلية الطبيعية.
- في اليوم 11 ، قم بتسمية الخلايا التي تعبر عن GPCR ذات الأهمية باستخدام إستر Carboxyfluorescein succinimidyl (CFSE هي صبغة تلطيخ الخلايا الفلورية). بالنسبة لخلايا Stuffer ، استخدم صبغة فلورية صفراء ، أو العكس. يمكنك استخدام أصباغ بديلة إذا كنت تفضل ذلك.
- تحضير معلق خلوي بتركيز 1 × 106 خلايا / مل في RPMI مع 2٪ FBS. احتضان الخلايا بالصبغة بتركيز نهائي قدره 5 ميكرومتر عند 37 درجة مئوية في حمام مائي مع تحريض لطيف لمدة 20 دقيقة. لضمان نتائج قابلة للمقارنة ، قم بتبديل تعيينات الصبغة في تجارب منفصلة. بدلا من ذلك ، استخدم صبغة واحدة لتسمية نوع خلية مشترك كمعيار داخلي ، بما في ذلك الخلايا التجريبية وخلايا التحكم في متلقين مختلفين.
- اغسل الخلايا الملصقة واخلطها بنسبة 1: 1. تقدير تركيز الخلية باستخدام عداد الخلايا. حقن 15-30 × 106 خلايا عن طريق الوريد في الفئران المتلقية (WT أو الفئران المتلقية المعدلة وراثيا ، اعتمادا على الغرض من التجربة).
- بعد حوالي 10-12 ساعة ، قم بحقن الفئران بجسم مضاد مضاد ل CD31 (على سبيل المثال ، DyLight 633 المسمى ، استنساخ 390) ، والذي يجب أن يكون قبل 10-15 دقيقة من التضحية لتحديد الأوعية الدموية والتمييز بين الخلايا داخل الأوعية الدموية والخلايا المكتسبة.
- قتل الفئران باستخدام استنشاق ثاني أكسيد الكربون2 متبوعا بخلع عنق الرحم. تحليل توطين الخلية بواسطة FACS لمعلقات الخلايا كما هو موضح في الخطوة 3.8 أعلاه أو عن طريق تصوير حوامل الأنسجة الكاملة كما في الخطوة 3.9.8 أو الخطوة 3.9.7 للأعضاء ذات الأهمية باستخدام الفحص المجهري متحد البؤر.
- بالنسبة للأعضاء الرقيقة مثل القصبة الهوائية أو قرن الرحم أو الغدد الليمفاوية ، قم بإعداد حوامل الاسكواش. ضع المنديل على شريحة بشريط لاصق على الوجهين على الجانبين ، وأضف بضع قطرات من محلول التثبيت Fluoromount-G ، وقم بتغطيته بقلة غطاء ، واضغط برفق وبشكل متساو لتثبيت الغطاء على الشريط باستخدام شريحة منفصلة أو جسم مسطح آخر.
- بالنسبة للأقسام المجمدة ، قم بتضمين الأنسجة في مركب درجة حرارة القطع المثلى (OCT). بالنسبة للرئتين ، قم بتقطيع 50٪ OCT / PBS قبل التضمين.
- استخدم قياس التدفق الخلوي لأعضاء التحكم مثل العقدة الليمفاوية الطرفية (PLN) أو الطحال أو الدم لتقييم كفاءة التنبيغ (٪ Thy1.1+) كما هو موضح في الشكل 1 وتطبيع النتائج. تصور PLN باستخدام حوامل أو أقسام الاسكواش باستخدام الفحص المجهري متحد البؤر. عد الخلايا باستخدام الفحص المجهري متحد البؤر باستخدام برنامج Imaris.
- تحديد نسبة الخلايا المنقولة GPCR إلى خلايا التحكم (المحولة Stuffer) إما في أعضاء كاملة أو مقصورات أعضاء معينة. التطبيع إلى نسب المدخلات التي يحددها FACS و / أو إلى النسبة المستردة من أجهزة التحكم حيث يعرف GPCR أو يفترض أنه غير ذي صلة.
- لتحليل التوطين البيئي الجزئي في الرئتين ، قم بقياس مسافة الخلايا إلى المعالم النسيجية (على سبيل المثال ، الأغشية القاعدية أو الأوردة القصبية القصبية) باستخدام برنامج Imaris.
النتائج
في هذه الدراسة ، نقدم بروتوكولا مفصلا للتحقيق في قدرة مستقبلات معينة على توجيه توطين الخلايا التائية في الجسم الحي. كدليل على هذا البروتوكول ، استخدمنا GPR2513. نحن قادرون على تحقيق كفاءة نقل بنسبة 30٪ -40٪ باستخدام هذا البروتوكول ، كما تم تقييمه بواسطة تلطيخ Thy1.1 بواسطة قياس التدفق الخلوي. أجرينا فحوصات الانجذاب الكيميائي المستندة إلى الويل في المختبر باستخدام الخلايا المحولة GPR25 جنبا إلى جنب مع أدوات التحكم في الحشو ، واختبار هجرتها نحو hCXCL17 و mCXCL17 و CXCL12 كتحكم إيجابي. هاجرت الخلايا التائية المحولة GPR25 بكفاءة إلى CXCL17 مقارنة بالخلايا المحولة بالحشو ، مما يؤكد التحويل الناجح والتعبير الوظيفي للمستقبل (الشكل 2).
توجيه طويل الأجل
الشكل 1 يصور استراتيجية البوابات لتحليل الخلايا التائية عبر الأعضاء المختلفة. تم حقن الجسم المضاد المضاد ل CD45 قبل 5 دقائق من حصاد الأنسجة لاستبعاد الخلايا داخل الأوعية الدموية من التحليل. تم تضمين خلايا TCRβ + CD4 + Thy1.1+ فقط ، مما يدل على نجاح التنبيغ. تم حساب نسبة الخلايا التي تعبر عن GPCR إلى تلك التي تحتوي على المتجه الفارغ لكل عضو. تم تطبيع هذه النتائج إلى نسبة التنبيغ الأصلية (٪ Thy1.1 +) لتجمع خلايا الإدخال.
بعد الحقن في الفئران المتلقية ، قامت الخلايا المنقولة GPR25 بملء الأنسجة المخاطية غير المعوية (NIMT) بشكل تفضيلي مثل الجهاز البولي التناسلي (GU) والمعدة وأعضاء القصبة الهوائية الغنية ب GPR25LG (الشكل 3). كشفت دراساتنا عن إثراء كبير للخلايا المنقولة GPR25 في عزلات الرئة بأكملها في 7 أسابيع ولكن ليس بعد أسبوع واحد من الحقن ، مما يشير إلى النضج المحتمل أو إعادة التموضع داخل الرئة بمرور الوقت (الشكل 3). تسلط هذه النتائج الضوء على أهمية اختيار طول الدراسة المناسب.
توجيه قصير المدى
للتحقيق في توطين GPR25 في الجسم الحي ودوره في التوجيه من مجرى الدم إلى NIMT ، أجرينا فحوصات توجيه قصيرة المدى. تم حقن الخلايا التائية المحولة GPR25 بشكل مشترك مع الخلايا المنقولة بالنواقل الضابطة وتحليلها بعد 10-12 ساعة بعد النقل الوريدي إلى الفئران البرية (WT) و CXCL17 - / - (الشكل 4). تم إعطاء Anti-CD31 قبل 20 دقيقة من التضحية للتمييز بين الخلايا داخل الأوعية الدموية وتلك التي تم تكبيرها. في متلقي WT ، منح تعبير GPR25 ميزة موجهة للأعضاء الغنية ب CXCL17 ، مثل القصبة الهوائية والمعدة واللسان والمرارة والغشاء المخاطي في الرحم ، ولكن ليس للأمعاء أو الغدد الليمفاوية أو الطحال حيث لا يتم التعبير عن CXCL17 (الشكل 4A-C). ومن المثير للاهتمام ، أن التصوير متحد البؤر والقياس الكمي أظهر أن الخلايا التائية المنقولة GPR25 لم يتم إثرائها فقط بين الخلايا التي تم تسخيرها ولكن أيضا بين الخلايا التي لا تزال مرتبطة بالبطانة الوعائية داخل NIMT ، مما يشير إلى أن المسار يساهم في التوقف الأولي على البطانة وكذلك الدخول إلى الأنسجة المستهدفة والهجرة إلى الظهارة المخاطية. تم إلغاء ميزة الخلايا التائية المحولة GPR25 على الخلايا المحولة بالحشو عند حقنها في متلقي CXCL17 - /-.
داخل الخلال المحيط بالأوعية الدموية الهوائية في الرئة ، تم تحديد الخلايا المحولة GPR25 في الغالب في الشعب الهوائية ، بينما تم العثور على خلايا التحكم بشكل متكرر بالقرب من الأوردة (الشكل 4 د). يشير هذا النمط إلى إعادة تموضع الخلايا المعتمدة على GPR25 من المواقع الوريدية إلى تحت الغشاء المخاطي للقصبات الهوائية. ومع ذلك ، لم تظهر الخلايا المحولة GPR25 تفضيلا للقصيبات وفشلت في الفصل عن خلايا التحكم في متلقي CXCL17 / -. تشير هذه النتائج إلى أن الميوافينية الكيميائية GPR25 تقود على وجه التحديد التوطين إلى الشعب الهوائية الرئوية ، في حين أن التسرب الأولي قد يكون مستقلا عن GPR25 ويتم بوساطته بواسطة آليات بديلة.
سمحت لنا تقنيتنا باستنتاج أن محور GPR25-CXCL17 يتوسط على وجه التحديد تجنيد الخلايا الليمفاوية في الجهاز التنفسي والجهاز الهضمي العلوي والقنوات الصفراوية والجهاز البولي التناسلي. حدد البروتوكول المفصل هنا دور GPR25 في التوجيه الخاص بالأنسجة ، مما يساهم في فهم أعمق لكيفية تأثير هذا المستقبل اليتيم سابقا على توطين الخلايا التائية داخل البيئات الدقيقة المتميزة للأنسجة.
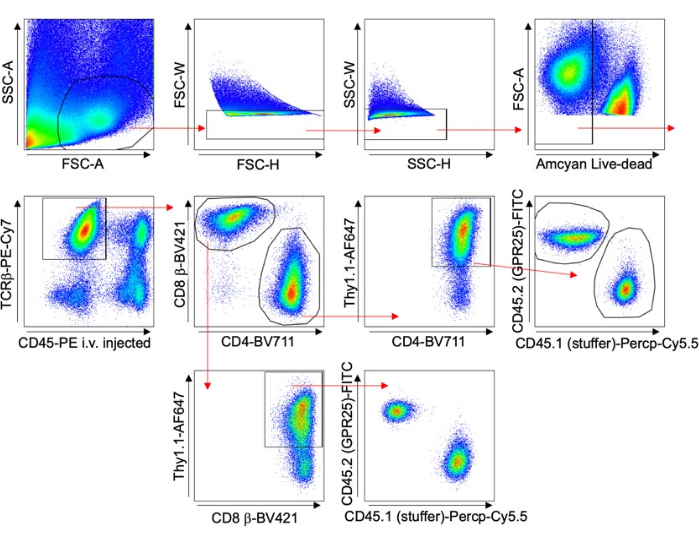
الشكل 1: استراتيجية البوابات التمثيلية. مخطط FACS يوضح استراتيجية البوابات المستخدمة في تجارب نقل الخلايا التائية للفأر ، وتحديدا لدراسة التوجيه طويلة المدى (مثال الرئة). تم استخدام تلطيخ CD45-PE و Thy1.1 المحقون عن طريق الوريد لاستبعاد الخلايا داخل الأوعية الدموية وتحليل الخلايا المنقولة على وجه التحديد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
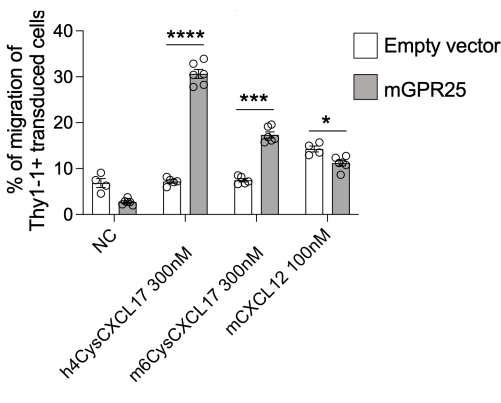
الشكل 2: الانجذاب الكيميائي للخلايا المنقولة للتحقق من وظيفتها. الخلايا المحولة mGPR25 ، ولكن ليس نظيراتها الفارغة التي تم تحويلها بالنواقل ، تتسبب في الانجذاب الكيميائي بقوة تجاه الفأر والإنسان CXCL17 في المختبر في فحوصات الهجرة القائمة على الوحل. يتم تقديم النتائج كمتوسط ± SEM من تجربتين مستقلتين على الأقل. P < 0.0001 مقابل عدم التحكم في الكيموكين (اختبار t ثنائي الذيل). تم تعديل هذا الرقم من13. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: نتائج FACS للموجه على المدى الطويل. نسبة GPR25 المحولة للتحكم في الخلايا المنقولة بالنواقل في الأنسجة بعد 1 و 7 أسابيع من الحقن في فئران Rag1 - /- تم تمييز GPR25 وخلايا التحكم بواسطة CD45.1 مقابل النمط الخيفي CD45.2 ، وتم تبديلها في تجارب مختلفة ، وتحليلها بواسطة قياس التدفق الخلوي ، وتطبيعها إلى نسب الإدخال. تظهر النتائج المجمعة من ثلاث تجارب مستقلة (2-3 فئران لكل تجربة) كمتوسط ± SEM. * P < 0.05 ، ** P < 0.01 ، *** P < 0.001 (اختبار T ثنائي الذيل). يشير N / A إلى انخفاض استعادة الخلايا للتحليل. تم تعديل هذا الرقم من13. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
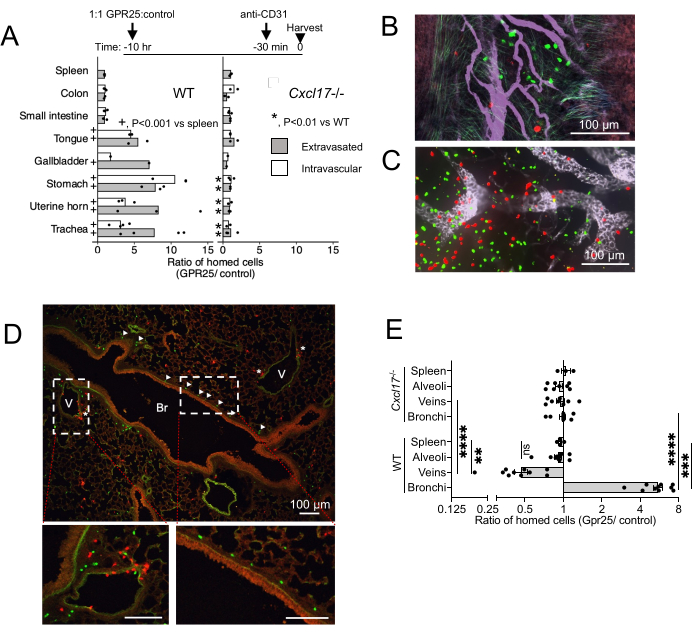
الشكل 4: نتائج التصوير متحد البؤر من التوجيه قصير المدى. (أ) نسبة GPR25 إلى الخلايا المانحة للتحكم بعد 10-12 ساعة من الحقن ، والتي يتم تحديدها عن طريق الفحص المجهري متحد البؤر للأنسجة الجبلية بأكملها أو الأقسام المجمدة. تم تحديد النسب في الطحال الضابط عن طريق قياس التدفق الخلوي. قيم P المشتقة من اختبار فيشر الدقيق الذي يقارن عدد الخلايا في الأنسجة المستهدفة المشار إليها مقابل الطحال في متلقي WT (+) أو مقارنة الأعداد في الأنسجة المستهدفة في CXCL17 - / - مقابل متلقي WT (*). تم تجميع عدد الخلايا من 1 (المرارة) أو 2-4 تجارب مستقلة مع فأر واحد لكل حالة وتجربة. يتم عرض النسب المتوسطة. (ب-د) صور تمثيلية للقصبة الهوائية (B) و PLN (C) والمقاطع العرضية للرئة (D) بعد 10 ساعات من الحقن ، تظهر خلايا GPR25 (خضراء) والتحكم (الأحمر) CD4 T تشير رؤوس الأسهم في (D) إلى خلايا GPR25 مترجمة في الشعب الهوائية (Br) ؛ تشير العلامات النجمية إلى الخلايا القريبة من الأوردة (V). (ه) نسبة GPR25 للتحكم في الخلايا المانحة داخل البيئات الدقيقة الرئوية المشار إليها: الشعب الهوائية: في حدود 30 ميكرومتر من الغشاء القاعدي للقصبات الهوائية. الوريد: في حدود 30 ميكرومتر من البطانة الوريدية أو ملامسة لها. الحويصلات الهوائية: داخل المساحات السنخية غير المجاورة للأوردة أو الشعب الهوائية. كل نقطة هي النسبة داخل 2-4 حقول 10x مستقلة ل WT و CXCL17 ، تمثل ~ 4 مم2. تم تكرار نسب الطحال من (ب) للمقارنة. تظهر النتائج 3 تجارب مستقلة مع 1-2 فئران لكل تجربة وأظهرت كمتوسط ± SEM. * P < 0.05 ، ** P < 0.01 ، *** P < 0.001 ، **** P < 0.0001 مقابل الطحال ؛ WT مقابل CXCL17 - / - (اختبار t ثنائي الذيل). تم تعديل هذا الرقم من13. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يعد اختبار التوجيه المتحكم فيه داخليا الموضح في هذه الدراسة طريقة شاملة لفحص تهريب الخلايا التائية بوساطة GPCR وتحديد المواقع داخل البيئات الدقيقة للأعضاء والأنسجة المتنوعة. يدمج هذا النهج العديد من التحسينات الهامة لتعزيز قابلية التكرار والدقة والكفاءة.
يتمثل أحد الجوانب الحاسمة لهذا البروتوكول في النقل الفعال للخلايا التائية باستخدام نواقل الفيروسات القهقرية MSCV ، والذي يتم تسهيله من خلال استخدام خلايا Plat-E لإنتاج الفيروسات. تشمل التحسينات الرئيسية الحفاظ على خلايا Plat-E عند التقاء مناسب ، واستخدام ألواح مطلية ب poly-D-lysine لتعزيز تعداء الفيروس ، واستخدام استراتيجية نقل مزدوجة لتعظيم تعبير GPCR. نظرا لأن نواقل MSCV تتطلب انقساما نشطا للخلايا من أجل تكامل الجينوم الفعال ، فإن تحفيز دخول دورة الخلية من خلال تنشيط الخلايا التائية يعزز بشكل كبير كفاءة نقل الفيروسات القهقرية. تعد التركيزات العالية من الأجسام المضادة ل CD3 و CD28 أمرا بالغ الأهمية لضمان تنشيط الخلايا التائية وتفجيرها ، والتي وجدت دراساتنا أنها أكثر فعالية من التركيزات المنخفضة التي تم الإبلاغ عنها في أماكن أخرى14. وجدنا أيضا أن تضمين السيتوكينات IL-2 و IL-7 في وسط الاستزراع أمر حيوي للحفاظ على بقاء الخلايا التائية وتعزيز توسعها ، مما يضمن مجموعة قوية من الخلايا التائية السليمة والمحولة اللازمة لدراسات الهجرة والتوجيه الدقيقة.
بالإضافة إلى تحسين نقل الفيروسات القهقرية ، يسمح البروتوكول بدراسات توجيه طويلة الأجل باستخدام علامات CD45.1 / CD45.2 للتمييز بين الخلايا المنقولة GPCR والخلايا الضابطة في تجارب تنافسية داخل نفس المضيف. يضمن هذا النهج تعرض الخلايا لنفس الإشارات الفسيولوجية. يعد إدراج علامة Thy1.1 ذا قيمة للتمييز بين الخلايا التائية المنقولة وغير المنقولة ، خاصة عندما لا تتوفر أجسام مضادة محددة ل GPCRs اليتيمة. البديل المناسب لبعض التطبيقات هو استخدام بروتين الفلورسنت بدلا من كاسيت Thy1.1.
لتحليلات الخلايا المنزلية بواسطة FACS ، يستخدم البروتوكول الأجسام المضادة ل CD45 التي يتم حقنها قبل 5 دقائق من حصاد الأنسجة للتمييز بين الخلايا المنتشرة والخلايا المقيمة في الأنسجة ، مما يمنع سوء تفسير البيانات الموجهة بالنسبة للفحص المجهري متحد البؤر ، تم حقن الأجسام المضادة ل CD31 قبل 10-30 دقيقة من التضحية لتسمية الأوعية الدموية ، مما يسمح بالتصور الدقيق لتوطين الخلايا التائية والتمييز بين الخلايا المرتبطة ببطانة الأوعية الدموية والخلايا المنتشرة. يحدد تحليل الصور باستخدام برنامج Imaris مسافة الخلايا من المعالم النسيجية ، مما يوفر رؤى مفصلة حول توطين البيئة الدقيقة والتفاعلات.
تتمثل قوة هذا البروتوكول في المقارنة جنبا إلى جنب لسلوك الخلايا المتطابقة التي تختلف فقط في التعبير عن المستقبل المنقول. بينما نستخدم المصطلح التقليدي التوجيه التنافسي لوصف الحقن المشترك والتوجيه اللاحق لخلايا التحكم والمقارنة ، فإننا نقر بأن هذا المصطلح هو تسمية خاطئة من الناحية الفنية. في المقايسات قصيرة المدى ، من المحتمل أن تكون آليات تجنيد الأنسجة زائدة ، مما يجعل المنافسة الفعلية بين مجموعات الخلايا غير محتملة. قد يكون المصطلح الأكثر دقة هو التوجيه المقارن أو التوجيه المتحكم فيه داخليا ، حيث يقوم البروتوكول بتقييم سلوكيات التوجيه بطريقة خاضعة للرقابة ومقارنة. أيضا ، يمكن أن تتضمن الهجرة الفسيولوجية والموجه مساهمات متكاملة لمستقبلات الجاذبة الكيميائية المتعددة ، والتي يمكن أن تعمل في وقت واحد أو بالتتابع لتوجيه هجرة الخلايا متعددة الخطوات في المجالات المعقدة للجاذبات الموجودة في الجسم الحي15. تعبر الخلايا التائية التي يتم تنشيطها في المختبر في ظل الظروف التي نستخدمها تلقائيا عن CXCR3 ومن المحتمل أن تكون GPCRs الأخرى ، والتي ، من خلال التنسيق مع المستقبلات المنقولة ، قد تؤثر على التوطين النهائي للخلايا. عادة ما يؤدي نقل الفيروسات القهقرية إلى الإفراط في التعبير عن الجين المستهدف ، ويجب مراعاة أن مستوى تعبير المستقبلات يمكن أن يؤثر أيضا على التوجيه. علاوة على ذلك ، يمكن أن يؤدي الإفراط في التعبير عن المستقبل نظريا إلى تغيير خصائص الخلية بشكل مستقل عن تفاعلات المستقبل والترابط. لمعالجة هذا الأمر ، أجرينا تعبيرا تكميليا باستخدام الفئران CXCL17 - / - ، التي تفتقر إلى الترابط ل GPR25. يساعد هذا النهج في ضمان أن التأثيرات الملحوظة لدينا يتم التوسط فيها من خلال التعرف على الترابط المتشابه. يمكن للباحثين الذين ليس لديهم إمكانية الوصول إلى سلالات خروج المغلوب المحددة دمج تقنيات shRNA أو CRISPR لإسقاط أو ضرب GPCRs معينة في الخلايا التائية. يمكن أن يعزز هذا التكيف تعدد استخدامات البروتوكول لدراسة وظيفة GPCR في الخلايا التائية.
في حين أن نقل الفيروسات القهقرية يوفر كفاءة عالية ، إلا أنه يتطلب انقسام الخلايا بنشاط ، والذي قد لا يعكس بدقة سلوك الخلايا الهادئة. تظهر بعض مستقبلات الكيموكين نشاطا تفاضليا اعتمادا على الحالة التكاثرية للخلية ، على الرغم من أن خصوصيتها تظل دون تغيير. أظهرت طريقة بديلة ، التثقيب الكهربائي النيون ، كفاءة عالية في التعدي في الخلايا التائية ، وإن كان ذلك بشكل عابر16. قد يكون هذا كافيا للمقايسات قصيرة المدى ، في حين أن MSCV يمكن أن ينتج عنه تعبير مستقر ، مما يجعله مناسبا لكل من الدراسات قصيرة وطويلة الأجل. ومع ذلك ، لم نتمكن من العثور على أدبيات تشير إلى أن هذا النظام قد تم استخدامه لدراسات التوجيه. إذا كانت كفاءة التعداء منخفضة ، فقد نحتاج إلى تحديد الخلايا باستخدام علامة مرئية ، مثل التعداء المشترك مع GFP.
يوفر هذا البروتوكول لقطة ثابتة لتهريب الخلايا ، مما يحد من الرؤى حول السلوك الخلوي وحركته في الوقت الفعلي. كما أن لديها قيودا متأصلة على الدقة ، لا سيما لمراقبة الهياكل تحت الخلوية وبنية الأنسجة على نطاق واسع. لمواجهة هذه التحديات ، نقترح استخدام تقنيات التصوير المتقدمة مثل الفحص المجهري متعدد الفوتون وتصوير الخلايا الحية والفحص المجهري داخل الحيوية. توفر هذه الطرق دقة مكانية أعلى ، واختراقا أعمق للأنسجة ، والقدرة على تصور العمليات الخلوية ديناميكيا. يسمح الفحص المجهري داخل الحيوية ، على وجه الخصوص ، بالتتبع في الوقت الفعلي لسلوك الخلايا التائية في الجسم الحي ، مما يتيح مراقبة هجرة الخلايا والتفاعلات والاستجابات للمنبهات في سياقها الأصلي. هذا النهج قوي بشكل خاص لتقييم توجيه الخلايا التائية وتوطين الأنسجة ، مما يكشف عن كيفية تكيف الخلايا ديناميكيا مع البيئات الدقيقة المختلفة. من خلال دمج تقنيات التصوير المتقدمة هذه ، يمكن للدراسات المستقبلية تحقيق فهم أكثر شمولا لحركة الخلايا التائية ، والتفاعلات ، والتوجيه بوساطة GPCR ، مما يعزز بشكل كبير الرؤى حول سلوكها داخل الأنسجة.
سيساعد البروتوكول الذي نقدمه في دراسة وظائف GPCR في توجيه الخلايا المناعية وله تطبيقات واسعة في العلاج المناعي والالتهابات والمناعة الذاتية. علاوة على ذلك ، فإنه يوفر فرصا جديدة لاكتشاف الأهداف العلاجية وتحسين الاستجابات المناعية من خلال استكشاف GPCRs غير المميزة سابقا في الخلايا التائية التي تستهدف السرطان ومعالجة الخلايا التائية غير المناسبة في أمراض المناعة الذاتية.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
بدعم من منح المعاهد الوطنية للصحة R01 AI178113 و R01 AI047822 ، ومنحة 1903-03787 من صندوق ليونا إم وهاري ب. هيلمسلي الخيري ، ومنح برنامج أبحاث الأمراض المرتبطة بالتبغ (TRDRP) T31IP1880 و T33IR6609 إلى ECB ؛ تم دعم YB من قبل جائزة زمالة البحث من مؤسسة كرون والتهاب القولون الأمريكية (835171). تم دعم B.O. من خلال زمالة ما بعد الدكتوراه من مؤسسة رامون أريسيس (مدريد ، إسبانيا) وجائزة زمالة الباحثين من مؤسسة كرون والتهاب القولون الأمريكية (574148). تم دعم A.A. من قبل معهد كاليفورنيا للطب التجديدي (CIRM) - EDUC2-12677.
Materials
| Name | Company | Catalog Number | Comments |
| AF647 anti mouse CD90.1-Thy1.1 (OX-7) | Biolegend | 202507 | |
| anti-CD31 (DyLight 633, clone 390) | InvivoMab | BE0377 | |
| anti-mouse CD28 37.51 | eBiosciences | ||
| anti-mouse CD3 145-2c11 | eBiosciences | ||
| APCCy7 anti mouse CD3 (145-2c11) | Biolegend | 100329 | |
| BV421 anti mouse CD8b (Ly-3) | Biolegend | 126629 | |
| BV711 anti mouse CD4 (RM4-5) | Biolegend | 100549 | |
| CD90.1 microbeads | Miltenyi | 130-121-273 | |
| CFSE | Thermoscientific | C34554 | |
| FITC anti mouse CD45.2 (104) | BD | AB_395041 | |
| mouse IL2 | Peprotech | 200-02-50UG | |
| mouse IL7 | Peprotech | 217-17-10UG | |
| Mouse T CD4 isolation kit | STEMCELL technologies | 18000 | |
| MSCV-IRES- Thy1.1 GPR25 | Vectorbuilder | ||
| MSCV-IRES- Thy1.1 Stuffer | Vectorbuilder | ||
| PE-CD45 (30-F11) antibody | Biolegend | 103105 | |
| PECy7 anti mouse TCRb (H57-597) | Tonbo | ||
| PercpCy5.5 anti mouse CD45.1 (A20) | eBiosciences | ||
| Platinum-E (Plat-E) | cell Biolabs. Inc | RV-101 | |
| Yellow fluorescent dye | Thermoscientific |
References
- Cheng, L., et al. Structure, function and drug discovery of GPCR signaling. MolBiomed. 4 (1), 46 (2023).
- Lammermann, T., Kastenmuller, W. Concepts of GPCR-controlled navigation in the immune system. Immunol Rev. 289 (1), 205-231 (2019).
- Fu, H., Ward, E. J., Marelli-Berg, F. M. Mechanisms of t cell organotropism. Cell Mol Life Sci. 73 (16), 3009-3033 (2016).
- Cinalli, R. M., et al. T cell homeostasis requires g protein-coupled receptor-mediated access to trophic signals that promote growth and inhibit chemotaxis. Eur J Immunol. 35 (3), 786-795 (2005).
- Wu, V., et al. Illuminating the onco-GPCRome: Novel g protein-coupled receptor-driven oncocrine networks and targets for cancer immunotherapy. J Biol Chem. 294 (29), 11062-11086 (2019).
- Wu, V. H., et al. The GPCR-alpha(s)-pka signaling axis promotes T-cell dysfunction and cancer immunotherapy failure. Nat Immunol. 24 (8), 1318-1330 (2023).
- Ramezani, A., Hawley, T. S., Hawley, R. G. Stable gammaretroviral vector expression during embryonic stem cell-derived in vitro hematopoietic development. Mol Ther. 14 (2), 245-254 (2006).
- . . Plat-E retroviral packaging cells (RV-101) user manual. , (2024).
- Anderson, J., Hope, T. Intracellular trafficking of retroviral vectors: obstacles and advances. Gene Ther. 12, 1667-1678 (2005).
- Kim, E., et al. Isolation and analyses of lamina propria lymphocytes from mouse intestines. STAR Protoc. 3 (2), 101366 (2022).
- Steinert, E. M., et al. Quantifying Memory CD8 T Cells Reveals Regionalization of Immunosurveillance. Cell. 161 (4), 737-749 (2015).
- Miltenyi Biotec. . CD90.1 MicroBeads mouse and rat. , (2024).
- Ocón, B., et al. A lymphocyte chemoaffinity axis for lung, non-intestinal mucosae and CNS. Nature. 635, 736-745 (2024).
- Sumida, H., et al. Gpr55 regulates intraepithelial lymphocyte migration dynamics and susceptibility to intestinal damage. Sci Immunol. 2 (18), eaao1135 (2017).
- Foxman, E. F., Campbell, J. J., Butcher, E. C. Multistep navigation and the combinatorial control of leukocyte chemotaxis. J. Cell Biol. 139 (5), 1349-1360 (1997).
- Alawar, N., et al. A solution for highly efficient electroporation of primary cytotoxic T lymphocytes. BMC Biotechnol. 24 (1), 16 (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved