Method Article
Transducción retroviral eficiente y localización competitiva para investigar la localización de células T mediada por GPCR en diversos microentornos tisulares
En este artículo
Resumen
Presentamos protocolos mejorados para la transducción retroviral de receptores de tráfico y el homing competitivo para estudiar el posicionamiento de linfocitos específicos de órganos y microambientes mediados por receptores. Este método ofrece información valiosa sobre los mecanismos de tráfico de células inmunitarias y tiene aplicaciones potenciales en futuras investigaciones básicas y terapéuticas.
Resumen
Comprender cómo la expresión del receptor acoplado a la proteína G (GPCR) afecta el posicionamiento celular dentro de diversos microentornos tisulares es esencial para dilucidar los mecanismos de tráfico de células inmunitarias. Presentamos un ensayo de localización competitivo diseñado para estudiar la localización de células T mediada por GPCR en órganos que expresan sus ligandos quimioatrayentes afines, aplicable tanto para estudios a corto como a largo plazo. El enfoque implica un protocolo mejorado para la transducción del virus de células madre murinas recombinantes (MSCV) de las células T para expresar el GPCR de interés o un constructo de control, seguido de un homing competitivo en ratones receptores. La distribución celular a través de los diferentes órganos se analiza mediante citometría de flujo y/o microscopía confocal. En experimentos a corto plazo (10-12 h), la microscopía confocal reveló distintos patrones de localización celular, incluidos los alvéolos, la submucosa de los bronquios, los sitios venosos y el intersticio en el pulmón, así como el epitelio que recubre la tráquea, el estómago y el asta uterina. En estudios a largo plazo (1-7 semanas), la citometría de flujo proporcionó información sobre la acumulación celular preferencial, revelando cambios dinámicos y una posible maduración o reposicionamiento dentro de los tejidos a lo largo del tiempo. Este competitivo ensayo de localización es una herramienta sólida para estudiar el posicionamiento celular mediado por GPCR, ya que ofrece información valiosa sobre la distribución específica del tejido y las posibles aplicaciones en inmunología e investigación terapéutica.
Introducción
Los receptores acoplados a proteínas G (GPCR) son fundamentales en la regulación de una variedad de procesos celulares, incluida la transducción de señales, la neurotransmisión, la regulación hormonaly la migración de células inmunitarias. Desempeñan un papel crucial en el control espacio-temporal de la migración y localización de linfocitos2. Durante la fase de preparación de las respuestas inmunitarias, el microambiente local y las interacciones celulares hacen que los linfocitos T expresen un conjunto único de moléculas de adhesión y receptores de quimiocinas conocidos como receptores homing. Esta adaptación permite que las células T con experiencia en antígenos se involucren con las células endoteliales (CE) específicas de órganos y migren a distintos tejidos diana. La capacidad de las células T para adquirir tropismo tisular es vital para las respuestas efectivas de recuerdo, particularmente en el contexto de infecciones recurrentes que afectan al mismo órgano 3,4.
Los GPCR guían a las células inmunitarias a tejidos y órganos específicos donde realizan funciones críticas, como dirigir las células T y NK CD8+ a los sitios tumorales para una acción citotóxica o ayudar a las células T CD4+ a orquestar las respuestas inmunitarias al apoyar la activación de otras células inmunitarias. Comprender cómo los GPCR dirigen las células T a sus ubicaciones precisas es esencial para avanzar en las inmunoterapias dirigidas 5,6. El desafío, sin embargo, radica en modelar estas interacciones complejas in vitro, ya que es difícil replicar simultáneamente tanto las señales espacialmente restringidas como las señales quimiotácticas direccionales.
Dilucidar las funciones de receptores específicos de leucocitos también suele ser un desafío debido a su limitada frecuencia de expresión en poblaciones endógenas y al hecho de que estos receptores suelen decorar distintos tipos de células. Esta complejidad hace que sea difícil aislar el papel de un receptor específico de otros mecanismos específicos de subconjuntos celulares. Idealmente, los métodos deberían comparar poblaciones similares, diferenciándose solo en el receptor de interés para proporcionar información clara.
Para superar estos desafíos, hemos adoptado un ensayo de referencia competitivo que emplea la transducción retroviral recombinante de MSCV para una expresión eficiente de GPCR en células T. Los vectores retrovirales MSCV, que combinan elementos de los vectores MESV basados en el virus del sarcoma mieloproliferativo (PCMV) y los vectores LN basados en el virus de la leucemia murina de Moloney (MMLV), incorporan una señal de empaquetamiento híbrido extendida derivada de los vectores LN7. Esta modificación mejora la eficiencia de la entrega de genes, lo que permite estudios a corto y largo plazo de la localización de células T in vivo. Mediante el uso de partículas retrovirales de alto título y microscopía confocal, el enfoque permite una visualización precisa del posicionamiento y las interacciones de las células T dentro de entornos de tejidos complejos. Presentamos protocolos detallados para la transducción retroviral de receptores de tráfico y la realización de ensayos de localización controlados internamente (los llamados competitivos) para estudiar el posicionamiento de linfocitos específicos de órganos y microambientes mediados por receptores. El objetivo general de este método es proporcionar información valiosa sobre los mecanismos de tráfico de células inmunitarias y permitir futuras aplicaciones tanto en la investigación básica como en el desarrollo terapéutico.
Protocolo
Todos los ratones de este estudio se mantuvieron en instalaciones específicas libres de patógenos (SPF) en el Sistema de Atención Médica de Asuntos de Veteranos de Palo Alto (VAPAHCS). Los ratones B6/SJL Prprc Pep3BoyJ (CD45.1), C57B6/J (CD45.2) y Rag1-/- se compraron a Jackson Laboratories. Si bien usamos PepBoy para obtener células CD45.1, recomendamos usar JAXBoy (C57BL/6J-Ptprcem6Lutzy/J). JAXBoy es una cepa totalmente coisogénica generada a través de CRISPR en lugar del retrocruzamiento tradicional, lo que mejora la consistencia genética. Históricamente, los estudios marcados con alotipos CD45 con ratones PepBoy (CD45.1), que no son totalmente congénitos, han incluido ensayos de recirculación y localización de controles con comparaciones de tipo salvaje (WT/WT) para abordar la posible variabilidad. Con los ratones JAXBoy ahora disponibles como una alternativa totalmente isogénica, es posible que estos controles adicionales ya no sean necesarios. Los investigadores aún deben considerar que las diferencias entre las variantes CD45.1 y CD45.2, como sus roles como proteínas tirosina fosfatasas, pueden influir en el comportamiento celular y los patrones de búsqueda. Todos los protocolos discutidos en el texto y a continuación han sido aprobados o cumplen con las pautas del Departamento de Medicina de Animales de Laboratorio acreditado y el Panel Administrativo sobre el Cuidado de Animales de Laboratorio en el Sistema de Atención Médica de VA Palo Alto (VAPAHCS). Los animales fueron sacrificados utilizando procedimientos aprobados. Se incluyeron ratones de ambos sexos, de 8 a 12 semanas de edad, en los experimentos.
1. Preparación del vector MSCV
- Compre el vector retroviral MSCV-IRES-Thy1.1 con la región codificante del gen de interés del ratón (GOI) o un ORF_Stuffer (control ORF negativo)
NOTA: Este constructo incluye el marcador de superficie Thy1.1 junto con el gen GPCR de interés. El enlazador del sitio de entrada interno del ribosoma (IRES) permite la coexpresión del GPCR con el Thy1.1, lo que facilita la identificación de las células transducidas por citometría de flujo o purificación y aislamiento por perlas magnéticas. Esto es particularmente útil cuando los anticuerpos específicos para el GPCR no están disponibles, como suele ser el caso de los GPCR poco estudiados. - Obtener el plásmido MSCV en forma bacteriana y cultivo mediante la inoculación de caldo Luria-Bertani (LB) suplementado con una selección adecuada de antibióticos basada en el gen de resistencia codificado por el plásmido (por ejemplo, ampicilina, kanamicina o cloranfenicol). El medio LB se compone de triptona (10 g/L), extracto de levadura (5 g/L) y NaCl (10 g/L), ajustados a pH 7,0 y esterilizados en autoclave. Incubar el cultivo a 37 °C en una incubadora agitadora (220 RPM) durante la noche.
- Prepare las existencias de plásmidos utilizando técnicas estándar de biología molecular utilizando un kit de preparación de ADN.
- Después del aislamiento del ADN, mida la concentración de ADN con un espectrofotómetro y prepare soluciones de plásmidos de trabajo a una concentración de 1 μg/μL. Almacene los plásmidos a -20 °C para su uso futuro.
2. Establecimiento del cultivo de líneas celulares de envasado
NOTA: Utilizamos células de platino E (Plat-E) de Cell Biolabs. Las células Plat-E son una línea celular basada en 293T con un promotor EF1α, que proporciona una expresión estable y de alto rendimiento de proteínas estructurales retrovirales (genes gag, pol y env), lo que permite el empaquetamiento retroviral con una sola transfección de plásmido8. Aunque se podrían utilizar otras líneas celulares, como NIH-3T3 o 293T, no hemos probado estas alternativas.
- Prepare los medios celulares Plat-E agregando DMEM, 10% de FBS, 1% de penicilina/estreptomicina, blasticidina (10 μg/mL) y puromicina (1 μg/mL). Use blasticidina y puromicina para el mantenimiento celular, pero omítalas durante y después de la transfección.
- Las células Plate Plat-E se envían congeladas en 1,0 mL, a >3 x 106 células/mL en DMEM, 20% FBS y 10% DMSO. Descongélelos rápidamente en un baño de agua a 37 °C. Transfiera todas las células descongeladas a un tubo cónico de 15 mL que contenga medio de cultivo Plat-E.
- Centrifugar a 450 x g durante 5 min a 4 °C. Vuelva a suspender el pellet de celda en 1 mL de medio Plat-E pipeteando suavemente para crear una suspensión de una sola celda.
- Agregue 9 mL de medio Plat-E a una placa de cultivo de 10 cm, luego transfiera 1 mL de células resuspendidas a la placa. Confirme que las células descongeladas son viables mezclando un volumen igual de suspensión celular y azul de tripán y contando las células viables (no teñidas) y muertas (teñidas con azul) utilizando un hemocitómetro o un contador de células, con el objetivo de una viabilidad del >70%.
- Incubar las células a 37 °C en una incubadora humidificada con 5% de CO2. No cambie el medio durante los primeros 3 días; Es normal observar células flotantes y muertas en el primer deshielo.
- Cuando las células alcancen el 85%-90% de confluencia, lavar con DMEM/PBS Ca-/Mg-. Sepárelas con 2 mL de 0,05% de tripsina/0,5 mM de EDTA e incubar durante 3 min a 37 °C. Agregue 8 mL de medio Plat-E, recoja las células en un tubo cónico de 15 mL y centrifugue a 450 x g durante 5 min a 4 °C.
- Divida en una proporción de superficie de 1:10 o 1:5 (es decir, siembre platos nuevos con 1/10 o 1/5 del volumen total del plato original). Volver a suspender en un volumen final de 10 mL de medio Plat-E e incubar a 37 °C en una incubadora humidificada con 5% de CO2.
- Alicuone el resto de las células en 1 mL de FBS con DMSO al 10% y congele a -80 °C y posteriormente en nitrógeno líquido para uso a largo plazo.
NOTA: Trate las células como se describe anteriormente cuando estén cerca del 85% de confluentes. Para mantener una salud celular óptima, evite la confluencia excesiva y trate de dividir 3 días con una dilución de 1:10. Si el crecimiento se ralentiza, use una alícuota nueva. El rendimiento de la célula suele disminuir con los siguientes pasos. Recomendamos usar celdas para la transfección entre los pasajes 4 y 15 para obtener mejores resultados.
3. Producción de células transducidas
- Día 1: Semillas de células P E
NOTA: Calcule el número de celdas y placas Plat E necesarias. Utilizamos 1 mL de sobrenadante viral por pocillo en una placa de 24 pocillos para transfectar las células 2 veces. Por lo general, utilizamos aproximadamente dos placas transfectadas en placa de Petri de 10 cm con células Plate-E por placa de 24 pocillos con células T en cultivo.- Comience recubriendo las placas de cultivo de tejidos de 10 cm con 5 mL de 50 μg/mL de poli-D-lisina en agua estéril. Incubar a temperatura ambiente durante 45 min. Lave 2 veces con PBS Ca-/Mg estéril, para asegurarse de que no queden residuos.
NOTA: Recomendamos recubrir las placas, ya que las células Plat-E tienden a desprenderse después de la transfección, lo que provoca un rendimiento celular deficiente y una reducción de la producción de títulos virales. - Separe las células Plat-E como se describe anteriormente en el paso 2.6 y realice un ensayo de exclusión de azul de tripano para garantizar la viabilidad. Mezcle un volumen igual de suspensión celular y Azul de Tripán. Cuente las células viables (no teñidas) y muertas (teñidas en azul) usando un hemocitómetro/contador de células. Siembre 3 células vivas de 10⁶ en una placa de Petri de cultivo de tejidos de 10 cm con medio Plat-E libre de antibióticos.
NOTA: Las placas sembradas deben alcanzar un 85%-90% de confluencia al día siguiente. Si esto no se logra, considere usar una alícuota de celda diferente. Ajuste la densidad de siembra en función del momento del enchapado; Para el enchapado nocturno, se pueden usar 3.5 x 106 celdas.
- Comience recubriendo las placas de cultivo de tejidos de 10 cm con 5 mL de 50 μg/mL de poli-D-lisina en agua estéril. Incubar a temperatura ambiente durante 45 min. Lave 2 veces con PBS Ca-/Mg estéril, para asegurarse de que no queden residuos.
- Día 2: Transfección de células Plat-E y placas de recubrimiento para células T con anticuerpos anti-CD3 y anti-CD28
- Reemplace el medio en los cultivos celulares Plat-E con 6,5 mL de medio sérico reducido.
- Prepare la mezcla de transfección de acuerdo con las instrucciones del fabricante para el reactivo Lipofectamine (se utilizó Lipofectamine 2000 en este estudio).
- Para cada placa, mezcle 45 μL de Lipofectamine 2000 con 210 μL de medio sérico reducido en un tubo, y 15 μg de ADN con 235 μL de medio sérico reducido en otro tubo. Combine el contenido de los tubos pipeteando 3x-4x.
- Incube la mezcla durante 5-20 minutos a temperatura ambiente para permitir que se formen complejos de lipofectamina / ADN, luego agregue gota a gota a las placas. Incubar las placas durante 16 h a 37 °C.
- Pocillos de activación de linfocitos T: Cubrir placas de 24 pocillos con 5 μg/mL de CD28 anti-ratón (37,51) y 10 μg/mL de CD3 anti-ratón (145-2c11) en 375 μL/pocillo de PBS durante la noche a 4 °C o durante 3-4 h en la incubadora a 37 °C el día 3.
NOTA: Envuelva las placas en una película transparente si incuba durante la noche para evitar la evaporación. El activador de ratón Dynabeads CD3/CD28 se puede utilizar como alternativa con resultados comparables.
- Día 3: Cambiar el medio Plat-E y aislar y activar las células T
- Cambie el medio de transfección Plat-E a 14 mL de medio completo DMEM por la mañana. Prepare los medios de células T agregando RPMI-10: RPMI 1640 con L-glutamina, 10% FBS, 1 % de penicilina/estreptomicina, 1x MEM aminoácidos no esenciales, 1 mM de piruvato de sodio, 50 μM de β-mercaptoetanol y 1 mM de HEPES.
- Eutanasiar ratones JAXBoy (CD45.1) y C57B6/J (CD45.2) mediante inhalación de CO2seguida de luxación cervical. Aísle el bazo y los ganglios linfáticos en condiciones estériles.
- Machaca suavemente el bazo en un colador de celdas de malla de nailon de 100 μm con medio RPMI en una placa de 6 pocillos con un émbolo de jeringa.
- Transfiera la solución a través de un filtro de celdas de malla de nailon de 40 μm para una suspensión de una sola celda a un tubo cónico de 50 mL. Centrifugar a 450 x g durante 5 min a 4 °C y lavarlos con PBS Ca-/Mg-.
- Realice la selección magnética negativa con el kit de aislamiento T / T CD4 del mouse siguiendo las instrucciones del fabricante o, alternativamente, clasifique las celdas usando FACS estéril
- Cuente las células T utilizando un contador de células y colóquelas en los pocillos de activación de las células T a 1-1,5 x 106 por pocillo en 1 mL de medio RPMI-10 por pocillo. Incubar las células a 37 °C con 5% de CO₂ en una incubadora humidificada. Espere de 24 a 48 h para una activación adecuada, según se evalúe bajo el microscopio, como se explica en las notas a continuación.
NOTA: La reticulación de CD3 y CD28 activa eficazmente las células T en esta configuración. Un bazo de ratón suele producir aproximadamente 1 x 108 esplenocitos. Las células T CD4+ generalmente constituyen alrededor del 10% de la población total de esplenocitos. Por lo tanto, para preparar una placa de 24 pocillos con 1-1,5 x 106 linfocitos T CD4+ por pocillo, se estima que las celdas de 2-3 ratones serán suficientes.
- Día 4: Transducción
- Revise las células T después de 24 horas bajo un microscopio. Asegúrese de que las células T estén en un estado de voladura (formando grupos y apareciendo agrandadas debido a la activación) antes de la transducción. Las células T explosivas aseguran que estén en un estado de división, que es crucial para la transducción de MSCV9.
- Recoja ~ 10 mL de sobrenadante viral de las placas de 10 cm en un tubo cónico. Reemplace las placas de cultivo de Plat-E con otros 10 mL de medio Plat-E sin antibióticos para garantizar que haya suficiente medio para generar más medios para una segunda transducción al día siguiente. Ajuste el volumen de los medios en las placas PLAT-E en función del número de pocillos de células T que deben transfectarse al día siguiente.
NOTA: La transducción 2x mejora significativamente la eficiencia. - Filtre el sobrenadante viral pasando a través de un filtro de jeringa de 0,45 μm. Añadir 8 μg/mL de policeno y 1:100 HEPES.
- Gire la placa de células T de 24 pocillos durante 7 minutos a 950 x g. Recoja y guarde cuidadosamente el sobrenadante sin desalojar las células. Este sobrenadante contiene citocinas y otros factores secretados por las células T después de la activación y reemplazados por este sobrenadante después de la spinfección para mantener el perfil de citocinas y factores para apoyar la proliferación y el crecimiento de las células T.
- Realizar la desinfección añadiendo 1 mL de sobrenadante viral a cada pocillo y centrifugando a 1.150 x g durante 4 h a 32 °C. Selle las placas con una envoltura de plástico durante la desinfección.
- Después de la desinfección, reemplace con cuidado el medio con el sobrenadante de células T previamente guardado.
- Día 5: Repetir la transducción
- Repita la transfección como se describe en el día 4. Opcionalmente, mezcle el sobrenadante guardado en el paso 3.4.3 de los linfocitos T activados inicialmente con medios frescos en una proporción de 1:1 si el medio parece agotado.
- Día 6: Lavar las células y expandirlas
- Lave las células con PBS Ca+/Mg+. y transferirlos a una nueva placa de cultivo con 130 U/mL de IL2 de ratón y 10 ng/mL de IL7 de ratón. Incubar las células durante al menos 2 días o hasta que alcancen el nivel de expansión deseado, en función del número de células necesarias para la inyección.
- Día 8: Cosecha y purificación
- Recolecta células y purifica con un gradiente de densidad Histopaque de 1.077.
NOTA: Esta técnica ayuda a aislar las células viables (como los linfocitos u otras células inmunitarias) de las células muertas o los desechos. Las células muertas, que tienen una densidad más alta, se depositarán en el fondo del tubo, mientras que las células viables suelen permanecer en la capa de interfaz. - Agregue 5 mL de Histopaque 1.077 a un tubo de 15 mL. Recolectar las células centrifugando a 450 x g durante 5 min a 4 °C para peletizar las células.
- Vuelva a suspender el pellet celular en 5 mL de PBS Ca+/Mg+. Coloque cuidadosamente la suspensión celular sobre 5 mL de Histopaque 1.077 en el tubo de centrífuga.
- Centrifugar a 400-500 x g durante 20 minutos a temperatura ambiente, asegurándose de que la rotura/aceleración de la centrífuga se establezca en cero.
- Después de la centrifugación, las células se separarán en capas distintas en función de la densidad. Las células deseadas suelen estar en la capa de interfaz entre la histopaca y el medio superior, mientras que las células muertas se asentarán en la parte inferior. Recoja cuidadosamente la capa celular en la capa de interfaz con una pipeta, evitando la contaminación con otras capas. Las células recolectadas ahora están listas y limpias para las inyecciones.
- Evalúe la eficiencia de la transducción mediante la tinción Thy1.1 y el análisis de citometría de flujo. Consulte la estrategia de compuerta en la Figura 1.
NOTA: Después de la transducción, las células se pueden utilizar en ensayos de quimiotaxis para evaluar su migración hacia quimiocinas específicas en comparación con las células vectorial de control para confirmar funcionalmente su actividad in vitro antes de proceder con las inyecciones.
- Recolecta células y purifica con un gradiente de densidad Histopaque de 1.077.
- Ensayo de localización in vivo a largo plazo
- Para el homing a largo plazo, use CD45.1 para el GPCR de ratón de interés y CD45.2 para las celdas transducidas de vector vacío (o viceversa). Mezcle las dos poblaciones de células en una proporción de 1:1.
- Inyectar por vía intravenosa 20-30 x 106 células totales por cada ratón receptor Rag1-/- adulto para el tropismo de 1 semana y 5 x 106 para el tropismo de 7 semanas de duración. Utilizamos receptores de Rag1-/- deficientes en linfocitos para reducir la competencia con las células T endógenas.
- Después de 1 a 7 semanas (dependiendo del estudio), inyecte el anticuerpo anti-CD45 por vía intravenosa (i.v.) en los ratones 5 minutos antes de la cosecha para etiquetar las células transmitidas por la sangre.
- Eutanasia a los ratones mediante inhalación de CO2 seguida de dislocación cervical.
NOTA: Se han realizado estudios de 1 semana y 7 semanas; Es posible que sean posibles estudios más largos, pero aún no se han evaluado. - Recolecta células de diferentes órganos de interés y controles. Digerir los tejidos de acuerdo con los protocolos estándar de preparación de linfocitos para cada órgano10,11.
- Teñir las células recolectadas con anticuerpos monoclonales (mAb) para el análisis de citometría de flujo.
- Localización competitiva a corto plazo: posicionamiento de células T e imágenes
- Recomendamos el uso de ratones C57B6/J como donantes, dado que marcaremos las células con fluorescencia. Sin embargo, para ensayos de referencia muy cortos, de hasta unas pocas horas, se puede utilizar cualquier cepa.
- En el día 8 de cultivo, aísle magnéticamente las células transducidas (Thy1.1+) utilizando microperlas CD90.1, de acuerdocon las instrucciones del fabricante.
- Mantener solo las células transducidas (>95% de pureza) en cultivo después de este punto durante 2 días bajo IL2 e IL7 como se indicó anteriormente y dejar que se expandan. Las microperlas son biodegradables y después de 48 h no afectarán la función normal de las células.
- El día 11, etiquete las células que expresan el GPCR de interés con el éster de carboxifluoresceína succinimidilo (CFSE es un colorante de tinción celular fluorescente). Para las células de relleno, use un tinte fluorescente amarillo, o viceversa. Puedes usar tintes alternativos si lo prefieres.
- Prepare una suspensión celular a una concentración de 1 x 106 celdas/mL en RPMI con 2% de FBS. Incubar las células con el colorante a una concentración final de 5 μM a 37 °C en un baño de agua con agitación suave durante 20 min. Para garantizar resultados comparables, alterne las asignaciones de tinte en experimentos separados. Alternativamente, use un solo tinte para etiquetar un tipo de célula común como un estándar interno, incluidas las células experimentales y de control en diferentes receptores.
- Lave las celdas etiquetadas y mézclelas en una proporción de 1:1. Calcule la concentración de células utilizando un contador de células. Inyectar 15-30 x 106 células por vía intravenosa en ratones receptores (ratones receptores WT o transgénicos, dependiendo del propósito del experimento).
- Aproximadamente 10-12 h más tarde, inyecte a los ratones con el anticuerpo anti-CD31 (por ejemplo, marcado con DyLight 633, clon 390), que debe ser de 10 a 15 minutos antes del sacrificio para delinear los vasos sanguíneos y discriminar las células intravasculares de las extravasadas.
- Eutanasia a los ratones mediante inhalación de CO2 seguida de dislocación cervical. Analice la localización celular por FACS de suspensiones celulares como se describe en el paso 3.8 anterior o mediante la obtención de imágenes de tejidos enteros como en el paso 3.9.8 o el paso 3.9.7 para órganos de interés utilizando microscopía confocal.
- Para órganos delgados como la tráquea, el cuerno uterino o los ganglios linfáticos, prepare monturas de calabaza. Coloque el pañuelo en un portaobjetos con cinta adhesiva de doble cara en los lados, agregue unas gotas de solución de montaje Fluoromount-G, cúbralo con un cubreobjetos y presione suave y uniformemente para fijar el cubreobjetos a la cinta con un portaobjetos separado u otro objeto plano.
- Para secciones congeladas, incruste el tejido en el compuesto de temperatura de corte óptima (OCT). En el caso de los pulmones, perfundir con un 50% de OCT/PBS antes de incrustar.
- Utilice la citometría de flujo para órganos de control como el ganglio linfático periférico (PLN), el bazo o la sangre para evaluar la eficiencia de la transducción (% Thy1.1+) como se muestra en la Figura 1 y normalizar los resultados. Visualice PLN con monturas o secciones de squash mediante microscopía confocal. Recuento de células mediante microscopía confocal con el software Imaris.
- Determine la proporción de células transducidas con GPCR y células de control (transducidas por Stuffer) en órganos completos o compartimentos de órganos específicos. Normalizar a las proporciones de entrada determinadas por el FACS y/o a la relación recuperada de los órganos de control en los que se sabe o se presume que el GPCR es irrelevante.
- Para el análisis de la localización microambiental en los pulmones, mida la distancia de las células a los puntos de referencia histológicos (por ejemplo, membranas o venas basales bronquiales) utilizando el software Imaris.
Resultados
En este estudio, presentamos un protocolo detallado para investigar la capacidad de receptores específicos para dirigir la localización de células T in vivo. Como demostración de este protocolo, utilizamos GPR2513. Somos capaces de lograr una eficiencia de transducción del 30%-40% utilizando este protocolo, según lo evaluado por la tinción de Thy1.1 por citometría de flujo. Realizamos ensayos de quimiotaxis in vitro basados en transpocillos utilizando células transducidas con GPR25 junto con controles de relleno, probando su migración hacia hCXCL17, mCXCL17 y CXCL12 como control positivo. Las células T transducidas por GPR25 migraron de manera eficiente a CXCL17 en comparación con las células transducidas por relleno, lo que confirma la transducción exitosa y la expresión funcional del receptor (Figura 2).
Búsqueda a largo plazo
Figura 1 describe la estrategia de compuerta para analizar las células T en varios órganos. El anticuerpo anti-CD45 se inyectó 5 minutos antes de la extracción de tejido para excluir las células intravasculares del análisis. Solo se incluyeron las células TCRβ+ CD4+ Thy1.1+, indicativas de una transducción exitosa. Se calculó la proporción de células que expresan GPCR con respecto a las que tienen el vector vacío para cada órgano. Estos resultados se normalizaron al porcentaje de transducción original (% Thy1.1+) del grupo de celdas de entrada.
Tras la inyección en ratones receptores, las células transducidas por GPR25 poblaron preferentemente los tejidos mucosos no intestinales (NIMT), como el tracto genitourinario (GU), el estómago y los órganos de la tráquea ricos en GPR25LG (Figura 3). Nuestros estudios revelaron un enriquecimiento significativo de las células transducidas por GPR25 en aislados de pulmón completo a las 7 semanas, pero no a 1 semana después de la inyección, lo que sugiere una posible maduración o reposicionamiento dentro del pulmón con el tiempo (Figura 3). Estos hallazgos resaltan la importancia de seleccionar una duración de estudio adecuada.
Búsqueda a corto plazo
Para investigar la localización in vivo de GPR25 y su papel en el guiado desde el torrente sanguíneo hasta el NIMT, realizamos ensayos de guiado a corto plazo. Las células T transducidas con GPR25 se coinyectaron con células transducidas por vectores de control y se analizaron 10-12 h después de la transferencia intravenosa en ratones de tipo salvaje (WT) y CXCL17-/- (Figura 4). Se administró anti-CD31 20 min antes del sacrificio para distinguir las células intravasculares de las extravasadas. En los receptores de WT, la expresión de GPR25 confirió una ventaja de localización a los órganos ricos en CXCL17, como la tráquea, el estómago, la lengua, la vesícula biliar y las mucosas uterinas, pero no a los intestinos, los ganglios linfáticos o el bazo, donde no se expresa CXCL17 (Figura 4A-C). Curiosamente, las imágenes confocales y la cuantificación mostraron que las células T transducidas por GPR25 no solo estaban enriquecidas entre las células extravasadas, sino también entre las células aún unidas al endotelio vascular dentro de NIMT, lo que sugiere que la vía contribuye a la detención inicial en el endotelio, así como a la entrada en los tejidos objetivo y la migración al epitelio mucoso. La ventaja de los linfocitos T transducidos con GPR25 sobre los linfocitos transducidos con relleno se abolió cuando se inyectaron en receptores de CXCL17-/-.
Dentro del intersticio peribroncovascular del pulmón, las células transducidas por GPR25 se localizaron predominantemente en los bronquios, mientras que las células de control se encontraron con mayor frecuencia cerca de las venas (Figura 4D). Este patrón sugiere el reposicionamiento dependiente de GPR25 de las células de los sitios venosos a la submucosa bronquial. Sin embargo, las células transducidas con GPR25 no mostraron preferencia por los bronquiolos y no lograron segregarse de las células de control en los receptores de CXCL17-/-. Estos hallazgos indican que la quimioafinidad de GPR25 impulsa específicamente la localización a los bronquios pulmonares, mientras que la extravasación inicial puede ser independiente de GPR25 y mediada por mecanismos alternativos.
Nuestra técnica nos permitió concluir que el eje GPR25-CXCL17 media específicamente el reclutamiento de linfocitos en las vías respiratoria, gastrointestinal superior, biliar y genitourinaria. El protocolo detallado aquí definió el papel de GPR25 en la localización específica del tejido, lo que contribuye a una comprensión más profunda de cómo este receptor previamente huérfano influye en la localización de las células T dentro de distintos microambientes tisulares.
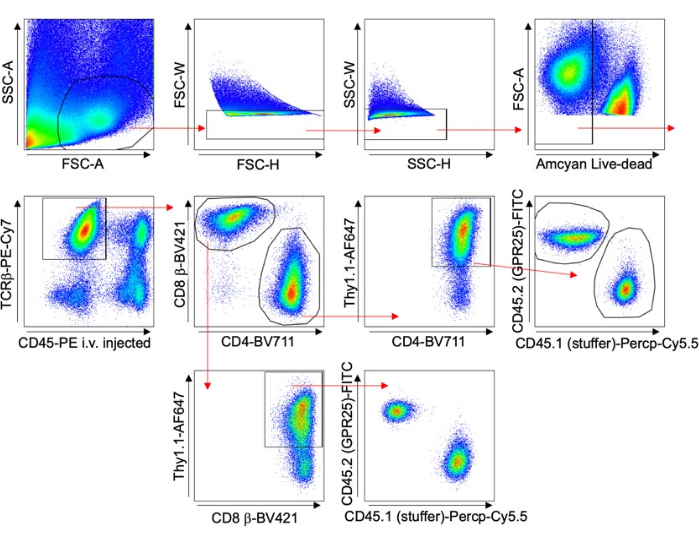
Figura 1: Estrategia de compuerta representativa. Gráfico FACS que muestra la estrategia de compuerta utilizada para los experimentos de transducción de células T de ratón, específicamente para el estudio de localización a largo plazo (ejemplo de pulmón). Se utilizó inyección intravenosa de CD45-PE y tinción con Thy1.1 para excluir las células intravasculares y analizar específicamente las células transducidas. Haga clic aquí para ver una versión más grande de esta figura.
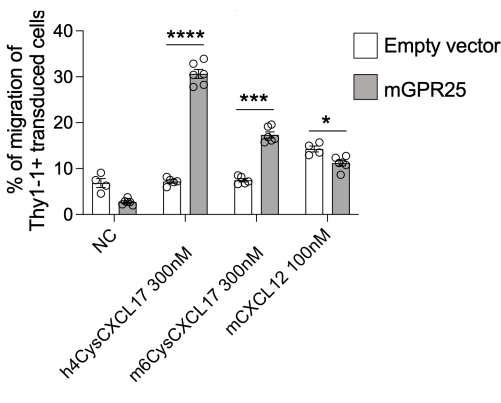
Figura 2: Quimiotaxis de células transducidas para comprobar su función. Las células transducidas con mGPR25, pero no las contrapartes transducidas por vectores vacíos, robustamente quimiotaxis hacia CXCL17 de ratón y humano in vitro en ensayos de migración basados en transpozos. Los resultados se presentan como media ± SEM de al menos dos experimentos independientes. P < 0,0001 vs. ningún control de quimiocinas (prueba t de dos colas). Esta cifra ha sido modificada de13. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Resultados de FACS para la localización a largo plazo. Proporción de células transducidas por GPR25 para células transducidas por vectores de control en tejidos 1 y 7 semanas después de la inyección en ratones Rag1-/-. Las células GPR25 y control se distinguieron por el alotipo CD45.1 frente al CD45.2, se conmutaron en diferentes experimentos, se analizaron por citometría de flujo y se normalizaron a las relaciones de entrada. Los resultados agrupados de tres experimentos independientes (2-3 ratones por experimento) se muestran como media ± SEM. *P < 0,05, **P < 0,01, ***P < 0,001 (prueba T de dos colas). N/A indica una baja recuperación de células para el análisis. Esta cifra ha sido modificada de13. Haga clic aquí para ver una versión más grande de esta figura.
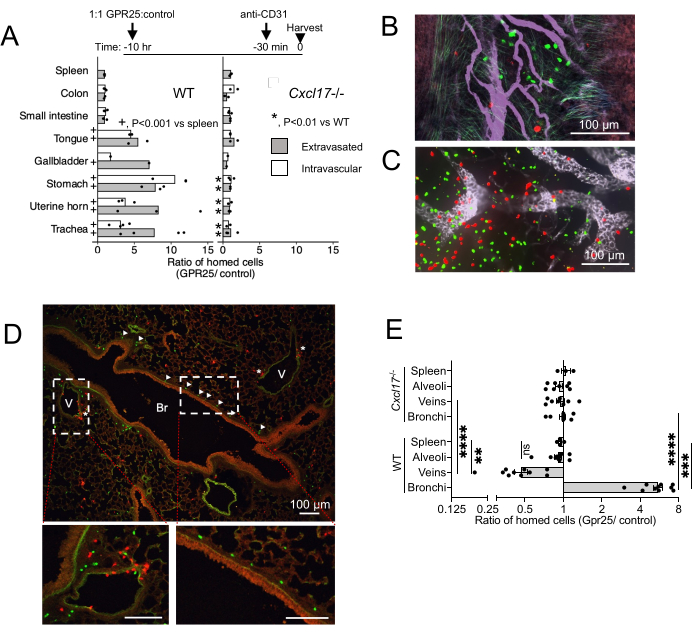
Figura 4: Resultado de la obtención de imágenes confocales a corto plazo. (A) Proporción de GPR25 para células donantes de control 10-12 h después de la inyección, determinada por microscopía confocal de tejidos de montaje completo o secciones congeladas. Las proporciones en el bazo control se determinaron mediante citometría de flujo. Valores p derivados de la prueba exacta de Fisher comparando los recuentos de células en los tejidos diana indicados frente al bazo en los receptores de WT (+) o comparando los recuentos en los tejidos diana en los receptores de CXCL17-/- frente a los receptores de WT (*). Recuentos de células agrupados de 1 (vesícula biliar) o 2-4 experimentos independientes con un ratón por condición y experimento. Se muestran las proporciones medias. (B-D) Imágenes representativas de la tráquea (B), PLN (C) y secciones transversales pulmonares (D) 10 h después de la inyección, que muestran células T CD4 GPR25 (verde) y control (rojo). Las puntas de flecha en (D) indican células GPR25 localizadas en el bronquio (Br); Los asteriscos indican células cerca de las venas (V). (E) La proporción de GPR25 para controlar las células del donante dentro de los microambientes pulmonares indicados: Bronquios: dentro de los 30 μm de la membrana basal bronquial. Vena: a menos de 30 μm del endotelio venoso o en contacto con él. Alvéolos: dentro de los espacios alveolares no adyacentes a las venas o bronquios. Cada punto es la relación dentro de 2-4 campos independientes de 10x para WT y CXCL17, lo que representa ~ 4 mm2. Las proporciones del bazo se duplicaron de (B) para comparar. Los resultados muestran 3 experimentos independientes con 1-2 ratones por experimento y se muestran como media ± SEM. *P < 0,05, **P < 0,01, ***P < 0,001, ****P < 0,0001 vs bazo; WT vs CXCL17-/- (prueba t de dos colas). Esta cifra ha sido modificada de13. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El ensayo de localización controlado internamente descrito en este estudio es un método integral para examinar el tráfico y el posicionamiento de células T mediado por GPCR dentro de diversos órganos y microambientes tisulares. Este enfoque integra varias optimizaciones críticas para mejorar la reproducibilidad, la precisión y la eficiencia.
Un aspecto crítico de este protocolo es la transducción eficiente de células T utilizando vectores retrovirales MSCV, que se ve facilitada por el uso de células Plat-E para la producción viral. Las optimizaciones clave incluyen el mantenimiento de las células Plat-E en la confluencia adecuada, el uso de placas recubiertas de poli-D-lisina para mejorar la transfección viral y el empleo de una estrategia de doble transducción para maximizar la expresión de GPCR. Dado que los vectores MSCV requieren una división celular activa para una integración efectiva del genoma, la inducción de la entrada en el ciclo celular a través de la activación de las células T mejora significativamente la eficiencia de la transducción retroviral. Las altas concentraciones de anticuerpos anti-CD3 y CD28 son críticas para asegurar la activación y el blasting de las células T, que nuestros estudios han encontrado que son más efectivas que las concentraciones más bajas reportadas en otroslugares. También descubrimos que la inclusión de las citocinas IL-2 e IL-7 en el medio de cultivo es vital para mantener la viabilidad de las células T y promover su expansión, lo que garantiza una población robusta de células T sanas y transducidas necesarias para estudios precisos de migración y localización.
Además de optimizar la transducción retroviral, el protocolo permite realizar estudios de localización a largo plazo utilizando marcadores CD45.1/CD45.2 para diferenciar entre células transducidas por GPCR y células de control en experimentos competitivos dentro del mismo huésped. Este enfoque asegura que las células estén expuestas a las mismas señales fisiológicas. La inclusión del marcador Thy1.1 es valiosa para distinguir entre linfocitos T transducidos y no transducidos, especialmente cuando no se dispone de anticuerpos específicos para los GPCR huérfanos. Una alternativa adecuada para algunas aplicaciones sería el uso de proteína fluorescente en lugar del casete Thy1.1.
Para los análisis de células alojadas por FACS, el protocolo emplea anticuerpos anti-CD45 inyectados 5 minutos antes de la recolección de tejido para distinguir entre células circulantes y residentes en tejido, evitando interpretaciones erróneas de los datos de referencia. Para la microscopía confocal, se inyectaron anticuerpos anti-CD31 10-30 minutos antes del sacrificio para marcar los vasos sanguíneos, lo que permitió una visualización precisa de la localización de las células T y distinguir entre las células unidas al endotelio vascular y las células extravasadas. El análisis de imágenes con el software Imaris cuantifica la distancia de las células a los puntos de referencia histológicos, proporcionando información detallada sobre su localización e interacciones microambientales.
La fuerza de este protocolo es la comparación lado a lado del comportamiento de células idénticas que difieren solo en la expresión del receptor transducido. Si bien utilizamos el término convencional de homing competitivo para describir la coinyección y la posterior homing de las células de control y de comparación, reconocemos que este término es técnicamente un nombre inapropiado. En los ensayos a corto plazo, es probable que los mecanismos de reclutamiento de tejidos sean excesivos, lo que hace improbable la competencia real entre las poblaciones celulares. Un término más preciso sería homing comparativo o homing controlado internamente, ya que el protocolo evalúa los comportamientos de homing de forma controlada y comparativa. Además, la migración fisiológica y el homing pueden implicar contribuciones integradas de múltiples receptores quimioatrayentes, que pueden actuar simultánea o secuencialmente para dirigir la migración celular en múltiples pasos en los complejos campos de atrayentes que existen in vivo15. Los linfocitos T activados in vitro en las condiciones que empleamos expresan espontáneamente CXCR3 y probablemente otros GPCR, que, a través de la coordinación con el receptor transducido, pueden influir en la localización final de las células. La transducción retroviral suele dar lugar a una sobreexpresión del gen diana, y hay que tener en cuenta que el nivel de expresión del receptor también podría afectar al homing. Además, la sobreexpresión de un receptor podría, en teoría, alterar las propiedades celulares independientemente de las interacciones receptor-ligando. Para abordar esto, llevamos a cabo la expresión complementaria utilizando ratones CXCL17-/-, que carecen del ligando para GPR25. Este enfoque ayuda a garantizar que los efectos observados estén mediados por el reconocimiento de ligandos afines. Los investigadores que no tienen acceso a cepas knockout específicas podrían incorporar técnicas de shRNA o CRISPR para derribar o eliminar GPCR específicos en las células T. Esta adaptación podría mejorar aún más la versatilidad del protocolo para estudiar la función de GPCR en las células T.
Si bien la transducción retroviral ofrece una alta eficiencia, requiere células que se dividen activamente, lo que puede no reflejar con precisión el comportamiento de las células inactivas. Algunos receptores de quimiocinas exhiben actividad diferencial dependiendo del estado proliferativo de la célula, aunque su especificidad permanece inalterada. Un método alternativo, la electroporación con neón, ha demostrado una alta eficiencia de transfección en células T, aunque de forma transitoria16. Esto puede ser suficiente para ensayos a corto plazo, mientras que MSCV puede producir una expresión estable, lo que lo hace adecuado para estudios a corto y largo plazo. Sin embargo, no hemos encontrado bibliografía que indique que este sistema se ha utilizado para estudios de homeing. Si la eficiencia de la transfección es baja, es posible que necesitemos seleccionar las células utilizando un marcador visible, como la co-transfección con GFP.
Este protocolo proporciona una instantánea estática del tráfico celular, lo que limita la información sobre el comportamiento y la motilidad celular en tiempo real. También tiene limitaciones de resolución inherentes, particularmente para observar estructuras subcelulares y arquitectura de tejidos a escala fina. Para abordar estos desafíos, proponemos el uso de técnicas de imagen avanzadas como la microscopía multifotónica, la imagen de células vivas y la microscopía intravital. Estos métodos ofrecen una mayor resolución espacial, una penetración más profunda en los tejidos y la capacidad de visualizar dinámicamente los procesos celulares. La microscopía intravital, en particular, permite el seguimiento en tiempo real del comportamiento de las células T in vivo, lo que permite observar la migración celular, las interacciones y las respuestas a los estímulos dentro de su contexto nativo. Este enfoque es especialmente potente para evaluar la localización de los tejidos y la localización de los tejidos, ya que revela cómo las células se adaptan dinámicamente a diferentes microentornos. Al integrar estas técnicas de imagen avanzadas, los estudios futuros pueden lograr una comprensión más completa de la motilidad de las células T, las interacciones y la localización mediada por GPCR, lo que mejora significativamente la comprensión de su comportamiento dentro de los tejidos.
El protocolo que proporcionamos ayudará a estudiar las funciones de GPCR en la localización de células inmunitarias y tiene amplias aplicaciones en inmunoterapia, inflamación y autoinmunidad. Además, ofrece nuevas oportunidades para descubrir dianas terapéuticas y mejorar las respuestas inmunitarias mediante la exploración de GPCR no caracterizados previamente en células T dirigidas al cáncer y el abordaje de la localización inapropiada de células T en enfermedades autoinmunes.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Con el apoyo de las subvenciones R01 AI178113 y R01 AI047822 de los NIH, la subvención 1903-03787 de The Leona M. & Harry B. Helmsley Charitable Trust y las subvenciones del Programa de Investigación de Enfermedades Relacionadas con el Tabaco (TRDRP) T31IP1880 y T33IR6609 a E.C.B.; Y.B. recibió el apoyo de un premio Research Fellows Award de la Fundación Americana de Crohn y Colitis (835171). B.O. ha contado con el apoyo de una beca postdoctoral de la Fundación Ramón Areces (Madrid, España) y un Research Fellows Award de la Fundación Americana de Crohn y Colitis (574148). A.A. contó con el apoyo del Instituto de Medicina Regenerativa de California (CIRM) - EDUC2-12677.
Materiales
| Name | Company | Catalog Number | Comments |
| AF647 anti mouse CD90.1-Thy1.1 (OX-7) | Biolegend | 202507 | |
| anti-CD31 (DyLight 633, clone 390) | InvivoMab | BE0377 | |
| anti-mouse CD28 37.51 | eBiosciences | ||
| anti-mouse CD3 145-2c11 | eBiosciences | ||
| APCCy7 anti mouse CD3 (145-2c11) | Biolegend | 100329 | |
| BV421 anti mouse CD8b (Ly-3) | Biolegend | 126629 | |
| BV711 anti mouse CD4 (RM4-5) | Biolegend | 100549 | |
| CD90.1 microbeads | Miltenyi | 130-121-273 | |
| CFSE | Thermoscientific | C34554 | |
| FITC anti mouse CD45.2 (104) | BD | AB_395041 | |
| mouse IL2 | Peprotech | 200-02-50UG | |
| mouse IL7 | Peprotech | 217-17-10UG | |
| Mouse T CD4 isolation kit | STEMCELL technologies | 18000 | |
| MSCV-IRES- Thy1.1 GPR25 | Vectorbuilder | ||
| MSCV-IRES- Thy1.1 Stuffer | Vectorbuilder | ||
| PE-CD45 (30-F11) antibody | Biolegend | 103105 | |
| PECy7 anti mouse TCRb (H57-597) | Tonbo | ||
| PercpCy5.5 anti mouse CD45.1 (A20) | eBiosciences | ||
| Platinum-E (Plat-E) | cell Biolabs. Inc | RV-101 | |
| Yellow fluorescent dye | Thermoscientific |
Referencias
- Cheng, L., et al. Structure, function and drug discovery of GPCR signaling. MolBiomed. 4 (1), 46 (2023).
- Lammermann, T., Kastenmuller, W. Concepts of GPCR-controlled navigation in the immune system. Immunol Rev. 289 (1), 205-231 (2019).
- Fu, H., Ward, E. J., Marelli-Berg, F. M. Mechanisms of t cell organotropism. Cell Mol Life Sci. 73 (16), 3009-3033 (2016).
- Cinalli, R. M., et al. T cell homeostasis requires g protein-coupled receptor-mediated access to trophic signals that promote growth and inhibit chemotaxis. Eur J Immunol. 35 (3), 786-795 (2005).
- Wu, V., et al. Illuminating the onco-GPCRome: Novel g protein-coupled receptor-driven oncocrine networks and targets for cancer immunotherapy. J Biol Chem. 294 (29), 11062-11086 (2019).
- Wu, V. H., et al. The GPCR-alpha(s)-pka signaling axis promotes T-cell dysfunction and cancer immunotherapy failure. Nat Immunol. 24 (8), 1318-1330 (2023).
- Ramezani, A., Hawley, T. S., Hawley, R. G. Stable gammaretroviral vector expression during embryonic stem cell-derived in vitro hematopoietic development. Mol Ther. 14 (2), 245-254 (2006).
- . . Plat-E retroviral packaging cells (RV-101) user manual. , (2024).
- Anderson, J., Hope, T. Intracellular trafficking of retroviral vectors: obstacles and advances. Gene Ther. 12, 1667-1678 (2005).
- Kim, E., et al. Isolation and analyses of lamina propria lymphocytes from mouse intestines. STAR Protoc. 3 (2), 101366 (2022).
- Steinert, E. M., et al. Quantifying Memory CD8 T Cells Reveals Regionalization of Immunosurveillance. Cell. 161 (4), 737-749 (2015).
- Miltenyi Biotec. . CD90.1 MicroBeads mouse and rat. , (2024).
- Ocón, B., et al. A lymphocyte chemoaffinity axis for lung, non-intestinal mucosae and CNS. Nature. 635, 736-745 (2024).
- Sumida, H., et al. Gpr55 regulates intraepithelial lymphocyte migration dynamics and susceptibility to intestinal damage. Sci Immunol. 2 (18), eaao1135 (2017).
- Foxman, E. F., Campbell, J. J., Butcher, E. C. Multistep navigation and the combinatorial control of leukocyte chemotaxis. J. Cell Biol. 139 (5), 1349-1360 (1997).
- Alawar, N., et al. A solution for highly efficient electroporation of primary cytotoxic T lymphocytes. BMC Biotechnol. 24 (1), 16 (2024).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados