Method Article
Конфокальный микроскопический анализ сортировки белков по плазмодесматам у Nicotiana benthamiana
В этой статье
Резюме
Данный протокол описывает выбор оптимальных плазмодезальных маркеров для анализа нацеливания белков на плазмодесматы на основе конфокальной микроскопии во время взаимодействия вирус-плазмодесмат или плазмодесмального транспорта.
Аннотация
Плазмодесматы представляют собой мембранные нанопоры, которые соединяют цитоплазму соседних растительных клеток и обеспечивают межклеточный трафик питательных веществ, макромолекул, а также вторгающихся вирусов. Плазмодесматы играют фундаментальную роль в регуляции межклеточной коммуникации, способствуя развитию растений, реакциям окружающей среды и взаимодействию с вирусными патогенами. Обнаружение плазмодесмальной локализации растительных или вирусных белков может предоставить полезную функциональную информацию о белке и важно для понимания механизмов взаимодействия растений и вирусов. Чтобы облегчить эти исследования, мы описываем протокол анализа различных плазмодесмальных белков-мишеней на основе конфокальной микроскопии для выбора наилучшего плазмодесального маркера для изучения взаимодействия вирус-плазмодесмат или плазмодесмального транспорта. В частности, анализ этих событий проиллюстрирован с использованием белка межклеточного движения (MP) вируса очистки вен репы (TVCV), локализованного белка 5 плазмодесматы Arabidopsis (PDLP5) и каллозного связывающего белка 1 Plasmodesmata (PDCB1). Данные плазмодесальной локализации белков анализируются параллельно с глобальной визуализацией плазмодесмат с использованием анилинового синего окрашивания тканей образца. Эти подходы могут быть легко адаптированы для анализа плазмодесмальной локализации любых клеточных или патогенных белков в подорожке.
Введение
Плазмодесматы (ФД) играют фундаментальную роль в контроле развития растений, реакциях окружающей среды и взаимодействии с вирусными патогенами посредством регуляции межклеточной коммуникации 1,2. ФД первоначально образуется во время цитокинеза, при этом сотни ФД встраиваются в новую клетку между двумя дочерними клетками, обеспечивая таким образом каналы для межклеточной коммуникации 3,4. ФД представляет собой богатую мембраной структуру, содержащую мембрану, полученную из эндоплазматического ретикулума (ЭР), транс-ФД-десмотубулу, в центральной части пор, выстланных плазматической мембраной 3,4. Сравнительные протеомные подходы идентифицировали многочисленные функциональные белки БП, включая β-1,3-глюканазы (БГ), каллоз-синтазы (КАЛС), белки, расположенные в плазмодесматах (ПДЛП), каллез-связывающие белки (ПДКБ), белки трансмембранной области с множественными С2-доменами (MCTP)3 и богатые лейцином повторные рецептороподобные киназы (РЛК)5. Недавно Kirk et al. разработали инструмент под названием plasmodesmata in silico proteome 1 (PIP1), который позволил предсказать новые белки PD у 22 видов растений6. PD изменяется по проницаемости и структуре в процессе развития растений и реакции на различные нагрузки. Отложение каллозы (β-1,3-глюкан) и гидролиз в области шейки, окружающей ПД, является одним из широко известных механизмов регуляции ПД7.
Многие патогенные микробы, включая грибы, бактерии и вирусы, могут манипулировать расширением или структурой БП во время их инфекции 2,8,9. Magnaporthe oryzae, возбудитель рисового бласта, развертывает внутриклеточные инвазивные гифы для перемещения от клетки к клетке через PD8. Бактериальный патоген Pseudomonas syringae pv. Томату требуется эффекторный белок HopO1-1 для межклеточного перемещения и распространения в растении-хозяине через взаимодействие и дестабилизацию PDLP7, тем самым увеличивая молекулярный поток в соседних клетках у Arabidopsis9. Тем не менее, растительные вирусы более универсальны в регуляции БП во время их межклеточной передачи, при этом белок движения вируса (МП) способствует перемещению от клетки к клетке2. Благодаря их важной функции в регулировании развития и роста растений, а также их взаимодействия с патогенными микробами растений, БП привлекают все большее внимание в последние годы. У Arabidopsis thaliana существует два основных типа функциональных белков PD, PDLP (1-8) и PDCB (1-5), и было обнаружено, что многие из них, например, PDLP5 1,10,11, PDLP112, PDLP613, PDLP714 и PDCB115, играют роль в манипулировании проницаемостью PD посредством регуляции отложения каллозы. Тем не менее, было обнаружено, что некоторые PDLP обладают функциональной избыточностью, например, нокаутные мутанты pdlp1 и pdlp1,2 не влияли на молекулярный транспорт, хотя двойные нокаутные мутанты pdlp1,3 и pdlp2,3 показали повышенную плазмодесмальнуюпроницаемость16. Интересно, что подавление/нокаут или сверхэкспрессия PDLP5 в отдельности приводит к увеличению или уменьшению плазмодесальной проницаемости, соответственно 1,17. Недавно Li et al. обнаружили, что PDLP5 и PDLP6 функционируют на различных клеточных интерфейсах13. Эти результаты указывают на то, что PDLP5 может иметь неизбыточные функции с другими PDLP.
В связи с важной функцией БП в межклеточной коммуникации мы разработали протокол для развертывания растительных белков PDLP5 и PDCB1, а также вирусного белка межклеточного движения (MP) вируса очистки вен репы (TVCV) в качестве простых, удобных и надежных маркеров PD для экспериментов в области клеточной биологии. Для дальнейшей верификации параллельно продолжалась визуализация БП с помощью анилинового синего окрашивания отобранных тканей. Описанные протоколы локализации БП PDLP5, PDCB1 и TVCV MP могут быть легко адаптированы для анализа потенциальной локализации БП любых клеточных или патогенных белков в живых растениях.
протокол
Подробная информация о реагентах и оборудовании, использованных в этом исследовании, приведена в Таблице материалов.
1. Рост растений
- Выращивайте семена Nicotiana benthamiana во влажной почве в камере с контролируемой средой при температуре 23 °C при 16 ч света и 8 ч в темноте.
- Примерно через 2 недели осторожно перенесите рассаду с торфяными гранулами вокруг корней в горшки большего размера и продолжайте рост в тех же условиях в течение 4-5 недель для экспериментов по агроинфильтрации.
ПРИМЕЧАНИЕ: Не используйте растения, когда они начинают цвести, так как накопление GFP уменьшится настадии соцветия 18.
2. Векторное построение
- С помощью ПЦР амплифицируют интересующие кодирующие последовательности с помощью высокоточной ДНК-полимеразы Q5 и клонируют их в входной вектор pDONR207 по реакции BP19 с использованием коммерчески доступного набора BP Clonase.
- Перенос генов-мишеней в полученных входных плазмидах в вектор назначения pPZP-RCS2A-nptII-DEST-EGFP-N1 с помощью реакции LR19 с использованием коммерчески доступного набора LR Clonase для получения плазмид с меткой EGFP, слитой с С-концом белков-мишеней.
- Верифицируйте все конструкции методом ПЦР и секвенирования19.
3. Агроинфильтрация
- Streak Agrobacterium tumefaciens EHA105 клеток, содержащих различные векторы на пластинах LB-агара и инкубированных в течение 2 дней при 28 °C.
- Поместите одну колонию в 2 мл бульона LB и инкубируйте в течение ночи при температуре 28 °C с перемешиванием (250 об/мин).
- Удалите 1 мл из ночной культуры, после чего добавьте 4 мл свежего бульона LB и повторно закваливайте в течение 1 ч в тех же условиях.
- Отрегулируйте бактериальную суспензию до OD600 = 0,1 (OD600 = 0,2 для совместной экспрессии двух белков) с помощью инфильтрационного буфера (MgCl2, 10 мМ; MES, 10 мМ, pH 5,6).
- Смешайте различные бактериальные суспензии в соотношении 1:1 (v/v), чтобы получить конечную концентрацию OD600 = 0,1. (необязательно).
- Бактериальную суспензию инкубировать при комнатной температуре в течение 3 ч при мягком перемешивании.
- Проникните в абаксиальную поверхность полностью раскрывшихся листьев с разных растений с помощью одноразового шприца объемом 1 мл и отметьте инфильтрированный участок (более темного цвета, чем окружающая неинфильтрированная ткань) водонепроницаемой ручкой.
- Перейдите к разделу «Конфокальная микроскопия» данного протокола (шаг 5).
ПРИМЕЧАНИЕ: Можно также использовать другие штаммы Agrobacterium tumefaciens, пригодные для трансформации интересующих видов растений.
4. Анилиновый синий морилка
- Добавьте аликвоту 200 мкл 1% анилинового синего (в 50 мМ буфере фосфата калия, pH 8,0) на предметное стекло микроскопа20.
- Иссеките инфильтрированный участок размером примерно от 0,5 см × 0,5 см от вены с помощью лезвия и перенесите образцы тканей листа в раствор анилинового синего цвета (абаксиальной стороной вверх) на предметное стекло микроскопа, убедитесь, что образцы тканей листа погружены в раствор анилинового синего, а затем накройте его покровным стеклом (22 мм x 50 мм).
- Поместите предметные стекла микроскопа с образцами в эксикатор, подключенный к вакуумному насосу, и вакуумируйте в течение 2 мин (<0,8 Па), после чего медленно сбросьте давление и инкубируйте в темноте в течение 30 мин при комнатной температуре.
- Визуализируйте флуоресцентный сигнал анилинового синего цвета под лазерным сканирующим конфокальным микроскопом с помощью совместимого программного обеспечения.
ПРИМЕЧАНИЕ: Здесь был использован метод окрашивания анилиновым синим цветом по Huang et al.20 . В модификации этой методики тот же эксперимент был проведен без 2-минутного вакуумного шага, что дало аналогичные результаты и показало, что вакуумная сушка не является существенной для анилинового окрашивания. Кроме того, концентрация анилинового синего пятна и время окрашивания могут варьироваться в зависимости от источника ткани листа и т.д.
5. Конфокальная микроскопия
- Соберите два листа с двух растений в разные моменты времени после проникновения. Разрежьте лезвием зону инфильтрации примерно на 0,5 см × 0,5 см срезов от жилы.
- Поместите образцы тканей в каплю стерильной воды (абаксиальной стороной вверх) в центральную часть предметного стекла микроскопа и накройте их покровным стеклом (22 мм x 50 мм), стараясь не допустить образования пузырьков.
- Убедитесь, что длины волн возбуждения для детектирования сигналов CFP, GFP и RFP составляют 405 нм, 488 нм и 561 нм соответственно, а эмиссионные фильтры для детектирования составляют 410–602 нм для CFP и 400–602 нм для EGFP и RFP, с отверстием 1 а.е. и общим усилением 769 В.
- Визуализируйте флуоресцентный сигнал автофлуоресцентных меток в инфильтрируемой зоне с помощью лазерного сканирующего конфокального микроскопа с совместимым программным обеспечением через 1, 2, 3, 5, 7 и 10 дней после инфильтрации.
- Используйте объектив с 10-кратным увеличением и фильтры GFP для определения местоположения клеток с флуоресцентным сигналом, а затем переключитесь на объектив с 40-кратным увеличением для визуализации субклеточной локализации и записи изображений.
- Соберите 20 изображений для каждого состояния, используя по крайней мере две независимые биологические реплики.
- Оценка локализации ПД исследуемого белка основана на диагностическом точечном появлении сигнала на периферии клетки21,22.
Примечание: При обнаружении субклеточной локализации неизвестного белка рекомендуется использовать не менее трех растений.
6. Анализ данных
- Используйте программное обеспечение Fiji для разделения каналов и добавления масштабной линейки к изображениям для визуализации.
- Используйте программное обеспечение Fiji для разделения каналов перед измерением среднего значения оттенков серого для каждого изображения, чтобы оценить интенсивность флуоресценции GFP (для MP, PDCB1 и PDLP5) или CFP (для анилинового окрашивания в синий цвет) в разные моменты времени.
- Используйте программное обеспечение Fiji для разделения каналов перед нормализацией изображений GFP (для MP, PDCB1 и PDLP5) или CFP (для анилинового окрашивания в синий цвет). Измерялась площадь изображения, а PD puncta подсчитывались вручную. Рассчитывали количество PD puncta на 100мкм2 .
- Используйте двустороннюю ANOVA с тестом23 множественных сравнений Тьюки для определения P-значений между различными выборками и разными временными точками с помощью статистического и графического программного обеспечения.
ПРИМЕЧАНИЕ: Для одноканального флуоресцентного изображения значение оттенков серого каждого пикселя представляет интенсивность флуоресценции этой точки24. Здесь среднее значение оттенков серого использовалось для оценки интенсивности флуоресценции каждого образца в разные моменты времени.
Результаты
Для облегчения изучения функции БП в физиологии растений и взаимодействия с патогенами были разработаны три простых и надежных референсных белка для локализации БП. Были выбраны два клеточных белка PD и патогенный MP-белок, кодируемый растительным тобамовирусом TVCV. Субклеточную локализацию этих белков визуализировали с помощью автофлуоресцентного репортера EGFP, слитого с С-концом каждого белка. В альтернативном подходе ФД визуализировали с помощью анилинового синего окрашивания отложений каллозы, ассоциированных с ФД. Эксперименты показали, что как PDLP5, так и MP демонстрируют точечную локализацию PD, при этом MP также локализуется в ядре клетки (рис. 1A), как отмечалось ранее25. В отличие от этого, PDCB1, по-видимому, разделяется между PD и ER (рис. 1A). Для исследователей, менее опытных в интерпретации субклеточной локализации GFP-меченых белков, рисунок 1A также иллюстрирует характерный нуклеоцитоплазматический паттерн EGFP, экспрессируемого в растительных клетках. Чтобы подтвердить сигнал ER PDCB1, мы совместно экспрессировали PDCB1 с маркером ER и обнаружили, что сигнал PDCB1 перекрывает сигнал маркера ER (рис. 1B). Для оценки эффективности локализации БД исследуемых белков был рассчитан процент клеток, экспрессирующих флуоресцентный сигнал, которые проявили БП-локализацию этого сигнала (табл. 1).
Для идентификации субклеточной локализации с использованием референсных белков полезно понимать временную шкалу экспрессии референсного белка и потенциальные изменения его локализации. На рисунке 2 показана такая кинетика для MP, PDLP5 и PDCB1, когда сами PD визуализировались с помощью анилинового синего окрашивания. И МП, и PDLP5 начали накапливаться на ПД уже через сутки после инфильтрации (dpi), и это накопление достигло видимого максимума при 2 dpi, оставаясь стабильным еще 5 дней, после чего интенсивность сигнала снизилась, скорее всего, из-за деградации белка. Временной ход субклеточной сортировки PDCB1 был более сложным: для первых 3 точек на дюйм PDCB1 демонстрировал сравнительно сильный сигнал ER, который почти полностью скрывал локализацию специфического сигнала PD, тогда как при 5 dpi этот последний сигнал становился более выраженным (рис. 2), хотя и в меньшем количестве клеток. Интересно, что появление четкого паттерна локализации PDCB1 PDCB1 после 5 dpi совпало со значительно меньшим количеством клеток, демонстрирующих сигнал EGFP (дополнительный рисунок 1). Таким образом, PDLP5 и MP могут функционировать как референсные белки PD с небольшим фоном в большинстве других клеточных компартментов, с оптимальным временным окном визуализации 2-5 dpi. PDCB1, с другой стороны, не так подходит, как маркер PD.
Затем было подтверждено, что маркеры БП сохраняют свою специфичность субклеточной локализации в присутствии других белков БП. С этой целью MP-EGFP или PDLP5-EGFP экспрессировали совместно с PD-локализующими26 МП другого растительного вируса, вируса табачной мозаики (TMV), меченного CFP. На рисунке 3 показано, что в обоих случаях ко-экспрессируемые белки демонстрировали четкую картину локализации БП. Аналогичным образом, специфичное для PD гистологическое анилиновое окрашивание тканей, экспрессирующих MP-EGFP или PDLP5-EGFP, не обнаружило никаких помех для локализации ФД сигналов EGFP и анилинового синего (рис. 3).
Исследования локализации БП часто выигрывают от более количественной оценки общей экспрессии референсного белка и сигнала БП. Этот подход к количественной оценке проиллюстрирован на рисунках 4 и 5. Для количественной оценки общей экспрессии измеряли интенсивность сигнала PDLP5 и MP. Оба белка демонстрировали сильные сигналы во всех временных точках визуализации в течение периода 10 dpi, с максимальной интенсивностью сигнала при 3 dpi для PDLP5 и при 2 dpi для MP (рис. 4). Статистически значимых различий в интенсивности сигнала между PDLP5 и MP не было выявлено ни в одной из временных точек визуализации. Интенсивность сигнала PDCB1 демонстрировала большие колебания между временными точками, при этом самый сильный сигнал наблюдался при 7 dpi (Рисунок 4), хотя в этот момент было трудно собрать статистически значимые данные из-за нехватки экспрессирующих клеток. Таким образом, первые 3 dpi представляют собой оптимальное время для обнаружения экспрессии PDCB1. Как и ожидалось, образцы анилинового синего цвета показали более стабильный сигнал, чем временно экспрессируемые белки (рис. 4).
Затем были количественно определены PD puncta, образованные PDLP5 и MP. PDLP5 показал стабильное количество PD puncta на протяжении всего периода наблюдения, без статистически значимых различий между любыми двумя из исследуемых временных точек (рис. 5). Наибольшее количество PD puncta, образованных MP, было обнаружено при 2 dpi, и они оставались относительно стабильными до конца периода наблюдения. Сравнение количества PD puncta между PDLP5 и MP не выявило статистически значимых различий в большинстве случаев выборки (рис. 5). Количество PD puncta, окрашенных анилиновым синим, также оставалось стабильным, хотя оно несколько снизилось на уровне 10 dpi. Количество PD puncta, обозначенных анилиновым синим, PDLP5 или MP, было сходно друг с другом со статистической значимостью (рис. 5), что согласуется со специфичностью PD этих маркеров. Количество PD puncta для PDCB1 не анализировалось, потому что в более ранние моменты времени сигнал PD был затемнен сигналом ER, а в более поздние моменты времени он наблюдался только в относительно небольшом числе клеток (см. рис. 2).

Рисунок 1: Плазмодесматы (ПД) локализация TVCV MP, PDLP5 и PDCB1 транзиторно экспрессируются в Nicotiana benthamiana и анилиновом синем окрашивании ПД. (A) Локализация ПД MP-EGFP, PDLP5-EGFP и PDCB1-EGFP и анилиновое окрашивание. Сигнал EGFP отображается зеленым цветом, анилиновый синий сигнал — синим, а пластидная автофлуоресценция — красным. (B) Коэкспрессия MP-EGFP, PDLP5-EGFP и PDCB1-EGFP с маркером эндоплазматического ретикулума (ER), помеченным mRFP. Изображения были записаны через 2 дня после инфильтрации (dpi) и представляют собой одиночные конфокальные срезы, репрезентативные для двух независимых экспериментов (N = 20 изображений с 2 растений). Сигнал EGFP обозначен зеленым цветом, сигнал mRFP — фиолетовым, а пластидная автофлуоресценция — красным. Желтые стрелки указывают на PDCB1, локализованный в ER. Масштабные линейки = 5 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Временной ход локализации БП PD-PR MP, PDLP5 и PDCB1, временно экспрессируемых у Nicotiana benthamiana , и окрашивания PD в анилиновый синий. Изображения были записаны с разрешением 2 dpi и представляют собой отдельные конфокальные срезы, репрезентативные для двух независимых экспериментов (N = 20 изображений с 2 растений для всех систем, за исключением 7 dpi и 10 dpi для PDCB1-EGFP, в которых меньшее количество клеток проявляло сигнал). Сигнал EGFP обозначен зеленым цветом, а сигнал анилинового синего — синим. Масштабные линейки = 5 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
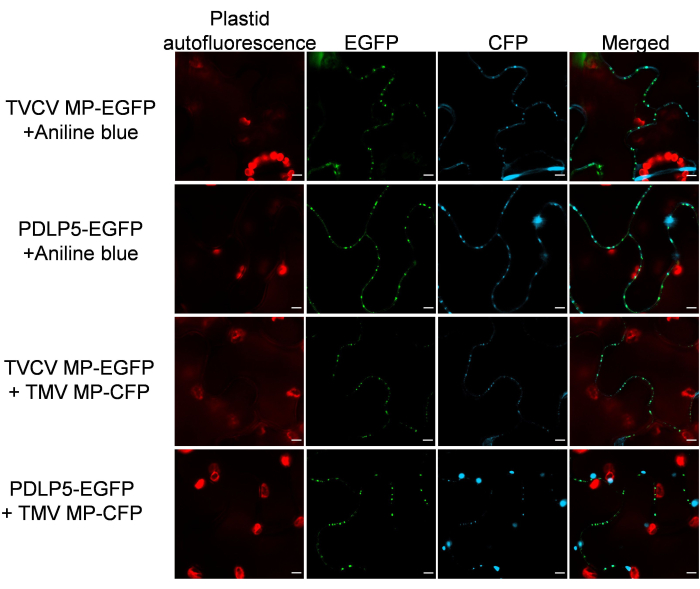
Рисунок 3: TVCV MP и PDLP5 сохраняют свою PD-локализацию после совместной экспрессии с PD-локализующим TMV MP и костейнинга с анилиновым синим. Изображения были записаны с разрешением 2 dpi и представляют собой отдельные конфокальные срезы, репрезентативные для N ≥ 10 изображений с 4-6 растений. Сигнал EGFP отображается зеленым цветом, сигнал CFP и анилиновый синий сигнал — синим, а автофлуоресценция пластид — красным. Масштабные линейки = 5 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
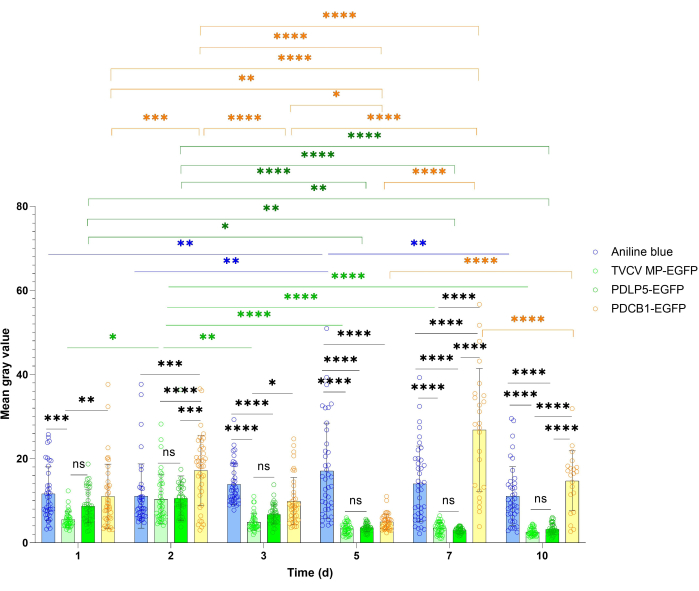
Рисунок 4: Временной ход интенсивности флуоресценции TVCV MP, PDLP5 и PDCB1, временно экспрессируемых при окрашивании Nicotiana benthamiana и анилиновым синим PD. Количественные данные были собраны из экспериментов, описанных на рисунке 2. Полосы погрешностей представляют собой стандартное отклонение среднего значения по результатам нескольких экспериментов. Отдельные точки данных указываются в качестве среднего значения для каждого измерения. Различия между средними значениями, оцененными с помощью двустороннего ANOVA с помощью теста множественных сравнений Тьюки, являются статистически значимыми для P-значений. *P < 0,05, **P < 0,01, а ***P < 0,001, ****P < 0,0001; ns, не является статистически значимым. Синие полосы, анилиновое окрашивание; светло-зеленые полосы, MP-EGFP, темно-зеленые полосы, PDLP5-EGFP; желтые полосы, PDCB1-EGFP. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Временной ход формирования PD puncta с помощью TVCV MP и PDLP5, временно экспрессируемых в Nicotiana benthamiana , и при окрашивании PD в анилиновый синий цвет. Количественные данные были собраны из экспериментов, описанных на рисунке 2. Полосы погрешностей представляют собой стандартное отклонение среднего значения по результатам нескольких экспериментов. Отдельные точки данных указываются в качестве среднего значения для каждого измерения. Различия между средними значениями, оцененными с помощью двустороннего ANOVA с помощью теста множественных сравнений Тьюки, являются статистически значимыми для P-значений. *P < 0,05, **P < 0,01, ***P < 0,001, ****P < 0,0001. Синие полосы, анилиновое окрашивание; светло-зеленые полосы, MP-EGFP, темно-зеленые полосы, PDLP5-EGFP. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Эксперимент I | ||||
| Всего ячеек | Клетки с локализацией ПД | Соты со смешанным сигналом | Клетки с локализацией ПД (%) | |
| Анилиновый синий | 40 | 40 | 4 | 100 |
| МП-ЭГФП | 40 | 40 | 4 | 100 |
| PDCB1-EGFP | 40 | 3 | 38 | 7.5 |
| PDLP5-EGFP | 40 | 40 | 0 | 100 |
| Эксперимент II | ||||
| Всего ячеек | Клетки с локализацией ПД | Соты со смешанным сигналом | Клетки с локализацией ПД (%) | |
| Анилиновый синий | 40 | 40 | 8 | 100 |
| МП-ЭГФП | 40 | 39 | 8 | 97.5 |
| PDCB1-EGFP | 40 | 12 | 31 | 30 |
| PDLP5-EGFP | 40 | 39 | 2 | 97.5 |
Таблица 1: Эффективность локализации ПД.
Дополнительный рисунок 1: Локализация ПД TVCV MP, PDLP5 и PDCB1, временно экспрессируемых у Nicotiana benthamiana. Изображения были записаны с разрешением 5 dpi (A), 7 dpi (B) и 10 dpi (C). Сигнал EGFP имеет зеленый цвет, а автофлуоресценция пластид — красный. Масштабные линейки = 20 μм. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
Любые клеточные биологические исследования межклеточной коммуникации растений и межклеточного транспорта при нормальном развитии растений и морфогенезе, а также при взаимодействии растений с патогенами требуют обнаружения и мониторинга сортировки белков, как эндогенных, так и кодируемых патогенами, в межклеточных связях растений, плазмодесматах (ПД). Эти эксперименты можно было бы существенно облегчить за счет использования эталонных белков, как эндогенных, так и патогенных, которые точно и последовательно локализуются в БП, украшая и визуализируя эти структуры. Эта потребность удовлетворяется путем выбора трех известных PD-локализующих белков: Arabidopsis PDLP5 и PDCB1, а также MP из тобамовирусного патогена TVCV. Эти белки были помечены на их С-концах автофлуоресцентным репортером EGFP, и способность полученных гибридных белков сортироваться до PD была определена после их переходной экспрессии в листьях Nicotiana benthamiana и конфокального микроскопического анализа экспрессирующих тканей. Для общей визуализации БП в этих тканях использовался стандартный метод окрашивания анилиновым синим.
Считается, что МП растительных вирусов делятся на две большие группы в отношении их влияния на структуру и целостность ПД: МП, которые увеличивают проницаемость ПД обратимо и без каких-либо структурных изменений в ПД, и МП, которые ограничивают ПД путем модификации своей структуры. МП тобамовирусов, таких как TVCV, относятся к первой группе МП, позиционируя их как привлекательные маркеры БП для исследований субклеточной локализации27,28.
Эти эксперименты позиционировали PDLP5-EGFP и MP-EGFP как надежные и воспроизводимые биологические маркеры БП, с эффективностью обнаружения БП, сопоставимой с эффективностью анилинового синего красителя. Локализация PDLP5-EGFP и MP-EGFP с точки зрения ПД выявлена на протяжении всего периода наблюдения 10 dpi, при этом оптимальное время для наблюдения характерной картины локализации PD было установлено в диапазоне от 2 до 3 dpi. Несмотря на то, что экспрессия промотора 35S может привести к посттранскрипционному сайленсингу экспрессируемого гена, это часто происходит после длительной экспрессии у стабильно трансгенных растений. С другой стороны, использование этого сильного конститутивного промотора важно для легкого обнаружения маркерного белка. Если экспрессия референсного белка снижается после 7-10 dpi, следует использовать более короткие периоды, т.е. 2-3 dpi. Существенных различий в общей картине субклеточной локализации между PDLP5 и MP здесь не обнаружено, за исключением того, что MP накапливался в ядре клетки в дополнение к PD. И наоборот, PDCB1 не рекомендуется использовать в качестве маркера PD как такового из-за сложности его субклеточной локализации, которая включает в себя существенную локализацию в ER.
Легкость детектирования сигнала флуоресценции EGFP также зависела от стадии роста растения; в частности, у N. benthamiana наименьшее накопление сигнала EGFP было отмечено на18-й стадии соцветия.
Целью данного исследования была разработка маркеров локализации БП, максимально эксклюзивных для других субклеточных компартментов. Таким образом, их использование в качестве референсов для локализации представляющих интерес белков с дополнительными возможностями субклеточной локализации должно сочетаться с экспрессией других субклеточных маркеров, таких как специфичные для ER, митохондрий, плазматической мембраны и т. д. В этом случае включение дополнительных клеток Agrobacterium для экспрессии этих маркеров следует учитывать при расчете конечной концентрации агроинфильтрационных культур, т.е. OD600 жидких культур. Очевидно, что концентрация клеток и время роста растений должны быть адаптированы для выявления максимальной экспрессии и локализации ЧР у других видов растений.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Работа в лаборатории VC была поддержана грантами NIH (R35GM144059), NSF (MCB 1913165 и IOS 1758046) и BARD (IS-5276-20) для VC. Спонсоры не играли никакой роли в дизайне исследования, сборе и интерпретации данных, а также в принятии решения о публикации.
Материалы
| Name | Company | Catalog Number | Comments |
| ABT AC 1 phase motor | BRANDTECH | ABF63/4C-7RQ | |
| Agrobacterium tumefaciens EHA105 | |||
| Contamination control | CCI | ||
| Gateway BP Clonase II Enzyme mix | Invitrogen | #11789020 | |
| Gateway LR Clonase II Enzyme mix | Invitrogen | #11791020 | |
| GraphPad Prism 8.0.1. | GraphPad Software Inc. | ||
| Image J | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation | ||
| Laser scanning confocal microscope | Zeiss | LSM 900 | |
| Nicotiana benthamiana | Plant species | ||
| pDONR207 | Invitrogen | #12213013 | |
| Q5 High-Fidelity DNA Polymerase | NEB | #M0491S |
Ссылки
- Lee, J., et al. A plasmodesmata-localized protein mediates crosstalk between cell-to-cell communication and innate immunity in Arabidopsis. The Plant Cell. 23 (9), 3353-3373 (2011).
- Benitez-Alfonso, Y., Faulkner, C., Ritzenthaler, C., Maule, A. J. Plasmodesmata gateways to local and systemic virus infection. Mol Plant-Microbe Interact. 23 (11), 1403-1412 (2010).
- Bayer, E. M., Benitez-Alfonso, Y. Plasmodesmata: Channels under pressure. Annu Rev Plant Biol. 75, 21(2024).
- Maule, A. J. Plasmodesmata: Structure, function and biogenesis. Curr Opin Plant Biol. 11, 680-686 (2008).
- Fernandez-Calvino, L., et al. Arabidopsis plasmodesmal proteome. PLoS One. 6 (4), e18880(2011).
- Kirk, P., Amsbury, S., German, L., Gaudioso-Pedraza, R., Benitez-Alfonso, Y. A comparative meta-proteomic pipeline for the identification of plasmodesmata proteins and regulatory conditions in diverse plant species. BMC Biol. 20, 128(2022).
- Levy, A., Erlanger, M., Rosenthal, M., Epel, B. L. A plasmodesmata-associated β-1,3-glucanase in Arabidopsis. The Plant J. 49 (4), 669-682 (2007).
- Kankanala, P., Czymmek, K., Valent, B. Roles for rice membrane dynamics and plasmodesmata during biotrophic invasion by the blast fungus. The Plant Cell. 19 (2), 706-724 (2007).
- Aung, K., et al. Pathogenic bacteria target plant plasmodesmata to colonize and invade surrounding tissues. The Plant Cell. 32 (3), 595-611 (2020).
- Cui, W., Lee, J. Arabidopsis callose synthases CalS1/8 regulate plasmodesmal permeability during stress. Nat Plants. 2 (5), 160(2016).
- Liu, N. J., et al. Phytosphinganine affects plasmodesmata permeability via facilitating PDLP5-stimulated callose accumulation in Arabidopsis. Mol Plant. 13 (1), 128-143 (2020).
- Caillaud, M. C., et al. The plasmodesmal protein PDLP1 localizes to haustoria-associated membranes during downy mildew infection and regulates callose deposition. PLoS Pathog. 10 (11), e1004496(2014).
- Li, Z., Su-Ling, L., Christian, M., Walley, J. W., Aung, K. Plasmodesmata-located protein 6 regulates plasmodesmal function in Arabidopsis vasculature. The Plant Cell. , (2024).
- Chen, X., et al. Arabidopsis PDLP7 modulated plasmodesmata function is related to BG10-dependent glucosidase activity required for callose degradation. Sci Bull. , (2024).
- Simpson, C., Thomas, C., Findlay, K., Bayer, E., Maule, A. J. An Arabidopsis GPI-anchor plasmodesmal neck protein with callose binding activity and potential to regulate cell-to-cell trafficking. The Plant Cell. 21 (2), 581-594 (2009).
- Thomas, C. L., Bayer, E. M., Ritzenthaler, C., Fernandez-Calvino, L., Maule, A. J. Specific targeting of a plasmodesmal protein affecting cell-to-cell communication. PLoS Biol. 6 (1), e7(2008).
- Lim, G., et al. Plasmodesmata localizing proteins regulate transport and signaling during systemic acquired immunity in plants. Cell Host Microbe. 19 (4), 541-549 (2016).
- Sheludko, Y. V., Sindarovska, Y. R., Gerasymenko, I. M., Bannikova, M. A., Kuchuk, N. V. Comparison of several Nicotiana species as hosts for high-scale Agrobacterium-mediated transient expression. Biotechnol Bioeng. 96 (3), 608-614 (2007).
- Walhout, A. J. M., et al. GATEWAY recombinational cloning: Application to the cloning of large numbers of open reading frames or ORFeomes. Methods Enzymol. 328, 575-592 (2000).
- Huang, C., et al. dsRNA-induced immunity targets plasmodesmata and is suppressed by viral movement proteins. The Plant Cell. 35 (10), 3845-3869 (2023).
- Roberts, I. M., et al. Dynamic changes in the frequency and architecture of plasmodesmata during the sink-source transition in tobacco leaves. Protoplasma. 218, 31-44 (2001).
- Yuan, C., Lazarowitz, S. G., Citovsky, V. The plasmodesmal localization signal of TMV MP is recognized by plant synaptotagmin SYTA. mBio. 9 (4), e01314-e01318 (2018).
- Ward, S. J., Ramirez, M. D., Neelakantan, H., Walker, E. A. Cannabidiol prevents the development of cold and mechanical allodynia in paclitaxel-treated female C57Bl6 mice. Anesth Analg. 113 (4), 947-950 (2011).
- Erkkilä, M. T., et al. Widefield fluorescence lifetime imaging of protoporphyrin IX for fluorescence-guided neurosurgery: An ex vivo feasibility study. J Biophotonics. 12 (6), e201800378(2019).
- Levy, A., Zheng, J. Y., Lazarowitz, S. G. The tobamovirus Turnip vein clearing virus 30-kilodalton movement protein localizes to novel nuclear filaments to enhance virus infection. J Virol. 87 (11), 6428-6440 (2013).
- Yuan, C., Lazarowitz, S. G., Citovsky, V. Identification of a functional plasmodesmal localization signal in a plant viral cell-to-cell-movement protein. mBio. 7 (1), e2052-e2015 (2016).
- Kumar, G., Dasgupta, I. Variability, functions and interactions of plant virus movement proteins: what do we know so far. Microorganisms. 9 (4), 695(2021).
- Waigmann, E., Ueki, S., Trutnyeva, K., Citovsky, V. The ins and outs of nondestructive cell-to-cell and systemic movement of plant viruses. Crit Rev Plant Sci. 23 (3), 195-250 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены