Method Article
ניתוח מיקרוסקופיה קונפוקלית של מיון חלבונים לפלסמודסמאטה בניקוטיאנה בנטמיאנה
In This Article
Summary
פרוטוקול זה מתאר את הבחירה של סמנים פלסמודסמליים אופטימליים עבור ניתוחים מבוססי מיקרוסקופיה קונפוקלית של מיקוד חלבונים לפלסמודסמאטה במהלך אינטראקציות וירוס-פלסמודסמאטה או הובלה פלסמודסמלית.
Abstract
פלסמודסמאטה הן ננו-נקבוביות קרומיות המחברות את הציטופלסמה של תאי צמח סמוכים ומאפשרות מעבר בין תאים של חומרי מזון, מקרומולקולות וכן וירוסים פולשים. פלסמודסמאטה ממלאת תפקידים בסיסיים בוויסות התקשורת הבין-תאית, ותורמת להתפתחות צמחים, תגובות סביבתיות ואינטראקציות עם פתוגנים נגיפיים. גילוי לוקליזציה פלסמודזמלית של חלבונים צמחיים או נגיפיים יכול לספק מידע פונקציונלי שימושי על החלבון, והוא חשוב להבנת המנגנונים של אינטראקציות צמחים-וירוסים. כדי להקל על מחקרים אלה, אנו מתארים פרוטוקול לניתוח מבוסס מיקרוסקופיה קונפוקלית של חלבוני מיקוד פלסמודסמליים שונים כדי לבחור את הסמן הפלסמודסמלי הטוב ביותר לחקר אינטראקציות וירוס-פלסמודסמאטה או הובלה פלסמודסמלית. באופן ספציפי, הניתוחים של אירועים אלה מודגמים באמצעות חלבון תנועת תא לתא (MP) של וירוס ניקוי ורידים לפת (TVCV), Arabidopsis Plasmodesmata-Localized Protein 5 (PDLP5) וחלבון קושר פלסמודסמאטה קלוז 1 (PDCB1). נתוני הלוקליזציה של חלבונים מנותחים במקביל להדמיה הגלובלית של פלסמודסמאטה באמצעות צביעה כחולה אנילין של הרקמות שנדגמו. גישות אלה יכולות להיות מותאמות בקלות כדי לנתח את הלוקליזציה פלסמודזמלית של כל חלבונים תאיים או פתוגניים בצמח.
Introduction
פלסמודסמאטה (PD) ממלאת תפקיד בסיסי בבקרת התפתחות צמחים, תגובות סביבתיות ואינטראקציות עם פתוגנים נגיפיים באמצעות ויסות התקשורת הבין-תאית 1,2. פרקינסון נוצר בתחילה במהלך ציטוקינזיס, כאשר מאות פרקינסון מוחדרים לתא החדש בין שני תאי הבת, ובכך מספקים את התעלות לתקשורת בין תאים 3,4. PD הוא מבנה עשיר בקרום, המכיל את הממברנה הנגזרת מהרשתית האנדופלסמית (ER), desmotubule trans-PD, בחלק המרכזי של הנקבוביות המרופדות על ידי קרום פלזמה 3,4. גישות פרוטאומיות השוואתיות זיהו חלבונים פונקציונליים רבים של פרקינסון, כולל β-1,3-גלוקנאזות (BGs), סינתזות קלוזה (CALS), חלבונים הממוקמים בפלזמודסמאטה (PDLPs), חלבונים קושרי יבלות (PDCBs), חלבוני אזור טרנסממברנה מרובים (MCTPs)3 וקינאזות דמויות קולטן חוזר עשיר בלאוצין (RLK)5. לאחרונה, קירק ועמיתיו פיתחו כלי שנקרא פלסמודסמאטה בסיליקו פרוטאום 1 (PIP1), שאיפשר לחזות חלבוני פרקינסון חדשים ב-22 מיני צמחים6. מחלת פרקינסון משתנה בחדירות ובמבנה במהלך התפתחות הצמח ובתגובה לעקות שונות. שקיעת קלוזה (β-1,3-גלוקן) והידרוליזה באזור הצוואר סביב מחלת פרקינסון היא אחד המנגנונים הידועים של ויסות פרקינסון7.
חיידקים פתוגניים רבים, כולל פטריות, חיידקים ונגיפים, יכולים להשפיע על התרחבות או מבנה מחלת פרקינסון במהלך ההדבקה שלהם 2,8,9. Magnaporthe oryzae, הגורם הסיבתי לפיצוץ אורז, פורס קורים פולשניים תוך-תאיים כדי לעבור מתא לתא באמצעות PD8. פתוגן חיידקי Pseudomonas מזרקים pv. עגבנייה זקוקה לחלבון משפיע HopO1-1 לתנועה בין-תאית והתפשטות בצמח המארח באמצעות אינטראקציה עם PDLP7 ומערער יציבות, ובכך מגביר את השטף המולקולרי בתאים שכנים בארבידופסיס9. עם זאת, נגיפים צמחיים הם רב-תכליתיים יותר בוויסות מחלת פרקינסון במהלך ההעברה הבין-תאית שלהם, כאשר חלבון התנועה הנגיפית, MP, מקדם תנועה מתאלתא 2. בשל תפקידם החשוב בוויסות התפתחות וצמיחת צמחים, כמו גם האינטראקציה שלהם עם חיידקים פתוגניים צמחיים, מחלת פרקינסון זוכה לתשומת לב גוברת בשנים האחרונות. בארבידופסיס תאליאנה, ישנם שני סוגים עיקריים של חלבונים פונקציונליים של פרקינסון, PDLPs (1-8) ו-PDCB (1-5), ורבים מהם, למשל, PDLP5 1,10,11, PDLP112, PDLP613, PDLP714 ו-PDCB115, נמצאו כממלאים תפקיד במניפולציה של חדירות PD באמצעות ויסות של שקיעת קלוזה. עם זאת, חלק מה-PDLPs נמצאו בעלי יתירות תפקודית, למשל, מוטציות נוקאאוט של pdlp1 ו-pdlp1,2 לא השפיעו על הסחר המולקולרי, אם כי מוטציות נוקאאוט כפולות של pdlp1,3 ו-pdlp2,3 הראו חדירות פלסמודזמלית מוגברת16. באופן מעניין, ירידה ברגולציה/נוקאאוט או ביטוי יתר של PDLP5 בלבד גורמים לעלייה או ירידה בחדירות פלסמודזמלית, בהתאמה 1,17. לאחרונה, Li et al. מצאו כי PDLP5 ו- PDLP6 פועלים בממשקי תאים שונים13. תוצאות אלה מצביעות על כך של-PDLP5 עשויות להיות פונקציות שאינן יתירות עם PDLPs אחרים.
בשל התפקיד הקריטי של מחלת פרקינסון בתקשורת בין-תאית, פיתחנו פרוטוקול לפריסת חלבוני PDLP5 ו-PDCB1 צמחיים ואת חלבון התנועה הנגיפי מתא לתא (MP) של נגיף ניקוי ורידים לפת (TVCV) כסמני PD פשוטים, נוחים ואמינים לניסויים בביולוגיה של התא. לאימות נוסף, הדמיה של PD באמצעות צביעה כחולה אנילין של הרקמות שנדגמו המשיכה במקביל. ניתן להתאים בקלות את הפרוטוקולים המתוארים עבור לוקליזציה של PDLP5, PDCB1 ו-TVCV MP כדי לנתח לוקליזציה פוטנציאלית של PD של חלבונים תאיים או חלבונים שמקורם בפתוגן בצמחים חיים.
Protocol
פרטי הריאגנטים והציוד ששימש במחקר זה מפורטים בטבלת החומרים.
1. גידול צמחים
- לגדל זרעי Nicotiana benthamiana באדמה רטובה בתא סביבה מבוקרת ב 23 °C (75 °F) תחת 16 שעות של אור ו 8 שעות של חושך.
- לאחר כשבועיים, מעבירים בזהירות את השתילים עם כדורי הכבול סביב שורשיהם לעציצים גדולים יותר וממשיכים לצמוח באותם תנאים במשך 4-5 שבועות לניסויי ההסתננות.
הערה: אין להשתמש בצמחים כאשר הם מתחילים לפרוח, מכיוון שהצטברות GFP תפחת בשלב התפרחת18.
2. בנייה וקטורית
- השתמש ב- PCR כדי להגביר את רצפי הקידוד המעניינים עם Q5 High-Fidelity DNA Polymerase ולשכפל אותם לווקטור הכניסה pDONR207 על ידי תגובת BP19 באמצעות ערכת BP Clonase זמינה מסחרית.
- העבר את גני המטרה בפלסמידים הנכנסים המתקבלים לווקטור היעד pPZP-RCS2A-nptII-DEST-EGFP-N1 על ידי תגובת LR19 באמצעות ערכת LR Clonase זמינה מסחרית לייצור פלסמידים עם תג EGFP המאוחה למסוף C של חלבוני המטרה.
- אמת את כל המבנים על ידי PCR ורצף19.
3. חדירה חקלאית
- פס Agrobacterium tumefaciens EHA105 תאים המכילים וקטורים שונים על לוחות אגר LB מודגר במשך 2 ימים תחת 28 ° C.
- מעבירים מושבה אחת לתוך 2 מ"ל של מרק LB ודגורים לילה ב 28 ° C עם תסיסה (250 סל"ד).
- מוציאים 1 מ"ל מתרבית הלילה, ולאחר מכן מוסיפים 4 מ"ל של מרק LB טרי, ומשנים את התרבית למשך שעה אחת באותם תנאים.
- התאם את תרחיף החיידקים ל- OD600 = 0.1 (OD600 = 0.2 לביטוי משותף של שני חלבונים) עם חיץ חדירה (MgCl2, 10 mM; MES, 10 mM, pH 5.6).
- ערבבו תרחיפים חיידקיים שונים ביחס של 1:1 (v/v) לקבלת ריכוז סופי של OD600 = 0.1. (אופציונלי).
- לדגור על התרחיף החיידקי בטמפרטורת החדר במשך 3 שעות עם תסיסה רכה.
- לחדור את פני השטח abaxial של עלים מורחבים לחלוטין צמחים שונים עם מזרק חד פעמי 1 מ"ל מחט, ולסמן את האזור חדר (צבע כהה יותר מאשר הרקמה שמסביב, לא חדר) עם עט עמיד למים.
- המשך לסעיף מיקרוסקופ קונפוקלי של פרוטוקול זה (שלב 5).
הערה: זנים אחרים של Agrobacterium tumefaciens המתאימים לשינוי של מיני צמחים מעניינים יכולים לשמש גם.
4. כתם כחול אנילין
- הוסף aliquot של 200 μL של 1% כחול אנילין (ב 50 mM אשלגן פוספט חיציץ, pH 8.0) לשקופית מיקרוסקופ20.
- מוציאים את השטח המוחדר של כ-0.5 ס"מ ×-0.5 ס"מ, הרחק מהווריד, בעזרת להב, ומעבירים את דגימות רקמת העלה לתמיסה הכחולה אנילין (צד אבקסיאלי כלפי מעלה) בשקופית המיקרוסקופ, ומוודאים שדגימות רקמת העלה שקועות בתמיסה הכחולה אנילין, ולאחר מכן מכסים אותה בזכוכית כיסוי (22 מ"מ x 50 מ"מ).
- מניחים את שקופיות המיקרוסקופ עם הדגימות במייבש המחובר למשאבת ואקום ומפנים למשך 2 דקות (0.8 < Pa), ולאחר מכן שחרור איטי של הלחץ והדגירה בחושך למשך 30 דקות בטמפרטורת החדר.
- דמיינו את האות הפלואורסצנטי של כחול אנילין תחת מיקרוסקופ קונפוקלי סורק לייזר עם תוכנה תואמת.
הערה: כאן, שיטת צביעת כחול אנילין על ידי Huang et al.20 שימש. בשינוי של טכניקה זו, אותו ניסוי בוצע ללא שלב ואקום של 2 דקות, הניב תוצאות דומות והציע כי ייבוש ואקום אינו חיוני לצביעת אנילין. כמו כן, ריכוז הכתם הכחול אנילין וזמן הצביעה עשויים להשתנות בהתאם למקור רקמת העלה וכו'.
5. מיקרוסקופ קונפוקלי
- קוצרים שני עלים משני צמחים בנקודות זמן שונות לאחר החדירה. חותכים את אזור החדירה לכ 0.5 ס"מ × 0.5 ס"מ פרוסות מן הווריד עם להב.
- הניחו את דגימות הרקמה בטיפת מים סטריליים (abaxial side-up) בחלק המרכזי של מגלשת מיקרוסקופ, וכסו אותן בזכוכית כיסוי (22 מ"מ x 50 מ"מ), תוך הקפדה על מניעת בועות.
- ודא שאורכי גל העירור לגילוי אותות CFP, GFP ו- RFP הם 405 ננומטר, 488 ננומטר ו- 561 ננומטר, בהתאמה, ומסנני הפליטה לגילוי היו 410-602 ננומטר עבור CFP, ו- 400-602 ננומטר עבור EGFP ו- RFP, כאשר חור הסיכה 1 AU והרווח הראשי מוגדרים כ- 769 V.
- דמיינו את האות הפלואורסצנטי של תגים אוטופלואורסצנטיים באזור המסתנן באמצעות מיקרוסקופ קונפוקלי סורק לייזר עם תוכנה תואמת ביום אחד, יומיים, 3 ימים, 5 ימים, 7 ימים ו-10 ימים לאחר החדירה.
- השתמש בעדשה אובייקטיבית של 10x ובמסנני GFP כדי לאתר תאים עם אות פלואורסצנטי ולאחר מכן עבור לעדשה אובייקטיבית של 40x לתצוגה חזותית של לוקליזציה תת-תאית והקלטת תמונה.
- אסוף 20 תמונות עבור כל מצב, באמצעות לפחות שני עותקים ביולוגיים בלתי תלויים.
- ציון PD לוקליזציה של החלבון הנבדק מבוסס על מראה ניקוב אבחון של האות בשולי התא21,22.
הערה: בעת זיהוי לוקליזציה תת-תאית של חלבון לא ידוע, מומלץ להשתמש בשלושה צמחים לפחות.
6. ניתוח נתונים
- השתמש בתוכנת פיג'י כדי לפצל ערוצים ולהוסיף את סרגל קנה המידה לתמונות לצורך תצוגה חזותית.
- השתמש בתוכנת פיג'י כדי לפצל ערוצים לפני מדידת הערך הממוצע בגווני אפור עבור כל תמונה כדי להעריך את עוצמת הפלואורסצנטיות של GFP (עבור MP, PDCB1 ו- PDLP5) או CFP (עבור צביעה בצבע כחול אנילין) בנקודות זמן שונות.
- השתמש בתוכנת פיג'י כדי לפצל ערוצים לפני נורמליזציה של תמונות GFP (עבור MP, PDCB1 ו- PDLP5) או CFP (עבור צביעה כחולה אנילין). שטח התמונה נמדד, וה-PD puncta נספרו ידנית. מספר PD puncta לכל 100 מיקרומטר2 חושב.
- השתמש ANOVA דו כיווני עם מבחן השוואות מרובות של Tukey23 כדי לקבוע את ערכי P בין הדגימות השונות ונקודות זמן שונות עם תוכנות סטטיסטיות וגרפים.
הערה: בתמונה פלואורסצנטית חד-ערוצית, ערך גווני האפור של כל פיקסל מייצג את עוצמת הפלואורסצנטיות של נקודה24 זו. כאן, ערך גווני האפור הממוצע שימש להערכת עוצמת הפלואורסצנטיות של כל דגימה בנקודות זמן שונות.
תוצאות
כדי להקל על מחקרים של תפקוד פרקינסון בפיזיולוגיה של צמחים ובאינטראקציות עם פתוגנים, פותחו שלושה חלבוני ייחוס פשוטים ואמינים עבור לוקליזציה של פרקינסון. נבחרו שני חלבוני PD תאיים וחלבון MP שמקורו בפתוגן המקודד על ידי נגיף הצמח TVCV. הלוקליזציה התת-תאית של חלבונים אלה הודגמה באמצעות כתב אוטופלואורסצנטי EGFP שהתמזג עם C-terminus של כל חלבון. בגישה חלופית, הודגמו פרקינסון באמצעות צביעה כחולה אנילין של משקעי קלוזה הקשורים למחלת פרקינסון. הניסויים הראו שגם PDLP5 וגם MP הפגינו לוקליזציה של PD מנוקב, כאשר MP גם ממוקם בגרעין התא (איור 1A), כפי שצוין קודם לכן25. לעומת זאת, PDCB1 נראה כמחלק בין PD ל-ER (איור 1A). עבור חוקרים פחות מנוסים בפענוח לוקליזציה תת-תאית של חלבונים המתויגים ב-GFP, איור 1A גם מדגים את התבנית הנוקלאוציטופלזמית האופיינית של EGFP המתבטאת בתאי צמחים. כדי לאשר את אות ה-ER של PDCB1, ביטאנו יחד את PDCB1 עם סמן ER ומצאנו שהאות PDCB1 חופף לאות של סמן ה-ER (איור 1B). כדי להעריך את היעילות של לוקליזציה של PD של החלבונים שנבדקו, חושב אחוז התאים המבטאים את האות הפלואורסצנטי שהציג לוקליזציה של PD של אות זה (טבלה 1).
לצורך זיהוי לוקליזציה תת-תאית על ידי שימוש בחלבוני ייחוס, כדאי להבין את סקאלת הזמן של ביטוי חלבון הייחוס ואת השינויים האפשריים בלוקליזציה שלו. איור 2 מראה קינטיקה כזו עבור MP, PDLP5 ו-PDCB1 כאשר PD עצמם הודגמו על-ידי צביעה כחולה אנילין. הן MP והן PDLP5 החלו להצטבר ב- PD כבר ביום אחד לאחר החדירה (dpi), והצטברות זו הגיעה למקסימום הנראה לעין ב- 2 dpi, ונותרה יציבה במשך 5 ימים נוספים, ולאחר מכן עוצמת האות ירדה, ככל הנראה עקב פירוק חלבונים. מהלך הזמן של המיון התת-תאי PDCB1 היה מורכב יותר: עבור 3 dpi הראשונים, PDCB1 הציג אות ER חזק יחסית, אשר הסתיר כמעט לחלוטין לוקליזציה של אות ספציפי ל-PD, בעוד שב-5 dpi, האות האחרון נעשה בולט יותר (איור 2), אם כי בפחות תאים. באופן מעניין, הופעתה של תבנית הלוקליזציה הברורה של PDCB1 לאחר 5 dpi חפפה לירידה משמעותית במספר התאים המראים את אות ה-EGFP (איור משלים 1). לפיכך, PDLP5 ו-MP יכולים לתפקד כחלבוני ייחוס PD עם רקע מועט ברוב תאי התא האחרים, עם חלון זמן הדמיה אופטימלי של 2-5 dpi. PDCB1, לעומת זאת, אינו מתאים כמו סמן PD.
לאחר מכן אומת כי סמני PD שומרים על ספציפיות הלוקליזציה התת-תאית שלהם בנוכחות חלבוני PD אחרים. לשם כך, MP-EGFP או PDLP5-EGFP בוטאו יחד עם PD-לוקליזציה של26 MP של וירוס צמחי אחר, Tobacco mosaic virus (TMV) המתויג עם CFP. איור 3 מראה שבשני המקרים, החלבונים שקיבלו ביטוי משותף הציגו דפוס לוקליזציה ברור של פרקינסון. באופן דומה, צביעה היסטולוגית היסטולוגית ספציפית לאנילין כחול של רקמות המבטאות MP-EGFP או PDLP5-EGFP לא זיהתה הפרעה ללוקליזציה של PD של האותות הכחולים של EGFP ואנילין (איור 3).
מחקרי לוקליזציה של פרקינסון נהנים לעתים קרובות מהערכה כמותית יותר של הביטוי הכולל של חלבון הייחוס ואות הפרקינסון. גישת כימות זו מודגמת באיור 4 ובאיור 5. לצורך כימות הביטוי הכללי נמדדה עוצמת האות של PDLP5 ו-MP. שני החלבונים הראו אותות חזקים בכל נקודות הזמן של ההדמיה במהלך תקופת 10 dpi, עם עוצמת אות מקסימלית של 3 dpi עבור PDLP5 ושל 2 dpi עבור MP (איור 4). לא היו הבדלים מובהקים סטטיסטית בעוצמת האות בין PDLP5 ל-MP באף אחת מנקודות הזמן של ההדמיה החזותית. עוצמת האות PDCB1 הראתה תנודות גדולות יותר בין נקודות זמן, כאשר האות החזק ביותר נצפה ב-7 dpi (איור 4), אף על פי שהיה קשה לאסוף נתונים מובהקים סטטיסטית בנקודת זמן זו בשל המחסור בתאים מבטאים. לפיכך, 3 dpi הראשונים מייצגים את העיתוי האופטימלי לזיהוי ביטוי PDCB1. כצפוי, דגימות של צביעת כחול אנילין הציגו אות יציב יותר מאשר החלבונים המבוטאים באופן חולף (איור 4).
לאחר מכן כומתו PD puncta שנוצרו על ידי PDLP5 ו-MP. PDLP5 הראה מספר יציב של PD puncta לאורך תקופת התצפית, ללא הבדלים מובהקים סטטיסטית בין שתיים מנקודות הזמן שנבדקו (איור 5). המספר הגבוה ביותר של PD puncta שנוצר על ידי MP זוהה ב 2 dpi, והם נשארו יציבים יחסית עד סוף תקופת התצפית. השוואת המספרים של PD puncta בין PDLP5 ו-MP לא גילתה הבדלים מובהקים סטטיסטית ברוב זמני הדגימה (איור 5). גם מספר PD puncta המוכתם בכחול אנילין נותר יציב, אם כי ירד מעט ועמד על 10 dpi. מספרי PD puncta המעוטרים בכחול אנילין, PDLP5 או MP היו דומים זה לזה עם מובהקות סטטיסטית (איור 5), בהתאם לספציפיות PD של סמנים אלה. המספרים של PD puncta עבור PDCB1 לא נותחו מאחר שבנקודות זמן מוקדמות יותר, אות PD הוסתר על-ידי אות המיון, ובנקודות זמן מאוחרות יותר, הוא נצפה רק בתאים מעטים יחסית (ראו איור 2).

איור 1: לוקליזציה של פלסמודסמאטה (PD) של TVCV MP, PDLP5 ו-PDCB1 המתבטאת באופן ארעי בצביעת ניקוטיאנה בנטמיאנה ואנילין כחול של PD. (A) לוקליזציה של PD של MP-EGFP, PDLP5-EGFP ו-PDCB1-EGFP וצביעת אנילין. אות EGFP הוא בירוק, אות כחול אנילין הוא בכחול, ו autofluorescence plastid הוא באדום. (B) ביטוי משותף של MP-EGFP, PDLP5-EGFP ו-PDCB1-EGFP עם סמן הרשתית האנדופלסמית (ER) המתויג ב-mRFP. התמונות הוקלטו יומיים לאחר החדירה (dpi) והן מקטעים קונפוקליים בודדים המייצגים שני ניסויים עצמאיים (N = 20 תמונות משני צמחים). אות EGFP הוא בירוק, אות mRFP הוא בסגול, ו autofluorescence plastid הוא באדום. חיצים צהובים מציינים PDCB1 מקומי בחדר המיון. פסי קנה מידה = 5 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: מהלך הזמן של לוקליזציה של PD של TVCV MP, PDLP5 ו-PDCB1 המתבטא באופן ארעי ב-Nicotiana benthamiana ובצביעה כחולה אנילין של PD. התמונות הוקלטו ברזולוציה של 2 dpi והן מקטעים קונפוקליים בודדים המייצגים שני ניסויים עצמאיים (N = 20 תמונות מ-2 צמחים עבור כל המערכות, למעט 7 dpi ו-10 dpi עבור PDCB1-EGFP, שבהם פחות תאים הציגו את האות). אות ה-EGFP מסומן בירוק, והאות הכחול אנילין מופיע בכחול. פסי קנה מידה = 5 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
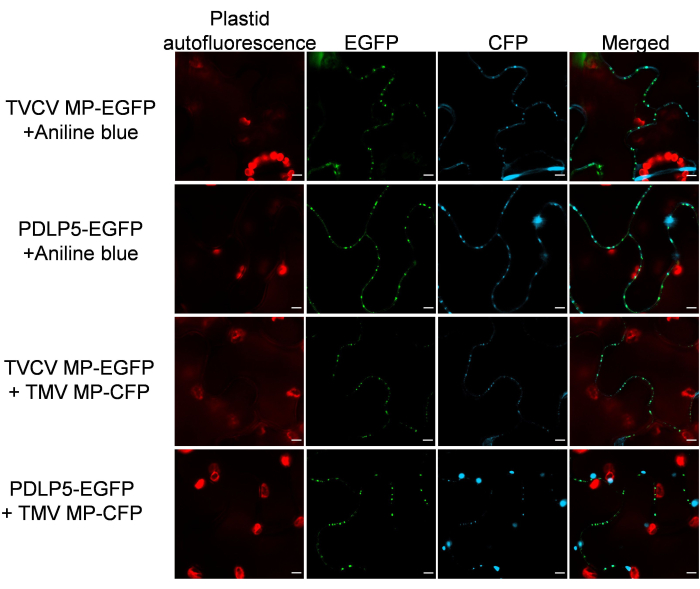
איור 3: TVCV MP ו-PDLP5 שומרים על לוקליזציה של PD לאחר ביטוי משותף עם PD-localizing TMV MP ו-costaining עם כחול אנילין. התמונות הוקלטו ברזולוציה של 2 dpi והן מקטעים קונפוקליים בודדים המייצגים N ≥ 10 תמונות מ-4-6 צמחים. אות EGFP הוא בירוק, אות CFP ואות כחול אנילין הם בכחול, ואת autofluorescence plastid הוא באדום. פסי קנה מידה = 5 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
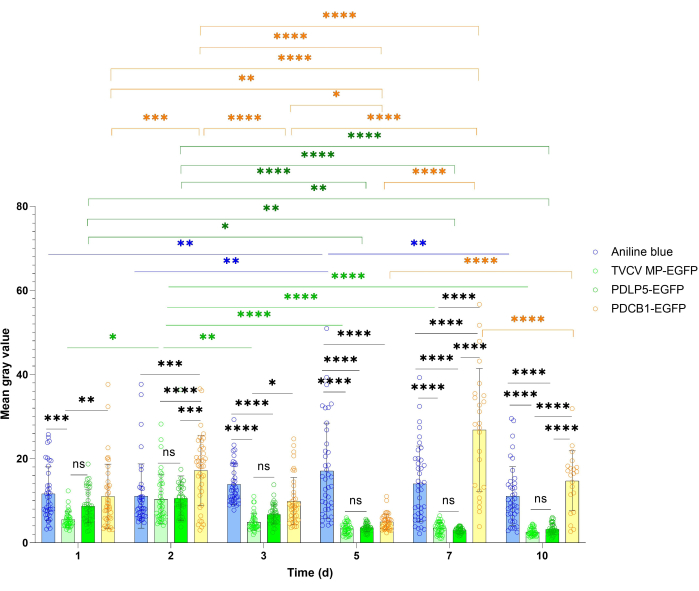
איור 4: מהלך הזמן של עוצמת הפלואורסצנטיות של TVCV MP, PDLP5 ו-PDCB1 המתבטא באופן ארעי בצביעת PD כחול של ניקוטיאנה בנטמיאנה ואנילין. נתונים כמותיים נאספו מהניסויים המתוארים באיור 2. קווי שגיאה מייצגים את סטיית התקן של הממוצע מניסויים מרובים. נקודות הנתונים הבודדות מסומנות כממוצע עבור כל מדידה. הבדלים בין ערכים ממוצעים המוערכים על ידי ANOVA דו-כיווני לבין מבחן ההשוואות המרובות של Tukey מובהקים סטטיסטית עבור ערכי P. *P < 0.05, **P < 0.01 ו- ***P < 0.001, ****P < 0.0001; NS, לא מובהק סטטיסטית. פסים כחולים, כתמי אנילין; עמודות ירוקות בהירות, MP-EGFP, עמודות ירוקות כהות, PDLP5-EGFP; פסים צהובים, PDCB1-EGFP. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 5: מהלך הזמן של היווצרות PD puncta על-ידי TVCV MP ו-PDLP5 מבוטא באופן ארעי ב-Nicotiana benthamiana ועל-ידי צביעה כחולה אנילין של PD. נתונים כמותיים נאספו מהניסויים המתוארים באיור 2. קווי שגיאה מייצגים את סטיית התקן של הממוצע מניסויים מרובים. נקודות הנתונים הבודדות מסומנות כממוצע עבור כל מדידה. הבדלים בין ערכים ממוצעים המוערכים על ידי ANOVA דו-כיווני לבין מבחן ההשוואות המרובות של Tukey מובהקים סטטיסטית עבור ערכי P. *P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.0001. פסים כחולים, כתמי אנילין; פסים ירוקים בהירים, MP-EGFP, פסים ירוקים כהים, PDLP5-EGFP. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| ניסוי א' | ||||
| סה"כ תאים | תאים עם לוקליזציה של PD | תאים עם אות מעורב | תאים עם לוקליזציה של PD (%) | |
| כחול אנילין | 40 | 40 | 4 | 100 |
| MP-EGFP | 40 | 40 | 4 | 100 |
| PDCB1-EGFP | 40 | 3 | 38 | 7.5 |
| PDLP5-EGFP | 40 | 40 | 0 | 100 |
| ניסוי 2 | ||||
| סה"כ תאים | תאים עם לוקליזציה של PD | תאים עם אות מעורב | תאים עם לוקליזציה של PD (%) | |
| כחול אנילין | 40 | 40 | 8 | 100 |
| MP-EGFP | 40 | 39 | 8 | 97.5 |
| PDCB1-EGFP | 40 | 12 | 31 | 30 |
| PDLP5-EGFP | 40 | 39 | 2 | 97.5 |
טבלה 1: יעילות לוקליזציה של PD.
איור משלים 1: לוקליזציה של PD של TVCV MP, PDLP5 ו-PDCB1 המבוטאת באופן זמני ב-Nicotiana benthamiana. התמונות הוקלטו ברזולוציה של 5 dpi (A), 7 dpi (B) ו- 10 dpi (C). אות ה-EGFP הוא ירוק, והאוטופלואורסצנטיות של הפלסטיד אדומה. פסי קנה מידה = 20 מיקרומטר. אנא לחץ כאן להורדת קובץ זה.
Discussion
כל מחקר ביולוגי של התא על תקשורת בין-תאית של צמחים והעברה בין תאים במהלך התפתחות נורמלית של צמחים ומורפוגנזה, כמו גם במהלך אינטראקציות צמחים-פתוגנים, מחייב זיהוי וניטור של מיון חלבונים - הן אנדוגניים והן מקודדים פתוגנים - לקשרים בין-תאיים צמחיים, פלסמודסמאטה (PD). ניסויים אלה יוקלו באופן משמעותי על ידי שימוש בחלבוני ייחוס, בין אם אנדוגניים או שמקורם בפתוגנים, אשר לוקליזציה נאמנה ועקבית למחלת פרקינסון, קישוט והדמיה של מבנים אלה. צורך זה מטופל כאן על ידי בחירת שלושה חלבונים ידועים לוקליזציה של PD: Arabidopsis PDLP5 ו- PDCB1, ו- MP מהפתוגן הטובמו-ויראלי TVCV. חלבונים אלה תויגו ב-C-termini שלהם בכתב האוטופלואורסצנטי EGFP, ויכולתם של חלבוני האיחוי שהתקבלו למיין ל-PD נקבעה בעקבות ביטוים הארעי בעלים של Nicotiana benthamiana וניתוח מיקרוסקופיה קונפוקלית של רקמות ההבעה. לצורך הדמיה כללית של מחלת פרקינסון ברקמות אלה, נעשה שימוש בשיטת הצביעה הכחולה הסטנדרטית של אנילין.
חברי פרלמנט נגיפיים צמחיים נחשבים כמתחלקים לשתי קבוצות עיקריות מבחינת השפעתם על המבנה והשלמות של פרקינסון: חברי פרלמנט המגבירים את חדירות הפרקינסון באופן הפיך וללא כל שינוי מבני בפרקינסון וחברי פרלמנט המגבירים את הפרקינסון על ידי שינוי המבנה שלהם. חברי פרלמנט של טובמווירוסים, כגון TVCV, שייכים לקבוצה הראשונה MP, מה שממקם אותם כסמנים אטרקטיביים של PD עבור מחקרי לוקליזציה תת-תאיים 27,28.
ניסויים אלה מיקמו את PDLP5-EGFP ואת MP-EGFP כסמנים ביולוגיים אמינים וניתנים לשחזור של PD, כאשר יעילות זיהוי PD דומה לזו של צבע כחול אנילין. לוקליזציה PD של PDLP5-EGFP ו- MP-EGFP זוהתה לאורך כל תקופת התצפית של 10 dpi, עם הזמן האופטימלי לצפייה בדפוס הלוקליזציה האופייני של PD בין 2 dpi ל- 3 dpi. למרות שביטוי ממקדם 35S עלול לגרום להשתקה לאחר שעתוק של הגן המבוטא, זה קורה לעתים קרובות לאחר ביטוי ממושך בצמחים טרנסגניים שעברו טרנספורמציה יציבה. מצד שני, השימוש במקדם מכונן חזק זה חשוב לזיהוי קל של חלבון הסמן. אם ביטוי חלבון הייחוס יורד לאחר 7-10 dpi, יש להשתמש בפרקי זמן קצרים יותר, כלומר 2-3 dpi. הבדלים משמעותיים בדפוס הלוקליזציה התת-תאי הכולל בין PDLP5 ל-MP לא זוהו כאן, למעט MP שהצטבר בגרעין התא בנוסף ל-PD. לעומת זאת, PDCB1 אינו מומלץ לשימוש כסמן PD כשלעצמו בשל מורכבות דפוס הלוקליזציה התת-תאי שלו, הכולל לוקליזציה משמעותית למיון.
קלות הזיהוי של אות הפלואורסצנטיות של EGFP הייתה תלויה גם בשלב הצמיחה של הצמח; באופן ספציפי, ב- N. benthamiana, הצטברות אות EGFP הנמוכה ביותר נצפתה בשלב התפרחת18.
מחקר זה נועד לפתח את סמני הלוקליזציה של PD הבלעדיים באופן מקסימלי לתאים תת-תאיים אחרים. לפיכך, השימוש בהם כהפניות ללוקליזציה של חלבונים בעלי עניין עם יכולות לוקליזציה תת-תאיות נוספות צריך להיות משולב עם ביטוי של סמנים תת-תאיים אחרים, כגון אלה הספציפיים למיון, מיטוכונדריה, קרום פלזמה וכו '. במקרה זה, הכללת תאי אגרובקטריום נוספים לביטוי סמנים אלה צריכה להילקח בחשבון בעת חישוב הריכוז הסופי של תרביות חדירה, כלומר, OD600 של התרביות הנוזליות. כמובן, יש להתאים את ריכוז התאים ואת זמני צמיחת הצמחים לביטוי מקסימלי ולזיהוי דפוסי לוקליזציה של PD במינים אחרים של צמחים.
Disclosures
המחברים מצהירים כי אין אינטרסים מתחרים.
Acknowledgements
העבודה במעבדת ההון סיכון נתמכה על ידי מענקים מ-NIH (R35GM144059), NSF (MCB 1913165 ו-IOS 1758046) ו-BARD (IS-5276-20) לקרנות הון סיכון. למממנים לא היה כל תפקיד בעיצוב המחקר, באיסוף הנתונים ובפרשנותם, או בהחלטה לפרסם.
Materials
| Name | Company | Catalog Number | Comments |
| ABT AC 1 phase motor | BRANDTECH | ABF63/4C-7RQ | |
| Agrobacterium tumefaciens EHA105 | |||
| Contamination control | CCI | ||
| Gateway BP Clonase II Enzyme mix | Invitrogen | #11789020 | |
| Gateway LR Clonase II Enzyme mix | Invitrogen | #11791020 | |
| GraphPad Prism 8.0.1. | GraphPad Software Inc. | ||
| Image J | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation | ||
| Laser scanning confocal microscope | Zeiss | LSM 900 | |
| Nicotiana benthamiana | Plant species | ||
| pDONR207 | Invitrogen | #12213013 | |
| Q5 High-Fidelity DNA Polymerase | NEB | #M0491S |
References
- Lee, J., et al. A plasmodesmata-localized protein mediates crosstalk between cell-to-cell communication and innate immunity in Arabidopsis. The Plant Cell. 23 (9), 3353-3373 (2011).
- Benitez-Alfonso, Y., Faulkner, C., Ritzenthaler, C., Maule, A. J. Plasmodesmata gateways to local and systemic virus infection. Mol Plant-Microbe Interact. 23 (11), 1403-1412 (2010).
- Bayer, E. M., Benitez-Alfonso, Y. Plasmodesmata: Channels under pressure. Annu Rev Plant Biol. 75, 21 (2024).
- Maule, A. J. Plasmodesmata: Structure, function and biogenesis. Curr Opin Plant Biol. 11, 680-686 (2008).
- Fernandez-Calvino, L., et al. Arabidopsis plasmodesmal proteome. PLoS One. 6 (4), e18880 (2011).
- Kirk, P., Amsbury, S., German, L., Gaudioso-Pedraza, R., Benitez-Alfonso, Y. A comparative meta-proteomic pipeline for the identification of plasmodesmata proteins and regulatory conditions in diverse plant species. BMC Biol. 20, 128 (2022).
- Levy, A., Erlanger, M., Rosenthal, M., Epel, B. L. A plasmodesmata-associated β-1,3-glucanase in Arabidopsis. The Plant J. 49 (4), 669-682 (2007).
- Kankanala, P., Czymmek, K., Valent, B. Roles for rice membrane dynamics and plasmodesmata during biotrophic invasion by the blast fungus. The Plant Cell. 19 (2), 706-724 (2007).
- Aung, K., et al. Pathogenic bacteria target plant plasmodesmata to colonize and invade surrounding tissues. The Plant Cell. 32 (3), 595-611 (2020).
- Cui, W., Lee, J. Arabidopsis callose synthases CalS1/8 regulate plasmodesmal permeability during stress. Nat Plants. 2 (5), 160 (2016).
- Liu, N. J., et al. Phytosphinganine affects plasmodesmata permeability via facilitating PDLP5-stimulated callose accumulation in Arabidopsis. Mol Plant. 13 (1), 128-143 (2020).
- Caillaud, M. C., et al. The plasmodesmal protein PDLP1 localizes to haustoria-associated membranes during downy mildew infection and regulates callose deposition. PLoS Pathog. 10 (11), e1004496 (2014).
- Li, Z., Su-Ling, L., Christian, M., Walley, J. W., Aung, K. Plasmodesmata-located protein 6 regulates plasmodesmal function in Arabidopsis vasculature. The Plant Cell. , (2024).
- Chen, X., et al. Arabidopsis PDLP7 modulated plasmodesmata function is related to BG10-dependent glucosidase activity required for callose degradation. Sci Bull. , (2024).
- Simpson, C., Thomas, C., Findlay, K., Bayer, E., Maule, A. J. An Arabidopsis GPI-anchor plasmodesmal neck protein with callose binding activity and potential to regulate cell-to-cell trafficking. The Plant Cell. 21 (2), 581-594 (2009).
- Thomas, C. L., Bayer, E. M., Ritzenthaler, C., Fernandez-Calvino, L., Maule, A. J. Specific targeting of a plasmodesmal protein affecting cell-to-cell communication. PLoS Biol. 6 (1), e7 (2008).
- Lim, G., et al. Plasmodesmata localizing proteins regulate transport and signaling during systemic acquired immunity in plants. Cell Host Microbe. 19 (4), 541-549 (2016).
- Sheludko, Y. V., Sindarovska, Y. R., Gerasymenko, I. M., Bannikova, M. A., Kuchuk, N. V. Comparison of several Nicotiana species as hosts for high-scale Agrobacterium-mediated transient expression. Biotechnol Bioeng. 96 (3), 608-614 (2007).
- Walhout, A. J. M., et al. GATEWAY recombinational cloning: Application to the cloning of large numbers of open reading frames or ORFeomes. Methods Enzymol. 328, 575-592 (2000).
- Huang, C., et al. dsRNA-induced immunity targets plasmodesmata and is suppressed by viral movement proteins. The Plant Cell. 35 (10), 3845-3869 (2023).
- Roberts, I. M., et al. Dynamic changes in the frequency and architecture of plasmodesmata during the sink-source transition in tobacco leaves. Protoplasma. 218, 31-44 (2001).
- Yuan, C., Lazarowitz, S. G., Citovsky, V. The plasmodesmal localization signal of TMV MP is recognized by plant synaptotagmin SYTA. mBio. 9 (4), e01314-e01318 (2018).
- Ward, S. J., Ramirez, M. D., Neelakantan, H., Walker, E. A. Cannabidiol prevents the development of cold and mechanical allodynia in paclitaxel-treated female C57Bl6 mice. Anesth Analg. 113 (4), 947-950 (2011).
- Erkkilä, M. T., et al. Widefield fluorescence lifetime imaging of protoporphyrin IX for fluorescence-guided neurosurgery: An ex vivo feasibility study. J Biophotonics. 12 (6), e201800378 (2019).
- Levy, A., Zheng, J. Y., Lazarowitz, S. G. The tobamovirus Turnip vein clearing virus 30-kilodalton movement protein localizes to novel nuclear filaments to enhance virus infection. J Virol. 87 (11), 6428-6440 (2013).
- Yuan, C., Lazarowitz, S. G., Citovsky, V. Identification of a functional plasmodesmal localization signal in a plant viral cell-to-cell-movement protein. mBio. 7 (1), e2052-e2015 (2016).
- Kumar, G., Dasgupta, I. Variability, functions and interactions of plant virus movement proteins: what do we know so far. Microorganisms. 9 (4), 695 (2021).
- Waigmann, E., Ueki, S., Trutnyeva, K., Citovsky, V. The ins and outs of nondestructive cell-to-cell and systemic movement of plant viruses. Crit Rev Plant Sci. 23 (3), 195-250 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved