Method Article
Nicotiana benthamiana에서 Plasmodesmata에 대한 단백질 분류의 컨포칼 현미경 분석
요약
이 프로토콜은 바이러스-플라스모데스마타 상호 작용 또는 플라스모데스마 수송 중 플라스모데스마타를 표적으로 하는 단백질의 컨포칼 현미경 기반 분석을 위한 최적의 플라스모데스마 마커 선택에 대해 설명합니다.
초록
Plasmodesmata는 인접한 식물 세포의 세포질을 연결하고 영양분, 거대분자 및 침입 바이러스의 세포 간 이동을 가능하게 하는 막질 나노 기공입니다. Plasmodesmata는 세포 간 통신 조절에 근본적인 역할을 하여 식물 발달, 환경 반응 및 바이러스 병원체와의 상호 작용에 기여합니다. 식물 또는 바이러스 단백질의 plasmodesmal localization을 발견하는 것은 단백질에 대한 유용한 기능적 정보를 제공할 수 있으며 식물-바이러스 상호 작용의 메커니즘을 이해하는 데 중요합니다. 이러한 연구를 용이하게 하기 위해 바이러스-플라스모데스마타 상호 작용 또는 플라스모데즘 수송을 연구하기 위한 최상의 플라스모데즘 마커를 선택하기 위해 다양한 플라스모데스 표적 단백질의 컨포칼 현미경 기반 분석을 위한 프로토콜을 설명합니다. 구체적으로, 순무 정맥 청소 바이러스 (TVCV)의 세포 간 이동 단백질(MP), 애기장대 Plasmodesmata-Localized Protein 5(PDLP5) 및 Plasmodesmata Callose-Binding Protein 1(PDCB1)을 사용하여 이러한 이벤트의 분석을 설명합니다. 단백질 plasmodesmal localization 데이터는 샘플링된 조직의 아닐린 블루 염색을 사용하여 plasmodesmata의 전체 시각화와 병행하여 분석됩니다. 이러한 접근법은 planta의 세포 또는 병원체 단백질의 plasmodesmal localization을 분석하는 데 쉽게 적용할 수 있습니다.
서문
Plasmodesmata (PD)는 세포 간 통신 조절을 통해 식물 발달, 환경 반응 및 바이러스 병원체와의 상호 작용을 제어하는 데 근본적인 역할을 합니다 1,2. PD는 초기에 사이토키네시스(cytokinesis) 중에 형성되며, 수백 개의 PD가 두 딸 세포 사이의 새로운 세포에 삽입되어 세포 간 통신을 위한 채널을 공급합니다 3,4. PD는 원형질막(3,4)에 의해 늘어선 기공의 중앙 부분에 소포체(ER) 유래 막, 트랜스-PD 데스모튜불(trans-PD desmotubule)을 포함하는 막이 풍부한 구조입니다. 비교 단백질체학 접근법은 β-1,3-glucanases(BG), callose synthase(CALS), plasmodesmata-located proteins(PDLP), callose-binding proteins(PDCB), multiple C2 domains transmembrane region proteins(MCTP)3 및 류신이 풍부한 반복 수용체 유사 kinases(RLK)5를 포함한 수많은 PD 기능성 단백질을 식별했습니다. 최근 Kirk et al.은 plasmodesmata in silico proteome 1 (PIP1)이라는 도구를 개발하여 22 종의 식물6에서 새로운 PD 단백질을 예측할 수 있게 되었습니다. PD는 식물 발달 및 다양한 스트레스에 대한 반응 중에 투과성과 구조가 다양합니다. PD를 둘러싼 목 부위의 칼로스(β-1,3-glucan) 침착 및 가수분해는 PD 조절7의 널리 알려진 메커니즘 중 하나입니다.
곰팡이, 박테리아 및 바이러스를 포함한 많은 병원성 미생물은 감염 중에 PD 확장 또는 구조를 조작할 수 있습니다 2,8,9. 벼 돌풍의 원인 물질인 Magnaporthe oryzae는 세포 내 침습성 균사를 배치하여 PD8을 통해 세포에서 세포로 이동합니다. 세균성 병원체 Pseudomonas syringae pv. 토마토는 세포 간 이동을 위해 effector protein HopO1-1이 필요하며, PDLP7과 상호 작용하고 불안정하게 만들어 숙주 식물에서 확산시켜 애기장대9의 인접 세포에서 분자 플럭스를 증가시킵니다. 그러나 식물 바이러스는 바이러스 이동 단백질(MP)이 세포 간 이동을 촉진하여 세포 간 전염 중에 PD를 조절하는 데 더 다양합니다2. PD는 식물의 발달과 성장을 조절하는 중요한 기능과 식물 병원성 미생물과의 상호 작용으로 인해 최근 몇 년 동안 점점 더 주목을 받고 있습니다. 애기장대(Arabidopsis thaliana)에는 PDLP(1-8)와 PDCB(1-5)의 두 가지 주요 유형의 PD 기능성 단백질이 있으며, 그 중 많은 유형, 예를 들어 PDLP5 1,10,11, PDLP112, PDLP613, PDLP714 및 PDCB115는 칼로스 침착의 조절을 통해 PD 투과성을 조작하는 역할을 하는 것으로 밝혀졌습니다. 그러나, 일부 PDLP는 기능적 중복성을 갖는 것으로 나타났는데, 예를 들어, pdlp1,3 및 pdlp2,3의 이중 knockout 돌연변이체는 증가된 플라스모데스말 투과성을 보였지만, pdlp1,3 및 pdlp1,2의 knockout 돌연변이체는 분자 이동에 영향을 미치지 않았다16. 흥미롭게도, PDLP5 단독의 하향 조절/녹아웃 또는 과발현은 각각 플라스모드 투과성의 증가 또는 감소를 초래합니다 1,17. 최근에, Li 등은 PDLP5 및 PDLP6가 서로 다른 세포 계면에서 기능한다는 것을 발견했다13. 이러한 결과는 PDLP5가 다른 PDLP와 중복되지 않는 기능을 가질 수 있음을 나타냅니다.
세포 간 통신에서 PD의 중요한 기능으로 인해 당사는 식물 PD 단백질 PDLP5 및 PDCB1과 순무 정맥 청소 바이러스 (TVCV)의 바이러스 세포 간 이동 단백질(MP)을 세포 생물학 실험을 위한 간단하고 편리하며 신뢰할 수 있는 PD 마커로 배포하기 위한 프로토콜을 개발했습니다. 추가 검증을 위해 샘플링된 조직의 아닐린 블루 염색을 사용한 PD의 시각화가 병렬로 진행되었습니다. PDLP5, PDCB1 및 TVCV MP의 PD 국소화에 대해 설명된 프로토콜은 살아있는 식물에서 세포 또는 병원체 유래 단백질의 잠재적인 PD 국소화를 분석하기 위해 쉽게 조정할 수 있습니다.
프로토콜
이 연구에 사용된 시약 및 장비의 세부 사항은 재료 표에 나열되어 있습니다.
1. 식물 성장
- Nicotiana benthamiana 씨앗을 23 ° C의 통제 된 환경 챔버에서 16 시간의 빛과 8 시간의 어둠 아래에서 젖은 토양에서 성장시킵니다.
- 약 2 주 후, 뿌리 주위의 이탄 알갱이가있는 묘목을 조심스럽게 더 큰 화분으로 옮기고 그로인 여과 실험을 위해 4-5 주 동안 동일한 조건에서 성장을 계속합니다.
참고 : 꽃이 피기 시작할 때 식물을 사용하지 마십시오., GFP 축적은 꽃이 핌단계 18에서 감소합니다.
2. 벡터 구성
- PCR을 사용하여 Q5 High-Fidelity DNA Polymerase로 관심 있는 코딩 염기서열을 증폭하고 상업적으로 이용 가능한 BP Clonase kit를 사용하여 BP 반응19 에 의해 entry vector pDONR207로 클로닝합니다.
- 결과적으로 입수된 entry plasmids의 target genes를 상업적으로 이용 가능한 LR Clonase kit를 사용하여 LR 반응19 에 의해 대상 벡터 pPZP-RCS2A-nptII-DEST-EGFP-N1로 전달하여 target 단백질의 C-말단에 융합된 EGFP tag를 가진 plasmid를 생성합니다.
- PCR 및 염기서열분석19로 모든 구조를 확인합니다.
3. 사로인침습
- LB 한천 플레이트에 다른 벡터를 포함하는 줄무늬 Agrobacterium tumefaciens EHA105 세포를 28°C에서 2일 동안 배양합니다.
- 단일 콜로니를 2mL의 LB 육수에 옮기고 교반(250rpm)으로 28°C에서 밤새 배양합니다.
- 하룻밤 배양액에서 1mL를 제거한 다음 신선한 LB 육수 4mL를 추가하고 동일한 조건에서 1시간 동안 재배양합니다.
- 박테리아 현탁액을 침투 완충액(MgCl2, 10mM; MES, 10mM, pH 5.6)를 참조하십시오.
- 서로 다른 박테리아 현탁액을 1:1(v/v)의 비율로 혼합하여 최종 농도를 OD600 = 0.1로 만듭니다. (선택 사항).
- 박테리아 현탁액을 실온에서 부드러운 교반으로 3시간 동안 배양합니다.
- 다른 식물에서 완전히 팽창 한 잎의 abaxial 표면을 1mL의 바늘없는 일회용 주사기로 침투시키고 침투 부위 (주변의 비 침투 조직보다 어두운 색)를 방수 펜으로 표시합니다.
- 이 프로토콜의 Confocal microscopy 섹션으로 진행합니다(5단계).
참고: 관심 식물 종의 변형에 적합한 Agrobacterium tumefaciens 의 다른 균주도 사용할 수 있습니다.
4. 아닐린 블루 스테인
- 200μL의 1% 아닐린 블루(50mM 인산칼륨 완충액, pH 8.0)의 분취액을 현미경 슬라이드20에 추가합니다.
- 정맥에서 약 0.5cm × 0.5cm의 침투 부위를 칼날로 절제하고 잎 조직 샘플을 현미경 슬라이드의 아닐린 블루 용액(abaxial side-up)으로 옮기고 잎 조직 샘플이 아닐린 블루 용액에 잠겼는지 확인한 다음 커버 유리(22mm x 50mm)로 덮습니다.
- 샘플과 함께 현미경 슬라이드를 진공 펌프에 부착된 데시케이터에 넣고 2분(<0.8Pa) 동안 배출한 다음 압력을 천천히 해제하고 어두운 곳에서 실온에서 30분 동안 배양합니다.
- 호환 가능한 소프트웨어를 사용하여 레이저 스캐닝 컨포칼 현미경으로 아닐린 블루의 형광 신호를 시각화할 수 있습니다.
참고: 여기에서는 Huang et al.20 의 아닐린 블루 염색 방법이 사용되었습니다. 이 기법을 수정하여 2분 진공 단계 없이 동일한 실험을 수행하여 유사한 결과를 얻었으며 진공 건조가 아닐린 염색에 필수적이지 않음을 시사했습니다. 또한, 아닐린 블루 염색의 농도와 염색 시간은 잎 조직의 출처 등에 따라 달라질 수 있습니다.
5. 공초점 현미경 검사
- 침투 후 서로 다른 시점에서 두 식물의 잎 두 개를 수확하십시오. 침윤 부위를 약 0.5cm로 자르× 칼날로 정맥에서 0.5cm 잘라냅니다.
- 현미경 슬라이드의 중앙 부분에 있는 멸균수 한 방울(abaxial side-up)에 조직 샘플을 넣고 기포가 생기지 않도록 주의하면서 커버 유리(22mm x 50mm)로 덮습니다.
- CFP, GFP 및 RFP 신호 검출을 위한 여기 파장이 각각 405nm, 488nm 및 561nm이고 검출을 위한 방출 필터가 CFP의 경우 410-602nm, EGFP 및 RFP의 경우 400-602nm이고 핀홀은 1AU이고 마스터 게인은 769V로 설정되어 있는지 확인합니다.
- 침입 후 1일, 2일, 3일, 5일, 7일, 10일에 호환 가능한 소프트웨어가 있는 레이저 스캐닝 컨포칼 현미경을 사용하여 침투 영역에서 자가형광 태그의 형광 신호를 시각화합니다.
- 10x 대물렌즈와 GFP 필터를 사용하여 형광 신호가 있는 세포를 찾은 다음 40x 대물렌즈로 전환하여 세포 내 국소화 및 이미지 기록을 시각화합니다.
- 두 개 이상의 독립적인 생물학적 복제를 사용하여 각 조건에 대해 20개의 이미지를 수집합니다.
- 세포 주변부에서 신호의 진단적 반점 모양을 기반으로 테스트된 단백질의 PD 국소화를 점수화합니다(21,22).
참고: 알려지지 않은 단백질의 세포 내 국소화를 검출할 때는 최소 3개의 식물을 사용하는 것이 좋습니다.
6. 데이터 분석
- Fiji 소프트웨어를 사용하여 채널을 분할하고 시각화를 위해 이미지에 스케일 바를 추가합니다.
- 각 이미지의 평균 그레이스케일 값을 측정하기 전에 Fiji 소프트웨어를 사용하여 채널을 분할하여 서로 다른 시점에서 GFP(MP, PDCB1 및 PDLP5의 경우) 또는 CFP(아닐린 블루 염색의 경우) 형광 강도를 평가합니다.
- GFP(MP, PDCB1 및 PDLP5의 경우) 또는 CFP(아닐린 블루 염색의 경우) 이미지를 정규화하기 전에 Fiji 소프트웨어를 사용하여 채널을 분할합니다. 이미지의 면적을 측정하고 PD puncta를 수동으로 계산했습니다. 100μm2 당 PD puncta의 수를 계산하였다.
- Tukey의 다중 비교 테스트23 과 함께 양방향 분산 분석을 사용하여 통계 및 그래프 소프트웨어로 서로 다른 샘플과 다른 시점 간의 P-값을 결정합니다.
참고: 단일 채널 형광 이미지의 경우, 각 픽셀의 그레이스케일 값은 해당 점24의 형광 강도를 나타냅니다. 여기서, 평균 그레이스케일 값은 서로 다른 시점에서 각 샘플의 형광 강도를 평가하는 데 사용되었습니다.
결과
식물 생리학에서 PD 기능 및 병원체와의 상호 작용에 대한 연구를 용이하게 하기 위해 PD 국소화를 위해 간단하고 신뢰할 수 있는 세 가지 참조 단백질이 개발되었습니다. 2개의 세포 PD 단백질과 식물 토바모바이러스 TVCV에 의해 암호화된 병원체 유래 MP 단백질을 선택하였다. 이러한 단백질의 세포 내 국소화는 각 단백질의 C-말단에 융합된 자가형광 리포터 EGFP를 사용하여 시각화되었습니다. 다른 접근법으로, PD 관련 칼로스 침전물의 아닐린 블루 염색을 사용하여 PD를 시각화했습니다. 실험은 PDLP5와 MP 모두 반점 PD 국소화를 나타냈으며, MP도 세포핵에서 국소화되어 있음을 보여주었습니다(그림 1A), 앞서 언급한바와 같이 25. 대조적으로, PDCB1은 PD와 ER 사이에서 분할되는 것처럼 보였다(그림 1A). GFP 태그 단백질의 세포 내 국소화를 해석한 경험이 적은 연구자를 위해 그림 1A 는 식물 세포에서 발현되는 EGFP의 특징적인 핵세포질 패턴도 보여줍니다. PDCB1의 ER 신호를 확인하기 위해 PDCB1을 ER 마커와 함께 발현한 결과 PDCB1 신호가 ER 마커의 신호와 겹치는 것을 확인했습니다(그림 1B). 테스트된 단백질의 PD 국소화의 효율성을 평가하기 위해, 이 신호의 PD 국소화를 나타내는 형광 신호를 발현하는 세포의 비율을 계산하였다(표 1).
참조 단백질을 사용하여 세포 내 국소화를 식별하려면 참조 단백질 발현의 시간 척도와 그 국소화의 잠재적 변화를 이해하는 것이 유용합니다. 그림 2 는 PD 자체가 아닐린 블루 염색으로 시각화되었을 때 MP, PDLP5 및 PDCB1에 대한 이러한 역학을 보여줍니다. MP와 PDLP5 모두 침투 후 1일(dpi)에 이미 PD에서 축적되기 시작했으며, 이 축적은 2dpi에서 겉보기 최대치에 도달하여 5일 동안 더 안정적으로 유지된 후 신호 강도가 감소했는데, 이는 단백질 분해로 인한 것일 수 있습니다. PDCB1 세포 내 분류의 시간 경과는 더 복잡했습니다: 처음 3dpi에서 PDCB1은 비교적 강한 ER 신호를 나타내어 PD 특이적 신호 국소화를 거의 완전히 모호하게 한 반면, 5dpi에서는 더 적은 세포에서 이 후자의 신호가 더 뚜렷해졌습니다(그림 2). 흥미롭게도, 5dpi 후 PDCB1의 명확한 PD 국소화 패턴의 출현은 EGFP 신호를 나타내는 셀의 수가 상당히 적다는 것과 일치했습니다(보충 그림 1). 따라서 PDLP5 및 MP는 대부분의 다른 세포 구획에서 배경지식이 거의 없는 PD 참조 단백질로 기능할 수 있으며, 최적의 시각화 시간 창은 2-5dpi입니다. 반면에 PDCB1은 PD 마커만큼 적합하지 않습니다.
그런 다음 PD 마커가 다른 PD 단백질의 존재 하에서 세포 내 국소화 특이성을 유지한다는 것을 확인했습니다. 이를 위해, MP-EGFP 또는 PDLP5-EGFP는 CFP로 태그된 또 다른 식물 바이러스인 담배 모자이크 바이러스(TMV)의 PD-국소화26MP와 동시 발현되었습니다. 그림 3 은 두 경우 모두 동시 발현된 단백질이 명확한 PD 국소화 패턴을 나타냈다는 것을 보여줍니다. 마찬가지로, MP-EGFP- 또는 PDLP5-EGFP 발현 조직의 PD 특이적 조직학적 아닐린 청색 염색에서는 EGFP 및 아닐린 청색 신호의 PD 국소화에 대한 간섭이 감지되지 않았습니다(그림 3).
PD 국소화 연구는 종종 기준 단백질의 전체 발현 및 PD 신호에 대한 보다 정량적인 추정을 통해 이점을 얻을 수 있습니다. 이 정량화 접근법은 그림 4 와 그림 5에 나와 있습니다. 일반적인 발현의 정량화를 위해 PDLP5 및 MP의 신호 강도를 측정하였다. 두 단백질 모두 10dpi 기간 동안 모든 시각화 시점에서 강력한 신호를 보였으며 PDLP5의 경우 3dpi, MP의 경우 2dpi에서 최대 신호 강도를 보였습니다(그림 4). 시각화 시점 중 어느 곳에서도 PDLP5와 MP 간의 신호 강도에는 통계적으로 유의미한 차이가 없었습니다. PDCB1 신호 강도는 발현 세포의 부족으로 인해 이 시점에서 통계적으로 유의미한 데이터를 수집하기 어려웠지만, 가장 강한 신호는 7dpi에서 관찰되어 시점 간 변동이 더 컸습니다(그림 4). 따라서 처음 3dpi는 PDCB1 발현을 감지하기 위한 최적의 타이밍을 나타냅니다. 예상대로 아닐린 청색 염색 샘플은 일시적으로 발현된 단백질보다 더 안정적인 신호를 나타냈습니다(그림 4).
그런 다음 PDLP5 및 MP에 의해 형성된 PD 반점을 정량화했습니다. PDLP5는 관찰 기간 동안 안정적인 PD 반점 수를 보였으며 테스트된 두 시점 간에 통계적으로 유의한 차이는 없었습니다(그림 5). MP에 의해 형성된 PD puncta의 가장 많은 수는 2dpi에서 감지되었으며, 관찰 기간이 끝날 때까지 비교적 안정적인 상태를 유지했습니다. PDLP5와 MP 사이의 PD 반점 수를 비교한 결과, 대부분의 샘플링 시간에서 통계적으로 유의한 차이는 나타나지 않았습니다(그림 5). 아닐린 블루로 염색 된 PD puncta의 수도 10dpi에서 약간 감소했지만 안정적으로 유지되었습니다. 아닐린 블루, PDLP5 또는 MP로 장식된 PD 반점의 수는 통계적 유의성으로 서로 유사했으며(그림 5), 이러한 마커의 PD 특이성과 일치했습니다. PDCB1에 대한 PD 반점의 수는 분석되지 않았는데, 그 이유는 초기 시점에서는 PD 신호가 ER 신호에 의해 가려졌고 이후 시점에서는 상대적으로 적은 수의 세포에서만 관찰되었기 때문입니다( 그림 2 참조).

그림 1: 니코티아나 벤타미아나(Nicotiana benthamiana )에서 일시적으로 발현되는 TVCV MP, PDLP5 및 PDCB1의 플라스모데마타(PD) 국소화 및 PD의 아닐린 블루 염색 . (A) MP-EGFP, PDLP5-EGFP 및 PDCB1-EGFP 및 아닐린 염색의 PD 국소화. EGFP 신호는 녹색, 아닐린 청색 신호는 청색, 플라스티드 자가형광은 빨간색입니다. (B) MP-EGFP, PDLP5-EGFP 및 PDCB1-EGFP와 mRFP로 태그된 소포체(ER) 마커의 동시 발현. 이미지는 침투 후 2일(dpi)에 기록되었으며 두 개의 독립적인 실험(N = 2개 공장의 이미지 20개)을 대표하는 단일 공초점 섹션입니다. EGFP 신호는 녹색, mRFP 신호는 자주색, 플라스티드 자가형광은 빨간색입니다. 노란색 화살표는 응급실에 국한된 PDCB1을 나타냅니다. 스케일 바 = 5 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 니코티아나 벤타미아나 에서 일시적으로 발현되는 TVCV MP, PDLP5 및 PDCB1의 PD 국소화 시간 경과와 PD의 아닐린 블루 염색. 이미지는 2dpi로 기록되었으며 두 개의 독립적인 실험을 대표하는 단일 공초점 섹션입니다(더 적은 수의 셀이 신호를 나타내는 PDCB1-EGFP의 경우 7dpi 및 10dpi를 제외한 모든 시스템에 대해 2개 공장의 N = 20개 이미지). EGFP 신호는 녹색이고 아닐린 청색 신호는 청색입니다. 스케일 바 = 5 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
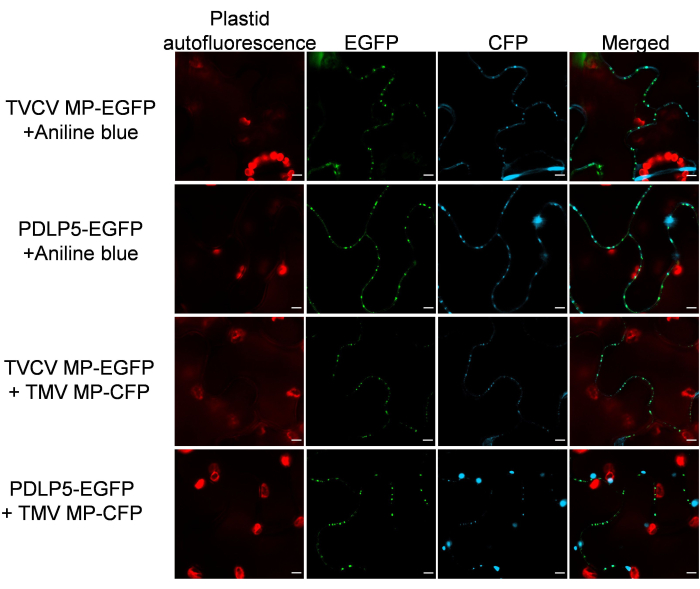
그림 3: TVCV MP 및 PDLP5는 PD 국소화 TMV MP와 동시 발현하고 아닐린 블루와 함께 염색한 후 PD 국소화를 유지합니다. 이미지는 2dpi로 기록되었으며 4-6 개의 식물에서 N ≥ 10 개의 이미지를 대표하는 단일 공초점 섹션입니다. EGFP 신호는 녹색, CFP 신호와 아닐린 청색 신호는 청색, 플라스티드 자가형광은 빨간색입니다. 스케일 바 = 5 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
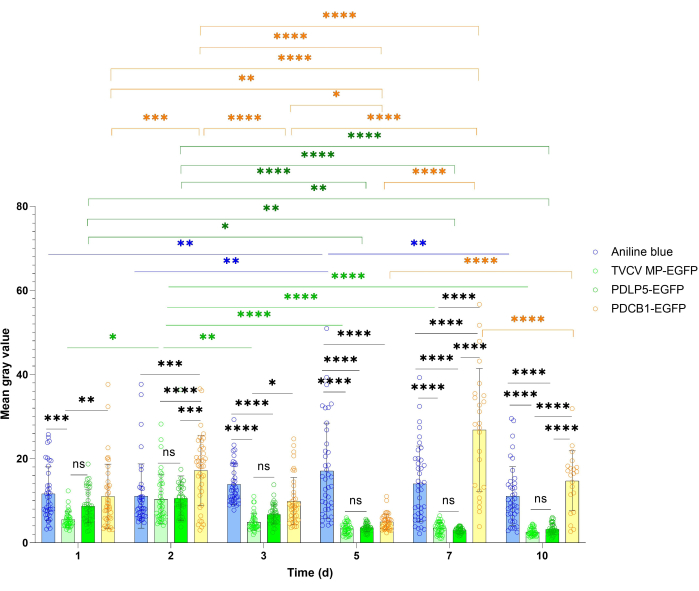
그림 4: Nicotiana benthamiana 및 아닐린 블루 PD 염색에서 일시적으로 발현된 TVCV MP, PDLP5 및 PDCB1의 형광 강도의 시간 경과. 정량적 데이터는 그림 2에 설명된 실험에서 수집되었습니다. 오차 막대는 여러 실험에서 평균의 표준 편차를 나타냅니다. 개별 데이터 포인트는 각 측정의 평균으로 표시됩니다. Tukey의 다중 비교 검정을 사용하여 이원 분산 분석으로 평가한 평균값 간의 차이는 P-값에 대해 통계적으로 유의합니다. *P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.0001; NS는 통계적으로 유의하지 않습니다. 블루 바, 아닐린 염색; 연한 녹색 막대, MP-EGFP, 짙은 녹색 막대, PDLP5-EGFP; 노란색 막대, PDCB1-EGFP. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: Nicotiana benthamiana 및 PD의 아닐린 블루 염색에 의해 일시적으로 발현되는 TVCV MP 및 PDLP5에 의한 PD 반점 형성의 시간 경과. 정량적 데이터는 그림 2에 설명된 실험에서 수집되었습니다. 오차 막대는 여러 실험에서 평균의 표준 편차를 나타냅니다. 개별 데이터 포인트는 각 측정의 평균으로 표시됩니다. Tukey의 다중 비교 검정을 사용하여 이원 분산 분석으로 평가한 평균값 간의 차이는 P-값에 대해 통계적으로 유의합니다. *P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.0001. 블루 바, 아닐린 염색; 연한 녹색 바, MP-EGFP, 짙은 녹색 바, PDLP5-EGFP. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 실험 I | ||||
| 전체 셀 수 | PD 국소화가 있는 세포 | 신호가 혼합된 셀 | PD 국소화가 있는 세포(%) | |
| 아닐린 블루 | 40 | 40 | 4 | 100 |
| MP-EGFP 님 | 40 | 40 | 4 | 100 |
| PDCB1-EGFP | 40 | 3 | 38 | 7.5 |
| PDLP5-EGFP 님 | 40 | 40 | 0 | 100 |
| 실험 II | ||||
| 전체 셀 수 | PD 국소화가 있는 세포 | 신호가 혼합된 셀 | PD 국소화가 있는 세포(%) | |
| 아닐린 블루 | 40 | 40 | 8 | 100 |
| MP-EGFP 님 | 40 | 39 | 8 | 97.5 |
| PDCB1-EGFP | 40 | 12 | 31 | 30 |
| PDLP5-EGFP 님 | 40 | 39 | 2 | 97.5 |
표 1: PD 위치 파악의 효율성.
보충 그림 1: Nicotiana benthamiana에서 일시적으로 발현된 TVCV MP, PDLP5 및 PDCB1의 PD 국소화. 이미지는 5dpi(A), 7dpi(B), 10dpi(C)로 기록되었습니다. EGFP 신호는 녹색이고 플라스티드 자가형광은 빨간색입니다. 스케일 바 = 20 μm. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
정상적인 식물 발달 및 형태 형성 중 및 식물-병원체 상호 작용 중 식물 세포 간 통신 및 세포 간 수송에 대한 모든 세포 생물학적 연구는 내인성 및 병원체로 암호화된 단백질과 식물 세포 간 연결, 즉 플라스모데스마타(PD)의 분류를 검출하고 모니터링해야 합니다. 이러한 실험은 내인성 또는 병원체 유래 여부에 관계없이 PD에 충실하고 일관되게 국한되어 이러한 구조를 장식하고 시각화하는 참조 단백질을 사용함으로써 실질적으로 촉진될 것입니다. 이러한 필요성은 여기에서 세 가지 알려진 PD 국소화 단백질, 즉 애기장대(Arabidopsis) PDLP5 및 PDCB1, 그리고 토바모바이러스 병원체 TVCV의 MP를 선택하여 해결됩니다. 이 단백질은 자가형광 리포터 EGFP로 C-말단에 태그를 지정했으며, 생성된 융합 단백질이 PD로 분류하는 능력은 Nicotiana benthamiana 의 잎에서 일시적인 발현과 발현 조직의 컨포칼 현미경 분석에 따라 결정되었습니다. 이러한 조직에서 PD의 일반적인 시각화를 위해 표준 아닐린 블루 염색 방법이 사용되었습니다.
식물 바이러스 MP는 PD 구조 및 무결성에 미치는 영향과 관련하여 두 가지 주요 그룹으로 나뉘는 것으로 생각됩니다 : PD의 구조적 변화없이 PD 투과성을 가역적으로 증가시키는 MP와 구조를 수정하여 PD를 차단하는 MP입니다. TVCV와 같은 토바모바이러스의 MP는 첫 번째 그룹 MP 그룹에 속하며, 이는 세포 내 국소화 연구를 위한 PD의 매력적인 마커로 자리매김한다27,28.
이 실험은 PDLP5-EGFP 및 MP-EGFP를 PD의 신뢰할 수 있고 재현 가능한 생물학적 마커로 포지셔닝했으며, PD 검출 효율성은 아닐린 블루 염료와 비슷했습니다. PDLP5-EGFP 및 MP-EGFP의 PD 국소화는 10dpi의 전체 관찰 기간에 걸쳐 감지되었으며, 이는 2dpi와 3dpi 사이의 특징적인 PD 국소화 패턴을 관찰하기 위한 최적의 시간이었습니다. 35S 프로모터로부터의 발현이 발현된 유전자의 전사 후 침묵을 초래할 수 있지만, 이는 안정적으로 형질전환된 형질전환 식물에서 장기간 발현 후에 종종 발생한다. 다른 한편으로는, 이러한 강력한 구성 프로모터의 사용은 마커 단백질의 쉬운 검출에 중요하다. 참조 단백질 발현이 7-10dpi 후에 감소하면 더 짧은 기간, 즉 2-3dpi를 사용해야 합니다. PDLP5와 MP 사이의 전반적인 세포내 국소화 패턴에서 유의한 차이는 검출되지 않았으나, PD 외에 MP가 세포핵에 축적되었다는 점을 제외하고는 PDCB1은 ER에 대한 상당한 국소화를 포함하는 세포내 국소화 패턴의 복잡성으로 인해 PD 마커로 사용하는 것은 권장되지 않습니다.
EGFP 형광 신호의 검출 용이성은 식물의 성장 단계에 따라 달라졌습니다. 특히, N. benthamiana에서, 가장 낮은 EGFP 신호 축적은 꽃차례단계 18에서 관찰되었다.
이 연구는 다른 세포 내 구획에 최대한 독점적인 PD 국소화 마커를 개발하는 것을 목표로 했습니다. 따라서, 추가적인 세포 내 국소화 기능을 가진 관심 단백질의 국소화를 위한 참조로서의 사용은 ER, 미토콘드리아, 원형질막 등에 특이적인 것과 같은 다른 세포 내 마커의 발현과 결합되어야 합니다. 이 경우, 이러한 마커의 발현을 위한 추가 아그로박테리움 세포의 포함은 아그로인여과 배양물의 최종 농도, 즉 액체 배양물의 OD600 을 계산할 때 고려되어야 합니다. 분명히, 세포 농도와 식물 성장 시간은 다른 식물 종에서 최대한의 발현 및 PD 국소화 패턴 검출을 위해 조정되어야 합니다.
공개
저자는 상충되는 이해관계가 없음을 선언합니다.
감사의 말
벤처캐피털 연구소의 연구는 NIH(R35GM144059), NSF(MCB 1913165 및 IOS 1758046) 및 BARD(IS-5276-20)의 보조금으로 지원되었습니다. 연구비 제공자는 연구 설계, 데이터 수집, 해석 또는 출판 결정에 아무런 역할도 하지 않았다.
자료
| Name | Company | Catalog Number | Comments |
| ABT AC 1 phase motor | BRANDTECH | ABF63/4C-7RQ | |
| Agrobacterium tumefaciens EHA105 | |||
| Contamination control | CCI | ||
| Gateway BP Clonase II Enzyme mix | Invitrogen | #11789020 | |
| Gateway LR Clonase II Enzyme mix | Invitrogen | #11791020 | |
| GraphPad Prism 8.0.1. | GraphPad Software Inc. | ||
| Image J | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation | ||
| Laser scanning confocal microscope | Zeiss | LSM 900 | |
| Nicotiana benthamiana | Plant species | ||
| pDONR207 | Invitrogen | #12213013 | |
| Q5 High-Fidelity DNA Polymerase | NEB | #M0491S |
참고문헌
- Lee, J., et al. A plasmodesmata-localized protein mediates crosstalk between cell-to-cell communication and innate immunity in Arabidopsis. The Plant Cell. 23 (9), 3353-3373 (2011).
- Benitez-Alfonso, Y., Faulkner, C., Ritzenthaler, C., Maule, A. J. Plasmodesmata gateways to local and systemic virus infection. Mol Plant-Microbe Interact. 23 (11), 1403-1412 (2010).
- Bayer, E. M., Benitez-Alfonso, Y. Plasmodesmata: Channels under pressure. Annu Rev Plant Biol. 75, 21 (2024).
- Maule, A. J. Plasmodesmata: Structure, function and biogenesis. Curr Opin Plant Biol. 11, 680-686 (2008).
- Fernandez-Calvino, L., et al. Arabidopsis plasmodesmal proteome. PLoS One. 6 (4), e18880 (2011).
- Kirk, P., Amsbury, S., German, L., Gaudioso-Pedraza, R., Benitez-Alfonso, Y. A comparative meta-proteomic pipeline for the identification of plasmodesmata proteins and regulatory conditions in diverse plant species. BMC Biol. 20, 128 (2022).
- Levy, A., Erlanger, M., Rosenthal, M., Epel, B. L. A plasmodesmata-associated β-1,3-glucanase in Arabidopsis. The Plant J. 49 (4), 669-682 (2007).
- Kankanala, P., Czymmek, K., Valent, B. Roles for rice membrane dynamics and plasmodesmata during biotrophic invasion by the blast fungus. The Plant Cell. 19 (2), 706-724 (2007).
- Aung, K., et al. Pathogenic bacteria target plant plasmodesmata to colonize and invade surrounding tissues. The Plant Cell. 32 (3), 595-611 (2020).
- Cui, W., Lee, J. Arabidopsis callose synthases CalS1/8 regulate plasmodesmal permeability during stress. Nat Plants. 2 (5), 160 (2016).
- Liu, N. J., et al. Phytosphinganine affects plasmodesmata permeability via facilitating PDLP5-stimulated callose accumulation in Arabidopsis. Mol Plant. 13 (1), 128-143 (2020).
- Caillaud, M. C., et al. The plasmodesmal protein PDLP1 localizes to haustoria-associated membranes during downy mildew infection and regulates callose deposition. PLoS Pathog. 10 (11), e1004496 (2014).
- Li, Z., Su-Ling, L., Christian, M., Walley, J. W., Aung, K. Plasmodesmata-located protein 6 regulates plasmodesmal function in Arabidopsis vasculature. The Plant Cell. , (2024).
- Chen, X., et al. Arabidopsis PDLP7 modulated plasmodesmata function is related to BG10-dependent glucosidase activity required for callose degradation. Sci Bull. , (2024).
- Simpson, C., Thomas, C., Findlay, K., Bayer, E., Maule, A. J. An Arabidopsis GPI-anchor plasmodesmal neck protein with callose binding activity and potential to regulate cell-to-cell trafficking. The Plant Cell. 21 (2), 581-594 (2009).
- Thomas, C. L., Bayer, E. M., Ritzenthaler, C., Fernandez-Calvino, L., Maule, A. J. Specific targeting of a plasmodesmal protein affecting cell-to-cell communication. PLoS Biol. 6 (1), e7 (2008).
- Lim, G., et al. Plasmodesmata localizing proteins regulate transport and signaling during systemic acquired immunity in plants. Cell Host Microbe. 19 (4), 541-549 (2016).
- Sheludko, Y. V., Sindarovska, Y. R., Gerasymenko, I. M., Bannikova, M. A., Kuchuk, N. V. Comparison of several Nicotiana species as hosts for high-scale Agrobacterium-mediated transient expression. Biotechnol Bioeng. 96 (3), 608-614 (2007).
- Walhout, A. J. M., et al. GATEWAY recombinational cloning: Application to the cloning of large numbers of open reading frames or ORFeomes. Methods Enzymol. 328, 575-592 (2000).
- Huang, C., et al. dsRNA-induced immunity targets plasmodesmata and is suppressed by viral movement proteins. The Plant Cell. 35 (10), 3845-3869 (2023).
- Roberts, I. M., et al. Dynamic changes in the frequency and architecture of plasmodesmata during the sink-source transition in tobacco leaves. Protoplasma. 218, 31-44 (2001).
- Yuan, C., Lazarowitz, S. G., Citovsky, V. The plasmodesmal localization signal of TMV MP is recognized by plant synaptotagmin SYTA. mBio. 9 (4), e01314-e01318 (2018).
- Ward, S. J., Ramirez, M. D., Neelakantan, H., Walker, E. A. Cannabidiol prevents the development of cold and mechanical allodynia in paclitaxel-treated female C57Bl6 mice. Anesth Analg. 113 (4), 947-950 (2011).
- Erkkilä, M. T., et al. Widefield fluorescence lifetime imaging of protoporphyrin IX for fluorescence-guided neurosurgery: An ex vivo feasibility study. J Biophotonics. 12 (6), e201800378 (2019).
- Levy, A., Zheng, J. Y., Lazarowitz, S. G. The tobamovirus Turnip vein clearing virus 30-kilodalton movement protein localizes to novel nuclear filaments to enhance virus infection. J Virol. 87 (11), 6428-6440 (2013).
- Yuan, C., Lazarowitz, S. G., Citovsky, V. Identification of a functional plasmodesmal localization signal in a plant viral cell-to-cell-movement protein. mBio. 7 (1), e2052-e2015 (2016).
- Kumar, G., Dasgupta, I. Variability, functions and interactions of plant virus movement proteins: what do we know so far. Microorganisms. 9 (4), 695 (2021).
- Waigmann, E., Ueki, S., Trutnyeva, K., Citovsky, V. The ins and outs of nondestructive cell-to-cell and systemic movement of plant viruses. Crit Rev Plant Sci. 23 (3), 195-250 (2004).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유