Method Article
Интегративный протокол для получения 3D-органоидов печени человека, полученных из ИПСК
В этой статье
Резюме
Полученные из ИПСК 3D органоиды печени человека представляют собой потенциальный инструмент для понимания действия гормона щитовидной железы на развитие печени.
Аннотация
Получение стабильных клеток печени в культуре представляет собой значительную проблему для исследований печени. Учитывая это, был представлен оптимизированный метод с использованием индуцированных плюрипотентных стволовых клеток человека (ИПСК) для получения 3D-культур органоидов печени человека (ГХО). Использование HHO предлагает ценный подход к пониманию развития печени, разгадке заболеваний печени, проведению высокопроизводительных исследований для разработки лекарств и изучению потенциала трансплантации печени. В первом исследовании, с помощью иммунофлюоресценции и количественных методов ОТ-ПЦР, отслеживалось прогрессирование, выявляя присутствие различных клеточных популяций, таких как гепатобласты и два типа клеток, полученных из гепатобластов: холангиоциты или гепатоцитоподобные клетки, на разных стадиях развития. В этом отчете представлен простой 3D-протокол, начиная с ИПСК и заканчивая приобретением HHO, которые отражают стадии развития человеческого эмбриона. Протокол, охватывающий 46-50 дней, включает в себя несколько этапов: (i) тщательное управление культурой hiPSC для получения HHOs, (ii) инициирование дифференцировки клеток в 2D и последующий переход к 3D, и (iii) оптимизированная стратегия диссоциации для расщепления HHO на одиночные клетки для секвенирования РНК одиночных клеток. В качестве иллюстрации широкого применения этого подхода данный протокол ранее применялся для раскрытия роли передачи сигналов гормонов щитовидной железы в развитии клеток печени.
Введение
Печень выполняет различные метаболические функции, такие как регулирование доступности легкоусвояемых энергетических субстратов, таких как глюкоза и кетоновые тела, а также детоксикация ксенобиотических соединений. В последние годы наблюдается значительный рост распространенности заболеваний печени, в основном связанных с неалкогольным стеатогепатитом (НАСГ), который при отсутствии лечения может развиться в цирроз или рак1. Поэтому крайне важно понимать метаболические функции печени и связанные с ней заболевания, чтобы способствовать разработке эффективных методов лечения 2,3.
Появление трехмерных (3D) культур привело к созданию модели органоида, представляющей собой революционный и инновационный подход к рассмотрению функциональности и сложности развития органов4. Органоиды определяются как трехмерные самоорганизованные агрегаты дифференцированных клеток, которые имитируют функции и цитоархитегерство соответствующего органа5.
За последние десятилетия мириады протоколов по органоидам печени человека (HHO) приобрели широкий интерес, начиная от использования различных человеческих клеток, полученных из iPSC6, или только гепатоцитоподобныхклеток7, до включения разнообразных сложных микроокружений факторов роста или ингибиторов и дифференцировочных клеток-предшественников в монослое7 или 3D8. Эти подходы позволяют решать множество потенциальных задач, от высокопроизводительного скрининга лекарств9 до получения более глубокого понимания механизмов, лежащих в основе заболеваний печени10.
Здесь выполнен пошаговый протокол дифференцировки HHO на основе химических сигналов, упомянутых11 , с методологически адаптированными вариациями. Этот протокол начинается с надлежащей обработки и культивирования индуцированных плюрипотентных стволовых клеток человека (hiPSC), подробно описывая методы манипуляций с гелем внеклеточного матрикса, пассирования клеток и дифференцировки в HHO. Процесс начинается со стимуляции дифференцировки ИПСК в дефинитивную энтодерму (ДЭ)12 и последующего имитации in vivo эффектов FGF и BMP для содействия развитию монослойных клеток задней передней кишки (ПФГ)13. 3D-архитектура достигается на 10-й день, когда клетки ПФГ дифференцируются в незрелую печеночную фазу, которая станет гепатобластами, фетальными клетками-предшественниками холангиоцитов и гепатоцитов2. Наконец, 3D-структуры диссоциируются на отдельные клетки для исследований секвенирования РНК. В качестве примера применимости данного протокола было продемонстрировано, как данная модель HHO подходит для изучения действия гормонов щитовидной железы и дейодиназы 2 типа (D2) на развитие гепатоцитов и холангиоцитов14.
протокол
1. Лечение гипертока крови
ПРИМЕЧАНИЕ: ИПСК (клеточная линия CS03iCTR-n3) были коммерчески закуплены. Надлежащее управление гелевым покрытием внеклеточного матрикса и средой ИПСК является ключом к прикреплению ИПСК к пластинам и их питанию. Здесь были описаны объемы, необходимые для одного 6-луночного планшета. Оставшиеся ИПСК из 6-луночного планшета, которые не будут дифференцироваться в органоиды, могут быть сохранены в жидком азоте для длительного хранения.
- Дозирование геля с внеклеточным матриксом и среды hiPSC
- Правильно разморозьте флакон геля с внеклеточным матриксом, поместив в емкость со льдом при температуре 4 °C на ночь.
ПРИМЕЧАНИЕ: Перед выделением квотирования проверьте сертификат анализа, чтобы проверить объем для коэффициента разрежения. Это представляет собой концентрацию белка геля внеклеточного матрикса; Поэтому он варьируется от одного лота к другому. - Распределите гель с внеклеточным матриксом в подходящие аликвоты в соответствии с коэффициентом разбавления (4x, 2x и 1x) с помощью предварительно охлажденных и помеченных пробирок. Добавьте 4-кратный коэффициент разбавления геля внеклеточного матрикса к 25 мл холодного DMEM/F12, чтобы покрыть четыре 6-луночные планшеты. Своевременно запечатайте крышки лабораторной герметизирующей пленкой и заморозьте при температуре -80 °C. Избегайте длительного нахождения на воздухе и образования пузырьков в аликвотах.
- Разморозьте 100 мл добавки hiPSC при температуре 4 °C на ночь. Добавьте его в 400 мл базальной среды hiPSC. После гомогенизации с помощью серологической пипетки объемом 50 мл поместите среду hiPSC в пробирки объемом 40 мл и заморозьте при температуре -20 °C до использования.
- Правильно разморозьте флакон геля с внеклеточным матриксом, поместив в емкость со льдом при температуре 4 °C на ночь.
- Покрытие пластинами для культуры hiPSC
- Нумеруйте и промаркируйте 6-луночные планшеты. Держите рядом одну гелевую аликвоту внеклеточного матрикса, погруженную в сухой лед.
- Для покрытия одного 6-луночного планшета разбавьте одну аликвоту геля внеклеточного матрикса (1x) в 6,25 мл холодного DMEM/F12 (2x в 12,5 мл и 4x в 25 мл DMEM/F12).
- Пипеткой введите небольшой объем DMEM/F12 (~500 μл) в гелевую пробирку с внеклеточным матриксом. Поворачивайте вверх и вниз, чтобы разморозить и гомогенизировать гель внеклеточного матрикса холодным DMEM/F12, предотвращая образование пузырьков, и верните его в остальную часть холодной пробирки, содержащей DMEM/F12, с помощью серологической пипетки для полного перемешивания.
- Внесите 1 мл геля внеклеточного матрикса в DMEM/F12 в одну лунку для покрытия 6-луночной пластины (6 мл для всей пластины). Равномерно распределите 1 мл по поверхности, перемещая, не встряхивая, пластину до полного ее покрытия.
- Дайте постоять при комнатной температуре (RT) в течение 1 часа перед использованием. Если 6-луночный планшет используется не полностью, закройте его лабораторной герметизирующей пленкой и храните в холодильнике при температуре 4 °C.
ПРИМЕЧАНИЕ: Тарелку с покрытием можно хранить в холодильнике в течение 1 недели при температуре 4 °C.
- Размораживание и культивирование гиПСК
- Заранее рассчитайте объем среды hiPSC и прогрейте при РТ вместе с 6-луночным покрытием планшета за 1 ч до применения (2 мл на лунку).
ПРИМЕЧАНИЕ: В случае холодных или замороженных аликвот погрузите их в инкубатор с температурой 37 °C или водяную баню за 15 минут до использования. - Разделите 1 мл ИПСК в жидкости N2 из криовиала на 3 лунки 6-луночного планшета (соотношение 1:3). Для целого 6-луночного планшета используйте 2 криовалиала. Здесь в протоколе описывается размораживание и культивирование ИПСК из одного криовиала. Повторите процесс для 2 криовалиалов.
- Введите криовиал, содержащий примерно 1 мл замороженных ИПСК через колпачок и пропустив его через поверхностную воду, при этом дно флакона погрузить на водяную баню при температуре 37 °C до размораживания.
- После размораживания распылите на криовиал этанол и пипеткой нанесите 1 мл ИПСК с пипеткой. Медленно дозируйте в пустую коническую пробирку объемом 15 мл. Добавляйте 5 мл теплой среды hiPSC по каплям, осторожно встряхивая пробирку.
- Центрифугируйте пробирку при давлении 300 x g в течение 5 мин при RT. Осторожно удалите надосадочную жидкость путем аспирации стеклянной пипеткой, подключенной к вакууму, не разрушая гранулу, оставляя некоторое количество остаточной среды. Осторожно ресуспендируйте гранулу в 6 мл среды, а затем добавьте по 2 мл на лунку в 3 лунки 6-луночного планшета.
ПРИМЕЧАНИЕ: Оставляйте небольшие скопления иПСК для правильного роста. - Согните 6-луночную пластину и аспирируйте гель внеклеточного матрикса с ранее покрытой пластины, не касаясь кончика до дна лунки.
- Переведите 2 мл среды с ИПСК на лунку. Осторожно встряхните пластину вперед, назад и из стороны в сторону, чтобы равномерно распределить агрегаты hiPSC на пластине.
- Поместите 6-луночный планшет в инкубатор при температуре 37 °C, 5%CO2 и влажности 95%. Ежедневно меняйте среду (2 мл на лунку), проверяя прогрессирующий рост.
- Пассаж ИПСК при приобретении 80% слияния роста (через 4-5 дней; см. рисунок 1А). Характеристики здоровых и пролиферативных ИПСК включают четкие границы и плотную упаковку крупных ядер в центре растущих клеточных агрегаций.
- Заранее рассчитайте объем среды hiPSC и прогрейте при РТ вместе с 6-луночным покрытием планшета за 1 ч до применения (2 мл на лунку).
- Пассирование ИПСК
- Как только hiPSCs достигнут 80% конфлюенции, что указывает примерно на 1,2 x 106 клеток на лунку, они проходят в новую 6-луночную пластину. Разделите в соотношении 1:3 (от 1 лунки к 3), или отрегулируйте соотношение (1:4; 1:6) в соответствии с требованиями эксперимента.
- Перед сдачей необходимо провести заделку геля из внеклеточного матрикса для соответствующего количества 6-луночных планшетов, как описано в шаге 1.2.
- Удалите надосадочную жидкость из каждой лунки и добавьте 2 мл PBS на лунку. Аспирация PBS с последующим добавлением 1 мл отслаивающей среды hiPSC в лунку в течение 1 мин. Затем удалите 1 мл отслаивающей среды с ИПСК.
- Поместите 6-луночный планшет в инкубатор при температуре 37 °C на 7 минут. Добавьте 1 мл среды hiPSC на лунку. Отделите и соберите путем пипетирования 1 мл среды hiPSC с клетками в пробирку объемом 15 мл.
- Центрифугируйте пробирку при 300 x g в течение 5 минут при RT. Чтобы поместить клетки в 6-луночный планшет, повторите шаги 1.3.5-1.3.7. Поместите 6-луночный планшет в инкубатор при температуре 37 °C, 5%CO2 и влажности 95%. Перейдите к шагу 1.5. для замораживания hiPSC при необходимости.
- Замораживание hiPSC (по желанию)
ПРИМЕЧАНИЕ: Количество ИПСК необходимое, необходимое для продвижения в НО, может привести к образованию остаточных скважин, которые могут храниться в течение длительного времени. Если возникает необходимость в расширении прохода для криовиального хранения, ИПСК могут поддерживаться в течение длительного времени.- Разморозьте необходимый объем криоконсервирующей среды (1 мл на лунку клеток) в лед при температуре 4 °С. Маркировка криопробирок с указанием количества пассажей, даты и клеточной линии. Отсоедините ячейки с помощью отсоединяющей среды hiPSC, как показано на шаге 1.4. в конической пробирке объемом 15 мл.
- Центрифугируйте при 300 x g в течение 5 минут при RT. Полностью аспирируйте надосадочную жидкость, осторожно оставляя клеточную гранулу нетронутой. Предусмотрительно ресуспендировать гранулу в 1 мл холодной криоконсервирующей среды (на лунку), оставив агрегаты hiPSC.
ПРИМЕЧАНИЕ: Если лунки имеют низкую плотность, менее 50% сливаемости, на каждые 2 лунки можно использовать 1 мл среды для криоконсервации. - Перенесите 1 мл среды для криоконсервации с ИПСК в криопробирку. Осторожно взбалтывайте криопробирку, чтобы гомогенизировать содержимое клеток.
ПРИМЕЧАНИЕ: Если вы готовите больше пробирок для криоконсервации, оставьте уже подготовленные пробирки во льду. - Поместите пробирки в контейнер для заморозки с контролируемой скоростью при температуре -80 °C на ночь. Перенесите трубки в бак с жидким азотом через 24 часа.
2. Пошаговая дифференциация от ИПСК в печеночные органоиды
ПРИМЕЧАНИЕ: Восстановление реагентов было выполнено и соблюдалось в соответствии с рекомендациями производителя.
- 2D-дифференциация от hiPSC до DE (день 0-день 4 (от D-0 до D-4); Рисунок 1В)
- После 3 пассажей, если клетки здоровы и растут хорошо и быстро, приступают к дифференцировке ИПСК. Покройте 6-луночный планшет, как описано в шаге 1.2. Чтобы дифференцировать hiPSC и DE, используйте набор DE, следуя инструкциям производителя.
- Перед началом дифференцировки культивируют ИПСК в соотношении пассажей 2:1 (из 6 лунок получить 3 для начала дифференцировки) в течение 24 ч до достижения концентрации клеток в лунке, указанной в инструкции к ДЭ.
- Выполните дифференциацию в соответствии с протоколом производителя со следующими изменениями.
- Увеличьте концентрацию Y-27632, добавляемого в hiPSC, с 10 мкМ до 50 мкМ (за сутки до начала дифференцировки).
- Увеличьте дозу диссоциационного реагента на 1,5 мл на лунку, а также объем DMEM/F12 до того же количества на лунку в расчете на реагент диссоциации. Добавьте 1 мл DMEM/F12 (из 1,5) в каждую лунку, и еще 0,5 мл скопируйте в пробирку объемом 15 или 50 мл.
- Дифференцировка клеток ДЭ в клетки ПФГ (от D-4 до D-10; Рисунок 1С)
- Приготовьте среду PFG (Advanced DMEM/F12 в качестве базальной среды, 1x добавку Glutamax, 1x добавку B27, 20 нг/мл BMP4, 10 нг/мл FGF2) для дифференцировки клеток DE за несколько дней до индукции в PFG и храните ее при 4 °C.
ПРИМЕЧАНИЕ: B27 содержит T3 в своем составе. В случае исследования гормонов щитовидной железы (ТГ) с этого момента B27 следует заменить на домашний B2615 , который не содержит TH. - Прогрейте среду PFG (2 мл на лунку) и продвинутый DMEM/F12 при 37 °C в течение 15 мин или RT в течение 1 ч. Наклонитесь над планшетом и аспирируйте среду ДЭ из лунок с помощью стеклянной пипетки, подключенной к вакууму (или вручную с помощью пипетки Р1000), не царапая клетки.
- Добавьте 2 мл теплого усовершенствованного DMEM/F12 на лунку, а затем аспирируйте его. Добавьте 2 мл теплой среды PFG на лунку в 6-луночный планшет. Меняйте средство ежедневно в течение следующих 6 дней.
- Приготовьте среду PFG (Advanced DMEM/F12 в качестве базальной среды, 1x добавку Glutamax, 1x добавку B27, 20 нг/мл BMP4, 10 нг/мл FGF2) для дифференцировки клеток DE за несколько дней до индукции в PFG и храните ее при 4 °C.
- Индукция из 2D клеток ПФГ в 3D незрелые органоиды печени (IHO; с Д-10 по Д-18)
ПРИМЕЧАНИЕ: Требуется около 30 000-35 000 элементов в 30 μл, добавляемых в каждую лунку 96-луночного планшета ULA. Коэффициент прохода составляет 2:1, из 2 лунок (6-луночный планшет) с монослоем дифференцированных клеток ПФГ; он обеспечит полноценную 96-луночную пластину со сверхнизким прикреплением (ULA) (Рисунок 1D).- Перед началом приема 3D органоидов или в более ранние дни предварительно приготовьте среду IHO (Advanced DMEM/F12 в качестве базальной среды, 1x добавка N2, 1x B27, 50 нМ A83-01, 30 мкМ дексаметазон, 5 мкМ CHIR99021, 500 нМ вальпроевая кислота, 50 нг/мл эпидермального фактора роста человека (EGF), 20 нг/мл фактора роста гепатоцитов человека (HGF), 40 нг/мл Jagged-1, 300 нг/мл N-6,20-О-дибутириладенозина 30,50-циклической 35-монофосфатной натриевой соли (dbCAMP), 10 мкМ никотинамида) и хранить его при 4 °С.
- Наклейте этикетку на 96-луночную пластину со сверхнизким креплением (ULA). Для отделения клеток ПФГ используйте фермент диссоциации клеток в соответствии с инструкциями производителя.
- Перед использованием нагрейте фермент диссоциации, усовершенствованный DMEM/F12 и PBS до 37 °C. Отсадите и выбросьте среду ПФГ из лунок. Добавьте 2 мл PBS на лунку, затем аспирируйте его.
- Добавьте 1,5 мл фермента диссоциации клеток в лунку при температуре 37 °C в течение 7 минут, чтобы отделить клетки от лунки. Не удаляя фермент диссоциации клеток, добавьте 1 мл усовершенствованного DMEM. Соберите все клетки и добавьте их в пробирку объемом 50 мл.
- Подсчитайте количество клеток на мл с помощью клеточного счетчика или гемоцитометра. Центрифугируйте при 150 x g в течение 8 мин.
- К грануле добавьте соответствующий объем (3 мл среды IHO для всего 96-луночного планшета ULA) и 1x гель внеклеточного матрикса, чтобы довести до конечного необходимого количества клеток (30 000-35 000 клеток).
- Поместите планшет на 96 лунок в инкубатор с температурой до 37 °C, 5%CO2 и влажностью 95%. Через 24 ч (D-11) клетки перегруппируются в круглую форму; добавьте 50 мкл на лунку среды IHO.
- На следующий день (D-12) увеличьте до 100 мкл среды IHO на лунку. В D14 удалите ~100-120 мкл из каждой лунки либо с помощью стеклянной пипетки, подключенной к вакууму, либо с помощью пипетки по одной. Следите за тем, чтобы не допустить аспирации органоидов. Добавьте 100 мкл среды IHO в D-14 и D-16.
ПРИМЕЧАНИЕ: После D-16, из-за отсутствия движения, появляется чрезмерный рост, который исчезает после D18.
- Органоиды гепатобластов (ГБО, от D-18 до D-26)
ПРИМЕЧАНИЕ: На этом этапе IHO с 96-луночной пластины ULA будут перемещены в 6-луночную пластину ULA. Для 96 IHO, полученных на предыдущей стадии, в каждую скважину было помещено 10 органоидов, что в общей сложности представляет собой 1 и 1/2 6-луночных планшетов ULA для продолжения созревания (Рисунок 1E).- Как и на предыдущих этапах дифференцировки, подготовьте среду для дифференцировки ГБО в предыдущие дни.
- Коктейль реагентов, используемых для дифференцировки в ГБО, описан на шаге 2.3. Удалите вальпроевую кислоту и включите в коктейль следующие биохимические вещества: BMP7, BMP4 и FGF7. Окончательный состав представляет собой усовершенствованный DMEM/F12 в качестве базальной среды, 1x добавку N2, 1x B27, 50 нМ A83-01, 30 мкМ Дексаметазон, 5 мкМ CHIR99021, 500 нМ вальпроевую кислоту, 50 нг/мл эпидермального фактора роста человека (EGF), 20 нг/мл фактора роста гепатоцитов человека (HGF), 40 нг/мл Jagged-1, 300 нг/мл N-6,20-O-дибутириладенозин 30,50-циклический 35 монофосфат натрия соль (dbCAMP), 10 мкМ никотинамид, 25 нг/мл FGF7, 50 нг/мл BMP4, 20 нг/мл BMP7.
- Предварительно подогрейте HBO medium (3 мл на лунку) и Advanced DMEM/F12 (3 мл на лунку) при 37 °C. Добавьте в каждую лунку по 3 мл теплого усовершенствованного DMEM/F12.
- Распределите 10 органоидов IHO в лунку из 96-луночного планшета с наконечником шириной 200 мл. Извлеките усовершенствованный DMEM/F12, наклонившись над пластиной и отсосав его с помощью стеклянной пипетки, подключенной к вакууму (или вручную с помощью P1000).
- Добавьте 3 мл теплой среды ГБО на лунку. Включите и поместите 6-луночные планшеты ULA на мультиплатформенный шейкер при 65 об/мин внутри инкубатора, установленного при температуре 37 °C, 5%CO2 и влажности 95%. Через 4 дня (Д-22) и 6 дней (Д-24) замените среду ГБО (3 мл на лунку).
- Как и на предыдущих этапах дифференцировки, подготовьте среду для дифференцировки ГБО в предыдущие дни.
- Созревание в печеночные органоиды (ГО) в 2 различные фазы (от D-26 до D-46)
ПРИМЕЧАНИЕ: Это последний процесс созревания, который происходит в два периода дифференцировки в зависимости от содержания и типа реагентов в среде.- Заранее приготовьте первую среду HO (HO1) и храните ее при температуре 4 °C. Удалите Jagged1 и уменьшите концентрацию CHIR99021 по сравнению со средой HBO. Окончательный состав: Advanced DMEM/F12 в качестве базальной среды, 1x N2 добавка, 1x B27, 500 нМ A83-01, 30 мкМ Дексаметазон, 2 мкМ CHIR99021, 50 нг/мл эпидермального фактора роста человека (EGF), 20 нг/мл фактора роста гепатоцитов человека (HGF), 300 нг/мл N-6,20-О-дибутирилиладенозин 30,50-циклической 35 монофосфатной натриевой соли (dbCAMP), 10 мкМ никотинамида, 25 нг/мл FGF7, 20 нг/мл BMP4, 20 нг/мл BMP7.
- Нагрейте среду Advanced DMEM/F12 и HO1 до 37 °C перед использованием. В том же 6-луночном планшете ULA осторожно отсасывайте предыдущую среду HBO, наклонившись над пластиной и поместив кончик стеклянной пипетки, подключенной к вакууму, к стене (или вручную с помощью пипетки P1000).
- Добавьте 3 мл теплого Advanced DMEM/F12 на лунку и аспирируйте его. Добавьте 3 мл теплой среды HO1 на лунку. Меняйте среду HO1 каждые 3 дня (D-29, D-32, D-35, D-38) вместе со сбором образца.
- На этапе D 38 модифицируйте коктейль реагентов для второго периода HO (HO2), удаляя CHIR99021, BMP4, dbcAMP и FGF7 и заменяя их FGF19 и DAPT. Конечная композиция среды представляет собой усовершенствованный DMEM/F12 в качестве базальной среды, 1x добавку N2, 1x B27, 500 нМ A83-01, 30 мкМ дексаметазона, 50 нг/мл эпидермального фактора роста человека (EGF), 20 нг/мл фактора роста гепатоцитов человека (HGF), 10 мкМ никотинамида, 20 нг/мл BMP7, 25 нг/мл FGF19, 5 мкМ DAPT.
- Нагрейте среду Advanced DMEM/F12 и HO2 до 37 °C перед использованием. Продолжайте с помощью 6-луночного планшета ULA и осторожно аспирируйте предыдущую среду HO1. Добавьте 3 мл Advanced DMEM/F12 в лунку и удалите его.
- Добавьте 3 мл теплой среды HO2 на лунку. Меняйте носитель HO2 каждые 4 дня (D-42, D-46, D-50, ...) и отбирайте образцы в те же дни, что и носитель.
3. Диссоциация одиночных клеток
Примечание: Этот шаг имеет решающее значение для метода секвенирования РНК одиночных клеток. Количество органоидов может варьироваться в зависимости от размера, и чем старше день диссоциации, тем больше количество клеток в органоидах. В прежние времена количество диссоциированных органоидов увеличивалось, а время диссоциации уменьшалось в равных количествах. Диссоциацию проводили с 10 органоидами в D-14 и D-17, 8 органоидами в D-23 и D-26 и 6 органоидами в D-30 и D-45. Процедуры для одного кластера органоидов подробно описаны (рис. 1F).
- Приготовление реагентов
- Приготовьте Advanced-DMEM с конечной концентрацией 7,5% бычьего альбумина фракции V (BSA) и отфильтруйте после гомогенизации.
- Приготовьте 1 мл среды фермента диссоциации с 1 мл трипсина 0,5% - ЭДТА (10х) в качестве базальной среды, 50 мкМ Y-27632, 40 Ед/мкл ингибитора РНКазы и 1 Ед/мкл ДНКазы I.
- Приготовьте среду для инактивации трипсина с 2 мл Advanced DMEM/F12 + 7,5% BSA в качестве базальной среды, 50 мкМ Y-27632, 40 Ед/мкл ингибитора РНКазы и 1 Ед/мкл ДНКазы I.
- Перед началом работы нагрейте фильтрующий материал и PBS до 37 °C.
- Диссоциация HHO
- Очистите рабочее место и инструменты с помощью очистителя РНКаза. Соберите количество органоидов в соответствии со днем дифференцировки в полипропиленовую пробирку объемом 15 мл с широко открытым наконечником.
- Постирайте PBS 2x-3x. Добавьте 1 мл среды диссоциации фермента в пробирку объемом 15 мл с собранными органоидами и выдержите при температуре 37 °C в коромысле при 30 об/мин в течение 5 минут.
ВНИМАНИЕ: Будьте осторожны и не роняйте трубку с коромысла. - Через 5 минут сначала проверьте колпачок на наличие оставшихся органоидов, затем механически разрушьте органоиды с помощью P1000, вращая вверх и вниз 10 раз для каждого органоида (всего 60 раз). Повторите то же самое нарушение с P200. Проверьте крышку трубки на случай, если на ней не застрянут органоиды.
- Поместите пробирку объемом 15 мл снова на коромысле в инкубатор еще на 5 минут. Повторите процесс, описанный в пункте 4, начиная с вращения P200 вверх и вниз и продолжая серологической пипеткой объемом 1 мл, подключенной к наконечнику P10.
- Снова поместите пробирку объемом 15 мл на коромысле в инкубатор на последние 5 минут. В случае отсутствия диссоциации оставьте еще на 5 минут и повторите ручное прерывание.
- Добавьте 1 мл инактивирующей среды трипсина и гомогенизируйте ее. Поместите новую полипропиленовую пробирку объемом 15 мл с клеточным фильтром 40 μм сверху. Отфильтруйте 2 мл (клетки со средой для диссоциации фермента и средой для инактивации трипсина) через клеточный фильтр 40 мкм в пробирку объемом 15 мл.
- Добавьте еще 1 мл инактивирующей среды для трипсина, чтобы извлечь все оставшиеся клетки из клеточного фильтра размером 40 мкм.
- Возьмите 5 мкл одноклеточной среды, смешанной с 5 мкл раствора красителя, чтобы подсчитать количество диссоциированных клеток, чтобы приступить к их фиксации. Подсчитайте клетки после центрифугирования и ресуспензии с помощью первого реагента из набора для фиксации и выполните фильтрацию клеток с помощью клеточного фильтра 40 мкм.
Результаты
Каждый этап этого протокола ступенчатой дифференцировки от ИПСК в ГОК определяли с помощью количественных измерений методом количественной ПЦР и иммунофлюоресценции специфичных для стадий маркеров, известных из библиографии (рис. 2). Пошаговая последовательность обоих методов и достигнутые результаты, связанные с правильной дифференциацией на ОО, были изображены в14. В предыдущем исследовании ИПСК определялись по уровням мРНК POU5F1 (также известного как OCT4) и SOX2, двух хорошо известных факторов Яманаки16, которые снижались с течением времени (рис. 2A). Впоследствии были измерены уровни мРНК маркеров DE11 , таких как OTX2, CER1 и FOXA2, а также маркеров PFG11 HNF4A, CDX2 и TBX3, а также локализованная экспрессия OTX2, HNF4A и TBX3 с помощью иммунофлуоресценции (рис. 2A, B). После 3D продвижения, следить за прогрессированием иммунофлюоресценции альбумина и HNF4a (рисунок 2С); пролиферативный маркер MKI6717 и TBX3, важный в регуляции гепатобласта18 (рисунок 2D), был выполнен из D-18 в D-46. В частности, альбумин колокализован с HNF4a (рисунок 2C); между тем, MKI67 время от времени появлялся на D-46 (рисунок 2D). Кроме того, гепатоцитарные и холангиоцитоподобные клетки были идентифицированы по уровням мРНК и иммунофлуоресценции HNF4A19 и KRT718 в D-46 (рис. 2E).
Объем развивающихся органоидов прогрессивно увеличивался от D-14 к D-38, о чем свидетельствует ~2-кратное увеличение уровней мРНК пролиферативного маркера MKI67 на D-22 по сравнению с D-10. Отсутствие Т4 в среде приводило к повышению уровня мРНК MKI67 на ~20% и ~75% на D-14 и D-18 соответственно по сравнению с 10-м днем (рис. 3А). Чтобы доказать функциональность печеночного органоида, с помощью иммуноферментного анализа были измерены уровни альбумина, аполипопротеина B и A114 , собранных из среды печеночных органоидов. На D-42 и D-46 уровни мРНК ALB оставались значительно выше в T4-HO по сравнению с T3-HO или V-Ho в 3,0 и 2,5 раза соответственно (рис. 3B). С другой стороны, уровни APOB были в ~10 и 3 раза выше (рисунок 3C), а уровни APOA1 были в ~3 раза и ~2 раза выше (рисунок 3D) у D-42 и D-46 соответственно.
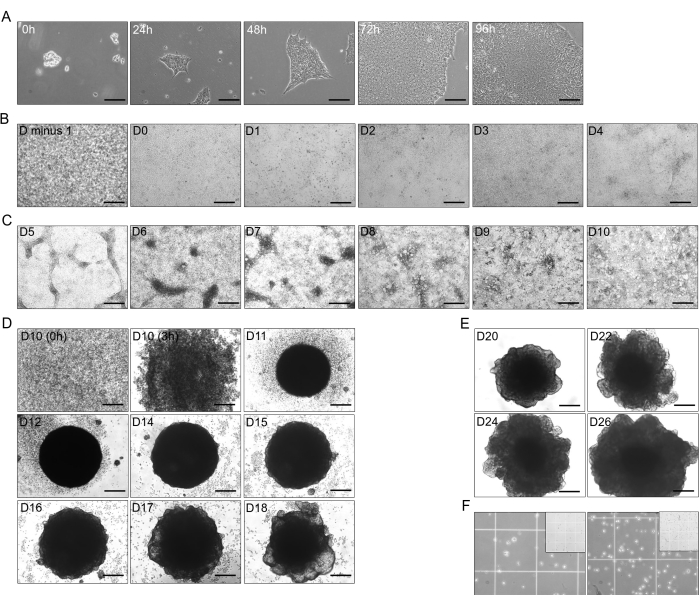
Рисунок 1: Стадии дифференцировки от hiPSC к печеночным органоидам. (A) Переходный рост hiPSC (линия CS03iCTR-n3) от 0 ч до 96 ч, достигающий примерно 70%-80% слияния в лунках одного планшета. Масштабная линейка: 125 мкм. (B) Прогрессирование начальной стадии дифференцировки гиПСК в дефинитивную энтодерму (ДЭ), показывающее 100% слияние в предыдущий день (D минус 1) через 24 ч и дифференцировку до D4 (от D-0 до D-4). Масштабная линейка: 300 мкм. (C) Дифференцировка от DE (D-4) в заднюю переднюю кишку (PFG; D-10) с T4 добавлен B26. Масштабная линейка: 300 мкм. (D) Трансформация 2D-PFG в 3D незрелые органоиды печени (IHO) с добавлением T4-B26 из D-10 в виде одиночных клеток до D-18, за исключением D-13. Масштабная линейка: 300 мкм. (E) Поддержание и рост органоидов гепатобластов (ГБО) с добавлением Т4 B26 в D-20, D-22, D-24 и D-26. Масштабная линейка: 300 мкм. (F) Диссоциация HBO в D-26 (~2,5 x 105 клеток в 750 μL; слева) и HO1 в D-30 (~4 x 105 клеток в 750 μL; справа) на одиночные клетки с добавлением T4-B26. На врезке показан квадратный размер камеры Нойбауэра 1 мм, в то время как меньший квадрат имеет размер 250 мкм. Изображения были сделаны в HHO, у которых свободная концентрация Т4, используемая в среде, составляла ~15 пМ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Мониторинг и характеристика дифференциации HHO. (A) Экспрессия уровней мРНК маркеров hiPSC (POU5F1, SOX2), определенной энтодермы (DE; OTX2, CER1, FOXA2) и задней передней кишки (PFG; TBX3, HNF4A, CDX2). (iPSC, n=8; DE и PFG n=7; HNF4A в ПФГ, n=6). (B) Иммунофлюоресценция при hiPSC, DE и PFG OTX2 (вверху, красный), HNF4A (средний, зеленый) и TBX3 (внизу, красный). (C) «Иммунофлюоресценция на D-18, D-26 и D-46 альбумина (красный) и HNF4A (зеленый). (D) Иммунофлюоресценция на D-18, D-26 и D-46 MKI67 (зеленый) и TBX3 (красный). (E) Иммунофлуоресценция на уровне D-46 альбумина (маркер гепатоцитов; красный) и KRT7 (маркер холангиоцитов; зеленый). Ядра показаны с помощью 4',6-диамидино-2-фенилиндола (DAPI). Эта цифра была изменена по сравнению сцифрой 14. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Анализ созревания HHO. (A) Относительные уровни мРНК пролиферативного маркера MKI67 в отсутствие TH (черный) по сравнению со свободным T4 при ~15 pM (красный) в среде от D-10 до D-46 (n=4, за исключением T4-HOs при D-42, n=2; и при D-46, n=3). (B) Уровни альбумина измеряли в среде от D-35 до D-50 в трех условиях: отсутствие TH (черный), со свободным T4 при ~15 pM (красный) и свободным T3 при ~10 pM (синий; n=4). (С, Г) Уровни аполипопротеинов B (APOB) и A1 (APOA1) измерялись в среде от D-35 до D-50 в трех условиях: отсутствие TH (черный); и со свободным T4 при ~15 pM (красный). Данные с 10 органоидов на лунку (n=4). Двусторонний t-критерий Стьюдента для сравнения V-HO с T4-HO днями и односторонний ANOVA и тест Тьюки были использованы для множественных сравнений. Данные представляют собой среднее значение дубликатов, представленное в виде выровненных точечных диаграмм и их среднего значения. *: p<0.05; **: p<0.01; : р<0,001; : p<0.0001. Ось x указывает дни дифференцировки. Эта цифра была изменена по сравнению сцифрой 14. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Текущий протокол предлагает различные методологические детали того, как работать с гиПСК и последующими 3D-культурами органоидов. Это включает в себя два основных критических этапа: (i) отделение двухмерных культур и последующее их развитие в трехмерные органоиды печени через 10 дней, а также (ii) тонкая диссоциация трехмерной структуры на отдельные клетки. Основываясь на имеющейся информации, это первый отчет о 3D-модели HHO для изучения действия гормонов щитовидной железы, демонстрирующий пиковую экспрессию DIO2 в гепатобластоподобных клетках14 , как это первоначально было идентифицировано у мышей20 печени P1.
Как и во многих других методах, использующих каркасы, наносимые на клетки, гель внеклеточного матрикса был использован для имитации внеклеточного матрикса21, тем самым облегчая сборку в характерную трехмерную структуру органоидов. Термочувствительный характер этого реагента подчеркивает важность манипуляций с ним, сохраняя его замороженным и, во время работы, погруженным в лед. Следовательно, использование другого геля с внеклеточным матриксомвозможно22, хотя в этом протоколе ИПСК не прикреплялись и не пролиферировали в пластине с отсутствием каркаса, что делает его надлежащее управление решающим аспектом в начале протокола, наряду с генерацией трехмерных органоидов.
После завершения дифференцировки ГК жизнеспособная диссоциация органоидов в отдельные клетки представляла собой еще одно серьезное препятствие, которое необходимо было преодолеть, поскольку механические нарушения могут спровоцировать гибель клеток, к тому времени данные секвенирования РНК низкогокачества. Для обеспечения оптимальных результатов настоящий протокол показал, что может быть достигнуто более 70% жизнеспособности одиночных клеток с диссоциацией более 105 клеток до и после фиксации для последующего штрихкодирования.
В отличие от других рукописей, описывающих только один тип клеток в органоидах7, дифференцировка HHO включает по крайней мере две клетки, происходящие из гепатобластов: гепатоциты и холангиоциты. Включение двух реагентов, ответственных за их образование, HFG24 и EGF25, а также дексаметазона26, который способствует созреванию гепатоцитов, и Jagged-118, который активирует передачу сигналов Notch, ведущую к холангиоцитам. Эта переплетенная сигнальная сеть при разработке ОГ позволяет достичь 3D-структуры и мимикрировать эксперименты in vivo, в дополнение к преодолению недостатка снижения дифференцировки долговременных культур первичных гепатоцитов27. Примечательно, что, несмотря на экспрессию типичных для взрослых печеночных маркеров, присутствие фетальных маркеров в поздних фазах органоидов28 все еще может быть обнаружено, как это демонстрирует данный протокол. Это, по сути, отражает нормальное развитие печени у человека, у которого печеночные маркеры плода могут быть в норме обнаружены до 1 годажизни29.
Нечастым явлением, наблюдаемым во время развития ИПСК в ГОО (особенно в незрелые периоды ГО, например, в последние дни ИГО и некоторых ГБО и ГО1), было появление чрезмерно развитых кистозных структур, которые в конечном итоге исчезали, как только пластины помещались на шейкер. Это непропорциональное прогрессирование кистозных структур предполагает наличие некротического ядра к тому времени, необходимость более высокого орошения30 с более частыми изменениями среды или добавление небольших объемов геля внеклеточного матрикса для устранения чрезмерного роста кисты.
В отличие от первоначальной публикации, в которой основное внимание уделялось увеличению числа органоидов в последний период дифференцировки для высокопроизводительного скрининга лекарственныхсредств11, метод, о котором сообщается, представил использование планшетов ULA для содействия раннему образованию 3D-органоидов большого размера и облегчения работы с HHO. Эти корректировки демонстрируют гибкость и широкий спектр исследований, которые могут быть выполнены с помощью этого простого протокола.
Раскрытие информации
Антонио К. Бьянко является консультантом компаний Abbvie, Acella, Aligos, Synthonics. У других авторов нет соответствующих разоблачений.
Благодарности
Эта работа была поддержана Национальным институтом диабета, болезней пищеварительной системы и почек (NIDDK -DK58538, DK65066, DK77148; ACB).
Материалы
| Name | Company | Catalog Number | Comments |
| 10 µL Universal Pipette Tips Filtered, Low rentention, Pre-sterile | VWR | 613-6462 | All procedures |
| 1000 µL Universal Pipette Tips Filtered, Low rentention, Pre-sterile | VWR | 613-6470 | All procedures |
| 15 mL Polypropilene Conical Tube | Falcon (Corning) | 352097 | Dissociation Hepatic Organoids |
| 200 µL Universal Pipette Tips Filtered, Low rentention, Pre-sterile | VWR | 613-6465 | All procedures |
| 3,3',5-Triiodo-L-thyronine | Sigma | T2877-100 | Hepatic Organoid differentiation |
| 40 μm Cell Strainer | Corning | 431750 | Dissociation Hepatic Organoids |
| 50 mL tube | Falcon (Corning) | 352070 | All procedures |
| 6 well-plate Nunc Cell-Culture Treated Multidishes | Thermo fisher scientific | 140675 | hiPSC maintenance |
| A83-01 | R&D Systems | 2939/10 | Hepatic Organoid differentiation |
| Advanced DMEM/F12 | Gibco | 12634010 | Hepatic Organoid differentiation |
| ART Wide Bore Filtered Pipette Tips | ART | 2069GPK | All procedures |
| B27 supplement | Gibco | 17504044 | Hepatic Organoid differentiation |
| BMP7 | R&D Systems | 354-BP-010/CF | Hepatic Organoid differentiation |
| Bovine Albumin Fraction V (7.5% solution) | Gibco | 15260037 | Dissociation Hepatic Organoids |
| BSA, Fraction V, Fatty Acid Free for Tissue Culture | GoldBio | A-421-100 | Dissociation Hepatic Organoids |
| CHIR99021 | R&D Systems | 4423/10 | Hepatic Organoid differentiation |
| Corning 96-well Clear Flat Bottom Ultra-Low Attachment | Corning | 3474 | Hepatic Organoid differentiation |
| Costar 6-well Clear Flat Bottom Ultra-Low Attachment | Corning | 3471 | Hepatic Organoid differentiation |
| CS03iCTR-n3 human induced Pluripotent Stem Cell line | Cedar-sinai | hiPSC maintenance | |
| DAPT | R&D Systems | 2634/10 | Hepatic Organoid differentiation |
| dbCAMP | Millipore Sigma | D0627-100MG | Hepatic Organoid differentiation |
| Dexamethasone | R&D Systems | 1126/100 | Hepatic Organoid differentiation |
| DMEM/F12 | Gibco | 11320033 | hiPSC maintenance |
| DNAse I, RNase-free, HC | Thermo Fisher scientific | EN0523 | Dissociation Hepatic Organoids |
| Falcon 10 mL Serological Pipet, Polystyrene, 0.1 Increments, Individually Packed, Sterile | Corning | 357551 | All procedures |
| Falcon 5 mL Serological Pipet, Polystyrene, 0.1 Increments, Individually Packed, Sterile | Corning | 357543 | All procedures |
| Falcon 50 mL Serological pipet, Polystyrene, 1.0 Increments, Individually Packed, Sterile | Corning | 357550 | All procedures |
| Gentle Cell Dissociation Reagent (GCDR) | Stemcell Technologies | 100-0485 | Hepatic Organoid differentiation |
| Glutamax supplement | Gibco | 35050061 | Hepatic Organoid differentiation |
| L-Thyroxine | Sigma | T1775-1G | Hepatic Organoid differentiation |
| Matrigel hESC-Qualified Matrix, LDEV-free, 5 mL | Corning | 354277 | Extracellular matrix gel |
| mFreSR | Stemcell Technologies | 5855 | hiPSC cryopreservation medium |
| mTeSR 5x Supplement | Stemcell Technologies | 100-0276 | hiPSC medium |
| mTeSR Plus | Stemcell Technologies | 100-0276 | hiPSC medium |
| Multi Platform Shaker | Fisherbrand (Thermo Fisher technologies) | 88861021 | Hepatic Organoid differentiation |
| N2 supplement | Gibco | 17502048 | Hepatic Organoid differentiation |
| Nicotinamide | R&D Systems | 4106/50 | Hepatic Organoid differentiation |
| PBS, pH 7.4 | Gibco | 10010023 | hiPSC maintenance |
| Recombinant human BMP4 | R&D Systems | 314-BP-010/CF | Hepatic Organoid differentiation |
| Recombinant human EGF | R&D Systems | 236-EG-200 | Hepatic Organoid differentiation |
| Recombinant human FGF basic/FGF2/bFGF | R&D Systems | 233-FB-010/CF | Hepatic Organoid differentiation |
| Recombinant human FGF19 | R&D Systems | 959-FG-025/CF | Hepatic Organoid differentiation |
| Recombinant human HGF | R&D Systems | 294-HG-005/CF | Hepatic Organoid differentiation |
| Recombinant Human Jagged-1 Fc Chimera | R&D Systems | 1277-JG-050 | Hepatic Organoid differentiation |
| Recombinant human KGF/FGF7 | R&D Systems | 251-KG-010/CF | Hepatic Organoid differentiation |
| ReLeSR | Stemcell Technologies | 100-0483 | hiPSC detaching medium |
| RNAse Inhibitor Ambion, cloned, 40 U/μL | Invitrogen | AM2682 | Dissociation Hepatic Organoids |
| RNase Zap | Invitrogen | AM9780 | Dissociation Hepatic Organoids |
| Sorvall Legend XT/XF Centrifuge Series | Thermo Fisher Scientific | 75004539 | All procedures |
| STEMdiff Definitive Endoderm Kit | Stemcell Technologies | 5110 | Hepatic Organoid differentiation |
| Trypan Blue solution (0.4%) | Gibco | 15250061 | Dye solution |
| TrypLE Express Enzyme | Gibco | 12604013 | Cell Dissociation enzyme |
| Trypsin 0.5% - EDTA (10X) | Gibco | 15400054 | Dissociation Hepatic Organoids |
| Valproic acid, sodium salt | R&D Systems | 2815/100 | Hepatic Organoid differentiation |
| Vari-Mix Platform Rocker | Thermo Fisher scientific | M79735Q | Dissociation Hepatic Organoids |
| Y-27632 dihydrochloride | R&D Systems | 1254 | Hepatic Organoid differentiation |
Ссылки
- Peiseler, M., et al. Immune mechanisms linking metabolic injury to inflammation and fibrosis in fatty liver disease - novel insights into cellular communication circuits. J Hepatol. 77 (4), 1136-1160 (2022).
- Gordillo, M., Evans, T., Gouon-Evans, V. Orchestrating liver development. Development. 142 (12), 2094-2108 (2015).
- Lemaigre, F. P. Mechanisms of liver development: concepts for understanding liver disorders and design of novel therapies. Gastroenterology. 137 (1), 62-79 (2009).
- He, C., et al. Liver organoids, novel and promising modalities for exploring and repairing liver injury. Stem Cell Rev Rep. 19 (2), 345-357 (2023).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Takebe, T., et al. Vascularized and functional human liver from an iPSC-derived organ bud transplant. Nature. 499 (7459), 481-484 (2013).
- Si-Tayeb, K., et al. Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells. Hepatology. 51 (1), 297-305 (2010).
- Wu, F., et al. Generation of hepatobiliary organoids from human induced pluripotent stem cells. J Hepatol. 70 (6), 1145-1158 (2019).
- Shinozawa, T., et al. High-fidelity drug-induced liver injury screen using human pluripotent stem cell-derived organoids. Gastroenterology. 160 (3), 831-846.e10 (2021).
- Ouchi, R., et al. Modeling steatohepatitis in humans with pluripotent stem cell-derived organoids. Cell Metab. 30 (2), 374-384.e6 (2019).
- Ramli, M. N. B., et al. Human pluripotent stem cell-derived organoids as models of liver disease. Gastroenterology. 159 (4), 1471-1486.e12 (2020).
- Shen, M. M. Nodal signaling: developmental roles and regulation. Development. 134 (6), 1023-1034 (2007).
- Ang, L. T., et al. A roadmap for human liver differentiation from pluripotent stem cells. Cell Rep. 22 (8), 2190-2205 (2018).
- Hidalgo-Álvarez, J., Salas-Lucia, F., Vera Cruz, D., Fonseca, T. L., Bianco, A. C. Localized T3 production modifies the transcriptome and promotes the hepatocyte-like lineage in iPSC-derived hepatic organoids. JCI Insight. 8 (23), e173780 (2023).
- . B27 Supplement Available from: https://www.weizmann.ac.il/molgen/hanna/sites/molgen.hanna/files/users/user52/HANNA-LAB-B22-B27-PROTOCOL-V3.pdf (2016)
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Zhu, X., Sun, J. CircHIPK3 regulates melanoma cell behaviors by binding with miR-215-5p to upregulate YY1. Mol Cell Probes. 53, 101644 (2020).
- Guan, Y., et al. Human hepatic organoids for the analysis of human genetic diseases. JCI Insight. 2 (17), e94954 (2017).
- Walesky, C., Apte, U. Role of hepatocyte nuclear factor 4α (HNF4α) in cell proliferation and cancer. Gene Expr. 16 (3), 101-108 (2015).
- Fonseca, T. L., et al. Hepatic inactivation of the type 2 deiodinase confers resistance to alcoholic liver steatosis. Alcohol Clin Exp Res. 43 (7), 1376-1383 (2019).
- Kleinman, H. K., Martin, G. R. Matrigel: basement membrane matrix with biological activity. Semin Cancer Biol. 15 (5), 378-386 (2005).
- Kozlowski, M. T., Crook, C. J., Ku, H. T. Towards organoid culture without Matrigel. Commun Biol. 4 (1), 1387 (2021).
- Arceneaux, D., et al. A contamination focused approach for optimizing the single-cell RNA-seq experiment. iScience. 26 (7), 107242 (2023).
- Matsumoto, K., Nakamura, T. Hepatocyte growth factor: molecular structure and implications for a central role in liver regeneration. J Gastroenterol Hepatol. 6 (5), 509-519 (1991).
- Kimura, M., Moteki, H., Ogihara, M. Role of hepatocyte growth regulators in liver regeneration. Cells. 12 (2), 208 (2023).
- Michalopoulos, G. K., Bowen, W. C., Mulè, K., Luo, J. HGF-, EGF-, and dexamethasone-induced gene expression patterns during formation of tissue in hepatic organoid cultures. Gene Expr. 11 (2), 55-75 (2003).
- Kaur, I., et al. Primary hepatocyte isolation and cultures: Technical aspects, challenges and advancements. Bioengineering (Basel). 10 (2), 131 (2023).
- Baxter, M., et al. Phenotypic and functional analyses show stem cell-derived hepatocyte-like cells better mimic fetal rather than adult hepatocytes. J Hepatol. 62 (3), 581-589 (2015).
- Blohm, M. E., Vesterling-Hörner, D., Calaminus, G., Göbel, U. Alpha 1-fetoprotein (AFP) reference values in infants up to 2 years of age. Pediatr Hematol Oncol. 15 (2), 135-142 (1998).
- Liu, Q., Zeng, A., Liu, Z., Wu, C., Song, L. Liver organoids: From fabrication to application in liver diseases. Front Physiol. 13, 956244 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены