Method Article
Protocollo integrativo per la generazione di organoidi epatici umani 3D derivati da iPSC
In questo articolo
Riepilogo
Gli organoidi epatici 3D derivati da iPSC umane costituiscono un potenziale strumento per comprendere l'azione dell'ormone tiroideo sullo sviluppo del fegato.
Abstract
Ottenere cellule epatiche stabili in coltura rappresenta una sfida significativa per gli studi sul fegato. Tenendo presente questo, viene illustrato un metodo ottimizzato che utilizza cellule staminali pluripotenti indotte umane (hiPSC) per generare colture 3D di organoidi epatici umani (HHO). L'utilizzo degli HHO offre un approccio prezioso per comprendere lo sviluppo del fegato, svelare le malattie del fegato, condurre studi ad alto rendimento per lo sviluppo di farmaci ed esplorare il potenziale del trapianto di fegato. Nella prima indagine, attraverso tecniche di immunofluorescenza e RT-PCR quantitativa, è stata monitorata la progressione, identificando la presenza di varie popolazioni cellulari, come gli epatoblasti e i due tipi di cellule derivate dagli epatoblasti: colangiociti o cellule epatocitario-simili, in diversi stadi di sviluppo. Questo rapporto presenta un semplice protocollo 3D a partire da hiPSC per acquisire HHO che rispecchiano le fasi dello sviluppo dell'embrione umano. Il protocollo, che dura 46-50 giorni, comprende diverse fasi: (i) gestione meticolosa della coltura di hiPSC per generare HHO, (ii) inizio della differenziazione cellulare in 2D e successiva transizione al 3D e (iii) una strategia di dissociazione ottimizzata per scomporre gli HHO in singole cellule per il sequenziamento dell'RNA a singola cellula. A dimostrazione delle ampie applicazioni di questo approccio, il presente protocollo è stato precedentemente applicato per svelare il ruolo della segnalazione dell'ormone tiroideo nello sviluppo delle cellule epatiche.
Introduzione
Il fegato svolge diverse funzioni metaboliche, come la regolazione della disponibilità di substrati energetici facilmente utilizzabili come il glucosio e i corpi chetonici, nonché la disintossicazione dei composti xenobiotici. Negli ultimi anni, c'è stato un aumento significativo della prevalenza di malattie del fegato, in gran parte attribuite alla steatoepatite non alcolica (NASH), che, se non trattata, può progredire verso la cirrosi o il cancro1. Pertanto, è imperativo comprendere le funzioni metaboliche del fegato e le malattie ad esso correlate per facilitare lo sviluppo di trattamenti efficaci 2,3.
L'emergere di colture tridimensionali (3D) ha portato alla creazione del modello dell'organoide, che rappresenta un approccio rivoluzionario e innovativo per affrontare la funzionalità e la complessità dello sviluppo degli organi4. Gli organoidi sono definiti come aggregati 3D auto-organizzati di cellule differenziate che imitano le funzioni e la citoarchitettura del rispettivo organo5.
Negli ultimi decenni, una miriade di protocolli di organoidi epatici umani (HHO) ha guadagnato un interesse diffuso, che vanno dall'utilizzo di diverse cellule umane derivate da iPSC6 o solo cellule simili agli epatociti7 all'incorporazione di una varietà di microambienti intricati di fattori di crescita o inibitori e alla differenziazione delle cellule progenitrici in monostrato7 o 3D8. Questi approcci si prestano a una moltitudine di potenziali obiettivi, dallo screening di farmaci ad alto rendimento9 all'acquisizione di ulteriori informazioni sui meccanismi alla base delle malattie epatiche10.
Qui, viene eseguito un protocollo passo-passo di differenziazione HHO basato sui segnali chimici menzionati11 , con variazioni metodologiche adattate. Questo protocollo inizia con l'appropriata manipolazione e coltivazione di cellule staminali pluripotenti indotte umane (hiPSC), descrivendo in dettaglio le tecniche per la manipolazione del gel della matrice extracellulare, il passaggio cellulare e la differenziazione in HHO. Il processo inizia stimolando la differenziazione delle hiPSC nell'endoderma definitivo (DE)12 e successivamente imitando gli effetti in vivo di FGF e BMP per promuovere lo sviluppo di cellule monostrato dell'intestino anteriore posteriore (PFG)13. L'architettura 3D si ottiene il giorno 10 quando le cellule PFG vengono differenziate in una fase epatica immatura che diventerà l'epatoblasto, la cellula precursore fetale dei colangiociti e degli epatociti2. Infine, le strutture 3D vengono dissociate in singole cellule per studi di sequenziamento dell'RNA. Come esempio dell'applicabilità di questo protocollo, è stato dimostrato come questo modello HHO si presti allo studio dell'azione dell'ormone tiroideo e della deiodinasi di tipo 2 (D2) sullo sviluppo di epatociti e colangiociti14.
Protocollo
1. Gestione dell'hiPSC
NOTA: le hiPSC (linea cellulare CS03iCTR-n3) sono state acquistate commercialmente. La gestione appropriata del rivestimento in gel della matrice extracellulare e del terreno hiPSC è fondamentale per attaccare le hiPSC alle piastre e alimentarle. Qui sono stati descritti i volumi necessari per una piastra a 6 pozzetti. Le hiPSC rimanenti dalla piastra a 6 pozzetti, che non si differenziano in organoidi, possono essere conservate in azoto liquido per la conservazione a lungo termine.
- Erogazione di gel per matrice extracellulare e terreno hiPSC
- Scongelare correttamente il flacone del gel per matrice extracellulare mettendolo in un contenitore con ghiaccio a 4 °C per una notte.
NOTA: Prima di aliquotare, controllare il certificato di analisi per verificare il volume del fattore di diluizione. Questo rappresenta la concentrazione proteica del gel della matrice extracellulare; Pertanto, varia da un lotto all'altro. - Distribuire il gel della matrice extracellulare in aliquote adeguate in base al fattore di diluizione (4x, 2x e 1x) utilizzando provette pre-raffreddate ed etichettate. Aggiungere un fattore di diluizione 4x di gel per matrice extracellulare a 25 mL di DMEM/F12 freddo per rivestire quattro piastre a 6 pozzetti. Sigillare prontamente i coperchi con pellicola sigillante da laboratorio e congelarli a -80 °C. Evitare l'esposizione prolungata all'aria e la creazione di bolle nelle aliquote.
- Scongelare 100 ml di terreno integratore hiPSC a 4 °C durante la notte. Aggiungerlo a 400 ml di terreno basale hiPSC. Una volta omogeneizzato con una pipetta sierologica da 50 mL, aliquotare il terreno hiPSC in provette da 40 mL e congelare a -20 °C fino al momento dell'uso.
- Scongelare correttamente il flacone del gel per matrice extracellulare mettendolo in un contenitore con ghiaccio a 4 °C per una notte.
- Rivestimento di piastre per la coltura hiPSC
- Numerare ed etichettare le piastre a 6 pozzetti. Tenere a portata di mano un'aliquota di gel di matrice extracellulare, immersa nel ghiaccio secco.
- Per il rivestimento di una piastra a 6 pozzetti, diluire un'aliquota di gel per matrice extracellulare (1x) in 6,25 mL di DMEM/F12 freddo (2x in 12,5 mL e 4x in 25 mL di DMEM/F12).
- Pipettare un piccolo volume di DMEM/F12 (~500 μL) nella provetta in gel della matrice extracellulare. Agitare su e giù per scongelare e omogeneizzare il gel della matrice extracellulare con DMEM/F12 freddo, evitando la creazione di bolle, e rimetterlo nel resto della provetta fredda contenente DMEM/F12 utilizzando una pipetta sierologica per miscelare completamente.
- Incorporare 1 mL di gel per matrice extracellulare in DMEM/F12 in un pozzetto per rivestire la piastra a 6 pozzetti (6 mL per l'intera piastra). Distribuire uniformemente 1 mL sulla superficie muovendo, senza agitare, la piastra fino a ricoprirla completamente.
- Lasciare riposare a temperatura ambiente (RT) per 1 ora prima dell'uso. Se la piastra a 6 pozzetti non è completamente utilizzata, sigillarla con pellicola sigillante da laboratorio e conservarla in frigorifero a 4 °C.
NOTA: Un piatto rivestito può essere conservato per 1 settimana in frigorifero a 4 °C.
- Disgelo e cultura dell'hiPSC
- Calcolare in anticipo il volume di hiPSC medio e caldo a RT insieme alla piastra rivestita a 6 pozzetti 1 ora prima dell'uso (2 ml per pozzetto).
NOTA: In caso di aliquote fredde o congelate, immergerle in un'incubatrice a 37 °C o in un bagnomaria 15 minuti prima dell'uso. - Scissione di 1 mL di hiPSCs nel liquido N2 da una crioviale in 3 pozzetti di una piastra a 6 pozzetti (rapporto 1:3). Per un'intera piastra a 6 pozzetti, utilizzare 2 crioviali. Qui, il protocollo descrive lo scongelamento e la coltura di hiPSC da un crioviale. Ripeti il processo per 2 crioviali.
- Introdurre il crioviale contenente circa 1 mL di hiPSC congelate tenendolo attraverso il tappo e facendolo scorrere nell'acqua superficiale, con il fondo del flaconcino immerso in un bagno d'acqua a 37 °C fino allo scongelamento.
- Una volta scongelato, spruzzare il crioviale con etanolo e pipettare 1 mL di hiPSC. Erogare lentamente in una provetta conica vuota da 15 mL. Aggiungere 5 mL di hiPSC medium caldo goccia a goccia agitando delicatamente la provetta.
- Centrifugare la provetta a 300 x g per 5 minuti a RT. Eliminare delicatamente il surnatante aspirando con una pipetta di vetro collegata al vuoto senza rompere il pellet, lasciando un po' di terreno residuo. Risospendere con cura il pellet in 6 mL di terreno e quindi aggiungere 2 mL per pozzetto in 3 pozzetti della piastra a 6 pozzetti.
NOTA: Lasciare piccoli aggregati di hiPSC per una crescita corretta. - Piegare la piastra a 6 pozzetti e aspirare il gel della matrice extracellulare dalla piastra precedentemente rivestita senza toccare la punta con il fondo del pozzetto.
- Trasferire 2 mL di terreno con hiPSC per pozzetto. Agitare delicatamente la piastra in avanti, indietro e da un lato all'altro per distribuire uniformemente gli aggregati hiPSC sulla piastra.
- Posizionare la piastra a 6 pozzetti in un incubatore a 37 °C, 5% di CO2 e 95% di umidità. Cambiare il terreno ogni giorno (2 mL per pozzetto), controllando la crescita progressiva.
- Passaggio hiPSCs quando viene acquisita l'80% della confluenza di crescita (dopo 4-5 giorni; vedi Figura 1A). Le caratteristiche delle hiPSC sane e proliferative includono bordi distinti e un impacchettamento stretto di nuclei di grandi dimensioni al centro delle aggregazioni cellulari in crescita.
- Calcolare in anticipo il volume di hiPSC medio e caldo a RT insieme alla piastra rivestita a 6 pozzetti 1 ora prima dell'uso (2 ml per pozzetto).
- Superamento di hiPSC
- Una volta che le hiPSC raggiungono l'80% di confluenza, indicando circa 1,2 x 106 cellule per pozzetto, passare in una nuova piastra a 6 pozzetti. Dividere con un rapporto di 1:3 (da 1 pozzetto a 3) o regolare il rapporto (1:4; 1:6) in base ai requisiti dell'esperimento.
- Prima del passaggio, preparare l'inclusione del gel della matrice extracellulare necessaria per il numero appropriato di piastre a 6 pozzetti, come descritto al punto 1.2.
- Rimuovere il surnatante da ogni pozzetto e aggiungere 2 ml di PBS per pozzetto. Aspirare il PBS, quindi aggiungere 1 mL di terreno di distacco hiPSC per pozzetto per 1 minuto. Quindi rimuovere 1 mL di terreno di distacco hiPSC.
- Posizionare la piastra a 6 pozzetti in un incubatore a 37 °C per 7 minuti. Aggiungere 1 mL di terreno hiPSC per pozzetto. Staccare e raccogliere pipettando 1 mL del terreno hiPSC con le cellule nella provetta da 15 mL.
- Centrifugare la provetta a 300 x g per 5 minuti a RT. Per placcare le celle in una piastra a 6 pozzetti, ripetere i passaggi 1.3.5-1.3.7. Posizionare la piastra a 6 pozzetti in un incubatore a 37 °C, 5% di CO2 e 95% di umidità. Andare al passaggio 1.5. per congelare hiPSC, se necessario.
- Congelamento hiPSC (opzionale)
NOTA: Il numero di hiPSC necessari per la promozione in HO può comportare l'avanzo di pozzetti che possono essere conservati a lungo termine. Nel caso in cui fosse necessario ampliare il passaggio per la conservazione crioviale, le hiPSC possono essere mantenute per periodi prolungati.- Scongelare il volume richiesto di terreno di crioconservazione (1 mL per pozzetto di cellule) in ghiaccio a 4 °C. Etichettare le crioprovette con il numero di passaggi, la data e la linea cellulare. Staccare le cellule con il terreno di distacco hiPSC come al punto 1.4. in una provetta conica da 15 mL.
- Centrifugare a 300 x g per 5 minuti a RT. Aspirare completamente il surnatante, lasciando accuratamente indisturbato il pellet cellulare. Risospendere prudentemente il pellet in 1 mL di terreno di crioconservazione freddo (per pozzetto) lasciando aggregati hiPSC.
NOTA: Se i pozzetti sono a bassa densità, meno del 50% confluente, è possibile utilizzare 1 mL di terreno di crioconservazione ogni 2 pozzetti. - Trasferire 1 mL di terreno di crioconservazione con le hiPSC nella crioprovetta. Agitare delicatamente la crioprovetta per omogeneizzare il contenuto cellulare.
NOTA: Se si preparano più provette per la crioconservazione, lasciare le provette già preparate nel ghiaccio. - Porre le provette nel contenitore di congelamento a velocità controllata a -80 °C per una notte. Trasferire i tubi nel serbatoio dell'azoto liquido dopo 24 ore.
2. Differenziazione graduale da hiPSC in organoidi epatici
NOTA: La ricostituzione dei reagenti è stata eseguita e seguita secondo le linee guida del produttore.
- Differenziazione 2D da hiPSC a DE (giorno 0-giorno 4 (da D-0 a D-4); Figura 1B)
- Dopo 3 passaggi, se le cellule sono sane e crescono bene e velocemente, si procede alla differenziazione della hiPSC. Rivestire una piastra a 6 pozzetti come descritto al punto 1.2. Per differenziare hiPSC in DE, utilizzare il kit DE seguendo le istruzioni del produttore.
- Prima di iniziare la differenziazione, coltivare le hiPSC in un rapporto di passaggio di 2:1 (da 6 pozzetti per ottenere 3 per iniziare la differenziazione) per 24 ore per raggiungere la concentrazione cellulare nel pozzetto indicata nelle istruzioni DE.
- Eseguire la differenziazione secondo il protocollo del produttore con le seguenti modifiche.
- Aumentare la concentrazione di Y-27632 aggiunto a hiPSC da 10 μM a 50 μM (un giorno prima di iniziare la differenziazione).
- Aumentare 1,5 mL per pozzetto del reagente di dissociazione e anche il volume di DMEM/F12 alla stessa quantità per pozzetto del reagente di dissociazione. Aggiungere 1 mL di DMEM/F12 (su 1,5) a ciascun pozzetto e 0,5 mL in più accumulati in una provetta da 15 o 50 mL.
- Differenziazione di cellule DE in cellule PFG (da D-4 a D-10; Figura 1C)
- Preparare il terreno PFG (Advanced DMEM/F12 come terreno basale, 1x integratore di Glutamax, 1x integratore di B27, 20 ng/mL BMP4, 10 ng/mL FGF2) per la differenziazione delle cellule DE giorni prima dell'induzione in PFG e conservarlo a 4 °C.
NOTA: B27 contiene T3 come parte della sua composizione. Nel caso degli studi sull'ormone tiroideo (TH), da qui in poi, la B27 dovrebbe essere sostituita con la B2615 fatta in casa che non contiene TH. - Riscaldare il terreno PFG (2 mL per pozzetto) e il DMEM/F12 avanzato a 37 °C per 15 minuti o RT per 1 ora. Piegare la piastra e aspirare il terreno DE dai pozzetti con una pipetta di vetro collegata a un vuoto (o manualmente con una pipetta P1000) senza graffiare le cellule.
- Aggiungere 2 mL di DMEM/F12 avanzato caldo per pozzetto e quindi aspirarlo. Aggiungere 2 mL di terreno PFG caldo per pozzetto nella piastra a 6 pozzetti. Cambia il mezzo ogni giorno per i prossimi 6 giorni.
- Preparare il terreno PFG (Advanced DMEM/F12 come terreno basale, 1x integratore di Glutamax, 1x integratore di B27, 20 ng/mL BMP4, 10 ng/mL FGF2) per la differenziazione delle cellule DE giorni prima dell'induzione in PFG e conservarlo a 4 °C.
- Induzione da cellule PFG 2D a organoidi epatici immaturi 3D (IHOs; da D-10 a D-18)
NOTA: Sono necessarie quasi 30.000-35.000 cellule in 30 μl aggiunti a ciascun pozzetto della piastra ULA a 96 pozzetti. Il rapporto di passaggio è di 2:1, da 2 pozzetti (piastra a 6 pozzetti) con un monostrato di celle PFG differenziate; fornirà una piastra completa a 96 pozzetti con attacco ultra-basso (ULA) (Figura 1D).- Prima di iniziare gli organoidi 3D o nei giorni precedenti, preparare preventivamente il terreno IHO (Advanced DMEM/F12 come terreno basale, 1x integratore di N2, 1x B27, 50 nM A83-01, 30 μM di desametasone, 5 μM di CHIR99021, 500 nM di acido valproico, 50 ng/mL di fattore di crescita epidermico umano (EGF), 20 ng/mL di fattore di crescita degli epatociti umani (HGF), 40 ng/mL di Jagged-1, 300 ng/mL di N-6,20-O-dibutirriladenosina 30,50-ciclico 35 monofosfato sale sodico (dbCAMP), 10 μM Nicotinamide) e conservarlo a 4 °C.
- Etichettare una piastra a 96 pozzetti con attacco ultra-basso (ULA). Per staccare le cellule PFG, utilizzare l'enzima di dissociazione cellulare secondo le istruzioni del produttore.
- Riscaldare l'enzima di dissociazione, il DMEM/F12 avanzato e il PBS a 37 °C prima dell'uso. Aspirare e scartare il mezzo PFG dei pozzetti. Aggiungere 2 ml di PBS per pozzetto, quindi aspirarlo.
- Aggiungere 1,5 mL di enzima di dissociazione cellulare per pozzetto a 37 °C per 7 minuti per staccare le cellule dal pozzetto. Senza rimuovere l'enzima di dissociazione cellulare, aggiungere 1 mL di DMEM avanzato. Raccogliere tutte le cellule e aggiungerle in una provetta da 50 mL.
- Contare il numero di cellule per mL con un contatore di cellule o un emocitometro. Centrifugare a 150 x g per 8 min.
- Al pellet, aggiungere il volume appropriato (3 mL di terreno IHO per un'intera piastra ULA a 96 pozzetti) e 1x gel di matrice extracellulare per regolare il numero finale di cellule necessarie (30.000-35.000 cellule).
- Posizionare la piastra a 96 pozzetti in un incubatore impostato a 37 °C, 5% di CO2 e 95% di umidità. Dopo 24 ore (D-11), le cellule si raggrupperanno in una forma circolare; aggiungere 50 μl per pozzetto del terreno IHO.
- Il giorno successivo (D-12), aumentare a 100 μL di terreno IHO per pozzetto. A D14, rimuovere ~100-120 μL da ciascun pozzetto con la pipetta di vetro collegata a un vuoto o con una pipetta una per una. Fare attenzione a non aspirare gli organoidi. Aggiungere 100 μl di terreno IHO a D-14 e D-16.
NOTA: Dopo il D-16, a causa del fatto che non viene messo in movimento, appare una crescita eccessiva che svanisce dopo il D18.
- Organoidi epatoblasti (HBO, da D-18 a D-26)
NOTA: In questa fase, gli IHO della piastra ULA a 96 pozzetti verranno riposizionati in una piastra ULA a 6 pozzetti. Per 96 IHO della fase precedente, sono stati posizionati 10 organoidi per pozzetto, che rappresentano un totale di 1 e 1/2 piastre ULA a 6 pozzetti per procedere con la maturazione (Figura 1E).- Come fatto nelle fasi precedenti della differenziazione, preparare il mezzo di differenziazione HBO nei giorni precedenti.
- Il cocktail di reagenti utilizzato per differenziare in HBO è descritto nella fase 2.3. Rimuovere l'acido valproico e incorporare nel cocktail le seguenti sostanze biochimiche: BMP7, BMP4 e FGF7. La composizione finale è Advanced DMEM/F12 come terreno basale, 1x integratore di N2, 1x B27, 50 nM A83-01, 30 μM di desametasone, 5 μM di CHIR99021, 500 nM di acido valproico, 50 ng/mL di fattore di crescita epidermico umano (EGF), 20 ng/mL di fattore di crescita degli epatociti umani (HGF), 40 ng/mL di Jagged-1, 300 ng/mL di N-6,20-O-dibutirriladenosina 30,50-sale sodico ciclico 35 monofosfato (dbCAMP), 10 μM di nicotinamide, 25 ng/mL FGF7, 50 ng/mL BMP4, 20 ng/mL BMP7.
- Riscaldare in precedenza il terreno HBO (3 mL per pozzetto) e Advanced DMEM/F12 (3 mL per pozzetto) a 37 °C. Aggiungere 3 mL di DMEM/F12 avanzato caldo a ciascun pozzetto.
- Distribuire 10 organoidi IHO per pozzetto dalla piastra a 96 pozzetti con un puntale largo 200 mL. Rimuovere il DMEM/F12 avanzato chinandosi sulla piastra e aspirandola con la pipetta di vetro collegata al vuoto (o manualmente con un P1000).
- Aggiungere 3 ml di terreno HBO caldo per pozzetto. Accendere e posizionare le piastre ULA a 6 pozzetti su un agitatore multipiattaforma a 65 giri/min all'interno dell'incubatore impostato a 37 °C, 5% CO2 e 95% di umidità. Dopo 4 giorni (D-22) e 6 giorni (D-24), sostituire il terreno HBO (3 mL per pozzetto).
- Come fatto nelle fasi precedenti della differenziazione, preparare il mezzo di differenziazione HBO nei giorni precedenti.
- Maturazione in organoidi epatici (HO) attraverso 2 diverse fasi (da D-26 a D-46)
NOTA: Questo è l'ultimo processo di maturazione che avviene in due periodi di differenziazione a causa del contenuto e del tipo di reagenti nel mezzo.- Preparare in anticipo il primo del terreno HO (HO1) e conservarlo a 4 °C. Rimuovere Jagged1 e diminuire la concentrazione di CHIR99021 rispetto al mezzo HBO. La composizione finale è: DMEM/F12 avanzato come terreno basale, 1x integratore di N2, 1x B27, 500 nM A83-01, 30 μM di desametasone, 2 μM di CHIR99021, 50 ng/mL di fattore di crescita epidermico umano (EGF), 20 ng/mL di fattore di crescita degli epatociti umani (HGF), 300 ng/mL di N-6,20-O-dibutirriladenosina 30,50-ciclico 35 monofosfato sale sodico (dbCAMP), 10 μM di nicotinamide, 25 ng/mL FGF7, 20 ng/mL BMP4, 20 ng/mL BMP7.
- Riscaldare il fluido Advanced DMEM/F12 e HO1 a 37 °C prima dell'uso. Nella stessa piastra ULA a 6 pozzetti, aspirare con cura il precedente mezzo HBO piegando la piastra e posizionando la punta della pipetta di vetro collegata a un vuoto contro la parete (o manualmente con una pipetta P1000).
- Aggiungere 3 mL di Advanced DMEM/F12 caldo per pozzetto e aspirarlo. Aggiungere 3 mL di terreno caldo HO1 per pozzetto. Sostituire il mezzo HO1 ogni 3 giorni (D-29, D-32, D-35, D-38) insieme alla raccolta del campione.
- A D 38, modificare il cocktail di reagenti per il secondo periodo di HO (HO2) rimuovendo CHIR99021, BMP4, dbcAMP e FGF7 e sostituendoli con FGF19 e DAPT. La composizione finale del terreno è Advanced DMEM/F12 come terreno basale, 1x integratore di N2, 1x B27, 500 nM A83-01, 30 μM di desametasone, 50 ng/mL di fattore di crescita epidermico umano (EGF), 20 ng/mL di fattore di crescita degli epatociti umani (HGF), 10 μM di nicotinamide, 20 ng/mL di BMP7, 25 ng/mL di FGF19, 5 μM di DAPT.
- Riscaldare il fluido Advanced DMEM/F12 e HO2 a 37 °C prima dell'uso. Continuare con la stessa piastra ULA a 6 pozzetti e aspirare con cura il precedente terreno HO1. Aggiungere 3 mL di Advanced DMEM/F12 per pozzetto e rimuoverlo.
- Aggiungere 3 mL di terreno caldo HO2 per pozzetto. Sostituire il terreno HO2 ogni 4 giorni (D-42, D-46, D-50, ...) e prelevare campioni negli stessi giorni in cui viene cambiato il fluido.
3. Dissociazione unicellulare
NOTA: Questo passaggio è fondamentale per la tecnica di sequenziamento dell'RNA a singola cellula. Il numero di organoidi può variare a seconda delle dimensioni, e più vecchio è il giorno della dissociazione, maggiore è la quantità di cellule negli organoidi. In passato, il numero di organoidi dissociati aumentava e i tempi di dissociazione si riducevano a parità di quantità. La dissociazione è stata eseguita con 10 organoidi a D-14 e D-17, 8 organoidi a D-23 e D-26 e 6 organoidi a D-30 e D-45. Le procedure per un cluster di organoidi sono dettagliate (Figura 1F).
- Preparazione dei reagenti
- Preparare Advanced-DMEM con una concentrazione finale del 7,5% di albumina bovina frazione V (BSA) e filtrare dopo l'omogeneizzazione.
- Preparare 1 mL di terreno enzimatico di dissociazione con 1 mL di tripsina 0,5% - EDTA (10x) come terreno basale, 50 μM di Y-27632, 40 U/μL di inibitore della RNasi e 1 U/μL di DNasi I.
- Preparare il terreno di inattivazione della tripsina con 2 mL di Advanced DMEM/F12 + 7,5% BSA come terreno basale, 50 μM di Y-27632, 40 U/μL di inibitore della RNasi e 1 U/μL di DNasi I.
- Riscaldare sia il fluido che il PBS a 37 °C prima di iniziare.
- Dissociazione degli HHO
- Pulisci il posto di lavoro e gli strumenti con il detergente RNase. Raccogliere il numero di organoidi in base al giorno di differenziazione in una provetta in polipropilene da 15 mL con punta spalancata.
- Lavare con PBS 2x-3x. Aggiungere 1 mL di terreno enzimatico di dissociazione nella provetta da 15 mL con gli organoidi raccolti e mantenere a 37 °C in un bilanciere a 30 giri/min per 5 minuti.
ATTENZIONE: Fare attenzione a non far cadere il tubo dal bilanciere. - Dopo 5 minuti, per prima cosa, controllare il tappo per eventuali organoidi rimanenti, quindi interrompere meccanicamente gli organoidi con un P1000 facendo roteare su e giù 10 volte per organoide (60 volte in totale). Ripetere la stessa interruzione con un P200. Controllare il tappo della provetta nel caso in cui gli organoidi vi rimangano incastrati.
- Posizionare nuovamente la provetta da 15 ml sul bilanciere nell'incubatrice per altri 5 minuti. Ripetere la procedura del punto 4, iniziando facendo roteare su e giù un P200 e continuando con una pipetta sierologica da 1 mL collegata a un puntale P10.
- Posizionare nuovamente la provetta da 15 mL sul bilanciere nell'incubatrice per gli ultimi 5 minuti. In caso di mancata dissociazione, lasciarlo per altri 5 minuti e ripetere l'interruzione manuale.
- Aggiungere 1 mL di terreno di inattivazione della tripsina e omogeneizzarlo. Posizionare una nuova provetta in polipropilene da 15 mL con un filtro cellulare da 40 μm sulla parte superiore. Filtrare i 2 mL (cellule con il mezzo enzimatico di dissociazione e il mezzo di inattivazione della tripsina) attraverso un colino cellulare da 40 μm nella provetta da 15 mL.
- Aggiungere un altro 1 mL di terreno di inattivazione della tripsina per recuperare le cellule rimanenti dal filtro cellulare da 40 μm.
- Prelevare 5 μl di terreno unicellulare miscelato con 5 μl di una soluzione colorante per contare il numero di cellule dissociate per procedere con la loro fissazione. Contare le cellule dopo la centrifugazione e la risospensione con il primo reagente del kit di fissazione ed eseguire la filtrazione cellulare utilizzando un filtro cellulare da 40 μm.
Risultati
Ogni fase di questo protocollo di differenziazione graduale da hiPSC in HHO è stata definita utilizzando misurazioni quantitative mediante qPCR e immunofluorescenza di marcatori noti stadio-specifici dalla bibliografia (Figura 2). In14 sono stati illustrati il passo dopo passo di entrambe le tecniche e i risultati ottenuti relativi alla corretta differenziazione in HO. Nell'indagine precedente, le hiPSC sono state definite attraverso i livelli di mRNA di POU5F1 (noto anche come OCT4) e SOX2, due noti fattori Yamanaka16, che diminuiscono nel tempo (Figura 2A). Successivamente, sono stati misurati i livelli di mRNA dei marcatori DE11 come OTX2, CER1 e FOXA2 e i marcatori PFG11 HNF4A, CDX2 e TBX3, insieme all'espressione localizzata di OTX2, HNF4A e TBX3 mediante immunofluorescenza (Figura 2A, B). Dopo la promozione 3D, per seguire la progressione dell'immunofluorescenza dell'albumina e di HNF4a (Figura 2C); il marcatore proliferativo, MKI6717, e TBX3, importante nella regolazione dell'epatoblasto18 (Figura 2D) è stato eseguito da D-18 a D-46. In particolare, l'albumina colocalizzata con HNF4a (Figura 2C); nel frattempo, MKI67 è apparso sporadicamente a D-46 (Figura 2D). Inoltre, le cellule simili agli epatociti e ai colangiociti sono state identificate attraverso i livelli di mRNA e l'immunofluorescenza di HNF4A19 e KRT718 a D-46 (Figura 2E).
Il volume degli organoidi in via di sviluppo è aumentato progressivamente da D-14 a D-38, come indicato dall'aumento di ~2 volte dei livelli di mRNA per il marcatore proliferativo MKI67 su D-22 rispetto a D-10. L'assenza di T4 nel terreno ha portato ad un aumento dei livelli di mRNA di MKI67 del ~20% e del ~75% rispettivamente su D-14 e D-18, rispetto al giorno 10 (Figura 3A). Per dimostrare la funzionalità dell'organoide epatico, i livelli di albumina, apolipoproteina B e A114 raccolti dai terreni degli organoidi epatici sono stati misurati utilizzando ELISA. Su D-42 e D-46, i livelli di mRNA di ALB sono rimasti sostanzialmente più alti nei T4-HO rispetto ai T3-HO o ai V-Ho, rispettivamente di 3,0 e 2,5 volte (Figura 3B). D'altra parte, i livelli di APOB erano ~10 volte e 3 volte superiori (Figura 3C) e i livelli di APOA1 erano ~3 volte e ~2 volte superiori (Figura 3D) rispettivamente a D-42 e D-46.
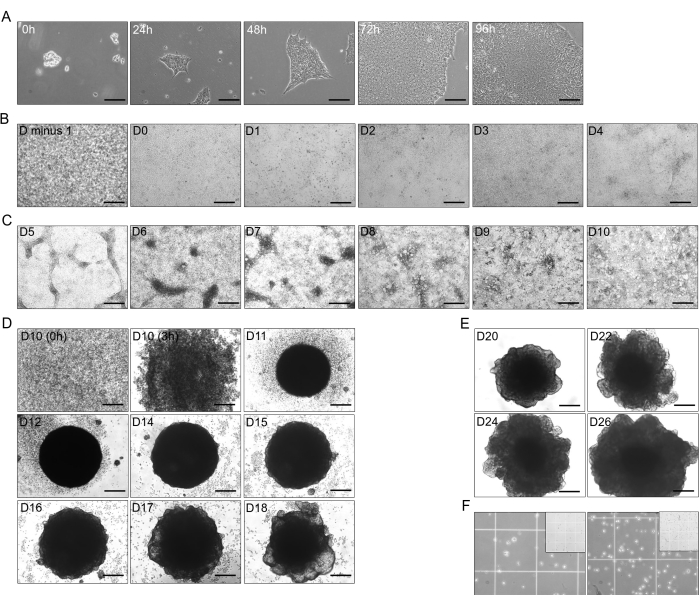
Figura 1: Fasi di differenziazione da hiPSC a organoidi epatici. (A) Crescita di transizione di hiPSC (linea CS03iCTR-n3) da 0 h a 96 h, raggiungendo circa il 70%-80% di confluenza nei pozzetti di una piastra. Barra della scala: 125 μm. (B) Progressione dello stadio iniziale della differenziazione di hiPSC nell'endoderma definitivo (DE), che mostra una confluenza del 100% il giorno precedente (D meno 1) dopo 24 ore e una differenziazione fino a D4 (da D-0 a D-4). Barra graduata: 300 μm. (C) Differenziazione da DE (D-4) in intestino anteriore posteriore (PFG; D-10) con l'aggiunta di T4 B26. Barra della scala: 300 μm. (D) Trasformazione di 2D-PFG in organoidi epatici immaturi 3D (IHO) con aggiunta di B26 T4 da D-10 come cellule singole fino a D-18, escluso D-13. Barra graduata: 300 μm. (E) Mantenimento e crescita di organoidi epatoblasti (HBO) con aggiunta di B26 T4 a D-20, D-22, D-24 e D-26. Barra della scala: 300 μm. (F) Dissociazione di HBO a D-26 (~2,5 x 105 cellule in 750 μL; a sinistra) e HO1 a D-30 (~4 x 105 cellule in 750 μL; a destra) in singole cellule con B26 aggiunta di T4. L'inserto illustra la dimensione quadrata di 1 mm della camera di Neuebauer, dove il quadrato più piccolo misura 250 μm. Le immagini sono state portate a HHO la cui concentrazione libera di T4 utilizzata nei mezzi era di ~15 pM. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Monitoraggio e caratterizzazione del differenziamento degli HHO. (A) Espressione dei livelli di mRNA dei marcatori hiPSC (POU5F1, SOX2), endoderma definito (DE; OTX2, CER1, FOXA2) e dell'intestino anteriore posteriore (PFG; TBX3, HNF4A, CDX2). (iPSC, n=8; DE e PFG n=7; HNF4A in PFG, n=6). (B) Immunofluorescenza a hiPSC, DE e PFG di OTX2 (in alto, rosso), HNF4A (al centro, verde) e TBX3 (in basso, rosso). (C) "Immunofluorescenza a D-18, D-26 e D-46 di albumina (rosso) e HNF4A (verde). (D) Immunofluorescenza a D-18, D-26 e D-46 di MKI67 (verde) e TBX3 (rosso). (E) Immunofluorescenza a D-46 di albumina (marcatore epatocitario; rosso) e KRT7 (marcatore colangiocitario; verde). I nuclei sono mostrati con 4',6-diamidino-2-fenilindolo (DAPI). Questa cifra è stata modificata da14. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Analisi della maturazione dell'HHO. (A) Livelli relativi di mRNA del marcatore proliferativo MKI67 in assenza di TH (nero) rispetto a T4 libero a ~15 pM (rosso) nel terreno da D-10 a D-46 (n=4 tranne T4-HO a D-42, n=2; e a D-46, n=3). (B) I livelli di albumina sono stati misurati nel mezzo da D-35 a D-50 in tre condizioni: assenza di TH (nero), con T4 libero a ~15 pM (rosso) e T3 libero a ~10 pM (blu; n=4). (C, D) I livelli di apolipoproteina B (APOB) e A1 (APOA1) sono stati misurati nel terreno da D-35 a D-50 in tre condizioni: assenza di TH (nero); e con T4 libero a ~15 pM (rosso). Dati da 10 organoidi per pozzetto (n=4). Per confronti multipli sono stati utilizzati il t-test di Student a due code per confrontare i giorni V-HO con quelli T4-HO e il test ANOVA e Tukey a una via. I dati sono la media dei duplicati, rappresentata come grafici a punti a dispersione allineati e la loro media. *: pag<0.05; **: pag<0.01; : p<0.001; : pag<0,0001. L'asse delle ascisse indica i giorni della differenziazione. Questa cifra è stata modificata da14. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
L'attuale protocollo offre vari dettagli metodologici su come gestire le hiPSC e le successive colture di organoidi 3D. Ciò include le due principali fasi critiche: (i) il distacco delle colture 2D e quindi il loro sviluppo in organoidi epatici 3D dopo 10 giorni, nonché (ii) la delicata dissociazione di una struttura 3D in singole cellule. Sulla base delle informazioni disponibili, questo è il primo rapporto di un modello 3D HHO per studiare l'azione dell'ormone tiroideo, dimostrando un picco di espressione di DIO2 nelle cellule epatoblasto-simili14 come originariamente identificato nei topi epatici P120.
Come con molte altre tecniche che utilizzano scaffold applicati alle cellule, il gel della matrice extracellulare è stato utilizzato per imitare la matrice extracellulare21, facilitando così l'assemblaggio nella caratteristica struttura 3D degli organoidi. La natura sensibile al calore di questo reagente sottolinea l'importanza della sua manipolazione mantenendolo congelato e, durante la manipolazione, immerso nel ghiaccio. Di conseguenza, è possibile utilizzare un diverso gel di matrice extracellulare22, sebbene le hiPSC non si siano attaccate e proliferate in una placca di assenza di scaffold in questo protocollo, rendendo la sua corretta gestione un aspetto cruciale all'inizio del protocollo, insieme alla generazione di organoidi 3D.
Dopo aver completato la differenziazione degli HO, una dissociazione praticabile degli organoidi in singole cellule rappresentava un altro importante ostacolo da superare, poiché la disgregazione meccanica può provocare la morte cellulare, a quel punto dati di sequenziamento dell'RNA di bassa qualità23. Per garantire risultati ottimali, il presente protocollo ha dimostrato che è possibile raggiungere oltre il 70% di vitalità di una singola cellula, con la dissociazione di oltre 105 cellule prima e dopo la fissazione per il successivo codice a barre.
A differenza di altri manoscritti che descrivono un solo tipo di cellula negli organoidi7, la differenziazione dell'HHO include almeno due cellule derivate da epatoblasti: cellule simili agli epatociti e ai colangiociti. L'incorporazione di due reagenti responsabili della loro formazione, HFG24 e EGF25, e insieme al desametasone26 che promuove la maturazione degli epatociti, e Jagged-118 che attiva la segnalazione Notch che porta verso i colangiociti. Questa rete di segnali intrecciata nello sviluppo di HO ci permette di realizzare la struttura 3D e di imitare gli esperimenti in vivo , oltre a superare lo svantaggio del declino nel differenziamento delle colture a lungo termine di epatociti primari27. È da notare che, nonostante l'espressione di marcatori epatici tipici dell'adulto, la presenza di marcatori fetali nelle fasi avanzate degli organoidi28 può ancora essere rilevata, come dimostra questo protocollo. Questo, infatti, riflette il normale sviluppo epatico nell'uomo, in cui i marcatori epatici fetali possono essere normalmente rilevati fino a 1 anno di vita29.
Un evento raro osservato durante lo sviluppo di hiPSC in HHO (in particolare durante i periodi immaturi delle HO, come negli ultimi giorni di IHO e in alcuni HBO e HO1) è stata la comparsa di strutture cistiche sovrasviluppate, che alla fine sono svanite una volta che le piastre sono state posizionate sullo shaker. Questa progressione sproporzionata delle strutture cistiche suggerisce un nucleo necrotico, quindi la necessità di una maggiore irrigazione30 con cambi di terreno più frequenti o l'aggiunta di bassi volumi di gel della matrice extracellulare per eliminare l'eccessiva crescita delle cisti.
A differenza della pubblicazione originale, che si concentrava su un aumento del numero di organoidi nell'ultimo periodo di differenziazione per lo screening di farmaci ad alto rendimento11, il metodo ora riportato ha introdotto l'uso di piastre ULA per promuovere la formazione precoce di organoidi 3D di grandi dimensioni e facilitare la manipolazione degli HHO. Questi aggiustamenti dimostrano la flessibilità e la vasta gamma di studi che possono essere realizzati attraverso questo semplice protocollo.
Divulgazioni
Antonio C. Bianco è consulente per Abbvie, Acella, Aligos, Synthonics. Gli altri autori non hanno divulgazioni rilevanti.
Riconoscimenti
Questo lavoro è stato sostenuto dall'Istituto Nazionale del Diabete e delle Malattie Digestive e Renali (NIDDK -DK58538, DK65066, DK77148; ACB).
Materiali
| Name | Company | Catalog Number | Comments |
| 10 µL Universal Pipette Tips Filtered, Low rentention, Pre-sterile | VWR | 613-6462 | All procedures |
| 1000 µL Universal Pipette Tips Filtered, Low rentention, Pre-sterile | VWR | 613-6470 | All procedures |
| 15 mL Polypropilene Conical Tube | Falcon (Corning) | 352097 | Dissociation Hepatic Organoids |
| 200 µL Universal Pipette Tips Filtered, Low rentention, Pre-sterile | VWR | 613-6465 | All procedures |
| 3,3',5-Triiodo-L-thyronine | Sigma | T2877-100 | Hepatic Organoid differentiation |
| 40 μm Cell Strainer | Corning | 431750 | Dissociation Hepatic Organoids |
| 50 mL tube | Falcon (Corning) | 352070 | All procedures |
| 6 well-plate Nunc Cell-Culture Treated Multidishes | Thermo fisher scientific | 140675 | hiPSC maintenance |
| A83-01 | R&D Systems | 2939/10 | Hepatic Organoid differentiation |
| Advanced DMEM/F12 | Gibco | 12634010 | Hepatic Organoid differentiation |
| ART Wide Bore Filtered Pipette Tips | ART | 2069GPK | All procedures |
| B27 supplement | Gibco | 17504044 | Hepatic Organoid differentiation |
| BMP7 | R&D Systems | 354-BP-010/CF | Hepatic Organoid differentiation |
| Bovine Albumin Fraction V (7.5% solution) | Gibco | 15260037 | Dissociation Hepatic Organoids |
| BSA, Fraction V, Fatty Acid Free for Tissue Culture | GoldBio | A-421-100 | Dissociation Hepatic Organoids |
| CHIR99021 | R&D Systems | 4423/10 | Hepatic Organoid differentiation |
| Corning 96-well Clear Flat Bottom Ultra-Low Attachment | Corning | 3474 | Hepatic Organoid differentiation |
| Costar 6-well Clear Flat Bottom Ultra-Low Attachment | Corning | 3471 | Hepatic Organoid differentiation |
| CS03iCTR-n3 human induced Pluripotent Stem Cell line | Cedar-sinai | hiPSC maintenance | |
| DAPT | R&D Systems | 2634/10 | Hepatic Organoid differentiation |
| dbCAMP | Millipore Sigma | D0627-100MG | Hepatic Organoid differentiation |
| Dexamethasone | R&D Systems | 1126/100 | Hepatic Organoid differentiation |
| DMEM/F12 | Gibco | 11320033 | hiPSC maintenance |
| DNAse I, RNase-free, HC | Thermo Fisher scientific | EN0523 | Dissociation Hepatic Organoids |
| Falcon 10 mL Serological Pipet, Polystyrene, 0.1 Increments, Individually Packed, Sterile | Corning | 357551 | All procedures |
| Falcon 5 mL Serological Pipet, Polystyrene, 0.1 Increments, Individually Packed, Sterile | Corning | 357543 | All procedures |
| Falcon 50 mL Serological pipet, Polystyrene, 1.0 Increments, Individually Packed, Sterile | Corning | 357550 | All procedures |
| Gentle Cell Dissociation Reagent (GCDR) | Stemcell Technologies | 100-0485 | Hepatic Organoid differentiation |
| Glutamax supplement | Gibco | 35050061 | Hepatic Organoid differentiation |
| L-Thyroxine | Sigma | T1775-1G | Hepatic Organoid differentiation |
| Matrigel hESC-Qualified Matrix, LDEV-free, 5 mL | Corning | 354277 | Extracellular matrix gel |
| mFreSR | Stemcell Technologies | 5855 | hiPSC cryopreservation medium |
| mTeSR 5x Supplement | Stemcell Technologies | 100-0276 | hiPSC medium |
| mTeSR Plus | Stemcell Technologies | 100-0276 | hiPSC medium |
| Multi Platform Shaker | Fisherbrand (Thermo Fisher technologies) | 88861021 | Hepatic Organoid differentiation |
| N2 supplement | Gibco | 17502048 | Hepatic Organoid differentiation |
| Nicotinamide | R&D Systems | 4106/50 | Hepatic Organoid differentiation |
| PBS, pH 7.4 | Gibco | 10010023 | hiPSC maintenance |
| Recombinant human BMP4 | R&D Systems | 314-BP-010/CF | Hepatic Organoid differentiation |
| Recombinant human EGF | R&D Systems | 236-EG-200 | Hepatic Organoid differentiation |
| Recombinant human FGF basic/FGF2/bFGF | R&D Systems | 233-FB-010/CF | Hepatic Organoid differentiation |
| Recombinant human FGF19 | R&D Systems | 959-FG-025/CF | Hepatic Organoid differentiation |
| Recombinant human HGF | R&D Systems | 294-HG-005/CF | Hepatic Organoid differentiation |
| Recombinant Human Jagged-1 Fc Chimera | R&D Systems | 1277-JG-050 | Hepatic Organoid differentiation |
| Recombinant human KGF/FGF7 | R&D Systems | 251-KG-010/CF | Hepatic Organoid differentiation |
| ReLeSR | Stemcell Technologies | 100-0483 | hiPSC detaching medium |
| RNAse Inhibitor Ambion, cloned, 40 U/μL | Invitrogen | AM2682 | Dissociation Hepatic Organoids |
| RNase Zap | Invitrogen | AM9780 | Dissociation Hepatic Organoids |
| Sorvall Legend XT/XF Centrifuge Series | Thermo Fisher Scientific | 75004539 | All procedures |
| STEMdiff Definitive Endoderm Kit | Stemcell Technologies | 5110 | Hepatic Organoid differentiation |
| Trypan Blue solution (0.4%) | Gibco | 15250061 | Dye solution |
| TrypLE Express Enzyme | Gibco | 12604013 | Cell Dissociation enzyme |
| Trypsin 0.5% - EDTA (10X) | Gibco | 15400054 | Dissociation Hepatic Organoids |
| Valproic acid, sodium salt | R&D Systems | 2815/100 | Hepatic Organoid differentiation |
| Vari-Mix Platform Rocker | Thermo Fisher scientific | M79735Q | Dissociation Hepatic Organoids |
| Y-27632 dihydrochloride | R&D Systems | 1254 | Hepatic Organoid differentiation |
Riferimenti
- Peiseler, M., et al. Immune mechanisms linking metabolic injury to inflammation and fibrosis in fatty liver disease - novel insights into cellular communication circuits. J Hepatol. 77 (4), 1136-1160 (2022).
- Gordillo, M., Evans, T., Gouon-Evans, V. Orchestrating liver development. Development. 142 (12), 2094-2108 (2015).
- Lemaigre, F. P. Mechanisms of liver development: concepts for understanding liver disorders and design of novel therapies. Gastroenterology. 137 (1), 62-79 (2009).
- He, C., et al. Liver organoids, novel and promising modalities for exploring and repairing liver injury. Stem Cell Rev Rep. 19 (2), 345-357 (2023).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: modeling development and disease using organoid technologies. Science. 345 (6194), 1247125(2014).
- Takebe, T., et al. Vascularized and functional human liver from an iPSC-derived organ bud transplant. Nature. 499 (7459), 481-484 (2013).
- Si-Tayeb, K., et al. Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells. Hepatology. 51 (1), 297-305 (2010).
- Wu, F., et al. Generation of hepatobiliary organoids from human induced pluripotent stem cells. J Hepatol. 70 (6), 1145-1158 (2019).
- Shinozawa, T., et al. High-fidelity drug-induced liver injury screen using human pluripotent stem cell-derived organoids. Gastroenterology. 160 (3), 831-846.e10 (2021).
- Ouchi, R., et al. Modeling steatohepatitis in humans with pluripotent stem cell-derived organoids. Cell Metab. 30 (2), 374-384.e6 (2019).
- Ramli, M. N. B., et al. Human pluripotent stem cell-derived organoids as models of liver disease. Gastroenterology. 159 (4), 1471-1486.e12 (2020).
- Shen, M. M. Nodal signaling: developmental roles and regulation. Development. 134 (6), 1023-1034 (2007).
- Ang, L. T., et al. A roadmap for human liver differentiation from pluripotent stem cells. Cell Rep. 22 (8), 2190-2205 (2018).
- Hidalgo-Álvarez, J., Salas-Lucia, F., Vera Cruz, D., Fonseca, T. L., Bianco, A. C. Localized T3 production modifies the transcriptome and promotes the hepatocyte-like lineage in iPSC-derived hepatic organoids. JCI Insight. 8 (23), e173780(2023).
- B27 Supplement. , Hanna Lab Protocol – Weizmann Institute of Science. https://www.weizmann.ac.il/molgen/hanna/sites/molgen.hanna/files/users/user52/HANNA-LAB-B22-B27-PROTOCOL-V3.pdf (2016).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Zhu, X., Sun, J. CircHIPK3 regulates melanoma cell behaviors by binding with miR-215-5p to upregulate YY1. Mol Cell Probes. 53, 101644(2020).
- Guan, Y., et al. Human hepatic organoids for the analysis of human genetic diseases. JCI Insight. 2 (17), e94954(2017).
- Walesky, C., Apte, U. Role of hepatocyte nuclear factor 4α (HNF4α) in cell proliferation and cancer. Gene Expr. 16 (3), 101-108 (2015).
- Fonseca, T. L., et al. Hepatic inactivation of the type 2 deiodinase confers resistance to alcoholic liver steatosis. Alcohol Clin Exp Res. 43 (7), 1376-1383 (2019).
- Kleinman, H. K., Martin, G. R. Matrigel: basement membrane matrix with biological activity. Semin Cancer Biol. 15 (5), 378-386 (2005).
- Kozlowski, M. T., Crook, C. J., Ku, H. T. Towards organoid culture without Matrigel. Commun Biol. 4 (1), 1387(2021).
- Arceneaux, D., et al. A contamination focused approach for optimizing the single-cell RNA-seq experiment. iScience. 26 (7), 107242(2023).
- Matsumoto, K., Nakamura, T. Hepatocyte growth factor: molecular structure and implications for a central role in liver regeneration. J Gastroenterol Hepatol. 6 (5), 509-519 (1991).
- Kimura, M., Moteki, H., Ogihara, M. Role of hepatocyte growth regulators in liver regeneration. Cells. 12 (2), 208(2023).
- Michalopoulos, G. K., Bowen, W. C., Mulè, K., Luo, J. HGF-, EGF-, and dexamethasone-induced gene expression patterns during formation of tissue in hepatic organoid cultures. Gene Expr. 11 (2), 55-75 (2003).
- Kaur, I., et al. Primary hepatocyte isolation and cultures: Technical aspects, challenges and advancements. Bioengineering (Basel). 10 (2), 131(2023).
- Baxter, M., et al. Phenotypic and functional analyses show stem cell-derived hepatocyte-like cells better mimic fetal rather than adult hepatocytes. J Hepatol. 62 (3), 581-589 (2015).
- Blohm, M. E., Vesterling-Hörner, D., Calaminus, G., Göbel, U. Alpha 1-fetoprotein (AFP) reference values in infants up to 2 years of age. Pediatr Hematol Oncol. 15 (2), 135-142 (1998).
- Liu, Q., Zeng, A., Liu, Z., Wu, C., Song, L. Liver organoids: From fabrication to application in liver diseases. Front Physiol. 13, 956244(2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon