Method Article
بروتوكول تكاملي لتوليد العضيات الكبدية البشرية ثلاثية الأبعاد المشتقة من iPSC
In This Article
Summary
تشكل العضيات الكبدية 3D المشتقة من iPSC البشرية أداة محتملة لفهم عمل هرمون الغدة الدرقية على نمو الكبد.
Abstract
يشكل الحصول على خلايا كبدية مستقرة في الثقافة تحديا كبيرا لدراسات الكبد. مع وضع ذلك في الاعتبار ، يتم تصوير طريقة محسنة باستخدام الخلايا الجذعية متعددة القدرات المستحثة البشرية (hiPSCs) لتوليد ثقافات ثلاثية الأبعاد للعضيات الكبدية البشرية (HHOs). يوفر استخدام HHOs نهجا قيما لفهم نمو الكبد ، وكشف أمراض الكبد ، وإجراء دراسات عالية الإنتاجية لتطوير الأدوية ، واستكشاف إمكانات زراعة الكبد. في التحقيق السابق ، من خلال التألق المناعي وتقنيات RT-PCR الكمية ، تمت مراقبة التقدم ، وتحديد وجود مجموعات مختلفة من الخلايا ، مثل الخلايا الكبدية ونوعين من الخلايا المشتقة من الخلايا الكبدية: الخلايا الصفراوية أو الخلايا الشبيهة بخلايا الكبد ، عبر مراحل النمو المختلفة. يقدم هذا التقرير بروتوكولا ثلاثي الأبعاد مباشرا يبدأ من hiPSC للحصول على HHOs التي تعكس مراحل نمو الجنين البشري. يشمل البروتوكول ، الذي يمتد من 46 إلى 50 يوما ، عدة خطوات: (أنا) الإدارة الدقيقة لثقافة hiPSC لتوليد HHOs ، (ثانيا) بدء تمايز الخلايا في 2D والانتقال اللاحق إلى 3D ، و (3) استراتيجية تفكك محسنة لتقسيم HHOs إلى خلايا مفردة لتسلسل الحمض النووي الريبي أحادي الخلية. كتوضيح للتطبيقات الواسعة لهذا النهج ، تم تطبيق البروتوكول الحالي سابقا لكشف دور إشارات هرمون الغدة الدرقية في تطوير خلايا الكبد.
Introduction
يؤدي الكبد وظائف التمثيل الغذائي المتنوعة ، مثل تنظيم توافر ركائز الطاقة القابلة للاستخدام بسهولة مثل أجسام الجلوكوز والكيتون ، بالإضافة إلى إزالة السموم من مركبات الأجانب الحيوية. في السنوات الأخيرة ، كانت هناك زيادة كبيرة في انتشار أمراض الكبد ، والتي تعزى إلى حد كبير إلى التهاب الكبد الدهني غير الكحولي (NASH) ، والذي ، إذا لم يتم علاجه ، يمكن أن يتطور إلى تليف الكبد أوالسرطان 1. لذلك ، من الضروري فهم وظائف التمثيل الغذائي للكبد والأمراض المرتبطة به لتسهيل تطوير العلاجات الفعالة2،3.
أدى ظهور ثقافات ثلاثية الأبعاد (ثلاثية الأبعاد) إلى إنشاء نموذج عضوي ، يمثل نهجا رائدا ومبتكرا لمعالجة وظائف وتعقيد تطوير الأعضاء4. يتم تعريف العضيات على أنها مجاميع ثلاثية الأبعاد ذاتية التنظيم للخلايا المتمايزة التي تحاكي الوظائف والهندسة الخلوية للعضوالمعني 5.
على مدى العقود الماضية ، اكتسبت بروتوكولات عدد لا يحصى من المعاهد العضوية الكبدية البشرية (HHO) اهتماما واسع النطاق ، بدءا من استخدام الخلايا المتنوعة المشتقة من iPSC البشرية6 أو الخلايا الشبيهة بخلايا الكبدفقط 7 إلى دمج مجموعة متنوعة من البيئات الدقيقة المعقدة لعوامل النمو أو المثبطات وتمييز الخلايا السلفية في الطبقة الأحادية7 أو 3D8. تصلح هذه الأساليب للعديد من الأهداف المحتملة ، من فحص الأدوية عاليالإنتاجية 9 إلى اكتساب مزيد من الأفكار حول الآليات الكامنة وراء أمراض الكبد10.
هنا ، يتم تنفيذ بروتوكول خطوة بخطوة لتمايز HHO بناء على الإشارات الكيميائية المذكورة11 ، مع اختلافات منهجية متكيفة. يبدأ هذا البروتوكول بالمناولة المناسبة وزراعة الخلايا الجذعية متعددة القدرات المستحثة البشرية (hiPSC) ، وتفصيل تقنيات التلاعب بهلام المصفوفة خارج الخلية ، ومرور الخلايا ، والتمايز إلى HHOs. تبدأ العملية بتحفيز تمايز hiPSCs إلى الأديم الباطن النهائي (DE) 12 وبالتالي محاكاة التأثيرات في الجسم الحي ل FGF و BMP لتعزيز تطور خلايا أحادية الطبقة في الأمعاء الأمامية الخلفية (PFG) 13. يتم تحقيق البنية ثلاثية الأبعاد في اليوم 10 عندما يتم تمايز خلايا PFG إلى مرحلة كبدية غير ناضجة ستصبح الخلايا الكبدية ، وهي الخلية السليفة الجنينية للخلايا الصفراوية وخلايا الكبد2. أخيرا ، يتم فصل الهياكل ثلاثية الأبعاد إلى خلايا مفردة لدراسات تسلسل الحمض النووي الريبي. كمثال على قابلية تطبيق هذا البروتوكول ، تم توضيح كيف يفسح نموذج HHO هذا المجال لدراسة عمل هرمون الغدة الدرقية والنوع 2 ديودينازي (D2) على تطور خلايا الكبد والخلايا الصفراوية14.
Protocol
1. إدارة hiPSC
ملاحظة: تم شراء hiPSCs (خط الخلايا CS03iCTR-n3) تجاريا. تعد الإدارة المناسبة لطلاء هلام المصفوفة خارج الخلية ووسط hiPSC أمرا أساسيا لربط hiPSCs بالألواح وتغذيتها. هنا ، تم وصف الأحجام اللازمة للوحة واحدة مكونة من 6 آبار. يمكن تخزين hiPSCs المتبقية من الصفيحة المكونة من 6 آبار ، والتي لن تتمايز إلى عضويات ، في النيتروجين السائل للتخزين طويل الأجل.
- الاستغناء عن جل المصفوفة خارج الخلية ووسط hiPSC
- قم بإذابة زجاجة جل المصفوفة خارج الخلية بشكل صحيح عن طريق وضعها في وعاء به ثلج عند 4 درجات مئوية طوال الليل.
ملاحظة: قبل الاقتباس، تحقق من شهادة التحليل للتحقق من حجم عامل التخفيف. هذا يمثل تركيز البروتين لهلام المصفوفة خارج الخلية. لذلك ، فإنه يختلف من قطعة إلى أخرى. - قم بتوزيع جل المصفوفة خارج الخلية إلى حصص مناسبة وفقا لعامل التخفيف (4x و 2x و 1x) باستخدام أنابيب مبردة مسبقا وذات علامات. أضف عامل تخفيف 4x من هلام المصفوفة خارج الخلية إلى 25 مل من DMEM / F12 البارد لتغطية أربعة أطباق مكونة من 6 آبار. أغلق الأغطية على الفور بغشاء مانع للتسرب في المختبر وقم بتجميدها عند -80 درجة مئوية. تجنب التعرض الطويل للهواء وتكوين فقاعات في الأحكام.
- قم بإذابة 100 مل من وسط مكمل hiPSC عند 4 درجات مئوية بين عشية وضحاها. أضفه إلى 400 مل من الوسط القاعدي hiPSC. بمجرد تجانسها بماصة مصلية سعة 50 مل ، قم بتقسيم وسط hiPSC في أنابيب سعة 40 مل وقم بتجميدها عند -20 درجة مئوية حتى الاستخدام.
- قم بإذابة زجاجة جل المصفوفة خارج الخلية بشكل صحيح عن طريق وضعها في وعاء به ثلج عند 4 درجات مئوية طوال الليل.
- طلاء الألواح لثقافة hiPSC
- قم بعدد وتسمية اللوحة (الأطباق) المكونة من 6 آبار. احتفظ بجل مصفوفة خارج الخلية في مكان قريب ، مغمورا في الثلج الجاف.
- لطلاء صفيحة واحدة مكونة من 6 آبار ، قم بتخفيف هلام مصفوفة خارج الخلية (1x) إلى 6.25 مل من DMEM / F12 البارد (2x إلى 12.5 مل و 4x إلى 25 مل من DMEM / F12).
- ماصة كمية صغيرة من DMEM / F12 (~ 500 ميكرولتر) في أنبوب هلام المصفوفة خارج الخلية. قم بالتدوير لأعلى ولأسفل لإذابة الجليد وتجانس هلام المصفوفة خارج الخلية باستخدام DMEM/F12 البارد، مما يمنع تكوين الفقاعات، وإعادته إلى بقية الأنبوب البارد المحتوي على DMEM/F12 باستخدام ماصة مصلية للخلط تماما.
- قم بتضمين 1 مل من هلام المصفوفة خارج الخلية في DMEM / F12 في بئر واحد لطلاء اللوحة المكونة من 6 آبار (6 مل للوحة بأكملها). وزعي 1 مل بالتساوي على السطح عن طريق تحريك اللوحة دون اهتزاز حتى يتم تغطيتها بالكامل.
- اتركيه في درجة حرارة الغرفة (RT) لمدة ساعة واحدة قبل الاستخدام. إذا لم يتم استخدام اللوحة المكونة من 6 آبار بالكامل ، فقم بإغلاقها بغشاء مانع للتسرب في المختبر وقم بتخزينها في الثلاجة عند 4 درجات مئوية.
ملاحظة: يمكن تخزين الصفيحة المطلية لمدة أسبوع واحد في الثلاجة عند 4 درجات مئوية.
- ذوبان واستزراع hiPSC
- احسب مسبقا حجم وسط hiPSC والدافئ عند RT جنبا إلى جنب مع اللوحة المطلية ب 6 آبار قبل ساعة واحدة من الاستخدام (2 مل لكل بئر).
ملاحظة: في حالة الكميات الباردة أو المجمدة ، اغمرها في حاضنة 37 درجة مئوية أو حمام مائي قبل 15 دقيقة من الاستخدام. - قسم 1 مل من hiPSCs في السائل N2 من cryovial إلى 3 آبار من صفيحة 6 آبار (نسبة 1: 3). للحصول على طبق كامل مكون من 6 آبار ، استخدم 2 كريوفيال. هنا ، يصف البروتوكول ذوبان وثقافة hiPSCs من تبريد. كرر العملية لمدة 2 cryovials.
- أدخل المبرد الذي يحتوي على ما يقرب من 1 مل من hiPSCs المجمدة عن طريق تثبيته من خلال الغطاء وتحريكه عبر الماء السطحي ، مع غمر قاع القارورة في حمام مائي عند 37 درجة مئوية حتى إذابة الجليد.
- بمجرد إذابته ، رش التبريد بالإيثانول والماصة 1 مل من hiPSCs. استغني ببطء في أنبوب مخروطي فارغ سعة 15 مل. أضف 5 مل من متوسط hiPSC الدافئ قطرة قطرة مع هز الأنبوب برفق.
- قم بالطرد المركزي للأنبوب عند 300 × جم لمدة 5 دقائق في RT. قم بإزالة المادة الطافية بدقة عن طريق الشفط باستخدام ماصة زجاجية متصلة بالفراغ دون تعطيل الحبيبات ، مع ترك بعض الوسط المتبقي. أعد تعليق الحبيبات بعناية في 6 مل من المتوسط ثم أضف 2 مل لكل بئر في 3 آبار من اللوحة المكونة من 6 آبار.
ملاحظة: اترك مجاميع صغيرة من hiPSCs للنمو الصحيح. - ثني الصفيحة المكونة من 6 آبار واستنشق هلام المصفوفة خارج الخلية من اللوحة المطلية مسبقا دون لمس الطرف إلى قاع البئر.
- نقل 2 مل من الوسط مع hiPSCs لكل بئر. رج اللوحة برفق للأمام والخلف ومن جانب إلى آخر لتوزيع مجاميع hiPSC بالتساوي على اللوحة.
- ضع اللوحة المكونة من 6 آبار في حاضنة عند 37 درجة مئوية ، و 5٪ ثاني أكسيد الكربون2 ، و 95٪ رطوبة. قم بتغيير الوسط يوميا (2 مل لكل بئر) ، والتحقق من النمو التدريجي.
- مرور hiPSCs عند اكتساب 80٪ من التقاء النمو (بعد 4-5 أيام ؛ انظر الشكل 1 أ). تشمل خصائص hiPSCs الصحية والتكاثرية حدودا مميزة وعبوات محكمة للنوى الكبيرة في وسط تجمعات الخلايا النامية.
- احسب مسبقا حجم وسط hiPSC والدافئ عند RT جنبا إلى جنب مع اللوحة المطلية ب 6 آبار قبل ساعة واحدة من الاستخدام (2 مل لكل بئر).
- مرور hiPSC
- بمجرد أن تصل hiPSCs إلى 80٪ من التقاء ، مما يشير إلى ما يقرب من 1.2 × 106 خلايا لكل بئر ، تمر إلى صفيحة جديدة مكونة من 6 آبار. قم بالتقسيم بنسبة 1: 3 (من 1 بئر إلى 3) ، أو اضبط النسبة (1: 4 ؛ 1: 6) وفقا لمتطلبات التجربة.
- قبل المرور ، قم بإعداد تضمين هلام المصفوفة خارج الخلية المطلوب للعدد المناسب من الألواح المكونة من 6 آبار ، كما هو موضح في الخطوة 1.2.
- قم بإزالة المادة الطافية من كل بئر وأضف 2 مل من PBS لكل بئر. قم بشفط PBS ، متبوعا بإضافة 1 مل من وسط فصل hiPSC لكل بئر لمدة 1 دقيقة. ثم قم بإزالة 1 مل من وسط فصل hiPSC.
- ضع الطبق المكون من 6 آبار في حاضنة على حرارة 37 درجة مئوية لمدة 7 دقائق. أضف 1 مل من وسط hiPSC لكل بئر. افصل واجمع عن طريق سحب 1 مل من وسط hiPSC مع الخلايا في أنبوب 15 مل.
- جهاز الطرد المركزي للأنبوب عند 300 × جم لمدة 5 دقائق في RT. لوضع الخلايا في صفيحة من 6 آبار ، كرر الخطوات 1.3.5-1.3.7. ضع اللوحة المكونة من 6 آبار في حاضنة عند 37 درجة مئوية ، و 5٪ ثاني أكسيد الكربون2 ، و 95٪ رطوبة. انتقل إلى الخطوة 1.5. لتجميد hiPSC إذا لزم الأمر.
- تجميد hiPSC (اختياري)
ملاحظة: قد يؤدي عدد hiPSCs المطلوبة للترقية إلى HOs إلى بقايا آبار يمكن تخزينها على المدى الطويل. إذا كانت هناك حاجة لتوسيع الممر للتخزين المبرد ، فيمكن الحفاظ على hiPSCs لفترات طويلة.- قم بإذابة الحجم المطلوب من وسط الحفظ بالتبريد (1 مل لكل بئر من الخلايا) في الجليد عند 4 درجات مئوية. قم بتسمية الأنابيب المبردة بعدد الممرات والتاريخ وخط الخلية. افصل الخلايا ذات وسط فصل hiPSC كما في الخطوة 1.4. في أنبوب مخروطي 15 مل.
- جهاز طرد مركزي عند 300 × جم لمدة 5 دقائق في RT. استنشق المادة الطافية بالكامل ، مع ترك حبيبات الخلية دون إزعاج بعناية. أعد تعليق الحبيبات بحكمة في 1 مل من وسط الحفظ بالتبريد البارد (لكل بئر) عن طريق ترك مجاميع hiPSC.
ملاحظة: إذا كانت الآبار منخفضة الكثافة ، فأقل من 50٪ ملتقية ، فيمكن استخدام 1 مل من وسط الحفظ بالتبريد لكل 2 بئر. - انقل 1 مل من وسط الحفظ بالتبريد باستخدام hiPSCs إلى أنبوب التبريد. حرك الأنبوب المبرد برفق لتجانس محتوى الخلية.
ملاحظة: في حالة تحضير المزيد من الأنابيب للحفظ بالتبريد ، اترك الأنابيب المعدة بالفعل في الجليد. - ضع الأنابيب في حاوية التجميد ذات المعدل الخاضع للرقابة عند -80 درجة مئوية طوال الليل. انقل الأنابيب إلى خزان النيتروجين السائل بعد 24 ساعة.
2. التمايز خطوة بخطوة من hiPSC إلى العضيات الكبدية
ملاحظة: تم إجراء إعادة تشكيل الكواشف واتباعها وفقا لإرشادات الشركة المصنعة.
- 2D التمايز من hiPSC إلى DE (اليوم 0-اليوم 4 (D-0 إلى D-4); الشكل 1 ب)
- بعد 3 مقاطع ، إذا كانت الخلايا صحية وتنمو بشكل جيد وسريع ، فانتقل إلى تمايز hiPSC. قم بتغطية صفيحة مكونة من 6 آبار كما هو موضح في الخطوة 1.2. للتمييز بين hiPSC إلى DE ، استخدم مجموعة DE باتباع تعليمات الشركة المصنعة.
- قبل البدء في التمايز ، قم بزراعة hiPSCs بنسبة مرور 2: 1 (من 6 آبار للحصول على 3 لبدء التمايز) لمدة 24 ساعة لتحقيق تركيز الخلية في البئر المشار إليه في تعليمات DE.
- قم بإجراء التمايز وفقا لبروتوكول الشركة المصنعة مع التعديلات التالية.
- ارفع تركيز Y-27632 المضاف إلى hiPSC من 10 ميكرومتر إلى 50 ميكرومتر (قبل يوم من بدء التمايز).
- قم بزيادة 1.5 مل لكل بئر من كاشف التفكك وكذلك حجم DMEM / F12 إلى نفس الكمية لكل بئر مثل كاشف التفكك. أضف 1 مل من DMEM / F12 (من 1.5) إلى كل بئر ، وتراكم 0.5 مل إضافي في أنبوب سعة 15 أو 50 مل.
- تمايز خلايا DE إلى خلايا PFG (D-4 إلى D-10; الشكل 1 ج)
- قم بإعداد وسط PFG (DMEM / F12 المتقدم كوسط قاعدي ، 1x مكمل Glutamax ، 1x مكمل B27 ، 20 نانوغرام / مل BMP4 ، 10 نانوغرام / مل FGF2) لتمايز خلايا DE قبل أيام من الحث في PFG وتخزينها عند 4 درجات مئوية.
ملاحظة: يحتوي B27 على T3 كجزء من تكوينه. في حالة دراسات هرمون الغدة الدرقية (TH) ، من الآن فصاعدا ، يجب استبدال B27 ب B2615 محلي الصنع لا يحتوي على TH. - قم بتسخين وسط PFG (2 مل لكل بئر) و DMEM / F12 المتقدم عند 37 درجة مئوية لمدة 15 دقيقة أو RT لمدة 1 ساعة. قم بثني اللوحة واستنشاق وسط DE من الآبار باستخدام ماصة زجاجية متصلة بفراغ (أو يدويا باستخدام ماصة P1000) دون خدش الخلايا.
- أضف 2 مل من DMEM / F12 الدافئ المتقدم لكل بئر ثم استنشقه. أضف 2 مل من وسط PFG الدافئ لكل بئر في الطبق المكون من 6 آبار. قم بتغيير الوسيط يوميا لمدة 6 أيام القادمة.
- قم بإعداد وسط PFG (DMEM / F12 المتقدم كوسط قاعدي ، 1x مكمل Glutamax ، 1x مكمل B27 ، 20 نانوغرام / مل BMP4 ، 10 نانوغرام / مل FGF2) لتمايز خلايا DE قبل أيام من الحث في PFG وتخزينها عند 4 درجات مئوية.
- الحث من خلايا 2D PFG إلى 3D غير ناضجة العضيات الكبدية (IHOs; من مد-10 إلى مد-18)
ملاحظة: هناك حاجة إلى ما يقرب من 30,000-35,000 خلية في 30 ميكرولتر مضافة إلى كل بئر من لوحة ULA المكونة من 96 بئرا. نسبة المرور هي 2: 1 ، من 2 بئر (6 آبار صفيحة) مع طبقة أحادية من خلايا PFG المتمايزة ؛ سيوفر لوحة مرفقة منخفضة للغاية (ULA) كاملة من 96 بئرا (الشكل 1 د).- قبل البدء في العضيات ثلاثية الأبعاد أو في الأيام السابقة ، قم بإعداد وسيط IHO مسبقا (Advanced DMEM / F12 كوسيط قاعدي ، 1x N2 الملحق ، 1x B27 ، 50 نانومتر A83-01 ، 30 ميكرومتر ديكساميثازون ، 5 ميكرومتر CHIR99021 ، 500 نانومتر حمض الفالبرويك ، 50 نانوغرام / مل عامل نمو البشرة البشرية (EGF) ، 20 نانوغرام / مل عامل نمو خلايا الكبد البشرية (HGF) ، 40 نانوغرام / مل خشنة -1 ، 300 نانوغرام / مل N-6،20-O-dibutyryladenosine 30،50-cyclic 35 ملح صوديوم أحادي الفوسفات (dbCAMP) ، 10 ميكرومتر نيكوتيناميد) وتخزينه في 4 درجات مئوية.
- قم بتسمية لوحة مرفقة منخفضة جدا (ULA) سعة 96 بئرا. لفصل خلايا PFG ، استخدم إنزيم تفكك الخلايا وفقا لتعليمات الشركة المصنعة.
- قم بتسخين إنزيم التفكك ، DMEM / F12 المتقدم ، و PBS عند 37 درجة مئوية قبل الاستخدام. استنشق وتخلص من وسط PFG للآبار. أضف 2 مل من PBS لكل بئر ، ثم استنشقه.
- أضف 1.5 مل من إنزيم تفكك الخلايا لكل بئر عند 37 درجة مئوية لمدة 7 دقائق لفصل الخلايا عن البئر. بدون إزالة إنزيم تفكك الخلية ، أضف 1 مل من DMEM المتقدم. اجمع كل الخلايا وأضفها إلى أنبوب سعة 50 مل.
- احسب عدد الخلايا لكل مل باستخدام عداد الخلايا أو مقياس كثافة الدم. جهاز طرد مركزي عند 150 × جم لمدة 8 دقائق.
- إلى الحبيبات ، أضف الحجم المناسب (3 مل من وسط IHO للوحة ULA كاملة مكونة من 96 بئرا) و 1x هلام مصفوفة خارج الخلية للتكيف مع العدد النهائي للخلايا المطلوبة (30,000-35,000 خلية).
- ضع اللوحة المكونة من 96 بئرا في حاضنة تصل إلى 37 درجة مئوية ، و 5٪ ثاني أكسيد الكربون2 ، و 95٪ رطوبة. بعد 24 ساعة (D-11) ، ستعيد الخلايا تجميع صفوفها في شكل دائري. أضف 50 ميكرولتر لكل بئر من وسط IHO.
- في اليوم التالي (D-12) ، قم بزيادة إلى 100 ميكرولتر من وسط IHO لكل بئر. عند D14، قم بإزالة ~100-120 ميكرولتر من كل بئر إما باستخدام الماصة الزجاجية المتصلة بفراغ أو باستخدام ماصة واحدة تلو الأخرى. احرص على عدم شفط العضيات. أضف 100 ميكرولتر من وسيط IHO في D-14 و D-16.
ملاحظة: بعد D-16 ، نظرا لعدم وضعه في الحركة ، يظهر النمو المفرط الذي يختفي بعد D18.
- عضيات الأرومات الكبدية (HBOs ، D-18 إلى D-26)
ملاحظة: في هذه الخطوة ، سيتم نقل IHOs من لوحة ULA المكونة من 96 بئرا إلى لوحة ULA المكونة من 6 آبار. بالنسبة ل 96 IHOs من المرحلة السابقة ، تم وضع 10 عضيات لكل بئر ، وهو ما يمثل ما مجموعه 1 و 1/2 6 ألواح ULA ذات 6 آبار للمضي قدما في النضج (الشكل 1E).- كما هو الحال في خطوات التمايز السابقة ، قم بإعداد وسيط تمايز HBOs في الأيام السابقة.
- تم وصف مزيج الكواشف المستخدمة للتمييز إلى HBOs في الخطوة 2.3. قم بإزالة حمض الفالبرويك ودمج المواد الكيميائية الحيوية التالية في الكوكتيل: BMP7 و BMP4 و FGF7. التركيبة النهائية هي Advanced DMEM / F12 كوسيط قاعدي ، 1x N2 الملحق ، 1x B27 ، 50 نانومتر A83-01 ، 30 ميكرومتر ديكساميثازون ، 5 ميكرومتر CHIR99021 ، 500 نانومتر حمض الفالبرويك ، 50 نانوغرام / مل عامل نمو البشرة البشرية (EGF) ، 20 نانوغرام / مل عامل نمو خلايا الكبد البشرية (HGF) ، 40 نانوغرام / مل خشنة -1 ، 300 نانوغرام / مل N-6،20-O-dibutyryladenosine 30،50-cyclic 35 ملح الصوديوم أحادي الفوسفات (dbCAMP) ، 10 ميكرومتر نيكوتيناميد ، 25 نانوغرام / مل FGF7 ، 50 نانوغرام / مل BMP4 ، 20 نانوغرام / مل BMP7.
- دافئ سابقا HBO متوسط (3 مل لكل بئر) و Advanced DMEM / F12 (3 مل لكل بئر) عند 37 درجة مئوية. أضف 3 مل من DMEM / F12 المتقدم الدافئ إلى كل بئر.
- قم بتوزيع 10 عضيات IHO لكل بئر من الصفيحة المكونة من 96 بئرا بطرف تجويف عريض 200 مل. قم بإزالة DMEM/F12 المتقدم عن طريق الانحناء فوق اللوحة وشفطها باستخدام الماصة الزجاجية المتصلة بالمكنسة الكهربائية (أو يدويا باستخدام P1000).
- أضف 3 مل من وسط HBO الدافئ لكل بئر. قم بتشغيل ووضع ألواح ULA المكونة من 6 آبار على شاكر متعدد المنصات عند 65 دورة في الدقيقة داخل الحاضنة عند 37 درجة مئوية ، و 5٪ ثاني أكسيد الكربون2 ، و 95٪ رطوبة. بعد 4 أيام (D-22) و 6 أيام (D-24) ، استبدل وسيط HBO (3 مل لكل بئر).
- كما هو الحال في خطوات التمايز السابقة ، قم بإعداد وسيط تمايز HBOs في الأيام السابقة.
- النضج إلى عضيات كبدية (HO) من خلال مرحلتين مختلفتين (D-26 إلى D-46)
ملاحظة: هذه هي عملية النضج الأخيرة التي تحدث في فترتين من التمايز بسبب المحتوى ونوع الكواشف في الوسط.- قم بإعداد أول وسيط HO (HO1) مسبقا وقم بتخزينه عند 4 درجات مئوية. قم بإزالة Jagged1 وقلل من تركيز CHIR99021 مقارنة بوسيط HBO. التركيبة النهائية هي: DMEM / F12 المتقدم كوسط قاعدي ، 1x N2 مكمل غذائي ، 1x B27 ، 500 نانومتر A83-01 ، 30 ميكرومتر ديكساميثازون ، 2 ميكرومتر CHIR99021 ، 50 نانوغرام / مل عامل نمو البشرة البشرية (EGF) ، 20 نانوغرام / مل عامل نمو خلايا الكبد البشرية (HGF) ، 300 نانوغرام / مل N-6،20-O-dibutyryladenosine 30،50-cyclic 35 ملح الصوديوم أحادي الفوسفات (dbCAMP) ، 10 ميكرومتر نيكوتيناميد ، 25 نانوغرام / مل FGF7 ، 20 نانوغرام / مل BMP4 ، 20 نانوغرام / مل BMP7.
- وسط DMEM / F12 و HO1 المتقدم الدافئ عند 37 درجة مئوية قبل الاستخدام. في نفس لوحة ULA المكونة من 6 آبار، قم بسحب وسيط HBO السابق بعناية عن طريق الانحناء فوق اللوحة ووضع طرف الماصة الزجاجية المتصلة بفراغ على الحائط (أو يدويا باستخدام ماصة P1000).
- أضف 3 مل من Advanced DMEM / F12 الدافئ لكل بئر وشفطه. أضف 3 مل من وسط HO1 الدافئ لكل بئر. قم بتغيير وسيط HO1 كل 3 أيام (D-29 ، D-32 ، D-35 ، D-38) جنبا إلى جنب مع جمع العينات.
- في D 38 ، قم بتعديل مزيج الكواشف للفترة الثانية من HO (HO2) عن طريق إزالة CHIR99021 و BMP4 و dbcAMP و FGF7 واستبدالها ب FGF19 و DAPT. التركيبة المتوسطة النهائية هي Advanced DMEM / F12 كوسيط قاعدي ، 1x N2 مكمل غذائي ، 1x B27 ، 500 نانومتر A83-01 ، 30 ميكرومتر ديكساميثازون ، 50 نانوغرام / مل عامل نمو البشرة البشرية (EGF) ، 20 نانوغرام / مل عامل نمو خلايا الكبد البشرية (HGF) ، 10 ميكرومتر نيكوتيناميد ، 20 نانوغرام / مل BMP7 ، 25 نانوغرام / مل FGF19 ، 5 ميكرومتر DAPT.
- وسط DMEM / F12 و HO2 المتقدم الدافئ عند 37 درجة مئوية قبل الاستخدام. استمر بنفس لوحة ULA المكونة من 6 آبار ، واستنشق بعناية وسط HO1 السابق. أضف 3 مل من Advanced DMEM / F12 لكل بئر وقم بإزالته.
- أضف 3 مل من وسط HO2 الدافئ لكل بئر. قم بتغيير وسيط HO2 كل 4 أيام (D-42 ، D-46 ، D-50 ، ...) وأخذ عينات في نفس الأيام التي يتم فيها تغيير الوسيط.
3. تفكك خلية واحدة
ملاحظة: هذه الخطوة ضرورية لتقنية تسلسل الحمض النووي الريبي أحادية الخلية. قد يختلف عدد العضيات وفقا للحجم ، وكلما كان يوم التفكك أكبر سنا ، زادت كمية الخلايا في العضيات. في الأيام السابقة ، زاد عدد العضيات المنفصلة ، وانخفضت أوقات التفكك بكميات متساوية. تم إجراء التفكك مع 10 عضيات في D-14 و D-17 ، و 8 عضيات في D-23 و D-26 ، و 6 عضويات في D-30 و D-45. يتم تفصيل إجراءات مجموعة واحدة من العضيات (الشكل 1F).
- تحضير الكواشف
- تحضير Advanced-DMEM بتركيز نهائي 7.5٪ من الألبومين البقري الكسر V (BSA) والتصفية بعد التجانس.
- تحضير 1 مل من وسط إنزيم التفكك مع 1 مل من التربسين 0.5٪ - EDTA (10x) كوسط قاعدي ، و 50 ميكرومتر Y-27632 ، و 40 U / μL RNase مثبط ، و 1 U / μL DNase I.
- قم بإعداد وسط تعطيل التربسين باستخدام 2 مل من Advanced DMEM / F12 + 7.5٪ BSA كوسط قاعدي ، و 50 ميكرومتر Y-27632 ، و 40 U / μL RNase مثبط ، و 1 U / μL DNase I.
- قم بتسخين كل من الوسائط و PBS عند 37 درجة مئوية قبل البدء.
- تفكيك HHOs
- نظف مكان العمل والأدوات باستخدام منظف RNase. اجمع عدد العضيات وفقا ليوم التمايز في أنبوب بولي بروبلين سعة 15 مل بطرف مفتوح على مصراعيه.
- يغسل باستخدام PBS 2x-3x. أضف 1 مل من وسط إنزيم التفكك في أنبوب 15 مل مع العضيات المجمعة واحتفظ بدرجة حرارة 37 درجة مئوية في كرسي هزاز عند 30 دورة في الدقيقة لمدة 5 دقائق.
تنبيه: احرص على عدم إسقاط الأنبوب من الكرسي الرزاح. - بعد 5 دقائق ، أولا ، تحقق من الغطاء بحثا عن أي عضيات متبقية ، ثم قم بتعطيل العضيات ميكانيكيا باستخدام P1000 عن طريق الدوران لأعلى ولأسفل 10 مرات لكل مادة عضوية (60 مرة في المجموع). كرر نفس الاضطراب مع P200. افحص غطاء الأنبوب في حالة تعثر العضيات عليه.
- ضع الأنبوب سعة 15 مل مرة أخرى على الروك في الحاضنة لمدة 5 دقائق أخرى. كرر عملية النقطة 4، بدءا من تحريك P200 لأعلى ولأسفل والاستمرار باستخدام ماصة مصلية سعة 1 مل متصلة بطرف P10.
- ضع الأنبوب سعة 15 مل مرة أخرى على الروك في الحاضنة لمدة 5 دقائق. في حالة عدم وجود تفكك ، اتركه لمدة 5 دقائق إضافية وكرر التعطيل اليدوي.
- أضف 1 مل من وسط تعطيل التربسين وقم بتجانسه. ضع أنبوبا جديدا من البولي بروبلين سعة 15 مل مع مصفاة خلية 40 ميكرومتر في الأعلى. قم بتصفية 2 مل (الخلايا ذات وسط إنزيم التفكك ووسط تعطيل التربسين) من خلال مصفاة خلية 40 ميكرومتر في أنبوب 15 مل.
- أضف 1 مل أخرى من وسط تعطيل التربسين لاستعادة أي خلايا متبقية من مصفاة الخلية 40 ميكرومتر.
- خذ 5 ميكرولتر من وسط أحادي الخلية ممزوجا ب 5 ميكرولتر من محلول صبغة لحساب عدد الخلايا المنفصلة للمضي قدما في تثبيتها. عد الخلايا بعد الطرد المركزي وإعادة التعليق باستخدام الكاشف الأول لمجموعة التثبيت وقم بإجراء ترشيح الخلية باستخدام مصفاة خلية 40 ميكرومتر.
النتائج
تم تحديد كل مرحلة من مراحل بروتوكول التمايز التدريجي هذا من hiPSC إلى HHOs باستخدام القياسات الكمية بواسطة qPCR والتألق المناعي للعلامات المعروفة الخاصة بالمرحلة من الببليوغرافيا (الشكل 2). تم تصوير خطوة بخطوة لكلتا التقنيتين والنتائج المحققة المتعلقة بالتمايز الصحيح إلى HOs في14. في التحقيق السابق ، تم تعريف hiPSCs من خلال مستويات mRNA ل POU5F1 (المعروف أيضا باسم OCT4) و SOX2 ، وهما عاملان معروفان من Yamanaka16 ، والتي انخفضت بمرور الوقت (الشكل 2 أ). بعد ذلك ، تم قياس مستويات mRNA لعلامات DE11 مثل OTX2 و CER1 و FOXA2 و PFG11 علامات HNF4A و CDX2 و TBX3 ، جنبا إلى جنب مع التعبير الموضعي ل OTX2 و HNF4A و TBX3 عن طريق التألق المناعي (الشكل 2 أ ، ب). بعد الترويج ثلاثي الأبعاد ، لمتابعة التألق المناعي للتقدم من الألبومين و HNF4a (الشكل 2C) ؛ تم تنفيذ علامة التكاثر ، MKI6717 ، و TBX3 ، المهمة في تنظيم الأرومة الكبدية18 (الشكل 2 د) من D-18 إلى D-46. والجدير بالذكر أن الألبومين متنامي مع HNF4a (الشكل 2C) ؛ وفي الوقت نفسه ، ظهر MKI67 بشكل متقطع في D-46 (الشكل 2 د). أيضا ، تم تحديد الخلايا الشبيهة بخلايا الكبد والقنوات الصفراوية من خلال مستويات mRNA والتألق المناعي ل HNF4A19 و KRT718 في D-46 (الشكل 2E).
زاد حجم العضيات النامية تدريجيا من D-14 إلى D-38 ، كما يتضح من الزيادة ~ 2 ضعفا في مستويات mRNA للعلامة التكاثرية MKI67 على D-22 مقارنة ب D-10. أدى غياب T4 في الوسط إلى زيادة مستويات MKI67 mRNA بنسبة ~ 20٪ و ~ 75٪ على D-14 و D-18 ، على التوالي ، مقارنة باليوم 10 (الشكل 3 أ). لإثبات وظيفة العضية الكبدية ، تم قياس مستويات الألبومين والصميم الشحمي B و A114 التي تم جمعها من وسط العضيات الكبدية باستخدام ELISA. في D-42 و D-46 ، ظلت مستويات ALB mRNA أعلى بكثير في T4-HOs مقارنة ب T3-HOs أو V-Hos بمقدار 3.0 أضعاف و 2.5 ضعف ، على التوالي (الشكل 3 ب). من ناحية أخرى ، كانت مستويات APOB ~ 10 أضعاف و 3 أضعاف أعلى (الشكل 3 ج) ، وكانت مستويات APOA1 ~ 3 أضعاف و ~ 2 أضعاف أعلى (الشكل 3 د) في D-42 و D-46 ، على التوالي.
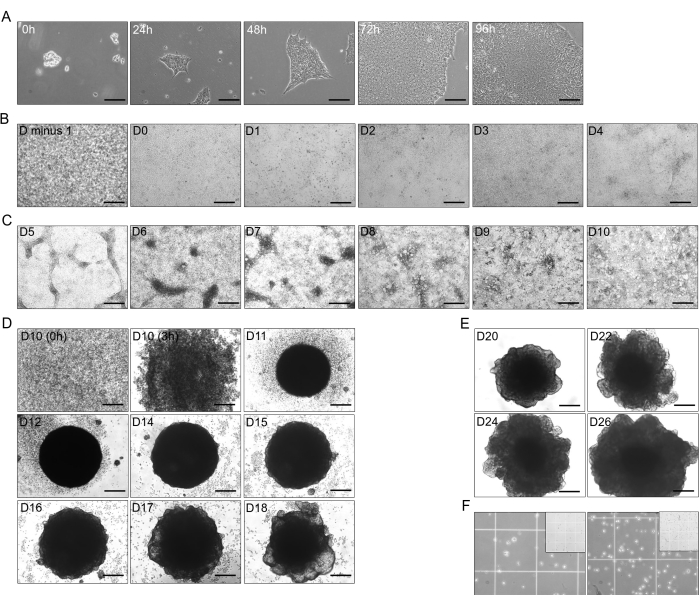
الشكل 1: مراحل التمايز من hiPSC إلى العضيات الكبدية. (أ) النمو الانتقالي ل hiPSC (خط CS03iCTR-n3) من 0 ساعة إلى 96 ساعة ، ويصل إلى ما يقرب من 70٪ -80٪ التقاء في آبار لوحة واحدة. شريط المقياس: 125 ميكرومتر. (ب) تقدم المرحلة الأولية من تمايز hiPSC إلى الأديم الباطن النهائي (DE) ، مما يظهر التقاء بنسبة 100٪ في اليوم السابق (D ناقص 1) بعد 24 ساعة ، والتمايز حتى D4 (D-0 إلى D-4). شريط المقياس: 300 ميكرومتر (C) التمايز من DE (D-4) إلى الأمعاء الأمامية الخلفية (PFG; D-10) مع إضافة T4 B26. شريط المقياس: 300 ميكرومتر. (D) تحويل 2D-PFG إلى عضيات كبدية غير ناضجة ثلاثية الأبعاد (IHO) مع B26 المضاف T4 من D-10 كخلايا مفردة حتى D-18 ، باستثناء D-13. شريط المقياس: 300 ميكرومتر. (ه) صيانة ونمو عضيات الأرومات الكبدية (HBO) مع B26 المضاف إلى T4 في D-20 و D-22 و D-24 و D-26. شريط المقياس: 300 ميكرومتر (F) تفكك HBO عند D-26 (~ 2.5 × 105 خلايا في 750 ميكرولتر ؛ يسار) ، و HO1 في D-30 (~ 4 × 105 خلايا في 750 ميكرولتر ؛ يمين) في خلايا مفردة مع B26 المضاف إلى T4. يوضح الجزء الداخلي الحجم المربع البالغ 1 مم لغرفة Neuebauer ، حيث يبلغ قياس المربع الأصغر 250 ميكرومتر. تم التقاط الصور إلى HHOs التي كان تركيزها الحر ل T4 المستخدم في الوسائط ~ 15 جزء في المليون. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: مراقبة وتوصيف تمايز HHOs. (أ) التعبير عن مستويات الرنا المرسال لعلامات hiPSC (POU5F1 ، SOX2) ، الأديم الباطن المحدد (DE ؛ OTX2 و CER1 و FOXA2) والأمعاء الأمامية الخلفية (PFG; TBX3 ، HNF4A ، CDX2). (iPSC ، ن = 8 ؛ DE و PFG n = 7 ؛ HNF4A في PFG ، ن = 6). (ب) التألق المناعي في hiPSC و DE و PFG من OTX2 (أعلى ، أحمر) ، HNF4A (وسط ، أخضر) ، و TBX3 (أسفل ، أحمر). (ج) "التألق المناعي في D-18 و D-26 و D-46 من الألبومين (الأحمر) و HNF4A (الأخضر). (د) التألق المناعي في D-18 و D-26 و D-46 من MKI67 (أخضر) و TBX3 (أحمر). (ه) التألق المناعي في D-46 للألبومين (علامة الخلايا الكبدية ؛ أحمر) و KRT7 (علامة الخلايا الصفراوية ؛ أخضر). تظهر النوى مع 4′،6-diamidino-2-fenilindol (DAPI). تم تعديل هذا الرقم من14. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: تحليل نضج HHO. (أ) مستويات mRNA النسبية للعلامة التكاثرية MKI67 في غياب TH (أسود) مقابل T4 الحر عند ~ 15 جزء من المليون (أحمر) في الوسط من D-10 إلى D-46 (ن = 4 باستثناء T4-HOs في D-42 ، ن = 2 ؛ وفي D-46 ، ن = 3). (ب) تم قياس مستويات الألبومين في الوسط من D-35 إلى D-50 في ثلاثة شروط: غياب TH (أسود) ، مع T4 حر عند ~ 15 جزء في المليون (أحمر) و T3 الحر عند ~ 10 جزء في المليون (أزرق ؛ ن = 4). (ج، د) تم قياس مستويات صميم البروتين الشحمي B (APOB) و A1 (APOA1) في الوسط من D-35 إلى D-50 في ثلاث شروط: غياب TH (أسود). ومع T4 مجاني عند ~ 15 جزء في المليون (أحمر). بيانات من 10 عضيات لكل بئر (ن = 4). تم استخدام اختبار الطالب ثنائي الذيل لمقارنة V-HOs مقابل T4-HOs واختبار ANOVA أحادي الاتجاه واختبار Tukey لمقارنات متعددة. البيانات هي متوسط التكرارات ، ممثلة في شكل مخططات نقطية مبعثرة محاذاة ومتوسطها. *: p<0.05; **: p<0.01; p<0.001: ص<0.0001.: يشير المحور x إلى أيام التمايز. تم تعديل هذا الرقم من14. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يقدم البروتوكول الحالي تفاصيل منهجية مختلفة حول كيفية التعامل مع hiPSCs والثقافات العضوية ثلاثية الأبعاد اللاحقة. يتضمن ذلك الخطوتين الحاسمتين الرئيسيتين: (أنا) فصل الثقافات ثنائية الأبعاد ثم تطورها إلى عضيات كبدية ثلاثية الأبعاد بعد 10 أيام ، بالإضافة إلى (2) التفكك الدقيق لهيكل ثلاثي الأبعاد إلى خلايا مفردة. بناء على المعلومات المتاحة ، هذا هو التقرير الأول لنموذج HHO ثلاثي الأبعاد لدراسة عمل هرمون الغدة الدرقية ، مما يدل على ذروة التعبير عن DIO2 في الخلايا الشبيهة بالخلاياالكبدية 14 كما تم تحديدها في الأصل في فئران الكبدP1 20.
كما هو الحال مع العديد من التقنيات الأخرى التي تستخدم السقالات المطبقة على الخلايا ، تم استخدام هلام المصفوفة خارج الخلية لتقليد المصفوفة خارجالخلية 21 ، وبالتالي تسهيل التجميع في الهيكل ثلاثي الأبعاد المميز للعضيات. تؤكد الطبيعة الحساسة للحرارة لهذا الكاشف على أهمية التلاعب به وإبقائه مجمدا ، وأثناء المناولة ، مغمورا في الجليد. وبالتالي ، فإن استخدام هلام مصفوفة خارج الخلية مختلف ممكن22 ، على الرغم من أن hiPSCs لم تلتصق وتتكاثر في لوحة غياب السقالة في هذا البروتوكول ، مما يجعل إدارتها السليمة جانبا حاسما في بداية البروتوكول ، جنبا إلى جنب مع توليد العضيات ثلاثية الأبعاد.
بعد الانتهاء من تمايز HOs ، يمثل التفكك القابل للتطبيق للعضيات إلى خلايا مفردة عقبة رئيسية أخرى يجب التغلب عليها ، حيث قد يؤدي الاضطراب الميكانيكي إلى موت الخلايا ، بحلول ذلك الوقت بيانات تسلسل الحمض النووي الريبي منخفضةالجودة 23. لضمان أفضل النتائج ، أظهر البروتوكول الحالي أنه يمكن تحقيق أكثر من 70٪ من صلاحية الخلية المفردة ، مع تفكك أكثر من 105 خلايا قبل وبعد التثبيت للترميز الشريطي اللاحق.
على عكس المخطوطات الأخرى التي تصف نوعا واحدا فقط من الخلايا العضوية7 ، فإن تمايز HHO يشمل خليتين مشتقتين من الأرومة الكبدية على الأقل: خلايا الكبد والخلايا الصفراوية. دمج اثنين من الكواشف المسؤولة عن تكوينها ، HFG24 و EGF25 ، جنبا إلى جنب مع ديكساميثازون26 الذي يعزز نضوج خلايا الكبد ، و Jagged-118 الذي ينشط إشارات Notch التي تؤدي إلى الخلايا الصفراوية. تسمح لنا شبكة الإشارات المتشابكة هذه في تطوير HOs بتحقيق الهيكل ثلاثي الأبعاد وتقليد التجارب في الجسم الحي ، بالإضافة إلى التغلب على عيوب انخفاض التمايز بين الثقافات طويلة الأجل لخلايا الكبد الأولية27. من الجدير بالذكر أنه على الرغم من التعبير عن علامات الكبد النموذجية للبالغين ، لا يزال من الممكن اكتشاف وجود علامات الجنين في المراحل المتقدمة من العضيات28 ، كما يوضح هذا البروتوكول. هذا ، في الواقع ، يعكس تطور الكبد الطبيعي لدى البشر ، حيث يمكن اكتشاف علامات كبد الجنين بشكل طبيعي حتى عام واحد من العمر29.
كان الحدوث النادر الذي لوحظ أثناء تطور hiPSCs إلى HHOs (خاصة خلال الفترات غير الناضجة من HOs ، كما هو الحال في الأيام الأخيرة من IHO وبعض HBO و HO1) هو ظهور الهياكل الكيسية المتطورة ، والتي تلاشت في النهاية بمجرد وضع الألواح على شاكر. يشير هذا التقدم غير المتناسب للهياكل الكيسية إلى وجود نواة نخرية بحلول ذلك الوقت ضرورة الري العالي30 مع تغييرات متوسطة أكثر تواترا أو إضافة كميات منخفضة من هلام المصفوفة خارج الخلية للقضاء على النمو المفرط للكيس.
على عكس المنشور الأصلي ، الذي ركز على زيادة عدد العضيات في الفترة الأخيرة من التمايز لفحص الأدوية عاليةالإنتاجية 11 ، أدخلت الطريقة التي تم الإبلاغ عنها الآن استخدام لوحات ULA لتعزيز التكوين المبكر للعضيات ثلاثية الأبعاد كبيرة الحجم وتسهيل التعامل مع HHOs. تظهر هذه التعديلات المرونة والمجموعة الواسعة من الدراسات التي يمكن إنجازها من خلال هذا البروتوكول المباشر.
Disclosures
أنطونيو سي بيانكو هو مستشار لشركة Abbvie و Acella و Aligos و Synthonics. المؤلفون الآخرون ليس لديهم إفصاحات ذات صلة.
Acknowledgements
تم دعم هذا العمل من قبل المعهد الوطني للسكري وأمراض الجهاز الهضمي والكلى (NIDDK -DK58538 ، DK65066 ، DK77148; ACB).
Materials
| Name | Company | Catalog Number | Comments |
| 10 µL Universal Pipette Tips Filtered, Low rentention, Pre-sterile | VWR | 613-6462 | All procedures |
| 1000 µL Universal Pipette Tips Filtered, Low rentention, Pre-sterile | VWR | 613-6470 | All procedures |
| 15 mL Polypropilene Conical Tube | Falcon (Corning) | 352097 | Dissociation Hepatic Organoids |
| 200 µL Universal Pipette Tips Filtered, Low rentention, Pre-sterile | VWR | 613-6465 | All procedures |
| 3,3',5-Triiodo-L-thyronine | Sigma | T2877-100 | Hepatic Organoid differentiation |
| 40 μm Cell Strainer | Corning | 431750 | Dissociation Hepatic Organoids |
| 50 mL tube | Falcon (Corning) | 352070 | All procedures |
| 6 well-plate Nunc Cell-Culture Treated Multidishes | Thermo fisher scientific | 140675 | hiPSC maintenance |
| A83-01 | R&D Systems | 2939/10 | Hepatic Organoid differentiation |
| Advanced DMEM/F12 | Gibco | 12634010 | Hepatic Organoid differentiation |
| ART Wide Bore Filtered Pipette Tips | ART | 2069GPK | All procedures |
| B27 supplement | Gibco | 17504044 | Hepatic Organoid differentiation |
| BMP7 | R&D Systems | 354-BP-010/CF | Hepatic Organoid differentiation |
| Bovine Albumin Fraction V (7.5% solution) | Gibco | 15260037 | Dissociation Hepatic Organoids |
| BSA, Fraction V, Fatty Acid Free for Tissue Culture | GoldBio | A-421-100 | Dissociation Hepatic Organoids |
| CHIR99021 | R&D Systems | 4423/10 | Hepatic Organoid differentiation |
| Corning 96-well Clear Flat Bottom Ultra-Low Attachment | Corning | 3474 | Hepatic Organoid differentiation |
| Costar 6-well Clear Flat Bottom Ultra-Low Attachment | Corning | 3471 | Hepatic Organoid differentiation |
| CS03iCTR-n3 human induced Pluripotent Stem Cell line | Cedar-sinai | hiPSC maintenance | |
| DAPT | R&D Systems | 2634/10 | Hepatic Organoid differentiation |
| dbCAMP | Millipore Sigma | D0627-100MG | Hepatic Organoid differentiation |
| Dexamethasone | R&D Systems | 1126/100 | Hepatic Organoid differentiation |
| DMEM/F12 | Gibco | 11320033 | hiPSC maintenance |
| DNAse I, RNase-free, HC | Thermo Fisher scientific | EN0523 | Dissociation Hepatic Organoids |
| Falcon 10 mL Serological Pipet, Polystyrene, 0.1 Increments, Individually Packed, Sterile | Corning | 357551 | All procedures |
| Falcon 5 mL Serological Pipet, Polystyrene, 0.1 Increments, Individually Packed, Sterile | Corning | 357543 | All procedures |
| Falcon 50 mL Serological pipet, Polystyrene, 1.0 Increments, Individually Packed, Sterile | Corning | 357550 | All procedures |
| Gentle Cell Dissociation Reagent (GCDR) | Stemcell Technologies | 100-0485 | Hepatic Organoid differentiation |
| Glutamax supplement | Gibco | 35050061 | Hepatic Organoid differentiation |
| L-Thyroxine | Sigma | T1775-1G | Hepatic Organoid differentiation |
| Matrigel hESC-Qualified Matrix, LDEV-free, 5 mL | Corning | 354277 | Extracellular matrix gel |
| mFreSR | Stemcell Technologies | 5855 | hiPSC cryopreservation medium |
| mTeSR 5x Supplement | Stemcell Technologies | 100-0276 | hiPSC medium |
| mTeSR Plus | Stemcell Technologies | 100-0276 | hiPSC medium |
| Multi Platform Shaker | Fisherbrand (Thermo Fisher technologies) | 88861021 | Hepatic Organoid differentiation |
| N2 supplement | Gibco | 17502048 | Hepatic Organoid differentiation |
| Nicotinamide | R&D Systems | 4106/50 | Hepatic Organoid differentiation |
| PBS, pH 7.4 | Gibco | 10010023 | hiPSC maintenance |
| Recombinant human BMP4 | R&D Systems | 314-BP-010/CF | Hepatic Organoid differentiation |
| Recombinant human EGF | R&D Systems | 236-EG-200 | Hepatic Organoid differentiation |
| Recombinant human FGF basic/FGF2/bFGF | R&D Systems | 233-FB-010/CF | Hepatic Organoid differentiation |
| Recombinant human FGF19 | R&D Systems | 959-FG-025/CF | Hepatic Organoid differentiation |
| Recombinant human HGF | R&D Systems | 294-HG-005/CF | Hepatic Organoid differentiation |
| Recombinant Human Jagged-1 Fc Chimera | R&D Systems | 1277-JG-050 | Hepatic Organoid differentiation |
| Recombinant human KGF/FGF7 | R&D Systems | 251-KG-010/CF | Hepatic Organoid differentiation |
| ReLeSR | Stemcell Technologies | 100-0483 | hiPSC detaching medium |
| RNAse Inhibitor Ambion, cloned, 40 U/μL | Invitrogen | AM2682 | Dissociation Hepatic Organoids |
| RNase Zap | Invitrogen | AM9780 | Dissociation Hepatic Organoids |
| Sorvall Legend XT/XF Centrifuge Series | Thermo Fisher Scientific | 75004539 | All procedures |
| STEMdiff Definitive Endoderm Kit | Stemcell Technologies | 5110 | Hepatic Organoid differentiation |
| Trypan Blue solution (0.4%) | Gibco | 15250061 | Dye solution |
| TrypLE Express Enzyme | Gibco | 12604013 | Cell Dissociation enzyme |
| Trypsin 0.5% - EDTA (10X) | Gibco | 15400054 | Dissociation Hepatic Organoids |
| Valproic acid, sodium salt | R&D Systems | 2815/100 | Hepatic Organoid differentiation |
| Vari-Mix Platform Rocker | Thermo Fisher scientific | M79735Q | Dissociation Hepatic Organoids |
| Y-27632 dihydrochloride | R&D Systems | 1254 | Hepatic Organoid differentiation |
References
- Peiseler, M., et al. Immune mechanisms linking metabolic injury to inflammation and fibrosis in fatty liver disease - novel insights into cellular communication circuits. J Hepatol. 77 (4), 1136-1160 (2022).
- Gordillo, M., Evans, T., Gouon-Evans, V. Orchestrating liver development. Development. 142 (12), 2094-2108 (2015).
- Lemaigre, F. P. Mechanisms of liver development: concepts for understanding liver disorders and design of novel therapies. Gastroenterology. 137 (1), 62-79 (2009).
- He, C., et al. Liver organoids, novel and promising modalities for exploring and repairing liver injury. Stem Cell Rev Rep. 19 (2), 345-357 (2023).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Takebe, T., et al. Vascularized and functional human liver from an iPSC-derived organ bud transplant. Nature. 499 (7459), 481-484 (2013).
- Si-Tayeb, K., et al. Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells. Hepatology. 51 (1), 297-305 (2010).
- Wu, F., et al. Generation of hepatobiliary organoids from human induced pluripotent stem cells. J Hepatol. 70 (6), 1145-1158 (2019).
- Shinozawa, T., et al. High-fidelity drug-induced liver injury screen using human pluripotent stem cell-derived organoids. Gastroenterology. 160 (3), 831-846.e10 (2021).
- Ouchi, R., et al. Modeling steatohepatitis in humans with pluripotent stem cell-derived organoids. Cell Metab. 30 (2), 374-384.e6 (2019).
- Ramli, M. N. B., et al. Human pluripotent stem cell-derived organoids as models of liver disease. Gastroenterology. 159 (4), 1471-1486.e12 (2020).
- Shen, M. M. Nodal signaling: developmental roles and regulation. Development. 134 (6), 1023-1034 (2007).
- Ang, L. T., et al. A roadmap for human liver differentiation from pluripotent stem cells. Cell Rep. 22 (8), 2190-2205 (2018).
- Hidalgo-Álvarez, J., Salas-Lucia, F., Vera Cruz, D., Fonseca, T. L., Bianco, A. C. Localized T3 production modifies the transcriptome and promotes the hepatocyte-like lineage in iPSC-derived hepatic organoids. JCI Insight. 8 (23), e173780 (2023).
- . B27 Supplement Available from: https://www.weizmann.ac.il/molgen/hanna/sites/molgen.hanna/files/users/user52/HANNA-LAB-B22-B27-PROTOCOL-V3.pdf (2016)
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Zhu, X., Sun, J. CircHIPK3 regulates melanoma cell behaviors by binding with miR-215-5p to upregulate YY1. Mol Cell Probes. 53, 101644 (2020).
- Guan, Y., et al. Human hepatic organoids for the analysis of human genetic diseases. JCI Insight. 2 (17), e94954 (2017).
- Walesky, C., Apte, U. Role of hepatocyte nuclear factor 4α (HNF4α) in cell proliferation and cancer. Gene Expr. 16 (3), 101-108 (2015).
- Fonseca, T. L., et al. Hepatic inactivation of the type 2 deiodinase confers resistance to alcoholic liver steatosis. Alcohol Clin Exp Res. 43 (7), 1376-1383 (2019).
- Kleinman, H. K., Martin, G. R. Matrigel: basement membrane matrix with biological activity. Semin Cancer Biol. 15 (5), 378-386 (2005).
- Kozlowski, M. T., Crook, C. J., Ku, H. T. Towards organoid culture without Matrigel. Commun Biol. 4 (1), 1387 (2021).
- Arceneaux, D., et al. A contamination focused approach for optimizing the single-cell RNA-seq experiment. iScience. 26 (7), 107242 (2023).
- Matsumoto, K., Nakamura, T. Hepatocyte growth factor: molecular structure and implications for a central role in liver regeneration. J Gastroenterol Hepatol. 6 (5), 509-519 (1991).
- Kimura, M., Moteki, H., Ogihara, M. Role of hepatocyte growth regulators in liver regeneration. Cells. 12 (2), 208 (2023).
- Michalopoulos, G. K., Bowen, W. C., Mulè, K., Luo, J. HGF-, EGF-, and dexamethasone-induced gene expression patterns during formation of tissue in hepatic organoid cultures. Gene Expr. 11 (2), 55-75 (2003).
- Kaur, I., et al. Primary hepatocyte isolation and cultures: Technical aspects, challenges and advancements. Bioengineering (Basel). 10 (2), 131 (2023).
- Baxter, M., et al. Phenotypic and functional analyses show stem cell-derived hepatocyte-like cells better mimic fetal rather than adult hepatocytes. J Hepatol. 62 (3), 581-589 (2015).
- Blohm, M. E., Vesterling-Hörner, D., Calaminus, G., Göbel, U. Alpha 1-fetoprotein (AFP) reference values in infants up to 2 years of age. Pediatr Hematol Oncol. 15 (2), 135-142 (1998).
- Liu, Q., Zeng, A., Liu, Z., Wu, C., Song, L. Liver organoids: From fabrication to application in liver diseases. Front Physiol. 13, 956244 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved