Method Article
Protocolo integrador para la generación de organoides hepáticos humanos 3D derivados de iPSC
En este artículo
Resumen
Los organoides hepáticos 3D derivados de iPSC humanos constituyen una herramienta potencial para comprender la acción de la hormona tiroidea en el desarrollo del hígado.
Resumen
La obtención de células hepáticas estables en cultivo supone un reto importante para los estudios hepáticos. Teniendo esto en cuenta, se describe un método optimizado que utiliza células madre pluripotentes inducidas humanas (hiPSC) para generar cultivos 3D de organoides hepáticos humanos (HHO). La utilización de HHO ofrece un enfoque valioso para comprender el desarrollo del hígado, desentrañar las enfermedades hepáticas, realizar estudios de alto rendimiento para el desarrollo de fármacos y explorar el potencial del trasplante de hígado. En la investigación anterior, mediante técnicas de inmunofluorescencia y RT-PCR cuantitativa, se monitorizó la progresión, identificando la presencia de diversas poblaciones celulares, como los hepatoblastos y los dos tipos de células derivadas de hepatoblastos: colangiocitos o células similares a los hepatocitos, en diferentes etapas de desarrollo. Este informe presenta un protocolo 3D sencillo a partir de hiPSC para adquirir HHO que reflejan las etapas del desarrollo del embrión humano. El protocolo, que abarca entre 46 y 50 días, abarca varios pasos: (i) gestión meticulosa del cultivo de hiPSC para generar HHO, (ii) inicio de la diferenciación celular en 2D y la posterior transición a 3D, y (iii) una estrategia de disociación optimizada para descomponer los HHO en células individuales para la secuenciación de ARN de una sola célula. Como ilustración de las amplias aplicaciones de este enfoque, el presente protocolo se aplicó previamente para desentrañar el papel de la señalización de la hormona tiroidea en el desarrollo de las células hepáticas.
Introducción
El hígado realiza diversas funciones metabólicas, como la regulación de la disponibilidad de sustratos energéticos fácilmente utilizables como la glucosa y los cuerpos cetónicos, así como la desintoxicación de compuestos xenobióticos. En los últimos años, se ha producido un aumento significativo en la prevalencia de enfermedades hepáticas, atribuidas en gran medida a la esteatohepatitis no alcohólica (EHNA), que, si no se tratan, pueden progresar a cirrosis o cáncer1. Por lo tanto, es imperativo comprender las funciones metabólicas del hígado y sus enfermedades relacionadas para facilitar el desarrollo de tratamientos efectivos 2,3.
La aparición de cultivos tridimensionales (3D) ha llevado a la creación del modelo de organoide, que representa un enfoque innovador y revolucionario para abordar la funcionalidad y la complejidad del desarrollo de losórganos. Los organoides se definen como agregados 3D autoorganizados de células diferenciadas que imitan las funciones y la citoarquitectura del órgano respectivo5.
En las últimas décadas, una miríada de protocolos de organoides hepáticos humanos (HHO) ha ganado un interés generalizado, que van desde la utilización de diversas células derivadas de iPSC humanas6 o únicamente células similares a los hepatocitos7 hasta la incorporación de una variedad de microambientes intrincados de factores de crecimiento o inhibidores y la diferenciación de células progenitoras en monocapa7 o 3D8. Estos enfoques se prestan a una multitud de objetivos potenciales, desde el cribado de fármacos de alto rendimiento9 hasta la obtención de más información sobre los mecanismos subyacentes a las enfermedades hepáticas10.
Aquí, se realiza un protocolo paso a paso de diferenciación de HHO basado en las señales químicas mencionadas11 , con variaciones metodológicas adaptadas. Este protocolo comienza con el manejo y cultivo adecuado de células madre pluripotentes inducidas humanas (hiPSC), detallando técnicas para la manipulación del gel de matriz extracelular, el paso de células y la diferenciación en HHO. El proceso comienza estimulando la diferenciación de las hiPSCs en endodermo definitivo (DE)12 y posteriormente imitando los efectos in vivo de FGF y BMP para promover el desarrollo de células monocapa del intestino anterior posterior (PFG)13. La arquitectura 3D se logra el día 10 cuando las células PFG se diferencian en una fase hepática inmadura que se convertirá en los hepatoblastos, la célula precursora fetal de los colangiocitos y hepatocitos2. Finalmente, las estructuras 3D se disocian en células individuales para estudios de secuenciación de ARN. Como ejemplo de la aplicabilidad de este protocolo, se demostró cómo este modelo de HHO se presta para el estudio de la acción de la hormona tiroidea y la desiodinasa tipo 2 (D2) en el desarrollo de hepatocitos y colangiocitos14.
Protocolo
1. Manejo de hiPSC
NOTA: las hiPSC (línea celular CS03iCTR-n3) se compraron comercialmente. El manejo adecuado del recubrimiento de gel de matriz extracelular y el medio hiPSC es clave para unir las hiPSC a las placas y alimentarlas. Aquí, se describieron los volúmenes necesarios para una placa de 6 pocillos. Las hiPSC restantes de la placa de 6 pocillos, que no se diferenciarán en organoides, pueden almacenarse en nitrógeno líquido para su almacenamiento a largo plazo.
- Dispensación de gel de matriz extracelular y medio hiPSC
- Descongele adecuadamente el frasco del gel de matriz extracelular colocándolo en un recipiente con hielo a 4 °C durante la noche.
NOTA: Antes de alícuotas, verifique el certificado de análisis para verificar el volumen del factor de dilución. Esto representa la concentración de proteínas del gel de la matriz extracelular; por lo tanto, varía de un lote a otro. - Distribuya el gel de matriz extracelular en alícuotas adecuadas de acuerdo con el factor de dilución (4x, 2x y 1x) utilizando tubos preenfriados y etiquetados. Agregue un factor de dilución 4x de gel de matriz extracelular a 25 mL de DMEM/F12 frío para cubrir cuatro placas de 6 pocillos. Selle rápidamente las tapas con una película de sellado de laboratorio y congélelas a -80 °C. Evite la exposición prolongada al aire y la creación de burbujas en las alícuotas.
- Descongele 100 ml de medio suplementario hiPSC a 4 °C durante la noche. Añádalo a 400 mL de medio basal hiPSC. Una vez homogeneizado con una pipeta serológica de 50 mL, alícuota el medio hiPSC en tubos de 40 mL y congelar a -20 °C hasta su uso.
- Descongele adecuadamente el frasco del gel de matriz extracelular colocándolo en un recipiente con hielo a 4 °C durante la noche.
- Recubrimiento de placas para el cultivo hiPSC
- Numere y etiquete la(s) placa(s) de 6 pocillos. Mantenga una alícuota de gel de matriz extracelular cerca, sumergida en hielo seco.
- Para recubrir una placa de 6 pocillos, diluya una alícuota de gel de matriz extracelular (1x) en 6,25 mL de DMEM/F12 frío (2x en 12,5 mL y 4x en 25 mL de DMEM/F12).
- Pipetear un pequeño volumen de DMEM/F12 (~500 μL) en el tubo de gel de matriz extracelular. Agitar hacia arriba y hacia abajo para descongelar y homogeneizar el gel de matriz extracelular con DMEM/F12 frío, evitando la creación de burbujas, y devolverlo al resto del tubo frío que contiene DMEM/F12 utilizando una pipeta serológica para mezclar completamente.
- Incruste 1 mL de gel de matriz extracelular en DMEM/F12 en un pocillo para recubrir la placa de 6 pocillos (6 mL para toda la placa). Distribuya el 1 mL uniformemente sobre la superficie moviendo, sin agitar, la placa hasta que esté completamente cubierta.
- Deje reposar a temperatura ambiente (RT) durante 1 h antes de usar. Si la placa de 6 pocillos no se utiliza en su totalidad, séllela con una película de sellado de laboratorio y guárdela en el refrigerador a 4 °C.
NOTA: Una placa recubierta se puede almacenar durante 1 semana en la nevera a 4 °C.
- Descongelación y cultivo de hiPSC
- Calcule de antemano el volumen del medio hiPSC y caliéntelo a RT junto con la placa recubierta de 6 pocillos 1 h antes de su uso (2 mL por pocillo).
NOTA: En caso de alícuotas frías o congeladas, sumérjalas en una incubadora a 37 °C o en un baño de agua 15 min antes de su uso. - Divida 1 mL de hiPSCs en el líquido N2 de un criovial en 3 pocillos de una placa de 6 pocillos (proporción 1:3). Para una placa completa de 6 pocillos, use 2 crioviales. Aquí, el protocolo describe la descongelación y el cultivo de hiPSC a partir de una criovial. Repita el proceso para 2 crioviales.
- Introducir el criovial que contiene aproximadamente 1 mL de hiPSCs congeladas sosteniéndolo a través del tapón y deslizándolo por el agua superficial, con el fondo del vial sumergido en un baño de agua a 37 °C hasta la descongelación.
- Una vez descongelado, rocíe el criovial con etanol y pipetee 1 mL de hiPSCs. Dispensar lentamente en un tubo cónico vacío de 15 ml. Añadir 5 mL de medio hiPSC tibio gota a gota mientras se agita suavemente el tubo.
- Centrifugar el tubo a 300 x g durante 5 min a RT. Eliminar delicadamente el sobrenadante aspirando con una pipeta de vidrio conectada al vacío sin interrumpir el pellet, dejando algo de medio residual. Vuelva a suspender con cuidado el pellet en 6 mL de medio y luego agregue 2 mL por pocillo en 3 pocillos de la placa de 6 pocillos.
NOTA: Deje pequeños agregados de hiPSCs para un correcto crecimiento. - Doble la placa de 6 pocillos y aspire el gel de matriz extracelular de la placa previamente recubierta sin tocar la punta con el fondo del pocillo.
- Transfiera 2 mL del medio con hiPSC por pocillo. Agite suavemente la placa hacia adelante, hacia atrás y de lado a lado para distribuir uniformemente los agregados de hiPSC en la placa.
- Coloque la placa de 6 pocillos en una incubadora a 37 °C, 5% de CO2 y 95% de humedad. Cambiar el medio diariamente (2 mL por pocillo), controlando el crecimiento progresivo.
- Paso de las hiPSCs cuando se adquiere una confluencia de crecimiento del 80% (después de 4-5 días; ver Figura 1A). Las características de las hiPSCs sanas y proliferativas incluyen bordes distintivos y un empaquetamiento apretado de núcleos grandes en el centro de las agregaciones celulares en crecimiento.
- Calcule de antemano el volumen del medio hiPSC y caliéntelo a RT junto con la placa recubierta de 6 pocillos 1 h antes de su uso (2 mL por pocillo).
- Aprobación de hiPSC
- Una vez que las hiPSCs alcanzan el 80% de confluencia, lo que indica aproximadamente 1,2 x 106 células por pocillo, pasan a una nueva placa de 6 pocillos. Divida en una proporción de 1:3 (de 1 bien a 3), o ajuste la proporción (1:4; 1:6) de acuerdo con los requisitos del experimento.
- Antes de pasar, prepare la inclusión de gel de matriz extracelular requerida para el número apropiado de placas de 6 pocillos, como se describe en el paso 1.2.
- Retire el sobrenadante de cada pocillo y agregue 2 mL de PBS por pocillo. Aspire el PBS, seguido de la adición de 1 mL de medio de desprendimiento de hiPSC por pocillo durante 1 min. A continuación, retire 1 ml de medio de separación hiPSC.
- Coloque la placa de 6 pocillos en una incubadora a 37 °C durante 7 min. Agregue 1 mL de medio hiPSC por pocillo. Separe y recoja pipeteando 1 mL del medio hiPSC con células en el tubo de 15 mL.
- Centrifugar el tubo a 300 x g durante 5 min a RT. Para colocar las celdas en una placa de 6 pocillos, repita los pasos 1.3.5-1.3.7. Coloque la placa de 6 pocillos en una incubadora a 37 °C, 5% de CO2 y 95% de humedad. Vaya al paso 1.5. para congelar hiPSC si es necesario.
- Congelación hiPSC (opcional)
NOTA: El número de hiPSCs necesarias para la promoción a HO puede dar lugar a pozos sobrantes que se pueden almacenar a largo plazo. En caso de que sea necesario ampliar el paso para el almacenamiento criovial, las hiPSC pueden mantenerse durante períodos prolongados.- Descongele el volumen requerido de medio de criopreservación (1 mL por pocillo de celdas) en hielo a 4 °C. Etiquete los criotubos con el número de pasajes, la fecha y la línea celular. Separe las células con medio de separación hiPSC como en el paso 1.4. en un tubo cónico de 15 mL.
- Centrifugar a 300 x g durante 5 min en RT. Aspirar completamente el sobrenadante, dejando con cuidado el pellet de la célula sin tocar. Vuelva a suspender prudentemente el pellet en 1 mL de medio de criopreservación frío (por pocillo) dejando los agregados de hiPSC.
NOTA: Si los pozos están a baja densidad, menos del 50% de confluentes, se puede usar 1 mL de medio de criopreservación por cada 2 pocillos. - Transfiera 1 mL de medio de criopreservación con las hiPSC al tubo criogénico. Agite suavemente el tubo criogénico para homogeneizar el contenido de la célula.
NOTA: Si prepara más tubos para criopreservar, deje los tubos ya preparados en hielo. - Coloque los tubos en el recipiente de congelación de velocidad controlada a -80 °C durante la noche. Transfiera los tubos al tanque de nitrógeno líquido después de 24 h.
2. Diferenciación paso a paso de hiPSC a organoides hepáticos
NOTA: La reconstitución de los reactivos se realizó y siguió de acuerdo con las pautas del fabricante.
- Diferenciación 2D de hiPSC a DE (día 0-día 4 (D-0 a D-4); Figura 1B)
- Después de 3 pasadas, si las células están sanas y crecen bien y rápido, se procede a la diferenciación de la hiPSC. Cubra una placa de 6 pocillos como se describe en el paso 1.2. Para diferenciar hiPSC en DE, utilice el kit DE siguiendo las instrucciones del fabricante.
- Antes de comenzar la diferenciación, se deben cultivar hiPSCs en una proporción de paso de 2:1 (desde 6 pocillos hasta obtener 3 para comenzar la diferenciación) durante 24 h para lograr la concentración celular en el pocillo indicado en las instrucciones de DE.
- Realice la diferenciación según el protocolo del fabricante con las siguientes modificaciones.
- Aumentar la concentración de Y-27632 añadido a hiPSC de 10 μM a 50 μM (un día antes de iniciar la diferenciación).
- Aumente 1,5 mL por pocillo del reactivo de disociación y también el volumen de DMEM/F12 a la misma cantidad por pocillo que el reactivo de disociación. Agregue 1 mL de DMEM/F12 (de 1.5) a cada pocillo, y 0.5 mL adicionales acumulados en un tubo de 15 o 50 mL.
- Diferenciación de células DE en células PFG (D-4 a D-10; Figura 1C)
- Prepare el medio PFG (Advanced DMEM/F12 como medio basal, 1x suplemento de Glutamax, 1x suplemento de B27, 20 ng/mL de BMP4, 10 ng/mL de FGF2) para la diferenciación de las células DE días antes de la inducción en PFG y almacene a 4 °C.
NOTA: B27 contiene T3 como parte de su composición. En el caso de los estudios de hormona tiroidea (TH), a partir de aquí, la B27 debe ser reemplazada por la B2615 casera que no contiene TH. - Calentar el medio PFG (2 mL por pocillo) y el DMEM/F12 avanzado a 37 °C durante 15 min o RT durante 1 h. Inclínese sobre la placa y aspire el medio DE de los pocillos con una pipeta de vidrio conectada a un vacío (o manualmente con una pipeta P1000) sin rayar las células.
- Agregue 2 mL de DMEM/F12 avanzado tibio por pocillo y luego aspire. Agregue 2 mL de medio PFG tibio por pocillo en la placa de 6 pocillos. Cambie el medio diariamente durante los próximos 6 días.
- Prepare el medio PFG (Advanced DMEM/F12 como medio basal, 1x suplemento de Glutamax, 1x suplemento de B27, 20 ng/mL de BMP4, 10 ng/mL de FGF2) para la diferenciación de las células DE días antes de la inducción en PFG y almacene a 4 °C.
- Inducción de células PFG 2D a organoides hepáticos inmaduros (IHO) 3D; D-10 a D-18)
NOTA: Se requieren entre 30.000 y 35.000 células en 30 μL añadidos a cada pocillo de la placa ULA de 96 pocillos. La relación de paso es de 2:1, desde 2 pocillos (placa de 6 pocillos) con una monocapa de celdas PFG diferenciadas; proporcionará una placa de fijación ultrabaja (ULA) completa de 96 pocillos (Figura 1D).- Antes de iniciar los organoides 3D o en días anteriores, prepare previamente el medio IHO (Advanced DMEM/F12 como medio basal, 1x suplemento de N2, 1x B27, 50 nM A83-01, 30 μM de dexametasona, 5 μM CHIR99021, 500 nM de ácido valproico, 50 ng/mL de factor de crecimiento epidérmico humano (EGF), 20 ng/mL de factor de crecimiento de hepatocitos humanos (HGF), 40 ng/mL Jagged-1, 300 ng/mL N-6,20-O-dibutiriladenosina 30,50-cíclica 35 monofosfato sódico sal (dbCAMP), 10 μM Nicotinamida) y almacenarlo a 4 °C.
- Etiquete una placa de fijación ultrabaja (ULA) de 96 pocillos. Para separar las células PFG, utilice la enzima de disociación celular de acuerdo con las instrucciones del fabricante.
- Calentar la enzima de disociación, DMEM/F12 avanzado y PBS a 37 °C antes de usar. Aspire y deseche el medio PFG de los pocillos. Agregue 2 mL de PBS por pocillo, luego aspire.
- Añadir 1,5 mL de enzima de disociación celular por pocillo a 37 °C durante 7 min para separar las células del pocillo. Sin eliminar la enzima de disociación celular, agregue 1 mL de DMEM avanzado. Reúna todas las células y agréguelas en un tubo de 50 ml.
- Cuente el número de células por ml con un contador de células o un hemocitómetro. Centrifugar a 150 x g durante 8 min.
- Al pellet, agregue el volumen adecuado (3 mL de medio IHO para una placa ULA completa de 96 pocillos) y 1x gel de matriz extracelular para ajustarse al número final de células necesarias (30.000-35.000 células).
- Coloque la placa de 96 pocillos en una incubadora configurada a una temperatura de hasta 37 °C, 5% de CO2 y 95% de humedad. Después de 24 h (D-11), las células se reagruparán en forma circular; añadir 50 μL por pocillo del medio IHO.
- Al día siguiente (D-12), aumentar a 100 μL de medio IHO por pocillo. En D14, retire ~ 100-120 μL de cada pocillo, ya sea con la pipeta de vidrio conectada a un vacío o con una pipeta una por una. Tenga cuidado de no aspirar los organoides. Añadir 100 μL de medio IHO en D-14 y D-16.
NOTA: Después de D-16, debido a que no se coloca en movimiento, aparece un crecimiento excesivo que desaparece después de D18.
- Organoides hepatoblastos (HBOs, D-18 a D-26)
NOTA: En este paso, las OHI de la placa ULA de 96 pocillos se reubicarán en una placa ULA de 6 pocillos. Para 96 OHI de la etapa anterior, se colocaron 10 organoides por pocillo, lo que representa un total de placas de ULA de 1 y 1/2 6 pocillos para proceder a la maduración (Figura 1E).- Al igual que se hizo en los pasos anteriores de diferenciación, prepare el medio de diferenciación de HBO en los días anteriores.
- El cóctel de reactivos utilizados para diferenciarse en HBO se describe en el paso 2.3. Retire el ácido valproico e incorpore al cóctel los siguientes bioquímicos: BMP7, BMP4 y FGF7. La composición final es Advanced DMEM/F12 como medio basal, 1x suplemento de N2, 1x B27, 50 nM A83-01, 30 μM de dexametasona, 5 μM CHIR99021, 500 nM de ácido valproico, 50 ng/mL de factor de crecimiento epidérmico humano (EGF), 20 ng/mL de factor de crecimiento de hepatocitos humanos (HGF), 40 ng/mL Jagged-1, 300 ng/mL de N-6,20-O-dibutiriladenosina 30,50-cíclica 35 sal sódica monofosfato (dbCAMP), 10 μM de nicotinamida, 25 ng/mL de FGF7, 50 ng/mL de BMP4, 20 ng/mL de BMP7.
- Calentar previamente medio HBO (3 mL por pocillo) y Advanced DMEM/F12 (3 mL por pocillo) a 37 °C. Agregue 3 mL de DMEM/F12 avanzado tibio a cada pocillo.
- Distribuya 10 organoides IHO por pocillo desde la placa de 96 pocillos con una punta de diámetro de 200 mL de diámetro. Retire el DMEM/F12 avanzado inclinándose sobre la placa y succionándola con la pipeta de vidrio conectada al vacío (o manualmente con un P1000).
- Agregue 3 mL de medio HBO tibio por pocillo. Encienda y coloque las placas de ULA de 6 pocillos en un agitador multiplataforma a 65 rpm dentro de la incubadora configurada a 37 °C, 5% de CO2 y 95% de humedad. Después de 4 días (D-22) y 6 días (D-24), reemplace el medio HBO (3 mL por pocillo).
- Al igual que se hizo en los pasos anteriores de diferenciación, prepare el medio de diferenciación de HBO en los días anteriores.
- Maduración en organoides hepáticos (HO) a través de 2 fases diferentes (D-26 a D-46)
NOTA: Este es el último proceso de maduración que ocurre en dos períodos de diferenciación debido al contenido y al tipo de reactivos en el medio.- Prepare con antelación el primero del medio HO (HO1) y guárdelo a 4 °C. Elimine Jagged1 y disminuya la concentración de CHIR99021 en comparación con el medio HBO. La composición final es: DMEM/F12 avanzado como medio basal, 1x suplemento de N2, 1x B27, 500 nM A83-01, 30 μM de dexametasona, 2 μM CHIR99021, 50 ng/mL de factor de crecimiento epidérmico humano (EGF), 20 ng/mL de factor de crecimiento de hepatocitos humanos (HGF), 300 ng/mL de N-6,20-O-dibutiriladenosina 30,50-cíclico 35 sal sódica de monofosfato (dbCAMP), 10 μM de nicotinamida, 25 ng/mL FGF7, 20 ng/mL BMP4, 20 ng/mL BMP7.
- Calentar el medio DMEM/F12 y HO1 avanzado a 37 °C antes de su uso. En la misma placa ULA de 6 pocillos, aspire con cuidado el medio HBO anterior inclinándose sobre la placa y colocando la punta de la pipeta de vidrio conectada a un vacío contra la pared (o manualmente con una pipeta P1000).
- Añadir 3 mL de Advanced DMEM/F12 tibio por pocillo y aspirarlo. Agregue 3 mL de medio HO1 tibio por pocillo. Cambie el medio HO1 cada 3 días (D-29, D-32, D-35, D-38) junto con la recolección de la muestra.
- En D 38, modifique el cóctel de reactivos para el segundo período de HO (HO2) eliminando CHIR99021, BMP4, dbcAMP y FGF7 y sustituyéndolos por FGF19 y DAPT. La composición final del medio es Advanced DMEM/F12 como medio basal, 1x suplemento de N2, 1x B27, 500 nM A83-01, 30 μM de dexametasona, 50 ng/mL de factor de crecimiento epidérmico humano (EGF), 20 ng/mL de factor de crecimiento de hepatocitos humanos (HGF), 10 μM de nicotinamida, 20 ng/mL de BMP7, 25 ng/mL de FGF19, 5 μM de DAPT.
- Calentar el medio DMEM/F12 y HO2 avanzado a 37 °C antes de su uso. Continúe con la misma la placa ULA de 6 pocillos y aspire cuidadosamente el medio HO1 anterior. Agregue 3 mL de Advanced DMEM/F12 por pocillo y retírelo.
- Agregue 3 mL de medio HO2 tibio por pocillo. Cambiar el medio HO2 cada 4 días (D-42, D-46, D-50, ...) y tomar muestras los mismos días que se cambia el medio.
3. Disociación unicelular
NOTA: Este paso es crítico para la técnica de secuenciación de ARN de una sola célula. El número de organoides puede variar según el tamaño, y cuanto más antiguo es el día de la disociación, mayor es la cantidad de células en los organoides. En los primeros días, el número de organoides disociados aumentó y los tiempos de disociación se redujeron en cantidades iguales. Se realizó disociación con 10 organoides en D-14 y D-17, 8 organoides en D-23 y D-26, y 6 organoides en D-30 y D-45. Se detallan los procedimientos para un grupo de organoides (Figura 1F).
- Preparación de reactivos
- Preparar Advanced-DMEM con una concentración final de 7,5% de fracción V de albúmina bovina (BSA) y filtrar después de la homogeneización.
- Prepare 1 mL del medio enzimático de disociación con 1 mL de tripsina al 0,5% - EDTA (10x) como medio basal, 50 μM Y-27632, 40 U/μL de inhibidor de ARNasa y 1 U/μL de DNasa I.
- Prepare el medio de inactivación de tripsina con 2 mL de DMEM/F12 avanzado + 7,5% de BSA como medio basal, 50 μM Y-27632, 40 U/μL de inhibidor de ARNasa y 1 U/μL de DNasa I.
- Caliente ambos medios y PBS a 37 °C antes de comenzar.
- Disociación de los HHO
- Limpie el lugar de trabajo y las herramientas con el limpiador RNase. Recoger el número de organoides según el día de diferenciación en un tubo de polipropileno de 15 mL con la punta bien abierta.
- Lavar con PBS 2x-3x. Añadir 1 mL de medio enzimático de disociación en el tubo de 15 mL con organoides recolectados y mantener a 37 °C en un balancín a 30 rpm durante 5 min.
PRECAUCIÓN: Tenga cuidado de no dejar caer el tubo del balancín. - Después de 5 minutos, primero, revise la tapa en busca de organoides restantes, luego interrumpa mecánicamente los organoides con un P1000 girando hacia arriba y hacia abajo 10 veces por organoide (60 veces en total). Repita la misma interrupción con un P200. Revise la tapa del tubo en caso de que los organoides se peguen en él.
- Vuelva a colocar el tubo de 15 ml en el balancín de la incubadora durante otros 5 minutos. Repita el proceso del punto 4, comenzando girando hacia arriba y hacia abajo un P200 y continuando con una pipeta serológica de 1 mL conectada a una punta P10.
- Vuelva a colocar el tubo de 15 ml en el balancín de la incubadora durante los últimos 5 minutos. En caso de que no haya disociación, déjelo durante 5 minutos adicionales y repita la interrupción manual.
- Añadir 1 mL de medio de inactivación de tripsina y homogeneizarlo. Coloque un nuevo tubo de polipropileno de 15 mL con un filtro de células de 40 μm encima. Filtre los 2 mL (células con el medio enzimático de disociación y el medio de inactivación de tripsina) a través de un filtro de células de 40 μm en el tubo de 15 mL.
- Agregue otro 1 mL de medio de inactivación de tripsina para recuperar las células restantes del filtro de células de 40 μm.
- Tome 5 μL de medio unicelular mezclado con 5 μL de una solución de colorante para contar el número de células disociadas y proceder a su fijación. Cuente las células después de la centrifugación y la resuspensión con el primer reactivo del kit de fijación y realice la filtración celular con un filtro de células de 40 μm.
Resultados
Cada etapa de este protocolo de diferenciación escalonada de hiPSC a HHOs se definió mediante el uso de mediciones cuantitativas por qPCR e inmunofluorescencia de marcadores específicos de la etapa conocidos de la bibliografía (Figura 2). El paso a paso de ambas técnicas y los resultados obtenidos en relación con la correcta diferenciación en HO se mostraron en14. En la investigación previa, las hiPSCs se definieron a través de los niveles de ARNm de POU5F1 (también conocido como OCT4) y SOX2, dos factores de Yamanaka bien conocidos16, que disminuyeron con el tiempo (Figura 2A). Posteriormente, se midieron los niveles de ARNm de los marcadores DE11 como OTX2, CER1 y FOXA2, y los marcadores PFG11 HNF4A, CDX2 y TBX3, junto con la expresión localizada de OTX2, HNF4A y TBX3 por inmunofluorescencia (Figura 2A,B). Después de la promoción 3D, para seguir la progresión de la inmunofluorescencia de la albúmina y HNF4a (Figura 2C); el marcador proliferativo, MKI6717, y TBX3, importante en la regulación del hepatoblasto18 (Figura 2D) se realizó desde D-18 hasta D-46. En particular, la albúmina colocalizada con HNF4a (Figura 2C); mientras tanto, MKI67 apareció esporádicamente en D-46 (Figura 2D). Además, se identificaron células similares a hepatocitos y colangiocitos a través de los niveles de ARNm y la inmunofluorescencia de HNF4A19 y KRT718 en D-46 (Figura 2E).
El volumen de los organoides en desarrollo aumentó progresivamente de D-14 a D-38, como lo indica el aumento de ~ 2 veces en los niveles de ARNm para el marcador proliferativo MKI67 en D-22 en comparación con D-10. La ausencia de T4 en el medio condujo a un aumento en los niveles de ARNm de MKI67 en ~20% y ~75% en D-14 y D-18, respectivamente, en comparación con el día 10 (Figura 3A). Para demostrar la funcionalidad del organoide hepático, se midieron los niveles de albúmina, apolipoproteína B y A114 recogidos de los medios de los organoides hepáticos mediante ELISA. En D-42 y D-46, los niveles de ARNm de ALB se mantuvieron sustancialmente más altos en los T4-HO en comparación con los T3-HO o V-Ho en 3,0 y 2,5 veces, respectivamente (Figura 3B). Por otro lado, los niveles de APOB fueron ~10 veces y 3 veces más altos (Figura 3C), y los niveles de APOA1 fueron ~3 veces y ~2 veces más altos (Figura 3D) en D-42 y D-46, respectivamente.
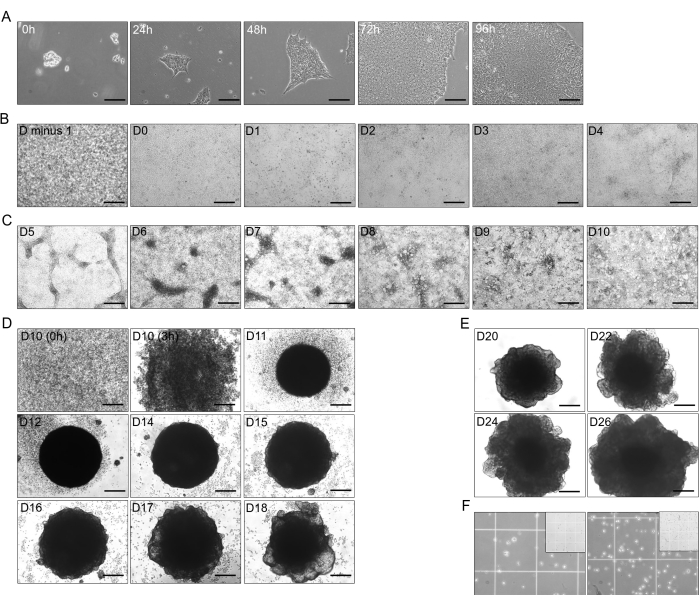
Figura 1: Etapas de diferenciación de hiPSC a organoides hepáticos. (A) Crecimiento transicional de hiPSC (línea CS03iCTR-n3) de 0 h a 96 h, alcanzando aproximadamente 70%-80% de confluencia en los pocillos de una placa. Barra de escala: 125 μm. (B) Progresión de la etapa inicial de la diferenciación de hiPSC en endodermo definitivo (DE), mostrando un 100% de confluencia el día anterior (D menos 1) después de 24 h, y diferenciación hasta D4 (D-0 a D-4). Barra de escala: 300 μm. (C) Diferenciación de DE (D-4) a intestino anterior posterior (PFG; D-10) con T4 añadido B26. Barra de escala: 300 μm. (D) Transformación de 2D-PFG en organoides hepáticos inmaduros (IHO) 3D con B26 añadido a T4 desde D-10 como células individuales hasta D-18, excluyendo D-13. Barra de escala: 300 μm. (E) Mantenimiento y crecimiento de organoides hepatoblastos (HBO) con B26 adicionado a T4 en D-20, D-22, D-24 y D-26. Barra de escala: 300 μm. (F) Disociación de HBO en D-26 (~2,5 x 105 celdas en 750 μL; izquierda) y HO1 en D-30 (~4 x 105 celdas en 750 μL; derecha) en celdas individuales con B26 T4 agregado. El recuadro ilustra el tamaño cuadrado de 1 mm de la cámara de Neuebauer, donde el cuadrado más pequeño mide 250 μm. Las imágenes se tomaron a HHO cuya concentración libre de T4 utilizada en los medios fue de ~15 pM. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Monitorización y caracterización de la diferenciación de los HHOs. (A) Expresión de niveles de ARNm de marcadores hiPSC (POU5F1, SOX2), endodermo definido (DE; OTX2, CER1, FOXA2) y el intestino anterior posterior (PFG; TBX3, HNF4A, CDX2). (iPSC, n=8; DE y PFG n=7; HNF4A en PFG, n=6). (B) Inmunofluorescencia en hiPSC, DE y PFG de OTX2 (arriba, rojo), HNF4A (medio, verde) y TBX3 (abajo, rojo). (C) "Inmunofluorescencia en D-18, D-26 y D-46 de albúmina (rojo) y HNF4A (verde). (D) Inmunofluorescencia en D-18, D-26 y D-46 de MKI67 (verde) y TBX3 (rojo). (E) Inmunofluorescencia en D-46 de albúmina (marcador de hepatocitos; rojo) y KRT7 (marcador de colangiocitarios; verde). Los núcleos se muestran con 4′,6-diamidino-2-fenilindol (DAPI). Esta cifra ha sido modificada de14. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Análisis de la maduración del HHO. (A) Niveles relativos de ARNm del marcador proliferativo MKI67 en ausencia de TH (negro) frente a T4 libre a ~15 pM (rojo) en el medio de D-10 a D-46 (n=4 excepto T4-HO en D-42, n=2; y en D-46, n=3). (B) Los niveles de albúmina se midieron en el medio de D-35 a D-50 en tres condiciones: ausencia de TH (negro), con T4 libre a ~15 pM (rojo) y T3 libre a ~10 pM (azul; n = 4). (C, D) Se midieron los niveles de apolipoproteína B (APOB) y A1 (APOA1) en el medio de D-35 a D-50 en tres condiciones: ausencia de TH (negro); y con T4 libre a ~15 pM (rojo). Datos de 10 organoides por pocillo (n=4). Para las comparaciones múltiples se utilizó la prueba t de Student de dos colas para comparar los días V-HO con los T4-HO, y para las comparaciones múltiples se utilizó el ANOVA de un factor y la prueba de Tukey. Los datos son la media de los duplicados, representados como diagramas de puntos de dispersión alineados y su media. *: p<0,05; **: p<0,01; : P<0,001; : P<0.0001. El eje x indica los días de la diferenciación. Esta cifra ha sido modificada de14. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Discusión
El protocolo actual ofrece varios detalles metodológicos sobre cómo manejar las hiPSC y los posteriores cultivos de organoides en 3D. Esto incluye los dos pasos críticos principales: (i) la separación de los cultivos 2D y luego su desarrollo en organoides hepáticos 3D después de 10 días, así como (ii) la delicada disociación de una estructura 3D en células individuales. Sobre la base de la información disponible, este es el primer informe de un modelo 3D de HHO para estudiar la acción de la hormona tiroidea, demostrando un pico de expresión de DIO2 en células similares a hepatoblastos14 como se identificó originalmente en ratones hígado P120.
Al igual que con muchas otras técnicas que utilizan andamios aplicados a las células, se utilizó gel de matriz extracelular para imitar la matriz extracelular21, facilitando así el ensamblaje en la estructura 3D característica de los organoides. La naturaleza sensible al calor de este reactivo subraya la importancia de su manipulación manteniéndolo congelado y, durante su manipulación, sumergido en hielo. En consecuencia, es posible utilizar un gel de matriz extracelular diferente22, aunque las hiPSCs no se adhirieron y proliferaron en una placa de ausencia de andamio en este protocolo, por lo que su manejo adecuado fue un aspecto crucial en el inicio del protocolo, junto con la generación de organoides 3D.
Después de completar la diferenciación de los HOs, una disociación viable de los organoides en células individuales representó otro obstáculo importante a superar, ya que la disrupción mecánica puede provocar la muerte celular, por lo que los datos de secuenciación de ARN de baja calidad23. Para garantizar resultados óptimos, el protocolo presente mostró que se podía lograr más del 70% de viabilidad de una sola célula, con la disociación de más de 105 células antes y después de la fijación para el posterior código de barras.
A diferencia de otros manuscritos que describen solo un tipo de célula en los organoides7, la diferenciación del HHO incluye al menos dos células derivadas de hepatoblastos: células similares a los hepatocitos y células similares a los colangiocitos. La incorporación de dos reactivos responsables de su formación, HFG24 y EGF25, y junto con dexametasona26 que promueve la maduración de los hepatocitos, y Jagged-118 que activa la señalización Notch que conduce hacia los colangiocitos. Esta red de señales entrelazadas en el desarrollo de HOs nos permite lograr la estructura 3D e imitar experimentos in vivo , además de superar el inconveniente de la disminución en la diferenciación de cultivos a largo plazo de hepatocitos primarios27. Es notable que, a pesar de la expresión de marcadores hepáticos típicos de adultos, todavía se puede detectar la presencia de marcadores fetales en fases avanzadas de los organoides28, como lo demuestra este protocolo. Esto, de hecho, refleja el desarrollo normal del hígado en los seres humanos, en los que los marcadores hepáticos fetales pueden detectarse normalmente hasta 1 año de vida29.
Un hecho poco frecuente observado durante el desarrollo de las hiPSCs en HHO (particularmente durante los períodos inmaduros de las HOs, como en los últimos días de la IHO y algunos HBO y HO1) fue la aparición de estructuras quísticas sobredesarrolladas, que finalmente se desvanecieron una vez que las placas se colocaron en el agitador. Esta progresión desproporcionada de las estructuras quísticas sugiere un núcleo necrótico para entonces, la necesidad de una mayor irrigación30 con cambios de medio más frecuentes o la adición de bajos volúmenes de gel de matriz extracelular para eliminar el crecimiento excesivo del quiste.
A diferencia de la publicación original, que se centró en un mayor número de organoides en el último período de diferenciación para el cribado de fármacos de alto rendimiento11, el método ahora descrito introdujo el uso de placas de ULA para promover la formación temprana de organoides 3D de gran tamaño y facilitar el manejo de los HHO. Estos ajustes demuestran la flexibilidad y la amplia gama de estudios que se pueden realizar a través de este sencillo protocolo.
Divulgaciones
Antonio C. Bianco es consultor de Abbvie, Acella, Aligos, Synthonics. Los otros autores no tienen divulgaciones relevantes.
Agradecimientos
Este trabajo contó con el apoyo del Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales (NIDDK -DK58538, DK65066, DK77148; ACB).
Materiales
| Name | Company | Catalog Number | Comments |
| 10 µL Universal Pipette Tips Filtered, Low rentention, Pre-sterile | VWR | 613-6462 | All procedures |
| 1000 µL Universal Pipette Tips Filtered, Low rentention, Pre-sterile | VWR | 613-6470 | All procedures |
| 15 mL Polypropilene Conical Tube | Falcon (Corning) | 352097 | Dissociation Hepatic Organoids |
| 200 µL Universal Pipette Tips Filtered, Low rentention, Pre-sterile | VWR | 613-6465 | All procedures |
| 3,3',5-Triiodo-L-thyronine | Sigma | T2877-100 | Hepatic Organoid differentiation |
| 40 μm Cell Strainer | Corning | 431750 | Dissociation Hepatic Organoids |
| 50 mL tube | Falcon (Corning) | 352070 | All procedures |
| 6 well-plate Nunc Cell-Culture Treated Multidishes | Thermo fisher scientific | 140675 | hiPSC maintenance |
| A83-01 | R&D Systems | 2939/10 | Hepatic Organoid differentiation |
| Advanced DMEM/F12 | Gibco | 12634010 | Hepatic Organoid differentiation |
| ART Wide Bore Filtered Pipette Tips | ART | 2069GPK | All procedures |
| B27 supplement | Gibco | 17504044 | Hepatic Organoid differentiation |
| BMP7 | R&D Systems | 354-BP-010/CF | Hepatic Organoid differentiation |
| Bovine Albumin Fraction V (7.5% solution) | Gibco | 15260037 | Dissociation Hepatic Organoids |
| BSA, Fraction V, Fatty Acid Free for Tissue Culture | GoldBio | A-421-100 | Dissociation Hepatic Organoids |
| CHIR99021 | R&D Systems | 4423/10 | Hepatic Organoid differentiation |
| Corning 96-well Clear Flat Bottom Ultra-Low Attachment | Corning | 3474 | Hepatic Organoid differentiation |
| Costar 6-well Clear Flat Bottom Ultra-Low Attachment | Corning | 3471 | Hepatic Organoid differentiation |
| CS03iCTR-n3 human induced Pluripotent Stem Cell line | Cedar-sinai | hiPSC maintenance | |
| DAPT | R&D Systems | 2634/10 | Hepatic Organoid differentiation |
| dbCAMP | Millipore Sigma | D0627-100MG | Hepatic Organoid differentiation |
| Dexamethasone | R&D Systems | 1126/100 | Hepatic Organoid differentiation |
| DMEM/F12 | Gibco | 11320033 | hiPSC maintenance |
| DNAse I, RNase-free, HC | Thermo Fisher scientific | EN0523 | Dissociation Hepatic Organoids |
| Falcon 10 mL Serological Pipet, Polystyrene, 0.1 Increments, Individually Packed, Sterile | Corning | 357551 | All procedures |
| Falcon 5 mL Serological Pipet, Polystyrene, 0.1 Increments, Individually Packed, Sterile | Corning | 357543 | All procedures |
| Falcon 50 mL Serological pipet, Polystyrene, 1.0 Increments, Individually Packed, Sterile | Corning | 357550 | All procedures |
| Gentle Cell Dissociation Reagent (GCDR) | Stemcell Technologies | 100-0485 | Hepatic Organoid differentiation |
| Glutamax supplement | Gibco | 35050061 | Hepatic Organoid differentiation |
| L-Thyroxine | Sigma | T1775-1G | Hepatic Organoid differentiation |
| Matrigel hESC-Qualified Matrix, LDEV-free, 5 mL | Corning | 354277 | Extracellular matrix gel |
| mFreSR | Stemcell Technologies | 5855 | hiPSC cryopreservation medium |
| mTeSR 5x Supplement | Stemcell Technologies | 100-0276 | hiPSC medium |
| mTeSR Plus | Stemcell Technologies | 100-0276 | hiPSC medium |
| Multi Platform Shaker | Fisherbrand (Thermo Fisher technologies) | 88861021 | Hepatic Organoid differentiation |
| N2 supplement | Gibco | 17502048 | Hepatic Organoid differentiation |
| Nicotinamide | R&D Systems | 4106/50 | Hepatic Organoid differentiation |
| PBS, pH 7.4 | Gibco | 10010023 | hiPSC maintenance |
| Recombinant human BMP4 | R&D Systems | 314-BP-010/CF | Hepatic Organoid differentiation |
| Recombinant human EGF | R&D Systems | 236-EG-200 | Hepatic Organoid differentiation |
| Recombinant human FGF basic/FGF2/bFGF | R&D Systems | 233-FB-010/CF | Hepatic Organoid differentiation |
| Recombinant human FGF19 | R&D Systems | 959-FG-025/CF | Hepatic Organoid differentiation |
| Recombinant human HGF | R&D Systems | 294-HG-005/CF | Hepatic Organoid differentiation |
| Recombinant Human Jagged-1 Fc Chimera | R&D Systems | 1277-JG-050 | Hepatic Organoid differentiation |
| Recombinant human KGF/FGF7 | R&D Systems | 251-KG-010/CF | Hepatic Organoid differentiation |
| ReLeSR | Stemcell Technologies | 100-0483 | hiPSC detaching medium |
| RNAse Inhibitor Ambion, cloned, 40 U/μL | Invitrogen | AM2682 | Dissociation Hepatic Organoids |
| RNase Zap | Invitrogen | AM9780 | Dissociation Hepatic Organoids |
| Sorvall Legend XT/XF Centrifuge Series | Thermo Fisher Scientific | 75004539 | All procedures |
| STEMdiff Definitive Endoderm Kit | Stemcell Technologies | 5110 | Hepatic Organoid differentiation |
| Trypan Blue solution (0.4%) | Gibco | 15250061 | Dye solution |
| TrypLE Express Enzyme | Gibco | 12604013 | Cell Dissociation enzyme |
| Trypsin 0.5% - EDTA (10X) | Gibco | 15400054 | Dissociation Hepatic Organoids |
| Valproic acid, sodium salt | R&D Systems | 2815/100 | Hepatic Organoid differentiation |
| Vari-Mix Platform Rocker | Thermo Fisher scientific | M79735Q | Dissociation Hepatic Organoids |
| Y-27632 dihydrochloride | R&D Systems | 1254 | Hepatic Organoid differentiation |
Referencias
- Peiseler, M., et al. Immune mechanisms linking metabolic injury to inflammation and fibrosis in fatty liver disease - novel insights into cellular communication circuits. J Hepatol. 77 (4), 1136-1160 (2022).
- Gordillo, M., Evans, T., Gouon-Evans, V. Orchestrating liver development. Development. 142 (12), 2094-2108 (2015).
- Lemaigre, F. P. Mechanisms of liver development: concepts for understanding liver disorders and design of novel therapies. Gastroenterology. 137 (1), 62-79 (2009).
- He, C., et al. Liver organoids, novel and promising modalities for exploring and repairing liver injury. Stem Cell Rev Rep. 19 (2), 345-357 (2023).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Takebe, T., et al. Vascularized and functional human liver from an iPSC-derived organ bud transplant. Nature. 499 (7459), 481-484 (2013).
- Si-Tayeb, K., et al. Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells. Hepatology. 51 (1), 297-305 (2010).
- Wu, F., et al. Generation of hepatobiliary organoids from human induced pluripotent stem cells. J Hepatol. 70 (6), 1145-1158 (2019).
- Shinozawa, T., et al. High-fidelity drug-induced liver injury screen using human pluripotent stem cell-derived organoids. Gastroenterology. 160 (3), 831-846.e10 (2021).
- Ouchi, R., et al. Modeling steatohepatitis in humans with pluripotent stem cell-derived organoids. Cell Metab. 30 (2), 374-384.e6 (2019).
- Ramli, M. N. B., et al. Human pluripotent stem cell-derived organoids as models of liver disease. Gastroenterology. 159 (4), 1471-1486.e12 (2020).
- Shen, M. M. Nodal signaling: developmental roles and regulation. Development. 134 (6), 1023-1034 (2007).
- Ang, L. T., et al. A roadmap for human liver differentiation from pluripotent stem cells. Cell Rep. 22 (8), 2190-2205 (2018).
- Hidalgo-Álvarez, J., Salas-Lucia, F., Vera Cruz, D., Fonseca, T. L., Bianco, A. C. Localized T3 production modifies the transcriptome and promotes the hepatocyte-like lineage in iPSC-derived hepatic organoids. JCI Insight. 8 (23), e173780 (2023).
- . B27 Supplement Available from: https://www.weizmann.ac.il/molgen/hanna/sites/molgen.hanna/files/users/user52/HANNA-LAB-B22-B27-PROTOCOL-V3.pdf (2016)
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Zhu, X., Sun, J. CircHIPK3 regulates melanoma cell behaviors by binding with miR-215-5p to upregulate YY1. Mol Cell Probes. 53, 101644 (2020).
- Guan, Y., et al. Human hepatic organoids for the analysis of human genetic diseases. JCI Insight. 2 (17), e94954 (2017).
- Walesky, C., Apte, U. Role of hepatocyte nuclear factor 4α (HNF4α) in cell proliferation and cancer. Gene Expr. 16 (3), 101-108 (2015).
- Fonseca, T. L., et al. Hepatic inactivation of the type 2 deiodinase confers resistance to alcoholic liver steatosis. Alcohol Clin Exp Res. 43 (7), 1376-1383 (2019).
- Kleinman, H. K., Martin, G. R. Matrigel: basement membrane matrix with biological activity. Semin Cancer Biol. 15 (5), 378-386 (2005).
- Kozlowski, M. T., Crook, C. J., Ku, H. T. Towards organoid culture without Matrigel. Commun Biol. 4 (1), 1387 (2021).
- Arceneaux, D., et al. A contamination focused approach for optimizing the single-cell RNA-seq experiment. iScience. 26 (7), 107242 (2023).
- Matsumoto, K., Nakamura, T. Hepatocyte growth factor: molecular structure and implications for a central role in liver regeneration. J Gastroenterol Hepatol. 6 (5), 509-519 (1991).
- Kimura, M., Moteki, H., Ogihara, M. Role of hepatocyte growth regulators in liver regeneration. Cells. 12 (2), 208 (2023).
- Michalopoulos, G. K., Bowen, W. C., Mulè, K., Luo, J. HGF-, EGF-, and dexamethasone-induced gene expression patterns during formation of tissue in hepatic organoid cultures. Gene Expr. 11 (2), 55-75 (2003).
- Kaur, I., et al. Primary hepatocyte isolation and cultures: Technical aspects, challenges and advancements. Bioengineering (Basel). 10 (2), 131 (2023).
- Baxter, M., et al. Phenotypic and functional analyses show stem cell-derived hepatocyte-like cells better mimic fetal rather than adult hepatocytes. J Hepatol. 62 (3), 581-589 (2015).
- Blohm, M. E., Vesterling-Hörner, D., Calaminus, G., Göbel, U. Alpha 1-fetoprotein (AFP) reference values in infants up to 2 years of age. Pediatr Hematol Oncol. 15 (2), 135-142 (1998).
- Liu, Q., Zeng, A., Liu, Z., Wu, C., Song, L. Liver organoids: From fabrication to application in liver diseases. Front Physiol. 13, 956244 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados