Method Article
用于生成 iPSC 衍生的 3D 人肝类器官的综合方案
摘要
人类 iPSC 衍生的 3D 肝脏类器官构成了了解甲状腺激素对肝脏发育作用的潜在工具。
摘要
在培养物中获得稳定的肝细胞对肝脏研究构成了重大挑战。考虑到这一点,描述了一种利用人诱导多能干细胞 (hiPSC) 生成人肝类器官 (HHO) 的 3D 培养物的优化方法。HHO 的利用为了解肝脏发育、解开肝脏疾病、进行药物开发的高通量研究以及探索肝移植的潜力提供了一种有价值的方法。在前一项研究中,通过免疫荧光和定量 RT-PCR 技术监测进展,确定不同发育阶段存在各种细胞群,例如肝母细胞和两种类型的肝母细胞衍生细胞:胆管细胞或肝细胞样细胞。本报告提出了一个简单的 3D 方案,从 hiPSC 开始,以获得反映人类胚胎发育阶段的 HHO。该方案跨越 46-50 天,包括几个步骤:(i) 精心管理 hiPSC 培养以生成 HHO,(ii) 在 2D 中开始细胞分化并随后过渡到 3D,以及 (iii) 优化的解离策略,将 HHO 分解成单细胞以进行单细胞 RNA 测序。作为这种方法广泛应用的一个例子,本方案以前被用于揭示甲状腺激素信号传导在肝细胞发育中的作用。
引言
肝脏执行多种代谢功能,例如调节葡萄糖和酮体等易用能量底物的可用性,以及解毒外源性化合物。近年来,肝病的患病率显著增加,这主要归因于非酒精性脂肪性肝炎 (NASH),如果不治疗,可能会发展为肝硬化或癌症1。因此,必须了解肝脏及其相关疾病的代谢功能,以促进有效治疗方法的开发 2,3。
三维 (3D) 培养物的出现导致了类器官模型的创建,代表了解决器官发育的功能和复杂性的开创性和创新方法4。类器官被定义为分化细胞的 3D 自组织聚集体,可模拟相应器官的功能和细胞结构5。
在过去的几十年里,无数的人肝类器官 (HHO) 方案引起了广泛的兴趣,从利用不同的人 iPSC 衍生细胞6 或单独的肝细胞样细胞7 到掺入生长因子或抑制剂的各种复杂微环境,以及在单层7 或 3D 中分化祖细胞8.这些方法适用于多种潜在目标,从高通量药物筛选9 到进一步了解肝病的潜在机制10。
在这里,根据提到的化学线索11 执行 HHO 分化的分步方案,并采用方法学适应的变化。该方案从人诱导多能干细胞 (hiPSC) 的适当处理和培养开始,详细介绍了细胞外基质凝胶作、细胞传代和分化为 HHO 的技术。该过程首先刺激 hiPSC 分化为最终内胚层 (DE)12 ,随后模拟 FGF 和 BMP 的 体内 效应,以促进后前肠 (PFG) 单层细胞的发育13。3D 结构是在第 10 天实现的,当时 PFG 细胞分化为未成熟的肝期,该期将成为肝母细胞,即胆管细胞和肝细胞的胎儿前体细胞2。最后,将 3D 结构解离成单细胞进行 RNA 测序研究。作为该方案适用性的一个例子,证明了该 HHO 模型如何有助于研究甲状腺激素作用和 2 型脱碘酶 (D2) 对肝细胞和胆管细胞发育的影响14。
研究方案
1. hiPSC 的管理
注:hiPSC(CS03iCTR-n3 细胞系)是商业购买的。细胞外基质凝胶涂层和 hiPSC 培养基的适当管理是将 hiPSC 连接到板并补料的关键。在这里,描述了一个 6 孔板所需的体积。来自 6 孔板的剩余 hiPSC 不会分化为类器官,可以储存在液氮中长期储存。
- 分配细胞外基质凝胶和 hiPSC 培养基
- 将细胞外基质凝胶瓶置于 4 °C 的加冰容器中过夜,以适当解冻。
注:分装前,请检查分析证书以验证稀释因子的体积。这表示细胞外基质凝胶的蛋白质浓度;因此,它因批次而异。 - 使用预冷和标记的试管,根据稀释因子(4x、2x 和 1x)将细胞外基质凝胶分配到合适的等分试样中。将 4 倍稀释因子的细胞外基质凝胶添加到 25 mL 冷 DMEM/F12 中,以包被四个 6 孔板。立即用实验室密封膜密封盖子,并在 -80 °C 下冷冻。避免长时间暴露在空气中和在等分试样中产生气泡。
- 在 4 °C 下解冻 100 mL 的 hiPSC 补充剂培养基过夜。将其添加到 400 mL 的 hiPSC 基础培养基中。使用 50 mL 血清移液管匀浆后,将 hiPSC 培养基分装到 40 mL 试管中,并在 -20 °C 下冷冻直至使用。
- 将细胞外基质凝胶瓶置于 4 °C 的加冰容器中过夜,以适当解冻。
- 用于 hiPSC 培养的板包被
- 对 6 孔板进行计数和标记。在附近放置一个细胞外基质凝胶等分试样,浸入干冰中。
- 对于包被一个 6 孔板,将一个细胞外基质凝胶等分试样 (1x) 稀释到 6.25 mL 冷 DMEM/F12 中(2x 稀释到 12.5 mL 中,4x 稀释到 25 mL DMEM/F12 中)。
- 将少量 DMEM/F12 (~500 μL) 移液到细胞外基质凝胶管中。上下旋转以用冷 DMEM/F12 解冻和匀浆细胞外基质凝胶,防止产生气泡,然后使用血清移液管将其返回到含 DMEM/F12 的冷管的其余部分以完全混合。
- 将 DMEM/F12 中的 1 mL 细胞外基质凝胶包埋到一个孔中,用于包被 6 孔板(整个板 6 mL)。通过移动板而不摇晃板,将 1 mL 均匀分布在表面上,直到它完全覆盖。
- 使用前在室温 (RT) 下静置 1 小时。如果 6 孔板未完全使用,请用实验室密封膜密封并存放在 4 °C 的冰箱中。
注意:涂层板可以在 4 °C 的冰箱中储存 1 周。
- hiPSC 的解冻和培养
- 提前计算 hiPSC 培养基的体积,并在使用 1 小时前 6 孔涂层板一起在 RT 下加热(每孔 2 mL)。
注:如果是冷等分试样或冷冻等分试样,请在使用前 15 分钟将其浸入 37 °C 培养箱或水浴中。 - 将液体 N2 中的 1 mL hiPSC 从冷冻管中分液到 6 孔板的 3 个孔中(比例为 1:3)。对于整个 6 孔板,使用 2 个冻存管。在这里,该方案描述了来自一个冷冻管的 hiPSC 的解冻和培养。对 2 个冻存管重复该过程。
- 将含有约 1 mL 冷冻 hiPSC 的冷冻管穿过盖子并将其滑过表面水,将小瓶底部浸入 37 °C 的水浴中直至解冻。
- 解冻后,用乙醇喷洒冷冻管并移液 1 mL hiPSC。在 15 mL 空锥形管中缓慢分液。加入 5 mL 温热的 hiPSC 培养基,逐滴加入,同时轻轻摇动试管。
- 在 RT 下以 300 x g 离心管 5 分钟。用连接到真空的玻璃移液器吸出,小心地去除上清液,而不会破坏沉淀,留下一些残留培养基。小心地将沉淀重悬于 6 mL 培养基中,然后在 6 孔板的 3 个孔中每孔添加 2 mL。
注意:留下小的 hiPSC 聚集体以正确生长。 - 将 6 孔板弯曲,从先前包被的板中吸出细胞外基质凝胶,而不将尖端接触孔底部。
- 每孔转移 2 mL 含 hiPSC 的培养基。轻轻向前、向后和左右摇动板,以将 hiPSC 聚集体均匀分布在板上。
- 将 6 孔板放入 37 °C、5% CO2 和 95% 湿度的培养箱中。每天更换培养基(每孔 2 mL),检查进展情况。
- 当获得 80% 生长汇合时(4-5 天后;参见 图 1A),传代 hiPSC。健康和增殖性 hiPSC 的特征包括明显的边界和在生长的细胞聚集体中心大细胞核的紧密包装。
- 提前计算 hiPSC 培养基的体积,并在使用 1 小时前 6 孔涂层板一起在 RT 下加热(每孔 2 mL)。
- hiPSC 的传代
- 一旦 hiPSC 达到 80% 汇合,表明每孔大约 1.2 x 106 个细胞,传代到新的 6 孔板中。以 1:3 的比例分液(从 1 孔到 3 孔),或根据实验要求调整比例(1:4;1:6)。
- 传代前,如步骤 1.2 中所述,为适当数量的 6 孔板准备所需的细胞外基质凝胶包埋。
- 从每个孔中取出上清液,每孔加入 2 mL PBS。吸出 PBS,然后每孔加入 1 mL 的 hiPSC 分离培养基,持续 1 分钟。然后去除 1 mL 的 hiPSC 分离培养基。
- 将 6 孔板置于 37 °C 的培养箱中 7 分钟。每孔加入 1 mL hiPSC 培养基。将 1 mL 含细胞的 hiPSC 培养基移液至 15 mL 试管中,分离并收集。
- 在 RT 下以 300 x g 离心管 5 分钟。要将细胞接种到 6 孔板中,请重复步骤 1.3.5-1.3.7。将 6 孔板放入 37 °C、5% CO2 和 95% 湿度的培养箱中。请转至步骤 1.5。如果需要,冷冻 hiPSC。
- 冷冻 hiPSC(可选)
注:提升为 HO 所需的 hiPSC 数量可能会导致可以长期储存的剩余孔。如果需要扩大通道以进行冷冻管储存,则可以延长 hiPSC 的维持时间。- 将所需体积的冻存培养基(每孔细胞 1 mL)在 4 °C 下解冻到冰中。用传代次数、日期和细胞系标记冻存管。如步骤 1.4 所示,用 hiPSC 分离培养基分离细胞。在 15 mL 锥形管中。
- 在 RT 下以 300 x g 离心 5 分钟。完全吸出上清液,小心地保持细胞沉淀不受干扰。小心翼翼地将沉淀重悬于 1 mL 冷冻存培养基(每孔)中,留下 hiPSC 聚集体。
注:如果孔密度低,汇合度低于 50%,则每 2 个孔可使用 1 mL 冻存培养基。 - 将 1 mL 含 hiPSC 的冻存培养基转移至冻存管中。轻轻搅拌冻存管以使细胞内容物均质化。
注:如果准备更多试管进行冻存,请将已准备好的试管置于冰中。 - 将试管置于 -80 °C 的受控速率冷冻容器中过夜。24 小时后将试管转移到液氮罐中。
2. 从 hiPSC 分化为肝脏类器官
注:根据制造商的指南进行并遵循试剂的重构。
- 从 hiPSC 到 DE 的 2D 分化(第 0 天-第 4 天(D-0 到 D-4); 图 1B)
- 传代 3 次后,如果细胞健康且生长良好且快速,则进行 hiPSC 的分化。如步骤 1.2 中所述涂覆 6 孔板。要将 hiPSC 区分为 DE,请按照制造商的说明使用 DE 试剂盒。
- 在开始分化之前,以 2:1 的传代比培养 hiPSC(从 6 个孔获得 3 个开始分化)24 小时,以达到 DE 说明中指示的孔中的细胞浓度。
- 根据制造商的方案进行区分,并进行以下修改。
- 将添加到 hiPSC 中的 Y-27632 的浓度从 10 μM 提高到 50 μM(开始分化前一天)。
- 每孔增加 1.5 mL 解离试剂,并将 DMEM/F12 的体积增加到与解离试剂相同的每孔量。向每个孔中加入 1 mL DMEM/F12(共 1.5 mL),并将额外的 0.5 mL 积累到 15 mL 或 50 mL 试管中。
- DE 细胞分化为 PFG 细胞(D-4 至 D-10; 图 1C)
- 准备PFG培养基(高级DMEM / F12作为基础培养基,1x Glutamax补充剂,1x B27补充剂,20 ng / mL BMP4,10 ng / mL FGF 2 ),用于在诱导成PFG前几天分化DE细胞,并将其储存在4°C。
注意:B27 的成分中包含 T3。在甲状腺激素 (TH) 研究的情况下,从这里开始,B27 应该用不含 TH 的自制 B2615 代替。 - 将 PFG 培养基(每孔 2 mL)和高级 DMEM/F12 在 37 °C 下加热 15 分钟或室温 1 小时。弯腰在板上,用连接到真空的玻璃移液器(或使用 P1000 移液器手动)从孔中吸出 DE 培养基,而不会刮伤细胞。
- 每孔加入 2 mL 温热的高级 DMEM/F12,然后吸出。在 6 孔板中每孔加入 2 mL 温热的 PFG 培养基。在接下来的 6 天内每天更换培养基。
- 准备PFG培养基(高级DMEM / F12作为基础培养基,1x Glutamax补充剂,1x B27补充剂,20 ng / mL BMP4,10 ng / mL FGF 2 ),用于在诱导成PFG前几天分化DE细胞,并将其储存在4°C。
- 从 2D PFG 细胞诱导到 3D 未成熟肝类器官 (IHO;D-10 至 D-18)
注:向 96 孔 ULA 板的每个孔中添加 30 μL 中需要近 30,000-35,000 个细胞。传代比为 2:1,来自 2 个孔(6 孔板),具有单层分化的 PFG 细胞;它将提供完整的 96 孔超低附着 (ULA) 板(图 1D)。- 在开始 3D 类器官之前或早期几天,预先准备 IHO 培养基(高级 DMEM/F12 作为基础培养基,1x N2 补充剂,1x B27,50 nM A83-01,30 μM 地塞米松,5 μM CHIR99021,500 nM 丙戊酸,50 ng/mL 人表皮生长因子 (EGF),20 ng/mL 人肝细胞生长因子 (HGF),40 ng/mL 锯齿-1, 300 ng/mL N-6,20-O-二丁酰腺苷 30,50-环 35 单磷酸钠盐 (dbCAMP),10 μM 烟酰胺)并将其储存在 4 °C。
- 标记 96 孔超低附着 (ULA) 板。为了分离 PFG 细胞,请根据制造商的说明使用细胞解离酶。
- 使用前将解离酶、高级 DMEM/F12 和 PBS 在 37 °C 下加热。吸出并丢弃孔的 PFG 培养基。每孔加入 2 mL PBS,然后吸出。
- 在 37 °C 下每孔加入 1.5 mL 细胞解离酶 7 分钟以将细胞从孔中分离。在不去除细胞解离酶的情况下,加入 1 mL 高级 DMEM。收集所有细胞并将它们添加到 50 mL 试管中。
- 使用细胞计数仪或血细胞计数器计数每 mL 的细胞数。以 150 x g 离心 8 分钟。
- 向沉淀中加入适当体积(用于整个 96 孔 ULA 板的 3 mL IHO 培养基)和 1x 细胞外基质凝胶,以调整至所需的最终细胞数量(30,000-35,000 个细胞)。
- 将 96 孔板放入温度高达 37 °C、5% CO2 和 95% 湿度的培养箱中。24 小时 (D-11) 后,细胞将重聚成圆形;每孔添加 50 μL 的 IHO 培养基。
- 第二天 (D-12),每孔增加至 100 μL IHO 培养基。在 D14 时,用连接到真空的玻璃移液器或用移液器逐个从每个孔中取出 ~100-120 μL。注意不要吸出类器官。在 D-14 和 D-16 处加入 100 μL IHO 培养基。
注意:在 D-16 之后,由于没有被置于运动状态,过度生长似乎在 D18 后消失。
- 肝母细胞类器官(HBO,D-18 至 D-26)
注意:在此步骤中,来自 96 孔 ULA 板的 IHO 将被重新定位到 6 孔 ULA 板中。对于前一阶段的 96 个 IHO,每孔放置 10 个类器官,代表总共 1 和 1/2 个 6 孔 ULA 板进行成熟(图 1E)。- 与前面的分化步骤一样,在前几天准备 HBOs 分化培养基。
- 用于分化为 HBO 的试剂混合物在步骤 2.3 中描述。去除丙戊酸并将以下生化物质加入混合物中:BMP7、BMP4 和 FGF7。最终组成是高级 DMEM/F12 作为基础培养基、1x N2 补充剂、1x B27、50 nM A83-01、30 μM 地塞米松、5 μM CHIR99021、500 nM 丙戊酸、50 ng/mL 人表皮生长因子 (EGF)、20 ng/mL 人肝细胞生长因子 (HGF)、40 ng/mL 锯齿状-1、300 ng/mL N-6,20-O-二丁酰腺苷 30,50-环 35 单磷酸钠盐 (dbCAMP), 10 μM 烟酰胺、25 ng/mL FGF7、50 ng/mL BMP4、20 ng/mL BMP7。
- 在 37 °C 下加热先前的 HBO 培养基(每孔 3 mL)和高级 DMEM/F12(每孔 3 mL)。向每个孔中加入 3 mL 温热的高级 DMEM/F12。
- 使用 200 mL 宽口径尖端从 96 孔板中每孔分布 10 个 IHO 类器官。弯腰在板上并用连接到真空的玻璃移液器吸取它(或使用 P1000 手动吸取),以去除高级 DMEM/F12。
- 每孔加入 3 mL 温热的 HBO 培养基。打开并将 6 孔 ULA 板以 65 rpm 的转速放在培养箱内的多平台振荡器上,培养箱设置为 37 °C、5% CO2 和 95% 湿度。4 天 (D-22) 和 6 天 (D-24) 后,更换 HBO 培养基(每孔 3 mL)。
- 与前面的分化步骤一样,在前几天准备 HBOs 分化培养基。
- 通过 2 个不同的阶段(D-26 至 D-46)成熟为肝脏类器官 (HO)
注:这是最后的成熟过程,由于培养基中试剂的含量和类型,分两个分化期进行。- 提前准备第一种 HO (HO1) 培养基并将其储存在 4 °C。与 HBO 培养基相比,去除 Jagged1 并降低 CHIR99021 的浓度。最终组成为:高级 DMEM/F12 作为基础培养基,1x N2 补充剂,1x B27,500 nM A83-01,30 μM 地塞米松,2 μM CHIR99021,50 ng/mL 人表皮生长因子 (EGF),20 ng/mL 人肝细胞生长因子 (HGF),300 ng/mL N-6,20-O-二丁酰腺苷 30,50-环 35 单磷酸钠盐 (dbCAMP),10 μM 烟酰胺, 25 ng/mL FGF7、20 ng/mL BMP4、20 ng/mL BMP7。
- 使用前将 Advanced DMEM/F12 和 HO1 培养基在 37 °C 下加热。在同一个 6 孔 ULA 板中,弯腰将连接到真空的玻璃移液器的尖端靠在墙上(或使用 P1000 移液器手动)小心吸出之前的 HBO 培养基。
- 每孔加入 3 mL 温热的 Advanced DMEM/F12 并吸出。每孔加入 3 mL 温热的 HO1 培养基。每 3 天更换一次 HO1 培养基(D-29、D-32、D-35、D-38)以及样品采集。
- 在 D 38,通过去除 CHIR99021、BMP4、dbcAMP 和 FGF7 并用 FGF19 和 DAPT 取代它们来修饰 HO 第二阶段 (HO2) 的试剂混合物。最终培养基成分为高级 DMEM/F12 作为基础培养基、1x N2 补充剂、1x B27、500 nM A83-01、30 μM 地塞米松、50 ng/mL 人表皮生长因子 (EGF)、20 ng/mL 人肝细胞生长因子 (HGF)、10 μM 烟酰胺、20 ng/mL BMP7、25 ng/mL FGF19、5 μM DAPT。
- 使用前将 Advanced DMEM/F12 和 HO2 培养基在 37 °C 下加热。继续使用相同的 6 孔 ULA 板,并小心吸出之前的 HO1 培养基。每孔加入 3 mL Advanced DMEM/F12 并将其去除。
- 每孔加入 3 mL 温热的 HO2 培养基。每 4 天更换一次 HO2 培养基(D-42、D-46、D-50 等),并在更换培养基的同一天取样。
3. 单细胞解离
注:此步骤对于单细胞 RNA 测序技术至关重要。类器官的数量可能因大小而异,解离日期越长,类器官中的细胞数量就越多。在早期,解离的类器官的数量增加,解离时间随着数量的增加而减少。在 D-14 和 D-17 处使用 10 个类器官,在 D-23 和 D-26 处使用 8 个类器官,在 D-30 和 D-45 处使用 6 个类器官进行解离。详细介绍了一组类器官的程序(图 1F)。
- 试剂的制备
- 制备终浓度为 7.5% 牛白蛋白组分 V (BSA) 的 Advanced-DMEM,并在均质后过滤。
- 制备 1 mL 解离酶培养基,含 1 mL 胰蛋白酶 0.5% - EDTA (10x) 作为基础培养基、50 μM Y-27632、40 U/μL RNase 抑制剂和 1 U/μL DNase I。
- 用 2 mL 高级 DMEM/F12 + 7.5% BSA 作为基础培养基、50 μM Y-27632、40 U/μL RNase 抑制剂和 1 U/μL DNase I 制备胰蛋白酶灭活培养基。
- 开始前,将培养基和 PBS 在 37 °C 下加热。
- HHO 的解离
- 使用 RNase 清洁剂清洁工作场所和工具。根据分化日期在尖端全开的 15 mL 聚丙烯管中收集类器官的数量。
- 用 PBS 2x-3x 洗涤。将 1 mL 解离酶培养基加入装有收集的类器官的 15 mL 试管中,并在摇杆中以 30 rpm 的速度在 37 °C 下保持 5 分钟。
注意: 小心不要将管子从摇杆上掉下来。 - 5 分钟后,首先检查盖子上是否有任何剩余的类器官,然后用 P1000 机械地破坏类器官,每个类器官上下旋转 10 次(总共 60 次)。对 P200 重复相同的中断。检查管帽,以防类器官卡在上面。
- 将 15 mL 试管再次放在摇杆上,再放入培养箱中 5 分钟。重复第 4 点的过程,首先上下旋转 P200,然后继续使用连接到 P10 吸头的 1 mL 血清移液器。
- 将 15 mL 试管再次放在摇杆上,放入培养箱中最后 5 分钟。如果没有解离,请再放置 5 分钟并重复手动破碎。
- 加入 1 mL 胰蛋白酶灭活培养基并匀浆。放置一个新的 15 mL 聚丙烯管,顶部有一个 40 μm 细胞过滤器。通过 40 μm 细胞过滤器将 2 mL(含有解离酶培养基和胰蛋白酶灭活培养基的细胞)过滤到 15 mL 试管中。
- 再加入 1 mL 胰蛋白酶灭活培养基,以从 40 μm 细胞过滤器中回收任何剩余的细胞。
- 取 5 μL 单细胞培养基与 5 μL 染料溶液混合,计数解离细胞的数量,以便继续固定。离心后对细胞进行计数,并使用固定试剂盒的第一种试剂重悬,并使用 40 μm 细胞过滤器进行细胞过滤。
结果
该方案从 hiPSC 逐步分化为 HHO 的每个阶段都是通过使用 qPCR 定量测量和免疫荧光从参考书目中的阶段特异性已知标记物来定义的(图 2)。14 描述了这两种技术的逐步步骤以及与正确分化为 HO 相关的结果。在之前的研究中,hiPSC 是通过 POU5F1 (也称为 OCT4)和 SOX2 的 mRNA 水平定义的,这是两个众所周知的山中因子16,随着时间的推移而降低(图 2A)。随后,通过免疫荧光测量 DE11 标志物如 OTX2、 CER1 和 FOXA2 以及 PFG11 标志物 HNF4A、 CDX2 和 TBX3 的 mRNA 水平,以及 OTX2、HNF4A 和 TBX3 的定位表达(图 2A、B)。3D 推广后,跟踪白蛋白和 HNF4a 的进展免疫荧光(图 2C);增殖标志物 MKI6717 和 TBX3 在调节肝母细胞18 中很重要 (图 2D) 从 D-18 到 D-46 进行。值得注意的是,白蛋白与 HNF4a 共定位(图 2C);同时,MKI67 零星出现在 D-46 (图 2D)。此外,通过 D-46 时 HNF4A19 和 KRT718 的 mRNA 水平和免疫荧光鉴定肝细胞和胆管细胞样细胞(图 2E)。
从 D-14 到 D-38,发育中的类器官的体积逐渐增加,如 D-22 上增殖标志物 MKI67 的 mRNA 水平与 D-10 相比增加 ~2 倍所示。与第 10 天相比,培养基中不存在 T4 导致 MKI67 mRNA 水平在 D-14 和 D-18 上分别增加了 ~20% 和 ~75%(图 3A)。为了证明肝脏类器官的功能,使用 ELISA 测量从肝脏类器官培养基中收集的白蛋白、载脂蛋白 B 和 A114 的 水平。在 D-42 和 D-46 上,T4-HOs 中的 ALB mRNA 水平与 T3-HOs 或 V-Hos 相比分别高出 3.0 倍和 2.5 倍(图 3B)。另一方面, APOB 水平分别在 D-42 和 D-46 高出 ~10 倍和 3 倍(图 3C), APOA1 水平分别高出 ~3 倍和 ~2 倍(图 3D)。
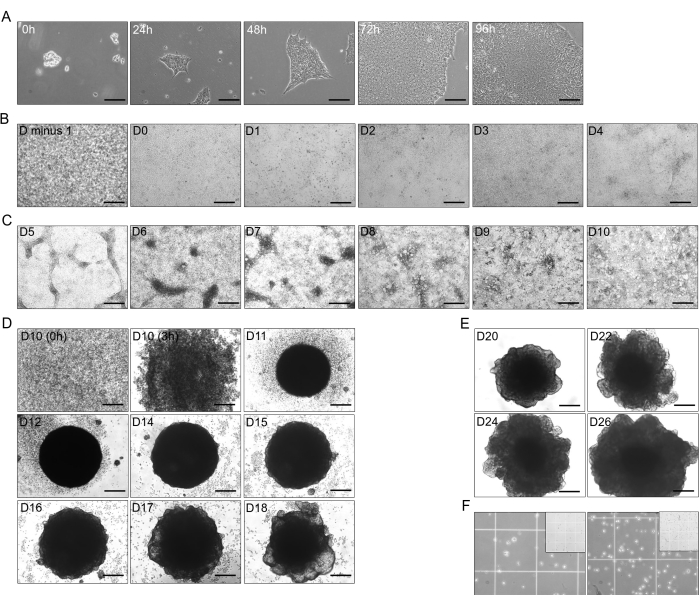
图 1:从 hiPSC 到肝脏类器官的分化阶段。 (A) hiPSC(CS03iCTR-n3 系)从 0 小时到 96 小时的过渡生长,在一个板的孔中达到约 70%-80% 的汇合度。比例尺:125 μm。(B) hiPSC 分化为最终内胚层 (DE) 的初始阶段,24 小时后显示前一天 (D 减 1) 100% 汇合,分化至 D4 (D-0 至 D-4)。比例尺:300 μm。(C) 从 DE (D-4) 分化为后前肠 (PFG;D-10),其中 T4 添加了 B26。比例尺:300 μm。(D) 将 2D-PFG 转化为 3D 未成熟肝类器官 (IHO),添加 T4 的 B26 从 D-10 作为单细胞直至 D-18,不包括 D-13。比例尺:300 μm。(E) 在 D-20、D-22、D-24 和 D-26 添加 T4 的 B26 的肝母细胞类器官 (HBO) 的维持和生长。比例尺:300 μm。(F) HBO 在 D-26 处(~2.5 x 105 个 细胞,在 750 μL 中;左图)和 HO1 在 D-30 处(~4 x 105 个细胞,在 750 μL 中;右图)解离成添加 T4 的 B26 的单细胞。插图说明了 Neuebauer 腔室的 1 mm 正方形尺寸,其中较小的正方形尺寸为 250 μm。将图像拍摄给培养基中使用的 T4 游离浓度为 ~15 pM 的 HHO。 请单击此处查看此图的较大版本。

图 2:HHO 分化的监测和表征。 (A) hiPSC 标志物 (POU5F1, SOX2)、明确内胚层 (DE;OTX2、CER1、FOXA2)和后前肠 (PFG;TBX3、HNF4A、CDX2)。(iPSC,n=8;DE 和 PFG n=7;PFG 中的 HNF4A,n=6)。(B) OTX2(上图,红色)、HNF4A(中图,绿色)和 TBX3(下图,红色)的 hiPSC、DE 和 PFG 处的免疫荧光。(C) “白蛋白(红色)和 HNF4A(绿色)的 D-18、D-26 和 D-46 的免疫荧光。(D) MKI67(绿色)和 TBX3(红色)在 D-18、D-26 和 D-46 处的免疫荧光。(E) 白蛋白(肝细胞标志物;红色)和 KRT7(胆管细胞标志物;绿色)D-46 处的免疫荧光。细胞核用 4′,6-二脒基-2-苯吲哚 (DAPI) 显示。此数字已从14 修改而来。请单击此处查看此数字的较大版本。

图 3:HHO 成熟分析。(A) 在 D-10 至 D-46 培养基中,在没有 TH(黑色)的情况下,增殖标志物 MKI67 与游离 T4 在 ~15 pM(红色)中的相对 mRNA 水平(n=4 除外,除了 D-42 处的 T4-HOs,n=2;和 D-46,n=3)。(B) 在 D-35 至 D-50 的培养基中测量三种情况下的白蛋白水平:无 TH(黑色),游离 T4 为 ~15 pM(红色),游离 T3 为 ~10 pM(蓝色;n=4)。(C、D)在 D-35 至 D-50 的培养基中测量载脂蛋白 B (APOB) 和 A1 (APOA1) 水平,在三种情况下:无 TH(黑色);游离 T4 为 ~15 pM(红色)。来自每孔 10 个类器官的数据 (n=4)。双尾学生 t 检验比较 V-HOs 与 T4-HOs 天数,单因素方差分析和 Tukey 检验用于多重比较。数据是重复项的平均值,表示为对齐的散点图及其平均值。*: 第 0<.05 页;**: 第 0<.01 页;: 第 0.001 页<;:第 <0.0001 页。x 轴表示分化的天数。此数字已从14 修改而来。请单击此处查看此数字的较大版本。
讨论
当前协议提供了有关如何处理 hiPSC 和后续 3D 类器官培养的各种方法学细节。这包括两个主要的关键步骤:(i) 2D 培养物的分离,然后在 10 天后发育成 3D 肝脏类器官,以及 (ii) 3D 结构精细解离成单个细胞。根据现有信息,这是研究甲状腺激素作用的 3D HHO 模型的首次报告,证明了最初在 P1 肝小鼠20 中发现的成肝细胞样细胞14 中 DIO2 的峰值表达。
与许多其他利用支架应用于细胞的技术一样,细胞外基质凝胶用于模拟细胞外基质21,从而促进组装成类器官的特征 3D 结构。这种试剂的热敏性强调了其作保持冷冻并在处理过程中浸入冰中的重要性。因此,使用不同的细胞外基质凝胶是可能的22,尽管在该方案中 hiPSC 没有在支架缺失板中附着和增殖,这使得其适当管理成为方案开始时的关键方面,以及 3D 类器官的产生。
在完成 HO 的分化后,类器官可行解离成单个细胞是另一个需要克服的主要障碍,因为机械破坏可能会引起细胞死亡,此时 RNA 测序数据质量低23。为确保最佳结果,本方案表明,在固定前后解离超过 105 个细胞以进行后续条形码编码,可以实现超过 70% 的单细胞活力。
与仅描述类器官7 中一种细胞类型的其他手稿不同,HHO 的分化包括至少两种肝母细胞衍生细胞:肝细胞和胆管细胞样细胞。掺入了两种负责其形成的试剂 HFG24 和 EGF25,以及促进肝细胞成熟的地塞米松26 和激活通向胆管细胞的 Notch 信号传导的 Jagged-118 。HOs 开发中的这种交织的信号网络使我们能够实现 3D 结构和模拟 体内 实验,此外还克服了原代肝细胞长期培养物分化下降的缺点27。值得注意的是,尽管表达了典型的成人肝脏标志物,但仍可以检测到类器官28 晚期胎儿标志物的存在,正如该方案所示。事实上,这反映了人类肝脏的正常发育,在人类中,胎儿肝脏标志物通常可以在 1 岁之前检测到29。
在将 hiPSC 发育成 HHO 的过程中(特别是在 HO 的未成熟时期,例如在 IHO 和一些 HBO 和 HO1 的最后几天)观察到的罕见情况是出现过度发育的囊性结构,一旦将板放在摇床上,这种结构最终会消失。这种不成比例的囊性结构进展表明坏死的核心到那时需要更高的冲洗30 和更频繁的培养基更换或添加少量的细胞外基质凝胶以消除囊肿的过度生长。
与最初的出版物相比,最初的出版物侧重于在高通量药物筛选的最后分化阶段类器官数量的增加11,现在报道的方法引入了 ULA 板的使用,以促进大尺寸 3D 类器官的早期形成并促进 HHO 的处理。这些调整证明了通过这种简单的方案可以完成的灵活性和大量研究。
披露声明
Antonio C. Bianco 是 Abbvie、Acella、Aligos、Synthonics 的顾问。其他作者没有相关披露。
致谢
这项工作得到了美国国家糖尿病、消化和肾脏疾病研究所 (NIDDK -DK58538, DK65066, DK77148 的支持;ACB 的
材料
| Name | Company | Catalog Number | Comments |
| 10 µL Universal Pipette Tips Filtered, Low rentention, Pre-sterile | VWR | 613-6462 | All procedures |
| 1000 µL Universal Pipette Tips Filtered, Low rentention, Pre-sterile | VWR | 613-6470 | All procedures |
| 15 mL Polypropilene Conical Tube | Falcon (Corning) | 352097 | Dissociation Hepatic Organoids |
| 200 µL Universal Pipette Tips Filtered, Low rentention, Pre-sterile | VWR | 613-6465 | All procedures |
| 3,3',5-Triiodo-L-thyronine | Sigma | T2877-100 | Hepatic Organoid differentiation |
| 40 μm Cell Strainer | Corning | 431750 | Dissociation Hepatic Organoids |
| 50 mL tube | Falcon (Corning) | 352070 | All procedures |
| 6 well-plate Nunc Cell-Culture Treated Multidishes | Thermo fisher scientific | 140675 | hiPSC maintenance |
| A83-01 | R&D Systems | 2939/10 | Hepatic Organoid differentiation |
| Advanced DMEM/F12 | Gibco | 12634010 | Hepatic Organoid differentiation |
| ART Wide Bore Filtered Pipette Tips | ART | 2069GPK | All procedures |
| B27 supplement | Gibco | 17504044 | Hepatic Organoid differentiation |
| BMP7 | R&D Systems | 354-BP-010/CF | Hepatic Organoid differentiation |
| Bovine Albumin Fraction V (7.5% solution) | Gibco | 15260037 | Dissociation Hepatic Organoids |
| BSA, Fraction V, Fatty Acid Free for Tissue Culture | GoldBio | A-421-100 | Dissociation Hepatic Organoids |
| CHIR99021 | R&D Systems | 4423/10 | Hepatic Organoid differentiation |
| Corning 96-well Clear Flat Bottom Ultra-Low Attachment | Corning | 3474 | Hepatic Organoid differentiation |
| Costar 6-well Clear Flat Bottom Ultra-Low Attachment | Corning | 3471 | Hepatic Organoid differentiation |
| CS03iCTR-n3 human induced Pluripotent Stem Cell line | Cedar-sinai | hiPSC maintenance | |
| DAPT | R&D Systems | 2634/10 | Hepatic Organoid differentiation |
| dbCAMP | Millipore Sigma | D0627-100MG | Hepatic Organoid differentiation |
| Dexamethasone | R&D Systems | 1126/100 | Hepatic Organoid differentiation |
| DMEM/F12 | Gibco | 11320033 | hiPSC maintenance |
| DNAse I, RNase-free, HC | Thermo Fisher scientific | EN0523 | Dissociation Hepatic Organoids |
| Falcon 10 mL Serological Pipet, Polystyrene, 0.1 Increments, Individually Packed, Sterile | Corning | 357551 | All procedures |
| Falcon 5 mL Serological Pipet, Polystyrene, 0.1 Increments, Individually Packed, Sterile | Corning | 357543 | All procedures |
| Falcon 50 mL Serological pipet, Polystyrene, 1.0 Increments, Individually Packed, Sterile | Corning | 357550 | All procedures |
| Gentle Cell Dissociation Reagent (GCDR) | Stemcell Technologies | 100-0485 | Hepatic Organoid differentiation |
| Glutamax supplement | Gibco | 35050061 | Hepatic Organoid differentiation |
| L-Thyroxine | Sigma | T1775-1G | Hepatic Organoid differentiation |
| Matrigel hESC-Qualified Matrix, LDEV-free, 5 mL | Corning | 354277 | Extracellular matrix gel |
| mFreSR | Stemcell Technologies | 5855 | hiPSC cryopreservation medium |
| mTeSR 5x Supplement | Stemcell Technologies | 100-0276 | hiPSC medium |
| mTeSR Plus | Stemcell Technologies | 100-0276 | hiPSC medium |
| Multi Platform Shaker | Fisherbrand (Thermo Fisher technologies) | 88861021 | Hepatic Organoid differentiation |
| N2 supplement | Gibco | 17502048 | Hepatic Organoid differentiation |
| Nicotinamide | R&D Systems | 4106/50 | Hepatic Organoid differentiation |
| PBS, pH 7.4 | Gibco | 10010023 | hiPSC maintenance |
| Recombinant human BMP4 | R&D Systems | 314-BP-010/CF | Hepatic Organoid differentiation |
| Recombinant human EGF | R&D Systems | 236-EG-200 | Hepatic Organoid differentiation |
| Recombinant human FGF basic/FGF2/bFGF | R&D Systems | 233-FB-010/CF | Hepatic Organoid differentiation |
| Recombinant human FGF19 | R&D Systems | 959-FG-025/CF | Hepatic Organoid differentiation |
| Recombinant human HGF | R&D Systems | 294-HG-005/CF | Hepatic Organoid differentiation |
| Recombinant Human Jagged-1 Fc Chimera | R&D Systems | 1277-JG-050 | Hepatic Organoid differentiation |
| Recombinant human KGF/FGF7 | R&D Systems | 251-KG-010/CF | Hepatic Organoid differentiation |
| ReLeSR | Stemcell Technologies | 100-0483 | hiPSC detaching medium |
| RNAse Inhibitor Ambion, cloned, 40 U/μL | Invitrogen | AM2682 | Dissociation Hepatic Organoids |
| RNase Zap | Invitrogen | AM9780 | Dissociation Hepatic Organoids |
| Sorvall Legend XT/XF Centrifuge Series | Thermo Fisher Scientific | 75004539 | All procedures |
| STEMdiff Definitive Endoderm Kit | Stemcell Technologies | 5110 | Hepatic Organoid differentiation |
| Trypan Blue solution (0.4%) | Gibco | 15250061 | Dye solution |
| TrypLE Express Enzyme | Gibco | 12604013 | Cell Dissociation enzyme |
| Trypsin 0.5% - EDTA (10X) | Gibco | 15400054 | Dissociation Hepatic Organoids |
| Valproic acid, sodium salt | R&D Systems | 2815/100 | Hepatic Organoid differentiation |
| Vari-Mix Platform Rocker | Thermo Fisher scientific | M79735Q | Dissociation Hepatic Organoids |
| Y-27632 dihydrochloride | R&D Systems | 1254 | Hepatic Organoid differentiation |
参考文献
- Peiseler, M., et al. Immune mechanisms linking metabolic injury to inflammation and fibrosis in fatty liver disease - novel insights into cellular communication circuits. J Hepatol. 77 (4), 1136-1160 (2022).
- Gordillo, M., Evans, T., Gouon-Evans, V. Orchestrating liver development. Development. 142 (12), 2094-2108 (2015).
- Lemaigre, F. P. Mechanisms of liver development: concepts for understanding liver disorders and design of novel therapies. Gastroenterology. 137 (1), 62-79 (2009).
- He, C., et al. Liver organoids, novel and promising modalities for exploring and repairing liver injury. Stem Cell Rev Rep. 19 (2), 345-357 (2023).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Takebe, T., et al. Vascularized and functional human liver from an iPSC-derived organ bud transplant. Nature. 499 (7459), 481-484 (2013).
- Si-Tayeb, K., et al. Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells. Hepatology. 51 (1), 297-305 (2010).
- Wu, F., et al. Generation of hepatobiliary organoids from human induced pluripotent stem cells. J Hepatol. 70 (6), 1145-1158 (2019).
- Shinozawa, T., et al. High-fidelity drug-induced liver injury screen using human pluripotent stem cell-derived organoids. Gastroenterology. 160 (3), 831-846.e10 (2021).
- Ouchi, R., et al. Modeling steatohepatitis in humans with pluripotent stem cell-derived organoids. Cell Metab. 30 (2), 374-384.e6 (2019).
- Ramli, M. N. B., et al. Human pluripotent stem cell-derived organoids as models of liver disease. Gastroenterology. 159 (4), 1471-1486.e12 (2020).
- Shen, M. M. Nodal signaling: developmental roles and regulation. Development. 134 (6), 1023-1034 (2007).
- Ang, L. T., et al. A roadmap for human liver differentiation from pluripotent stem cells. Cell Rep. 22 (8), 2190-2205 (2018).
- Hidalgo-Álvarez, J., Salas-Lucia, F., Vera Cruz, D., Fonseca, T. L., Bianco, A. C. Localized T3 production modifies the transcriptome and promotes the hepatocyte-like lineage in iPSC-derived hepatic organoids. JCI Insight. 8 (23), e173780 (2023).
- . B27 Supplement Available from: https://www.weizmann.ac.il/molgen/hanna/sites/molgen.hanna/files/users/user52/HANNA-LAB-B22-B27-PROTOCOL-V3.pdf (2016)
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Zhu, X., Sun, J. CircHIPK3 regulates melanoma cell behaviors by binding with miR-215-5p to upregulate YY1. Mol Cell Probes. 53, 101644 (2020).
- Guan, Y., et al. Human hepatic organoids for the analysis of human genetic diseases. JCI Insight. 2 (17), e94954 (2017).
- Walesky, C., Apte, U. Role of hepatocyte nuclear factor 4α (HNF4α) in cell proliferation and cancer. Gene Expr. 16 (3), 101-108 (2015).
- Fonseca, T. L., et al. Hepatic inactivation of the type 2 deiodinase confers resistance to alcoholic liver steatosis. Alcohol Clin Exp Res. 43 (7), 1376-1383 (2019).
- Kleinman, H. K., Martin, G. R. Matrigel: basement membrane matrix with biological activity. Semin Cancer Biol. 15 (5), 378-386 (2005).
- Kozlowski, M. T., Crook, C. J., Ku, H. T. Towards organoid culture without Matrigel. Commun Biol. 4 (1), 1387 (2021).
- Arceneaux, D., et al. A contamination focused approach for optimizing the single-cell RNA-seq experiment. iScience. 26 (7), 107242 (2023).
- Matsumoto, K., Nakamura, T. Hepatocyte growth factor: molecular structure and implications for a central role in liver regeneration. J Gastroenterol Hepatol. 6 (5), 509-519 (1991).
- Kimura, M., Moteki, H., Ogihara, M. Role of hepatocyte growth regulators in liver regeneration. Cells. 12 (2), 208 (2023).
- Michalopoulos, G. K., Bowen, W. C., Mulè, K., Luo, J. HGF-, EGF-, and dexamethasone-induced gene expression patterns during formation of tissue in hepatic organoid cultures. Gene Expr. 11 (2), 55-75 (2003).
- Kaur, I., et al. Primary hepatocyte isolation and cultures: Technical aspects, challenges and advancements. Bioengineering (Basel). 10 (2), 131 (2023).
- Baxter, M., et al. Phenotypic and functional analyses show stem cell-derived hepatocyte-like cells better mimic fetal rather than adult hepatocytes. J Hepatol. 62 (3), 581-589 (2015).
- Blohm, M. E., Vesterling-Hörner, D., Calaminus, G., Göbel, U. Alpha 1-fetoprotein (AFP) reference values in infants up to 2 years of age. Pediatr Hematol Oncol. 15 (2), 135-142 (1998).
- Liu, Q., Zeng, A., Liu, Z., Wu, C., Song, L. Liver organoids: From fabrication to application in liver diseases. Front Physiol. 13, 956244 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。