Method Article
iPSC由来3Dヒト肝臓オルガノイド作製のための統合プロトコール
要約
ヒトiPS細胞由来の3D肝臓オルガノイドは、甲状腺ホルモンが肝臓の発達に及ぼす作用を理解するための潜在的なツールとなります。
要約
培養中の安定した肝細胞を得ることは、肝臓研究にとって大きな課題です。このことを念頭に置いて、ヒト人工多能性幹細胞(hiPSC)を利用してヒト肝オルガノイド(HHO)の3D培養物を生成する最適化された方法が示されています。HHOsの利用は、肝臓の発達を理解し、肝疾患の解明、医薬品開発のためのハイスループット研究の実施、肝移植の可能性の探求に貴重なアプローチを提供します。前者の研究では、免疫蛍光法と定量的RT-PCR技術を用いて進行をモニタリングし、肝芽細胞や肝芽球由来細胞の2種類の肝芽細胞(胆管細胞または肝細胞様細胞)など、さまざまな細胞集団の存在を異なる発生段階にわたって同定しました。このレポートでは、ヒト胚発生の段階を反映したHHOを取得するためのhiPSCから始まる簡単な3Dプロトコルを紹介します。46〜50日間にわたるこのプロトコルには、(i)HHOを生成するためのhiPSC培養の綿密な管理、(ii)2Dでの細胞分化の開始とその後の3Dへの移行、(iii)HHOをシングルセルRNAシーケンシングのためのシングルセルに分解するための最適化された解離戦略など、いくつかのステップが含まれます。このアプローチの広範な応用の実例として、本プロトコルは、肝細胞の発達における甲状腺ホルモンシグナル伝達の役割を解明するために以前に適用されました。
概要
肝臓は、グルコースやケトン体などの容易に利用可能なエネルギー基質の利用可能性を調節したり、生体異物化合物を解毒したりするなど、さまざまな代謝機能を果たしています。近年、肝疾患の有病率が大幅に増加していますが、これは主に非アルコール性脂肪性肝炎(NASH)に起因しており、治療しないと肝硬変やがんに進行する可能性があります1。したがって、肝臓の代謝機能とその関連疾患を理解することは、効果的な治療法の開発を促進するために不可欠です2,3。
3次元(3D)培養の出現により、オルガノイドモデルが誕生し、臓器発生の機能性と複雑さに取り組むための画期的で革新的なアプローチとなっています4。オルガノイドは、それぞれの臓器の機能と細胞構造を模倣する分化した細胞の3D自己組織化凝集体として定義されます5。
過去数十年にわたり、多様なヒトiPS細胞由来細胞6 または肝細胞様細胞のみ の利用7から、成長因子または阻害剤の様々な複雑な微小環境の組み込み、および単層7 または3D8への分化前駆細胞の組み込みまで、無数のヒト肝オルガノイド(HHO)プロトコルが広範な関心を集めてきました.これらのアプローチは、ハイスループットの薬物スクリーニング9 から、肝疾患の根底にあるメカニズム10へのさらなる洞察を得ることまで、多数の潜在的な目的に役立ちます。
ここでは、前述の化学的手がかり11 に基づくHHO分化の段階的なプロトコルが、方法論的に適応したバリエーションで実行されます。このプロトコールは、ヒト人工多能性幹細胞(hiPSC)の適切な取り扱いと培養から始まり、細胞外マトリックスゲルの操作、細胞継代、およびHHOへの分化の技術について詳しく説明します。このプロセスは、ヒトiPS細胞の確定的内胚葉(DE)12 への分化を刺激することから始まり、続いてFGFおよびBMPの in vivo 効果を模倣して、後前腸(PFG)単層細胞13の発達を促進する。3Dアーキテクチャは、PFG細胞が未熟な肝相に分化し、胆管細胞と肝細胞の胎児前駆細胞である肝芽細胞になる10日目に達成されます2。最後に、3D構造を1つの細胞に解離して、RNAシーケンシング研究を行います。このプロトコルの適用可能性の一例として、このHHOモデルが甲状腺ホルモンの作用と肝細胞および胆管細胞の発達に関する2型デヨージナーゼ(D2)の研究にどのように役立つかが実証された14。
プロトコル
1. ヒトiPS細胞の管理
注:hiPSC(CS03iCTR-n3細胞株)は市販されています。細胞外マトリックスゲルコーティングとhiPSC培地の適切な管理は、hiPSCをプレートに付着させ、供給するための鍵となります。ここでは、1枚の6ウェルプレートに必要な容量について説明しました。6ウェルプレートに残ったヒトiPS細胞は、オルガノイドに分化しませんが、液体窒素で保存して長期保存することができます。
- 細胞外マトリックスゲルとhiPSC培地の分注
- 細胞外マトリックスゲルのボトルを氷の入った容器に4°Cで一晩置いて、適切に解凍します。
注:分注する前に、分析証明書を確認して、希釈係数の量を確認してください。これは、細胞外マトリックスゲルのタンパク質濃度を表します。したがって、ロットごとに異なります。 - 細胞外マトリックスゲルを希釈係数(4倍、2倍、および1倍)に応じて適切なアリコートに分配し、事前に冷却して標識したチューブを使用します。細胞外マトリックスゲルの4倍希釈係数を25 mLの冷DMEM/F12に加え、4つの6ウェルプレートをコーティングします。蓋を実験室用シーリングフィルムで速やかに密封し、-80°Cで凍結します。空気に長時間さらされたり、アリコートに気泡が発生したりしないようにしてください。
- 100 mLのhiPSCサプリメント培地を4°Cで一晩解凍します。400 mLのhiPSC基礎培地に加えます。50 mLの血清ピペットでホモジナイズしたら、hiPSC培地を40 mLのチューブに分注し、使用するまで-20°Cで凍結します。
- 細胞外マトリックスゲルのボトルを氷の入った容器に4°Cで一晩置いて、適切に解凍します。
- hiPSC培養のためのプレートコーティング
- 6ウェルプレートを数値化し、ラベル付けします。細胞外マトリックスゲルアリコート1個を近くに置き、ドライアイスに浸します。
- 1枚の6ウェルプレートをコーティングするには、細胞外マトリックスゲルアリコート1枚(1x)を6.25 mLの冷DMEM/F12に希釈します(2xは12.5 mLに、4xは25 mLのDMEM/F12に希釈します)。
- 少量のDMEM/F12(~500 μL)を細胞外マトリックスゲルチューブにピペットで移します。上下に渦巻いて、冷たいDMEM/F12で細胞外マトリックスゲルを解凍して均質化し、気泡の発生を防ぎ、血清学的ピペットを使用して冷たいDMEM/F12含有チューブの残りの部分に戻して完全に混合します。
- 1 mLの細胞外マトリックスゲルをDMEM/F12に1つのウェルに包埋し、6ウェルプレートをコーティングします(プレート全体で6 mL)。プレートが完全に覆われるまでプレートを振らずに動かして、1 mLを表面全体に均等に分散させます。
- 使用前に室温(RT)で1時間放置してください。6ウェルプレートを完全に使用しない場合は、実験室用シーリングフィルムで密封し、4°Cの冷蔵庫で保管してください。
注:コーティングされたプレートは、4°Cの冷蔵庫で1週間保存できます。
- hiPSCの解凍と培養
- hiPSC培地の容量を事前に計算し、使用の1時間前に6ウェルコーティングプレートとともにRTで温めます(ウェルあたり2mL)。
注:冷蔵または冷凍のアリコートの場合は、使用の15分前に37°Cのインキュベーターまたはウォーターバスに浸してください。 - クライオバイアルから液体N2 中の1 mLのhiPSCを6ウェルプレートの3ウェルに分割します(1:3の比率)。6ウェルプレート全体には、2つのクライオバイアルを使用します。ここでは、1つのクライオバイアルからのhiPSCの解凍と培養について、プロトコールで説明しています。2つのクライオバイアルについてこのプロセスを繰り返します。
- 約 1 mL の凍結 iPSC を含むクライオバイアルをキャップに通して表面水に滑り込ませ、バイアルの底を 37 °C の水浴に浸して解凍するまで導入します。
- 解凍後、クライオバイアルにエタノールを噴霧し、1 mLのhiPSCをピペットで移します。空の円錐形の15mLチューブでゆっくりと分注します。チューブを静かに振とうしながら、温かいiPSC培地5mLを一滴ずつ加えます。
- チューブを300 x g でRTで5分間遠心分離し、ペレットを乱さずに真空に接続されたガラスピペットで吸引することにより、上清を繊細に除去し、残留媒体を残します。ペレットを6 mLの培地に慎重に再懸濁し、次に6ウェルプレートの3ウェルにウェルあたり2 mLを加えます。
注:正しく増殖するために、hiPSCの小さな凝集体を残してください。 - 6ウェルプレートを折り返し、ウェルの底部の先端に触れることなく、以前にコーティングしたプレートから細胞外マトリックスゲルを吸引します。
- ウェルあたり2 mLの培地をhiPSCsと共に移します。プレートを前後左右にゆっくりと振って、hiPSC凝集体をプレート上に均等に分散させます。
- 6ウェルプレートを37°C、5%CO2、湿度95%のインキュベーターに入れます。培地を毎日交換し(ウェルあたり2 mL)、成長が進行することを確認します。
- 80%の成長コンフルエンスを獲得した場合の継代hiPSC(4〜5日後; 図1A参照)。健康で増殖性のヒトiPS細胞の特徴には、増殖する細胞凝集体の中心に明確な境界と大きな核の密集したパッケージングが含まれます。
- hiPSC培地の容量を事前に計算し、使用の1時間前に6ウェルコーティングプレートとともにRTで温めます(ウェルあたり2mL)。
- hiPSCの継代
- ヒトiPS細胞が80%のコンフルエント度に達したら、1ウェルあたり約1.2 x 106 細胞であることを示しています。その後、新しい6ウェルプレートに継ぎます。1:3の比率(1ウェルから3ウェルへ)で分割するか、実験の要件に応じて比率(1:4、1:6)を調整します。
- 継代する前に、ステップ1.2で説明したように、適切な数の6ウェルプレートに必要な細胞外マトリックスゲルをインベデントします。
- 各ウェルから上清を取り除き、ウェルごとに2 mLのPBSを加えます。PBSを吸引した後、ウェルあたり1 mLのhiPSC剥離培地を1分間添加します。次に、1 mLのhiPSC剥離培地を取り出します。
- 6ウェルプレートを37°Cのインキュベーターに7分間置きます。1ウェルあたり1 mLのhiPSC培地を添加します。細胞入りのhiPSC培地1 mLを15 mLチューブにピペットで移し、取り外して回収します。
- チューブを300 x g でRTで5分間遠心分離します。細胞を6ウェルプレートに播種するには、手順1.3.5〜1.3.7を繰り返します。6ウェルプレートを37°C、5%CO2、 湿度95%のインキュベーターに入れます。手順 1.5 に進みます。必要に応じてhiPSCを凍結します。
- hiPSCの凍結(オプション)
注:HOへの昇格に必要なhiPSCの数によっては、長期保存可能なウェルが残る場合があります。クライオビアル保存のために通路を拡大する必要がある場合、hiPSCを長期間維持することができます。- 必要量の凍結保存培地(細胞ウェルあたり1 mL)を4°Cの氷に解凍します。クライオチューブに継代数、日付、細胞株を標識します。ステップ1.4と同様に、hiPSC剥離培地で細胞を剥離します。15mLのコニカルチューブに入れます。
- 300 x g でRTで5分間遠心分離し、上清を完全に吸引し、細胞ペレットを慎重に乱さないようにします。hiPSC凝集体を残して、ペレットを1 mLの低温凍結保存培地(ウェルあたり)に慎重に再懸濁します。
注:ウェルが低密度で、コンフルエントが50%未満の場合、2ウェルごとに1 mLの凍結保存培地を使用できます。 - 1 mLの凍結保存培地とhiPSCをクライオチューブに移します。クライオチューブを穏やかに攪拌して、細胞内容物を均質化します。
注:凍結保存するためにさらにチューブを準備する場合は、すでに準備したチューブを氷の中に置いておきます。 - チューブを-80°Cの制御速度凍結容器に一晩置きます。24時間後にチューブを液体窒素タンクに移します。
2. hiPSCから肝臓オルガノイドへの段階的な鑑別
注:試薬の再構成は、製造元のガイドラインに従って実施され、それに従って行われました。
- hiPSC から DE への 2D 分化 (0 日目から 4 日目 (D-0 から D-4); 図1B)
- 3継代後、細胞が健康で、順調に速く成長している場合は、hiPS細胞の分化に進みます。ステップ1.2で説明したように6ウェルプレートをコーティングします。hiPSCをDEに区別するには、製造元の指示に従ってDEキットを使用してください。
- 分化を開始する前に、hiPSCを2:1の継代比(6ウェルから3ウェルで分化開始)で24時間培養し、DEの指示に示されているウェル内の細胞濃度を達成します。
- 製造元のプロトコルに従って、次の変更を加えて鑑別を実行します。
- hiPSCに添加したY-27632の濃度を10 μMから50 μMに上げます(鑑別開始前日)。
- 解離試薬のウェルあたり1.5 mL、およびDMEM/F12の容量を解離試薬のウェルあたり同量に増やします。各ウェルに1 mLのDMEM/F12(1.5個中)を加え、さらに0.5 mLを15 mLまたは50 mLのチューブに蓄積します。
- DE細胞のPFG細胞(D-4〜D-10; 図1C)
- PFGへの誘導の数日前に、DE細胞の分化のためにPFG培地(基礎培地としてのAdvanced DMEM/F12、1x Glutamaxサプリメント、1x B27サプリメント、20 ng/mL BMP4、10 ng/mL FGF2)を調製し、4°Cで保存します。
注:B27には、その組成の一部としてT3が含まれています。甲状腺ホルモン(TH)研究の場合、ここから先は、B27をTHを含まない自家製のB2615 に置き換える必要があります。 - PFG培地(ウェルあたり2 mL)と高度なDMEM/F12を37°Cで15分間、または室温で1時間温めます。プレートを曲げて、真空に接続されたガラスピペット(またはP1000ピペットで手動)を使用して、細胞を傷つけずにウェルからDE培地を吸引します。
- ウェルあたり2 mLの温かいアドバンスドDMEM/F12を加え、吸引します。6ウェルプレートにウェルあたり2 mLの温かいPFG培地を加えます。次の6日間は、毎日媒体を交換します。
- PFGへの誘導の数日前に、DE細胞の分化のためにPFG培地(基礎培地としてのAdvanced DMEM/F12、1x Glutamaxサプリメント、1x B27サプリメント、20 ng/mL BMP4、10 ng/mL FGF2)を調製し、4°Cで保存します。
- 2D PFG細胞から3D未熟肝オルガノイド(IHO;D-10 から D-18)
注:96ウェルULAプレートの各ウェルに30μLを添加すると、約30,000〜35,000個の細胞が必要です。継代比は2:1で、分化したPFG細胞の単層を持つ2ウェル(6ウェルプレート)から得られます。これは、完全な96ウェル超低アタッチメント(ULA)プレートを提供します(図1D)。- 3Dオルガノイドを開始する前に、またはそれ以前の場合は、IHO培地(基礎培地としてのAdvanced DMEM/F12、1x N2サプリメント、1x B27、50 nM A83-01、30 μMデキサメタゾン、5 μM CHIR99021、500 nMバルプロ酸、50 ng/mLヒト上皮成長因子(EGF)、20 ng/mLヒト肝細胞成長因子(HGF)、40 ng/mL Jagged-1、 300 ng/mL N-6,20-O-ジブチリアラデノシン 30,50-環状 35 一リン酸ナトリウム塩 (dbCAMP), 10 μM ニコチンアミド) を 4 °C で保存します。
- 96ウェル超低アタッチメント(ULA)プレートをラベリングします。PFG細胞の剥離には、製造元の指示に従って細胞解離酵素を使用してください。
- 解離酵素、アドバンスドDMEM/F12、およびPBSを37°Cで温めてから使用してください。井戸のPFG媒体を吸引して廃棄します。ウェルあたり2 mLのPBSを加え、吸引します。
- ウェルあたり1.5 mLの細胞解離酵素を37°Cで7分間加え、ウェルから細胞を剥離します。細胞解離酵素を除去せずに、1 mLの進行性DMEMを添加します。すべての細胞を集め、50mLのチューブに加えます。
- セルカウンターまたは血球計算盤でmLあたりの細胞数をカウントします。150 x g で8分間遠心分離します。
- ペレットに適切な容量(96ウェルULAプレート全体で3 mLのIHO培地)と1x細胞外マトリックスゲルを加えて、最終的に必要な細胞数(30,000〜35,000細胞)に調整します。
- 96ウェルプレートを、37°C、5%CO2、 湿度95%に設定されたインキュベーターに入れます。24時間後(D-11)、細胞は円形に再集合します。IHO培地のウェルあたり50μLを添加します。
- 翌日(D-12)に、ウェルあたり100 μLのIHO培地に増やします。D14 で、ガラスピペットを真空に接続するか、ピペットで 1 つずつ、各ウェルから ~100-120 μL を取り出します。オルガノイドを吸引しないように注意してください。D-14およびD-16に100 μLのIHO培地を加えます。
注:D-16以降は移動に移らないため、D18以降は過剰な成長が見られ、消失します。
- 肝芽球オルガノイド(HBO、D-18〜D-26)
注:このステップでは、96ウェルULAプレートのIHOを6ウェルULAプレートに移設します。前段階の96のIHOについて、ウェルごとに10のオルガノイドを配置し、合計1枚と1/2枚の6ウェルULAプレートを配置して熟成を進めました(図1E)。- 前の微分ステップで行ったように、前の日にHBOの微分培地を準備します。
- HBOに分化するために使用される試薬のカクテルについては、ステップ2.3で説明します。バルプロ酸を取り除き、BMP7、BMP4、FGF7の生化学物質をカクテルに組み込みます。最終組成は、基礎培地としてのAdvanced DMEM/F12、1x N2サプリメント、1x B27、50 nM A83-01、30 μMデキサメタゾン、5 μM CHIR99021、500 nMバルプロ酸、50 ng / mLヒト上皮成長因子(EGF)、20 ng / mLヒト肝細胞成長因子(HGF)、40 ng / mL Jagged-1、300 ng / mL N-6,20-O-ジブチリラデノシン30,50-環状35一リン酸ナトリウム塩(dbCAMP)、 10 μM ニコチンアミド、25 ng/mL FGF7、50 ng/mL BMP4、20 ng/mL BMP7。
- 以前はHBO培地(ウェルあたり3 mL)およびAdvanced DMEM/F12(ウェルあたり3 mL)を37°Cで温めました。各ウェルに3 mLの温かいアドバンスドDMEM/F12を加えます。
- 200 mLのワイドボアチップを備えた96ウェルプレートからウェルあたり10個のIHOオルガノイドを分配します。高度なDMEM / F12を取り外すには、プレートを曲げて、真空に接続されたガラスピペットで(またはP1000を使用して手動で)吸引します。
- ウェルごとに3mLの温かいHBO培地を加えます。電源を入れ、37°C、5%CO2、 湿度95%に設定されたインキュベーター内の65rpmのマルチプラットフォームシェーカーに6ウェルULAプレートを置きます。4日後(D-22)および6日後(D-24)に、HBO培地(ウェルあたり3 mL)を交換します。
- 前の微分ステップで行ったように、前の日にHBOの微分培地を準備します。
- 2つの異なるフェーズ(D-26からD-46)による肝臓オルガノイド(HO)への成熟
注:これは、培地中の試薬の含有量と種類により、2つの分化期間に発生する最後の成熟プロセスです。- HO(HO1)培地の最初のものを事前に準備し、4°Cで保存します。Jagged1を取り外し、HBOメディアと比較してCHIR99021の濃度を下げます。最終組成は、基礎培地としての高度なDMEM/F12、1x N2サプリメント、1x B27、500 nM A83-01、30 μMデキサメタゾン、2 μM CHIR99021、50 ng/mLヒト上皮成長因子(EGF)、20 ng/mLヒト肝細胞成長因子(HGF)、300 ng/mL N-6,20-O-ジブチリラデノシン30,50-環状35一リン酸ナトリウム塩(dbCAMP)、10 μMニコチンアミド、 25 ng/mL FGF7、20 ng/mL BMP4、20 ng/mL BMP7。
- Advanced DMEM/F12およびHO1培地を37°Cで温めてから使用してください。同じ6ウェルULAプレートで、プレートを曲げて真空に接続されたガラスピペットの先端を壁に当てて(またはP1000ピペットで手動で)、前のHBO培地を慎重に吸引します。
- ウェルあたり3 mLの温かいAdvanced DMEM/F12を加えて吸引します。ウェルあたり3 mLの温かいHO1培地を加えます。サンプル収集とともに、HO1培地を3日ごとに交換します(D-29、D-32、D-35、D-38)。
- D 38 で、HO (HO2) の第 2 ピリオドの試薬のカクテルを、CHIR99021、BMP4、dbcAMP、および FGF7 を除去し、FGF19 および DAPT で置き換えて変更します。最終的な培地組成は、基礎培地としてのAdvanced DMEM/F12、1x N2サプリメント、1x B27、500 nM A83-01、30 μM デキサメタゾン、50 ng/mL ヒト上皮成長因子(EGF)、20 ng/mL ヒト肝細胞成長因子(HGF)、10 μM ニコチンアミド、20 ng/mL BMP7、25 ng/mL FGF19、5 μM DAPT です。
- Advanced DMEM/F12およびHO2培地を37°Cで温めてから使用してください。6ウェルULAプレートを同じように続けて、前のHO1培地を慎重に吸引します。ウェルあたり3 mLのAdvanced DMEM/F12を加えて取り出します。
- ウェルあたり3 mLの温かいHO2培地を加えます。HO2培地を4日ごとに交換し(D-42、D-46、D-50など)、培地を交換したのと同じ日にサンプルを採取します。
3. シングルセル解離
注:このステップは、シングルセルRNAシーケンシング技術にとって重要です。オルガノイドの数はサイズによって異なり、解離日が古いほど、オルガノイド内の細胞の量が多くなります。以前は、解離したオルガノイドの数が増加し、解離時間は同量で減少しました。解離は、D-14とD-17に10個のオルガノイド、D-23とD-26に8個のオルガノイド、D-30とD-45に6個のオルガノイドで行いました。オルガノイドの1つのクラスターの手順は詳細です(図1F)。
- 試薬の調製
- 最終濃度7.5%のウシアルブミンフラクションV(BSA)でAdvanced-DMEMを調製し、均質化後にろ過します。
- 1 mLの解離酵素培地を、1 mLのトリプシン0.5% - EDTA(10x)を基礎培地として、50 μM Y-27632、40 U/μL RNase阻害剤、および1 U/μL DNase Iを調製します。
- 基礎培地として 2 mL の Advanced DMEM/F12 + 7.5% BSA、50 μM Y-27632、40 U/μL RNase 阻害剤、および 1 U/μL DNase I を使用してトリプシン不活化培地を調製します。
- 開始する前に、メディアとPBSの両方を37°Cで温めます。
- HHOの解離
- RNaseクリーナーで作業場とツールを清掃します。分化日に応じてオルガノイドの数を、先端が広く開いた15 mLのポリプロピレンチューブに集めます。
- PBS2x-3xで洗ってください。回収したオルガノイドを入れた15 mLチューブに解離酵素培地1 mLを加え、ロッカーで37°C、30 rpmで5分間保持します。
注意: チューブをロッカーから落とさないように注意してください。 - 5分後、まずキャップにオルガノイドが残っているかどうかを確認し、次にP1000でオルガノイドごとに10回(合計60回)上下に回転させてオルガノイドを機械的に破壊します。P200で同じ混乱を繰り返します。オルガノイドがチューブキャップに引っかかっていないか確認してください。
- 15 mLチューブをロッカーに再度設置し、さらに5分間インキュベーターに入れます。P200を上下に旋回させることから始めて、P10チップに接続された1 mLの血清学的ピペットで続けることにより、ポイント4のプロセスを繰り返します。
- 15 mLチューブをロッカーに再度取り付け、最後の5分間インキュベーターに入れます。解離しない場合は、さらに5分間放置し、手動での中断を繰り返します。
- 1mLのトリプシン不活化培地を加え、ホモジナイズします。新しい15 mLポリプロピレンチューブと40 μmセルストレーナーを上部に置きます。2 mL(解離酵素培地とトリプシン不活性化培地を含む細胞)を40 μmの細胞ストレーナーで15 mLチューブにろ過します。
- さらに1 mLのトリプシン不活化培地を添加して、40 μmのセルストレーナーから残りの細胞を回収します。
- 5 μLの単一細胞培地と5 μLの色素溶液を混合して、解離した細胞の数をカウントし、固定を進めます。固定キットの最初の試薬で遠心分離および再懸濁後の細胞をカウントし、40 μmの細胞ストレーナーを使用して細胞ろ過を行います。
結果
このプロトコルの hiPSC から HHO への段階的な分化の各段階は、qPCR による定量的測定と、参考文献からのステージ特異的な既知のマーカーの免疫蛍光法を使用して定義されました (図 2)。両方の手法の段階的なステップと、HOへの正しい分化に関連して達成された結果は、14に描かれました。これまでの研究では、HIPSCは、山中因子16の2つであるPOU5F1(OCT4としても知られる)とSOX2のmRNAレベルを通じて定義され、このレベルは時間とともに減少しました(図2A)。続いて、OTX2、CER1、FOXA2などのDE11マーカー、およびPFG11マーカーHNF4A、CDX2、TBX3のmRNAレベルと、免疫蛍光法によるOTX2、HNF4A、TBX3の局在化発現を測定しました(図2A、B)。3Dプロモーション後、アルブミンとHNF4aの進行免疫蛍光を追跡します(図2C)。肝芽球18(図2D)の調節に重要な増殖マーカーMKI6717、およびTBX3をD-18からD-46まで行った。特に、アルブミンはHNF4aと共局在しています(図2C)。一方、MKI67はD-46に散発的に出現した(図2D)。また、D-46のHNF4A19およびKRT718のmRNAレベルおよび免疫蛍光法を通じて、肝細胞および胆管細胞様細胞を同定した(図2E)。
D-14からD-38へのオルガノイドの体積は徐々に増加し、D-10と比較してD-22上の増殖 マーカーMKI67 のmRNAレベルが~2倍に増加したことで示されています。培地にT4が存在しないため、 MKI67 のmRNAレベルは、D-14とD-18でそれぞれ~20%、~75%増加しました(図3A)。肝臓オルガノイドの機能を証明するために、肝臓オルガノイドの培地から採取したアルブミン、アポリポタンパク質B、およびA114 のレベルをELISAを使用して測定しました。D-42およびD-46では、 ALB mRNAレベルはT4-HOsでT3-HOまたはV-Hosと比較して、それぞれ3.0倍および2.5倍と大幅に高いままでした(図3B)。一方、D-42では APOB レベルが~10倍、D-46では3倍(図3C)、 APOA1 レベルはD-46でそれぞれ~3倍、~2倍(図3D)でした。
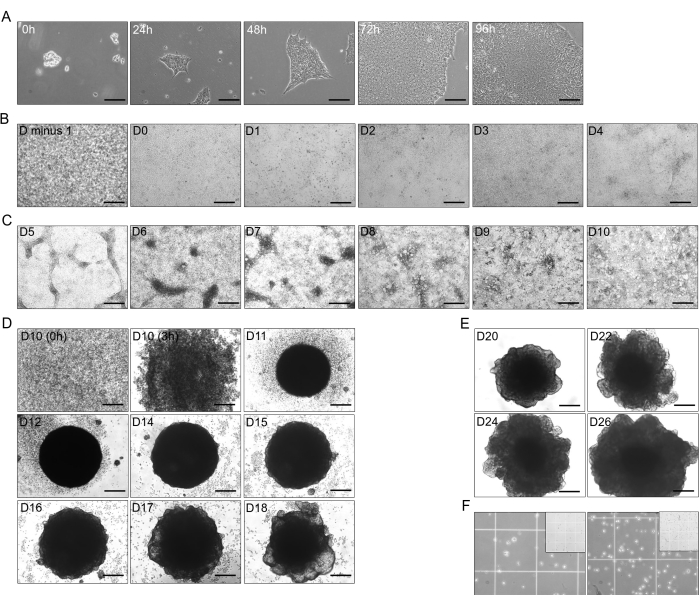
図1:hiPSCから肝臓オルガノイドへの分化段階 (A)0時間から96時間までのhiPSC(CS03iCTR-n3系統)の移行成長、1つのプレートのウェルで約70%-80%のコンフルエンスに達する。スケールバー:125μm.(B)hiPSC分化の初期段階が確定性内胚葉(DE)に進行し、24時間後に前日(D-1)に100%の合流を示し、D4(D-0〜D-4)まで分化。スケールバー:300μm.(C)DE(D-4)から後前腸(PFG;D-10)とT4はB26を追加しました。スケールバー:300μm.(D)D-10からD-10からT4添加B26を単一細胞として、D-13を除くD-18までのT4添加B26を添加した2D-PFGの3D未熟肝オルガノイド(IHO)への変換。スケールバー:300 μm. (E) D-20、D-22、D-24、D-26にT4添加B26を添加した肝芽球オルガノイド(HBO)の維持と成長。スケールバー:300 μm. (F) D-26 での HBO の解離 (750 μL 中の ~2.5 x 105 細胞; 左) と D-30 での HO1 (750 μL 中の ~4 x 105 細胞; 右) T4 B26 を添加した単一細胞への解離。挿入図は、ノイバウアーの部屋の1mm四方のサイズを示しており、小さい方の正方形は250μmです。画像は、メディアに使用されたT4の自由濃度が~15pMであったHHOに撮影されました。 この図の拡大版を表示するには、ここをクリックしてください。

図2:HHOの差別化の監視と特性評価。 (A)hiPSCマーカー(POU5F1、SOX2)、明確な内胚葉(DE;OTX2、CER1、FOXA2)および後部前腸(PFG;TBX3、HNF4A、CDX2)。(iPS細胞, n=8;DEおよびPFG n = 7;PFGのHNF4A、n = 6)。(B)OTX2(上、赤)、HNF4A(中、緑)、TBX3(下、赤)のhiPSC、DE、PFGでの免疫蛍光。(C)「D-18、D-26、D-46におけるアルブミン(赤)とHNF4A(緑)の免疫蛍光法」。(D)MKI67(緑)およびTBX3(赤)のD-18、D-26、およびD-46での免疫蛍光。(E)アルブミン(肝細胞マーカー;赤)およびKRT7(胆管細胞マーカー;緑)のD-46での免疫蛍光。核は4′,6-ジアミジノ-2-フェニリンドール(DAPI)で示されています。この図は14 から変更されています。この図の拡大版を表示するには、ここをクリックしてください。

(A) D-10 から D-46 までの培地 (d-42、n=2、D-46 の T4-HO を除く n=4、d-46、n=3) の TH (黒) と ~15 pM (赤) の非存在下での増殖マーカー MKI67 の相対 mRNA レベル。(B)アルブミンレベルは、D-35からD-50までの培地で、THの不在(黒)、遊離T4が~15 pM(赤)、遊離T3が~10 pM(青、n = 4)の3つの条件で測定されました。(C、D)アポリポタンパク質B(APOB)およびA1(APOA1)レベルは、D-35からD-50までの培地で3つの条件で測定されました。遊離T4は~15 pM(赤)です。ウェルあたり10のオルガノイドからのデータ(n = 4)。V-HOとT4-HOの日数を比較するための両側スチューデントt検定と、多重比較のための一元配置ANOVAおよびテューキー検定が使用されました。データは重複の平均であり、整列した散布図とその平均で表されます。*:p<0.05;**: p<0.01;: p<0.001;: p<0.0001.x 軸は、微分の日を示します。この図は14 から変更されています。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
現在のプロトコルでは、ヒトiPS細胞の取り扱い方法とその後の3Dオルガノイド培養について、さまざまな方法論的な詳細が提供されています。これには、(i)2D培養物の分離と10日後の3D肝臓オルガノイドへの発育、および(ii)3D構造の単一細胞への繊細な解離という2つの主要な重要なステップが含まれます。入手可能な情報に基づくと、これは甲状腺ホルモンの作用を研究するための3D HHOモデルの最初の報告であり、P1肝臓マウス20で最初に同定されたように、肝芽細胞様細胞14におけるDIO2のピーク発現を実証しています。
細胞に適用される足場を利用する他の多くの技術と同様に、細胞外マトリックスゲルは細胞外マトリックス21を模倣するために使用され、それによりオルガノイドの特徴的な3D構造への組み立てが容易になった。この試薬の熱に敏感な性質は、その操作の重要性を強調しています。これは、試薬を凍結し、取り扱い中に氷に浸すことの重要性を示しています。その結果、異なる細胞外マトリックスゲルを使用することも可能です22が、このプロトコルではhiPSCは足場不在プレートに付着および増殖しなかったため、3Dオルガノイドの生成と並んで、プロトコルの開始時にその適切な管理が重要な側面となっています。
HOの分化が完了した後、オルガノイドの単一細胞への生存可能な解離は、克服すべき別の大きなハードルを表しており、機械的破壊が細胞死を引き起こす可能性があるため、それまでに低品質のRNAシーケンシングデータ23。最適な結果を確実にするために、本プロトコルは、その後のバーコード化のための固定の前後に10個以上の5 細胞を解離させることで、70%を超える単一細胞生存率を達成できることを示しました。
オルガノイド7の1つの細胞型のみを記述した他の原稿とは異なり、HHOの分化には、肝細胞様細胞と胆管細胞様細胞という少なくとも2つの肝芽細胞由来細胞が含まれる。それらの形成に関与する2つの試薬、HFG24 とEGF25、および肝細胞の成熟を促進するデキサメタゾン26、および胆管細胞につながるNotchシグナル伝達を活性化するJagged-118 の組み込み。HOsの開発におけるこの絡み合ったシグナルネットワークは、初代肝細胞の長期培養の分化の低下という欠点を克服することに加えて、3D構造を達成し、 in vivo 実験を模倣することを可能にしている27。典型的な成人の肝マーカーの発現にもかかわらず、オルガノイド28の進行期における胎児マーカーの存在が依然として検出され得ることは注目に値する。実際、これはヒトの正常な肝臓の発達を反映しており、ヒトでは胎児の肝臓マーカーは通常、生後1年まで検出することができる29。
ヒトiPS細胞がHHOに発展する過程(特に、IHOや一部のHBOやHO1など、HOの未成熟期)に観察されるまれな出来事は、過剰に発達した嚢胞性構造の出現であり、プレートをシェーカーに置くと最終的には衰退しました。嚢胞性構造のこの不均衡な進行は、それまでに壊死性コアが、より頻繁な培地交換を伴うより高い灌漑30 の必要性、または過剰な嚢胞成長を排除するための少量の細胞外マトリックスゲルの追加の必要性を示唆しています。
ハイスループット薬物スクリーニングのための最後の分化期間におけるオルガノイド数の増加に焦点を当てた元の発表11とは対照的に、現在報告されている方法では、大型3Dオルガノイドの早期形成を促進し、HHOの取り扱いを容易にするためにULAプレートの使用が導入されました。これらの調整は、この簡単なプロトコルを通じて達成できる柔軟性と膨大な研究の数々を示しています。
開示事項
アントニオ・C・ビアンコは、Abbvie、Acella、Aligos、Synthonicsのコンサルタントです。他の著者は関連する開示を持っていません。
謝辞
この研究は、国立糖尿病・消化器・腎臓病研究所(NIDDK -DK58538, DK65066, DK77148;ACB)です。
資料
| Name | Company | Catalog Number | Comments |
| 10 µL Universal Pipette Tips Filtered, Low rentention, Pre-sterile | VWR | 613-6462 | All procedures |
| 1000 µL Universal Pipette Tips Filtered, Low rentention, Pre-sterile | VWR | 613-6470 | All procedures |
| 15 mL Polypropilene Conical Tube | Falcon (Corning) | 352097 | Dissociation Hepatic Organoids |
| 200 µL Universal Pipette Tips Filtered, Low rentention, Pre-sterile | VWR | 613-6465 | All procedures |
| 3,3',5-Triiodo-L-thyronine | Sigma | T2877-100 | Hepatic Organoid differentiation |
| 40 μm Cell Strainer | Corning | 431750 | Dissociation Hepatic Organoids |
| 50 mL tube | Falcon (Corning) | 352070 | All procedures |
| 6 well-plate Nunc Cell-Culture Treated Multidishes | Thermo fisher scientific | 140675 | hiPSC maintenance |
| A83-01 | R&D Systems | 2939/10 | Hepatic Organoid differentiation |
| Advanced DMEM/F12 | Gibco | 12634010 | Hepatic Organoid differentiation |
| ART Wide Bore Filtered Pipette Tips | ART | 2069GPK | All procedures |
| B27 supplement | Gibco | 17504044 | Hepatic Organoid differentiation |
| BMP7 | R&D Systems | 354-BP-010/CF | Hepatic Organoid differentiation |
| Bovine Albumin Fraction V (7.5% solution) | Gibco | 15260037 | Dissociation Hepatic Organoids |
| BSA, Fraction V, Fatty Acid Free for Tissue Culture | GoldBio | A-421-100 | Dissociation Hepatic Organoids |
| CHIR99021 | R&D Systems | 4423/10 | Hepatic Organoid differentiation |
| Corning 96-well Clear Flat Bottom Ultra-Low Attachment | Corning | 3474 | Hepatic Organoid differentiation |
| Costar 6-well Clear Flat Bottom Ultra-Low Attachment | Corning | 3471 | Hepatic Organoid differentiation |
| CS03iCTR-n3 human induced Pluripotent Stem Cell line | Cedar-sinai | hiPSC maintenance | |
| DAPT | R&D Systems | 2634/10 | Hepatic Organoid differentiation |
| dbCAMP | Millipore Sigma | D0627-100MG | Hepatic Organoid differentiation |
| Dexamethasone | R&D Systems | 1126/100 | Hepatic Organoid differentiation |
| DMEM/F12 | Gibco | 11320033 | hiPSC maintenance |
| DNAse I, RNase-free, HC | Thermo Fisher scientific | EN0523 | Dissociation Hepatic Organoids |
| Falcon 10 mL Serological Pipet, Polystyrene, 0.1 Increments, Individually Packed, Sterile | Corning | 357551 | All procedures |
| Falcon 5 mL Serological Pipet, Polystyrene, 0.1 Increments, Individually Packed, Sterile | Corning | 357543 | All procedures |
| Falcon 50 mL Serological pipet, Polystyrene, 1.0 Increments, Individually Packed, Sterile | Corning | 357550 | All procedures |
| Gentle Cell Dissociation Reagent (GCDR) | Stemcell Technologies | 100-0485 | Hepatic Organoid differentiation |
| Glutamax supplement | Gibco | 35050061 | Hepatic Organoid differentiation |
| L-Thyroxine | Sigma | T1775-1G | Hepatic Organoid differentiation |
| Matrigel hESC-Qualified Matrix, LDEV-free, 5 mL | Corning | 354277 | Extracellular matrix gel |
| mFreSR | Stemcell Technologies | 5855 | hiPSC cryopreservation medium |
| mTeSR 5x Supplement | Stemcell Technologies | 100-0276 | hiPSC medium |
| mTeSR Plus | Stemcell Technologies | 100-0276 | hiPSC medium |
| Multi Platform Shaker | Fisherbrand (Thermo Fisher technologies) | 88861021 | Hepatic Organoid differentiation |
| N2 supplement | Gibco | 17502048 | Hepatic Organoid differentiation |
| Nicotinamide | R&D Systems | 4106/50 | Hepatic Organoid differentiation |
| PBS, pH 7.4 | Gibco | 10010023 | hiPSC maintenance |
| Recombinant human BMP4 | R&D Systems | 314-BP-010/CF | Hepatic Organoid differentiation |
| Recombinant human EGF | R&D Systems | 236-EG-200 | Hepatic Organoid differentiation |
| Recombinant human FGF basic/FGF2/bFGF | R&D Systems | 233-FB-010/CF | Hepatic Organoid differentiation |
| Recombinant human FGF19 | R&D Systems | 959-FG-025/CF | Hepatic Organoid differentiation |
| Recombinant human HGF | R&D Systems | 294-HG-005/CF | Hepatic Organoid differentiation |
| Recombinant Human Jagged-1 Fc Chimera | R&D Systems | 1277-JG-050 | Hepatic Organoid differentiation |
| Recombinant human KGF/FGF7 | R&D Systems | 251-KG-010/CF | Hepatic Organoid differentiation |
| ReLeSR | Stemcell Technologies | 100-0483 | hiPSC detaching medium |
| RNAse Inhibitor Ambion, cloned, 40 U/μL | Invitrogen | AM2682 | Dissociation Hepatic Organoids |
| RNase Zap | Invitrogen | AM9780 | Dissociation Hepatic Organoids |
| Sorvall Legend XT/XF Centrifuge Series | Thermo Fisher Scientific | 75004539 | All procedures |
| STEMdiff Definitive Endoderm Kit | Stemcell Technologies | 5110 | Hepatic Organoid differentiation |
| Trypan Blue solution (0.4%) | Gibco | 15250061 | Dye solution |
| TrypLE Express Enzyme | Gibco | 12604013 | Cell Dissociation enzyme |
| Trypsin 0.5% - EDTA (10X) | Gibco | 15400054 | Dissociation Hepatic Organoids |
| Valproic acid, sodium salt | R&D Systems | 2815/100 | Hepatic Organoid differentiation |
| Vari-Mix Platform Rocker | Thermo Fisher scientific | M79735Q | Dissociation Hepatic Organoids |
| Y-27632 dihydrochloride | R&D Systems | 1254 | Hepatic Organoid differentiation |
参考文献
- Peiseler, M., et al. Immune mechanisms linking metabolic injury to inflammation and fibrosis in fatty liver disease - novel insights into cellular communication circuits. J Hepatol. 77 (4), 1136-1160 (2022).
- Gordillo, M., Evans, T., Gouon-Evans, V. Orchestrating liver development. Development. 142 (12), 2094-2108 (2015).
- Lemaigre, F. P. Mechanisms of liver development: concepts for understanding liver disorders and design of novel therapies. Gastroenterology. 137 (1), 62-79 (2009).
- He, C., et al. Liver organoids, novel and promising modalities for exploring and repairing liver injury. Stem Cell Rev Rep. 19 (2), 345-357 (2023).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Takebe, T., et al. Vascularized and functional human liver from an iPSC-derived organ bud transplant. Nature. 499 (7459), 481-484 (2013).
- Si-Tayeb, K., et al. Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells. Hepatology. 51 (1), 297-305 (2010).
- Wu, F., et al. Generation of hepatobiliary organoids from human induced pluripotent stem cells. J Hepatol. 70 (6), 1145-1158 (2019).
- Shinozawa, T., et al. High-fidelity drug-induced liver injury screen using human pluripotent stem cell-derived organoids. Gastroenterology. 160 (3), 831-846.e10 (2021).
- Ouchi, R., et al. Modeling steatohepatitis in humans with pluripotent stem cell-derived organoids. Cell Metab. 30 (2), 374-384.e6 (2019).
- Ramli, M. N. B., et al. Human pluripotent stem cell-derived organoids as models of liver disease. Gastroenterology. 159 (4), 1471-1486.e12 (2020).
- Shen, M. M. Nodal signaling: developmental roles and regulation. Development. 134 (6), 1023-1034 (2007).
- Ang, L. T., et al. A roadmap for human liver differentiation from pluripotent stem cells. Cell Rep. 22 (8), 2190-2205 (2018).
- Hidalgo-Álvarez, J., Salas-Lucia, F., Vera Cruz, D., Fonseca, T. L., Bianco, A. C. Localized T3 production modifies the transcriptome and promotes the hepatocyte-like lineage in iPSC-derived hepatic organoids. JCI Insight. 8 (23), e173780 (2023).
- . B27 Supplement Available from: https://www.weizmann.ac.il/molgen/hanna/sites/molgen.hanna/files/users/user52/HANNA-LAB-B22-B27-PROTOCOL-V3.pdf (2016)
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Zhu, X., Sun, J. CircHIPK3 regulates melanoma cell behaviors by binding with miR-215-5p to upregulate YY1. Mol Cell Probes. 53, 101644 (2020).
- Guan, Y., et al. Human hepatic organoids for the analysis of human genetic diseases. JCI Insight. 2 (17), e94954 (2017).
- Walesky, C., Apte, U. Role of hepatocyte nuclear factor 4α (HNF4α) in cell proliferation and cancer. Gene Expr. 16 (3), 101-108 (2015).
- Fonseca, T. L., et al. Hepatic inactivation of the type 2 deiodinase confers resistance to alcoholic liver steatosis. Alcohol Clin Exp Res. 43 (7), 1376-1383 (2019).
- Kleinman, H. K., Martin, G. R. Matrigel: basement membrane matrix with biological activity. Semin Cancer Biol. 15 (5), 378-386 (2005).
- Kozlowski, M. T., Crook, C. J., Ku, H. T. Towards organoid culture without Matrigel. Commun Biol. 4 (1), 1387 (2021).
- Arceneaux, D., et al. A contamination focused approach for optimizing the single-cell RNA-seq experiment. iScience. 26 (7), 107242 (2023).
- Matsumoto, K., Nakamura, T. Hepatocyte growth factor: molecular structure and implications for a central role in liver regeneration. J Gastroenterol Hepatol. 6 (5), 509-519 (1991).
- Kimura, M., Moteki, H., Ogihara, M. Role of hepatocyte growth regulators in liver regeneration. Cells. 12 (2), 208 (2023).
- Michalopoulos, G. K., Bowen, W. C., Mulè, K., Luo, J. HGF-, EGF-, and dexamethasone-induced gene expression patterns during formation of tissue in hepatic organoid cultures. Gene Expr. 11 (2), 55-75 (2003).
- Kaur, I., et al. Primary hepatocyte isolation and cultures: Technical aspects, challenges and advancements. Bioengineering (Basel). 10 (2), 131 (2023).
- Baxter, M., et al. Phenotypic and functional analyses show stem cell-derived hepatocyte-like cells better mimic fetal rather than adult hepatocytes. J Hepatol. 62 (3), 581-589 (2015).
- Blohm, M. E., Vesterling-Hörner, D., Calaminus, G., Göbel, U. Alpha 1-fetoprotein (AFP) reference values in infants up to 2 years of age. Pediatr Hematol Oncol. 15 (2), 135-142 (1998).
- Liu, Q., Zeng, A., Liu, Z., Wu, C., Song, L. Liver organoids: From fabrication to application in liver diseases. Front Physiol. 13, 956244 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved