Method Article
Оценка клиренса инсулина у мышей с помощью перфузии печени in situ
В этой статье
Резюме
Печеночный клиренс инсулина имеет решающее значение для регуляции гомеостаза глюкозы. В этой статье описана удобная процедура перфузии печени для непосредственной оценки скорости клиренса печеночного инсулина in situ у мышей.
Аннотация
Печеночный клиренс инсулина необходим для поддержания гомеостаза глюкозы и тесно связан с метаболическими нарушениями, такими как ожирение, резистентность к инсулину и диабет. Точное измерение клиренса инсулина имеет жизненно важное значение для понимания основных механизмов этих состояний. Этот протокол представляет собой простую и удобную для пользователя процедуру перфузии печени у мышей, специально разработанную для непосредственной оценки скорости клиренса печеночного инсулина. Метод включает в себя точную канюляцию воротной вены и надпеченочной нижней полой вены для создания перфузионной системы in situ , имитирующей физиологические условия. Протокол помогает исследователям пройти через каждый этап процедуры, от хирургической подготовки и настройки системы перфузии до сбора и анализа образцов. Предоставляются подробные инструкции, а также репрезентативные результаты и важные советы по оптимизации процедуры. Видеоурок сопровождает письменный протокол, предлагая визуально подробные инструкции и иллюстрации, что делает его доступным и всеобъемлющим справочником для ученых, изучающих молекулярные механизмы метаболизма и клиренса инсулина в печени.
Введение
Открытие инсулина стало одной из вех прошлого века. Много известно о регуляции синтеза, секреции и физиологических функций инсулина в метаболических тканях. Тем не менее, меньше внимания уделялось деградации инсулина и ее регуляторным механизмам. Метаболизм инсулина можно понимать как взаимодействие между функцией бета-клеток, инсулинорезистентностью (ИК) или чувствительностью и клиренсом инсулина. Наряду с секрецией инсулина, печеночный клиренс инсулина играет решающую роль в поддержании гомеостатического уровня инсулина, необходимого для достижения периферических тканей-мишеней и содействия правильномудействию инсулина. Многочисленные исследования определили нарушение клиренса инсулина как решающий фактор в патогенезе гиперинсулинемии при метаболическом синдроме, а также при других состояниях, таких как сахарный диабет 2 типа 2,3, неалкогольный стеатогепатит4 и синдром поликистозных яичников5. Таким образом, гиперинсулинемия, вторичная по отношению к сниженному клиренсу, может играть роль в патогенезе метаболических заболеваний. Стратегии, которые улучшают клиренс инсулина, могут обратить вспять неблагоприятные последствия гиперинсулинемии у этих людей.
Инсулин имеет уникальную схему распределения. Уровень циркулирующего плазменного инсулина зависит от равновесия между секрецией и выведением инсулина. Поджелудочная железа пульсирующим образом выделяет инсулин в воротную вену, направляя его к гепатоцитам. Будучи первым органом, который сталкивается с секрецией инсулина, печень разрушает большую часть инсулина во время его первого прохождения, составляя 60-70% от общего количестваинсулина6. Оставшийся инсулин выводится из печени через печеночную вену, попадая в системный кровоток, где он частично используется периферическими тканями (в первую очередь мышцами, жировой тканью и почками) перед дальнейшим извлечением печенью во время его второго прохождения через печеночнуюартерию.
Точное измерение клиренса инсулина имеет решающее значение. Прямое измерение клиренса печеночного инсулина в исследованиях на людях является сложной задачей, поскольку получение образцов крови из воротных и печеночных вен затруднено. Для оценки клиренса инсулина у людей и животных моделей используются как прямые, так и косвенные методы. Для косвенного измерения клиренса инсулина используются примерно три стратегии. Наиболее часто используемые в клинической практике оценки включают методы, основанные на молярном соотношении С-пептид/инсулин8. Этот подход основан на эквимолярной секреции обоих пептидов и отсутствии экстракции С-пептидов печенью9. Вторая группа методов основана на математическом анализе кривых распада инсулина в плазме крови после известного и специфического ввода гормона в кровоток 2,10,11. Третий метод основан на том, что вливание инсулина с постоянной скоростью приводит к стабильному уровню гормона в крови, где скорость выведения соответствует скорости введения12. Эти косвенные методы в первую очередь отражают общий клиренс инсулина в организме. Учитывая, что печень является основным местом клиренса инсулина и играет решающую роль в этом процессе, важно непосредственно оценить печеночный клиренс инсулина.
В предыдущих исследованиях непосредственно измеряли экстракцию инсулина в печени у здоровых собак13,14. В исследованиях также использовалась изолированная перфузированная модель печени крысы для оценки экстракции инсулина из печени15,16. Благодаря высокой доступности генетически модифицированных штаммов, мыши служат ценными моделями для исследования молекулярных путей. В нескольких исследованиях17 перфузия печени использовалась для непосредственной оценки печеночного клиренса инсулина на мышиной модели. В этих исследованиях перфузат, содержащий человеческий инсулин, вводится в воротную вену и собирается из нижней полой вены. Доля инсулина, поглощаемого печенью, указывает на его клиренс. Метод перфузии печени поддерживает печень в условиях, близких к физиологическим, путем циркуляции теплого, насыщенного кислородом и обогащенного питательными веществами перфузата через сосудистую сеть печени. Тем не менее, нет достаточных практических указаний и важных советов по продвижению и распространению этой техники.
Таким образом, в то время как печеночный клиренс инсулина привлекает все больше внимания, его роль в расстройствах, а также его молекулярные механизмыостаются неясными. Поэтому в области научных исследований очень нужны передовые методики. Этот протокол устанавливает детальную процедуру модифицированной перфузии печени у мышей для оценки клиренса печеночного инсулина. Кроме того, этот метод также может быть использован для изучения влияния лекарств на печень, включая эффект первого прохождения, процессы транспортировки лекарств и различные другие аспекты.
протокол
Этот протокол был одобрен Комитетом по уходу за животными и их использованию Нанкинским медицинским университетом (IACUC-2105018) и соответствует рекомендациям Комитета по институциональному уходу за животными и их использованию. Все мыши C57BL/6N содержались в 12-часовом цикле свет/темнота со свободным доступом к пище и воде. Шестинедельные мыши были случайным образом разделены на группу диеты Чау (CD) и группу диеты с высоким содержанием жиров (HFD). Группа HFD получала пищу с 60% высоким содержанием жиров и продолжала придерживаться этой диеты до 10-недельного возраста. Средняя масса тела составила 28,55 г ± 1,2 г в группе HFD и 24,3 г ± 0,48 г в контрольной группе. Подробная информация о реагентах и оборудовании, использованных в этом исследовании, приведена в Таблице материалов.
1. Подготовка
- Выполняйте необходимую стерилизацию хирургических инструментов и расходных материалов с помощью автоклавирования.
- Положите на операционный стол хирургические инструменты, шелковый шовный материал 6-0, стерильный маленький ватный аппликатор, инъекцию хлорида натрия (500 мл), ватные палочки и губки.
- Приготовьте 30 мл гепаринизированного физиологического раствора с конечной концентрацией 200 МЕ/мл.
- Подготовьте две силиконовые трубки с внутренним диаметром 0,31 мм и внешним диаметром 0,64 мм; Один длиной 4 см для использования в качестве катетера воротной вены, а другой 10 см в длину для использования в качестве катетера нижней полой вены.
- Приготовьте перфузионный буфер Krebs-Henseleit (KRBH), содержащий 5,0 ммоль/л глюкозы и 0,25% BSA.
- Приготовьте перфузионный буфер Krebs-Henseleit (KRBH), содержащий 5,0 ммоль/л глюкозы, 0,25% BSA и 4,0 нг/мл человеческого инсулина.
- Настройте систему перфузии печени. На рисунке 1 представлены основные компоненты системы перфузии печени.
2. Хирургическая катетеризация
- Приготовьте обезболивающую смесь, выполнив следующие действия:
- Развести Золетил 50 (250 мг/5 мл) в 10 раз с 0,9% раствором натрия хлорида.
- Ксилазина гидрохлорид (200 мг/2 мл) развести в 10 раз с 0,9% раствором натрия хлорида.
- Смешайте 0,5% раствор Zoletil 50 с 1% раствором гидрохлорида ксилазина в соотношении 1:1.
- Обезболите мышей.
- Проверьте и запишите вес тела мыши. Вводят смесь анестетиков путем внутрибрюшинного введения в дозе 5 мл/кг массы тела (2,5 мг/мл Золетил 50; 5 мг/мл ксилазина гидрохлорида). Начало анестезии обычно происходит в течение 5-10 минут после инъекции, о чем свидетельствует потеря выпрямляющего рефлекса и снижение реакции на внешние раздражители.
- Перенесите мышь на операционный стол. Закрепите конечности с помощью скотча. Вводите 2,5 ЕД/г гепарина внутрибрюшинно для достижения гепаринизации.
- С помощью электробритвы подстригите шерсть на коже живота и продезинфицируйте участок раствором повидон-йода.
- Провести катетеризацию воротной вены.
- Сделайте продольный разрез на 4 см от нижней части живота в сторону мечевидного отростка по средней линии живота. Аккуратно разрежьте брюшину ножницами, чтобы не повредить висцеральные органы. Вставьте брюшной ретрактор мыши, чтобы обнажить операционное поле.
- Сдвиньте кишечник вправо, чтобы открыть воротную вену, правую почку и нижнюю полую вену (рисунок 2A). С помощью артериальных щипцов зажмите полую вену у верхнего края почки.
- Изолируйте воротную вену (рис. 2A) и перевяжите дистальный конец шелковым швом 6-0. Неплотно завяжите еще один шов на проксимальном конце оголенного сосуда.
- Сделайте надрез возле перевязанного конца пружинными ножницами и вставьте катетер. Продвигайте катетер через разрез до уровня бифуркации портала.
- Закрепите обе лигатуры вокруг катетера и подтвердите правильность забора проб, подключив свободный конец катетера к шприцу для забора проб. Промойте гепаринизированным физиологическим раствором и зажмите катетер (рисунок 2C).
- Снимите тракционное устройство и внушите кишечник. Накройте операционную область стерильной марлей, пропитанной солевым раствором, или ватой.
- Провести катетеризацию надпеченочной нижней полой вены.
- Сделайте разрез вдоль грудины из мечевидного отростка, обнажая грудину.
- Вертикально разрежьте грудину и прорежьте диафрагму по краю ребра, чтобы обнажить грудную полость.
- Обнажите и изолируйте надпеченочную нижнюю полую вену (рис. 2B). Аккуратно перевязайте дистальный конец шелковым швом 6-0. Неплотно завяжите еще один шов на проксимальном конце сосуда.
- Сделайте разрез чуть ниже перевязанного конца пружинными ножницами и вставьте катетер длиной 10 см. Продвигайте катетер до тех пор, пока кончик катетера не приблизится к печени, и надежно завяжите обе лигатуры. Подтвердите правильность отбора проб и зажмите свободный конец катетера (рисунок 2D).
- Промойте операционную область солевым раствором. Накройте поверхность стерильной марлей, пропитанной солевым раствором.
3. Перфузия печени
- Усыпьте мышь с помощью передозировки анестетика и торакотомии в соответствии с институциональными рекомендациями по уходу за животными и их использованию, гарантируя, что все процедуры выполняются таким образом, чтобы свести к минимуму страдания.
- Настройте систему перфузии печени, которая включает в себя оксигенатор, устройство модуляции температуры, инфузионный насос и инфузионные трубки, как показано на рисунке 1.
- Обеспечивают непрерывный поток газа 95% кислорода и 5% углекислого газа в оксигенатор.
- Включите водяную баню и прогрейте комнату органа до 37 °C.
- Приготовьте перфузионный буфер KRBH с инсулином и без него. Загрунтуйте систему трубок с перфузионным буфером, инкубированным в водяной бане при температуре 37 °C.
ПРИМЕЧАНИЕ: KRBH не содержит BSA и глюкозы. Перфузионный буфер KRBH без человеческого инсулина содержит 5,0 ммоль/л глюкозы и 0,25% BSA, в то время как перфузионный буфер KRBH с человеческим инсулином содержит 5,0 ммоль/л глюкозы, 0,25% BSA и 4,0 нг/мл человеческого инсулина. - Поместите мышь в контейнер с температурой окружающей среды, поддерживаемой на уровне около 37 °C. Используйте греющую подушечку, чтобы поддерживать температуру тела на уровне 37 °C.
- Введите буфер KRBH через катетер воротной вены. Установите скорость инфузии на уровне 0,2 мл/мин с помощью мини-помпы.
- Обратите внимание, что печень бледнеет в течение нескольких секунд, что указывает на то, что перфузионный буфер протекает через печень. Чтобы вымыть больше оставшихся клеток крови в печени, приостановите инфузию на 1 минуту через 4 и 8 минут, начав время с начала перфузии.
- Перфузируйте печень буфером KRBH в течение 10 минут (без учета двух пауз по 1 минуте), что соответствует периоду равновесия. Соберите базальный образец из катетера нижней полой вены.
- Перфузируйте печень тем же раствором, обогащенным инсулином (4,0 нг/мл человеческого инсулина) еще на 30 мин.
- Отбирайте все образцы из нижней полой вены каждые 2 минуты.
- Запишите вес печени после перфузии. Соберите образцы печени из разных долей, сразу заморозьте их в жидком азоте, а затем перенесите на хранение при температуре -80 °C.
- Центрифугируйте все собранные образцы перфузии при температуре ~1 000 x g в течение 10 минут при 4 °C. Соберите надосадочную жидкость и перенесите их на хранение при температуре -80 °C.
ПРИМЕЧАНИЕ: Концентрация инсулина в образцах перфузии измеряется с помощью наборов иммуноферментного анализа человека (ИФА). - После процедуры убедитесь, что все биологические отходы утилизированы в соответствии с правилами безопасности.
4. Анализ данных
- Представьте данные в виде графиков XY, показывающих выход концентрации инсулина с течением времени.
- Рассчитайте среднюю скорость клиренса печеночного инсулина (HICRAVE) по следующей формуле:
HICRAVE = (1−Cf/Ci) × 100%
где Ci = начальная концентрация инсулина в инфузионном буфере, Cf = конечная средняя концентрация инсулина за последние 10 мин из надпеченочной нижней полой вены.
Результаты
В этом протоколе описана процедура инфузии печени для непосредственного расчета клиренса печеночного инсулина. Эта модель надежна и воспроизводима. Пример результатов, полученных в результате эксперимента, показан на рисунке 3. После 10-минутного периода равновесия буфер KRBH с добавлением 4,0 нг/мл человеческого инсулина перфузировали через воротную вену в течение 30 минут. Перфузионную жидкость собирали из катетера в надпеченочную нижнюю полую вену с интервалом в 2 минуты, и измеряли концентрацию человеческого инсулина в перфузионной жидкости. Результаты представлены здесь в виде среднего ± SEM. Пример эксперимента по перфузии печени, в котором сравнивались мыши на контрольной диете (CD) с мышами на диете с высоким содержанием жиров (HFD), показан на рисунке 3. Скорость клиренса печеночного инсулина (HICRAVE) составила 55,57% ± 4,43% в группе БК и 25,37% ± 6,83% в группе HFD (рис. 3B). Результаты показывают, что кормление с высоким содержанием жиров приводит к нарушению клиренса инсулина.
После перфузии были получены образцы печени для окрашивания гематоксилином и эозином (ПЭ) и сканирования всего предметного стекла; Были собраны хорошо перфузированная печень, плохо перфузированная печень и контрольный образец печени от нормальной мыши. При улучшении условий перфузии структура ткани печени была нормальной, печеночные канатики располагались радиально и аккуратно, гепатоциты были неповрежденными по форме, цитоплазма была равномерно окрашена, а ядро было чистым и круглым, почти неотличимым от ядра нормальной печени (рис. 4А, В). При слабой перфузии гепатоциты были отечными и заметно рыхлыми, с точечным некрозом вокруг центральных вен, вакуолярной дегенерацией в цитоплазме, ядерным пикнозом и отслойкой сосудов (рис. 4C). Уровни аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) в перфузате определяли на исходном уровне и после перфузии для оценки функции гепатоцитов. Результаты показали, что существенной разницы между уровнями АЛТ и АСТ не было (рисунок 4D).
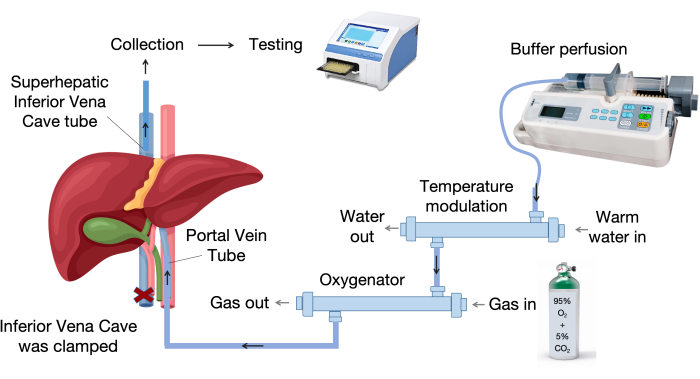
Рисунок 1: Компоненты перфузионной системы. Перфузионная система состоит из ключевых компонентов, включая инфузионный насос, блок контроля температуры и оксигенатор. Устройство с переменной температурой поддерживает температуру перфузионной жидкости на уровне 37 °C, в то время как мембранный оксигенатор использует полипропиленовые полые волокна для эффективного газообмена. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Анатомическое расположение и катетеризация. (А,Б) Изображены анатомические места расположения воротной вены и нижней полой вены. (C) Катетер воротной вены располагается чуть ниже разветвления на левую и правую ветви печени, а на внутрипеченочную нижнюю полую вену накладывается сосудистый зажим. (D) Катетер вводится в надпеченочную нижнюю полую вену и размещается рядом с верхним краем печени. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
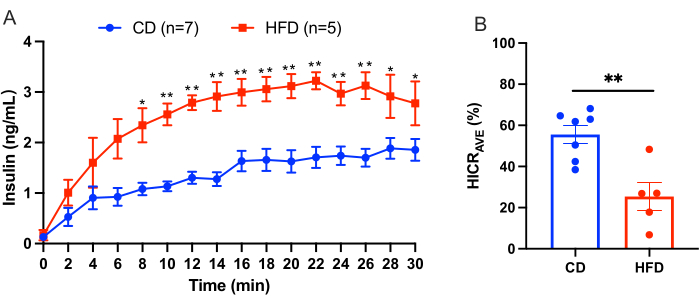
Рисунок 3: Результаты эксперимента по перфузии печени. Результаты эксперимента по перфузии печени, в котором сравнивались мыши на контрольной диете (CD) с мышами на диете с высоким содержанием жиров (HFD). (A) Концентрации инсулина во время перфузии печени у мышей с БК (синий, n = 7) по сравнению с мышами с HFD (красный, n = 5). (B) Средняя скорость клиренса печеночного инсулина (HICRAVE). Статистическая значимость обозначена как ±*p < 0,05, **p < 0,01 по сравнению с мышами CD, проанализированными с помощью непарного t-критерия. Полученные данные свидетельствуют о том, что кормление с высоким содержанием жиров приводит к нарушению клиренса инсулина. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Влияние перфузии на гистологию и функцию печени. (A) Нормальная морфология печени мыши (контроль). (B) Морфология печени в условиях усиленной перфузии. (C) Морфология печени в условиях субоптимальной перфузии. Красная стрелка указывает на отслойку сосуда, черная стрелка обозначает вакуолизацию, а зеленая стрелка выделяет пикноз ядра. Увеличение: 40x. (D) Уровни аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) в перфузате, измеренные на исходном уровне и после перфузии. Для анализа использовался метод парного t-критерия . Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Критические шаги в протоколе
Описанные выше хирургические процедуры должны выполняться с бережной осторожностью, чтобы избежать образования каких-либо повреждений в печени. Кроме того, хрупкая структура стенки сосуда вены печени делает его уязвимым для прокола и последующего кровотечения, если с ним не обращаться осторожно во время канюляции. В этом протоколе используются более мягкие силиконовые трубки, чтобы свести к минимуму повреждение кровеносных сосудов. Рекомендуется, чтобы катетеризация выполнялась опытным хирургом, который должен практиковаться часто, чтобы увеличить вероятность успеха интубации и свести к минимуму продолжительность процедуры.
Операционное поле следует время от времени орошать теплым физиологическим раствором для поддержания жизнеспособности гепатоцитов. Во время перфузии операционная область должна быть экранирована стерильной марлей или ватой. Эта практика предотвращает длительное воздействие воздуха, которое потенциально может нарушить функцию гепатоцитов.
Проблемы и решения
Очень важно расположить кончик катетера непосредственно перед точкой, в которой воротная вена разветвляется на левую и правую воротные вены печени. Если катетер введен слишком глубоко, может произойти неравномерная перфузия между долями печени. Кроме того, следует тщательно избегать появления пузырьков воздуха во время процесса инфузии, так как они могут вызвать воздушную эмболию в печени. Это может значительно повлиять на перфузию жидкости, достигающей гепатоцитов, и впоследствии повлиять на клиренс инсулина.
Первые 10 минут инфузии буфера KH представляют собой период равновесия, в течение которого перфузия может быть приостановлена 1-2 раза на 2 минуты каждый раз, чтобы как можно больше промыть остаточные клетки крови в печеночный синусоид. Если после 15 минут непрерывной перфузии в собранном образце наблюдается кровь, это может указывать на то, что сосудистые щипцы на нижней полой вене печени расположены неправильно и должныбыть проверены. Если инфузия приостановлена, при возобновлении инфузии в собранном образце могут появиться эритроциты из-за остаточных клеток крови в печеночных синусоидах. Эритроциты должны быть разделены с помощью центрифугирования перед измерением инсулина, так как присутствие ферментов, разрушающих инсулин в этих клетках, может потенциально повлиять на уровень инсулина.
Продолжительность хирургической катетеризации, время ишемии и реперфузии печени и количество газа, поступающего в воротную вену во время перфузии, могут влиять на функцию гепатоцитов и, таким образом, на скорость клиренса инсулина печенью. Степень дисфункции печени можно контролировать путем измерения уровней содержания аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), лактатдегидрогеназы (ЛДГ) и щелочной фосфатазы (ЩФ), а также с помощью окрашивания H&E. Исследования показали, что после успешной операции печень продолжает функционировать и реагировать в течение как минимум 3 ч19 мин.
Важность и потенциальные области применения перфузии печени у мышей
Мыши являются идеальными объектами исследований благодаря их генетическому сходству с человеком, коротким репродуктивным циклам и наличиюпередовых инструментов генной инженерии. На мышиных моделях клиренс инсулина можно оценить с помощью нескольких методов. Во время внутрибрюшинного глюкозотолерантного теста (ИПГТТ) печеночный клиренс инсулина измеряется как отношение площади под кривой (AUC) (рассчитывается трапециевидным методом) С-пептида к инсулину21. Во время зажима эуглицемиче-гиперинсулинемии соотношение между скоростью инфузии экзогенного инсулина и результирующей концентрацией инсулина в равновесном состоянии в плазме может быть использовано в качестве метода оценки клиренса инсулина косвенно22. Тем не менее, все эти методы косвенно оценивают печеночный клиренс инсулина.
Некоторые исследователи также используют клеточные анализы для оценки деградации инсулина. Клетки HepG2 или первичные гепатоциты мышей высевают в культивальные планшеты и добавляют соответствующую концентрацию человеческого инсулина. Образцы питательной среды отбирают через определенные промежутки времени для измерения концентрации инсулина человека и оценки его деградации с течением времени. В этом протоколе описана удобная для пользователя процедура перфузии печени in situ у мышей для непосредственной оценки скорости клиренса печеночного инсулина. По сравнению с исследованиями in vitro с использованием изолированных гепатоцитов, перфузия печени имеет преимущества сохранения архитектуры печени, зонального деления, полярности и целостности сосудов.
Система перфузии печени мышей является ценным инструментом для исследования динамики и молекулярных механизмов метаболизма инсулина в печени. Кроме того, этот протокол может быть широко использован не только в моделях предварительно индуцированного заболевания, но и в тестировании острых стимулов. Однако эта методика ограничена тем, что ее следует выполнять на месте. Этот протокол включает в себя модифицированную технику хирургической катетеризации, которая сводит к минимуму травмирование и сохраняет анатомическую целостность печени в максимально возможной степени. Необходимы дальнейшие усилия для наилучшего использования этой технологии для выяснения механизмов клиренса инсулина, особенно при метаболических заболеваниях, связанных с инсулинорезистентностью.
Раскрытие информации
О конфликте интересов заявлено не было.
Благодарности
Работа выполнена при поддержке Национального фонда естественных наук Китая (82200948, 82270921, 82170882).
Материалы
| Name | Company | Catalog Number | Comments |
| 60% high-fat diet | Research Diets, USA | D12492 | |
| Alanine aminotransferase Assay Kit | Nanjing Jiancheng Bioengineering Institute | C009-2-1 | |
| Anhydrous Glucose | Sangon Biotech | 50-99-7 | 500 G |
| Aspartate aminotransferase Assay Kit | Nanjing Jiancheng Bioengineering Institute | C010-2-1 | |
| Bovine Serum Albumin | GeminiBio | 700-107P | Fatty Acid-Free |
| Contour TS Blood Glucose Meter | Bayer | PH220800019 | |
| Contour TS Blood Glucose Test Strips | Bayer | DP38M3F05A | |
| Heparin Sodium | Changzhou Qian hong Bio-pharma | H32022088 | 12500 U/2mL |
| Human insulin | Novo Nordisk | S20191007 | 300 U/3mL |
| Human insulin immunoassay kit | Ezassay Biotechnology | HM200 | |
| KRBH buffer (Sugar, BSA free) | coolaber | SL65501 | 500 mL |
| Membrane oxygenator | Xi'an Xijing Medical Appliance | 5 | |
| Microscopic scissors | Shanghai Jinzhong | YBC020 | |
| Micro-serrefine clamp | Ningbo Medical Needle | 180709 | |
| Microsurgery forceps | Shanghai Jinzhong | WA3010, WA3020 | |
| Needle type filter | N-buliv | LG05-133-2 | |
| Povidone-iodine Solution | Shanghai likang Disinfectant Hi-Tech | 20231016J | |
| pump 11 Elite | Harvard Apparatus | PC5 70-4500 | |
| Retractor | Globalebio (Beijing) Technology | GEKK-10mm | 10 mm |
| Silicone Tubing | scientific commodities | #BB518-12 | 0.31 mm × 0.64 mm |
| Silicone Tubing | Fisher Scientific | #11-189-15A | ID 0.5 mm |
| Sodium Chloride Injection | Baxter | S2402023 | 4.5 g/500 mL |
| Surgical silk suture | Yangzhou Huanyu Medical Equipment | 6-0 | |
| Temperature modulation | Xi'an Xijing Medical Appliance | 6 | |
| Thermostatic water bath | Jiaxing Junsi Electronics | HIH-1 | 220 V 50 HZ |
| Three-way Joint | YISAI | AQTCY1.6 | ID 0.4 mm |
| Xylazine Hydrochloride Injection | ShengXin | 20240106 | 200 mg/2mL |
| Zoletil 50 | Virbac | WK001 | 250 mg/5mL |
Ссылки
- Najjar, S. M., Perdomo, G. Hepatic insulin clearance: Mechanism and physiology. Physiology (Bethesda). 34 (3), 198-215 (2019).
- Fu, Z., et al. Impaired insulin clearance as the initial regulator of obesity-associated hyperinsulinemia: Novel insight into the underlying mechanism based on serum bile acid profiles. Diabetes Care. 45 (2), 425-435 (2022).
- Koh, H. E., Cao, C., Mittendorfer, B. Insulin clearance in obesity and type 2 diabetes. Int J Mol Sci. 23 (2), 596(2022).
- Bril, F., et al. Relationship between disease severity, hyperinsulinemia, and impaired insulin clearance in patients with nonalcoholic steatohepatitis. Hepatology. 59 (6), 2178-2187 (2014).
- Herman, R., Sikonja, J., Jensterle, M., Janez, A., Dolzan, V. Insulin metabolism in polycystic ovary syndrome: Secretion, signaling, and clearance. Int J Mol Sci. 24 (4), 3140(2023).
- Najjar, S. M., Caprio, S., Gastaldelli, A. Insulin clearance in health and disease. Annu Rev Physiol. 85, 363-381 (2023).
- Polidori, D. C., Bergman, R. N., Chung, S. T., Sumner, A. E. Hepatic and extrahepatic insulin clearance are differentially regulated: Results from a novel model-based analysis of intravenous glucose tolerance data. Diabetes. 65 (6), 1556-1564 (2016).
- Castillo, M. J., Scheen, A. J., Letiexhe, M. R., Lefebvre, P. J. How to measure insulin clearance. Diabetes Metab Rev. 10 (2), 119-150 (1994).
- Rubenstein, A. H., Pottenger, L. A., Mako, M., Getz, G. S., Steiner, D. F. The metabolism of proinsulin and insulin by the liver. J Clin Invest. 51 (4), 912-921 (1972).
- Terris, S., Steiner, D. F. Binding and degradation of 125i-insulin by rat hepatocytes. J Biol Chem. 250 (21), 8389-8398 (1975).
- Ooms, H. A., Arnould, Y., Rosa, U., Pennisi, G. F., Franckson, J. R. Total metabolic clearance of crystalline insulin and radio-iodide substitued insulin. Pathol Biol. 16 (5), 241-245 (1968).
- Defronzo, R. A., Tobin, J. D., Andres, R. Glucose clamp technique: A method for quantifying insulin secretion and resistance. Am J Physiol. 237 (3), E214-E223 (1979).
- Asare-Bediako, I., et al. Assessment of hepatic insulin extraction from in vivo surrogate methods of insulin clearance measurement. Am J Physiol Endocrinol Metab. 315 (4), E605-E612 (2018).
- Kim, S. P., Ellmerer, M., Kirkman, E. L., Bergman, R. N. Beta-cell "rest" accompanies reduced first-pass hepatic insulin extraction in the insulin-resistant, fat-fed canine model. Am J Physiol Endocrinol Metab. 292 (6), E1581-E1589 (2007).
- Kotsis, T., et al. Insulin metabolism and assessment of hepatic insulin extraction during liver regeneration. A study in a rat model. J Invest Surg. 33 (1), 69-76 (2020).
- Mondon, C. E., Olefsky, J. M., Dolkas, C. B., Reaven, G. M. Removal of insulin by perfused rat liver: Effect of concentration. Metabolism. 24 (2), 153-160 (1975).
- Tamaki, M., et al. The diabetes-susceptible gene SLC30A8/ZnT8 regulates hepatic insulin clearance. J Clin Invest. 123 (10), 4513-4524 (2013).
- Ghadieh, H. E., Gastaldelli, A., Najjar, S. M. Role of insulin clearance in insulin action and metabolic diseases. Int J Mol Sci. 24 (8), 7156(2023).
- Winther-Sorensen, M., Kemp, I. M., Bisgaard, H. C., Holst, J. J., Wewer Albrechtsen, N. J. Hepatic glucose production, ureagenesis, and lipolysis quantified using the perfused mouse liver model. J Vis Exp. 200, e65596(2023).
- Rydell-Tormanen, K., Johnson, J. R. The applicability of mouse models to the study of human disease. Methods Mol Biol. 1940, 3-22 (2019).
- Zaidi, S., et al. Loss of ceacam1 in hepatocytes causes hepatic fibrosis. Eur J Clin Invest. 54 (7), e14177(2024).
- Piccinini, F., Bergman, R. N. The measurement of insulin clearance. Diabetes Care. 43 (9), 2296-2302 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены
Мы используем файлы cookie для улучшения качества работы на нашем веб-сайте.
Продолжая пользоваться нашим веб-сайтом или нажимая кнопку «Продолжить», вы соглашаетесь принять наши файлы cookie.