Method Article
In Situ Liver Perfusion을 통한 마우스의 인슐린 제거율 평가
요약
간 인슐린 청소는 포도당 항상성을 조절하는 데 중요합니다. 이 기사는 마우스의 현장 간 인슐린 제거율을 직접 평가하기 위한 사용자 친화적인 간 관류 절차에 대해 설명합니다.
초록
간 인슐린 청소는 포도당 항상성을 유지하는 데 필수적이며 비만, 인슐린 저항성 및 당뇨병과 같은 대사 장애와 밀접한 관련이 있습니다. 인슐린 제거율의 정확한 측정은 이러한 상태의 기저 메커니즘을 이해하는 데 매우 중요합니다. 이 프로토콜은 생쥐에서 간단하고 사용자 친화적인 간 관류 절차를 제공하며, 특히 간 인슐린 제거율을 직접 평가하도록 설계되었습니다. 이 방법은 문맥과 간상정맥을 정밀하게 캐뉼레이션하여 생리학적 조건을 모방하는 현장 관류 시스템을 만드는 것을 포함합니다. 이 프로토콜은 수술 준비 및 관류 시스템 설정부터 검체 채취 및 분석에 이르기까지 절차의 모든 단계를 통해 연구원을 안내합니다. 자세한 지침과 함께 대표적인 결과 및 절차를 최적화하기 위한 중요한 팁이 제공됩니다. 서면 프로토콜과 함께 제공되는 비디오 자습서는 시각적으로 심층적인 지침과 그림을 제공하여 간 인슐린 대사 및 제거의 이면에 있는 분자 메커니즘을 탐구하는 과학자들이 접근 가능하고 포괄적인 참고 자료가 될 수 있습니다.
서문
인슐린의 발견은 지난 세기의 이정표 중 하나가 되었습니다. 인슐린 합성, 분비 및 대사 조직에서의 생리적 기능 조절에 대해서는 많이 알려져 있습니다. 그러나 인슐린 분해와 그 조절 메커니즘에 대한 관심은 적었습니다. 인슐린 대사는 베타 세포 기능, 인슐린 저항성(IR) 또는 민감성, 인슐린 제거 사이의 상호 작용으로 이해할 수 있습니다. 인슐린 분비와 함께 간 인슐린 청소는 말초 표적 조직에 도달하는 데 필요한 인슐린의 항상성 수준을 유지하고 적절한 인슐린 작용을 촉진하는 데 중요한 역할을 합니다1. 여러 연구에서 인슐린 제거 장애가 대사 증후군에서 고인슐린혈증의 발병기전에서 중요한 요인으로 확인되었으며, 제2형 당뇨병 2,3, 비알코올성 지방간염4, 다낭성 난소 증후군5과 같은 다른 질환에서도 확인되었습니다. 따라서, 청소율 감소에 이차적으로 발생하는 고인슐린혈증은 대사 질환의 발병에 중요한 역할을 할 수 있습니다. 인슐린 제거율을 개선하는 전략은 이러한 개인에게 고인슐린혈증의 바람직하지 않은 영향을 되돌릴 수 있는 잠재력을 가지고 있습니다.
인슐린은 독특한 분포 패턴을 가지고 있습니다. 순환하는 혈장 인슐린의 수치는 인슐린 분비와 제거 사이의 평형에 따라 달라집니다. 췌장은 박동성 방식으로 인슐린을 문맥으로 분비하여 간세포로 보냅니다. 인슐린 분비를 접하는 첫 번째 기관인 간은 첫 번째 통과 과정에서 대부분의 인슐린을 저하시켜 전체 인슐린의 60%-70%를 차지합니다6. 나머지 인슐린은 간정맥을 통해 간을 빠져나와 전신 순환계로 들어가 말초 조직(주로 근육, 지방 조직 및 신장)에 의해 부분적으로 활용된 후 간동맥7을 두 번째 통과하는 동안 간에서 추가로 추출됩니다.
인슐린 제거율의 정확한 측정은 매우 중요합니다. 인간 연구에서 간 인슐린 청소율을 직접 측정하는 것은 문맥과 간 정맥에서 혈액 샘플을 채취하는 것이 어렵기 때문에 어렵습니다. 직접 및 간접 방법 모두 인간과 동물 모델에서 인슐린 제거율을 추정하는 데 사용됩니다. 인슐린 청소율을 간접적으로 측정하기 위해 대략 세 가지 전략이 사용됩니다. 임상실습에서 가장 빈번하게 활용되는 평가는 C-펩타이드/인슐린 몰비8에 기초한 방법과 관련이 있다. 이 접근법은 두 펩타이드의 등몰 분비와 간에서 C-펩타이드 추출이 없다는 점에 근거합니다9. 방법의 두 번째 그룹은 순환 2,10,11에 호르몬의 알려진 특정 입력 후 인슐린의 혈장 붕괴 곡선의 수학적 분석에 따라 달라집니다. 세 번째 방법은 일정한 비율로 인슐린을 주입하면 혈액 내 호르몬의 수치가 안정되어 제거율이 투여 비율12와 일치한다는 사실에 기초합니다. 이러한 간접 방법은 주로 신체의 전반적인 인슐린 청소를 반영합니다. 간이 인슐린 청소의 주요 부위이고 이 과정에서 중요한 역할을 한다는 점을 감안할 때 간 인슐린 청소를 직접 평가하는 것이 필수적입니다.
이전 연구에서는 건강한 개에서 간 인슐린 추출을 직접 측정했습니다 13,14. 연구에서는 또한 간에서 인슐린 추출을 평가하기 위해 분리된 관류된 쥐 간 모델을 사용했습니다15,16. 유전자 변형 균주의 가용성이 높기 때문에 마우스는 분자 경로를 조사하기 위한 귀중한 모델 역할을 합니다. 일부 연구에서는17 마우스 모델에서 간 인슐린 청소율을 직접 평가하기 위해 간 관류를 활용했다. 이 연구에서는 인간 인슐린을 함유한 관류물을 문맥에 주입하고 하대정맥에서 수집합니다. 간에서 흡수되는 인슐린의 비율은 간이 인슐린의 청소율을 나타냅니다. 간 관류 기술은 간 혈관 조직을 통해 따뜻하고 산소가 공급되며 영양이 풍부한 관류물을 순환시켜 간을 거의 생리학적 상태로 유지합니다. 그러나 이 기술을 발전시키고 보급하기 위한 실용적인 지침과 필수 팁이 충분하지 않습니다.
따라서, 간 인슐린 제거율은 점점 더 많은 주목을 받고 있지만, 분자 메커니즘뿐만 아니라 장애에 대한 인슐린 제거의 역할은 여전히 불분명하다18. 따라서 과학 연구 분야에서는 첨단 기술이 크게 필요합니다. 이 프로토콜은 간 인슐린 청소율을 평가하기 위해 마우스에서 세부적으로 수정된 간 관류 절차를 수립합니다. 또한 이 방법은 1차 통과 효과, 약물 수송 과정 및 기타 다양한 측면을 포함하여 간에 대한 약물의 효과를 연구하는 데에도 사용할 수 있습니다.
프로토콜
이 프로토콜은 난징 의과대학 동물 관리 및 사용 위원회(IACUC-2105018)의 승인을 받았으며 기관 동물 관리 및 사용 위원회의 지침을 따랐습니다. 모든 C57BL/6N 마우스는 음식과 물을 자유롭게 이용할 수 있는 12시간 라이트/다크 사이클로 유지되었습니다. 6주 된 쥐는 차우 다이어트(CD) 그룹과 고지방 다이어트(HFD) 그룹으로 무작위로 나뉘었습니다. HFD 그룹은 60%의 고지방 식단을 먹었고 생후 10주까지 이 식단을 계속했습니다. 평균 체중은 HFD 그룹이 28.55g ± 1.2g, 대조군이 24.3g ± 0.48g이었다. 이 연구에 사용된 시약 및 장비의 세부 정보는 재료 표에 나열되어 있습니다.
1. 준비
- 오토클레이브를 통해 수술 기구 및 소모품에 대한 필수 멸균을 수행합니다.
- 수술 기구, 6-0 실크 봉합사, 멸균 소형 면 어플리케이터, 염화나트륨 주사(500mL), 면봉, 스폰지를 수술대에 적당히 놓습니다.
- 최종 농도가 200 IU/mL인 헤파린 식염수 30 mL를 준비합니다.
- 내경이 0.31mm이고 외경이 0.64mm인 두 개의 실리콘 튜브를 준비합니다. 하나는 문맥 카테터로 사용하기 위한 4cm 길이이고 다른 하나는 하대정맥 카테터로 사용하기 위한 10cm 길이입니다.
- 5.0mmol/L 포도당과 0.25% BSA를 함유한 Krebs-Henseleit(KRBH) 관류 완충액을 준비합니다.
- 5.0mmol/L 포도당, 0.25% BSA 및 4.0ng/mL 인간 인슐린을 함유한 Krebs-Henseleit(KRBH) 관류 완충액을 준비합니다.
- 간 관류 시스템을 설정합니다. 그림 1 은 간 관류 시스템의 주요 구성 요소를 보여줍니다.
2. 외과적 카테터 삽입
- 아래 단계에 따라 마취 혼합물을 준비하십시오.
- Zoletil 50 (250 mg/5 mL)을 0.9% 염화나트륨 용액으로 10회 희석합니다.
- 자일라진 염산염(200mg/2mL)을 0.9% 염화나트륨 용액으로 10회 희석합니다.
- 0.5% Zoletil 50 용액과 1% Xylazine hydrochloride 용액을 1:1 비율로 혼합합니다.
- 생쥐를 마취시킵니다.
- 마우스의 체중을 확인하고 기록합니다. 체중 5mL/kg(2.5mg/mL Zoletil 50, 5mg/mL 자일라진 염산염)의 용량으로 복강내 주사를 통해 마취 혼합물을 투여합니다. 마취는 일반적으로 주사 후 5-10분 이내에 시작되며, 이는 오른쪽 반사 작용의 상실 및 외부 자극에 대한 반응 감소로 나타납니다.
- 마우스를 작업 테이블로 이동합니다. 접착 테이프를 사용하여 팔다리를 고정합니다. 2.5 U/g 헤파린을 복강내로 투여하여 헤파린화를 달성합니다.
- 전기 면도기를 사용하여 복부 피부의 털을 다듬고 포비돈 요오드 용액으로 해당 부위를 소독합니다.
- 문맥 카테터 삽입을 수행합니다.
- 하복부에서 복부 중간선을 따라 xiphoid 돌기 방향으로 4cm 세로로 절개합니다. 내장 기관이 손상되지 않도록 가위로 복막을 조심스럽게 자릅니다. 마우스 복부 견인기를 삽입하여 수술 부위를 노출시킵니다.
- 장을 오른쪽으로 움직여 문맥, 오른쪽 신장, 하대정맥을 드러냅니다(그림 2A). 동맥 겸자를 사용하여 신장 위쪽 가장자리에 있는 대정맥을 조입니다.
- 문맥을 분리하고(그림 2A) 6-0 실크 봉합사로 원위 끝을 접합합니다. 노출된 혈관의 근위부 끝에 다른 봉합사를 느슨하게 묶습니다.
- 스프링 가위로 결찰 말단 부근을 절개하고 카테터를 삽입합니다. 절개 부위를 통해 카테터를 문맥 분기점 수준까지 전진시킵니다.
- 카테터 주위에 두 합자를 고정하고 카테터의 자유 끝을 샘플링 주사기에 연결하여 적절한 샘플링을 확인합니다. 간질식염수로 씻어내고 카테터를 고정합니다(그림 2C).
- 견인 장치를 제거하고 장을 재설정하십시오. 식염수에 적신 멸균 거즈 또는 면으로 수술 부위를 덮습니다.
- 간상상대정맥 카테터 삽입을 수행합니다.
- xiphoid process에서 흉골을 따라 절개하여 흉골을 노출시킵니다.
- 흉골을 수직으로 자르고 갈비뼈 가장자리를 따라 횡격막을 잘라 흉강을 노출시킵니다.
- 간상대정맥(suprahepatic inferior vena cava)을 노출시키고 격리한다(그림 2B). 6-0 실크 봉합사로 말단 끝을 조심스럽게 접합합니다. 혈관의 근위부 끝에 다른 봉합사를 느슨하게 묶습니다.
- 스프링 가위로 결찰 말단 바로 아래를 절개하고 10cm 카테터를 삽입합니다. 카테터의 끝이 간에 가까워질 때까지 카테터를 전진시키고 양쪽 합자를 단단히 묶습니다. 적절한 샘플링을 확인하고 카테터의 자유 끝을 clamp합니다(그림 2D).
- 식염수로 수술 부위를 헹굽니다. 식염수에 적신 멸균 거즈로 표면을 덮으십시오.
3. 간 관류
- 동물 관리 및 사용에 대한 제도적 지침에 따라 마취제와 개흉술을 과다 투여하여 쥐를 안락사시키고, 모든 절차가 고통을 최소화하는 방식으로 수행되도록 합니다.
- 그림 1과 같이 산소 공급기, 온도 조절 장치, 주입 펌프 및 주입 튜브를 포함하는 간 관류 시스템을 설정합니다.
- 산소공급기에 95% 산소와 5% 이산화탄소의 지속적인 가스 흐름을 제공합니다.
- 수조를 켜고 장기 챔버를 37 °C로 예열합니다.
- 인슐린을 사용하거나 사용하지 않고 KRBH 관류 완충액을 준비합니다. 37°C의 수조에서 배양된 관류 완충액으로 튜빙 시스템을 프라임합니다.
참고: KRBH에는 BSA와 포도당이 없습니다. 인간 인슐린이 없는 KRBH 관류 완충액은 5.0mmol/L 포도당과 0.25% BSA를 함유하고 있으며, 인간 인슐린이 포함된 KRBH 관류 완충액은 5.0mmol/L 포도당, 0.25% BSA 및 4.0ng/mL 인간 인슐린을 함유하고 있습니다. - 주변 온도를 약 37°C로 유지한 용기에 마우스를 넣습니다. 보온 패드를 사용하여 체온을 37°C로 유지하십시오.
- 문맥 카테터를 통해 KRBH 완충액을 주입합니다. 미니 펌프를 통해 주입 속도를 0.2mL/분으로 설정합니다.
- 간이 몇 초 안에 창백해지는 것을 관찰하면 관류 완충액이 간을 통해 흐르고 있음을 나타냅니다. 간에 남아 있는 더 많은 혈액 세포를 씻어내려면 4분 및 8분 시점에서 1분 동안 주입을 일시 중지하고 관류 시작 시점부터 타이밍을 시작합니다.
- 평형 기간을 나타내는 총 10분(2개의 1분 일시 중지 제외) 동안 KRBH 버퍼로 간을 관류합니다. 하대정맥 카테터에서 기저 검체를 수집합니다.
- 인슐린이 풍부한 동일한 용액(4.0ng/mL 인간 인슐린)을 추가로 30분 동안 간에 관류합니다.
- 2분마다 하대정맥관에서 모든 샘플을 수집합니다.
- 관류 후 간 체중을 기록합니다. 다른 엽에서 간 샘플을 수집하고 즉시 액체 질소에 동결한 다음 -80°C로 옮겨 보관합니다.
- 수집된 모든 관류 시료를 ~1,000 x g 에서 4°C에서 10분 동안 원심분리기로 추출합니다. 상층액을 모아 -80 °C로 옮겨 보관합니다.
참고: 관류 샘플의 인슐린 농도는 인간 인슐린 효소 결합 면역흡착 분석법(ELISA) 키트를 사용하여 측정됩니다. - 절차 후 모든 생물학적 폐기물이 안전 규정에 따라 처리되었는지 확인하십시오.
4. 데이터 분석
- 시간 경과에 따른 인슐린 농도 출력을 보여주는 XY 그래프로 데이터를 표시합니다.
- 다음 공식을 사용하여 평균 간 인슐린 제거율(HICRAVE)을 계산합니다.
HICR평균 = (1−Cf/Ci) × 100%
여기서C i = 주입 완충액의 초기 인슐린 농도,C f = 간상 하대정맥에서 마지막 10분 동안의 최종 평균 인슐린 농도.
결과
이 프로토콜은 간 인슐린 청소율을 직접 계산하기 위한 간 주입 절차를 간략하게 설명합니다. 이 모델은 신뢰할 수 있고 재현 가능합니다. 실험에서 얻은 결과의 예가 그림 3에 나와 있습니다. 10분의 평형 기간 후, 4.0ng/mL 인간 인슐린이 보충된 KRBH 완충액을 30분 동안 문맥을 통해 관류했습니다. 2분 간격으로 간상하대정맥의 카테터에서 관류액을 채취하고, 관류액 내 인간 인슐린의 농도를 측정했습니다. 결과는 본 명세서에 SEM의 평균± 제시되어 있습니다. 대조군(CD)을 복용한 마우스와 고지방 식단(HFD)을 시행한 마우스를 비교한 간 관류 실험의 예가 그림 3에 나와 있습니다. 간 인슐린 제거율(HICRAVE)은 CD 투여군이 55.57%± 4.43%, HFD 투여군이 25.37%± 6.83%였다(그림 3B). 결과는 고지방 섭식이 인슐린 청소를 손상시킨다는 것을 나타냅니다.
관류 후, 헤마톡실린 및 에오신(HE) 염색 및 전체 슬라이드 스캔을 위해 간 샘플을 얻었습니다. 관류가 잘 된 간, 관류가 잘 되지 않은 간 및 정상 쥐의 대조군 간 샘플을 수집했습니다. 더 나은 관류 조건에서 간 조직 구조는 정상이었고, 간삭은 방사형으로 깔끔하게 배열되었으며, 간세포는 모양이 손상되지 않았으며, 세포질은 균일하게 염색되었으며, 핵은 정상 간과 거의 구별할 수 없을 정도로 투명하고 둥글었습니다(그림 4A, B). 관류가 잘 되지 않을 때, 간세포는 부종성이었고 현저하게 느슨했으며, 중심 정맥 주위의 반점 괴사, 세포질의 액포 변성, 핵 발열증 및 혈관 박리가 있었습니다(그림 4C). 관류액 내 알라닌 아미노전이효소(ALT) 및 아스파르테이트 아미노전이효소(AST) 수치는 간세포 기능을 평가하기 위해 기준선과 관류 후에 측정되었습니다. 그 결과 ALT와 AST 수준에는 유의한 차이가 없는 것으로 나타났습니다(그림 4D).
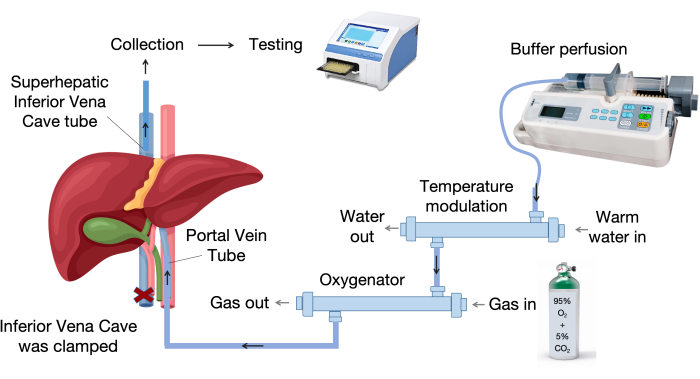
그림 1: 관류 시스템 구성 요소. 관류 시스템은 주입 펌프, 온도 제어 장치 및 산소 공급기를 포함한 핵심 구성 요소로 구성됩니다. 가변 온도 장치는 관류 액체를 37°C로 유지하는 반면, 멤브레인 산소공급기는 효과적인 가스 교환을 위해 폴리프로필렌 중공 섬유를 사용합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 해부학적 위치 및 카테터 삽입. (A,B) 문맥과 하대정맥의 해부학적 위치를 묘사합니다. (C) 문맥 카테터는 좌우 간 가지로 향하는 분기점 바로 아래에 위치하며, 간내 하대정맥에 혈관 클램프가 적용됩니다. (D) 카테터를 간상하 하대정맥에 삽입하고 간의 상부 가장자리 근처에 배치합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
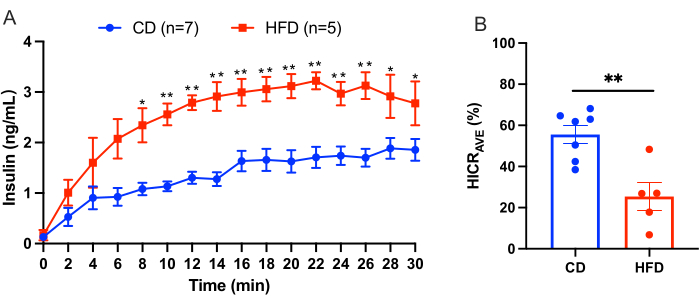
그림 3: 간 관류 실험 결과. 대조 다이어트(CD)를 하는 마우스와 고지방 다이어트(HFD)를 하는 마우스를 비교한 간 관류 실험의 결과. (A) CD 마우스(파란색, n = 7)와 HFD 마우스(빨간색, n = 5)의 간 관류 중 인슐린 농도. (B) 평균 간 인슐린 제거율(HICRAVE). 모든 데이터는 평균 ± SEM으로 표시됩니다. 통계적 유의성은 *p < 0.05, **p < 0.01 verse CD 마우스로 표시되며, 짝을 이루지 않은 t-test를 사용하여 분석됩니다. 연구 결과는 고지방 섭식이 인슐린 배출 장애로 이어진다는 것을 시사한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 관류가 간 조직학 및 기능에 미치는 영향. (A) 정상 마우스 간 형태(대조군). (B) 향상된 관류 조건에서의 간 형태. (C) 최적이 아닌 관류 조건에서의 간 형태. 빨간색 화살표는 혈관 박리를 나타내고, 검은색 화살표는 액포를 표시하며, 녹색 화살표는 핵의 발설을 강조합니다. 배율: 40x. (D) 관류액의 알라닌 아미노전이효소(ALT) 및 아스파르테이트 아미노전이효소(AST) 수준, 기준선 및 관류 후 측정. 분석을 위해 쌍체 t-검정 방법을 사용했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
프로토콜의 중요한 단계
위에서 설명한 수술 절차는 간에 병변이 생기지 않도록 조심스럽게 수행해야 합니다. 더욱이, 간 정맥 혈관 벽의 취약한 구조로 인해 삽관 중에 주의해서 다루지 않으면 천공과 그에 따른 출혈에 취약합니다. 이 프로토콜에는 혈관 손상을 최소화하기 위해 더 부드러운 실리콘 튜브가 사용됩니다. 삽관 성공률을 높이고 시술 기간을 최소화하기 위해 자주 연습해야 하는 숙련된 외과의가 카테터 삽입을 수행하는 것이 좋습니다.
간세포 생존력을 유지하기 위해 수술 부위에 때때로 따뜻한 식염수를 세척해야 합니다. 관류 중에는 수술 부위를 멸균 거즈 또는 면으로 보호해야 합니다. 이 방법은 잠재적으로 간세포 기능을 손상시킬 수 있는 공기에 장기간 노출되는 것을 방지합니다.
도전 과제와 해결책
문맥이 좌우 간문맥으로 분기되는 지점 바로 앞에 카테터 끝을 배치하는 것이 중요합니다. 카테터를 너무 깊게 삽입하면 간엽 사이에 불균일한 관류가 발생할 수 있습니다. 또한 기포는 간에서 공기 색전증을 유발할 가능성이 있으므로 주입 과정에서 조심스럽게 피해야 합니다. 이는 간세포에 도달하는 액체의 관류에 상당한 영향을 미칠 수 있으며 결과적으로 인슐린 청소에 영향을 미칠 수 있습니다.
KH 완충 주입의 처음 10분은 평형 기간을 구성하며, 이 기간 동안 관류는 잔류 혈액 세포를 가능한 한 많이 간 정현파로 씻어내기 위해 매번 2분 동안 1-2회 중단될 수 있습니다. 15분 동안 지속적으로 관류한 후에도 채취한 검체에서 혈액이 관찰되는 경우, 이는 간 하대정맥의 혈관 겸자가 제대로 배치되지 않았음을 나타낼 수 있으므로 검사를 받아야 한다19. 주입이 일시 중지되면 간 정현파의 잔류 혈액 세포로 인해 주입이 다시 시작될 때 수집된 검체에 적혈구가 나타날 수 있습니다. 적혈구는 인슐린 측정 전에 원심분리를 통해 분리해야 하는데, 이러한 세포 내에 인슐린 분해 효소가 존재하면 인슐린 수치에 잠재적으로 영향을 미칠 수 있기 때문입니다.
외과적 카테터 삽입 기간, 간 허혈-재관류 시간, 관류 중 문맥으로 들어가는 가스의 양은 모두 간세포의 기능에 영향을 미칠 수 있으며, 따라서 간의 인슐린 제거 속도에 영향을 미칠 수 있습니다. 간 기능 장애의 정도는 알라닌 아미노전이효소(ALT), 아스파르테이트 아미노전이효소(AST), 젖산 탈수소효소(LDH) 및 알칼리 포스파타제(ALP) 함량 측정과 H&E 염색을 통해 모니터링할 수 있습니다. 연구에 따르면 성공적인 수술 후 간은 최소 3시간 동안 계속 기능하고 반응합니다19.
마우스 간 관류의 중요성 및 잠재적 응용
생쥐는 인간과의 유전적 유사성, 짧은 생식 주기, 첨단 유전 공학 도구의 가용성으로 인해 이상적인 연구 대상입니다20. 마우스 모델에서는 여러 가지 방법을 사용하여 인슐린 제거율을 평가할 수 있습니다. 복강내 포도당 내성 검사(IPGTT) 동안 간 인슐린 청소율은 인슐린21에 대한 C-펩타이드의 곡선 아래 면적(AUC)(사다리꼴 방법으로 계산)의 비율로 측정됩니다. 유혈당-고인슐린혈증 클램프 동안, 외인성 인슐린 주입 속도와 그에 따른 정상 상태 혈장 인슐린 농도 간의 비율은 인슐린 제거율을 간접적으로 추정하는 방법으로 사용될 수 있다22. 그러나 이러한 방법은 모두 간성 인슐린 청소율을 간접적으로 평가합니다.
일부 연구자들은 인슐린 분해를 평가하기 위해 세포 기반 분석을 사용하기도 합니다. 마우스의 HepG2 세포 또는 1차 간세포를 배양판에 파종하고 적절한 농도의 인간 인슐린을 첨가합니다. 배양 배지의 샘플은 인간 인슐린 농도를 측정하고 시간 경과에 따른 분해를 평가하기 위해 특정 간격으로 수집됩니다17. 이 프로토콜에서는 간 인슐린 제거율을 직접 평가하기 위해 마우스의 사용자 친화적인 현장 간 관류 절차가 설명됩니다. 분리된 간세포를 사용한 시험관 내 연구와 비교했을 때, 간 관류는 간 구조, 구역 분할, 극성 및 혈관 무결성을 보존하는 이점이 있습니다.
마우스 간 관류 시스템은 간 인슐린 대사의 역학 및 분자 메커니즘을 조사하는 데 유용한 도구입니다. 또한 이 프로토콜은 사전 유도 질환 모델뿐만 아니라 급성 챌린지 자극 테스트에도 널리 사용될 수 있습니다. 그러나 이 기술은 현장에서 수행해야 한다는 점에서 제한적입니다. 이 프로토콜에는 손상을 최소화하고 간의 해부학적 무결성을 가능한 한 최대한 보존하는 수정된 외과적 카테터 삽입 기술이 포함됩니다. 특히 인슐린 저항성과 관련된 대사 질환에서 인슐린 제거 메커니즘을 밝히기 위해 이 기술을 최대한 활용하기 위해서는 더 많은 노력이 필요합니다.
공개
이해 상충은 선언되지 않았습니다.
감사의 말
이 연구는 중국 국립자연과학재단(National Natural Science Foundation of China, 82200948, 82270921, 82170882)의 지원을 받았다.
자료
| Name | Company | Catalog Number | Comments |
| 60% high-fat diet | Research Diets, USA | D12492 | |
| Alanine aminotransferase Assay Kit | Nanjing Jiancheng Bioengineering Institute | C009-2-1 | |
| Anhydrous Glucose | Sangon Biotech | 50-99-7 | 500 G |
| Aspartate aminotransferase Assay Kit | Nanjing Jiancheng Bioengineering Institute | C010-2-1 | |
| Bovine Serum Albumin | GeminiBio | 700-107P | Fatty Acid-Free |
| Contour TS Blood Glucose Meter | Bayer | PH220800019 | |
| Contour TS Blood Glucose Test Strips | Bayer | DP38M3F05A | |
| Heparin Sodium | Changzhou Qian hong Bio-pharma | H32022088 | 12500 U/2mL |
| Human insulin | Novo Nordisk | S20191007 | 300 U/3mL |
| Human insulin immunoassay kit | Ezassay Biotechnology | HM200 | |
| KRBH buffer (Sugar, BSA free) | coolaber | SL65501 | 500 mL |
| Membrane oxygenator | Xi'an Xijing Medical Appliance | 5 | |
| Microscopic scissors | Shanghai Jinzhong | YBC020 | |
| Micro-serrefine clamp | Ningbo Medical Needle | 180709 | |
| Microsurgery forceps | Shanghai Jinzhong | WA3010, WA3020 | |
| Needle type filter | N-buliv | LG05-133-2 | |
| Povidone-iodine Solution | Shanghai likang Disinfectant Hi-Tech | 20231016J | |
| pump 11 Elite | Harvard Apparatus | PC5 70-4500 | |
| Retractor | Globalebio (Beijing) Technology | GEKK-10mm | 10 mm |
| Silicone Tubing | scientific commodities | #BB518-12 | 0.31 mm × 0.64 mm |
| Silicone Tubing | Fisher Scientific | #11-189-15A | ID 0.5 mm |
| Sodium Chloride Injection | Baxter | S2402023 | 4.5 g/500 mL |
| Surgical silk suture | Yangzhou Huanyu Medical Equipment | 6-0 | |
| Temperature modulation | Xi'an Xijing Medical Appliance | 6 | |
| Thermostatic water bath | Jiaxing Junsi Electronics | HIH-1 | 220 V 50 HZ |
| Three-way Joint | YISAI | AQTCY1.6 | ID 0.4 mm |
| Xylazine Hydrochloride Injection | ShengXin | 20240106 | 200 mg/2mL |
| Zoletil 50 | Virbac | WK001 | 250 mg/5mL |
참고문헌
- Najjar, S. M., Perdomo, G. Hepatic insulin clearance: Mechanism and physiology. Physiology (Bethesda). 34 (3), 198-215 (2019).
- Fu, Z., et al. Impaired insulin clearance as the initial regulator of obesity-associated hyperinsulinemia: Novel insight into the underlying mechanism based on serum bile acid profiles. Diabetes Care. 45 (2), 425-435 (2022).
- Koh, H. E., Cao, C., Mittendorfer, B. Insulin clearance in obesity and type 2 diabetes. Int J Mol Sci. 23 (2), 596 (2022).
- Bril, F., et al. Relationship between disease severity, hyperinsulinemia, and impaired insulin clearance in patients with nonalcoholic steatohepatitis. Hepatology. 59 (6), 2178-2187 (2014).
- Herman, R., Sikonja, J., Jensterle, M., Janez, A., Dolzan, V. Insulin metabolism in polycystic ovary syndrome: Secretion, signaling, and clearance. Int J Mol Sci. 24 (4), 3140 (2023).
- Najjar, S. M., Caprio, S., Gastaldelli, A. Insulin clearance in health and disease. Annu Rev Physiol. 85, 363-381 (2023).
- Polidori, D. C., Bergman, R. N., Chung, S. T., Sumner, A. E. Hepatic and extrahepatic insulin clearance are differentially regulated: Results from a novel model-based analysis of intravenous glucose tolerance data. Diabetes. 65 (6), 1556-1564 (2016).
- Castillo, M. J., Scheen, A. J., Letiexhe, M. R., Lefebvre, P. J. How to measure insulin clearance. Diabetes Metab Rev. 10 (2), 119-150 (1994).
- Rubenstein, A. H., Pottenger, L. A., Mako, M., Getz, G. S., Steiner, D. F. The metabolism of proinsulin and insulin by the liver. J Clin Invest. 51 (4), 912-921 (1972).
- Terris, S., Steiner, D. F. Binding and degradation of 125i-insulin by rat hepatocytes. J Biol Chem. 250 (21), 8389-8398 (1975).
- Ooms, H. A., Arnould, Y., Rosa, U., Pennisi, G. F., Franckson, J. R. Total metabolic clearance of crystalline insulin and radio-iodide substitued insulin. Pathol Biol. 16 (5), 241-245 (1968).
- Defronzo, R. A., Tobin, J. D., Andres, R. Glucose clamp technique: A method for quantifying insulin secretion and resistance. Am J Physiol. 237 (3), E214-E223 (1979).
- Asare-Bediako, I., et al. Assessment of hepatic insulin extraction from in vivo surrogate methods of insulin clearance measurement. Am J Physiol Endocrinol Metab. 315 (4), E605-E612 (2018).
- Kim, S. P., Ellmerer, M., Kirkman, E. L., Bergman, R. N. Beta-cell "rest" accompanies reduced first-pass hepatic insulin extraction in the insulin-resistant, fat-fed canine model. Am J Physiol Endocrinol Metab. 292 (6), E1581-E1589 (2007).
- Kotsis, T., et al. Insulin metabolism and assessment of hepatic insulin extraction during liver regeneration. A study in a rat model. J Invest Surg. 33 (1), 69-76 (2020).
- Mondon, C. E., Olefsky, J. M., Dolkas, C. B., Reaven, G. M. Removal of insulin by perfused rat liver: Effect of concentration. Metabolism. 24 (2), 153-160 (1975).
- Tamaki, M., et al. The diabetes-susceptible gene SLC30A8/ZnT8 regulates hepatic insulin clearance. J Clin Invest. 123 (10), 4513-4524 (2013).
- Ghadieh, H. E., Gastaldelli, A., Najjar, S. M. Role of insulin clearance in insulin action and metabolic diseases. Int J Mol Sci. 24 (8), 7156 (2023).
- Winther-Sorensen, M., Kemp, I. M., Bisgaard, H. C., Holst, J. J., Wewer Albrechtsen, N. J. Hepatic glucose production, ureagenesis, and lipolysis quantified using the perfused mouse liver model. J Vis Exp. 200, e65596 (2023).
- Rydell-Tormanen, K., Johnson, J. R. The applicability of mouse models to the study of human disease. Methods Mol Biol. 1940, 3-22 (2019).
- Zaidi, S., et al. Loss of ceacam1 in hepatocytes causes hepatic fibrosis. Eur J Clin Invest. 54 (7), e14177 (2024).
- Piccinini, F., Bergman, R. N. The measurement of insulin clearance. Diabetes Care. 43 (9), 2296-2302 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유