Method Article
הערכת פינוי אינסולין בעכברים באמצעות זלוף כבד באתרו
In This Article
Summary
פינוי אינסולין בכבד הוא קריטי לוויסות הומאוסטזיס של גלוקוז. מאמר זה מתאר הליך זלוף כבד ידידותי למשתמש להערכה ישירה של קצב פינוי האינסולין בכבד באתרו בעכברים.
Abstract
פינוי אינסולין בכבד חיוני לשמירה על הומאוסטזיס גלוקוז וקשור קשר הדוק להפרעות מטבוליות כגון השמנת יתר, עמידות לאינסולין וסוכרת. מדידה מדויקת של פינוי האינסולין חיונית להבנת המנגנונים הבסיסיים של מצבים אלה. פרוטוקול זה מציג הליך זלוף כבד פשוט וידידותי למשתמש בעכברים, שתוכנן במיוחד כדי להעריך ישירות את קצב פינוי האינסולין בכבד. השיטה כוללת קנולציה מדויקת של וריד הפורטל והווריד הנבוב התחתון העל-הפטי כדי ליצור מערכת זלוף באתרה המחקה תנאים פיזיולוגיים. הפרוטוקול מנחה את החוקרים בכל שלב של ההליך, מהכנה כירורגית והקמת מערכת הזלוף ועד לאיסוף וניתוח דגימות. ניתנות הוראות מפורטות, יחד עם תוצאות מייצגות וטיפים חשובים לייעול ההליך. סרטון הדרכה מלווה את הפרוטוקול הכתוב, המציע הוראות ואיורים מעמיקים מבחינה ויזואלית, מה שהופך אותו להתייחסות נגישה ומקיפה למדענים החוקרים את המנגנונים המולקולריים מאחורי חילוף החומרים ופינוי האינסולין בכבד.
Introduction
גילוי האינסולין הפך לאחת מאבני הדרך של המאה הקודמת. הרבה ידוע על ויסות סינתזת האינסולין, הפרשת האינסולין ותפקודיו הפיזיולוגיים ברקמות מטבוליות. עם זאת, יש פחות התמקדות בפירוק האינסולין ובמנגנוני הרגולציה שלו. ניתן להבין את חילוף החומרים של אינסולין כיחסי הגומלין בין תפקוד תאי בטא, תנגודת לאינסולין (IR) או רגישות, ופינוי אינסולין. לצד הפרשת אינסולין, פינוי אינסולין בכבד ממלא תפקיד מכריע בשמירה על הרמה ההומאוסטטית של האינסולין הדרושה להגעה לרקמות היעד ההיקפיות ולהקלה על פעולת אינסולין תקינה1. מחקרים מרובים זיהו פגיעה בפינוי אינסולין כגורם מכריע בפתוגנזה של היפראינסולינמיה בתסמונת מטבולית, כמו גם במצבים אחריםכגון סוכרת מסוג 2,3, דלקת כבד לא אלכוהולית4 ותסמונת השחלות הפוליציסטיות5. לפיכך, היפראינסולינמיה משנית לפינוי מופחת עשויה לשחק תפקיד בפתוגנזה של מחלה מטבולית. לאסטרטגיות המשפרות את פינוי האינסולין יש פוטנציאל להפוך את ההשפעות השליליות של היפראינסולינמיה אצל אנשים אלה.
לאינסולין יש דפוס הפצה ייחודי. רמת האינסולין בפלזמה במחזור תלויה בשיווי המשקל בין הפרשת האינסולין להוצאתו. הלבלב מפריש אינסולין לווריד הפורטלי בצורה פועמת, ומכוון אותו אל הפטוציטים. כאיבר הראשון שנתקל בהפרשת אינסולין, הכבד מפרק את רוב האינסולין במהלך המעבר הראשון שלו, ומהווה 60%-70% מסך האינסולין6. האינסולין הנותר יוצא מהכבד דרך וריד הכבד, ונכנס למחזור הדם המערכתי, שם הוא מנוצל בחלקו על ידי רקמות היקפיות (בעיקר שריר, רקמת שומן וכליות) לפני שהוא מופק עוד על ידי הכבד במהלך המעבר השני שלו דרך עורק הכבד7.
המדידה המדויקת של פינוי האינסולין היא קריטית. מדידה ישירה של פינוי אינסולין בכבד במחקרים בבני אדם היא מאתגרת מכיוון שקשה להשיג דגימות דם מהפורטל ומוורידי הכבד. שיטות ישירות ועקיפות משמשות להערכת פינוי אינסולין בבני אדם ובמודלים של בעלי חיים. כשלוש אסטרטגיות משמשות למדידת פינוי אינסולין בעקיפין. ההערכות הנפוצות ביותר בפרקטיקה הקלינית כוללות שיטות המבוססות על יחס C-פפטיד/אינסולין מולארי8. גישה זו מבוססת על הפרשת שיווי המשקל של שני הפפטידים והיעדר מיצוי פפטיד C על ידי הכבד9. קבוצת השיטות השנייה תלויה בניתוח מתמטי של עקומות דעיכת הפלזמה של אינסולין לאחר כניסה ידועה וספציפית של ההורמון למחזור הדם 2,10,11. השיטה השלישית מבוססת על העובדה שעירוי אינסולין בקצב קבוע מוביל לרמות יציבות של ההורמון בדם, כאשר קצב ההסרה תואם את קצב המתן12. שיטות עקיפות אלו משקפות בעיקר את פינוי האינסולין הכללי בגוף. בהתחשב בכך שהכבד הוא האתר העיקרי של פינוי אינסולין וממלא תפקיד מכריע בתהליך זה, חיוני להעריך ישירות את פינוי האינסולין בכבד.
מחקרים קודמים מדדו ישירות את מיצוי האינסולין בכבד בכלבים בריאים13,14. מחקרים השתמשו גם במודל כבד חולדה מבודד כדי להעריך את מיצוי האינסולין מהכבד15,16. בשל הזמינות הגבוהה של זנים מהונדסים גנטית, עכברים משמשים כמודלים חשובים לחקירת מסלולים מולקולריים. כמה מחקרים17 השתמשו בזילוף כבד כדי להעריך ישירות את פינוי האינסולין בכבד במודל עכבר. במחקרים אלה, פרפוזה המכילה אינסולין אנושי מוזרקת לווריד הפורטלי ונאספת מהווריד הנבוב התחתון. שיעור האינסולין הנספג בכבד מעיד על פינויו. טכניקת זלוף הכבד שומרת על הכבד בתנאים כמעט פיזיולוגיים על ידי זרימת פרפוזה חמה, מחומצנת ומועשרת בחומרים מזינים דרך כלי הדם של הכבד. עם זאת, אין מספיק הדרכה מעשית וטיפים חיוניים לקידום והפצה של טכניקה זו.
לפיכך, בעוד שפינוי אינסולין בכבד זכה לתשומת לב הולכת וגוברת, תפקידו בהפרעות, כמו גם המנגנונים המולקולריים שלו, נותר לא ברור18. לכן, יש צורך רב בטכניקות מתקדמות בתחום המחקר המדעי. פרוטוקול זה קובע הליך זלוף כבד מותאם מפורט בעכברים להערכת פינוי אינסולין בכבד. בנוסף, ניתן להשתמש בשיטה זו גם כדי לחקור את ההשפעות של תרופות על הכבד, כולל אפקט המעבר הראשון, תהליכי הובלת תרופות והיבטים שונים אחרים.
Protocol
פרוטוקול זה אושר על ידי הוועדה לטיפול ושימוש בבעלי חיים של האוניברסיטה הרפואית של נאנג'ינג (IACUC-2105018) ופעל בהתאם להנחיות הוועדה המוסדית לטיפול ושימוש בבעלי חיים. כל עכברי C57BL/6N נשמרו במחזור אור/חושך של 12 שעות עם גישה חופשית למזון ומים. עכברים בני שישה שבועות חולקו באופן אקראי לקבוצת דיאטת צ'או (CD) וקבוצת דיאטה עתירת שומן (HFD). קבוצת ה-HFD הוזנה בתזונה עתירת שומן של 60% והמשיכה בדיאטה זו עד גיל 10 שבועות. משקל הגוף הממוצע היה 28.55 גרם ±-1.2 גרם בקבוצת HFD ו-24.3 גרם ±-0.48 גרם בקבוצת הביקורת. פרטי הריאגנטים והציוד המשמשים במחקר זה מפורטים בטבלת החומרים.
1. הכנה
- בצע עיקור הכרחי של מכשירים כירורגיים וחומרים מתכלים באמצעות חיטוי.
- הניחו את מכשירי הניתוח, תפר משי 6-0, מוליך כותנה קטן וסטרילי, הזרקת נתרן כלורי (500 מ"ל), צמר גפן וספוגים כראוי על שולחן הניתוחים.
- יש להכין 30 מ"ל של תמיסת מלח הפרינית בריכוז סופי של 200 יחב"ל/מ"ל.
- הכן שני צינורות סיליקון בקוטר פנימי של 0.31 מ"מ וקוטר חיצוני של 0.64 מ"מ; האחד באורך 4 ס"מ לשימוש כקטטר וריד הפורטל, והשני באורך 10 ס"מ לשימוש כקטטר הווריד הנבוב התחתון.
- הכן את מאגר הזלוף Krebs-Henseleit (KRBH) המכיל 5.0 ממול/ליטר גלוקוז ו-0.25% BSA.
- הכן את מאגר הזלוף Krebs-Henseleit (KRBH) המכיל 5.0 מילימול/ליטר גלוקוז, 0.25% BSA ו-4.0 ננוגרם/מ"ל אינסולין אנושי.
- הגדר את מערכת הזלוף בכבד. איור 1 מציג את המרכיבים העיקריים של מערכת הזלוף בכבד.
2. צנתור כירורגי
- הכן את תערובת ההרדמה על ידי ביצוע השלבים הבאים:
- יש לדלל את Zoletil 50 (250 מ"ג/5 מ"ל) 10 פעמים עם תמיסת נתרן כלורי 0.9%.
- יש לדלל קסילזין הידרוכלוריד (200 מ"ג/2 מ"ל) 10 פעמים עם תמיסת נתרן כלורי 0.9%.
- מערבבים את תמיסת זולטיל 50 0.5% עם תמיסת 1% קסילזין הידרוכלוריד ביחס של 1:1.
- להרדים את העכברים.
- בדוק ורשום את משקל גופו של העכבר. יש לתת את תערובת ההרדמה באמצעות הזרקה תוך-צפקית במינון של 5 מ"ל/ק"ג משקל גוף (2.5 מ"ג/מ"ל זולטיל 50; 5 מ"ג/מ"ל קסילזין הידרוכלוריד). תחילת ההרדמה מתרחשת בדרך כלל תוך 5-10 דקות לאחר ההזרקה, מה שמסומן על ידי אובדן רפלקס היישור ותגובה מופחתת לגירויים חיצוניים.
- העבר את העכבר לטבלת הניתוחים. אבטח את הגפיים באמצעות סרט דבק. יש לתת 2.5 U/g heparin תוך צפקי כדי להשיג הפריניזציה.
- השתמש במכונת גילוח חשמלית כדי לקצץ את הפרווה על עור הבטן ולחטא את האזור בתמיסת פובידון-יוד.
- ביצוע צנתור וריד פורטל.
- בצע חתך אורכי של 4 ס"מ מהבטן התחתונה לכיוון תהליך ה-xiphoid לאורך קו אמצע הבטן. חותכים בזהירות את הצפק במספריים כדי למנוע פגיעה באיברים הקרביים. הכנס את מפסק הבטן של העכבר כדי לחשוף את שדה הניתוח.
- הזיזו את המעיים ימינה כדי לחשוף את וריד הפורטל, את הכליה הימנית ואת הווריד הנבוב התחתון (איור 2A). השתמש במלקחיים עורקיים כדי להדק את הווריד הנבוב בקצה העליון של הכליה.
- בודד את וריד הפורטל (איור 2A) וקשר את הקצה הדיסטלי עם תפר משי 6-0. קושרים באופן רופף תפר נוסף בקצה הפרוקסימלי של הכלי החשוף.
- בצע חתך ליד הקצה הקשור במספריים קפיציים והכנס את הקטטר. קדם את הקטטר דרך החתך עד לרמת התפצלות הפורטל.
- אבטח את שתי הקשרים סביב הצנתר ואשר דגימה נכונה על ידי חיבור הקצה החופשי של הצנתר למזרק דגימה. יש לשטוף עם מי מלח הפריניים ולהדק את הקטטר (איור 2C).
- הסר את מכשיר המתיחה ואפס את המעיים. מכסים את אזור הניתוח בגזה סטרילית ספוגה במי מלח או כותנה.
- בצע צנתור וריד נבוב תחתון סופרהפטי.
- בצע חתך לאורך עצם החזה מתהליך ה- xiphoid וחשוף את עצם החזה.
- חותכים אנכית את עצם החזה וחותכים את הסרעפת לאורך שולי הצלעות כדי לחשוף את חלל בית החזה.
- חשוף ובודד את הווריד הנבוב התחתון העל-הפטי (איור 2B). קשור בזהירות את הקצה הדיסטלי עם תפר משי 6-0. קושרים באופן רופף תפר נוסף בקצה הפרוקסימלי של הכלי.
- בצע חתך ממש מתחת לקצה הקשור עם מספריים קפיציים והכנס קטטר 10 ס"מ. קדם את הקטטר עד שקצה הצנתר קרוב לכבד וקשר את שתי הקשירה היטב. אשר דגימה נכונה והדק את הקצה החופשי של הצנתר (איור 2D).
- שטפו את אזור הניתוח בתמיסת מלח. מכסים את המשטח בגזה סטרילית ספוגה במי מלח.
3. זלוף כבד
- המתת חסד של העכבר על ידי שימוש במנת יתר של חומרי הרדמה וכריתת בית החזה בהתאם להנחיות המוסדיות לטיפול ושימוש בבעלי חיים, תוך הבטחה שכל ההליכים מבוצעים באופן שממזער את הסבל.
- הגדר את מערכת הזלוף בכבד, הכוללת מחמצן, מכשיר אפנון טמפרטורה, משאבת עירוי וצינורות עירוי, כפי שמוצג באיור 1.
- ספק זרימת גז רציפה של 95% חמצן ו-5% פחמן דו חמצני לחמצן.
- הפעל את אמבט המים וחמם את תא האיברים ל -37 מעלות צלזיוס.
- הכן את מאגר הזלוף KRBH עם ובלי אינסולין. יש להניח את מערכת הצינורות עם מאגר הזלוף המודגר באמבט מים בטמפרטורה של 37 מעלות צלזיוס.
הערה: ה-KRBH נקי מ-BSA וגלוקוז. מאגר הזלוף KRBH ללא אינסולין אנושי מכיל 5.0 מילימול לליטר גלוקוז ו-0.25% BSA, בעוד שמאגר הזלוף KRBH עם אינסולין אנושי מכיל 5.0 מילימול לליטר גלוקוז, 0.25% BSA ו-4.0 ננוגרם/מ"ל אינסולין אנושי. - הנח את העכבר במיכל כאשר טמפרטורת הסביבה נשמרת על כ-37 מעלות צלזיוס. השתמש בכרית חימום כדי לשמור על טמפרטורת הגוף על 37 מעלות צלזיוס.
- החדירו את מאגר ה-KRBH דרך צנתר וריד הפורטל. הגדר את קצב העירוי על 0.2 מ"ל/דקה באמצעות משאבה מיני.
- שימו לב שהכבד מחוויר תוך שניות, מה שמצביע על כך שמאגר הזלוף זורם דרך הכבד. כדי לשטוף יותר תאי דם שנותרו בכבד, השהה את העירוי למשך דקה אחת בנקודות הזמן של 4 דקות ו-8 דקות, והתחל את התזמון בתחילת הזלוף.
- החדרת הכבד עם מאגר KRBH למשך 10 דקות בסך הכל (לא כולל שתי הפסקות של דקה), המייצגות את תקופת שיווי המשקל. אסוף את דגימת הבסיס מצנתר הווריד הנבוב התחתון.
- יש לטפטף את הכבד באותה תמיסה מועשרת באינסולין (4.0 ננוגרם/מ"ל אינסולין אנושי) למשך 30 דקות נוספות.
- אסוף את כל הדגימות מצינור הווריד הנבוב התחתון כל 2 דקות.
- רשום את משקל הכבד לאחר הזלוף. אוספים דגימות כבד מאונות שונות, מקפיאים אותן מיד בחנקן נוזלי ואז מעבירים ל-80 מעלות צלזיוס לאחסון.
- כל הצנטריפוגות אספו דגימות זלוף ב-~1,000 x g למשך 10 דקות ב-4 מעלות צלזיוס. אוספים את הסופרנטנטים ומעבירים אותם ל-80 מעלות צלזיוס לאחסון.
הערה: ריכוז האינסולין בדגימות זלוף נמדד באמצעות ערכות בדיקת אימונוסורבנט מקושר לאנזים אינסולין אנושי (ELISA). - לאחר ההליך, ודא שכל הפסולת הביולוגית מסולקת בהתאם לתקנות הבטיחות.
4. ניתוח נתונים
- הצג את הנתונים בגרפים XY המציגים את תפוקת ריכוז האינסולין לאורך זמן.
- חשב את שיעור פינוי האינסולין הממוצע בכבד (HICRAVE) באמצעות הנוסחה הבאה:
HICRAVE = (1−Cf/Ci) × 100%
כאשר Ci = ריכוז אינסולין ראשוני של מאגר העירוי, Cf = ריכוז האינסולין הממוצע הסופי ב-10 הדקות האחרונות מהווריד הנבוב התחתון העל-הפטי.
תוצאות
פרוטוקול זה מתאר את ההליך לעירוי כבד לחישוב פינוי אינסולין בכבד ישירות. דגם זה אמין וניתן לשחזור. דוגמה לתוצאות שהתקבלו מניסוי מוצגת באיור 3. לאחר תקופת שיווי משקל של 10 דקות, מאגר KRBH בתוספת אינסולין אנושי של 4.0 ננוגרם/מ"ל הוזרם דרך וריד הפורטל למשך 30 דקות. נוזל הזלוף נאסף מהצנתר בווריד הנבוב התחתון העל-הפטי במרווחים של 2 דקות, ונמדד ריכוז האינסולין האנושי בנוזל הזלוף. התוצאות מוצגות כאן כממוצע ± SEM. דוגמה לניסוי זלוף כבד שמשווה עכברים בדיאטת ביקורת (CD) לעכברים בדיאטת עתירת שומן (HFD) מוצגת באיור 3. שיעור פינוי האינסולין בכבד (HICRAVE) היה 55.57% ± 4.43% בקבוצת CD ו-25.37% ±-6.83% בקבוצת HFD (איור 3B). התוצאות מצביעות על כך שהזנה עתירת שומן מובילה לפגיעה בפינוי האינסולין.
לאחר הזלוף, התקבלו דגימות כבד לצביעה של המטוקסילין ואאוזין (HE) וסריקת שקופיות שלמות; נאספו כבד עם חדירה טובה, כבד עם חדירה גרועה ודגימת כבד ביקורת מעכבר רגיל. בתנאי זלוף טובים יותר, מבנה רקמת הכבד היה תקין, מיתרי הכבד היו מסודרים בצורה רדיאלית ומסודרת, הפטוציטים היו שלמים בצורתם, הציטופלזמה הייתה מוכתמת באופן אחיד, והגרעין היה צלול ועגול, כמעט בלתי ניתן להבחנה מזה של הכבד הרגיל (איור 4A,B). כאשר הזלוף היה גרוע, הפטוציטים היו בצקתיים ורופפים באופן ניכר, עם נמק מנוקב סביב הוורידים המרכזיים, ניוון ואקואולרי בציטופלזמה, פיקנוזיס גרעיני וניתוק כלי דם (איור 4C). רמות האלנין אמינוטרנספראז (ALT) ואספרטט אמינוטרנספראז (AST) בפרפוזה נמדדו בנקודת ההתחלה ולאחר הזלוף כדי להעריך את תפקוד הפטוציטים. התוצאות הצביעו על כך שלא היה הבדל משמעותי ברמות ALT ו-AST (איור 4D).
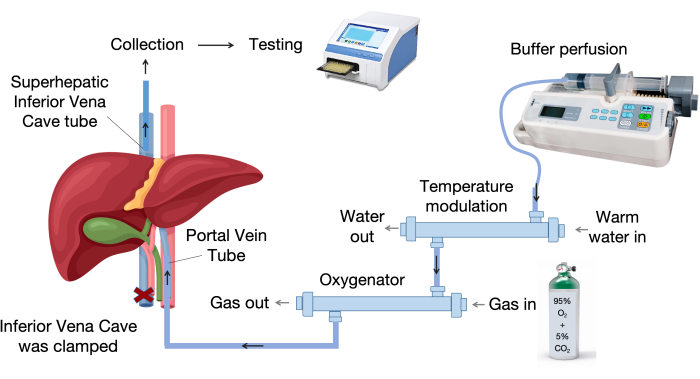
איור 1: רכיבי מערכת הזילוף. מערכת הזלוף מורכבת ממרכיבי מפתח, כולל משאבת עירוי, יחידת בקרת טמפרטורה ומחמצן. מכשיר הטמפרטורה המשתנה שומר על נוזל הזלוף ב-37 מעלות צלזיוס, בעוד שמחמצן הממברנה משתמש בסיבי פוליפרופילן חלולים להחלפת גז יעילה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: מיקום אנטומי וצנתור. (א,ב) מתאר את המיקומים האנטומיים של וריד הפורטל והווריד הנבוב התחתון. (C) צנתר וריד הפורטל ממוקם ממש מתחת להתפצלות לענפי הכבד השמאלי והימני, עם מהדק כלי דם המופעל על הווריד הנבוב התחתון התוך-כבדי. (D) הצנתר מוחדר לתוך הווריד הנבוב התחתון העל-הפטי וממוקם ליד השוליים העליונים של הכבד. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
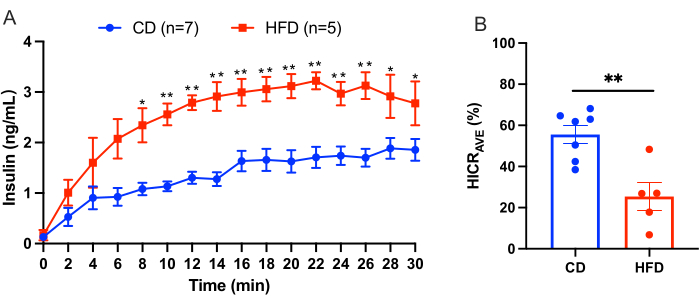
איור 3: תוצאות ניסוי זלוף כבד. תוצאות מניסוי זלוף כבד שהשווה עכברים בדיאטת ביקורת (CD) לעכברים בדיאטה עתירת שומן (HFD). (A) ריכוזי אינסולין במהלך זלוף כבד בעכברי CD (כחול, n = 7) לעומת עכברי HFD (אדום, n = 5). (B) שיעור פינוי אינסולין ממוצע בכבד (HICRAVE). כל הנתונים מוצגים כממוצע ± SEM. מובהקות סטטיסטית מסומנת כ-*p <-0.05, **p <-0.01 לעומת עכברי CD, שנותחו באמצעות מבחן t לא מזווג. התוצאות מצביעות על כך שהזנה עתירת שומן מובילה לפגיעה בפינוי האינסולין. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: השפעת הזלוף על היסטולוגיה ותפקוד הכבד. (A) מורפולוגיה תקינה של כבד עכבר (ביקורת). (B) מורפולוגיה של הכבד בתנאי זלוף משופרים. (C) מורפולוגיה של הכבד בתנאי זלוף תת-אופטימליים. החץ האדום מציין ניתוק כלי דם, החץ השחור מציין ואקואוליזציה, והחץ הירוק מדגיש פיקנוזיס של הגרעין. הגדלה: פי 40. (D) רמות של אלנין אמינוטרנספראז (ALT) ואספרטט אמינוטרנספראז (AST) בפרפוזה, שנמדדו בנקודת ההתחלה ולאחר הזילוף. שיטת מבחן ה-t הזוגית שימשה לניתוח. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
שלבים קריטיים בפרוטוקול
יש לבצע את ההליכים הכירורגיים שתוארו לעיל בזהירות עדינה כדי למנוע היווצרות נגעים בכבד. יתר על כן, המבנה השברירי של דופן כלי הדם של וריד הכבד הופך אותו לפגיע לניקוב ולדימום שלאחר מכן אם לא מטפלים בו בזהירות במהלך הקנולציה. צינורות סיליקון רכים יותר משמשים בפרוטוקול זה כדי למזער את הנזק לכלי הדם. מומלץ לבצע צנתור על ידי מנתח מנוסה שצריך להתאמן בתדירות גבוהה כדי להגדיל את אחוזי ההצלחה של האינטובציה ולמזער את משך ההליך.
יש להשקות מדי פעם את השדה הניתוחי במי מלח חמים כדי לשמור על כדאיות הפטוציטים. במהלך הזלוף, יש להגן על אזור הניתוח בגזה סטרילית או כותנה. נוהג זה מונע חשיפה ממושכת לאוויר, שעלולה לפגוע בתפקוד הפטוציטים.
אתגרים ופתרונות
חיוני למקם את קצה הקטטר ממש לפני הנקודה שבה וריד הפורטל מסתעף לתוך ורידי השער השמאלי והימני של הכבד. אם הצנתר מוחדר עמוק מדי, עלול להיווצר זלוף לא אחיד בין אונות הכבד. בנוסף, יש להימנע בזהירות מבועות אוויר בתהליך העירוי, מכיוון שיש להן פוטנציאל לגרום לתסחיף אוויר בכבד. זה יכול להשפיע באופן משמעותי על זלוף הנוזל המגיע להפטוציטים ובהמשך להשפיע על פינוי האינסולין.
10 הדקות הראשונות של עירוי חיץ KH מהוות את תקופת שיווי המשקל, במהלכה ניתן להשהות את הזלוף 1-2 פעמים למשך 2 דקות בכל פעם כדי לשטוף את תאי הדם הנותרים לתוך הסינוסואיד הכבדי ככל האפשר. אם נצפה דם בדגימה שנאספה לאחר 15 דקות של זלוף רציף, הדבר עשוי להצביע על כך שמלקחיים כלי הדם על הווריד הנבוב התחתון בכבד אינם ממוקמים כראוי ויש לבדוק אותם19. אם העירוי מושהה, כדוריות דם אדומות עשויות להופיע בדגימה שנאספה כאשר העירוי מופעל מחדש עקב שאריות תאי דם בסינוסואידים בכבד. יש להפריד את תאי הדם האדומים באמצעות צנטריפוגה לפני מדידת האינסולין, מכיוון שנוכחותם של אנזימים מפרקי אינסולין בתוך תאים אלה עלולה להשפיע על רמות האינסולין.
משך הצנתור הכירורגי, זמן איסכמיה-רפרפוזיה בכבד וכמות הגז הנכנסת לווריד הפורטלי במהלך הזלוף יכולים כולם להשפיע על תפקוד הפטוציטים ובכך על קצב פינוי האינסולין על ידי הכבד. ניתן לנטר את היקף התפקוד הלקוי של הכבד על ידי מדידת רמות תכולת אלנין אמינוטרנספראז (ALT), אספרטט אמינוטרנספראז (AST), לקטט דהידרוגנאז (LDH) ופוספטאז אלקליין (ALP), כמו גם על ידי צביעת H&E. מחקרים הראו כי לאחר ניתוח מוצלח, הכבד ממשיך לתפקד ולהגיב במשך 3 שעותו-19 לפחות.
חשיבות ויישומים פוטנציאליים של זלוף כבד עכבר
עכברים הם נושאי מחקר אידיאליים בשל הדמיון הגנטי שלהם לבני אדם, מחזורי רבייה קצרים וזמינות של כלים מתקדמים להנדסה גנטית20. במודלים של עכברים ניתן להעריך את פינוי האינסולין במספר שיטות. במהלך בדיקת סבילות לגלוקוז תוך צפקי (IPGTT), פינוי אינסולין בכבד נמדד כיחס בין השטח מתחת לעקומה (AUC) (מחושב בשיטה הטרפזית) של פפטיד C לאינסולין21. במהלך מהדק האוגליקמי-היפראינסולינמיה, היחס בין קצב עירוי האינסולין האקסוגני לריכוז האינסולין בפלזמה במצב יציב שנוצר יכול לשמש כשיטה להערכת פינוי האינסולין בעקיפין22. עם זאת, כל השיטות הללו מעריכות בעקיפין את פינוי האינסולין בכבד.
חלק מהחוקרים משתמשים גם במבחנים מבוססי תאים כדי להעריך את פירוק האינסולין. תאי HepG2 או הפטוציטים ראשוניים מעכברים נזרעים בצלחות תרבית, ומוסיפים ריכוז מתאים של אינסולין אנושי. דגימות של מדיום התרבית נאספות במרווחי זמן ספציפיים כדי למדוד את ריכוז האינסולין האנושי ולהעריך את הפירוק שלו לאורך זמן17. בפרוטוקול זה, מתואר הליך זלוף כבד ידידותי למשתמש במקום בעכברים להערכת שיעור פינוי האינסולין בכבד ישירות. בהשוואה למחקרי מבחנה המשתמשים בהפטוציטים מבודדים, לזלוף הכבד יש יתרונות של שימור ארכיטקטורה של הכבד, חלוקה אזורית, קוטביות ושלמות כלי הדם.
מערכת הזלוף של כבד העכבר היא כלי רב ערך לחקירת הדינמיקה והמנגנונים המולקולריים של חילוף החומרים של אינסולין בכבד. בנוסף, פרוטוקול זה יכול להיות בשימוש נרחב לא רק במודלים של מחלה מוקדמת אלא גם בבדיקות גירוי אתגר חריף. עם זאת, טכניקה זו מוגבלת בכך שהיא צריכה להתבצע באתרה. פרוטוקול זה כולל טכניקת צנתור כירורגית מותאמת הממזערת את הפציעה ושומרת על השלמות האנטומית של הכבד ככל האפשר. נדרשים מאמצים נוספים כדי לנצל בצורה הטובה ביותר את הטכנולוגיה הזו כדי להבהיר את מנגנוני פינוי האינסולין, במיוחד במחלות מטבוליות הקשורות לתנגודת לאינסולין.
Disclosures
לא הוכרזו ניגודי עניינים.
Acknowledgements
העבודה הזו נתמכה על ידי הקרן הלאומית למדעי הטבע של סין (82200948, 82270921 82170882).
Materials
| Name | Company | Catalog Number | Comments |
| 60% high-fat diet | Research Diets, USA | D12492 | |
| Alanine aminotransferase Assay Kit | Nanjing Jiancheng Bioengineering Institute | C009-2-1 | |
| Anhydrous Glucose | Sangon Biotech | 50-99-7 | 500 G |
| Aspartate aminotransferase Assay Kit | Nanjing Jiancheng Bioengineering Institute | C010-2-1 | |
| Bovine Serum Albumin | GeminiBio | 700-107P | Fatty Acid-Free |
| Contour TS Blood Glucose Meter | Bayer | PH220800019 | |
| Contour TS Blood Glucose Test Strips | Bayer | DP38M3F05A | |
| Heparin Sodium | Changzhou Qian hong Bio-pharma | H32022088 | 12500 U/2mL |
| Human insulin | Novo Nordisk | S20191007 | 300 U/3mL |
| Human insulin immunoassay kit | Ezassay Biotechnology | HM200 | |
| KRBH buffer (Sugar, BSA free) | coolaber | SL65501 | 500 mL |
| Membrane oxygenator | Xi'an Xijing Medical Appliance | 5 | |
| Microscopic scissors | Shanghai Jinzhong | YBC020 | |
| Micro-serrefine clamp | Ningbo Medical Needle | 180709 | |
| Microsurgery forceps | Shanghai Jinzhong | WA3010, WA3020 | |
| Needle type filter | N-buliv | LG05-133-2 | |
| Povidone-iodine Solution | Shanghai likang Disinfectant Hi-Tech | 20231016J | |
| pump 11 Elite | Harvard Apparatus | PC5 70-4500 | |
| Retractor | Globalebio (Beijing) Technology | GEKK-10mm | 10 mm |
| Silicone Tubing | scientific commodities | #BB518-12 | 0.31 mm × 0.64 mm |
| Silicone Tubing | Fisher Scientific | #11-189-15A | ID 0.5 mm |
| Sodium Chloride Injection | Baxter | S2402023 | 4.5 g/500 mL |
| Surgical silk suture | Yangzhou Huanyu Medical Equipment | 6-0 | |
| Temperature modulation | Xi'an Xijing Medical Appliance | 6 | |
| Thermostatic water bath | Jiaxing Junsi Electronics | HIH-1 | 220 V 50 HZ |
| Three-way Joint | YISAI | AQTCY1.6 | ID 0.4 mm |
| Xylazine Hydrochloride Injection | ShengXin | 20240106 | 200 mg/2mL |
| Zoletil 50 | Virbac | WK001 | 250 mg/5mL |
References
- Najjar, S. M., Perdomo, G. Hepatic insulin clearance: Mechanism and physiology. Physiology (Bethesda). 34 (3), 198-215 (2019).
- Fu, Z., et al. Impaired insulin clearance as the initial regulator of obesity-associated hyperinsulinemia: Novel insight into the underlying mechanism based on serum bile acid profiles. Diabetes Care. 45 (2), 425-435 (2022).
- Koh, H. E., Cao, C., Mittendorfer, B. Insulin clearance in obesity and type 2 diabetes. Int J Mol Sci. 23 (2), 596(2022).
- Bril, F., et al. Relationship between disease severity, hyperinsulinemia, and impaired insulin clearance in patients with nonalcoholic steatohepatitis. Hepatology. 59 (6), 2178-2187 (2014).
- Herman, R., Sikonja, J., Jensterle, M., Janez, A., Dolzan, V. Insulin metabolism in polycystic ovary syndrome: Secretion, signaling, and clearance. Int J Mol Sci. 24 (4), 3140(2023).
- Najjar, S. M., Caprio, S., Gastaldelli, A. Insulin clearance in health and disease. Annu Rev Physiol. 85, 363-381 (2023).
- Polidori, D. C., Bergman, R. N., Chung, S. T., Sumner, A. E. Hepatic and extrahepatic insulin clearance are differentially regulated: Results from a novel model-based analysis of intravenous glucose tolerance data. Diabetes. 65 (6), 1556-1564 (2016).
- Castillo, M. J., Scheen, A. J., Letiexhe, M. R., Lefebvre, P. J. How to measure insulin clearance. Diabetes Metab Rev. 10 (2), 119-150 (1994).
- Rubenstein, A. H., Pottenger, L. A., Mako, M., Getz, G. S., Steiner, D. F. The metabolism of proinsulin and insulin by the liver. J Clin Invest. 51 (4), 912-921 (1972).
- Terris, S., Steiner, D. F. Binding and degradation of 125i-insulin by rat hepatocytes. J Biol Chem. 250 (21), 8389-8398 (1975).
- Ooms, H. A., Arnould, Y., Rosa, U., Pennisi, G. F., Franckson, J. R. Total metabolic clearance of crystalline insulin and radio-iodide substitued insulin. Pathol Biol. 16 (5), 241-245 (1968).
- Defronzo, R. A., Tobin, J. D., Andres, R. Glucose clamp technique: A method for quantifying insulin secretion and resistance. Am J Physiol. 237 (3), E214-E223 (1979).
- Asare-Bediako, I., et al. Assessment of hepatic insulin extraction from in vivo surrogate methods of insulin clearance measurement. Am J Physiol Endocrinol Metab. 315 (4), E605-E612 (2018).
- Kim, S. P., Ellmerer, M., Kirkman, E. L., Bergman, R. N. Beta-cell "rest" accompanies reduced first-pass hepatic insulin extraction in the insulin-resistant, fat-fed canine model. Am J Physiol Endocrinol Metab. 292 (6), E1581-E1589 (2007).
- Kotsis, T., et al. Insulin metabolism and assessment of hepatic insulin extraction during liver regeneration. A study in a rat model. J Invest Surg. 33 (1), 69-76 (2020).
- Mondon, C. E., Olefsky, J. M., Dolkas, C. B., Reaven, G. M. Removal of insulin by perfused rat liver: Effect of concentration. Metabolism. 24 (2), 153-160 (1975).
- Tamaki, M., et al. The diabetes-susceptible gene SLC30A8/ZnT8 regulates hepatic insulin clearance. J Clin Invest. 123 (10), 4513-4524 (2013).
- Ghadieh, H. E., Gastaldelli, A., Najjar, S. M. Role of insulin clearance in insulin action and metabolic diseases. Int J Mol Sci. 24 (8), 7156(2023).
- Winther-Sorensen, M., Kemp, I. M., Bisgaard, H. C., Holst, J. J., Wewer Albrechtsen, N. J. Hepatic glucose production, ureagenesis, and lipolysis quantified using the perfused mouse liver model. J Vis Exp. 200, e65596(2023).
- Rydell-Tormanen, K., Johnson, J. R. The applicability of mouse models to the study of human disease. Methods Mol Biol. 1940, 3-22 (2019).
- Zaidi, S., et al. Loss of ceacam1 in hepatocytes causes hepatic fibrosis. Eur J Clin Invest. 54 (7), e14177(2024).
- Piccinini, F., Bergman, R. N. The measurement of insulin clearance. Diabetes Care. 43 (9), 2296-2302 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved