Method Article
Évaluation de la clairance de l’insuline chez la souris via la perfusion hépatique in situ
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
La clairance hépatique de l’insuline est essentielle pour réguler l’homéostasie du glucose. Cet article décrit une procédure de perfusion hépatique conviviale permettant d’évaluer directement le taux de clairance hépatique de l’insuline in situ chez la souris.
Résumé
La clairance hépatique de l’insuline est essentielle au maintien de l’homéostasie du glucose et est étroitement liée aux troubles métaboliques tels que l’obésité, la résistance à l’insuline et le diabète. Une mesure précise de la clairance de l’insuline est essentielle pour comprendre les mécanismes sous-jacents de ces affections. Ce protocole présente une procédure de perfusion hépatique simple et conviviale chez la souris, spécialement conçue pour évaluer directement le taux de clairance hépatique de l’insuline. La méthode implique une canulation précise de la veine porte et de la veine cave inférieure suprahépatique pour créer un système de perfusion in situ qui imite les conditions physiologiques. Le protocole guide les chercheurs à travers toutes les étapes de la procédure, de la préparation chirurgicale et la mise en place du système de perfusion à la collecte et à l’analyse des échantillons. Des instructions détaillées sont fournies, ainsi que des résultats représentatifs et des conseils importants pour optimiser la procédure. Un tutoriel vidéo accompagne le protocole écrit, offrant des instructions et des illustrations visuellement approfondies, ce qui en fait une référence accessible et complète pour les scientifiques qui explorent les mécanismes moléculaires à l’origine du métabolisme et de la clairance de l’insuline hépatique.
Introduction
La découverte de l’insuline est devenue l’un des jalons du siècle dernier. On sait beaucoup de choses sur la régulation de la synthèse et de la sécrétion d’insuline et de ses fonctions physiologiques dans les tissus métaboliques. Cependant, l’accent a été moins mis sur la dégradation de l’insuline et ses mécanismes de régulation. Le métabolisme de l’insuline peut être compris comme l’interaction entre la fonction des cellules bêta, la résistance à l’insuline (IR) ou la sensibilité et la clairance de l’insuline. Parallèlement à la sécrétion d’insuline, la clairance hépatique de l’insuline joue un rôle crucial dans le maintien du niveau homéostatique d’insuline nécessaire pour atteindre les tissus cibles périphériques et faciliter l’action correcte de l’insuline1. De nombreuses études ont identifié l’altération de la clairance de l’insuline comme un facteur crucial dans la pathogenèse de l’hyperinsulinémie dans le syndrome métabolique, ainsi que dans d’autres affections telles que le diabète de type 2 2,3, la stéatohépatite non alcoolique 4 et le syndrome des ovaires polykystiques5. Ainsi, l’hyperinsulinémie secondaire à une clairance réduite peut jouer un rôle dans la pathogenèse de la maladie métabolique. Les stratégies qui améliorent la clairance de l’insuline ont le potentiel d’inverser les effets défavorables de l’hyperinsulinémie chez ces personnes.
L’insuline a un mode de distribution unique. Le taux d’insuline plasmatique circulante dépend de l’équilibre entre la sécrétion et l’élimination de l’insuline. Le pancréas sécrète de l’insuline dans la veine porte de manière pulsatile, en la dirigeant vers les hépatocytes. En tant que premier organe à rencontrer la sécrétion d’insuline, le foie dégrade la majorité de l’insuline lors de son premier passage, représentant 60 à 70 % de l’insuline totale6. L’insuline restante sort du foie par la veine hépatique, entrant dans la circulation systémique, où elle est partiellement utilisée par les tissus périphériques (principalement les muscles, le tissu adipeux et les reins) avant d’être extraite par le foie lors de son deuxième passage dans l’artère hépatique7.
La mesure précise de la clairance de l’insuline est cruciale. Il est difficile de mesurer directement la clairance hépatique de l’insuline dans les études humaines, car il est difficile d’obtenir des échantillons de sang dans les veines porte et hépatiques. Des méthodes directes et indirectes sont utilisées pour estimer la clairance de l’insuline chez l’homme et les modèles animaux. Environ trois stratégies sont employées pour mesurer indirectement la clairance de l’insuline. Les évaluations les plus fréquemment utilisées dans la pratique clinique impliquent des méthodes basées sur le rapport molaire C-peptide/insuline8. Cette approche est fondée sur la sécrétion équimolaire des deux peptides et l’absence d’extraction du peptide C par le foie9. Le deuxième groupe de méthodes dépend de l’analyse mathématique des courbes de décroissance plasmatique de l’insuline après une entrée connue et spécifique de l’hormone dans la circulation 2,10,11. La troisième méthode est basée sur le fait que la perfusion d’insuline à un taux constant conduit à des niveaux stables de l’hormone dans le sang, où le taux d’élimination correspond au taux d’administration12. Ces méthodes indirectes reflètent principalement la clairance globale de l’insuline dans le corps. Étant donné que le foie est le principal site de clairance de l’insuline et joue un rôle crucial dans ce processus, il est essentiel d’évaluer directement la clairance hépatique de l’insuline.
Des études antérieures ont mesuré directement l’extraction hépatique de l’insuline chez des chiens en bonne santé13,14. Des études ont également utilisé un modèle isolé de foie de rat perfusé pour évaluer l’extraction de l’insuline du foie15,16. En raison de la grande disponibilité des souches génétiquement modifiées, les souris servent de modèles précieux pour l’étude des voies moléculaires. Quelques étudesont utilisé la perfusion hépatique pour évaluer directement la clairance hépatique de l’insuline dans un modèle murin. Dans ces études, un perfusat contenant de l’insuline humaine est perfusé dans la veine porte et prélevé dans la veine cave inférieure. La proportion d’insuline absorbée par le foie indique sa clairance. La technique de perfusion hépatique maintient le foie dans des conditions quasi physiologiques en faisant circuler un perfusat chaud, oxygéné et enrichi en nutriments à travers le système vasculaire hépatique. Cependant, il n’y a pas suffisamment d’orientations pratiques et de conseils essentiels pour faire progresser et diffuser cette technique.
Ainsi, alors que la clairance hépatique de l’insuline a fait l’objet d’une attention croissante, son rôle dans les troubles, ainsi que ses mécanismes moléculaires, restent incertains18. Par conséquent, les techniques de pointe sont grandement nécessaires dans le domaine de la recherche scientifique. Ce protocole établit une procédure détaillée de perfusion hépatique modifiée chez la souris pour évaluer la clairance hépatique de l’insuline. De plus, cette méthode peut également être utilisée pour étudier les effets des médicaments sur le foie, y compris l’effet de premier passage, les processus de transport des médicaments et divers autres aspects.
Protocole
Ce protocole a été approuvé par le Comité de protection et d’utilisation des animaux de l’Université de médecine de Nanjing (IACUC-2105018) et a suivi les directives du Comité institutionnel de protection et d’utilisation des animaux. Toutes les souris C57BL/6N ont été maintenues sur un cycle lumière/obscurité de 12 heures avec un accès libre à la nourriture et à l’eau. Des souris âgées de six semaines ont été divisées au hasard en un groupe de régime Chow (CD) et un groupe de régime riche en graisses (HFD). Le groupe HFD a été nourri avec un régime riche en graisses à 60 % et a continué à suivre ce régime jusqu’à l’âge de 10 semaines. Le poids corporel moyen était de 28,55 g ± 1,2 g pour le groupe HFD et de 24,3 g ± 0,48 g pour le groupe témoin. Les détails des réactifs et de l’équipement utilisés dans cette étude sont énumérés dans la table des matériaux.
1. Préparation
- Effectuer la stérilisation requise des instruments chirurgicaux et des consommables par autoclavage.
- Placez les instruments chirurgicaux, la suture en soie 6-0, le petit applicateur de coton stérile, l’injection de chlorure de sodium (500 ml), les cotons-tiges et les éponges de manière appropriée sur la table d’opération.
- Préparer 30 mL de solution saline héparinée à la concentration finale de 200 UI/mL.
- Préparez deux tubes en silicone d’un diamètre intérieur de 0,31 mm et d’un diamètre extérieur de 0,64 mm ; L’un de 4 cm de long pour être utilisé comme cathéter de veine porte, et l’autre de 10 cm de long pour être utilisé comme cathéter de la veine cave inférieure.
- Préparez le tampon de perfusion Krebs-Henseleit (KRBH) contenant 5,0 mmol/L de glucose et 0,25 % de BSA.
- Préparez le tampon de perfusion Krebs-Henseleit (KRBH) contenant 5,0 mmol/L de glucose, 0,25 % de BSA et 4,0 ng/mL d’insuline humaine.
- Mettre en place le système de perfusion hépatique. La figure 1 montre les principaux composants du système de perfusion hépatique.
2. Cathétérisme chirurgical
- Préparez le mélange anesthésique en suivant les étapes ci-dessous :
- Diluer Zoletil 50 (250 mg/5 mL) 10 fois avec une solution de chlorure de sodium à 0,9 %.
- Diluer 10 fois le chlorhydrate de xylazine (200 mg/2 mL) avec une solution de chlorure de sodium à 0,9 %.
- Mélanger la solution de Zoletil 50 à 0,5 % avec la solution de chlorhydrate de xylazine à 1 % dans un rapport de 1:1.
- Anesthésier les souris.
- Vérifiez et enregistrez le poids corporel de la souris. Administrer le mélange anesthésique par injection intrapéritonéale à une dose de 5 mL/kg de poids corporel (2,5 mg/mL de Zoletil 50 ; 5 mg/mL de chlorhydrate de xylazine). Le début de l’anesthésie se produit généralement dans les 5 à 10 minutes suivant l’injection, indiqué par la perte du réflexe de redressement et une réponse réduite aux stimuli externes.
- Transférez la souris sur la table d’opération. Fixez les membres à l’aide de ruban adhésif. Administrer 2,5 U/g d’héparine par voie intrapéritonéale pour obtenir l’héparinisation.
- Utilisez un rasoir électrique pour couper la fourrure de la peau abdominale et désinfectez la zone avec une solution de povidone iodée.
- Effectuer un cathétérisme de la veine porte.
- Faites une incision longitudinale de 4 cm du bas-ventre vers l’apophyse xiphoïde le long de la ligne médiane. Coupez soigneusement le péritoine avec des ciseaux pour éviter d’endommager les organes viscéraux. Insérez l’écarteur abdominal de la souris pour exposer le champ opératoire.
- Déplacez les intestins vers la droite pour révéler la veine porte, le rein droit et la veine cave inférieure (Figure 2A). Utilisez une pince artérielle pour clamper la veine cave sur le bord supérieur du rein.
- Isolez la veine porte (Figure 2A) et ligaturez l’extrémité distale avec une suture en soie 6-0. Attachez sans serrer une autre suture à l’extrémité proximale du vaisseau exposé.
- Faites une incision près de l’extrémité ligaturée avec des ciseaux à ressort et insérez le cathéter. Faites avancer le cathéter à travers l’incision jusqu’au niveau de la bifurcation porte.
- Fixez les deux ligatures autour du cathéter et confirmez le bon prélèvement en connectant l’extrémité libre du cathéter à une seringue de prélèvement. Rincer avec une solution saline héparinisée et clamper le cathéter (Figure 2C).
- Retirez le dispositif de traction et réinitialisez les intestins. Couvrez la zone chirurgicale avec de la gaze stérile imbibée de solution saline ou du coton.
- Effectuer un cathétérisme de la veine cave inférieure suprahépatique.
- Faites une incision le long du sternum à partir de l’apophyse xiphoïde, exposant le sternum.
- Ouvrez verticalement le sternum et coupez à travers le diaphragme le long du bord des côtes pour exposer la cavité thoracique.
- Exposer et isoler la veine cave inférieure suprahépatique (figure 2B). Ligaturez soigneusement l’extrémité distale avec une suture en soie 6-0. Attachez sans serrer une autre suture à l’extrémité proximale du vaisseau.
- Faites une incision juste en dessous de l’extrémité ligaturée avec des ciseaux à ressort et insérez un cathéter de 10 cm. Avancez le cathéter jusqu’à ce que l’extrémité du cathéter soit près du foie et attachez solidement les deux ligatures. Confirmez que le prélèvement est correct et clampez l’extrémité libre du cathéter (figure 2D).
- Rincez la zone chirurgicale avec une solution saline. Couvrez la surface avec de la gaze stérile imbibée de solution saline.
3. Perfusion hépatique
- Euthanasier la souris en utilisant une surdose d’anesthésique et une thoracotomie conformément aux lignes directrices de l’établissement pour le soin et l’utilisation des animaux, en veillant à ce que toutes les procédures soient effectuées de manière à minimiser la souffrance.
- Installez le système de perfusion hépatique, qui comprend un oxygénateur, un dispositif de modulation de température, une pompe à perfusion et des tubes de perfusion, comme illustré à la figure 1.
- Fournir un flux gazeux continu de 95 % d’oxygène et 5 % de dioxyde de carbone à l’oxygénateur.
- Allumez le bain-marie et préchauffez la chambre de l’orgue à 37 °C.
- Préparez le tampon de perfusion KRBH avec et sans insuline. Amorcez le système de tuyauterie avec le tampon de perfusion incubé dans un bain-marie à 37 °C.
REMARQUE : Le KRBH est exempt de BSA et de glucose. Le tampon de perfusion KRBH sans insuline humaine contient 5,0 mmol/L de glucose et 0,25 % de BSA, tandis que le tampon de perfusion KRBH avec insuline humaine contient 5,0 mmol/L de glucose, 0,25 % de BSA et 4,0 ng/mL d’insuline humaine. - Placez la souris dans un récipient avec la température ambiante maintenue à environ 37 °C. Utilisez un coussin chauffant pour maintenir la température corporelle à 37 °C.
- Perfuser le tampon KRBH à travers le cathéter veineux porte. Réglez le débit de perfusion à 0,2 mL/min à l’aide d’une mini-pompe.
- Observez que le foie pâlit en quelques secondes, ce qui indique que le tampon de perfusion circule dans le foie. Pour éliminer plus de cellules sanguines restantes dans le foie, interrompez la perfusion pendant 1 minute aux points de 4 minutes et de 8 minutes, en commençant le moment au début de la perfusion.
- Perfuser le foie avec le tampon KRBH pendant un total de 10 minutes (à l’exclusion des deux pauses de 1 minute), représentant la période d’équilibre. Prélevez l’échantillon basal à partir du cathéter de la veine cave inférieure.
- Perfuser le foie avec la même solution enrichie en insuline (4,0 ng/mL d’insuline humaine) pendant 30 minutes supplémentaires.
- Prélever tous les échantillons du tube de la veine cave inférieure toutes les 2 minutes.
- Enregistrez le poids du foie après la perfusion. Prélever des échantillons de foie dans différents lobes, les congeler immédiatement dans de l’azote liquide, puis les transférer à -80 °C pour le stockage.
- La centrifugeuse a collecté tous les échantillons de perfusion à ~1 000 x g pendant 10 min à 4 °C. Récupérez les surnageants et transférez-les à -80 °C pour le stockage.
REMARQUE : La concentration d’insuline dans les échantillons de perfusion est mesurée à l’aide de kits de test immuno-enzymatique (ELISA) humains. - Après l’intervention, assurez-vous que tous les déchets biologiques sont éliminés conformément aux règles de sécurité.
4. Analyse des données
- Présentez les données dans des graphiques XY montrant la concentration d’insuline au fil du temps.
- Calculez le taux moyen de clairance hépatique de l’insuline (HICR AVE) à l’aide de la formule suivante :
HICR AVE = (1−Cf/Ci) × 100 %
où Ci = concentration initiale d’insuline du tampon de perfusion, Cf = concentration moyenne finale d’insuline au cours des 10 dernières minutes à partir de la veine cave inférieure suprahépatique.
Résultats
Ce protocole décrit la procédure de perfusion hépatique pour calculer directement la clairance hépatique de l’insuline. Ce modèle est fiable et reproductible. La figure 3 donne un exemple des résultats obtenus à partir d’une expérience. Après une période d’équilibre de 10 minutes, le tampon KRBH complété par 4,0 ng/mL d’insuline humaine a été perfusé par la veine porte pendant 30 min. Le liquide de perfusion a été prélevé à partir du cathéter dans la veine cave inférieure suprahépatique à des intervalles de 2 minutes, et la concentration d’insuline humaine dans le liquide de perfusion a été mesurée. Les résultats sont présentés ici sous forme de ± moyenne SEM. La figure 3 montre un exemple d’expérience de perfusion hépatique comparant des souris suivant un régime témoin (CD) à des souris suivant un régime riche en graisses (HFD). Le taux de clairance hépatique de l’insuline (HICR AVE) était de 55,57 % ± 4,43 % pour le groupe CD et de 25,37 % ± 6,83 % pour le groupe HFD (Figure 3B). Les résultats indiquent qu’une alimentation riche en graisses entraîne une altération de la clairance de l’insuline.
Après la perfusion, des échantillons de foie ont été prélevés pour la coloration à l’hématoxyline et à l’éosine (HE) et le balayage de la lame entière ; Un foie bien irrigué, un foie mal irfusé et un échantillon de foie témoin provenant d’une souris normale ont été prélevés. Dans de meilleures conditions de perfusion, la structure du tissu hépatique était normale, les cordons hépatiques étaient disposés radialement et proprement, les hépatocytes étaient de forme intacte, le cytoplasme était uniformément coloré et le noyau était clair et rond, presque impossible à distinguer de celui du foie normal (Figure 4A,B). Lorsque la perfusion était mauvaise, les hépatocytes étaient œdémateux et nettement lâches, avec une nécrose ponctuée autour des veines centrales, une dégénérescence vacuolaire dans le cytoplasme, une pycnose nucléaire et un décollement vasculaire (Figure 4C). Les taux d’alanine aminotransférase (ALT) et d’aspartate aminotransférase (AST) dans le perfusat ont été mesurés au départ et après la perfusion pour évaluer la fonction hépatocytaire. Les résultats ont indiqué qu’il n’y avait pas de différence significative entre les niveaux d’ALT et d’AST (figure 4D).
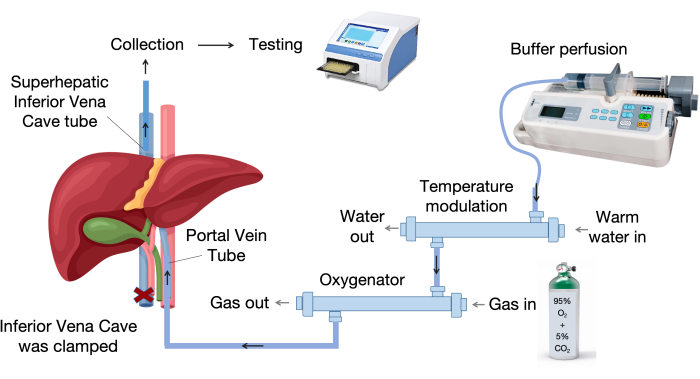
Figure 1 : Composants du système de perfusion. Le système de perfusion se compose de composants clés, notamment une pompe à perfusion, une unité de contrôle de la température et un oxygénateur. L’appareil à température variable maintient le liquide de perfusion à 37 °C, tandis que l’oxygénateur à membrane utilise des fibres creuses en polypropylène pour un échange gazeux efficace. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Localisation anatomique et cathétérisme. (A,B) Représente les emplacements anatomiques de la veine porte et de la veine cave inférieure. (C) Le cathéter de la veine porte est positionné juste en dessous de la bifurcation dans les branches hépatiques gauche et droite, avec une pince de vaisseau appliquée sur la veine cave inférieure intrahépatique. (D) Le cathéter est inséré dans la veine cave inférieure suprahépatique et placé près du bord supérieur du foie. Veuillez cliquer ici pour voir une version agrandie de cette figure.
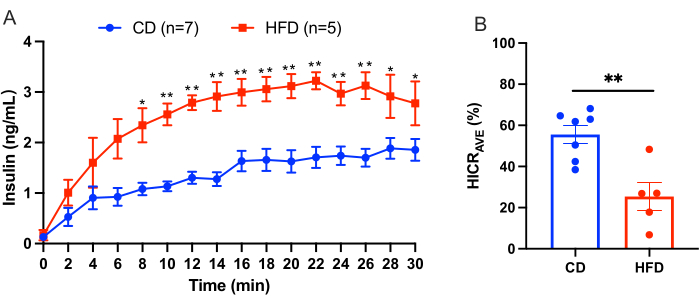
Figure 3 : Résultats de l’expérience de perfusion hépatique. Résultats d’une expérience de perfusion hépatique comparant des souris suivant un régime témoin (CD) à des souris suivant un régime riche en graisses (HFD). (A) Concentrations d’insuline pendant la perfusion hépatique chez les souris MC (bleu, n = 7) par rapport aux souris HFD (rouge, n = 5). (B) Taux moyen de clairance hépatique de l’insuline (HICRAVE). ±La signification statistique est indiquée par *p < 0,05, **p < 0,01 par rapport aux souris CD, analysées à l’aide d’un test t non apparié. Les résultats suggèrent qu’une alimentation riche en graisses entraîne une altération de la clairance de l’insuline. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Impact de la perfusion sur l’histologie et la fonction hépatiques. (A) Morphologie normale du foie de souris (contrôle). (B) Morphologie du foie dans des conditions de perfusion accrues. (C) Morphologie hépatique dans des conditions de perfusion sous-optimales. La flèche rouge indique le détachement du vaisseau, la flèche noire indique la vacuolisation et la flèche verte met en évidence la pycnose du noyau. Grossissement : 40x. (D) Niveaux d’alanine aminotransférase (ALT) et d’aspartate aminotransférase (AST) dans le perfusat, mesurés au départ et après la perfusion. La méthode du test t apparié a été utilisée pour l’analyse. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Étapes critiques du protocole
Les interventions chirurgicales décrites ci-dessus doivent être effectuées avec soin afin d’éviter de créer des lésions hépatiques. De plus, la structure fragile de la paroi vasculaire veineuse du foie la rend vulnérable à la ponction et aux saignements ultérieurs si elle n’est pas manipulée avec soin lors de la canulation. Des tubes en silicone plus souples sont utilisés dans ce protocole pour minimiser les dommages aux vaisseaux sanguins. Il est recommandé que le cathétérisme soit effectué par un chirurgien expérimenté qui devrait pratiquer fréquemment afin d’augmenter le taux de réussite de l’intubation et de minimiser la durée de l’intervention.
Le champ opératoire doit être irrigué de temps en temps avec une solution saline chaude pour maintenir la viabilité des hépatocytes. Pendant la perfusion, la zone chirurgicale doit être protégée avec de la gaze stérile ou du coton. Cette pratique permet d’éviter une exposition prolongée à l’air, ce qui peut potentiellement altérer la fonction hépatocytaire.
Défis et solutions
Il est crucial de positionner l’extrémité du cathéter juste avant le point où la veine porte se ramifie dans les veines portes hépatiques gauche et droite. Si le cathéter est inséré trop profondément, une perfusion inégale entre les lobes du foie peut se produire. De plus, les bulles d’air doivent être soigneusement évitées pendant le processus de perfusion, car elles ont le potentiel d’induire une embolie gazeuse dans le foie. Cela peut avoir un impact significatif sur la perfusion du liquide atteignant les hépatocytes et, par conséquent, affecter la clairance de l’insuline.
Les 10 premières minutes de perfusion de tampon KH constituent la période d’équilibre, pendant laquelle la perfusion peut être suspendue 1 à 2 fois pendant 2 minutes à chaque fois pour évacuer autant que possible les cellules sanguines résiduelles dans la sinusoïde hépatique. Si du sang est observé dans l’échantillon prélevé après 15 minutes de perfusion continue, cela peut indiquer que les pinces vasculaires sur la veine cave inférieure hépatique ne sont pas correctement positionnées et doivent être vérifiées19. Si la perfusion est interrompue, des globules rouges peuvent apparaître dans l’échantillon prélevé lorsque la perfusion est recommencée en raison de cellules sanguines résiduelles dans les sinusoïdes hépatiques. Les globules rouges doivent être séparés par centrifugation avant les mesures d’insuline, car la présence d’enzymes dégradant l’insuline dans ces cellules peut potentiellement avoir un impact sur les niveaux d’insuline.
La durée du cathétérisme chirurgical, le temps d’ischémie-reperfusion hépatique et la quantité de gaz pénétrant dans la veine porte pendant la perfusion peuvent tous affecter la fonction des hépatocytes et, par conséquent, le taux d’élimination de l’insuline par le foie. L’étendue du dysfonctionnement hépatique peut être surveillée en mesurant les taux d’alanine aminotransférase (ALT), d’aspartate aminotransférase (AST), de lactate déshydrogénase (LDH) et de phosphatase alcaline (ALP), ainsi que par coloration H&E. Des recherches ont montré qu’après une opération réussie, le foie continue de fonctionner et de répondre pendant au moins 3 h19.
Importance et applications potentielles de la perfusion hépatique chez la souris
Les souris sont des sujets de recherche idéaux en raison de leur similitude génétique avec les humains, de leurs cycles de reproduction courts et de la disponibilitéd’outils de génie génétique avancés. Dans des modèles murins, la clairance de l’insuline peut être évaluée à l’aide de plusieurs méthodes. Au cours du test de tolérance au glucose intrapéritonéal (IPGTT), la clairance hépatique de l’insuline est mesurée comme le rapport entre l’aire sous la courbe (AUC) (calculée par la méthode trapézoïdale) du peptide C et de l’insuline21. Au cours de l’opération clamp euglycémique-hyperinsulinémie, le rapport entre le débit de perfusion d’insuline exogène et la concentration plasmatique d’insuline à l’état d’équilibre qui en résulte peut être utilisé comme méthode pour estimer indirectement la clairance de l’insuline22. Cependant, ces méthodes évaluent toutes indirectement la clairance hépatique de l’insuline.
Certains chercheurs utilisent également des tests cellulaires pour évaluer la dégradation de l’insuline. Les cellules HepG2 ou les hépatocytes primaires de souris sont ensemencés dans des plaques de culture et une concentration appropriée d’insuline humaine est ajoutée. Des échantillons du milieu de culture sont prélevés à des intervalles précis pour mesurer la concentration d’insuline humaine et évaluer sa dégradation au fil du temps17. Dans ce protocole, une procédure de perfusion hépatique in situ conviviale chez la souris est décrite pour évaluer directement le taux de clairance hépatique de l’insuline. Par rapport aux études in vitro utilisant des hépatocytes isolés, la perfusion hépatique présente les avantages de préserver l’architecture hépatique, la division zonale, la polarité et l’intégrité vasculaire.
Le système de perfusion hépatique de souris est un outil précieux pour étudier la dynamique et les mécanismes moléculaires du métabolisme hépatique de l’insuline. De plus, ce protocole pourrait être largement utilisé non seulement dans les modèles de maladies pré-induites, mais aussi dans les tests de stimulus de provocation aiguë. Cependant, cette technique est limitée en ce sens qu’elle doit être réalisée in situ. Ce protocole implique une technique de cathétérisme chirurgical modifiée qui minimise les blessures et préserve l’intégrité anatomique du foie dans la mesure du possible. Des efforts supplémentaires sont nécessaires pour tirer le meilleur parti de cette technologie afin d’élucider les mécanismes de clairance de l’insuline, en particulier dans les maladies métaboliques associées à la résistance à l’insuline.
Déclarations de divulgation
Aucun conflit d’intérêts n’a été déclaré.
Remerciements
Ce travail a été soutenu par la Fondation nationale des sciences naturelles de Chine (82200948, 82270921, 82170882).
matériels
| Name | Company | Catalog Number | Comments |
| 60% high-fat diet | Research Diets, USA | D12492 | |
| Alanine aminotransferase Assay Kit | Nanjing Jiancheng Bioengineering Institute | C009-2-1 | |
| Anhydrous Glucose | Sangon Biotech | 50-99-7 | 500 G |
| Aspartate aminotransferase Assay Kit | Nanjing Jiancheng Bioengineering Institute | C010-2-1 | |
| Bovine Serum Albumin | GeminiBio | 700-107P | Fatty Acid-Free |
| Contour TS Blood Glucose Meter | Bayer | PH220800019 | |
| Contour TS Blood Glucose Test Strips | Bayer | DP38M3F05A | |
| Heparin Sodium | Changzhou Qian hong Bio-pharma | H32022088 | 12500 U/2mL |
| Human insulin | Novo Nordisk | S20191007 | 300 U/3mL |
| Human insulin immunoassay kit | Ezassay Biotechnology | HM200 | |
| KRBH buffer (Sugar, BSA free) | coolaber | SL65501 | 500 mL |
| Membrane oxygenator | Xi'an Xijing Medical Appliance | 5 | |
| Microscopic scissors | Shanghai Jinzhong | YBC020 | |
| Micro-serrefine clamp | Ningbo Medical Needle | 180709 | |
| Microsurgery forceps | Shanghai Jinzhong | WA3010, WA3020 | |
| Needle type filter | N-buliv | LG05-133-2 | |
| Povidone-iodine Solution | Shanghai likang Disinfectant Hi-Tech | 20231016J | |
| pump 11 Elite | Harvard Apparatus | PC5 70-4500 | |
| Retractor | Globalebio (Beijing) Technology | GEKK-10mm | 10 mm |
| Silicone Tubing | scientific commodities | #BB518-12 | 0.31 mm × 0.64 mm |
| Silicone Tubing | Fisher Scientific | #11-189-15A | ID 0.5 mm |
| Sodium Chloride Injection | Baxter | S2402023 | 4.5 g/500 mL |
| Surgical silk suture | Yangzhou Huanyu Medical Equipment | 6-0 | |
| Temperature modulation | Xi'an Xijing Medical Appliance | 6 | |
| Thermostatic water bath | Jiaxing Junsi Electronics | HIH-1 | 220 V 50 HZ |
| Three-way Joint | YISAI | AQTCY1.6 | ID 0.4 mm |
| Xylazine Hydrochloride Injection | ShengXin | 20240106 | 200 mg/2mL |
| Zoletil 50 | Virbac | WK001 | 250 mg/5mL |
Références
- Najjar, S. M., Perdomo, G. Hepatic insulin clearance: Mechanism and physiology. Physiology (Bethesda). 34 (3), 198-215 (2019).
- Fu, Z., et al. Impaired insulin clearance as the initial regulator of obesity-associated hyperinsulinemia: Novel insight into the underlying mechanism based on serum bile acid profiles. Diabetes Care. 45 (2), 425-435 (2022).
- Koh, H. E., Cao, C., Mittendorfer, B. Insulin clearance in obesity and type 2 diabetes. Int J Mol Sci. 23 (2), 596 (2022).
- Bril, F., et al. Relationship between disease severity, hyperinsulinemia, and impaired insulin clearance in patients with nonalcoholic steatohepatitis. Hepatology. 59 (6), 2178-2187 (2014).
- Herman, R., Sikonja, J., Jensterle, M., Janez, A., Dolzan, V. Insulin metabolism in polycystic ovary syndrome: Secretion, signaling, and clearance. Int J Mol Sci. 24 (4), 3140 (2023).
- Najjar, S. M., Caprio, S., Gastaldelli, A. Insulin clearance in health and disease. Annu Rev Physiol. 85, 363-381 (2023).
- Polidori, D. C., Bergman, R. N., Chung, S. T., Sumner, A. E. Hepatic and extrahepatic insulin clearance are differentially regulated: Results from a novel model-based analysis of intravenous glucose tolerance data. Diabetes. 65 (6), 1556-1564 (2016).
- Castillo, M. J., Scheen, A. J., Letiexhe, M. R., Lefebvre, P. J. How to measure insulin clearance. Diabetes Metab Rev. 10 (2), 119-150 (1994).
- Rubenstein, A. H., Pottenger, L. A., Mako, M., Getz, G. S., Steiner, D. F. The metabolism of proinsulin and insulin by the liver. J Clin Invest. 51 (4), 912-921 (1972).
- Terris, S., Steiner, D. F. Binding and degradation of 125i-insulin by rat hepatocytes. J Biol Chem. 250 (21), 8389-8398 (1975).
- Ooms, H. A., Arnould, Y., Rosa, U., Pennisi, G. F., Franckson, J. R. Total metabolic clearance of crystalline insulin and radio-iodide substitued insulin. Pathol Biol. 16 (5), 241-245 (1968).
- Defronzo, R. A., Tobin, J. D., Andres, R. Glucose clamp technique: A method for quantifying insulin secretion and resistance. Am J Physiol. 237 (3), E214-E223 (1979).
- Asare-Bediako, I., et al. Assessment of hepatic insulin extraction from in vivo surrogate methods of insulin clearance measurement. Am J Physiol Endocrinol Metab. 315 (4), E605-E612 (2018).
- Kim, S. P., Ellmerer, M., Kirkman, E. L., Bergman, R. N. Beta-cell "rest" accompanies reduced first-pass hepatic insulin extraction in the insulin-resistant, fat-fed canine model. Am J Physiol Endocrinol Metab. 292 (6), E1581-E1589 (2007).
- Kotsis, T., et al. Insulin metabolism and assessment of hepatic insulin extraction during liver regeneration. A study in a rat model. J Invest Surg. 33 (1), 69-76 (2020).
- Mondon, C. E., Olefsky, J. M., Dolkas, C. B., Reaven, G. M. Removal of insulin by perfused rat liver: Effect of concentration. Metabolism. 24 (2), 153-160 (1975).
- Tamaki, M., et al. The diabetes-susceptible gene SLC30A8/ZnT8 regulates hepatic insulin clearance. J Clin Invest. 123 (10), 4513-4524 (2013).
- Ghadieh, H. E., Gastaldelli, A., Najjar, S. M. Role of insulin clearance in insulin action and metabolic diseases. Int J Mol Sci. 24 (8), 7156 (2023).
- Winther-Sorensen, M., Kemp, I. M., Bisgaard, H. C., Holst, J. J., Wewer Albrechtsen, N. J. Hepatic glucose production, ureagenesis, and lipolysis quantified using the perfused mouse liver model. J Vis Exp. 200, e65596 (2023).
- Rydell-Tormanen, K., Johnson, J. R. The applicability of mouse models to the study of human disease. Methods Mol Biol. 1940, 3-22 (2019).
- Zaidi, S., et al. Loss of ceacam1 in hepatocytes causes hepatic fibrosis. Eur J Clin Invest. 54 (7), e14177 (2024).
- Piccinini, F., Bergman, R. N. The measurement of insulin clearance. Diabetes Care. 43 (9), 2296-2302 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon