Method Article
Avaliação da depuração de insulina em camundongos por meio de perfusão hepática in situ
Neste Artigo
Resumo
A depuração hepática da insulina é fundamental para regular a homeostase da glicose. Este artigo descreve um procedimento de perfusão hepática fácil de usar para avaliar diretamente a taxa de depuração da insulina hepática in situ em camundongos.
Resumo
A depuração hepática da insulina é essencial para manter a homeostase da glicose e está intimamente ligada a distúrbios metabólicos, como obesidade, resistência à insulina e diabetes. A medição precisa da depuração da insulina é vital para entender os mecanismos subjacentes dessas condições. Este protocolo apresenta um procedimento de perfusão hepática simples e fácil de usar em camundongos, projetado especificamente para avaliar diretamente a taxa de depuração de insulina hepática. O método envolve a canulação precisa da veia porta e da veia cava inferior supra-hepática para criar um sistema de perfusão in situ que imita as condições fisiológicas. O protocolo orienta os pesquisadores em todas as etapas do procedimento, desde a preparação cirúrgica e configuração do sistema de perfusão até a coleta e análise de amostras. Instruções detalhadas são fornecidas, juntamente com resultados representativos e dicas importantes para otimizar o procedimento. Um tutorial em vídeo acompanha o protocolo escrito, oferecendo instruções e ilustrações visualmente detalhadas, tornando-o uma referência acessível e abrangente para cientistas que exploram os mecanismos moleculares por trás do metabolismo e depuração da insulina hepática.
Introdução
A descoberta da insulina tornou-se um dos marcos do século passado. Muito se sabe sobre a regulação da síntese de insulina, secreção e suas funções fisiológicas nos tecidos metabólicos. No entanto, tem havido menos foco na degradação da insulina e seus mecanismos regulatórios. O metabolismo da insulina pode ser entendido como a interação entre a função das células beta, a resistência ou sensibilidade à insulina (RI) e a depuração da insulina. Juntamente com a secreção de insulina, a depuração hepática de insulina desempenha um papel crucial na manutenção do nível homeostático de insulina necessário para atingir os tecidos-alvo periféricos e facilitar a ação adequada da insulina1. Vários estudos identificaram a depuração de insulina prejudicada como um fator crucial na patogênese da hiperinsulinemia na síndrome metabólica, bem como em outras condições, como diabetes tipo 22, esteato-hepatite não alcoólica4 e síndrome do ovário policístico5. Assim, a hiperinsulinemia secundária à depuração reduzida pode desempenhar um papel na patogênese da doença metabólica. Estratégias que melhoram a depuração da insulina têm o potencial de reverter os impactos desfavoráveis da hiperinsulinemia nesses indivíduos.
A insulina tem um padrão único de distribuição. O nível de insulina plasmática circulante depende do equilíbrio entre a secreção e a remoção de insulina. O pâncreas secreta insulina na veia porta de forma pulsátil, direcionando-a para os hepatócitos. Como o primeiro órgão a encontrar secreção de insulina, o fígado degrada a maior parte da insulina durante sua primeira passagem, respondendo por 60% a 70% do total de insulina6. A insulina remanescente sai do fígado pela veia hepática, entrando na circulação sistêmica, onde é parcialmente utilizada pelos tecidos periféricos (principalmente músculo, tecido adiposo e rins) antes de ser extraída pelo fígado durante sua segunda passagem pela artéria hepática7.
A medição precisa da depuração da insulina é crucial. Medir diretamente a depuração da insulina hepática em estudos em humanos é um desafio porque a obtenção de amostras de sangue das veias porta e hepática é difícil. Métodos diretos e indiretos são usados para estimar a depuração da insulina em humanos e modelos animais. Aproximadamente três estratégias são empregadas para medir a depuração de insulina indiretamente. As avaliações mais frequentemente utilizadas na prática clínica envolvem métodos baseados na relação molar peptídeo C/insulina8. Essa abordagem é fundamentada na secreção equimolar de ambos os peptídeos e na ausência de extração do peptídeo C pelo fígado9. O segundo grupo de métodos depende da análise matemática das curvas de decaimento plasmático da insulina após uma entrada conhecida e específica do hormônio na circulação 2,10,11. O terceiro método baseia-se no fato de que a infusão de insulina a uma taxa constante leva a níveis estáveis do hormônio no sangue, onde a taxa de remoção coincide com a taxa de administração12. Esses métodos indiretos refletem principalmente a depuração geral da insulina no corpo. Dado que o fígado é o principal local de depuração da insulina e desempenha um papel crucial nesse processo, é essencial avaliar diretamente a depuração da insulina hepática.
Estudos anteriores mediram diretamente a extração de insulina hepática em cães saudáveis 13,14. Estudos também usaram um modelo isolado de fígado de rato perfundido para avaliar a extração de insulina do fígado15,16. Devido à alta disponibilidade de cepas geneticamente modificadas, os camundongos servem como modelos valiosos para investigar vias moleculares. Alguns estudos17 utilizaram a perfusão hepática para avaliar diretamente a depuração de insulina hepática em um modelo de camundongo. Nesses estudos, um perfusato contendo insulina humana é infundido na veia porta e coletado da veia cava inferior. A proporção de insulina absorvida pelo fígado indica sua depuração. A técnica de perfusão hepática mantém o fígado em condições quase fisiológicas, circulando um perfusado quente, oxigenado e enriquecido com nutrientes através da vasculatura hepática. No entanto, não há orientação prática suficiente e dicas essenciais para o avanço e disseminação dessa técnica.
Assim, embora a depuração hepática de insulina tenha recebido atenção crescente, seu papel nos distúrbios, bem como seus mecanismos moleculares, permanecem obscuros18. Portanto, técnicas avançadas são muito necessárias no campo da pesquisa científica. Este protocolo estabelece um procedimento detalhado de perfusão hepática modificada em camundongos para avaliar a depuração hepática da insulina. Além disso, esse método também pode ser usado para estudar os efeitos dos medicamentos no fígado, incluindo o efeito de primeira passagem, processos de transporte de medicamentos e vários outros aspectos.
Protocolo
Este protocolo foi aprovado pelo Comitê de Cuidados e Uso de Animais da Universidade Médica de Nanjing (IACUC-2105018) e seguiu as diretrizes do Comitê Institucional de Cuidados e Uso de Animais. Todos os camundongos C57BL / 6N foram mantidos em um ciclo claro / escuro de 12 horas com livre acesso a comida e água. Camundongos de seis semanas de idade foram divididos aleatoriamente em um grupo de dieta Chow (CD) e um grupo de dieta rica em gordura (HFD). O grupo HFD foi alimentado com uma dieta rica em 60% de gordura e continuou com essa dieta até as 10 semanas de idade. O peso corporal médio foi de 28,55 g ± 1,2 g para o grupo HFD e 24,3 g ± 0,48 g para o grupo controle. Os detalhes dos reagentes e equipamentos usados neste estudo estão listados na Tabela de Materiais.
1. Preparação
- Realize a esterilização necessária de instrumentos cirúrgicos e consumíveis por meio de autoclavagem.
- Coloque os instrumentos cirúrgicos, sutura de seda 6-0, aplicador de algodão pequeno estéril, injeção de cloreto de sódio (500 mL), cotonetes e esponjas adequadamente na mesa de operação.
- Prepare 30 mL de solução salina heparinizada com uma concentração final de 200 UI / mL.
- Prepare dois tubos de silicone com diâmetro interno de 0,31 mm e diâmetro externo de 0,64 mm; um de 4 cm de comprimento para uso como cateter de veia porta e o outro de 10 cm de comprimento para uso como cateter de veia cava inferior.
- Prepare o tampão de perfusão Krebs-Henseleit (KRBH) contendo 5,0 mmol / L de glicose e 0,25% de BSA.
- Prepare o tampão de perfusão Krebs-Henseleit (KRBH) contendo 5,0 mmol / L de glicose, 0,25% de BSA e 4,0 ng / mL de insulina humana.
- Configure o sistema de perfusão hepática. A Figura 1 mostra os principais componentes do sistema de perfusão hepática.
2. Cateterismo cirúrgico
- Prepare a mistura anestésica seguindo os passos abaixo:
- Dilua Zoletil 50 (250 mg / 5 mL) 10 vezes com solução de cloreto de sódio a 0,9%.
- Dilua o cloridrato de xilazina (200 mg / 2 mL) 10 vezes com solução de cloreto de sódio a 0,9%.
- Misture a solução de Zoletil 50 a 0,5% com a solução de cloridrato de xilazina a 1% na proporção de 1:1.
- Anestesie os ratos.
- Verifique e registre o peso corporal do mouse. Administre a mistura anestésica por injeção intraperitoneal na dose de 5 mL / kg de peso corporal (2,5 mg / mL Zoletil 50; 5 mg / mL de cloridrato de xilazina). O início da anestesia geralmente ocorre dentro de 5 a 10 minutos após a injeção, indicado pela perda do reflexo de endireitamento e resposta reduzida a estímulos externos.
- Transfira o mouse para a mesa de operação. Prenda os membros com fita adesiva. Administre 2,5 U/g de heparina por via intraperitoneal para obter heparinização.
- Use um barbeador elétrico para aparar o pelo da pele abdominal e desinfete a área com uma solução de iodopovidona.
- Realize o cateterismo da veia porta.
- Faça uma incisão longitudinal de 4 cm do abdômen inferior em direção ao apêndice xifóide ao longo da linha abdominal média. Corte cuidadosamente o peritônio com uma tesoura para evitar danos aos órgãos viscerais. Insira o afastador abdominal do rato para expor o campo cirúrgico.
- Mova os intestinos para a direita para revelar a veia porta, o rim direito e a veia cava inferior (Figura 2A). Use uma pinça de artéria para prender a veia cava na borda superior do rim.
- Isole a veia porta (Figura 2A) e ligue a extremidade distal com uma sutura de seda 6-0. Amarre frouxamente outra sutura na extremidade proximal do vaso exposto.
- Faça uma incisão perto da extremidade ligada com uma tesoura de mola e insira o cateter. Avance o cateter através da incisão até o nível da bifurcação portal.
- Prenda ambas as ligaduras ao redor do cateter e confirme a amostragem adequada conectando a extremidade livre do cateter a uma seringa de amostragem. Lave com solução salina heparinizada e clampeie o cateter (Figura 2C).
- Remova o dispositivo de tração e reinicie os intestinos. Cubra a área cirúrgica com gaze estéril embebida em solução salina ou algodão.
- Realize cateterismo da veia cava inferior supra-hepática.
- Faça uma incisão ao longo do esterno a partir do processo xifóide, expondo o esterno.
- Corte verticalmente o esterno e corte o diafragma ao longo da margem da costela para expor a cavidade torácica.
- Expor e isolar a veia cava inferior supra-hepática (Figura 2B). Ligue cuidadosamente a extremidade distal com uma sutura de seda 6-0. Amarre frouxamente outra sutura na extremidade proximal do vaso.
- Faça uma incisão logo abaixo da extremidade ligada com uma tesoura de mola e insira um cateter de 10 cm. Avance o cateter até que a ponta do cateter esteja próxima ao fígado e amarre ambas as ligaduras com segurança. Confirme a amostragem adequada e clampeie a extremidade livre do cateter (Figura 2D).
- Enxágue a área cirúrgica com solução salina. Cubra a superfície com gaze estéril embebida em solução salina.
3. Perfusão hepática
- Eutanasiar o camundongo usando uma overdose de anestésico e toracotomia de acordo com as diretrizes institucionais para cuidados e uso de animais, garantindo que todos os procedimentos sejam realizados de maneira a minimizar o sofrimento.
- Configure o sistema de perfusão hepática, que inclui um oxigenador, um dispositivo de modulação de temperatura, uma bomba de infusão e tubos de infusão, conforme mostrado na Figura 1.
- Forneça um fluxo contínuo de gás de 95% de oxigênio e 5% de dióxido de carbono para o oxigenador.
- Ligue o banho-maria e pré-aqueça a câmara do órgão a 37 °C.
- Prepare o tampão de perfusão KRBH com e sem insulina. Preparar o sistema de tubagem com o tampão de perfusão incubado em banho-maria a 37 °C.
NOTA: O KRBH é livre de BSA e glicose. O tampão de perfusão KRBH sem insulina humana contém 5,0 mmol/L de glicose e 0,25% de BSA, enquanto o tampão de perfusão KRBH com insulina humana contém 5,0 mmol/L de glicose, 0,25% de BSA e 4,0 ng/mL de insulina humana. - Coloque o mouse em um recipiente com a temperatura ambiente mantida em aproximadamente 37 °C. Use uma almofada de aquecimento para manter a temperatura corporal a 37 °C.
- Infundir o tampão KRBH através do cateter da veia porta. Defina a taxa de infusão em 0,2 mL / min por meio de uma mini bomba.
- Observe que o fígado fica pálido em segundos, indicando que o tampão de perfusão está fluindo através do fígado. Para eliminar mais células sanguíneas restantes no fígado, pause a infusão por 1 minuto nos pontos de tempo de 4 e 8 minutos, iniciando o tempo no início da perfusão.
- Perfundir o fígado com tampão KRBH por um total de 10 min (excluindo as duas pausas de 1 min), representando o período de equilíbrio. Colete a amostra basal do cateter da veia cava inferior.
- Perfundir o fígado com a mesma solução enriquecida com insulina (4,0 ng/mL de insulina humana) por mais 30 min.
- Colete todas as amostras do tubo de veia cava inferior a cada 2 min.
- Registre o peso do fígado após a perfusão. Colete amostras de fígado de diferentes lóbulos, congele-as imediatamente em nitrogênio líquido e transfira para -80 ° C para armazenamento.
- Centrifugue todas as amostras de perfusão coletadas a ~ 1.000 x g por 10 min a 4 ° C. Recolher os sobrenadantes e transferi-los para -80 °C para armazenamento.
NOTA: A concentração de insulina em amostras de perfusão é medida usando kits de ensaio de imunoabsorção enzimática de insulina humana (ELISA). - Após o procedimento, certifique-se de que todos os resíduos biológicos sejam descartados de acordo com as normas de segurança.
4. Análise dos dados
- Apresente os dados em gráficos XY mostrando a produção da concentração de insulina ao longo do tempo.
- Calcule a taxa média de depuração da insulina hepática (HICRAVE) usando a seguinte fórmula:
HICRAVE = (1−Cf/Ci) × 100%
onde Ci = concentração inicial de insulina do tampão de infusão, Cf = concentração média final de insulina nos últimos 10 minutos da veia cava inferior supra-hepática.
Resultados
Este protocolo descreve o procedimento de infusão hepática para calcular a depuração da insulina hepática diretamente. Este modelo é confiável e reprodutível. Um exemplo dos resultados obtidos de um experimento é mostrado na Figura 3. Após um período de equilíbrio de 10 minutos, o tampão KRBH suplementado com 4,0 ng/mL de insulina humana foi perfundido através da veia porta por 30 minutos. O líquido de perfusão foi coletado do cateter na veia cava inferior supra-hepática em intervalos de 2 minutos, e a concentração de insulina humana no fluido de perfusão foi medida. Os resultados são apresentados aqui como a média ± SEM. Um exemplo de um experimento de perfusão hepática comparando camundongos em uma dieta controle (CD) com camundongos em uma dieta rica em gordura (HFD) é mostrado na Figura 3. A taxa de depuração de insulina hepática (HICRAVE) foi de 55,57% ± 4,43% para o grupo DC e 25,37% ± 6,83% para o grupo HFD (Figura 3B). Os resultados indicam que a alimentação com alto teor de gordura leva ao comprometimento da depuração da insulina.
Após a perfusão, amostras de fígado foram obtidas para coloração de hematoxilina e eosina (HE) e varredura de lâmina inteira; Um fígado bem perfundido, um fígado mal perfundido e uma amostra de fígado controle de um camundongo normal foram coletados. Em melhores condições de perfusão, a estrutura do tecido hepático era normal, os cordões hepáticos estavam dispostos radial e ordenadamente, os hepatócitos estavam intactos, o citoplasma estava uniformemente corado e o núcleo era claro e redondo, quase indistinguível do fígado normal (Figura 4A,B). Quando a perfusão era pobre, os hepatócitos eram edemaciados e marcadamente soltos, com necrose puntiforme ao redor das veias centrais, degeneração vacuolar no citoplasma, picnose nuclear e descolamento vascular (Figura 4C). Os níveis de alanina aminotransferase (ALT) e aspartato aminotransferase (AST) no perfusato foram medidos no início e após a perfusão para avaliar a função dos hepatócitos. Os resultados indicaram que não houve diferença significativa nos níveis de ALT e AST (Figura 4D).
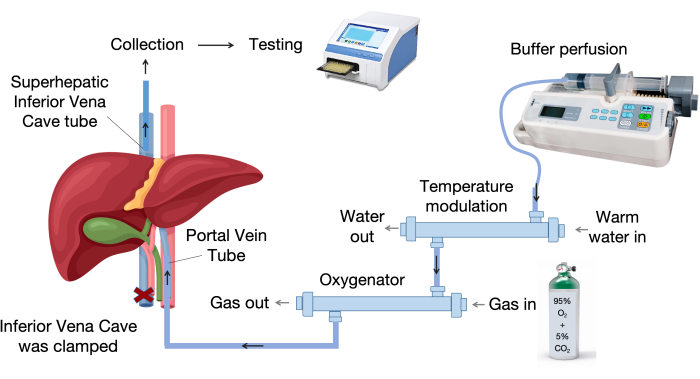
Figura 1: Componentes do sistema de perfusão. O sistema de perfusão consiste em componentes-chave, incluindo uma bomba de infusão, uma unidade de controle de temperatura e um oxigenador. O dispositivo de temperatura variável mantém o líquido de perfusão a 37 °C, enquanto o oxigenador de membrana utiliza fibras ocas de polipropileno para uma troca gasosa eficaz. Clique aqui para ver uma versão maior desta figura.

Figura 2: Localização anatômica e cateterismo. (A, B) Descreve as localizações anatômicas da veia porta e da veia cava inferior. (C) O cateter da veia porta é posicionado logo abaixo da bifurcação nos ramos hepáticos esquerdo e direito, com uma pinça de vaso aplicada na veia cava inferior intra-hepática. (D) O cateter é inserido na veia cava inferior supra-hepática e colocado próximo à margem superior do fígado. Clique aqui para ver uma versão maior desta figura.
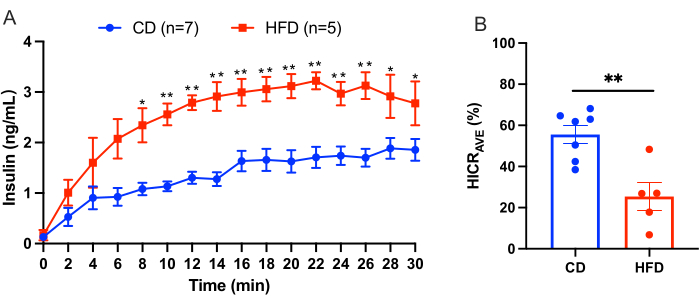
Figura 3: Resultados do experimento de perfusão hepática. Resultados de um experimento de perfusão hepática comparando camundongos em uma dieta de controle (CD) com camundongos em uma dieta rica em gordura (HFD). (A) Concentrações de insulina durante a perfusão hepática em camundongos CD (azul, n = 7) versus camundongos HFD (vermelho, n = 5). (B) Taxa média de depuração da insulina hepática (HICRAVE). Todos os dados são apresentados como média ± EPM. A significância estatística é indicada como *p < 0,05, **p < 0,01 em relação aos camundongos CD, analisados por meio de um teste t não pareado. Os resultados sugerem que a alimentação com alto teor de gordura leva à depuração prejudicada da insulina. Clique aqui para ver uma versão maior desta figura.

Figura 4: Impacto da perfusão na histologia e função hepática. (A) Morfologia normal do fígado de camundongo (controle). (B) Morfologia hepática em condições de perfusão aprimorada. (C) Morfologia hepática em condições de perfusão abaixo do ideal. A seta vermelha indica descolamento do vaso, a seta preta denota vacuolização e a seta verde destaca a picnose do núcleo. Ampliação: 40x. (D) Níveis de alanina aminotransferase (ALT) e aspartato aminotransferase (AST) no perfusato, medidos no início e após a perfusão. O método de teste t pareado foi empregado para análise. Clique aqui para ver uma versão maior desta figura.
Discussão
Etapas críticas no protocolo
Os procedimentos cirúrgicos descritos acima devem ser realizados com cuidado suave para evitar a criação de lesões no fígado. Além disso, a estrutura frágil da parede do vaso da veia hepática a torna vulnerável a punções e sangramento subsequente se não for manuseada com cuidado durante a canulação. Tubos de silicone mais macios são utilizados neste protocolo para minimizar os danos aos vasos sanguíneos. Recomenda-se que o cateterismo seja realizado por um cirurgião experiente, que deve praticar com frequência para aumentar a taxa de sucesso da intubação e minimizar a duração do procedimento.
O campo cirúrgico deve ser ocasionalmente irrigado com solução salina morna para manter a viabilidade dos hepatócitos. Durante a perfusão, a área cirúrgica deve ser protegida com gaze ou algodão estéril. Essa prática evita a exposição prolongada ao ar, o que pode prejudicar a função dos hepatócitos.
Desafios e soluções
É crucial posicionar a ponta do cateter logo antes do ponto em que a veia porta se ramifica nas veias porta hepáticas esquerda e direita. Se o cateter for inserido muito profundamente, pode ocorrer perfusão desigual entre os lobos do fígado. Além disso, as bolhas de ar devem ser cuidadosamente evitadas durante o processo de infusão, pois têm o potencial de induzir embolia gasosa no fígado. Isso pode afetar significativamente a perfusão do fluido que atinge os hepatócitos e, subsequentemente, afetar a depuração da insulina.
Os primeiros 10 minutos de infusão de tampão KH constituem o período de equilíbrio, durante o qual a perfusão pode ser suspensa 1-2 vezes por 2 minutos de cada vez para liberar as células sanguíneas residuais no sinusóide hepático o máximo possível. Se for observado sangue na peça coletada após 15 min de perfusão contínua, isso pode indicar que a pinça vascular na veia cava inferior hepática não está posicionada adequadamente e deve ser verificada19. Se a perfusão for pausada, podem aparecer glóbulos vermelhos na amostra recolhida quando a perfusão for reiniciada devido a células sanguíneas residuais nos sinusóides hepáticos. Os glóbulos vermelhos devem ser separados por centrifugação antes das medições de insulina, pois a presença de enzimas degradadoras de insulina dentro dessas células pode afetar os níveis de insulina.
A duração do cateterismo cirúrgico, o tempo de isquemia-reperfusão hepática e a quantidade de gás que entra na veia porta durante a perfusão podem afetar a função dos hepatócitos e, portanto, a taxa de depuração de insulina pelo fígado. A extensão da disfunção hepática pode ser monitorada medindo os níveis de alanina aminotransferase (ALT), aspartato aminotransferase (AST), lactato desidrogenase (LDH) e fosfatase alcalina (ALP), bem como pela coloração H & E. A pesquisa mostrou que, após uma operação bem-sucedida, o fígado continua a funcionar e responder por pelo menos 3 h19.
Importância e potenciais aplicações da perfusão hepática de camundongos
Os camundongos são sujeitos de pesquisa ideais devido à sua semelhança genética com os humanos, ciclos reprodutivos curtos e disponibilidade de ferramentas avançadas de engenharia genética20. Em modelos de camundongos, a depuração da insulina pode ser avaliada usando vários métodos. Durante o teste de tolerância à glicose intraperitoneal (IPGTT), a depuração hepática de insulina é medida como a razão entre a área sob a curva (AUC) (calculada pelo método trapezoidal) do peptídeo C para a insulina21. Durante o clamp euglicêmico-hiperinsulinemia, a razão entre a taxa de infusão de insulina exógena e a concentração plasmática de insulina no estado estacionário resultante pode ser usada como um método para estimar indiretamente a depuração de insulina22. No entanto, todos esses métodos avaliam indiretamente a depuração da insulina hepática.
Alguns pesquisadores também usam ensaios baseados em células para avaliar a degradação da insulina. Células HepG2 ou hepatócitos primários de camundongos são semeados em placas de cultura e uma concentração apropriada de insulina humana é adicionada. Amostras do meio de cultura são coletadas em intervalos específicos para medir a concentração de insulina humana e avaliar sua degradação ao longo do tempo17. Neste protocolo, um procedimento de perfusão hepática in situ fácil de usar em camundongos é descrito para avaliar diretamente a taxa de depuração da insulina hepática. Em comparação com estudos in vitro usando hepatócitos isolados, a perfusão hepática tem os benefícios de preservar a arquitetura hepática, a divisão zonal, a polaridade e a integridade vascular.
O sistema de perfusão hepática de camundongos é uma ferramenta valiosa para investigar a dinâmica e os mecanismos moleculares do metabolismo hepático da insulina. Além disso, este protocolo pode ser amplamente utilizado não apenas em modelos de doenças pré-induzidas, mas também em testes de estímulo de desafio agudo. No entanto, essa técnica é limitada, pois deve ser realizada in situ. Este protocolo envolve uma técnica de cateterismo cirúrgico modificada que minimiza a lesão e preserva a integridade anatômica do fígado na maior extensão possível. Mais esforços são necessários para fazer o melhor uso dessa tecnologia para elucidar os mecanismos de depuração da insulina, especialmente em doenças metabólicas associadas à resistência à insulina.
Divulgações
Nenhum conflito de interesse foi declarado.
Agradecimentos
Este trabalho foi apoiado pela Fundação Nacional de Ciências Naturais da China (82200948, 82270921, 82170882).
Materiais
| Name | Company | Catalog Number | Comments |
| 60% high-fat diet | Research Diets, USA | D12492 | |
| Alanine aminotransferase Assay Kit | Nanjing Jiancheng Bioengineering Institute | C009-2-1 | |
| Anhydrous Glucose | Sangon Biotech | 50-99-7 | 500 G |
| Aspartate aminotransferase Assay Kit | Nanjing Jiancheng Bioengineering Institute | C010-2-1 | |
| Bovine Serum Albumin | GeminiBio | 700-107P | Fatty Acid-Free |
| Contour TS Blood Glucose Meter | Bayer | PH220800019 | |
| Contour TS Blood Glucose Test Strips | Bayer | DP38M3F05A | |
| Heparin Sodium | Changzhou Qian hong Bio-pharma | H32022088 | 12500 U/2mL |
| Human insulin | Novo Nordisk | S20191007 | 300 U/3mL |
| Human insulin immunoassay kit | Ezassay Biotechnology | HM200 | |
| KRBH buffer (Sugar, BSA free) | coolaber | SL65501 | 500 mL |
| Membrane oxygenator | Xi'an Xijing Medical Appliance | 5 | |
| Microscopic scissors | Shanghai Jinzhong | YBC020 | |
| Micro-serrefine clamp | Ningbo Medical Needle | 180709 | |
| Microsurgery forceps | Shanghai Jinzhong | WA3010, WA3020 | |
| Needle type filter | N-buliv | LG05-133-2 | |
| Povidone-iodine Solution | Shanghai likang Disinfectant Hi-Tech | 20231016J | |
| pump 11 Elite | Harvard Apparatus | PC5 70-4500 | |
| Retractor | Globalebio (Beijing) Technology | GEKK-10mm | 10 mm |
| Silicone Tubing | scientific commodities | #BB518-12 | 0.31 mm × 0.64 mm |
| Silicone Tubing | Fisher Scientific | #11-189-15A | ID 0.5 mm |
| Sodium Chloride Injection | Baxter | S2402023 | 4.5 g/500 mL |
| Surgical silk suture | Yangzhou Huanyu Medical Equipment | 6-0 | |
| Temperature modulation | Xi'an Xijing Medical Appliance | 6 | |
| Thermostatic water bath | Jiaxing Junsi Electronics | HIH-1 | 220 V 50 HZ |
| Three-way Joint | YISAI | AQTCY1.6 | ID 0.4 mm |
| Xylazine Hydrochloride Injection | ShengXin | 20240106 | 200 mg/2mL |
| Zoletil 50 | Virbac | WK001 | 250 mg/5mL |
Referências
- Najjar, S. M., Perdomo, G. Hepatic insulin clearance: Mechanism and physiology. Physiology (Bethesda). 34 (3), 198-215 (2019).
- Fu, Z., et al. Impaired insulin clearance as the initial regulator of obesity-associated hyperinsulinemia: Novel insight into the underlying mechanism based on serum bile acid profiles. Diabetes Care. 45 (2), 425-435 (2022).
- Koh, H. E., Cao, C., Mittendorfer, B. Insulin clearance in obesity and type 2 diabetes. Int J Mol Sci. 23 (2), 596(2022).
- Bril, F., et al. Relationship between disease severity, hyperinsulinemia, and impaired insulin clearance in patients with nonalcoholic steatohepatitis. Hepatology. 59 (6), 2178-2187 (2014).
- Herman, R., Sikonja, J., Jensterle, M., Janez, A., Dolzan, V. Insulin metabolism in polycystic ovary syndrome: Secretion, signaling, and clearance. Int J Mol Sci. 24 (4), 3140(2023).
- Najjar, S. M., Caprio, S., Gastaldelli, A. Insulin clearance in health and disease. Annu Rev Physiol. 85, 363-381 (2023).
- Polidori, D. C., Bergman, R. N., Chung, S. T., Sumner, A. E. Hepatic and extrahepatic insulin clearance are differentially regulated: Results from a novel model-based analysis of intravenous glucose tolerance data. Diabetes. 65 (6), 1556-1564 (2016).
- Castillo, M. J., Scheen, A. J., Letiexhe, M. R., Lefebvre, P. J. How to measure insulin clearance. Diabetes Metab Rev. 10 (2), 119-150 (1994).
- Rubenstein, A. H., Pottenger, L. A., Mako, M., Getz, G. S., Steiner, D. F. The metabolism of proinsulin and insulin by the liver. J Clin Invest. 51 (4), 912-921 (1972).
- Terris, S., Steiner, D. F. Binding and degradation of 125i-insulin by rat hepatocytes. J Biol Chem. 250 (21), 8389-8398 (1975).
- Ooms, H. A., Arnould, Y., Rosa, U., Pennisi, G. F., Franckson, J. R. Total metabolic clearance of crystalline insulin and radio-iodide substitued insulin. Pathol Biol. 16 (5), 241-245 (1968).
- Defronzo, R. A., Tobin, J. D., Andres, R. Glucose clamp technique: A method for quantifying insulin secretion and resistance. Am J Physiol. 237 (3), E214-E223 (1979).
- Asare-Bediako, I., et al. Assessment of hepatic insulin extraction from in vivo surrogate methods of insulin clearance measurement. Am J Physiol Endocrinol Metab. 315 (4), E605-E612 (2018).
- Kim, S. P., Ellmerer, M., Kirkman, E. L., Bergman, R. N. Beta-cell "rest" accompanies reduced first-pass hepatic insulin extraction in the insulin-resistant, fat-fed canine model. Am J Physiol Endocrinol Metab. 292 (6), E1581-E1589 (2007).
- Kotsis, T., et al. Insulin metabolism and assessment of hepatic insulin extraction during liver regeneration. A study in a rat model. J Invest Surg. 33 (1), 69-76 (2020).
- Mondon, C. E., Olefsky, J. M., Dolkas, C. B., Reaven, G. M. Removal of insulin by perfused rat liver: Effect of concentration. Metabolism. 24 (2), 153-160 (1975).
- Tamaki, M., et al. The diabetes-susceptible gene SLC30A8/ZnT8 regulates hepatic insulin clearance. J Clin Invest. 123 (10), 4513-4524 (2013).
- Ghadieh, H. E., Gastaldelli, A., Najjar, S. M. Role of insulin clearance in insulin action and metabolic diseases. Int J Mol Sci. 24 (8), 7156(2023).
- Winther-Sorensen, M., Kemp, I. M., Bisgaard, H. C., Holst, J. J., Wewer Albrechtsen, N. J. Hepatic glucose production, ureagenesis, and lipolysis quantified using the perfused mouse liver model. J Vis Exp. 200, e65596(2023).
- Rydell-Tormanen, K., Johnson, J. R. The applicability of mouse models to the study of human disease. Methods Mol Biol. 1940, 3-22 (2019).
- Zaidi, S., et al. Loss of ceacam1 in hepatocytes causes hepatic fibrosis. Eur J Clin Invest. 54 (7), e14177(2024).
- Piccinini, F., Bergman, R. N. The measurement of insulin clearance. Diabetes Care. 43 (9), 2296-2302 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
Usamos cookies para melhorar sua experiência em nosso site.
Ao continuar usando nosso site ou clicando em 'continuar', você concorda em aceitar nossos cookies.