Method Article
Beurteilung der Insulinclearance bei Mäusen mittels In-situ-Leberperfusion
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die hepatische Insulinclearance ist entscheidend für die Regulierung der Glukosehomöostase. Dieser Artikel beschreibt ein benutzerfreundliches hepatisches Perfusionsverfahren zur direkten Bewertung der hepatischen Insulinclearance-Rate in situ bei Mäusen.
Zusammenfassung
Die hepatische Insulinclearance ist für die Aufrechterhaltung der Glukosehomöostase unerlässlich und steht in engem Zusammenhang mit Stoffwechselstörungen wie Fettleibigkeit, Insulinresistenz und Diabetes. Eine genaue Messung der Insulinclearance ist entscheidend für das Verständnis der zugrunde liegenden Mechanismen dieser Erkrankungen. Dieses Protokoll stellt ein unkompliziertes und benutzerfreundliches Verfahren zur Leberperfusion bei Mäusen dar, das speziell für die direkte Bewertung der hepatischen Insulinclearance-Rate entwickelt wurde. Die Methode beinhaltet eine präzise Kanülierung der Pfortader und der suprahepatischen unteren Hohlvene, um ein in situ Perfusionssystem zu schaffen, das physiologische Bedingungen nachahmt. Das Protokoll führt die Forscher durch jede Phase des Eingriffs, von der chirurgischen Vorbereitung über die Einrichtung des Perfusionssystems bis hin zur Probenentnahme und -analyse. Es gibt eine detaillierte Anleitung, zusammen mit repräsentativen Ergebnissen und wichtigen Tipps zur Optimierung des Verfahrens. Ein Video-Tutorial begleitet das schriftliche Protokoll mit visuell detaillierten Anweisungen und Illustrationen, was es zu einem zugänglichen und umfassenden Nachschlagewerk für Wissenschaftler macht, die die molekularen Mechanismen hinter dem hepatischen Insulinstoffwechsel und der Insulinclearance erforschen.
Einleitung
Die Entdeckung des Insulins ist zu einem der Meilensteine des letzten Jahrhunderts geworden. Über die Regulation der Insulinsynthese, der Insulinsekretion und ihrer physiologischen Funktionen in Stoffwechselgeweben ist viel bekannt. Der Insulinabbau und seine Regulationsmechanismen wurden jedoch weniger in den Fokus gerückt. Unter dem Insulinstoffwechsel versteht man das Zusammenspiel zwischen der Funktion der Betazelle, der Insulinresistenz (IR) bzw. -sensitivität und der Insulinclearance. Neben der Insulinsekretion spielt die hepatische Insulinclearance eine entscheidende Rolle bei der Aufrechterhaltung des homöostatischen Insulinspiegels, der für das Erreichen des peripheren Zielgewebes und die Erleichterung der richtigen Insulinwirkung erforderlich ist1. Mehrere Studien haben eine gestörte Insulinclearance als entscheidenden Faktor für die Pathogenese der Hyperinsulinämie beim metabolischen Syndrom sowie bei anderen Erkrankungen wie Typ-2-Diabetes 2,3, nichtalkoholischer Steatohepatitis4 und polyzystischem Ovarialsyndrom5 identifiziert. Daher kann Hyperinsulinämie als Folge einer verminderten Clearance eine Rolle bei der Pathogenese von Stoffwechselerkrankungen spielen. Strategien, die die Insulinclearance verbessern, haben das Potenzial, die ungünstigen Auswirkungen der Hyperinsulinämie bei diesen Personen umzukehren.
Insulin hat ein einzigartiges Verteilungsmuster. Die Höhe des zirkulierenden Plasmainsulins hängt vom Gleichgewicht zwischen Insulinsekretion und -entfernung ab. Die Bauchspeicheldrüse schüttet pulsierend Insulin in die Pfortader aus und leitet es zu den Hepatozyten. Als erstes Organ, das mit einer Insulinsekretion konfrontiert ist, baut die Leber während ihrer ersten Passage den Großteil des Insulins ab und macht 60 % bis 70 % des Gesamtinsulinsaus 6. Das verbleibende Insulin verlässt die Leber durch die Lebervene und gelangt in den systemischen Kreislauf, wo es teilweise von peripheren Geweben (hauptsächlich Muskeln, Fettgewebe und Nieren) verwertet wird, bevor es von der Leber während seines zweiten Durchgangs durch die Leberarterie weiter extrahiert wird7.
Die genaue Messung der Insulinclearance ist entscheidend. Die direkte Messung der hepatischen Insulinclearance in Humanstudien ist eine Herausforderung, da die Entnahme von Blutproben aus den Pfortadern und Lebervenen schwierig ist. Sowohl direkte als auch indirekte Methoden werden verwendet, um die Insulinclearance bei Menschen und Tiermodellen abzuschätzen. Es werden ungefähr drei Strategien angewendet, um die Insulinclearance indirekt zu messen. Bei den in der klinischen Praxis am häufigsten verwendeten Assessments handelt es sich um Methoden, die auf dem molaren Verhältnis von C-Peptidzu Insulin basieren 8. Dieser Ansatz beruht auf der äquimolaren Sekretion beider Peptide und dem Fehlen einer C-Peptid-Extraktion durch die Leber9. Die zweite Gruppe von Methoden beruht auf der mathematischen Analyse der Plasmazerfallskurven von Insulin nach einer bekannten und spezifischen Eintragung des Hormons in den Blutkreislauf 2,10,11. Die dritte Methode basiert auf der Tatsache, dass die Infusion von Insulin mit einer konstanten Rate zu stabilen Hormonspiegeln im Blut führt, wobei die Entfernungsrate der Verabreichungsrate entspricht12. Diese indirekten Methoden spiegeln in erster Linie die gesamte Insulinclearance im Körper wider. Da die Leber der primäre Ort der Insulinclearance ist und eine entscheidende Rolle in diesem Prozess spielt, ist es wichtig, die hepatische Insulinclearance direkt zu bewerten.
Frühere Studien haben die hepatische Insulinextraktion bei gesunden Hunden direkt gemessen13,14. In Studien wurde auch ein isoliertes perfundiertes Rattenlebermodell verwendet, um die Insulinextraktion aus der Leber zu beurteilen15,16. Aufgrund der hohen Verfügbarkeit von gentechnisch veränderten Stämmen dienen Mäuse als wertvolle Modelle für die Untersuchung molekularer Signalwege. In einigen Studien17 wurde die Leberperfusion verwendet, um die hepatische Insulinclearance in einem Mausmodell direkt zu beurteilen. In diesen Studien wird ein Perfusat, das Humaninsulin enthält, in die Pfortader infundiert und aus der unteren Hohlvene entnommen. Der Anteil des von der Leber aufgenommenen Insulins zeigt ihre Clearance an. Die Leberperfusionstechnik hält die Leber unter nahezu physiologischen Bedingungen, indem ein warmes, sauerstoffreiches und mit Nährstoffen angereichertes Perfusat durch das Lebergefäßsystem zirkuliert. Es gibt jedoch nicht genügend praktische Anleitungen und wichtige Tipps, um diese Technik voranzutreiben und zu verbreiten.
Während die hepatische Insulinclearance zunehmend Aufmerksamkeit erfährt, bleibt ihre Rolle bei Erkrankungen sowie ihre molekularen Mechanismen unklar18. Daher sind fortschrittliche Techniken im Bereich der wissenschaftlichen Forschung dringend erforderlich. Dieses Protokoll legt ein detailliertes modifiziertes Leberperfusionsverfahren bei Mäusen zur Beurteilung der hepatischen Insulinclearance fest. Darüber hinaus kann diese Methode auch verwendet werden, um die Auswirkungen von Medikamenten auf die Leber zu untersuchen, einschließlich des First-Pass-Effekts, der Wirkstofftransportprozesse und verschiedener anderer Aspekte.
Protokoll
Dieses Protokoll wurde vom Animal Care and Use Committee der Nanjing Medical University (IACUC-2105018) genehmigt und folgte den Richtlinien des Institutional Animal Care and Use Committee. Alle C57BL/6N-Mäuse wurden in einem 12-stündigen Hell-Dunkel-Zyklus mit freiem Zugang zu Futter und Wasser gehalten. Sechs Wochen alte Mäuse wurden nach dem Zufallsprinzip in eine Chow-Diät-Gruppe (CD) und eine Gruppe mit fettreicher Diät (HFD) eingeteilt. Die HFD-Gruppe erhielt eine 60% fettreiche Diät und setzte diese Diät bis zum Alter von 10 Wochen fort. Das durchschnittliche Körpergewicht betrug 28,55 g ± 1,2 g für die HFD-Gruppe und 24,3 g ± 0,48 g für die Kontrollgruppe. Die Einzelheiten zu den in dieser Studie verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Vorbereitung
- Führen Sie die erforderliche Sterilisation von chirurgischen Instrumenten und Verbrauchsmaterialien durch Autoklavieren durch.
- Legen Sie die chirurgischen Instrumente, die 6-0-Seidennaht, den sterilen kleinen Baumwollapplikator, die Natriumchlorid-Injektion (500 ml), die Wattestäbchen und die Schwämme entsprechend auf den Operationstisch.
- Bereiten Sie 30 ml heparinisierte Kochsalzlösung mit einer Endkonzentration von 200 IE/ml vor.
- Bereiten Sie zwei Silikonschläuche mit einem Innendurchmesser von 0,31 mm und einem Außendurchmesser von 0,64 mm vor; Einer mit einer Länge von 4 cm für die Verwendung als Pfortaderkatheter und der andere mit einer Länge von 10 cm für den Katheter der unteren Hohlvene.
- Bereiten Sie den Krebs-Henseleit (KRBH) Perfusionspuffer vor, der 5,0 mmol/l Glukose und 0,25 % BSA enthält.
- Bereiten Sie den Krebs-Henseleit (KRBH) Perfusionspuffer vor, der 5,0 mmol/l Glukose, 0,25 % BSA und 4,0 ng/ml Humaninsulin enthält.
- Richten Sie das Leberperfusionssystem ein. Abbildung 1 zeigt die Hauptkomponenten des Leberperfusionssystems.
2. Chirurgische Katheterisierung
- Bereiten Sie die Anästhesiemischung vor, indem Sie die folgenden Schritte ausführen:
- Verdünnen Sie Zoletil 50 (250 mg/5 ml) 10-mal mit 0,9% iger Natriumchloridlösung.
- Verdünnen Sie Xylazinhydrochlorid (200 mg/2 ml) 10-mal mit 0,9% iger Natriumchloridlösung.
- Mischen Sie die 0,5%ige Zoletil 50 Lösung mit der 1% igen Xylazinhydrochloridlösung im Verhältnis 1:1.
- Betäuben Sie die Mäuse.
- Überprüfen und notieren Sie das Körpergewicht der Maus. Verabreichen Sie das Anästhesiegemisch durch intraperitoneale Injektion in einer Dosis von 5 ml/kg Körpergewicht (2,5 mg/ml Zoletil 50; 5 mg/ml Xylazinhydrochlorid). Der Beginn der Anästhesie erfolgt typischerweise innerhalb von 5-10 Minuten nach der Injektion, was durch den Verlust des Aufrichtreflexes und eine verminderte Reaktion auf äußere Reize angezeigt wird.
- Übertragen Sie die Maus auf den Operationstisch. Sichern Sie die Gliedmaßen mit Klebeband. Verabreichen Sie 2,5 U/g Heparin intraperitoneal, um eine Heparinisierung zu erreichen.
- Schneiden Sie das Fell auf der Bauchhaut mit einem Elektrorasierer ab und desinfizieren Sie den Bereich mit einer Povidon-Jod-Lösung.
- Führen Sie eine Pfortaderkatheterisierung durch.
- Machen Sie einen 4 cm langen Schnitt vom Unterbauch in Richtung des Processus xiphoideus entlang der Mittelbauchlinie. Schneiden Sie das Bauchfell vorsichtig mit einer Schere auf, um eine Beschädigung der viszeralen Organe zu vermeiden. Führen Sie den Abdominal-Retraktor der Maus ein, um das Operationsfeld freizulegen.
- Bewegen Sie den Darm nach rechts, um die Pfortader, die rechte Niere und die untere Hohlvene freizulegen (Abbildung 2A). Klemmen Sie mit einer Arterienzange die Hohlvene am oberen Rand der Niere ein.
- Isolieren Sie die Pfortader (Abbildung 2A) und ligieren Sie das distale Ende mit einer 6-0-Seidennaht. Binden Sie eine weitere Naht locker an das proximale Ende des freiliegenden Gefäßes.
- Machen Sie mit einer Federschere einen Schnitt in der Nähe des ligierten Endes und führen Sie den Katheter ein. Schieben Sie den Katheter durch den Schnitt bis zur Höhe der Pfortadergabelung.
- Befestigen Sie beide Ligaturen um den Katheter und bestätigen Sie die ordnungsgemäße Probenahme, indem Sie das freie Ende des Katheters mit einer Probenahmespritze verbinden. Bündig mit heparinisierter Kochsalzlösung und klemmen Sie den Katheter ein (Abbildung 2C).
- Entfernen Sie die Traktionsvorrichtung und setzen Sie den Darm zurück. Decken Sie den Operationsbereich mit kochsalzgetränkter steriler Gaze oder Watte ab.
- Führen Sie eine suprahepatische Katheterisierung der unteren Hohlvene durch.
- Machen Sie einen Schnitt entlang des Brustbeins aus dem Xiphoidfortsatz und legen Sie das Brustbein frei.
- Schneiden Sie das Brustbein vertikal auf und durchschneiden Sie das Zwerchfell entlang des Rippenrandes, um die Brusthöhle freizulegen.
- Legen Sie die suprahepatische untere Hohlvene frei und isolieren Sie sie (Abbildung 2B). Ligattieren Sie das distale Ende vorsichtig mit einer 6-0 Seidennaht. Binden Sie locker eine weitere Naht an das proximale Ende des Gefäßes.
- Machen Sie mit einer Federschere einen Schnitt direkt unterhalb des ligierten Endes und legen Sie einen 10 cm langen Katheter ein. Schieben Sie den Katheter vor, bis sich die Spitze des Katheters in der Nähe der Leber befindet, und binden Sie beide Ligaturen fest. Bestätigen Sie die ordnungsgemäße Probenahme und klemmen Sie das freie Ende des Katheters ein (Abbildung 2D).
- Spülen Sie den Operationsbereich mit Kochsalzlösung ab. Decken Sie die Oberfläche mit mit Kochsalzlösung getränkter steriler Gaze ab.
3. Durchblutung der Leber
- Euthanasieren Sie die Maus mit einer Überdosis Anästhetikum und Thorakotomie in Übereinstimmung mit den institutionellen Richtlinien für die Pflege und Verwendung von Tieren, um sicherzustellen, dass alle Eingriffe so durchgeführt werden, dass das Leiden minimiert wird.
- Richten Sie das Leberperfusionssystem ein, das einen Oxygenator, ein Temperaturmodulationsgerät, eine Infusionspumpe und Infusionsschläuche umfasst, wie in Abbildung 1 gezeigt.
- Stellen Sie einen kontinuierlichen Gasfluss von 95 % Sauerstoff und 5 % Kohlendioxid zum Oxygenator bereit.
- Schalten Sie das Wasserbad ein und wärmen Sie die Orgelkammer auf 37 °C vor.
- Bereiten Sie den KRBH-Perfusionspuffer mit und ohne Insulin vor. Grundieren Sie das Schlauchsystem mit dem Perfusionspuffer, der in einem Wasserbad bei 37 °C inkubiert wird.
HINWEIS: Der KRBH ist frei von BSA und Glukose. Der KRBH-Perfusionspuffer ohne Humaninsulin enthält 5,0 mmol/l Glukose und 0,25 % BSA, während der KRBH-Perfusionspuffer mit Humaninsulin 5,0 mmol/l Glukose, 0,25 % BSA und 4,0 ng/ml Humaninsulin enthält. - Stellen Sie die Maus in einen Behälter mit einer Umgebungstemperatur von ca. 37 °C. Verwenden Sie ein Wärmekissen, um die Körpertemperatur auf 37 °C zu halten.
- Den KRBH-Puffer wird durch den Pfortaderkatheter infundiert. Stellen Sie die Infusionsrate über eine Minipumpe auf 0,2 mL/min ein.
- Beobachten Sie, dass die Leber innerhalb von Sekunden blass wird, was darauf hinweist, dass der Perfusionspuffer durch die Leber fließt. Um weitere verbleibende Blutzellen in der Leber auszuspülen, unterbrechen Sie die Infusion für 1 Minute zu den Zeitpunkten 4 und 8 Minuten und beginnen Sie mit dem Zeitpunkt zu Beginn der Perfusion.
- Perfundieren Sie die Leber mit KRBH-Puffer für insgesamt 10 Minuten (ohne die beiden 1-minütigen Pausen), die der Gleichgewichtsperiode entsprechen. Entnehmen Sie die Basalprobe aus dem Katheter der unteren Hohlvene.
- Perfundieren Sie die Leber für weitere 30 Minuten mit der gleichen mit Insulin angereicherten Lösung (4,0 ng/ml Humaninsulin).
- Entnehmen Sie alle 2 Minuten alle Proben aus der unteren Hohlvene.
- Notieren Sie das Lebergewicht nach der Perfusion. Entnehmen Sie Leberproben aus verschiedenen Lappen, frieren Sie sie sofort in flüssigem Stickstoff ein und überführen Sie sie dann zur Lagerung auf -80 °C.
- Zentrifugieren Sie alle gesammelten Perfusionsproben bei ~1.000 x g für 10 min bei 4 °C. Die Überstände auffangen und zur Lagerung auf -80 °C umfüllen.
HINWEIS: Die Insulinkonzentration in Perfusionsproben wird mit ELISA-Kits (Human Insulin Enzyme-linked Immunosorbent Assay) gemessen. - Stellen Sie nach dem Verfahren sicher, dass alle biologischen Abfälle gemäß den Sicherheitsvorschriften entsorgt werden.
4. Datenanalyse
- Präsentieren Sie die Daten in XY-Diagrammen, die die Insulinkonzentration im Laufe der Zeit zeigen.
- Berechnen Sie die durchschnittliche hepatische Insulinclearance-Rate (HICRAVE) mit der folgenden Formel:
HICRAVE = (1−Cf/Ci) × 100%
wobei Ci = anfängliche Insulinkonzentration des Infusionspuffers, Cf = endgültige durchschnittliche Insulinkonzentration in den letzten 10 Minuten aus der suprahepatischen unteren Hohlvene.
Ergebnisse
Dieses Protokoll beschreibt das Verfahren für die Leberinfusion zur direkten Berechnung der hepatischen Insulinclearance. Dieses Modell ist zuverlässig und reproduzierbar. Ein Beispiel für die Ergebnisse eines Experiments ist in Abbildung 3 dargestellt. Nach einer 10-minütigen Äquilibrierungsphase wurde KRBH-Puffer, der mit 4,0 ng/ml Humaninsulin supplementiert wurde, 30 Minuten lang durch die Pfortader perfundiert. In Abständen von 2 Minuten wurde Perfusionsflüssigkeit aus dem Katheter in der suprahepatischen unteren Hohlvene entnommen und die Konzentration von Humaninsulin in der Perfusionsflüssigkeit gemessen. Die Ergebnisse werden hier als Mittelwert ± SEM dargestellt. Ein Beispiel für ein Leberperfusionsexperiment, bei dem Mäuse mit einer Kontrolldiät (CD) mit Mäusen mit einer fettreichen Diät (HFD) verglichen wurden, ist in Abbildung 3 dargestellt. Die hepatische Insulinclearance-Rate (HICRAVE) betrug 55,57 % ± 4,43 % für die Zöliakie-Gruppe und 25,37 % ± 6,83 % für die HFD-Gruppe (Abbildung 3B). Die Ergebnisse deuten darauf hin, dass eine fettreiche Fütterung zu einer gestörten Insulinausscheidung führt.
Nach der Perfusion wurden Leberproben für die Hämatoxylin- und Eosin (HE)-Färbung und das Scannen ganzer Objektträger entnommen; Es wurden eine gut durchblutete Leber, eine schlecht durchblutete Leber und eine Kontrollleberprobe von einer normalen Maus entnommen. Unter besseren Perfusionsbedingungen war die Struktur des Lebergewebes normal, die Leberstränge waren radial und sauber angeordnet, die Hepatozyten waren in ihrer Form intakt, das Zytoplasma war gleichmäßig gefärbt und der Zellkern war klar und rund, fast nicht von dem der normalen Leber zu unterscheiden (Abbildung 4A, B). Bei schlechter Perfusion waren die Hepatozyten ödematös und deutlich locker, mit punktförmiger Nekrose um die Zentralvenen, vakuolärer Degeneration im Zytoplasma, nukleärer Pyknose und Gefäßablösung (Abbildung 4C). Die Spiegel der Alanin-Aminotransferase (ALT) und der Aspartat-Aminotransferase (AST) im Perfusat wurden zu Studienbeginn und nach der Perfusion gemessen, um die Funktion der Hepatozyten zu beurteilen. Die Ergebnisse zeigten, dass es keinen signifikanten Unterschied zwischen den ALT- und AST-Werten gab (Abbildung 4D).
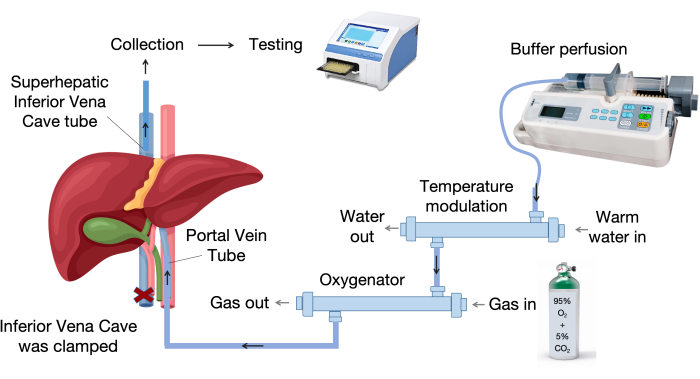
Abbildung 1: Komponenten des Perfusionssystems. Das Perfusionssystem besteht aus Schlüsselkomponenten, darunter eine Infusionspumpe, eine Temperiereinheit und ein Oxygenator. Das Gerät mit variabler Temperatur hält die Perfusionsflüssigkeit auf 37 °C, während der Membranoxygenator Polypropylen-Hohlfasern für einen effektiven Gasaustausch verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Anatomische Lokalisation und Katheterisierung. (A,B) Stellt die anatomischen Lagen der Pfortader und der Vena cava inferior dar. (C) Der Pfortaderkatheter wird direkt unterhalb der Bifurkation in den linken und rechten Leberast positioniert, wobei eine Gefäßklemme an der intrahepatischen unteren Hohlvene angebracht wird. (D) Der Katheter wird in die suprahepatische untere Hohlvene eingeführt und in der Nähe des oberen Leberrandes platziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
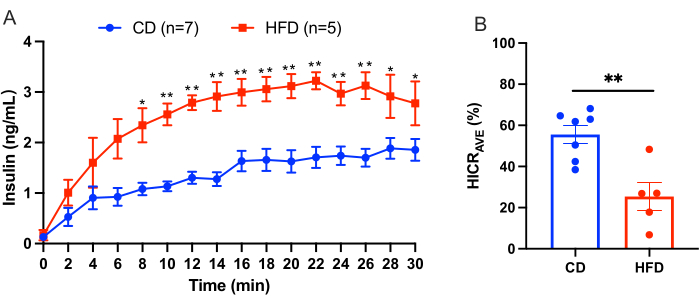
Abbildung 3: Ergebnisse des Leberperfusionsexperiments. Ergebnisse eines Leberperfusionsexperiments, bei dem Mäuse mit einer Kontrolldiät (CD) mit Mäusen mit einer fettreichen Diät (HFD) verglichen wurden. (A) Insulinkonzentrationen während der Leberperfusion bei Zöliakie-Mäusen (blau, n = 7) im Vergleich zu HFD-Mäusen (rot, n = 5). (B) Durchschnittliche hepatische Insulinclearance-Rate (HICRAVE). Alle Daten werden als Mittelwert ± SEM angegeben. Die statistische Signifikanz wird mit *p < 0,05, **p < 0,01 gegenüber den Zöliakie-Mäusen angegeben, die mit einem ungepaarten t-Test analysiert wurden. Die Ergebnisse deuten darauf hin, dass eine fettreiche Fütterung zu einer gestörten Insulinausscheidung führt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Einfluss der Perfusion auf die Histologie und Funktion der Leber. (A) Normale Lebermorphologie der Maus (Kontrolle). (B) Lebermorphologie unter Bedingungen mit erhöhter Perfusion. (C) Lebermorphologie unter suboptimalen Perfusionsbedingungen. Der rote Pfeil zeigt die Ablösung des Gefäßes, der schwarze Pfeil die Vakuolisierung und der grüne Pfeil die Pyknose des Zellkerns. Vergrößerung: 40x. (D) Spiegel der Alaninaminotransferase (ALT) und der Aspartataminotransferase (AST) im Perfusat, gemessen zu Studienbeginn und nach der Perfusion. Für die Analyse wurde die gepaarte t-Test-Methode verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Kritische Schritte im Protokoll
Die oben beschriebenen chirurgischen Eingriffe sollten mit sanfter Sorgfalt durchgeführt werden, um Läsionen in der Leber zu vermeiden. Darüber hinaus macht die fragile Struktur der Lebervenengefäßwand sie anfällig für Punktionen und nachfolgende Blutungen, wenn sie während der Kanülierung nicht vorsichtig behandelt wird. In diesem Protokoll werden weichere Silikonschläuche verwendet, um die Schädigung der Blutgefäße zu minimieren. Es wird empfohlen, dass die Katheterisierung von einem erfahrenen Chirurgen durchgeführt wird, der häufig üben sollte, um die Erfolgsrate der Intubation zu erhöhen und die Dauer des Eingriffs zu minimieren.
Das Operationsfeld sollte gelegentlich mit warmer Kochsalzlösung gespült werden, um die Lebensfähigkeit der Hepatozyten zu erhalten. Während der Perfusion sollte das Operationsgebiet mit steriler Gaze oder Watte abgeschirmt werden. Diese Praxis verhindert eine längere Exposition gegenüber der Luft, die möglicherweise die Funktion der Hepatozyten beeinträchtigen kann.
Herausforderungen und Lösungen
Entscheidend ist, die Spitze des Katheters kurz vor dem Punkt zu positionieren, an dem sich die Pfortader in die linke und rechte Leberpfortader verzweigt. Wenn der Katheter zu tief eingeführt wird, kann es zu einer ungleichmäßigen Durchblutung zwischen den Leberlappen kommen. Darüber hinaus müssen Luftblasen während des Infusionsprozesses sorgfältig vermieden werden, da sie das Potenzial haben, eine Luftembolie in der Leber auszulösen. Dies kann die Durchblutung der Flüssigkeit, die die Hepatozyten erreicht, erheblich beeinträchtigen und in der Folge die Insulinclearance beeinflussen.
Die ersten 10 Minuten der KH-Pufferinfusion stellen die Gleichgewichtsphase dar, in der die Perfusion 1-2 Mal für jeweils 2 Minuten unterbrochen werden kann, um die verbleibenden Blutzellen so weit wie möglich in die Lebersinusoide zu spülen. Wird in der entnommenen Probe nach 15 min kontinuierlicher Perfusion Blut beobachtet, kann dies darauf hindeuten, dass die Gefäßzange an der unteren Hohlvene der Leber nicht richtig positioniert ist und überprüft werden sollte19. Wenn die Infusion pausiert wird, können bei der Wiederaufnahme der Infusion rote Blutkörperchen in der entnommenen Probe aufgrund von verbleibenden Blutkörperchen in den Lebersinusoiden auftreten. Die roten Blutkörperchen sollten vor der Insulinmessung durch Zentrifugation getrennt werden, da das Vorhandensein von insulinabbauenden Enzymen in diesen Zellen möglicherweise den Insulinspiegel beeinflussen kann.
Die Dauer der chirurgischen Katheterisierung, die Ischämie-Reperfusionszeit der Leber und die Menge an Gas, die während der Perfusion in die Pfortader eintritt, können die Funktion der Hepatozyten und damit die Rate der Insulinclearance durch die Leber beeinflussen. Das Ausmaß der Leberfunktionsstörung kann durch Messung des Gehalts an Alaninaminotransferase (ALT), Aspartataminotransferase (AST), Laktatdehydrogenase (LDH) und alkalischer Phosphatase (ALP) sowie durch H&E-Färbung überwacht werden. Untersuchungen haben gezeigt, dass die Leber nach einer erfolgreichen Operation mindestens 3 h19 lang weiter funktioniert und reagiert.
Bedeutung und Anwendungsmöglichkeiten der Leberperfusion von Mäusen
Mäuse sind aufgrund ihrer genetischen Ähnlichkeit mit dem Menschen, ihrer kurzen Fortpflanzungszyklen und der Verfügbarkeit fortschrittlicher gentechnischer Werkzeuge ideale Forschungsobjekte20. In Mausmodellen kann die Insulinclearance mit verschiedenen Methoden bestimmt werden. Während des intraperitonealen Glukosetoleranztests (IPGTT) wird die hepatische Insulinclearance als Verhältnis der Fläche unter der Kurve (AUC) (berechnet nach der trapezförmigen Methode) von C-Peptid zu Insulin21 gemessen. Während der Euglykämie-Hyperinsulinämie-Klemme kann das Verhältnis zwischen der exogenen Insulininfusionsrate und der resultierenden Steady-State-Plasmainsulinkonzentration als Methode zur indirekten Abschätzung der Insulinclearance verwendet werden22. Diese Methoden beurteilen jedoch alle indirekt die hepatische Insulinclearance.
Einige Forscher verwenden auch zellbasierte Assays, um den Insulinabbau zu beurteilen. HepG2-Zellen oder primäre Hepatozyten von Mäusen werden in Kulturplatten ausgesät und eine angemessene Konzentration von Humaninsulin wird zugegeben. In bestimmten Abständen werden Proben des Kulturmediums entnommen, um die Insulinkonzentration beim Menschen zu messen und seinen Abbau im Laufe der Zeit zu bewerten17. In diesem Protokoll wird ein benutzerfreundliches in situ hepatisches Perfusionsverfahren an Mäusen beschrieben, um die hepatische Insulinclearancerate direkt zu bewerten. Im Vergleich zu In-vitro-Studien mit isolierten Hepatozyten hat die Leberperfusion den Vorteil, dass die Leberarchitektur, die zonale Teilung, die Polarität und die vaskuläre Integrität erhalten bleiben.
Das Leberperfusionssystem der Maus ist ein wertvolles Werkzeug, um die Dynamik und die molekularen Mechanismen des hepatischen Insulinstoffwechsels zu untersuchen. Darüber hinaus könnte dieses Protokoll nicht nur in präinduzierten Krankheitsmodellen, sondern auch in akuten Provokationsstimulustests weit verbreitet sein. Diese Technik ist jedoch insofern eingeschränkt, als sie vor Ort durchgeführt werden sollte. Dieses Protokoll beinhaltet eine modifizierte chirurgische Kathetertechnik, die Verletzungen minimiert und die anatomische Integrität der Leber so weit wie möglich bewahrt. Weitere Anstrengungen sind erforderlich, um diese Technologie bestmöglich zu nutzen, um die Mechanismen der Insulinclearance aufzuklären, insbesondere bei Stoffwechselerkrankungen, die mit Insulinresistenz einhergehen.
Offenlegungen
Es wurden keine Interessenkonflikte erklärt.
Danksagungen
Diese Arbeit wurde von der National Natural Science Foundation of China (82200948, 82270921, 82170882) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 60% high-fat diet | Research Diets, USA | D12492 | |
| Alanine aminotransferase Assay Kit | Nanjing Jiancheng Bioengineering Institute | C009-2-1 | |
| Anhydrous Glucose | Sangon Biotech | 50-99-7 | 500 G |
| Aspartate aminotransferase Assay Kit | Nanjing Jiancheng Bioengineering Institute | C010-2-1 | |
| Bovine Serum Albumin | GeminiBio | 700-107P | Fatty Acid-Free |
| Contour TS Blood Glucose Meter | Bayer | PH220800019 | |
| Contour TS Blood Glucose Test Strips | Bayer | DP38M3F05A | |
| Heparin Sodium | Changzhou Qian hong Bio-pharma | H32022088 | 12500 U/2mL |
| Human insulin | Novo Nordisk | S20191007 | 300 U/3mL |
| Human insulin immunoassay kit | Ezassay Biotechnology | HM200 | |
| KRBH buffer (Sugar, BSA free) | coolaber | SL65501 | 500 mL |
| Membrane oxygenator | Xi'an Xijing Medical Appliance | 5 | |
| Microscopic scissors | Shanghai Jinzhong | YBC020 | |
| Micro-serrefine clamp | Ningbo Medical Needle | 180709 | |
| Microsurgery forceps | Shanghai Jinzhong | WA3010, WA3020 | |
| Needle type filter | N-buliv | LG05-133-2 | |
| Povidone-iodine Solution | Shanghai likang Disinfectant Hi-Tech | 20231016J | |
| pump 11 Elite | Harvard Apparatus | PC5 70-4500 | |
| Retractor | Globalebio (Beijing) Technology | GEKK-10mm | 10 mm |
| Silicone Tubing | scientific commodities | #BB518-12 | 0.31 mm × 0.64 mm |
| Silicone Tubing | Fisher Scientific | #11-189-15A | ID 0.5 mm |
| Sodium Chloride Injection | Baxter | S2402023 | 4.5 g/500 mL |
| Surgical silk suture | Yangzhou Huanyu Medical Equipment | 6-0 | |
| Temperature modulation | Xi'an Xijing Medical Appliance | 6 | |
| Thermostatic water bath | Jiaxing Junsi Electronics | HIH-1 | 220 V 50 HZ |
| Three-way Joint | YISAI | AQTCY1.6 | ID 0.4 mm |
| Xylazine Hydrochloride Injection | ShengXin | 20240106 | 200 mg/2mL |
| Zoletil 50 | Virbac | WK001 | 250 mg/5mL |
Referenzen
- Najjar, S. M., Perdomo, G. Hepatic insulin clearance: Mechanism and physiology. Physiology (Bethesda). 34 (3), 198-215 (2019).
- Fu, Z., et al. Impaired insulin clearance as the initial regulator of obesity-associated hyperinsulinemia: Novel insight into the underlying mechanism based on serum bile acid profiles. Diabetes Care. 45 (2), 425-435 (2022).
- Koh, H. E., Cao, C., Mittendorfer, B. Insulin clearance in obesity and type 2 diabetes. Int J Mol Sci. 23 (2), 596 (2022).
- Bril, F., et al. Relationship between disease severity, hyperinsulinemia, and impaired insulin clearance in patients with nonalcoholic steatohepatitis. Hepatology. 59 (6), 2178-2187 (2014).
- Herman, R., Sikonja, J., Jensterle, M., Janez, A., Dolzan, V. Insulin metabolism in polycystic ovary syndrome: Secretion, signaling, and clearance. Int J Mol Sci. 24 (4), 3140 (2023).
- Najjar, S. M., Caprio, S., Gastaldelli, A. Insulin clearance in health and disease. Annu Rev Physiol. 85, 363-381 (2023).
- Polidori, D. C., Bergman, R. N., Chung, S. T., Sumner, A. E. Hepatic and extrahepatic insulin clearance are differentially regulated: Results from a novel model-based analysis of intravenous glucose tolerance data. Diabetes. 65 (6), 1556-1564 (2016).
- Castillo, M. J., Scheen, A. J., Letiexhe, M. R., Lefebvre, P. J. How to measure insulin clearance. Diabetes Metab Rev. 10 (2), 119-150 (1994).
- Rubenstein, A. H., Pottenger, L. A., Mako, M., Getz, G. S., Steiner, D. F. The metabolism of proinsulin and insulin by the liver. J Clin Invest. 51 (4), 912-921 (1972).
- Terris, S., Steiner, D. F. Binding and degradation of 125i-insulin by rat hepatocytes. J Biol Chem. 250 (21), 8389-8398 (1975).
- Ooms, H. A., Arnould, Y., Rosa, U., Pennisi, G. F., Franckson, J. R. Total metabolic clearance of crystalline insulin and radio-iodide substitued insulin. Pathol Biol. 16 (5), 241-245 (1968).
- Defronzo, R. A., Tobin, J. D., Andres, R. Glucose clamp technique: A method for quantifying insulin secretion and resistance. Am J Physiol. 237 (3), E214-E223 (1979).
- Asare-Bediako, I., et al. Assessment of hepatic insulin extraction from in vivo surrogate methods of insulin clearance measurement. Am J Physiol Endocrinol Metab. 315 (4), E605-E612 (2018).
- Kim, S. P., Ellmerer, M., Kirkman, E. L., Bergman, R. N. Beta-cell "rest" accompanies reduced first-pass hepatic insulin extraction in the insulin-resistant, fat-fed canine model. Am J Physiol Endocrinol Metab. 292 (6), E1581-E1589 (2007).
- Kotsis, T., et al. Insulin metabolism and assessment of hepatic insulin extraction during liver regeneration. A study in a rat model. J Invest Surg. 33 (1), 69-76 (2020).
- Mondon, C. E., Olefsky, J. M., Dolkas, C. B., Reaven, G. M. Removal of insulin by perfused rat liver: Effect of concentration. Metabolism. 24 (2), 153-160 (1975).
- Tamaki, M., et al. The diabetes-susceptible gene SLC30A8/ZnT8 regulates hepatic insulin clearance. J Clin Invest. 123 (10), 4513-4524 (2013).
- Ghadieh, H. E., Gastaldelli, A., Najjar, S. M. Role of insulin clearance in insulin action and metabolic diseases. Int J Mol Sci. 24 (8), 7156 (2023).
- Winther-Sorensen, M., Kemp, I. M., Bisgaard, H. C., Holst, J. J., Wewer Albrechtsen, N. J. Hepatic glucose production, ureagenesis, and lipolysis quantified using the perfused mouse liver model. J Vis Exp. 200, e65596 (2023).
- Rydell-Tormanen, K., Johnson, J. R. The applicability of mouse models to the study of human disease. Methods Mol Biol. 1940, 3-22 (2019).
- Zaidi, S., et al. Loss of ceacam1 in hepatocytes causes hepatic fibrosis. Eur J Clin Invest. 54 (7), e14177 (2024).
- Piccinini, F., Bergman, R. N. The measurement of insulin clearance. Diabetes Care. 43 (9), 2296-2302 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten