Method Article
通过原位肝灌注评估小鼠胰岛素清除率
摘要
肝脏胰岛素清除率对于调节葡萄糖稳态至关重要。本文介绍了一种用户友好的肝脏灌注程序,用于直接评估小鼠体内肝脏胰岛素的原位清除率。
摘要
肝脏胰岛素清除率对于维持葡萄糖稳态至关重要,并且与肥胖、胰岛素抵抗和糖尿病等代谢紊乱密切相关。准确测量胰岛素清除率对于了解这些疾病的潜在机制至关重要。该方案在小鼠中提出了一种简单且用户友好的肝脏灌注程序,专门用于直接评估肝脏胰岛素清除率。该方法涉及门静脉和肝上下腔静脉的精确插管,以创建一个模拟生理条件的 原位 灌注系统。该方案指导研究人员完成手术的每个阶段,从手术准备和设置灌注系统到样本采集和分析。提供了详细说明,以及具有代表性的结果和优化程序的重要提示。书面方案附有视频教程,提供视觉深入的说明和插图,使其成为科学家探索肝脏胰岛素代谢和清除背后的分子机制的可访问和综合参考。
引言
胰岛素的发现已成为上个世纪的里程碑之一。关于胰岛素合成、分泌及其在代谢组织中的生理功能的调节,人们了解很多。然而,对胰岛素降解及其调节机制的关注较少。胰岛素代谢可以理解为 β 细胞功能、胰岛素抵抗 (IR) 或敏感性以及胰岛素清除率之间的相互作用。除了胰岛素分泌外,肝脏胰岛素清除在维持到达外周靶组织和促进胰岛素正常作用所需的胰岛素稳态水平方面起着至关重要的作用1。多项研究发现胰岛素清除率受损是代谢综合征以及其他疾病(如 2 型糖尿病 2,3、非酒精性脂肪性肝炎4 和多囊卵巢综合征)中高胰岛素血症发病机制的关键因素5。因此,继发于清除率降低的高胰岛素血症可能在代谢性疾病的发病机制中发挥作用。改善胰岛素清除率的策略有可能逆转高胰岛素血症对这些个体的不利影响。
胰岛素具有独特的分布模式。循环血浆胰岛素的水平取决于胰岛素分泌和排出之间的平衡。胰腺以搏动方式将胰岛素分泌到门静脉中,将其引导至肝细胞。肝脏作为第一个遇到胰岛素分泌的器官,在第一次排代时降解了大部分胰岛素,占总胰岛素的 60%-70%6。剩余的胰岛素通过肝静脉离开肝脏,进入体循环,在那里它被外周组织(主要是肌肉、脂肪组织和肾脏)部分利用,然后在第二次通过肝动脉时被肝脏进一步提取7。
胰岛素清除率的精确测量至关重要。在人体研究中直接测量肝脏胰岛素清除率具有挑战性,因为很难从门静脉和肝静脉获取血液样本。直接和间接方法均用于估计人类和动物模型中的胰岛素清除率。大约采用 3 种策略来间接测量胰岛素清除率。临床实践中最常用的评估涉及基于 C 肽/胰岛素摩尔比8 的方法。这种方法的基础是两种肽的等摩尔分泌以及肝脏没有 C 肽提取9。第二组方法取决于已知和特异性地将激素输入循环后胰岛素血浆衰变曲线的数学分析 2,10,11。第三种方法基于以下事实:以恒定速率输注胰岛素导致血液中激素水平稳定,其中去除率与给药率相匹配12。这些间接方法主要反映体内胰岛素的整体清除率。鉴于肝脏是胰岛素清除的主要部位,在此过程中起着至关重要的作用,因此直接评估肝脏胰岛素清除率至关重要。
以前的研究直接测量了健康狗的肝脏胰岛素提取13,14。研究还使用离体灌注大鼠肝脏模型来评估从肝脏中提取胰岛素15,16。由于转基因菌株的高可用性,小鼠可作为研究分子途径的宝贵模型。一些研究17 利用肝脏灌注直接评估小鼠模型中的肝脏胰岛素清除率。在这些研究中,将含有人胰岛素的灌注液注入门静脉并从下腔静脉收集。肝脏吸收的胰岛素比例表明其清除率。肝脏灌注技术通过在肝脏脉管系统中循环温暖、含氧且营养丰富的灌注液,在接近生理条件下维持肝脏。然而,目前还没有足够的实用指导和基本技巧来推进和传播这项技术。
因此,虽然肝脏胰岛素清除率受到越来越多的关注,但它在疾病中的作用及其分子机制仍不清楚18。因此,科学研究领域非常需要先进的技术。该方案在小鼠中建立了详细的改良肝脏灌注程序,用于评估肝脏胰岛素清除率。此外,该方法还可用于研究药物对肝脏的影响,包括首过效应、药物运输过程和其他各个方面。
研究方案
该方案由南京医科大学动物护理与使用委员会 (IACUC-2105018) 批准,并遵循机构动物护理与使用委员会的指导方针。所有 C57BL/6N 小鼠维持 12 小时的光照/黑暗循环,可自由获取食物和水。将 6 周龄小鼠随机分为松狮饮食 (CD) 组和高脂饮食 (HFD) 组。HFD 组喂食 60% 的高脂肪饮食,并持续这种饮食直到 10 周龄。HFD 组的平均体重为 28.55 g ± 1.2 g,对照组为 24.3 g ± 0.48 g。本研究中使用的试剂和设备的详细信息列在 材料表中。
1. 准备工作
- 通过高压灭菌对手术器械和耗材进行必要的消毒。
- 将手术器械、6-0 丝缝合线、无菌小棉签、氯化钠注射液 (500 mL)、棉签和海绵适当放置在手术台上。
- 制备 30 mL 终浓度为 200 IU/mL 的肝素化盐水。
- 准备两支内径为 0.31 毫米、外径为 0.64 毫米的硅胶管;一个长 4 cm 的用作门静脉导管,另一个长 10 cm 的用作下腔静脉导管。
- 准备含有 5.0 mmol/L 葡萄糖和 0.25% BSA 的 Krebs-Henseleit (KRBH) 灌注缓冲液。
- 制备含有 5.0 mmol/L 葡萄糖、0.25% BSA 和 4.0 ng/mL 人胰岛素的 Krebs-Henseleit (KRBH) 灌注缓冲液。
- 设置肝脏灌注系统。 图 1 显示了肝脏灌注系统的主要组成部分。
2. 手术导管插入术
- 按照以下步骤准备麻醉混合物:
- 用 0.9% 氯化钠溶液稀释 Zoletil 50 (250 mg/5 mL) 10 次。
- 盐酸甲苯噻嗪 (200 mg/2 mL) 用 0.9% 氯化钠溶液稀释 10 次。
- 将 0.5% Zoletil 50 溶液与 1% 盐酸甲苯噻嗪溶液以 1:1 的比例混合。
- 麻醉小鼠。
- 检查并记录鼠标的体重。 通过 腹膜内注射以 5 mL/kg 体重的剂量(2.5 mg/mL Zoletil 50;5 mg/mL 盐酸甲苯噻嗪)施用麻醉混合物。麻醉开始通常发生在注射后 5-10 分钟内,表现为扶正反射丧失和对外部刺激的反应减弱。
- 将鼠标移动到作台。使用胶带固定肢体。腹膜内施用 2.5 U/g 肝素以实现肝素化。
- 使用电动剃须刀修剪腹部皮肤上的皮毛,并用聚维酮碘溶液对该区域进行消毒。
- 进行门静脉导管插入术。
- 从下腹部沿腹中线向剑突做一个 4 cm 的纵向切口。用剪刀小心地剪断腹膜,以免损伤内脏器官。插入小鼠腹部牵开器以露出手术区域。
- 将肠道向右移动,露出门静脉、右肾和下腔静脉(图 2A)。使用动脉钳夹住肾脏上缘的腔静脉。
- 隔离门静脉(图 2A)并用 6-0 丝缝合线连接远端。在暴露血管的近端松散地系上另一根缝合线。
- 用弹簧剪刀在结扎端附近切开一个切口,然后插入导管。将导管通过切口推进至门静脉分叉处的水平。
- 将两个结扎线固定在导管周围,并通过将导管的自由端连接到采样注射器来确认采样正确。用肝素化盐水冲洗并夹住导管(图 2C)。
- 取下牵引装置并重置肠道。用浸有盐水的无菌纱布或棉花覆盖手术区域。
- 进行肝上下腔静脉导管插入术。
- 从剑突沿胸骨切开一个切口,露出胸骨。
- 垂直切开胸骨,沿肋骨边缘切开横膈膜,露出胸腔。
- 暴露并隔离肝上下腔静脉(图 2B)。用 6-0 丝缝合线小心地结扎远端。在血管的近端松散地系上另一根缝合线。
- 用弹簧剪刀在结扎端正下方切开一个切口,然后插入一根 10 厘米的导管。推进导管,直到导管尖端靠近肝脏,并牢固地系好两条结扎线。确认正确采样并夹住导管的自由端(图 2D)。
- 用生理盐水冲洗手术区域。用盐水浸泡的无菌纱布覆盖表面。
3. 肝脏灌注
- 根据动物护理和使用的机构指南,使用过量的麻醉剂和开胸术对小鼠实施安乐死,确保所有程序都以最大限度地减少痛苦的方式进行。
- 设置肝脏灌注系统,包括氧合器、温度调节装置、输液泵和输液管, 如图 1 所示。
- 为氧合器提供 95% 氧气和 5% 二氧化碳的连续气流。
- 打开水浴,将风琴室预热至 37 °C。
- 准备含胰岛素和不含胰岛素的 KRBH 灌注缓冲液。用在 37 °C 水浴中孵育的灌注缓冲液灌注管道系统。
注意:KRBH 不含 BSA 和葡萄糖。不含人胰岛素的 KRBH 灌注缓冲液含有 5.0 mmol/L 葡萄糖和 0.25% BSA,而含人胰岛素的 KRBH 灌注缓冲液含有 5.0 mmol/L 葡萄糖、0.25% BSA 和 4.0 ng/mL 人胰岛素。 - 将鼠标放在环境温度保持在约 37 °C 的容器中。 使用加热垫将体温保持在 37 °C。
- 通过门静脉导管注入 KRBH 缓冲液。 通过 微型泵将输注速率设置为 0.2 mL/min。
- 观察到肝脏在几秒钟内变得苍白,表明灌注缓冲液正在流经肝脏。为了冲洗肝脏中更多剩余的血细胞,请在 4 分钟和 8 分钟的时间点暂停输注 1 分钟,从灌注开始时开始计时。
- 用 KRBH 缓冲液灌注肝脏总共 10 分钟(不包括两个 1 分钟的暂停),代表平衡期。从下腔静脉导管收集基础样本。
- 用富含胰岛素(4.0 ng/mL 人胰岛素)的相同溶液灌注肝脏,再灌注 30 分钟。
- 每 2 分钟从下腔静脉管收集所有样品。
- 记录灌注后的肝脏重量。从不同肺叶收集肝脏样品,立即在液氮中冷冻,然后转移至 -80 °C 储存。
- 将所有收集的灌注样品在 4 °C 下以 ~1,000 x g 离心 10 分钟。 收集上清液并将其转移至-80°C储存。
注:使用人胰岛素酶联免疫吸附测定 (ELISA) 试剂盒测量灌注样品中的胰岛素浓度。 - 手术后,确保所有生物废物都按照安全规定进行处理。
4. 数据分析
- 以 XY 图的形式显示数据,显示胰岛素浓度输出随时间的变化。
- 使用以下公式计算平均肝脏胰岛素清除率 (HICRAVE):
HICRAVE = (1−Cf/Ci) × 100%
其中CI = 输注缓冲液的初始胰岛素浓度,Cf = 肝上下腔静脉最后 10 分钟内的最终平均胰岛素浓度。
结果
该方案概述了肝脏输注直接计算肝脏胰岛素清除率的程序。该模型可靠且可重现。 图 3 显示了从实验中获得的结果示例。平衡 10 分钟后,通过门静脉灌注补充有 4.0 ng/mL 人胰岛素的 KRBH 缓冲液 30 分钟。以 2 min 的间隔从肝上下腔静脉导管中收集灌注液,并测量灌注液中人胰岛素的浓度。结果在本文中显示为 SEM ±平均值。 图 3 显示了比较对照饮食 (CD) 小鼠和高脂饮食 (HFD) 小鼠的肝脏灌注实验示例。CD 组的肝胰岛素清除率 (HICRAVE) 为 55.57% ± 4.43%,HFD 组为 25.37% ± 6.83%(图 3B)。结果表明,高脂肪喂养会导致胰岛素清除受损。
灌注后,取肝脏标本进行苏木精和伊红 (HE) 染色和全玻片扫描;收集正常小鼠的灌注良好的肝脏、灌注不良的肝脏和对照肝脏样本。在较好的灌注条件下,肝组织结构正常,肝索呈放射状排列整齐,肝细胞形状完整,细胞质染色均匀,细胞核清晰圆润,与正常肝脏几乎无法区分(图 4A、B)。当灌注不良时,肝细胞水肿且明显疏松,中央静脉周围有点状坏死,细胞质空泡变性,核脓肿和血管脱离(图 4C)。在基线和灌注后测量灌注液中丙氨酸氨基转移酶 (ALT) 和天冬氨酸氨基转移酶 (AST) 的水平,以评估肝细胞功能。结果表明,ALT 和 AST 水平没有显着差异(图 4D)。
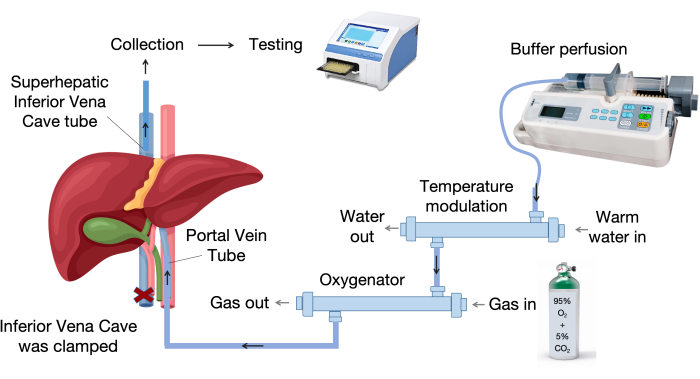
图 1:灌注系统组件。 灌注系统由关键部件组成,包括输液泵、温度控制装置和氧合器。可变温度装置将灌注液保持在 37 °C,而膜式氧合器利用聚丙烯中空纤维进行有效的气体交换。 请单击此处查看此图的较大版本。

图 2:解剖位置和导管插入术。 (A,B)描绘了门静脉和下腔静脉的解剖位置。(C) 门静脉导管位于分叉处正下方,进入左肝支和右肝支,将血管夹应用于肝内下腔静脉。(D) 导管插入肝上下腔静脉并放置在肝脏上缘附近。 请单击此处查看此图的较大版本。
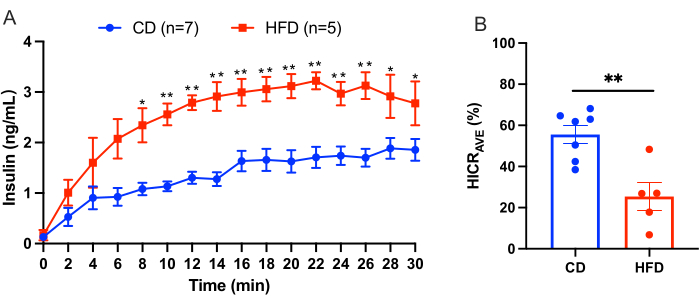
图 3:肝脏灌注实验结果。 比较对照饮食 (CD) 小鼠与高脂饮食 (HFD) 小鼠的肝脏灌注实验的结果。(A) CD 小鼠(蓝色,n = 7)与 HFD 小鼠(红色,n = 5)肝脏灌注期间的胰岛素浓度。(B) 平均肝脏胰岛素清除率 (HICRAVE)。所有数据均以平均值± SEM 表示。统计显着性表示为 *p < 0.05,**p < 0.01 相对于 CD 小鼠,使用未配对的 t 检验进行分析。结果表明,高脂肪喂养会导致胰岛素清除受损。 请单击此处查看此图的较大版本。

图 4:灌注对肝脏组织学和功能的影响。 (A) 正常的小鼠肝脏形态(对照)。(B) 增强灌注条件下的肝脏形态。(C) 次优灌注条件下的肝脏形态。红色箭头表示血管脱离,黑色箭头表示空泡化,绿色箭头突出显示细胞核的 pyknosis。放大倍数:40 倍。(D) 灌注液中丙氨酸氨基转移酶 (ALT) 和天冬氨酸氨基转移酶 (AST) 的水平,在基线和灌注后测量。采用配对 t 检验 方法进行分析。 请单击此处查看此图的较大版本。
讨论
协议中的关键步骤
上述外科手术应轻柔小心地进行,以避免在肝脏中产生任何病变。此外,如果在插管过程中不小心处理,肝静脉血管壁的脆弱结构使其容易被穿刺和随后的出血。该方案使用较软的硅胶管,以尽量减少对血管的损伤。建议由经验丰富的外科医生进行导管插入术,他应经常练习以提高插管成功率并最大限度地减少手术时间。
应偶尔用温盐水冲洗手术区域,以维持肝细胞活力。灌注时,手术区域应用无菌纱布或棉花遮挡。这种做法可以防止长时间暴露在空气中,这可能会损害肝细胞功能。
挑战和解决方案
将导管尖端定位在门静脉分支到左右肝门静脉的点之前至关重要。如果导管插入得太深,肝叶之间可能会出现灌注不均匀。此外,在输注过程中必须小心避免气泡,因为它们有可能在肝脏中诱发空气栓塞。这会显着影响到达肝细胞的液体灌注,进而影响胰岛素清除。
KH 缓冲液输注的前 10 分钟构成平衡期,在此期间,灌注可暂停 1-2 次,每次 2 分钟,以尽可能将残留血细胞冲洗到肝窦中。如果在连续灌注 15 分钟后在采集的标本中观察到血液,这可能表明肝下腔静脉上的血管钳位置不正确,应检查19。如果暂停输注,由于肝窦中残留血细胞,当重新开始输注时,收集的标本中可能会出现红细胞。在测量胰岛素之前,应 通过 离心分离红细胞,因为这些细胞内存在胰岛素降解酶可能会影响胰岛素水平。
手术导管插入术的持续时间、肝缺血再灌注时间以及灌注期间进入门静脉的气体量都会影响肝细胞的功能,从而影响肝脏清除胰岛素的速度。可以通过测量丙氨酸氨基转移酶 (ALT)、天冬氨酸氨基转移酶 (AST)、乳酸脱氢酶 (LDH) 和碱性磷酸酶 (ALP) 含量以及 H&E 染色来监测肝功能障碍的程度。研究表明,手术成功后,肝脏继续功能和反应至少 3 h19。
小鼠肝脏灌注的重要性和潜在应用
小鼠是理想的研究对象,因为它们与人类的基因相似性、生殖周期短以及先进的基因工程工具的可用性20。在小鼠模型中,可以使用多种方法评估胰岛素清除率。在腹膜内葡萄糖耐量试验 (IPGTT) 期间,肝脏胰岛素清除率测量为 C 肽与胰岛素21 的曲线下面积 (AUC)(通过梯形法计算)的比率。在正常血糖-高胰岛素血症钳夹期间,外源性胰岛素输注速率与产生的稳态血浆胰岛素浓度之间的比率可用作间接估计胰岛素清除率的方法22。然而,这些方法都间接评估肝脏胰岛素清除率。
一些研究人员还使用基于细胞的检测来评估胰岛素降解。将来自小鼠的 HepG2 细胞或原代肝细胞接种在培养板中,并加入适当浓度的人胰岛素。以特定时间间隔收集培养基样品,以测量人胰岛素浓度并评估其随时间推移的降解17。在该方案中,描述了一种用户友好的 小鼠原位 肝灌注程序,用于直接评估肝脏胰岛素清除率。与使用分离肝细胞的体外研究相比,肝脏灌注具有保留肝脏结构、带状分裂、极性和血管完整性的好处。
小鼠肝脏灌注系统是研究肝脏胰岛素代谢动力学和分子机制的宝贵工具。此外,该协议不仅可以广泛用于预诱导疾病模型,还可以用于急性激发刺激测试。然而,这种技术是有限的,因为它应该 在原位进行。该方案涉及一种改进的手术导管插入技术,可最大限度地减少损伤并最大程度地保持肝脏的解剖完整性。需要进一步的努力来最好地利用这项技术来阐明胰岛素清除的机制,尤其是在与胰岛素抵抗相关的代谢疾病中。
披露声明
没有宣布利益冲突。
致谢
这项工作得到了中国国家自然科学基金 (82200948, 82270921, 82170882) 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 60% high-fat diet | Research Diets, USA | D12492 | |
| Alanine aminotransferase Assay Kit | Nanjing Jiancheng Bioengineering Institute | C009-2-1 | |
| Anhydrous Glucose | Sangon Biotech | 50-99-7 | 500 G |
| Aspartate aminotransferase Assay Kit | Nanjing Jiancheng Bioengineering Institute | C010-2-1 | |
| Bovine Serum Albumin | GeminiBio | 700-107P | Fatty Acid-Free |
| Contour TS Blood Glucose Meter | Bayer | PH220800019 | |
| Contour TS Blood Glucose Test Strips | Bayer | DP38M3F05A | |
| Heparin Sodium | Changzhou Qian hong Bio-pharma | H32022088 | 12500 U/2mL |
| Human insulin | Novo Nordisk | S20191007 | 300 U/3mL |
| Human insulin immunoassay kit | Ezassay Biotechnology | HM200 | |
| KRBH buffer (Sugar, BSA free) | coolaber | SL65501 | 500 mL |
| Membrane oxygenator | Xi'an Xijing Medical Appliance | 5 | |
| Microscopic scissors | Shanghai Jinzhong | YBC020 | |
| Micro-serrefine clamp | Ningbo Medical Needle | 180709 | |
| Microsurgery forceps | Shanghai Jinzhong | WA3010, WA3020 | |
| Needle type filter | N-buliv | LG05-133-2 | |
| Povidone-iodine Solution | Shanghai likang Disinfectant Hi-Tech | 20231016J | |
| pump 11 Elite | Harvard Apparatus | PC5 70-4500 | |
| Retractor | Globalebio (Beijing) Technology | GEKK-10mm | 10 mm |
| Silicone Tubing | scientific commodities | #BB518-12 | 0.31 mm × 0.64 mm |
| Silicone Tubing | Fisher Scientific | #11-189-15A | ID 0.5 mm |
| Sodium Chloride Injection | Baxter | S2402023 | 4.5 g/500 mL |
| Surgical silk suture | Yangzhou Huanyu Medical Equipment | 6-0 | |
| Temperature modulation | Xi'an Xijing Medical Appliance | 6 | |
| Thermostatic water bath | Jiaxing Junsi Electronics | HIH-1 | 220 V 50 HZ |
| Three-way Joint | YISAI | AQTCY1.6 | ID 0.4 mm |
| Xylazine Hydrochloride Injection | ShengXin | 20240106 | 200 mg/2mL |
| Zoletil 50 | Virbac | WK001 | 250 mg/5mL |
参考文献
- Najjar, S. M., Perdomo, G. Hepatic insulin clearance: Mechanism and physiology. Physiology (Bethesda). 34 (3), 198-215 (2019).
- Fu, Z., et al. Impaired insulin clearance as the initial regulator of obesity-associated hyperinsulinemia: Novel insight into the underlying mechanism based on serum bile acid profiles. Diabetes Care. 45 (2), 425-435 (2022).
- Koh, H. E., Cao, C., Mittendorfer, B. Insulin clearance in obesity and type 2 diabetes. Int J Mol Sci. 23 (2), 596 (2022).
- Bril, F., et al. Relationship between disease severity, hyperinsulinemia, and impaired insulin clearance in patients with nonalcoholic steatohepatitis. Hepatology. 59 (6), 2178-2187 (2014).
- Herman, R., Sikonja, J., Jensterle, M., Janez, A., Dolzan, V. Insulin metabolism in polycystic ovary syndrome: Secretion, signaling, and clearance. Int J Mol Sci. 24 (4), 3140 (2023).
- Najjar, S. M., Caprio, S., Gastaldelli, A. Insulin clearance in health and disease. Annu Rev Physiol. 85, 363-381 (2023).
- Polidori, D. C., Bergman, R. N., Chung, S. T., Sumner, A. E. Hepatic and extrahepatic insulin clearance are differentially regulated: Results from a novel model-based analysis of intravenous glucose tolerance data. Diabetes. 65 (6), 1556-1564 (2016).
- Castillo, M. J., Scheen, A. J., Letiexhe, M. R., Lefebvre, P. J. How to measure insulin clearance. Diabetes Metab Rev. 10 (2), 119-150 (1994).
- Rubenstein, A. H., Pottenger, L. A., Mako, M., Getz, G. S., Steiner, D. F. The metabolism of proinsulin and insulin by the liver. J Clin Invest. 51 (4), 912-921 (1972).
- Terris, S., Steiner, D. F. Binding and degradation of 125i-insulin by rat hepatocytes. J Biol Chem. 250 (21), 8389-8398 (1975).
- Ooms, H. A., Arnould, Y., Rosa, U., Pennisi, G. F., Franckson, J. R. Total metabolic clearance of crystalline insulin and radio-iodide substitued insulin. Pathol Biol. 16 (5), 241-245 (1968).
- Defronzo, R. A., Tobin, J. D., Andres, R. Glucose clamp technique: A method for quantifying insulin secretion and resistance. Am J Physiol. 237 (3), E214-E223 (1979).
- Asare-Bediako, I., et al. Assessment of hepatic insulin extraction from in vivo surrogate methods of insulin clearance measurement. Am J Physiol Endocrinol Metab. 315 (4), E605-E612 (2018).
- Kim, S. P., Ellmerer, M., Kirkman, E. L., Bergman, R. N. Beta-cell "rest" accompanies reduced first-pass hepatic insulin extraction in the insulin-resistant, fat-fed canine model. Am J Physiol Endocrinol Metab. 292 (6), E1581-E1589 (2007).
- Kotsis, T., et al. Insulin metabolism and assessment of hepatic insulin extraction during liver regeneration. A study in a rat model. J Invest Surg. 33 (1), 69-76 (2020).
- Mondon, C. E., Olefsky, J. M., Dolkas, C. B., Reaven, G. M. Removal of insulin by perfused rat liver: Effect of concentration. Metabolism. 24 (2), 153-160 (1975).
- Tamaki, M., et al. The diabetes-susceptible gene SLC30A8/ZnT8 regulates hepatic insulin clearance. J Clin Invest. 123 (10), 4513-4524 (2013).
- Ghadieh, H. E., Gastaldelli, A., Najjar, S. M. Role of insulin clearance in insulin action and metabolic diseases. Int J Mol Sci. 24 (8), 7156 (2023).
- Winther-Sorensen, M., Kemp, I. M., Bisgaard, H. C., Holst, J. J., Wewer Albrechtsen, N. J. Hepatic glucose production, ureagenesis, and lipolysis quantified using the perfused mouse liver model. J Vis Exp. 200, e65596 (2023).
- Rydell-Tormanen, K., Johnson, J. R. The applicability of mouse models to the study of human disease. Methods Mol Biol. 1940, 3-22 (2019).
- Zaidi, S., et al. Loss of ceacam1 in hepatocytes causes hepatic fibrosis. Eur J Clin Invest. 54 (7), e14177 (2024).
- Piccinini, F., Bergman, R. N. The measurement of insulin clearance. Diabetes Care. 43 (9), 2296-2302 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。