Method Article
Применение окрашивания живых митохондрий при сортировке клеток для очистки гепатоцитов, полученных из индуцированных плюрипотентных стволовых клеток человека
В этой статье
Резюме
Гепатоциты, полученные из плюрипотентных стволовых клеток, могут быть очищены путем сортировки клеток с использованием комбинации окрашивания митохондриальными и активированными молекулами адгезии лейкоцитарных клеток (ALCAM, также известными как CD166).
Аннотация
Человеческие эмбриональные стволовые клетки (ЭС) и индуцированные плюрипотентные стволовые клетки (ИПКС) имеют потенциальное применение в клеточной регенеративной медицине для лечения тяжелобольных органов благодаря их неограниченной пролиферации и плюрипотентным свойствам. Тем не менее, дифференциация человеческих ES/iPS-клеток в 100% чистые типы клеток-мишеней является сложной задачей из-за их высокой чувствительности к окружающей среде. Онкогенез после трансплантации вызывается загрязненными, пролиферирующими и недифференцированными клетками, что делает технологию высокой очистки необходимой для безопасной реализации регенеративной медицины. Для снижения риска онкогенеза была разработана технология высокой очистки гепатоцитов человека, полученных из iPS-клеток. В методе используется FACS (флуоресцентно-активируемая сортировка клеток) с использованием комбинации высокого содержания митохондрий и маркера клеточной поверхности ALCAM (активированная молекула адгезии лейкоцитарных клеток) без генетической модификации. 97% ± 0,38% (n = 5) очищенных гепатоцитов, использующих этот метод, проявляли экспрессию белка альбумина. Целью данной статьи является предоставление подробных процедур для этого метода применительно к самому современному методу двумерной дифференцировки iPS-клеток человека в гепатоциты.
Введение
Эмбриональные и индуцированные плюрипотентные стволовые клетки (ЭС и ИПК соответственно) считаются перспективными источниками клеток для регенеративной терапии. Тем не менее, эффективность дифференцировки этих клеток в конкретные типы клеток-мишеней может варьироваться, даже при использовании одной и той же клеточной линии, протокола и экспериментатора 1,2,3,4. Эта изменчивость может быть связана с высокой чувствительностью клеток ES/iPS человека к окружающей среде. Поэтому в настоящее время сложно стабильно получать чистые клетки-мишени. Для достижения высокобезопасной регенеративной медицины крайне важно элиминировать пролиферативные клетки и недифференцированные стволовые клетки в терапевтических клетках, а также передовая технология очистки клеток-мишеней 5,6,7.
Сортировщик клеток — это устройство, которое мгновенно анализирует отдельные клетки и сортирует интересующие их живые клетки на основе уровня флуоресцентного сигнала, предлагая многообещающее решение. Это может быть достигнуто путем окрашивания антителами поверхностных маркеров, специфичных для типа клеток, или путем использования экспрессии репортерных генов, специфичных для типа клеток. Существует несколько сообщений о методах очистки кардиомиоцитов 8,9,10, полученных из плюрипотентных стволовых клеток, и гепатоцитов11,12. Hattori et al. разработали инновационный метод митохондриальной очистки с использованием клеточного сортировщика13. Учитывая тот факт, что кардиомиоциты обладают высокими энергетическими потребностями благодаря митохондриальной активности, окрашивание клеток живым митохондриальным красителем TMRM (метиловый эфир тетраметилродамина) может быть использовано для мечения и высокой очистки кардиомиоцитов с помощью FACS из эмбриоидных телец человеческих ES-клеток, содержащих различные типы клеток. Отсутствие онкогенности было подтверждено анализами на образование тератомы с очищенными кардиомиоцитами. Кроме того, Ямасита и др. неожиданно открыли метод очистки гепатоцитов из эмбриоидных телец человека, полученных из ES-клеток, путем выделения фракций с высокой митохондриальной активностью и ALCAM-положительнойэкспрессией. Обоснование этого метода заключается в том, что гепатоциты также имеют относительно большое количество митохондрий из-за высокого потребления ими АТФ для метаболизма питательных веществ и детоксикации15, а гепатоциты экспрессируют ALCAM, члена суперсемейства иммуноглобулинов, который играет роль в адгезии и миграции клеток16.
Предыдущие высокоочищающие методы для гепатоцитов, полученных из плюрипотентных стволовых клеток, требовали генетических модификаций, а негенетические методы очистки имели низкую эффективность. Митохондриальный негенетический метод имеет достоинства для достижения высокой чистоты. Когда необходимы печеночные клетки-предшественники, можно выбрать методына основе CD133 и CD13- или Dlk1 18,19. Несмотря на то, что точность технологии редактирования генома продвинулась вперед, потенциальный риск непредвиденных изменений генома (например, канцерогенеза) не может быть полностью устранен. Методы, основанные на митохондриальной активности, без привлечения генетической модификации, могут быть свободны от таких рисков.
В результате исследования различных митохондриальных показателей в кардиомиоцитах новорожденных крыс наблюдалось полное исчезновение ТМРМ в течение 24 ч, в то время как другие красители сохранялись в течение не менее 5 дней13 дней. Кроме того, важно отметить, что TMRM и JC-1 не влияли на жизнеспособность клеток при оценке с помощью анализа 3-(4,5-диметил-тиазол-2-ил)-2,5-дифенилтетразолия бромида (МТТ), в то время как другие красители продемонстрировали различное влияние на жизнеспособностьклеток13. TMRM демонстрирует более высокую безопасность.
На сегодняшний день разработано несколько методов двумерной (2D) дифференцировки в качестве более эффективных подходов к индуцированию дифференцировки по сравнению с трехмерным (3D) формированием эмбриоидного тела. Это связано с тем, что пошагово индуцирующие дифференцировку соединения или цитокины могут быть равномерно введены в клетки в двумерной плоскости, а не в трехмерном пространстве. В данном исследовании ранее описанный метод20 был модифицирован для индуцирования дифференцировки в гепатоциты, полученные из iPS-клеток человека. В данной работе подробно описаны процедуры современной 2D-дифференцировки и очистки гепатоцитов, полученных из iPS-клеток человека.
протокол
В этом исследовании использовались коммерчески полученные человеческие iPS-клетки (штамм 253G1) (см. Таблицу материалов).
1. Поддержание iPS-клеток человека
- Поддерживайте iPS-клетки человека в безпитательных условиях в среде AK02 на чашках для культур, покрытых 0,25 мкг/см2 iMatrix-511 (см. Таблицу материалов).
2. Печеночная дифференцировка iPS-клеток человека в 2D-культурах
ПРИМЕЧАНИЕ: На рисунке 1А приведен ежедневный график печеночной дифференцировки. На протяжении всего процесса используйте 6-луночные планшеты для культивирования и добавляйте 2 мл специальной промывочной или питательной среды в каждую лунку. Поддерживайте состояние клеточной культуры при 100% влажности, 5%CO2 и 20%O2 при 37 °C.
- Смажьте каждую лунку 6-луночного планшета 1 мл матрицы базальной мембраны (разбавленной на 1/25 PBS (-)) и инкубируйте при 37 °C в течение 1 ч.
- Пропустите человеческие iPS-клетки на покрытую оболочкой чашку с плотностью 20 000-30 000 клеток/см² с использованием среды AK02N с добавлением 10 μМ ингибитора ROCK (Y-27632) (см. Таблицу материалов). Замените среду без Y-27632 на следующий день и культуру еще на 2 дня.
- Промойте клетки один раз средой RPMI-1640. Инициируйте дифференцировку энтодермы, заменив среду на RPMI-B27-Glu (RPMI-1640 + 2% инсулин B27 + 1% дипептид L-аланил-L-глутамин) с добавлением 3-6 мкМ CHIR-99021 и 100 нг/мл активина А в течение 24 ч (см. таблицу материалов).
- Замените среду на RPMI-B27-Glu с добавлением 50 нг/мл активина А на 24 ч.
- Чтобы вызвать дифференцировку печеночных предшественников, замените среду на RPMI-B27-Glu с добавлением 1% диметилсульфоксида (ДМСО) на 5 дней.
- Чтобы ускорить созревание гепатоцитов, переключитесь на среду для созревания гепатоцитов: среду L-15 Лейбовица, содержащую 10 мкМ гидрокортизона 21-гемисукцината, 8,3% триптозофосфатного бульона, 100 нМ дексаметазона (DEX), 50 мкг/мл натрия-L-аскорбата, 0,58% инсулин-трансферрин-селена (ITS), 8,3% фетальной бычьей сыворотки (FBS), 2 мМ дипептида L-аланил-L-глутамина и 100 нМ N-гексаноевого-три-иле-(6)-аминогексанового амида (Дигекса) (см. Таблицу материалов).
- Меняйте носитель каждые 2 дня в течение 20 дней. Отсортируйте клетки примерно через 27 дней после начала дифференцировки.
3. Клеточный препарат для очистки гепатоцитов iPS-клеток человека
- Печеночные дифференцированные клетки промывают 2 мл PBS (-) на лунку.
- Добавьте в буфер Ads 1 мл раствора фермента, который включает 0,1% коллагеназу, 0,083% трипсина, 10 мкМ ингибитора ROCK (Y-27632), 20 нМ циклоспорина А и 50 мкг/мл L-аскорбата натрия (116 мМ NaCl, 12,5 мМ2PO4, 20 мМ HEPES, 5,4 мМ KCl, 5,6 мМ глюкозы и 0,8 мМ MgSO4; pH 7,35) (см. Таблицу материалов). Отделите ячейки от пластин, вращая их горизонтально при температуре 37 °C в течение примерно 2 часов.
- Убедившись, что клетки отделены и округлены под микроскопом, диспергируйте их в отдельные клетки с помощью щадящего пипетирования и соберите в пробирку объемом 50 мл.
- Центрифугируйте ячейки при 200 x g в течение 5 минут при 18 °C для их гранулирования. Удалите надосадочную жидкость с помощью аспиратора.
- Окрашивание митохондрий клеток путем диспергирования их в 5 мл среды для созревания гепатоцитов, содержащей 100 нМ TMRM (тетраметилродамин, сложный эфир метла) (см. Таблицу материалов). Выдерживать в течение 30 минут при температуре 37 °C, защищая от света, завернув в алюминиевую фольгу.
- Центрифугируйте клетки при 200 x g в течение 5 минут при 18 °C для их гранулирования. Удалите надосадочную жидкость.
- Ресуспендируйте ячейки с 1-5 мл буфера холодной рекламы, содержащего 2% FBS.
- Подсчитайте количество клеток с помощью 0,4% раствора трипанового синего и планшета для подсчета клеток.
- Центрифугируйте ячейки при 200 x g в течение 5 минут при 4 °C для их гранулирования. Удалите надосадочную жидкость.
- Разведите антитело против ALCAM (первичное антитело, см. Таблицу материалов) в соотношении 1:50 в буфере Ads и добавьте 100 мкл разведенного антитела на 10-6 клеток. Окрасьте ячейки на 50 минут на лед. Подготовьте клетки, которые не окрашены первичным антителом в качестве отрицательного контроля.
- Промойте ячейки холодным буфером Ads, содержащим 2% FBS, дважды.
- Разбавьте IgG против коз Alexa Fluor 488 (вторичное антитело, см. Таблицу материалов) в соотношении 1:100 в буфере Ads и добавьте 100 мкл разведенного антитела на 106 клеток. Покрасьте клетки на 30 минут на лед. Окрашивание клеток, которые не были окрашены первичным антителом, с помощью вторичного антитела.
- Промойте ячейки холодным буфером Ads, содержащим 2% FBS, дважды.
- Повторно суспендируйте ячейки в буфере Ads и отфильтруйте их через сетчатый фильтр с защелкивающейся крышкой (меш 35 мкм) непосредственно перед сортировкой с помощью FACS, чтобы удалить крупные скопления клеток и мусор.
4. FACS-анализ и сортировка гепатоцитов, полученных из iPS-клеток человека
- Настройте машину FACS для сортировки ячеек в соответствии с инструкциями производителя (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Используйте сопло размером 85 мкм или 100 мкм и нейтральный фильтр 2,0 для гепатоцитов. Используйте канал FITC для детектирования Alexa Flour 488 для ALCAM и канал PE для детектирования флуоресценции TMRM для митохондрий. - Отрегулируйте напряжения FSC (прямое рассеяние) и SSC (боковое рассеяние) для правильной визуализации популяции ячеек.
- Отрегулируйте напряжение флуоресцентных каналов FITC и PE. Начните с неразмеченных ячеек и центрируйте популяцию ячеек в нижней части каждого графика канала. Убедитесь, что помеченные ячейки правильно расположены в пределах графика.
- Используйте общую стратегию стробирования для устранения дублетов: Гейт основной FSC-A против Популяция SSC-A (Рисунок 2A), за которой следует FSC-H в сравнении с -W, а затем SSC-H против. -W (Рисунок 2B,C).
- Загатите популяцию TMRMhi и ALCAM+ (P2 на рисунке 2E) для сортировки гепатоцитов. Загатите популяцию TMRMhi и ALCAM- (P1 на рисунке 2E) для сортировки негепатоцитов. Отсортированные гепатоциты и негепатоциты соберите в пробирки для сбора по 15 мл, содержащие среду для созревания гепатоцитов.
- Центрифугируйте сборную пробирку, содержащую отсортированные клетки, при температуре 200 x g в течение 5 мин при 18 °C.
- Удалить надосадочную жидкость и ресуспендировать клетки в среду для созревания гепатоцитов.
- Посев клеток на обработанные митомицином С эмбриональные фибробласты мышей (МЭФ) или гелеобразный матрикс базальной мембраны средой для созревания гепатоцитов с добавлением 10 мкМ Y-27632 и 20 нМ циклоспорина А. Культивирование клеток в инкубаторе с температурой 37 °C CO2 в течение 5 дней.
5. Иммуноцитохимия для обнаружения гепатоцитов iPS-клеток человека
- Культивируемые клетки промыть в течение 5 дней после сортировки PBS (-).
- Зафиксируйте клетки 4% параформальдегидом на 5 минут при комнатной температуре.
- Промойте клетки буфером TBS-T (1x TBS с 1% Tween 20) дважды, чтобы удалить параформальдегид.
- Инкубировать клетки с 0,1% разбавленным буфером TBS-T Triton X-100 в течение 5 минут при комнатной температуре.
- Дважды промойте элементы буфером TBS-T, чтобы удалить Triton X-100.
- Добавить в ячейки имеющийся в продаже раствор блокировки (см. Таблицу материалов) на 30 мин при комнатной температуре.
- Добавьте первичные антитела против альбумина (маркера гепатоцитов) и ядерного антигена человека (hNA, см. таблицу материалов), разведенные в соотношении 1:50 в блокирующем растворе.
- Инкубируйте клетки при температуре 4 °C в течение ночи. Дважды промойте ячейки буфером TBS-T.
- Добавьте вторичные антитела: Alexa Fluor 488 donkey anti-rabbit IgG и Alexa Fluor 546 donkey anti-mouse IgG, разведенные в соотношении 1:100 в блокирующем растворе (см. Таблицу материалов).
- Инкубируйте клетки при комнатной температуре в течение 30 минут. Дважды промойте ячейки буфером TBS-T.
- Оцените чистоту гепатоцитов путем подсчета альбумин-положительных и hNA-положительных клеток под флуоресцентным микроскопом. Рассчитайте процент альбумин-положительных клеток на hNA-положительную клетку для популяций P1 и P2.
Результаты
Показана временная шкала процессов, индуцирующих дифференцировку iPS-клеток человека в гепатоциты с помощью 2D-культуры (рисунок 1A) и репрезентативных особенностей клеток (рисунок 1B). Примерно на 12-й день дифференцировки клетки начали проявлять многоугольную клеточную форму и круглые ядра, характерные для гепатоцитов. Некоторые гепатоциты также проявляли многоядерность.
Анализ FACS проводили с использованием клеток на 27-е сутки дифференцировки. Для идентификации популяции ALCAM+ на рисунке 2D,E показаны сравнительные графики с первым антителом против ALCAM и без него. Индуцируя печеночную дифференцировку с помощью 2D-культуры, популяция гепатоцитов (P2) составила 10,1% в этом эксперименте, что представляет собой значительное увеличение по сравнению с 0,8% (данные не показаны), обнаруженными с использованием 3D-метода формирования эмбриоидного тела.
Отсортированные клетки P1 и P2 культивировали на эмбриональных фибробластах мышей, обработанных митомицином C. Клетки P2 демонстрировали компактное сферическое колониеобразование, в то время как P1-клетки были дисперсными и имели более плоскую морфологию. Иммуногистохимическое окрашивание на человеческий ядерный антиген (hNA) и альбумин подтвердило обогащение гепатоцитоподобных клеток в P2, как показано на рисунке 3. Для оценки чистоты гепатоцитов в клетках Р1 и Р2 рассчитывали соотношение альбумин-положительных клеток к hNA-положительным клеткам (n = 5). Результаты показали, что 0% Р1-клеток и 97% ± 0,38% Р2-клеток были получены из человеческих ИПСК и проявляли гепатоцитоподобные характеристики (Рисунок 3).
Для подтверждения успешной сортировки гепатоцитов в ходе эксперимента FACS рекомендуется совместное окрашивание ASGR1 его специфическим антителом, конъюгированным с различными флуорофорами, и подтверждение, что P2 содержит ASGR1-положительные клетки.
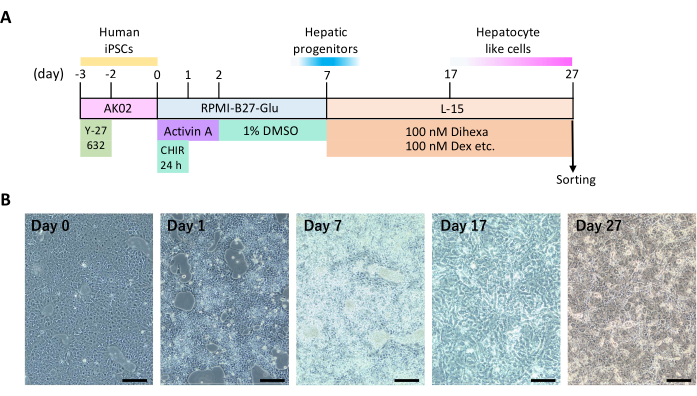
Рисунок 1: 2D печеночная дифференцировка ИПСК человека. (A) Временная шкала печеночной дифференцировки. Этот рисунок взят из Yamashita et al.14. (Б) Морфологические изменения во время печеночной дифференцировки. Масштабные линейки = 200 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Стратегия гейтирования для сортировки гепатоцитов и не-гепатоцитов в дифференцированных клетках печени (день 27). (A) Гейтирование популяции клеток-мишеней с использованием FSC-A в сравнении с Сюжет SSC-A. (B) Расширение закрытой популяции с шага (A) с использованием FSC-H по сравнению с FSC-W строит график и исключает дублетные ячейки. (C) Дальнейшее расширение закрытой популяции с шага (B) с использованием SSC-H по сравнению с График SSC-W и исключение дублетных ячеек. (D) и (E) Расширение закрытой популяции с шага (C) с использованием FITC-A (ALCAM) по сравнению с Участок PE-A (TMRM). (D) Окрашенные клетки TMRM и2-м антителом. (E) Окрашенные клетки с TMRM и1-м и2-м антителами. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
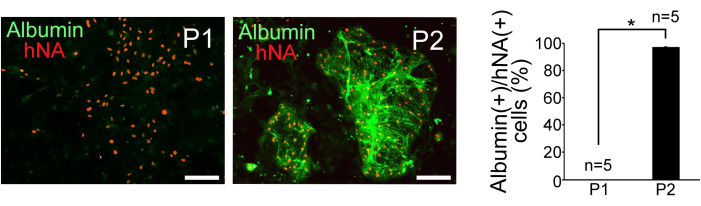
Рисунок 3: Результаты иммуногистохимического анализа. Иммуногистохимическое обнаружение альбумина и человеческого ядерного антигена (hNA) в отсортированных клетках P1 и P2, а также количественное определение клеточной фракции альбумина (+) в клетках hNA (+). Масштабные линейки = 100 μм. Данные представлены в виде среднего ± стандартного отклонения (SD) (n = 5). Статистический анализ проводили с использованием t-критерия Стьюдента. *P < 0,05. Этот рисунок взят из Yamashita et al.14. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Благодаря своей функции в метаболизме питательных веществ и детоксикации, гепатоциты обладают относительно большим количеством митохондрий по сравнению сдругими типами клеток. ALCAM входит в суперсемейство иммуноглобулинов и играет роль в адгезии и миграции клеток. Он экспрессируется в различных типах клеток, включая печеночные, эпителиальные, лимфоцитарные, миелоидные, фибробластные и нейрональные клетки16. С помощью комбинации метода, основанного на митохондриях, и антитела ALCAM, были успешно идентифицированы гепатоциты, полученные из iPS-клеток человека.
В то время как анализы для характеристики секреторной функции или ферментативной активности очищенных гепатоцитов не проводились, экспрессия мРНК гена CYP3A4 в очищенных гепатоцитах человека, полученных из iPS-клеток, была проверена. Кроме того, популяция гепатоцитов с TMRM (высоким) и ALCAM (+) выделена из эмбриоидных телец, полученных из ES-клеток человека, в которых наблюдалась более высокая экспрессия гепатоцит-ассоциированных наборов генов (VTN, SERPINA1, CYP1A1, FGB, FGA, FGG, AFP, ALB и APOB) по сравнению с кардиомиоцитами, полученными из ES-клеток14.
Важным шагом в рамках протокола является бережное отделение 2D-дифференцированных клеток печени от культуральных чашек с минимальными повреждениями, обеспечивая при этом сохранение митохондриальной активности для окрашивания TMRM. В зависимости от состояния дифференцировки, гепатоциты могут проявлять устойчивость к отслоению от чашки даже при обработке ферментами, и эта проблема может быть эффективно решена путем добавления 0,25 мМ ЭДТА.
Существующие методы очистки гепатоцитов с помощью FACS включают введение репортерных генов ниже по потоку промоторов, специфичных для генов, экспрессируемых гепатоцитами. Однако такой подход несет в себе потенциальный риск побочных эффектов, связанных с генетическими модификациями. Митохондриальный метод, с другой стороны, устраняет такие проблемы. Было идентифицировано несколько маркеров клеточной поверхности стволовых/прогениторных клеток печени взрослого или плода18, а печеночные клетки-предшественники, полученные из плюрипотентных стволовых клеток человека, могут быть отсортированы с использованием популяции CD13+CD133+ 19. С другой стороны, среди гепатоцитов, полученных из плюрипотентных стволовых клеток, небольшая часть созревших гепатоцитов может быть отсортирована с использованием антитела17 ASGR1 (рецептор азиалогликопротеина 1), которое является единственным маркером клеточной поверхности, специфичным для гепатоцитов. Показано, что популяция клеток с высокой митохондриальной и ALCAM-положительной способностью содержит как популяции, маркированные CD13+CD133+ клетками, так и ASGR1+ клетками. Это говорит о том, что высокомитохондриальные и ALCAM-положительные популяции могут содержать широкий спектр гепатоцитов с различной степенью созревания14. Следовательно, этот метод может обеспечить очистку популяции гепатоцитов с небольшими потерями.
Анализ цельных внутренних органов плода мыши на эмбриональные сутки 14,5 суток с использованием этого метода выявил экспрессию ALCAM как в миоцитах, так и в гепатоцитах14. В других предыдущих исследованиях сообщалось об экспрессии ALCAM в клетках-предшественниках миокарда мышей21. В случае с клетками, полученными из плюрипотентных стволовых клеток человека, кардиомиоциты были идентифицированы в ALCAM-отрицательной популяции. Эти данные показывают, что экспрессия ALCAM в сердечных и печеночных линиях различается в зависимости от вида и стадии зрелости клеток. Однако, из-за более высокой митохондриальной фракции в кардиомиоцитах по сравнению с гепатоцитами, было фактически успешно разделить эти два типа клеток с помощью FACS даже от смешанных клеток, полученных из цельного эмбриона мыши. Это говорит о том, что предложенный метод может быть полезен для очистки гепатоцитов и кардиомиоцитов других видов животных.
Ожидается, что описанная в настоящем документе технология очистки гепатоцитов сыграет ключевую роль в развитии регенеративной медицины за счет снижения потенциального риска образования опухолей, связанного с трансплантацией гепатоцитов человека, полученных из iPS-клеток. Тем не менее, отрицание тератомообразующей способности в популяции гепатоцитов, очищенной с помощью этого метода, не было сделано. Необходимо провести дальнейшие исследования для обеспечения безопасности.
Крупные и адгезивные клетки, такие как гепатоциты, очень уязвимы к механическим повреждениям во время сортировки FACS, что приводит к значительной потере жизнеспособных клеток. Для клинического применения важно разработать новый метод очистки, который создает культуральную среду, обеспечивающую выживание исключительно гепатоцитов, такой как метод лактата для очистки кардиомиоцитов22.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана грантом No 23390072] Министерства образования, культуры, спорта, науки и технологий [].
Материалы
| Name | Company | Catalog Number | Comments |
| 253G1 human iPS cell line | RIKEN BioResource Research Center | HPS0002 | |
| 4% paraformaldehyde | FUJIFILM Wako Pure Chemical Corporation | 163-20145 | |
| Activin A Solution, Human, Recombinant | NACALAI TESQUE, INC. | 18585 | |
| Anti-Nuclei Antibody, clone 235-1 | Chemicon | MAB1281 | Antibody against human nuclear antigen |
| B-27 Supplement (50x), serum free | Thermo Fisher Scientific | 17504044 | |
| BD FACSAria III | BD Biosciences | Cell sorter | |
| CHIR-99021 | MedChemExpress | HY-10182 | |
| Ciclosporin A | FUJIFILM Wako Pure Chemical Corporation | 035-18961 | |
| Collagenase | FUJIFILM Wako Pure Chemical Corporation | 034-22363 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | Corning | 354230 | Gel-like basement membrane matrix |
| CultureSure Y-27632 | FUJIFILM Wako Pure Chemical Corporation | 036-24023 | ROCK inhibitor |
| Dexamethasone | FUJIFILM Wako Pure Chemical Corporation | 047-18863 | |
| Dimethyl sulfoxide (DMSO) | FUJIFILM Wako Pure Chemical Corporation | 047-29353 | |
| Donkey anti-Goat IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Thermo Fisher Scientific | A-11055 | |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 546 | Thermo Fisher Scientific | A10036 | |
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Thermo Fisher Scientific | A-21206 | |
| Falcon 5 mL Round Bottom Polystyrene Test Tube, with Cell Strainer Snap Cap | Corning | 352235 | |
| Fetal Bovine Serum | Biowest | 51820-500 | |
| GlutaMAX Supplement | Thermo Fisher Scientific | 35050061 | Dipeptide L-Alanyl-L-Glutamine |
| Human/Mouse/Rat/Canine ALCAM/CD166 Antibody | R&D Systems | AF1172 | |
| Hydrocortisone 21-hemisuccinate sodium salt | Sigma-Aldrich | H2270 | |
| iMatrix-511 silk | Nippi | 892021 | |
| ImmunoBlock | KAC | CTKN001 | Blocking solution |
| ITS-G Supplement(×100) | FUJIFILM Wako Pure Chemical Corporation | 090-06741 | |
| Leibovitz's L-15 Medium | FUJIFILM Wako Pure Chemical Corporation | 128-06075 | |
| N-Hexanoic-Try-Ile-(6)-amino Hexanoic amide (Dihexa) | Toronto Research Chemicals | H293745 | |
| Polyclonal Rabbit Anti-Human Albumin | Dako | A0001 | |
| Polyoxyethylene Sorbitan Monolaurate (Tween 20) | NACALAI TESQUE, INC. | 28353-85 | |
| RPMI-1640 | FUJIFILM Wako Pure Chemical Corporation | 189-02025 | |
| Sodium L-Ascorbate | NACALAI TESQUE, INC. | 03422-32 | |
| StemFit AK02N | REPROCELL | RCAK02N | |
| TBS (10x) | NACALAI TESQUE, INC. | 12748-31 | |
| Tetramethylrhodamine, methyl ester (TMRM) | Thermo Fisher Scientific | T668 | |
| Triton X-100 | NACALAI TESQUE, INC. | 28229-25 | |
| Trypan Blue Solution | NACALAI TESQUE, INC. | 20577-34 | |
| TRYPSIN 250 | Difco | 215240 | |
| Tryptose phosphate broth solution | Sigma-Aldrich | T8159 |
Ссылки
- Yamamoto, T., et al. Differentiation potential of pluripotent stem cells correlates to the level of CHD7. Scientific Reports. 8 (1), 241 (2018).
- Laco, F., et al. Unraveling the inconsistencies of cardiac differentiation efficiency induced by the GSK3β inhibitor CHIR99021 in human pluripotent stem cells. Stem Cell Reports. 10 (6), 1851-1866 (2018).
- Anderson, N. C., et al. Balancing serendipity and reproducibility: Pluripotent stem cells as experimental systems for intellectual and developmental disorders. Stem Cell Reports. 16 (6), 1446-1457 (2021).
- Chen, C. X. -. Q., et al. Standardized quality control workflow to evaluate the reproducibility and differentiation potential of human iPSCs into neurons. bioRxiv. , (2021).
- Duinsbergen, D., Salvatori, D., Eriksson, M., Mikkers, H. Tumors originating from induced pluripotent stem cells and methods for their prevention. Annals of the New York Academy of Sciences. 1176, 197-204 (2009).
- Nori, S., et al. Long-term safety issues of iPSC-based cell therapy in a spinal cord injury model: oncogenic transformation with epithelial-mesenchymal transition. Stem Cell Reports. 4 (3), 360-373 (2015).
- Hentze, H., et al. Teratoma formation by human embryonic stem cells: evaluation of essential parameters for future safety studies. Stem Cell Research. 2 (3), 198-210 (2009).
- Anderson, D., et al. Transgenic enrichment of cardiomyocytes from human embryonic stem cells. Molecular Therapy. 15 (11), 2027-2036 (2007).
- Hidaka, K., et al. Chamber-specific differentiation of Nkx2.5-positive cardiac precursor cells from murine embryonic stem cells. The FASEB Journal. 17 (6), 740-742 (2003).
- Gassanov, N., Er, F., Zagidullin, N., Hoppe, U. C. Endothelin induces differentiation of ANP-EGFP expressing embryonic stem cells towards a pacemaker phenotype. The FASEB Journal. 18 (14), 1710-1712 (2004).
- Duan, Y., et al. Differentiation and enrichment of hepatocyte-like cells from human embryonic stem cells in vitro and in vivo. Stem Cells. 25 (12), 3058-3068 (2007).
- Takayama, K., et al. Enrichment of high-functioning human iPS cell-derived hepatocyte-like cells for pharmaceutical research. Biomaterials. 161, 24-32 (2018).
- Hattori, F., et al. Nongenetic method for purifying stem cell-derived cardiomyocytes. Nature methods. 7, 61-66 (2009).
- Yamashita, H., Fukuda, K., Hattori, F. Hepatocyte-like cells derived from human pluripotent stem cells can be enriched by a combination of mitochondrial content and activated leukocyte cell adhesion molecule. JMA Journal. 2 (2), 174-183 (2019).
- Fernandez-Vizarra, E., Enríquez, J., Pérez-Martos, A., Montoya, J., Fernández-Silva, P. Tissue-specific differences in mitochondrial activity and biogenesis. Mitochondrion. 11, 207-213 (2010).
- Swart, G. W. M. Activated leukocyte cell adhesion molecule (CD166/ALCAM): Developmental and mechanistic aspects of cell clustering and cell migration. European Journal of Cell Biology. 81 (6), 313-321 (2002).
- Peters, D. T., et al. Asialoglycoprotein receptor 1 is a specific cell-surface marker for isolating hepatocytes derived from human pluripotent stem cells. Development. 143 (9), 1475-1481 (2016).
- Kamiya, A., Inagaki, Y. Stem and progenitor cell systems in liver development and regeneration. Hepatology Research. 45 (1), 29-37 (2015).
- Yanagida, A., Ito, K., Chikada, H., Nakauchi, H., Kamiya, A. An In vitro expansion system for generation of human ips cell-derived hepatic progenitor-like cells exhibiting a bipotent differentiation potential. PLOS One. 8 (7), e67541 (2013).
- Siller, R., Greenhough, S., Naumovska, E., Sullivan, G. J. Small-molecule-driven hepatocyte differentiation of human pluripotent stem cells. Stem Cell Reports. 4 (5), 939-952 (2015).
- Hirata, H., et al. ALCAM (CD166) is a surface marker for early murine cardiomyocytes. Cells, Tissues, Organs. 184 (3-4), 172-180 (2006).
- Tohyama, S., et al. Distinct metabolic flow enables large-scale purification of mouse and human pluripotent stem cell-derived cardiomyocytes. Cell Stem Cell. 12 (1), 127-137 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены