Method Article
ヒト人工多能性幹細胞由来肝細胞の精製のための細胞選別における生ミトコンドリア染色の応用
要約
多能性幹細胞に由来する肝細胞は、ミトコンドリアと活性化白血球細胞接着分子(ALCAM、CD166)染色の組み合わせを使用して、細胞選別によって精製できます。
要約
ヒト胚性幹細胞(ES)細胞や人工多能性幹細胞(iPS細胞)は、その無限の増殖性と多能性により、重篤な臓器の治療に応用できる可能性が期待されています。しかし、ヒトES/iPS細胞を100%純粋な標的細胞に分化させることは、環境に対する感度が高いため困難です。移植後の腫瘍形成は、汚染された細胞、増殖する細胞、未分化細胞によって引き起こされるため、再生医療を安全に実現するためには、高精製技術が不可欠です。腫瘍形成のリスクを軽減するために、ヒトiPS細胞由来肝細胞を対象とした高精製技術が開発されました。この方法は、高ミトコンドリア含有量と細胞表面マーカーALCAM(活性化白血球接着分子)を遺伝子組み換えなしで組み合わせたFACS(蛍光活性化細胞ソーティング)を採用しています。この方法を用いて精製された肝細胞の97%±0.38%(n = 5)は、アルブミンタンパク質の発現を示した。本稿では、ヒトiPS細胞の肝細胞への最新の二次元分化法に適用された、この方法の詳細な手順を提供することを目的としています。
概要
胚性幹細胞と人工多能性幹細胞(ESおよびiPS細胞)は、再生治療の有望な細胞源と考えられています。しかし、これらの細胞を特定の標的細胞型に分化する効率は、同じ細胞株、プロトコール、および実験者1,2,3,4を使用する場合でも、異なる可能性があります。このばらつきは、ヒトES/iPS細胞の環境に対する感度が高いことに起因していると考えられます。そのため、純粋な標的細胞を安定して得ることは現状では困難です。安全性の高い再生医療を実現するためには、治療用細胞から増殖細胞や未分化幹細胞を排除することが重要であり、標的細胞の高度な精製技術が不可欠である5,6,7。
セルソーターは、個々の細胞を瞬時に解析し、蛍光シグナルの強度に基づいて目的の生細胞を選別する装置で、有望なソリューションを提供します。これは、細胞タイプ特異的な表面マーカーの抗体染色、または細胞タイプ特異的なレポーター遺伝子発現を利用することで達成できます。この技術を用いて、多能性幹細胞由来心筋細胞8,9,10および肝細胞11,12を精製する方法について、いくつかの報告があります。服部らは、セルソーターを用いた革新的なミトコンドリア精製法を開発した13。心筋細胞はミトコンドリアの活性を通じて高いエネルギー需要を持つという事実を利用して、生きたミトコンドリア指標色素TMRM(テトラメチルローダミンメチルエステル)で細胞を染色するために使用できます。これにより、さまざまな細胞タイプを含むヒトES細胞由来胚様体からFACSによる心筋細胞を標識し、高度に精製することができます。腫瘍原性の欠如は、精製された心筋細胞を用いた奇形腫形成アッセイによって確認されました。さらに、山下らは、ミトコンドリア活性が高くALCAM陽性発現を持つ画分を単離することにより、ヒトES細胞由来胚様体から肝細胞を精製する方法を思いがけず発見しました14。この方法の理論的根拠は、肝細胞は、栄養代謝および解毒のためのATPの大量消費のために、比較的多くのミトコンドリアも有しており15、肝細胞は免疫グロブリンスーパーファミリーのメンバーであるALCAMを発現し、これは細胞接着および移動16に役割を果たすというものである。
従来の多能性幹細胞由来肝細胞の高度に精製する方法は遺伝子改変が必要であり、非遺伝的精製法は効率が低かった17。ミトコンドリアの非遺伝的法は、高純度を達成するメリットがあります。肝前駆細胞が必要な場合、CD133およびCD13またはDlk1ベースの方法18,19を選択することができる。ゲノム編集技術の精度は向上していますが、予期せぬゲノム変化(発がんなど)の潜在的なリスクを完全に排除することはできません。ミトコンドリアの活性に基づく方法は、遺伝子組み換えを伴わず、そのようなリスクから解放されることができます。
新生児ラット心筋細胞における種々のミトコンドリア指標を調べた結果、TMRMは24時間以内に完全に消失することが観察されたが、他の色素は少なくとも5日間は残った13。さらに、TMRMおよびJC-1は、3-(4,5-ジメチル-チアゾール-2-イル)-2,5-ジフェニルテトラゾリウムブロマイド(MTT)アッセイで評価した場合、細胞生存率に影響を与えなかったが、他の色素は細胞生存率に対して異なる効果を示したことに注意することが重要です13。TMRMはより高い安全性を示します。
これまでに、3次元(3D)胚様体形成と比較して、より効率的な分化誘導方法として、いくつかの2次元(2D)分化法が開発されてきました。これは、段階的な分化誘導化合物またはサイトカインを、3D空間ではなく2D平面上の細胞に均一に投与できるためです。本研究では、先に報告された方法20 を改変し、ヒトiPS細胞由来肝細胞への分化を誘導した。ここでは、ヒトiPS細胞由来の肝細胞を最新の2次元分化・精製する手順について詳しく説明します。
プロトコル
本研究では、市販のヒトiPS細胞(253G1系統)を使用しました( 材料表参照)。
1. ヒトiPS細胞のメンテナンス
- 0.25 μg/cm2 iMatrix-511 をコーティングした培養皿に、AK02 培地でヒト iPS 細胞をフィーダーフリー状態で保持します ( 材料表を参照)。
2. 2D培養におけるヒトiPS細胞の肝臓分化
注:肝臓分化の毎日のスケジュールについては、 図1A を参照してください。.プロセス全体を通して、6ウェル培養プレートを使用し、指定された洗浄液または培地2 mLを各ウェルに加えます。細胞培養条件を湿度100%、CO25%、O20 %、37°Cで維持します。
- 6ウェルプレートの各ウェルに1 mLの基底膜マトリックス(PBS(-)で1/25に希釈)をコーティングし、37°Cで1時間インキュベートします。
- 10 μM ROCK阻害剤(Y-27632)を添加したAK02N培地を使用して、20,000〜30,000細胞/cm²の密度でヒトiPS細胞をコーティング皿に継代します( 材料の表を参照)。翌日、Y-27632を含まない培地を交換し、さらに2日間培養します。
- 細胞をRPMI-1640培地で一度洗浄します。培地をRPMI-B27-Glu(RPMI-1640 + 2% B27インスリン + 1% ジペプチドL-アラニル-L-グルタミン)に交換し、3-6 μM CHIR-99021および100 ng/mLアクチビンAを24時間補充することにより、内胚葉の分化を開始します( 材料の表を参照)。
- 培地をRPMI-B27-Gluに50 ng/mLのアクチビンAを添加したものを24時間交換します。
- 肝臓前駆細胞の分化を誘導するには、培地を RPMI-B27-Glu に 1% ジメチルスルホキシド (DMSO) を 5 日間補充して交換します。
- 肝細胞の成熟を促進するには、肝細胞成熟培地に切り替えます:10 μMヒドロコルチゾン21-ヘミスコハク酸、8.3%トリプトースリン酸ブロス、100 nMデキサメタゾン(DEX)、50 μg/mLナトリウム-L-アスコルビン酸、0.58%インスリン-トランスフェリン-セレン(ITS)、8.3%ウシ胎児血清(FBS)、2 mMジペプチドL-アラニル-L-グルタミン、および100 nM N-ヘキサノ-トライ-イル-(6)-アミノヘキサノアミド(ジヘキサ)を含むLeibovitzのL-15培地( 材料の表を参照)。
- 20日間、2日ごとに媒体を交換します。分化開始から約27日後に細胞を選別します。
3. ヒトiPS細胞由来肝細胞の精製のための細胞調製
- 肝臓分化細胞をウェルあたり2 mLのPBS(-)で洗浄します。
- 0.1% コラゲナーゼ、0.083% トリプシン、10 μM ROCK 阻害剤 (Y-27632)、20 nM シクロスポリン A、および 50 μg/mL の S-L-アスコルビン酸ナトリウムを含む 1 ウェルあたり 1 mL の酵素溶液を Ads バッファー (116 mM NaCl、12.5 mM NaH2PO4、20 mM HEPES、5.4 mM KCl、5.6 mM グルコース、および 0.8 mM MgSO4、pH 7.35) に添加します ( 材料の表を参照)。37°Cで約2時間水平に回転させて、細胞をプレートから分離します。
- 顕微鏡で細胞が剥離し、丸みを帯びていることを確認した後、穏やかなピペッティングで単一細胞に分散させ、50mLのチューブに回収します。
- 細胞を200 x g で5分間、18°Cで遠心分離し、ペレット化します。吸引器を使用して上清を取り除きます。
- 100 nM TMRM(テトラメチルローダミン、メトルエステル)を含む5 mLの肝細胞成熟培地に細胞を分散させることにより、細胞のミトコンドリアを染色します( 材料の表を参照)。37°Cで30分間インキュベートし、アルミホイルで包んで光から保護します。
- 細胞を200 x g で5分間、18°Cで遠心分離し、ペレット化します。上清を取り除きます。
- 2% FBSを含む1〜5mLの冷たいAdsバッファーで細胞を再懸濁します。
- 0.4%トリパンブルー溶液とセルカウントプレートを使用してセル数をカウントします。
- 細胞を200 x g で5分間、4°Cで遠心分離し、ペレット化します。上清を取り除きます。
- 抗ALCAM抗体(一次抗体、 材料表参照)をAdsバッファー中で1:50の比率で希釈し、希釈した抗体を106細胞あたり 100 μL加えます。細胞を氷上で50分間染色します。一次抗体で染色されていない細胞をネガティブコントロールとして調製します。
- 2%FBSを含む冷たいAdsバッファーで細胞を2回洗浄します。
- Alexa Fluor 488 donkey anti-goat IgG (secondary antibody, see Table of Materials) を Ads バッファーで 1:100 の比率で希釈し、希釈した抗体を 10 個6 細胞あたり 100 μL 加えます。細胞を氷上で30分間染色します。一次抗体で染色しなかった細胞を二次抗体で染色します。
- 2%FBSを含む冷たいAdsバッファーで細胞を2回洗浄します。
- 細胞をAdsバッファーに再懸濁し、スナップキャップセルストレーナー(35 μmメッシュ)でろ過し、FACSで選別して大きな細胞塊や破片を除去します。
4. ヒトiPS細胞由来肝細胞のFACS解析と選別
- 製造元の指示に従って、細胞選別用にFACSマシンをセットアップします( 材料の表を参照)。
注:85μmまたは100μmのノズルサイズと、肝細胞用のNDフィルター2.0を使用してください。ALCAM の Alexa Flour 488 の検出には FITC チャンネルを、ミトコンドリアの TMRM 蛍光の検出には PE チャンネルを使用します。 - FSC(前方散乱)およびSSC(側方散乱)電圧を調整して、細胞集団を適切に視覚化します。
- FITCおよびPE蛍光チャンネルの電圧を調整します。標識されていない細胞から開始し、細胞集団を各チャネルプロットの下部の中央に配置します。ラベル付けされたセルがプロット内に適切に配置されていることを確認します。
- ダブレットを排除するための一般的なゲーティング戦略を使用する: 主要なFSC-A と.SSC-A母集団(図2A)、続いてFSC-H と。-W、次にSSC-H 対。-W (図 2B、C)。
- TMRMhi および ALCAM+ 集団 ( 図 2E の P2) をゲートして、肝細胞を選別します。TMRMhi と ALCAM- の集団 ( 図 2E の P1) をゲートして、非肝細胞を選別します。選別した肝細胞と非肝細胞を、肝細胞成熟培地が入った15 mLの採取チューブに集めます。
- 選別した細胞を含むコレクションチューブを200 x g で18°Cで5分間遠心分離します。
- 上清を除去し、細胞を肝細胞成熟培地に再懸濁します。
- マイトマイシンC処理マウス胚性線維芽細胞(MEF)またはゲル状基底膜マトリックスに、10 μM Y-27632および20 nMシクロスポリンAを添加した肝細胞成熟培地で細胞を播種し、37°CのCO2 インキュベーターで細胞を5日間培養します。
5. ヒトiPS細胞由来肝細胞の検出のための免疫細胞化学
- 培養した細胞をPBS(-)で選別後、5日間洗浄します。
- 細胞を4%パラホルムアルデヒドで室温で5分間固定します。
- TBS-Tバッファー(1x TBS、1% Tween 20)で細胞を2回洗浄し、パラホルムアルデヒドを除去します。
- 細胞を0.1% Triton X-100希釈TBS-Tバッファーと室温で5分間インキュベートします。
- 細胞をTBS-Tバッファーで2回洗浄し、Triton X-100を除去します。
- 市販のブロッキング溶液( 材料表を参照)を細胞に室温で30分間加えます。
- アルブミン(肝細胞マーカー)およびヒト核抗原(hNA、 材料表を参照)に対する一次抗体を、ブロッキング溶液で1:50に希釈して添加します。
- 細胞を4°Cで一晩インキュベートします。細胞をTBS-Tバッファーで2回洗浄します。
- 二次抗体を添加する:Alexa Fluor 488ロバ抗ウサギIgGおよびAlexa Fluor 546ロバ抗マウスIgGをブロッキング溶液で1:100に希釈してください( 材料の表を参照)。
- 細胞を室温で30分間インキュベートします。細胞をTBS-Tバッファーで2回洗浄します。
- 蛍光顕微鏡でアルブミン陽性細胞とhNA陽性細胞をカウントすることにより、肝細胞の純度を評価します。P1 集団と P2 集団の両方について、hNA 陽性細胞あたりのアルブミン陽性細胞の割合を計算します。
結果
ヒトiPS細胞が2D培養によって肝細胞に分化する過程(図1A)と代表的な細胞特徴(図1B)の時系列を示します。分化12日目頃、細胞は肝細胞の特徴である多角形の細胞形状と丸い核を示し始めました。一部の肝細胞も多核形成を示しました。
FACS解析は、分化27日目に細胞を用いて行った。ALCAM+ 集団を同定するために、最初の抗ALCAM抗体がある場合とない場合の比較プロットをそれぞれ 図2D、Eに示します。2D培養による肝臓分化の誘導により、この実験では肝細胞の集団(P2)が10.1%であることが判明し、3D胚様体形成法で得られた0.8%(データは示さず)から大幅に増加しました。
選別したP1細胞とP2細胞をマイトマイシンCで処理したマウス胚性線維芽細胞で培養したところ、P2細胞は緻密な球状のコロニー形成を示したのに対し、P1細胞は分散してより平坦な形態を示した。ヒト核抗原(hNA)およびアルブミンの免疫組織化学的染色により、 図3に示すように、P2における肝細胞様細胞の濃縮が確認されました。P1細胞およびP2細胞における肝細胞の純度を評価するために、アルブミン陽性細胞とhNA陽性細胞の比率を計算しました(n = 5)。その結果、P1細胞の0%、P2細胞の97%±0.38%がヒトiPS細胞に由来し、肝細胞様の特徴を示すことが明らかになりました(図3)。
FACS実験中に肝細胞の選別が成功したことを確認するために、ASGR1を異なる蛍光色素と結合したその特異的抗体と共染色し、P2にASGR1陽性細胞が含まれていることを確認することをお勧めします。
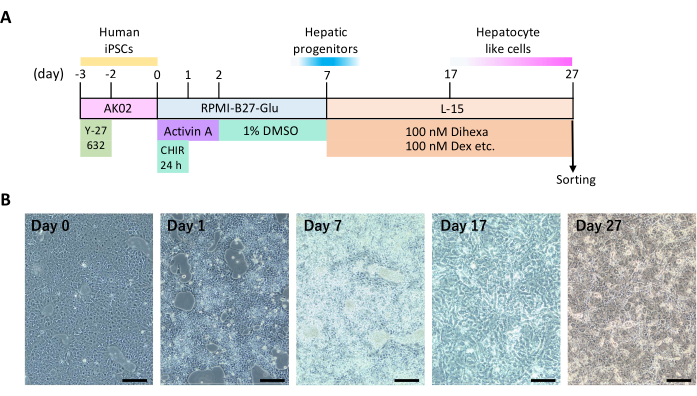
図1:ヒトiPS細胞の2D肝臓分化 (A)肝臓分化のタイムライン。この図は、Yamashita et al.14 から引用しています。(B)肝臓分化中の形態学的変化。スケールバー = 200 μm. この図の拡大版を表示するには、ここをクリックしてください。

図2:肝分化細胞における肝細胞と非肝細胞の選別のためのゲーティング戦略(27日目) (A)FSC-A を用いた標的細胞集団のゲーティング vs.SSC-Aプロット。(B)ステップ(A)からFSC-HとFSC-H を使用してゲート人口を拡大する。FSC-Wは、ダブレットセルをプロットし、除外します。(C)ステップ(B)からSSC-H対SSC-H を使用してゲート人口をさらに拡大します。SSC-W プロットとダブレットセルの除外。(D)および(E)ステップ(C)からFITC-A(ALCAM )を使用してゲート人口を拡大する vs.PE-A (TMRM) プロット。(D)TMRMと2番目の 抗体で細胞を染色。(E)TMRMおよび1st および2nd 抗体で染色した細胞。 この図の拡大版を表示するには、ここをクリックしてください。
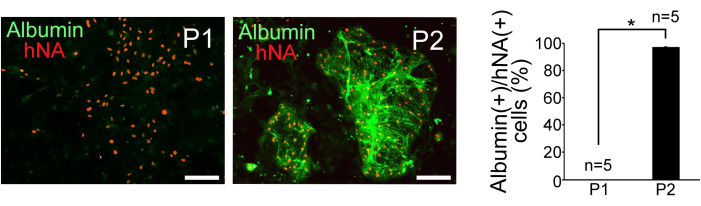
図3:免疫組織化学の結果。 選別されたP1およびP2細胞におけるアルブミンおよびヒト核抗原(hNA)の免疫組織化学的検出、およびhNA(+)細胞におけるアルブミン(+)細胞分画の定量。スケールバー = 100 μm。データは平均±標準偏差(SD)(n = 5)で表されます。統計分析は、スチューデントの t検定を使用して行われました。※P <0.05です。この図は、Yamashita et al.14 から引用しています。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
肝細胞は、栄養素の代謝と解毒におけるそれらの機能のために、他の細胞タイプと比較して比較的多くのミトコンドリアを持っています15。ALCAMは免疫グロブリンスーパーファミリーの一員であり、細胞の接着と遊走に役割を果たします。それは、肝臓細胞、上皮細胞、リンパ球細胞、骨髄細胞、線維芽細胞、およびニューロン細胞16を含む様々な細胞タイプで発現される。ミトコンドリアを用いた方法とALCAM抗体の組み合わせにより、ヒトiPS細胞由来肝細胞の同定に成功しました。
精製した肝細胞の分泌機能や酵素活性を特徴づけるアッセイは行わなかったが、精製したヒトiPS細胞由来肝細胞におけるCYP3A4遺伝子のmRNA発現を確認した。さらに、ヒトES細胞由来の胚様体から単離されたTMRM(高)およびALCAM(+)を有する肝細胞集団では、ES細胞由来心筋細胞と比較して、肝細胞関連遺伝子セット(VTN、 SERPINA1、 CYP1A1、 FGB、 FGA、 FGG、 AFP、 ALB、および APOB)の発現が高かった14。
このプロトコールの重要なステップは、TMRM染色のためのミトコンドリア活性の保存を確保しながら、最小限の損傷で2D肝臓分化細胞を培養皿から穏やかに分離することです。分化の状態によっては、肝細胞は酵素処理を行っても皿からの剥離に対して抵抗性を示すことがありますが、この課題は0.25 mM EDTAを添加することで効果的に対処できます。
FACS による 肝細胞の精製のための既存の方法には、肝細胞発現遺伝子に特異的なプロモーターの下流にレポーター遺伝子を導入することが含まれます。しかし、このアプローチには、遺伝子組み換えに伴う副作用の潜在的なリスクが伴います。一方、ミトコンドリア法はそのような懸念を排除します。成体または胎児の肝幹細胞/前駆細胞のいくつかの細胞表面マーカーが同定されており18、ヒト多能性幹細胞に由来する肝前駆細胞は、CD13+CD133+集団19を用いて選別することができる。一方、多能性幹細胞由来肝細胞のうち、肝細胞に特異的な唯一の細胞表面マーカーであるASGR1(asialoglycoprotein receptor 1)抗体17を用いて、成熟した肝細胞のごく一部を選別することができた。ミトコンドリア陽性率とALCAM陽性率が高い細胞集団には、CD13+CD133+細胞とASGR1+細胞でマークされた集団の両方が含まれていることが実証されました。このことは、高ミトコンドリアおよびALCAM陽性集団が、さまざまな成熟度を持つ広範囲の肝細胞を含んでいる可能性があることを示唆している14。したがって、この方法により、肝細胞集団の損失をほとんどなく精製できる可能性があります。
この方法を用いて胚14.5のマウス胎児の全内臓を解析したところ、筋細胞と肝細胞の両方でALCAMが発現していることが明らかになった14。他の先行研究では、マウス心筋前駆細胞におけるALCAMの発現が報告されている21。ヒト多能性幹細胞由来細胞の場合、ALCAM陰性集団で心筋細胞が同定されました。これらのデータは、心筋および肝臓系統におけるALCAMの発現が、種および細胞の成熟段階によって異なることを示しています。しかし、心筋細胞は肝細胞に比べてミトコンドリア分率が高いため、マウス全胚由来の混合細胞からでもFACSにより2つの細胞型を分離することに成功しました。このことから、提案手法は他の動物種の肝細胞や心筋細胞の精製に有用である可能性が示唆されています。
本稿で紹介する肝細胞精製技術は、ヒトiPS細胞由来肝細胞の移植に伴う潜在的な腫瘍形成リスクを緩和し、再生医療の分野を発展させる上で重要な役割を果たすことが期待されています。しかし、この技術によって精製された肝細胞集団における奇形腫形成能の否定は行われていません。安全性確保のためのさらなる研究を行う必要があります。
肝細胞のような大きくて接着した細胞は、FACSソーティング中の機械的損傷に対して非常に脆弱であり、その結果、生細胞が大幅に失われます。臨床応用のためには、心筋細胞の精製のための乳酸法22のように、肝細胞のみの生存を可能にする培養環境を確立する新しい精製法の開発が不可欠である。
開示事項
著者は何も開示していません。
謝辞
本研究は、文部科学省補助金番号[23390072]の支援を受けて行われました。
資料
| Name | Company | Catalog Number | Comments |
| 253G1 human iPS cell line | RIKEN BioResource Research Center | HPS0002 | |
| 4% paraformaldehyde | FUJIFILM Wako Pure Chemical Corporation | 163-20145 | |
| Activin A Solution, Human, Recombinant | NACALAI TESQUE, INC. | 18585 | |
| Anti-Nuclei Antibody, clone 235-1 | Chemicon | MAB1281 | Antibody against human nuclear antigen |
| B-27 Supplement (50x), serum free | Thermo Fisher Scientific | 17504044 | |
| BD FACSAria III | BD Biosciences | Cell sorter | |
| CHIR-99021 | MedChemExpress | HY-10182 | |
| Ciclosporin A | FUJIFILM Wako Pure Chemical Corporation | 035-18961 | |
| Collagenase | FUJIFILM Wako Pure Chemical Corporation | 034-22363 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | Corning | 354230 | Gel-like basement membrane matrix |
| CultureSure Y-27632 | FUJIFILM Wako Pure Chemical Corporation | 036-24023 | ROCK inhibitor |
| Dexamethasone | FUJIFILM Wako Pure Chemical Corporation | 047-18863 | |
| Dimethyl sulfoxide (DMSO) | FUJIFILM Wako Pure Chemical Corporation | 047-29353 | |
| Donkey anti-Goat IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Thermo Fisher Scientific | A-11055 | |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 546 | Thermo Fisher Scientific | A10036 | |
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Thermo Fisher Scientific | A-21206 | |
| Falcon 5 mL Round Bottom Polystyrene Test Tube, with Cell Strainer Snap Cap | Corning | 352235 | |
| Fetal Bovine Serum | Biowest | 51820-500 | |
| GlutaMAX Supplement | Thermo Fisher Scientific | 35050061 | Dipeptide L-Alanyl-L-Glutamine |
| Human/Mouse/Rat/Canine ALCAM/CD166 Antibody | R&D Systems | AF1172 | |
| Hydrocortisone 21-hemisuccinate sodium salt | Sigma-Aldrich | H2270 | |
| iMatrix-511 silk | Nippi | 892021 | |
| ImmunoBlock | KAC | CTKN001 | Blocking solution |
| ITS-G Supplement(×100) | FUJIFILM Wako Pure Chemical Corporation | 090-06741 | |
| Leibovitz's L-15 Medium | FUJIFILM Wako Pure Chemical Corporation | 128-06075 | |
| N-Hexanoic-Try-Ile-(6)-amino Hexanoic amide (Dihexa) | Toronto Research Chemicals | H293745 | |
| Polyclonal Rabbit Anti-Human Albumin | Dako | A0001 | |
| Polyoxyethylene Sorbitan Monolaurate (Tween 20) | NACALAI TESQUE, INC. | 28353-85 | |
| RPMI-1640 | FUJIFILM Wako Pure Chemical Corporation | 189-02025 | |
| Sodium L-Ascorbate | NACALAI TESQUE, INC. | 03422-32 | |
| StemFit AK02N | REPROCELL | RCAK02N | |
| TBS (10x) | NACALAI TESQUE, INC. | 12748-31 | |
| Tetramethylrhodamine, methyl ester (TMRM) | Thermo Fisher Scientific | T668 | |
| Triton X-100 | NACALAI TESQUE, INC. | 28229-25 | |
| Trypan Blue Solution | NACALAI TESQUE, INC. | 20577-34 | |
| TRYPSIN 250 | Difco | 215240 | |
| Tryptose phosphate broth solution | Sigma-Aldrich | T8159 |
参考文献
- Yamamoto, T., et al. Differentiation potential of pluripotent stem cells correlates to the level of CHD7. Scientific Reports. 8 (1), 241 (2018).
- Laco, F., et al. Unraveling the inconsistencies of cardiac differentiation efficiency induced by the GSK3β inhibitor CHIR99021 in human pluripotent stem cells. Stem Cell Reports. 10 (6), 1851-1866 (2018).
- Anderson, N. C., et al. Balancing serendipity and reproducibility: Pluripotent stem cells as experimental systems for intellectual and developmental disorders. Stem Cell Reports. 16 (6), 1446-1457 (2021).
- Chen, C. X. -. Q., et al. Standardized quality control workflow to evaluate the reproducibility and differentiation potential of human iPSCs into neurons. bioRxiv. , (2021).
- Duinsbergen, D., Salvatori, D., Eriksson, M., Mikkers, H. Tumors originating from induced pluripotent stem cells and methods for their prevention. Annals of the New York Academy of Sciences. 1176, 197-204 (2009).
- Nori, S., et al. Long-term safety issues of iPSC-based cell therapy in a spinal cord injury model: oncogenic transformation with epithelial-mesenchymal transition. Stem Cell Reports. 4 (3), 360-373 (2015).
- Hentze, H., et al. Teratoma formation by human embryonic stem cells: evaluation of essential parameters for future safety studies. Stem Cell Research. 2 (3), 198-210 (2009).
- Anderson, D., et al. Transgenic enrichment of cardiomyocytes from human embryonic stem cells. Molecular Therapy. 15 (11), 2027-2036 (2007).
- Hidaka, K., et al. Chamber-specific differentiation of Nkx2.5-positive cardiac precursor cells from murine embryonic stem cells. The FASEB Journal. 17 (6), 740-742 (2003).
- Gassanov, N., Er, F., Zagidullin, N., Hoppe, U. C. Endothelin induces differentiation of ANP-EGFP expressing embryonic stem cells towards a pacemaker phenotype. The FASEB Journal. 18 (14), 1710-1712 (2004).
- Duan, Y., et al. Differentiation and enrichment of hepatocyte-like cells from human embryonic stem cells in vitro and in vivo. Stem Cells. 25 (12), 3058-3068 (2007).
- Takayama, K., et al. Enrichment of high-functioning human iPS cell-derived hepatocyte-like cells for pharmaceutical research. Biomaterials. 161, 24-32 (2018).
- Hattori, F., et al. Nongenetic method for purifying stem cell-derived cardiomyocytes. Nature methods. 7, 61-66 (2009).
- Yamashita, H., Fukuda, K., Hattori, F. Hepatocyte-like cells derived from human pluripotent stem cells can be enriched by a combination of mitochondrial content and activated leukocyte cell adhesion molecule. JMA Journal. 2 (2), 174-183 (2019).
- Fernandez-Vizarra, E., Enríquez, J., Pérez-Martos, A., Montoya, J., Fernández-Silva, P. Tissue-specific differences in mitochondrial activity and biogenesis. Mitochondrion. 11, 207-213 (2010).
- Swart, G. W. M. Activated leukocyte cell adhesion molecule (CD166/ALCAM): Developmental and mechanistic aspects of cell clustering and cell migration. European Journal of Cell Biology. 81 (6), 313-321 (2002).
- Peters, D. T., et al. Asialoglycoprotein receptor 1 is a specific cell-surface marker for isolating hepatocytes derived from human pluripotent stem cells. Development. 143 (9), 1475-1481 (2016).
- Kamiya, A., Inagaki, Y. Stem and progenitor cell systems in liver development and regeneration. Hepatology Research. 45 (1), 29-37 (2015).
- Yanagida, A., Ito, K., Chikada, H., Nakauchi, H., Kamiya, A. An In vitro expansion system for generation of human ips cell-derived hepatic progenitor-like cells exhibiting a bipotent differentiation potential. PLOS One. 8 (7), e67541 (2013).
- Siller, R., Greenhough, S., Naumovska, E., Sullivan, G. J. Small-molecule-driven hepatocyte differentiation of human pluripotent stem cells. Stem Cell Reports. 4 (5), 939-952 (2015).
- Hirata, H., et al. ALCAM (CD166) is a surface marker for early murine cardiomyocytes. Cells, Tissues, Organs. 184 (3-4), 172-180 (2006).
- Tohyama, S., et al. Distinct metabolic flow enables large-scale purification of mouse and human pluripotent stem cell-derived cardiomyocytes. Cell Stem Cell. 12 (1), 127-137 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved