Method Article
יישום צביעת מיטוכונדריה חיה במיון תאים לטיהור הפטוציטים שמקורם בתאי גזע פלוריפוטנטיים המושרים על ידי בני אדם
In This Article
Summary
ניתן לטהר הפטוציטים שמקורם בתאי גזע פלוריפוטנטיים באמצעות מיון תאים, באמצעות שילוב של צביעת מולקולת הידבקות תאי לויקוציטים מיטוכונדריאלית ופעילה (ALCAM, הידועה גם בשם CD166).
Abstract
לתאי גזע עובריים אנושיים (ES) ולתאי גזע פלוריפוטנטיים מושרים (iPS) יש יישומים פוטנציאליים ברפואה רגנרטיבית מבוססת תאים לטיפול באיברים חולים קשה בשל ההתרבות הבלתי מוגבלת שלהם ותכונותיהם הפלוריפוטנטיות. עם זאת, התמיינות תאי ES/iPS אנושיים לסוגי תאי מטרה טהורים ב-100% היא מאתגרת בשל רגישותם הגבוהה לסביבה. גידולים לאחר ההשתלה נגרמים על ידי תאים מזוהמים, מתרבים ובלתי ממוינים, מה שהופך את טכנולוגיית הטיהור הגבוהה לחיונית למימוש בטוח של רפואה רגנרטיבית. כדי להפחית את הסיכון לגידולים, פותחה טכנולוגיית טיהור גבוהה עבור הפטוציטים שמקורם בתאי iPS אנושיים. השיטה משתמשת ב-FACS (מיון תאים המופעל על ידי פלואורסצנטיות) באמצעות שילוב של תכולת מיטוכונדריה גבוהה וסמן פני התא ALCAM (מולקולת היצמדות תאי לויקוציטים פעילים) ללא שינוי גנטי. 97% ± 0.38% (n = 5) מהפטוציטים המטוהרים בשיטה זו הציגו ביטוי חלבון אלבומין. מאמר זה נועד לספק נהלים מפורטים עבור שיטה זו, כפי שהיא מיושמת בשיטת ההתמיינות הדו-ממדית העדכנית ביותר עבור תאי iPS אנושיים להפטוציטים.
Introduction
תאי גזע עובריים ופלוריפוטנטיים מושרים (ES ו- iPS, בהתאמה) נחשבים למקורות תאים מבטיחים לטיפולים רגנרטיביים. עם זאת, היעילות של התמיינות תאים אלה לסוגי תאי יעד ספציפיים יכולה להשתנות, גם כאשר משתמשים באותו קו תאים, פרוטוקול ונסיין 1,2,3,4. ניתן לייחס שונות זו לרגישות הגבוהה של תאי ES/iPS אנושיים לסביבתם. לכן, כיום קשה להשיג באופן עקבי תאי מטרה טהורים. כדי להשיג רפואה רגנרטיבית בטוחה ביותר, חיוני לחסל תאים מתרבים ותאי גזע לא ממוינים בתאים טיפוליים, וטכנולוגיית טיהור מתקדמת לתאי מטרה חיונית 5,6,7.
ממיין תאים הוא מכשיר המנתח באופן מיידי תאים בודדים וממיין תאים חיים בעלי עניין בהתבסס על עוצמות האות הפלואורסצנטי, ומציע פתרון מבטיח. ניתן להשיג זאת באמצעות צביעת נוגדנים של סמנים ספציפיים לסוג התא או על ידי שימוש בביטויי גנים ספציפיים לסוג התא. באמצעות טכניקה זו, ישנם מספר דיווחים על שיטות לטיהור קרדיומיוציטים שמקורם בתאי גזע פלוריפוטנטיים 8,9,10 והפטוציטים11,12. Hattori et al. פיתחו שיטת טיהור מיטוכונדריאלית חדשנית באמצעות ממיין תאים13. תוך ניצול העובדה שלקרדיומיוציטים יש דרישות אנרגיה גבוהות באמצעות פעילות מיטוכונדריאלית, ניתן להשתמש בצביעת התאים בצבע המיטוכונדריה החי TMRM (טטרמתילרודאמין מתיל אסטר) כדי לתייג ולטהר מאוד קרדיומיוציטים על ידי FACS מגופי עוברים אנושיים שמקורם בתאי ES המכילים סוגי תאים שונים. היעדר הגידול אושר על ידי בדיקות היווצרות טרטומה עם קרדיומיוציטים מטוהרים. יתר על כן, ימאשיטה ועמיתיו גילו באופן בלתי צפוי שיטה לטיהור הפטוציטים מגופי עובר אנושיים שמקורם בתאי ES על ידי בידוד שברים בעלי פעילות מיטוכונדריאלית גבוהה וביטוי חיובי ALCAM14. הרציונל לשיטה זו הוא שלהפטוציטים יש גם מספר גבוה יחסית של מיטוכונדריה בשל הצריכה הגבוהה של ATP למטבוליזם תזונתי וניקוי רעלים15, והפטוציטים מבטאים ALCAM, חבר במשפחת האימונוגלובולינים, הממלא תפקיד בהידבקות תאים ונדידת16.
שיטות טיהור גבוהות קודמות עבור הפטוציטים שמקורם בתאי גזע פלוריפוטנטיים דרשו שינויים גנטיים, ושיטות טיהור לא גנטיות היו בעלות יעילות נמוכה17. השיטה המיטוכונדריאלית הלא גנטית היא בעלת ערך להשגת טוהר גבוה. כאשר יש צורך בתאי אב בכבד, ניתן לבחור בשיטות מבוססות CD133 ו- CD13 או Dlk118,19. למרות שהדיוק של טכנולוגיית עריכת הגנום התקדם, לא ניתן לבטל לחלוטין את הסיכון הפוטנציאלי לשינויים גנומיים בלתי צפויים (למשל, קרצינוגנזה). שיטות המבוססות על פעילות מיטוכונדריאלית, ללא שינוי גנטי, יכולות להיות חופשיות מסיכונים כאלה.
כתוצאה מבדיקת אינדיקטורים מיטוכונדריאליים שונים בקרדיומיוציטים של חולדות יילודים, TMRM נצפה נעלם לחלוטין תוך 24 שעות, בעוד שצבעים אחרים נשארו לפחות 5 ימים13. יתר על כן, חשוב לציין כי TMRM ו- JC-1 לא השפיעו על כדאיות התא כאשר הוערכו עם בדיקת 3-(4,5-dimethyl-thiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT), בעוד שצבעים אחרים הדגימו השפעות שונות על כדאיות התא13. TMRM מדגים בטיחות גבוהה יותר.
עד כה, פותחו מספר שיטות התמיינות דו-ממדיות (דו-ממדיות) כגישות יעילות יותר לגרימת התמיינות בהשוואה ליצירת גוף עוברי תלת-ממדי (תלת-ממדי). הסיבה לכך היא שתרכובות או ציטוקינים הגורמים להתמיינות באופן הדרגתי יכולים להינתן באופן אחיד לתאים במישור דו-ממדי, ולא במרחב תלת-ממדי. במחקר זה, שיטה20 שדווחה בעבר שונתה כדי לגרום להתמיינות לתאי iPS אנושיים. כאן מתוארים פרטי ההליכים להתמיינות וטיהור דו-ממדיים עדכניים של הפטוציטים שמקורם בתאי iPS אנושיים.
Protocol
במחקר זה נעשה שימוש בתאי iPS אנושיים שהושגו באופן מסחרי (זן 253G1) (ראו טבלת חומרים).
1. תחזוקה של תאי iPS אנושיים
- שמור על תאי iPS אנושיים בתנאים נטולי הזנה בתווך AK02 על צלחות תרבית מצופות 0.25 מיקרוגרם/ס"מ2 iMatrix-511 (ראה טבלת חומרים).
2. התמיינות בכבד של תאי iPS אנושיים בתרביות דו-ממדיות
הערה: עיין באיור 1A עבור לוח הזמנים היומי של התמיינות הכבד. לאורך כל התהליך השתמשו בצלחות תרבית של 6 בארות והוסיפו 2 מ"ל של מדיום השטיפה או התרבית הייעודי לכל באר. שמור על מצב תרבית התאים ב 100% לחות, 5% CO2, ו 20% O2 ב 37 ° C.
- מצפים כל באר של צלחת 6 בארות עם 1 מ"ל של מטריצת קרום מרתף (מדולל 1/25 PBS (-)), ודגרים ב 37 ° C במשך 1 שעה.
- מעבר תאי iPS אנושיים לצלחת המצופה בצפיפות של 20,000-30,000 תאים לסמ"ר באמצעות מדיום AK02N בתוספת מעכב ROCK של 10 מיקרומטר (Y-27632) (ראה טבלת חומרים). החליפו את המדיום ללא Y-27632 למחרת ואת התרבית למשך יומיים נוספים.
- לשטוף את התאים פעם אחת עם RPMI-1640 בינוני. התחל התמיינות אנדודרם על ידי החלפת המדיום עם RPMI-B27-Glu (RPMI-1640 + 2% B27 אינסולין + 1% דיפפטיד L-Alanyl-L-גלוטמין) בתוספת 3-6 מיקרומטר CHIR-99021 ו 100 ng / mL Activin A במשך 24 שעות (ראה טבלה של חומרים).
- החלף את המדיום עם RPMI-B27-Glu בתוספת 50 ng/mL Activin A למשך 24 שעות.
- כדי לגרום להבדיל אב כבד, להחליף את המדיום עם RPMI-B27-Glu בתוספת 1% dimethyl sulfoxide (DMSO) במשך 5 ימים.
- כדי לקדם את הבשלת הכבד, עבור למדיום הבשלת הפטוציטים: מדיום L-15 של לייבוביץ' המכיל 10 מיקרומטר הידרוקורטיזון 21-המיסוקצינאט, 8.3% מרק טריפטוז פוספט, 100 ננומטר דקסמתזון (DEX), 50 מיקרוגרם/מ"ל נתרן-L-אסקורבט, 0.58% אינסולין-טרנספרין-סלניום (ITS), 8.3% סרום בקר עוברי (FBS), 2 מילימטר דיפפטיד L-Alanyl-L-גלוטמין, ו-100 ננומטר N-הקסנואית-נסה-איל-איל-(6)-אמינו הקסנואית אמיד (Dihexa) (ראה טבלת חומרים).
- שנה את המדיום כל יומיים במשך 20 יום. מיין את התאים כ -27 ימים לאחר תחילת ההתמיינות.
3. הכנת תאים לטיהור הפטוציטים שמקורם בתאי iPS אנושיים
- לשטוף תאים ממוינים בכבד עם 2 מ"ל PBS (-) לכל באר.
- הוסף תמיסת אנזים 1 מ"ל לכל באר, הכוללת 0.1% collagenase, 0.083% טריפסין, 10 μM מעכב ROCK (Y-27632), 20 ננומטר ciclosporin A ו- 50 μg/mL נתרן-L-אסקורבט במאגר המודעות (116 mM NaCl, 12.5 mM NaH2PO4, 20 mM HEPES, 5.4 mM KCl, 5.6 mM גלוקוז ו- 0.8 mM MgSO4; pH 7.35) (ראה טבלת חומרים). נתק תאים מהלוחות על ידי סיבוב אופקי ב 37 ° C במשך כ 2 שעות.
- לאחר אישור כי התאים מנותקים ומעוגלים תחת מיקרוסקופ, לפזר אותם לתאים בודדים על ידי pipetting עדין, ולאסוף אותם בצינור 50 מ"ל.
- תאי צנטריפוגה ב 200 x גרם במשך 5 דקות ב 18 ° C כדי pellet אותם. הסר את supernatant באמצעות אספירטור.
- לצבוע את המיטוכונדריה של התאים על ידי פיזורם ב 5 מ"ל של מדיום הבשלת הפטוציטים המכיל 100 ננומטר TMRM (tetramethylrhodamine, אסטר מתל) (ראה טבלת חומרים). יש לדגור במשך 30 דקות בטמפרטורה של 37°C תוך הגנה מפני אור על ידי עטיפה ברדיד אלומיניום.
- צנטריפוגה את התאים ב 200 x גרם במשך 5 דקות ב 18 ° C כדי pellet אותם. הסר את supernatant.
- השהה מחדש את התאים עם 1-5 מ"ל של מאגר מודעות קר המכיל 2% FBS.
- ספור את מספר התא באמצעות תמיסה כחולה טריפאן 0.4% ולוח ספירת תאים.
- צנטריפוגה את התאים ב 200 x גרם במשך 5 דקות ב 4 ° C כדי pellet אותם. הסר את supernatant.
- לדלל נוגדן anti-ALCAM (נוגדן ראשוני, ראה טבלת חומרים) ביחס של 1:50 במאגר מודעות, ולהוסיף 100 μL של הנוגדן המדולל לכל 106 תאים. מכתימים את התאים למשך 50 דקות על קרח. הכינו תאים שאינם מוכתמים בנוגדן הראשוני כבקרה שלילית.
- שטפו את התאים עם מאגר מודעות קר המכיל 2% FBS פעמיים.
- יש לדלל חמור מסוג Alexa Fluor 488 Anti-Goat IgG (נוגדן משני, ראה טבלת חומרים) ביחס של 1:100 במאגר מודעות, ולהוסיף 100 μL של הנוגדן המדולל לכל 106 תאים. מכתימים את התאים למשך 30 דקות על קרח. תאי צביעה שלא הוכתמו בנוגדן הראשוני באמצעות הנוגדן המשני.
- שטפו את התאים עם מאגר מודעות קר המכיל 2% FBS פעמיים.
- השעה מחדש את התאים במאגר המודעות וסנן אותם דרך מסננת תאי מכסה הצמדה (רשת שינוי של 35 מיקרומטר) ממש לפני מיון לפי FACS כדי להסיר גושי תאים גדולים ולכלוך.
4. ניתוח FACS ומיון של תאי iPS אנושיים שמקורם בהפטוציטים
- הגדר את התקן FACS למיון תאים בהתאם להוראות היצרן (ראה טבלת חומרים).
הערה: השתמש בגודל זרבובית של 85 מיקרומטר או 100 מיקרומטר ובמסנן ND של 2.0 עבור הפטוציטים. השתמש בערוץ FITC לזיהוי קמח אלקסה 488 עבור ALCAM ובערוץ PE לזיהוי פלואורסצנטיות TMRM עבור מיטוכונדריה. - כוונן את מתחי FSC (פיזור קדימה) ו- SSC (פיזור צד) כדי להמחיש כראוי את אוכלוסיית התא.
- התאם את המתחים של התעלות הפלואורסצנטיות FITC ו- PE. התחל עם תאים ללא תווית ומרכז את אוכלוסיית התאים בתחתית כל תרשים ערוץ. ודא שהתאים המסומנים מסומנים ממוקמים כראוי בתוך התווייה.
- השתמש באסטרטגיית gating נפוצה כדי למנוע כפילויות: שער FSC-A העיקרי לעומת אוכלוסיית SSC-A (איור 2A), ואחריה אוכלוסיית FSC-H לעומת -W, ולאחר מכן SSC-H לעומת . -W (איור 2B,C).
- שער את אוכלוסיית TMRMhi ו-ALCAM+ (P2 באיור 2E) כדי למיין הפטוציטים. שער את אוכלוסיית TMRMhi ו- ALCAM (P1 באיור 2E) כדי למיין שאינם הפטוציטים. לאסוף hepatocytes ממוין non-hepatocytes ב 15 מ"ל צינורות איסוף המכילים hepatocyte התבגרות בינוני.
- צנטריפוגה צינור האיסוף המכיל את התאים ממוינים ב 200 x גרם במשך 5 דקות ב 18 ° C.
- הסר את supernatant ו resuspend את התאים במדיום התבגרות hepatocyte.
- זרעו את התאים על פיברובלסטים עובריים של עכברים (MEFs) שטופלו במיטומיצין C או מטריצת קרום מרתף דמוית ג'ל עם מדיום הבשלת הפטוציטים בתוספת 10 מיקרומטר Y-27632 ו-20 ננומטר ציקלוספורין A. תרבית את התאים באינקובטור CO2 של 37 מעלות צלזיוס למשך 5 ימים.
5. אימונוציטוכימיה לאיתור הפטוציטים שמקורם בתאי iPS אנושיים
- לשטוף את התאים בתרבית במשך 5 ימים לאחר מיון עם PBS (-).
- תקן את התאים עם 4% paraformaldehyde במשך 5 דקות בטמפרטורת החדר.
- שטפו את התאים עם חיץ TBS-T (1x TBS עם 1% Tween 20) פעמיים כדי להסיר את הפרפורמלדהיד.
- יש לדגור על התאים עם חיץ TBS-T מדולל של 0.1% Triton X-100 למשך 5 דקות בטמפרטורת החדר.
- שטפו את התאים עם חיץ TBS-T פעמיים כדי להסיר את Triton X-100.
- הוסף פתרון חסימה זמין מסחרית (ראה טבלת חומרים) לתאים למשך 30 דקות בטמפרטורת החדר.
- הוסף נוגדנים ראשוניים נגד אלבומין (סמן הפטוציטים) ואנטיגן גרעיני אנושי (hNA, ראה טבלת חומרים), מדולל 1:50 בתמיסת חסימה.
- לדגור על התאים ב 4 ° C במשך הלילה. שטפו את התאים עם מאגר TBS-T פעמיים.
- הוסף נוגדנים משניים: Alexa Fluor 488 חמור נגד ארנב IgG ו- Alexa Fluor 546 חמור נגד עכבר IgG, מדולל 1:100 בתמיסת חסימה (ראה טבלת חומרים).
- דוגרים על התאים בטמפרטורת החדר למשך 30 דקות. שטפו את התאים עם מאגר TBS-T פעמיים.
- הערך את טוהר הכבד על ידי ספירת תאים חיוביים לאלבומין ו- hNA חיוביים תחת מיקרוסקופ פלואורסצנטי. חשב את אחוז התאים החיוביים לאלבומין לכל תא חיובי ל-hNA עבור אוכלוסיות P1 ו-P2.
תוצאות
ציר הזמן של התהליכים שגורמים לתאי iPS אנושיים להתמיין להפטוציטים באמצעות תרבית דו-ממדית (איור 1A) ותכונות תאים מייצגות (איור 1B) מוצגים. בערך ביום ההתמיינות ה-12 החלו התאים להציג צורות תאים מצולעים וגרעינים עגולים, האופייניים להפטוציטים. חלק מהפטוציטים הציגו גם ריבוי גרעינים.
ניתוח FACS בוצע באמצעות התאים ביום ההתמיינות 27. כדי לזהות את אוכלוסיית ALCAM+, תרשימים השוואתיים עם ובלי נוגדן האנטי-ALCAM הראשון מוצגים באיור 2D,E, בהתאמה. גרימת התמיינות כבד באמצעות תרבית דו-ממדית, אוכלוסיית הפטוציטים (P2) נמצאה 10.1% בניסוי זה, המייצג עלייה משמעותית מ-0.8% (נתונים לא מוצגים) שנמצאו בשיטת היווצרות הגוף העוברי התלת-ממדי.
תאי P1 ו-P2 שמוינו גודלו בתרבית על פיברובלסטים עובריים של עכברים שטופלו במיטומיצין C. תאי P2 הציגו היווצרות מושבה קומפקטית וכדורית, ואילו תאי P1 פוזרו והיו בעלי מורפולוגיה שטוחה יותר. צביעה אימונוהיסטוכימית עבור אנטיגן גרעיני אנושי (hNA) ואלבומין אישרה את העשרת התאים דמויי הפטוציטים ב-P2, כפי שמתואר באיור 3. כדי להעריך את טוהר הפטוציטים בתאי P1 ו-P2, חושב היחס בין תאים חיוביים לאלבומין לתאים חיוביים ל-hNA חיוביים (n = 5). התוצאות גילו ש-0% מתאי P1 ו-97% ±-0.38% מתאי P2 נגזרו מתאי גזע פלוריפוטנטיים מושרים אנושיים והציגו מאפיינים דמויי הפטוציטים (איור 3).
כדי לאשר את המיון המוצלח של הפטוציטים במהלך ניסוי FACS, מומלץ להכתים יחד את ASGR1 עם הנוגדן הספציפי שלו מצומד עם פלואורופורים שונים ולאשר כי P2 מכיל תאים חיוביים ASGR1.
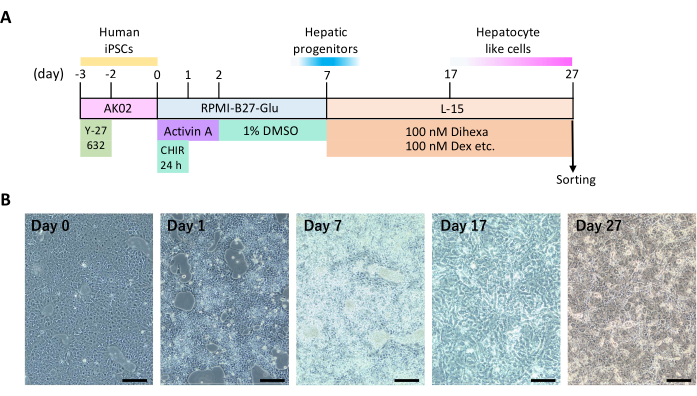
איור 1: התמיינות דו-ממדית בכבד של תאי גזע פלוריפוטנטיים מושרים אנושיים. (A) ציר הזמן להתמיינות בכבד. איור זה נלקח מ Yamashita et al.14. (B) שינויים מורפולוגיים במהלך התמיינות הכבד. פסי קנה מידה = 200 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: אסטרטגיית Gating למיון הפטוציטים והלא-הפטוציטים בתאים ממוינים בכבד (יום 27). (A) גטינג אוכלוסיית תאי היעד באמצעות FSC-A לעומת עלילת SSC-A. (ב) הרחבת האוכלוסייה המגודרת משלב (A) באמצעות FSC-H לעומת . FSC-W מתווה ולא כולל תאים כפולים. (ג) הרחבה נוספת של האוכלוסייה המגודרת משלב (B) באמצעות SSC-H לעומת . התוויית SSC-W ואי הכללת תאים כפולים. (D) ו-(E) הרחבת האוכלוסייה המגודרת משלב (C) באמצעות FITC-A (ALCAM) לעומת . עלילת PE-A (TMRM). (D) תאים מוכתמים עם TMRM והנוגדןהשני. (E) תאים מוכתמים עם TMRM ונוגדנים 1ו-2. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
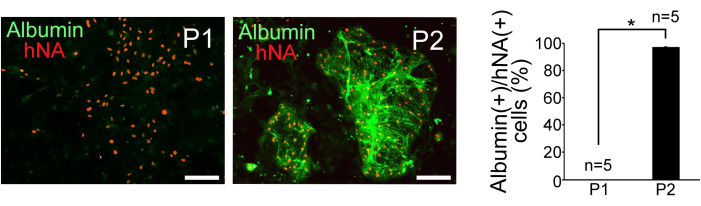
איור 3: תוצאות אימונוהיסטוכימיה. זיהוי אימונוהיסטוכימי של אלבומין ואנטיגן גרעיני אנושי (hNA) בתאי P1 ו-P2 ממוינים, וכימות של שבר תאים אלבומין (+) בתאי hNA (+). פסי קנה מידה = 100 מיקרומטר. הנתונים מיוצגים כממוצע ± סטיית תקן (SD) (n = 5). הניתוח הסטטיסטי נערך באמצעות מבחן t של התלמיד. *P < 0.05. איור זה נלקח מ Yamashita et al.14. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
בשל תפקודם במטבוליזם של חומרי מזון וניקוי רעלים, לפטוציטים יש מספר גדול יחסית של מיטוכונדריה בהשוואה לסוגי תאים אחרים15. ALCAM הוא חבר במשפחת האימונוגלובולינים וממלא תפקיד בהידבקות תאים ובנדידה. הוא מתבטא בסוגי תאים שונים, כולל כבד, אפיתל, לימפוציטים, מיאלואידים, פיברובלסטים ותאי עצב16. על ידי שימוש בשילוב של השיטה המבוססת על מיטוכונדריה ונוגדן ALCAM, זוהו בהצלחה הפטוציטים שמקורם בתאי iPS אנושיים.
בעוד שהבדיקות לאפיון תפקוד ההפרשה או פעילות האנזים של הפטוציטים המטוהרים לא בוצעו, ביטוי mRNA של הגן CYP3A4 בהפטוציטים שמקורם בתאי iPS אנושיים שטוהרו אומתו. יתר על כן, אוכלוסיית הפטוציטים עם TMRM (גבוה) ו- ALCAM (+) שבודדו מגופי עוברים שמקורם בתאי ES אנושיים, שנצפו ביטויים גבוהים יותר של קבוצות גנים הקשורות לכבד (VTN, SERPINA1, CYP1A1, FGB, FGA, FGG, AFP, ALB ו- APOB) בהשוואה לקרדיומיוציטים שמקורם בתאי ES14.
צעד קריטי במסגרת הפרוטוקול הוא לנתק בעדינות תאים ממוינים דו-ממדיים בכבד מצלחות התרבית עם נזק מינימלי תוך הבטחת שימור הפעילות המיטוכונדריאלית לצביעת TMRM. בהתאם למצב ההתמיינות, הפטוציטים עשויים להפגין עמידות לניתוק מהמנה אפילו עם טיפול אנזים, אתגר שניתן לטפל בו ביעילות על ידי תוספת של 0.25 mM EDTA.
שיטות קיימות לטיהור הפטוציטים באמצעות FACS כרוכות בהחדרת גנים מדווחים במורד הזרם של מקדמים ספציפיים לגנים המבוטאים בהפטוציטים. עם זאת, גישה זו נושאת את הסיכון הפוטנציאלי של תופעות לוואי הקשורות לשינויים גנטיים. השיטה המיטוכונדריאלית, לעומת זאת, מבטלת חששות כאלה. זוהו מספר סמנים של פני השטח של תאי גזע / אב של כבד בוגר או עוברי18, וניתן היה למיין תאי אב כבדיים שמקורם בתאי גזע פלוריפוטנטיים אנושיים באמצעות אוכלוסיית CD13+CD133+19. מצד שני, בין הפטוציטים שמקורם בתאי גזע פלוריפוטנטים, חלק קטן מהפטוציטים הבשלים יכולים להיות ממוינים באמצעות נוגדן ASGR1 (קולטן אסיאלוגליקוביץ 1)17, שהוא סמן פני התא היחיד הספציפי להפטוציטים. הוכח כי אוכלוסיית התאים המפגינים חיוביות גבוהה במיטוכונדריה וב- ALCAM הכילה את שתי האוכלוסיות המסומנות בתאי CD13+CD133+ ותאי ASGR1+. זה מצביע על כך שאוכלוסיות מיטוכונדריאליות וחיוביות ALCAM גבוהות עשויות להכיל מגוון רחב של הפטוציטים עם בשלות שונות14. כתוצאה מכך, שיטה זו עשויה לאפשר טיהור של אוכלוסיית hepatocyte עם אובדן קטן.
ניתוח הקרביים השלמים של העובר בעכבר ביום העוברי 14.5 בשיטה זו גילה את הביטוי של ALCAM הן במיוציטים והן בהפטוציטים14. מחקרים קודמים אחרים דיווחו על ביטוי ALCAM בתאי אב שריר הלב21. במקרה של תאים שמקורם בתאי גזע פלוריפוטנטיים אנושיים, הקרדיומיוציטים זוהו באוכלוסייה שלילית של ALCAM. נתונים אלה מראים כי ביטוי ALCAM בשושלות לב וכבד משתנה בהתאם הן למין והן לשלבי הבשלות התא. עם זאת, בשל החלק המיטוכונדריאלי הגבוה יותר בקרדיומיוציטים בהשוואה להפטוציטים, הצליח למעשה להפריד את שני סוגי התאים על ידי FACS אפילו מתאים מעורבים שמקורם בעובר השלם של העכבר. זה מצביע על כך שהשיטה המוצעת יכולה להיות שימושית לטיהור הפטוציטים וקרדיומיוציטים ממיני בעלי חיים אחרים.
טכנולוגיית טיהור הכבד המתוארת כאן צפויה למלא תפקיד מרכזי בקידום תחום הרפואה הרגנרטיבית על ידי הפחתת הסיכון הפוטנציאלי להיווצרות גידולים הקשורים להשתלת הפטוציטים שמקורם בתאי iPS אנושיים. עם זאת, שלילה של יכולת יצירת טרטומה באוכלוסיית הפטוציטים שטוהרה בטכניקה זו לא נעשתה. יש לבצע מחקרים נוספים להבטחת בטיחות.
תאים גדולים ודבקים כגון הפטוציטים פגיעים מאוד לנזק מכני במהלך מיון FACS, וכתוצאה מכך אובדן משמעותי של תאים ברי קיימא. עבור יישומים קליניים, חיוני לפתח שיטת טיהור חדשה הקובעת סביבת תרבית המאפשרת הישרדות של hepatocytes אך ורק כגון שיטת לקטט לטיהור cardiomyocyte22.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי משרד החינוך, התרבות, הספורט, המדע והטכנולוגיה מספר מענק [23390072].
Materials
| Name | Company | Catalog Number | Comments |
| 253G1 human iPS cell line | RIKEN BioResource Research Center | HPS0002 | |
| 4% paraformaldehyde | FUJIFILM Wako Pure Chemical Corporation | 163-20145 | |
| Activin A Solution, Human, Recombinant | NACALAI TESQUE, INC. | 18585 | |
| Anti-Nuclei Antibody, clone 235-1 | Chemicon | MAB1281 | Antibody against human nuclear antigen |
| B-27 Supplement (50x), serum free | Thermo Fisher Scientific | 17504044 | |
| BD FACSAria III | BD Biosciences | Cell sorter | |
| CHIR-99021 | MedChemExpress | HY-10182 | |
| Ciclosporin A | FUJIFILM Wako Pure Chemical Corporation | 035-18961 | |
| Collagenase | FUJIFILM Wako Pure Chemical Corporation | 034-22363 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | Corning | 354230 | Gel-like basement membrane matrix |
| CultureSure Y-27632 | FUJIFILM Wako Pure Chemical Corporation | 036-24023 | ROCK inhibitor |
| Dexamethasone | FUJIFILM Wako Pure Chemical Corporation | 047-18863 | |
| Dimethyl sulfoxide (DMSO) | FUJIFILM Wako Pure Chemical Corporation | 047-29353 | |
| Donkey anti-Goat IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Thermo Fisher Scientific | A-11055 | |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 546 | Thermo Fisher Scientific | A10036 | |
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Thermo Fisher Scientific | A-21206 | |
| Falcon 5 mL Round Bottom Polystyrene Test Tube, with Cell Strainer Snap Cap | Corning | 352235 | |
| Fetal Bovine Serum | Biowest | 51820-500 | |
| GlutaMAX Supplement | Thermo Fisher Scientific | 35050061 | Dipeptide L-Alanyl-L-Glutamine |
| Human/Mouse/Rat/Canine ALCAM/CD166 Antibody | R&D Systems | AF1172 | |
| Hydrocortisone 21-hemisuccinate sodium salt | Sigma-Aldrich | H2270 | |
| iMatrix-511 silk | Nippi | 892021 | |
| ImmunoBlock | KAC | CTKN001 | Blocking solution |
| ITS-G Supplement(×100) | FUJIFILM Wako Pure Chemical Corporation | 090-06741 | |
| Leibovitz's L-15 Medium | FUJIFILM Wako Pure Chemical Corporation | 128-06075 | |
| N-Hexanoic-Try-Ile-(6)-amino Hexanoic amide (Dihexa) | Toronto Research Chemicals | H293745 | |
| Polyclonal Rabbit Anti-Human Albumin | Dako | A0001 | |
| Polyoxyethylene Sorbitan Monolaurate (Tween 20) | NACALAI TESQUE, INC. | 28353-85 | |
| RPMI-1640 | FUJIFILM Wako Pure Chemical Corporation | 189-02025 | |
| Sodium L-Ascorbate | NACALAI TESQUE, INC. | 03422-32 | |
| StemFit AK02N | REPROCELL | RCAK02N | |
| TBS (10x) | NACALAI TESQUE, INC. | 12748-31 | |
| Tetramethylrhodamine, methyl ester (TMRM) | Thermo Fisher Scientific | T668 | |
| Triton X-100 | NACALAI TESQUE, INC. | 28229-25 | |
| Trypan Blue Solution | NACALAI TESQUE, INC. | 20577-34 | |
| TRYPSIN 250 | Difco | 215240 | |
| Tryptose phosphate broth solution | Sigma-Aldrich | T8159 |
References
- Yamamoto, T., et al. Differentiation potential of pluripotent stem cells correlates to the level of CHD7. Scientific Reports. 8 (1), 241(2018).
- Laco, F., et al. Unraveling the inconsistencies of cardiac differentiation efficiency induced by the GSK3β inhibitor CHIR99021 in human pluripotent stem cells. Stem Cell Reports. 10 (6), 1851-1866 (2018).
- Anderson, N. C., et al. Balancing serendipity and reproducibility: Pluripotent stem cells as experimental systems for intellectual and developmental disorders. Stem Cell Reports. 16 (6), 1446-1457 (2021).
- Chen, C. X. -Q., et al. Standardized quality control workflow to evaluate the reproducibility and differentiation potential of human iPSCs into neurons. bioRxiv. , (2021).
- Duinsbergen, D., Salvatori, D., Eriksson, M., Mikkers, H. Tumors originating from induced pluripotent stem cells and methods for their prevention. Annals of the New York Academy of Sciences. 1176, 197-204 (2009).
- Nori, S., et al. Long-term safety issues of iPSC-based cell therapy in a spinal cord injury model: oncogenic transformation with epithelial-mesenchymal transition. Stem Cell Reports. 4 (3), 360-373 (2015).
- Hentze, H., et al. Teratoma formation by human embryonic stem cells: evaluation of essential parameters for future safety studies. Stem Cell Research. 2 (3), 198-210 (2009).
- Anderson, D., et al. Transgenic enrichment of cardiomyocytes from human embryonic stem cells. Molecular Therapy. 15 (11), 2027-2036 (2007).
- Hidaka, K., et al. Chamber-specific differentiation of Nkx2.5-positive cardiac precursor cells from murine embryonic stem cells. The FASEB Journal. 17 (6), 740-742 (2003).
- Gassanov, N., Er, F., Zagidullin, N., Hoppe, U. C. Endothelin induces differentiation of ANP-EGFP expressing embryonic stem cells towards a pacemaker phenotype. The FASEB Journal. 18 (14), 1710-1712 (2004).
- Duan, Y., et al. Differentiation and enrichment of hepatocyte-like cells from human embryonic stem cells in vitro and in vivo. Stem Cells. 25 (12), 3058-3068 (2007).
- Takayama, K., et al. Enrichment of high-functioning human iPS cell-derived hepatocyte-like cells for pharmaceutical research. Biomaterials. 161, 24-32 (2018).
- Hattori, F., et al. Nongenetic method for purifying stem cell-derived cardiomyocytes. Nature methods. 7, 61-66 (2009).
- Yamashita, H., Fukuda, K., Hattori, F. Hepatocyte-like cells derived from human pluripotent stem cells can be enriched by a combination of mitochondrial content and activated leukocyte cell adhesion molecule. JMA Journal. 2 (2), 174-183 (2019).
- Fernandez-Vizarra, E., Enríquez, J., Pérez-Martos, A., Montoya, J., Fernández-Silva, P. Tissue-specific differences in mitochondrial activity and biogenesis. Mitochondrion. 11, 207-213 (2010).
- Swart, G. W. M. Activated leukocyte cell adhesion molecule (CD166/ALCAM): Developmental and mechanistic aspects of cell clustering and cell migration. European Journal of Cell Biology. 81 (6), 313-321 (2002).
- Peters, D. T., et al. Asialoglycoprotein receptor 1 is a specific cell-surface marker for isolating hepatocytes derived from human pluripotent stem cells. Development. 143 (9), Cambridge, England. 1475-1481 (2016).
- Kamiya, A., Inagaki, Y. Stem and progenitor cell systems in liver development and regeneration. Hepatology Research. 45 (1), 29-37 (2015).
- Yanagida, A., Ito, K., Chikada, H., Nakauchi, H., Kamiya, A. An In vitro expansion system for generation of human ips cell-derived hepatic progenitor-like cells exhibiting a bipotent differentiation potential. PLOS One. 8 (7), e67541(2013).
- Siller, R., Greenhough, S., Naumovska, E., Sullivan, G. J. Small-molecule-driven hepatocyte differentiation of human pluripotent stem cells. Stem Cell Reports. 4 (5), 939-952 (2015).
- Hirata, H., et al. ALCAM (CD166) is a surface marker for early murine cardiomyocytes. Cells, Tissues, Organs. 184 (3-4), 172-180 (2006).
- Tohyama, S., et al. Distinct metabolic flow enables large-scale purification of mouse and human pluripotent stem cell-derived cardiomyocytes. Cell Stem Cell. 12 (1), 127-137 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved