Method Article
인간 유도 만능 줄기 세포에서 유래한 간세포를 정제하기 위한 세포 분류에 살아있는 미토콘드리아 염색 적용
요약
만능 줄기 세포에서 유래한 간세포는 미토콘드리아 및 활성 백혈구 세포 접착 분자(ALCAM, CD166이라고도 함) 염색을 사용하여 세포 분류를 통해 정제할 수 있습니다.
초록
인간 배아 줄기(ES) 및 유도 만능 줄기(iPS) 세포는 무제한 증식 및 만능 특성으로 인해 심각하게 병든 장기를 치료하기 위한 세포 기반 재생 의학에 잠재적으로 응용될 수 있습니다. 그러나 인간 ES/iPS 세포를 100% 순수 표적 세포 유형으로 분화시키는 것은 환경에 대한 민감도가 높기 때문에 어렵습니다. 이식 후 종양 형성은 오염, 증식, 미분화 세포에 의해 발생하므로 재생 의학의 안전한 실현을 위해서는 고순도 기술이 필수적입니다. 종양 형성의 위험을 완화하기 위해 인간 iPS 세포 유래 간세포에 대한 고순도 기술이 개발되었습니다. 이 방법은 유전자 변형 없이 높은 미토콘드리아 함량과 세포 표면 마커 ALCAM(활성 백혈구 세포 접착 분자)의 조합을 사용하여 FACS(형광 활성화 세포 분류)를 사용합니다. 이 방법을 사용하여 정제된 간세포의 97% ± 0.38%(n=5)에서 알부민 단백질 발현을 나타냈다. 이 기사는 인간 iPS 세포를 간세포로 분화하는 가장 최근의 2차원 분화 방법에 적용되는 이 방법에 대한 자세한 절차를 제공하는 것을 목표로 합니다.
서문
배아 및 유도 만능 줄기 세포(각각 ES 및 iPS)는 재생 요법을 위한 유망한 세포 공급원으로 간주됩니다. 그러나, 이러한 세포를 특정 표적 세포 유형으로 분화하는 효율성은 동일한 세포주, 프로토콜 및 실험자 1,2,3,4를 사용하는 경우에도 다를 수 있습니다. 이러한 변동성은 인간 ES/iPS 세포가 환경에 민감하게 반응하기 때문일 수 있습니다. 따라서 현재로서는 순수한 타겟 세포를 지속적으로 획득하기 어렵습니다. 안전성이 높은 재생의학을 달성하기 위해서는 치료세포에서 증식세포와 미분화줄기세포를 제거하는 것이 중요하며, 표적세포에 대한 첨단 정제 기술이 필수적이다 5,6,7.
세포 분류기는 개별 세포를 즉시 분석하고 형광 신호 강도를 기반으로 관심 있는 활성 세포를 분류하는 장치로, 유망한 솔루션을 제공합니다. 이는 세포 유형별 표면 마커의 항체 염색을 통해 또는 세포 유형별 리포터 유전자 발현을 활용하여 달성할 수 있습니다. 이 기술을 사용하여 만능 줄기 세포 유래 심근 세포 8,9,10 및 간세포11,12를 정제하는 방법에 대한 여러 보고서가 있습니다. Hattori et al.은 세포 분류기13을 사용하여 혁신적인 미토콘드리아 정제 방법을 개발했습니다. 심근세포는 미토콘드리아 활동을 통해 많은 에너지를 필요로 한다는 사실을 이용하여 살아있는 미토콘드리아 표시 염료인 TMRM(테트라메틸로다민 메틸 에스테르)으로 세포를 염색하는 데 사용하여 다양한 세포 유형을 포함하는 인간 ES 세포 유래 배아체의 FACS로 심근세포를 라벨링하고 고도로 정제할 수 있습니다. 종양원성의 부재는 정제된 심근세포를 사용한 기형종 형성 분석에 의해 확인되었습니다. 또한, Yamashita 등은 미토콘드리아 활성이 높고 ALCAM 양성 발현이 가능한 분획을 분리하여 인간 ES 세포 유래 배아체에서 간세포를 정제하는 방법을 예기치 않게 발견했습니다14. 이 방법의 근거는 간세포는 영양 대사 및 해독을 위해 ATP를 많이 소비하기 때문에 상대적으로 많은 수의 미토콘드리아를 가지고 있으며15 간세포는 세포 접착 및 이동에 중요한 역할을 하는 면역글로불린 슈퍼패밀리의 구성원인 ALCAM을 발현한다는 것입니다16.
만능줄기세포 유래 간세포에 대한 이전의 고도의 정제 방법은 유전자 변형이 필요했고, 비유전자 정제 방법은 효율이 낮았다17. 미토콘드리아 비유전적 방법은 고순도를 달성하는 장점이 있습니다. 간 전구 세포가 필요한 경우, CD133 및 CD13 또는 Dlk1 기반 방법18,19를 선택할 수 있습니다. 게놈 편집 기술의 정확도가 향상되었지만, 예상치 못한 게놈 변화(예: 발암)의 잠재적 위험을 완전히 제거할 수는 없습니다. 유전자 변형을 포함하지 않고 미토콘드리아 활성에 기반한 방법은 이러한 위험에서 자유로울 수 있습니다.
신생아 쥐의 심근세포에서 다양한 미토콘드리아 지표를 조사한 결과, TMRM은 24시간 이내에 완전히 사라지는 것으로 관찰된 반면, 다른 염료는 최소 5일 동안 남아 있었다13. 또한, TMRM과 JC-1은 3-(4,5-dimethyl-thiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT) 분석으로 평가했을 때 세포 생존율에 영향을 미치지 않은 반면, 다른 염료는 세포 생존율에 다양한 영향을 미쳤다는 점에 유의해야 한다13. TMRM은 더 높은 안전성을 보여줍니다.
현재까지 여러 2차원(2D) 분화 방법이 3차원(3D) 배아 몸체 형성에 비해 분화를 유도하기 위한 보다 효율적인 접근법으로 개발되었습니다. 이는 단계적 분화 유도 화합물 또는 사이토카인을 3D 공간이 아닌 2D 평면의 세포에 균일하게 투여할 수 있기 때문입니다. 이 연구에서, 이전에 보고된 방법20 은 인간 iPS 세포 유래 간세포로의 분화를 유도하도록 수정되었다. 여기에서는 인간 iPS 세포에서 유래한 간세포의 최신 2D 분화 및 정제를 위한 절차에 대해 자세히 설명합니다.
프로토콜
이 연구는 상업적으로 획득한 인간 iPS 세포(253G1 균주)를 사용했습니다( 재료 표 참조).
1. 인간 iPS 세포의 유지
- 0.25 μg/cm2 iMatrix-511로 코팅된 배양 접시의 AK02 배지에서 인간 iPS 세포를 공급이 없는 상태로 유지합니다( 재료 표 참조).
2. 2D 배양에서 인간 iPS 세포의 간 분화
참고: 간 분화의 일일 일정에 대해서는 그림 1A 를 참조하십시오. 공정 전반에 걸쳐 6-웰 배양 플레이트를 사용하고 지정된 세척액 또는 배양 배지 2mL를 각 웰에 추가합니다. 37°C에서 100% 습도, 5%CO2 및 20%O2 에서 세포 배양 조건을 유지합니다.
- 6웰 플레이트의 각 웰에 1mL의 기저막 매트릭스(PBS(-)에서 1/25로 희석)를 코팅하고 37°C에서 1시간 동안 배양합니다.
- 10μM ROCK 억제제(Y-27632)가 보충된 AK02N 배지를 사용하여 20,000-30,000cells/cm²의 밀도로 인간 iPS 세포를 코팅된 접시에 통과시킵니다( 재료 표 참조). 다음 날 Y-27632를 넣지 않고 배지를 교체하고 추가로 2일 동안 배양합니다.
- RPMI-1640 배지로 세포를 한 번 세척합니다. 배지를 RPMI-B27-Glu(RPMI-1640 + 2% B27 인슐린 + 1% 디펩타이드 L-알라닐-L-글루타민)로 교체하고 3-6μM CHIR-99021 및 100ng/mL Activin A를 24시간 동안 보충하여 내배엽 분화를 시작합니다( 재료 표 참조).
- 배지를 24시간 동안 50ng/mL Activin A가 보충된 RPMI-B27-Glu로 교체합니다.
- 간 전구 세포 분화를 유도하기 위해 배지를 1% 디메틸 설폭사이드(DMSO)가 보충된 RPMI-B27-Glu로 5일 동안 교체합니다.
- 간세포 성숙을 촉진하기 위해 간세포 성숙 배지로 전환하십시오: 10μM 하이드로코르티손 21-헤미숙시네이트, 8.3% 트립토스 인산염 육수, 100nM 덱사메타손(DEX), 50μg/mL 나트륨-L-아스코르브산염, 0.58% 인슐린-트랜스페린-셀레늄(ITS), 8.3% 소 태아 혈청(FBS), 2mM 디펩타이드 L-알라닐-L-글루타민 및 100nM N-헥사노익-트라이-일-(6)-아미노 헥사노익 아미드(Dihexa)를 함유하는 Leibovitz의 L-15 배지( 재료 표 참조).
- 20일 동안 2일마다 매체를 교체합니다. 분화를 시작한 후 약 27일 후에 세포를 분류합니다.
3. 인간 iPS 세포 유래 간세포의 정제를 위한 세포 준비
- 웰당 2mL PBS(-)로 간 분화 세포를 세척합니다.
- 광고 완충액(116mM NaCl, 12.5mM NaH2PO4, 20mM HEPES, 5.4mM KCl, 5.6mM 포도당 5.8mM MgSO4, pH 7.35)에 0.1% 콜라겐아제, 0.083% 트립신, 10μM ROCK 억제제(Y-27632), 20nM 시클로스포린 A 및 50μg/mL 나트륨-L-아스코르브산염을 포함하는 웰당 1mL 효소 용액을 추가합니다(재료 표 참조). 37°C에서 약 2시간 동안 수평으로 회전하여 플레이트에서 셀을 분리합니다.
- 현미경으로 세포가 분리되어 둥글게 된 것을 확인한 후 부드러운 피펫팅으로 단세포로 분산시켜 50mL 튜브에 채취합니다.
- 18°C에서 5분 동안 200 x g 의 셀을 원심분리하여 펠릿화합니다. 흡입기를 사용하여 상층액을 제거합니다.
- 세포의 미토콘드리아를 100nM TMRM(테트라메틸로다민, 메틀 에스테르)을 함유하는 5mL의 간세포 성숙 배지에 분산시켜 염색합니다( 재료 표 참조). 37 °C에서 30 분 동안 배양하면서 알루미늄 호일로 싸서 빛으로부터 보호합니다.
- 200 x g 에서 18 °C에서 5 분 동안 세포를 원심 분리하여 펠릿화합니다. 상층액을 제거합니다.
- 2% FBS를 함유한 1-5mL의 콜드 광고 버퍼로 세포를 재현탁시킵니다.
- 0.4% 트리판 블루 용액과 세포 계수 플레이트를 사용하여 세포 수를 계산합니다.
- 세포를 200 x g 에서 4 °C에서 5 분 동안 원심 분리하여 펠릿화합니다. 상층액을 제거합니다.
- 항-ALCAM 항체(1차 항체, 재료 표 참조)를 광고 완충액에서 1:50 비율로 희석하고, 106 cells당 100 μL의 희석된 항체를 첨가한다. 얼음에서 50분 동안 세포를 염색합니다. 1차 항체로 염색되지 않은 세포를 음성 대조군으로 준비합니다.
- 2% FBS를 함유한 차가운 광고 버퍼로 세포를 두 번 세척합니다.
- 광고 완충액에서 Alexa Fluor 488 donkey anti-goat IgG(2차 항체, 재료 표 참조)를 1:100 비율로 희석하고 106 cells당 100 μL의 희석된 항체를 추가합니다. 얼음 위에서 30분 동안 세포를 염색합니다. 2차 항체를 사용하여 1차 항체로 염색되지 않은 세포를 염색합니다.
- 2% FBS를 함유한 차가운 광고 버퍼로 세포를 두 번 세척합니다.
- 광고 버퍼의 세포를 재현탁시키고 FACS로 분류하기 직전에 스냅 캡 세포 여과기(35μm 메쉬)를 통해 필터링하여 큰 세포 덩어리와 파편을 제거합니다.
4. 인간 iPS 세포 유래 간세포의 FACS 분석 및 분류
- 제조업체의 지침에 따라 셀 분류를 위해 FACS 기계를 설정합니다( 재료 표 참조).
참고: 간세포에는 85μm 또는 100μm 크기의 노즐과 2.0의 ND 필터를 사용하십시오. ALCAM에 대한 Alexa Flour 488을 감지하기 위해 FITC 채널을 사용하고 미토콘드리아에 대한 TMRM 형광을 감지하기 위해 PE 채널을 사용합니다. - FSC(순방향 산란) 및 SSC(측면 산란) 전압을 조정하여 세포 집단을 적절하게 시각화합니다.
- FITC 및 PE 형광 채널의 전압을 조정합니다. 레이블이 지정되지 않은 셀부터 시작하여 각 채널 플롯의 맨 아래에 있는 셀 모집단을 중앙에 배치합니다. 레이블이 지정된 셀이 플롯 내에 적절하게 배치되어 있는지 확인합니다.
- 더블릿을 제거하기 위해 일반적인 게이팅 전략을 사용하십시오: 주요 FSC-A 대 게이트 SSC-A 모집단(그림 2A), FSC-H 대 -W, 그리고 SSC-H 대 -W(그림 2B,C).
- TMRMhi 및 ALCAM+ 집단( 그림 2E의 P2)을 게이트하여 간세포를 분류합니다. TMRMhi 및 ALCAM- 집단( 그림 2E의 P1)을 게이트하여 비간세포를 분류합니다. 간세포 성숙 배지가 포함된 15mL 수집 튜브에서 분류된 간세포와 비간세포를 수집합니다.
- 분류된 세포가 들어 있는 수집 튜브를 200 x g 에서 18°C에서 5분 동안 원심분리합니다.
- 상층액을 제거하고 간세포 성숙 배지에서 세포를 재현탁시킵니다.
- 10 μM Y-27632 및 20 nM 시클로스포린 A가 보충된 간세포 성숙 배지를 사용하여 미토마이신 C 처리된 마우스 배아 섬유아세포(MEF) 또는 겔 같은 기저막 매트릭스에 세포를 파종합니다. 37°C CO2 인큐베이터에서 5일 동안 세포를 배양합니다.
5. 인간 iPS 세포 유래 간세포 검출을 위한 면역세포화학(Immunocytochemistry)
- 배양된 세포를 PBS(-)로 분류 후 5일 동안 세척합니다.
- 실온에서 5분 동안 4% 파라포름알데히드로 세포를 고정합니다.
- TBS-T 완충액(1x TBS, 1% Tween 20)으로 세포를 두 번 세척하여 파라포름알데히드를 제거합니다.
- 0.1% Triton X-100 희석된 TBS-T 완충액으로 실온에서 5분 동안 세포를 배양합니다.
- TBS-T 완충액으로 세포를 두 번 세척하여 Triton X-100을 제거합니다.
- 시중에서 판매되는 차단 용액( 재료 표 참조)을 실온에서 30분 동안 셀에 추가합니다.
- 차단 용액에 1:50으로 희석하여 알부민(간세포 마커) 및 인간 핵 항원(hNA, 재료 표 참조)에 대한 1차 항체를 추가합니다.
- 4 °C에서 밤새 세포를 배양합니다. TBS-T 버퍼로 세포를 두 번 세척합니다.
- 2차 항체 추가: 차단 용액에 1:100으로 희석한 Alexa Fluor 488 donkey anti-rabbit IgG 및 Alexa Fluor 546 donkey anti-mouse IgG( 재료 표 참조).
- 실온에서 30분 동안 세포를 배양합니다. TBS-T 버퍼로 세포를 두 번 세척합니다.
- 형광 현미경으로 알부민 양성 및 hNA 양성 세포를 계수하여 간세포 순도를 평가합니다. P1 및 P2 집단 모두에 대해 hNA 양성 세포당 알부민 양성 세포의 백분율을 계산합니다.
결과
인간 iPS 세포가 2D 배양을 통해 간세포로 분화하도록 유도하는 과정(그림 1A)과 대표적인 세포 특징(그림 1B)의 타임라인이 표시됩니다. 대략 분화 12일째에 세포는 간세포의 특징인 다각형 세포 모양과 둥근 핵을 나타내기 시작했습니다. 일부 간세포는 또한 다핵형성(multinucleation)을 보였다.
FACS 분석은 분화 27일째에 세포를 사용하여 수행하였다. ALCAM+ 집단을 식별하기 위해 첫 번째 항-ALCAM 항체가 있는 경우와 없는 경우를 비교 플롯이 각각 그림 2D,E에 나와 있습니다. 2D 배양을 통해 간 분화를 유도한 간세포(P2)의 개체군은 이 실험에서 10.1%로 나타났으며, 이는 3D 배아체 형성 방법을 사용하여 발견된 0.8%(데이터 미도시)에서 크게 증가한 것입니다.
분류된 P1 및 P2 세포는 미토마이신 C로 처리된 마우스 배아 섬유아세포에서 배양되었습니다. P2 세포는 조밀한 구형 콜로니 형성을 보인 반면, P1 세포는 분산되어 더 평평한 형태를 가졌습니다. 인간 핵 항원(hNA) 및 알부민에 대한 면역조직화학적 염색은 그림 3과 같이 P2에서 간세포 유사 세포의 농축을 확인했습니다. P1 및 P2 세포에서 간세포의 순도를 평가하기 위해 hNA 양성 세포에 대한 알부민 양성 세포의 비율을 계산했습니다(n=5). 그 결과 P1 세포의 0%와 P2 세포의 97% ± 0.38%가 인간 iPSC에서 유래했으며 간세포와 유사한 특성을 나타냈습니다(그림 3).
FACS 실험 중 간세포의 성공적인 분류를 확인하려면 ASGR1을 다른 형광단과 접합된 특정 항체와 함께 염색하고 P2에 ASGR1 양성 세포가 포함되어 있는지 확인하는 것이 좋습니다.
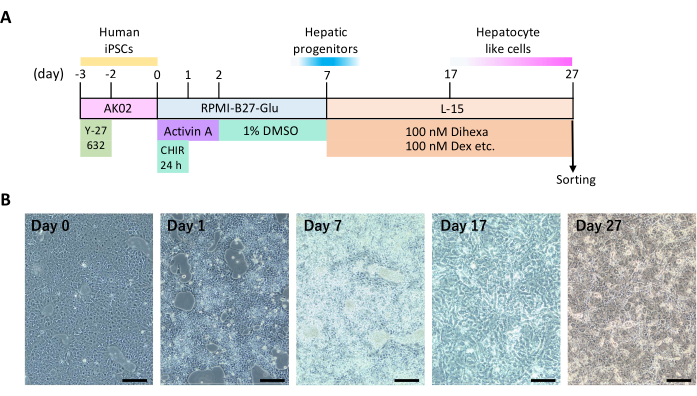
그림 1: 인간 iPSC의 2D 간 분화. (A) 간 분화를 위한 타임라인. 이 그림은 Yamashita et al.14에서 발췌한 것입니다. (B) 간 분화 중 형태학적 변화. 스케일 바 = 200 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 간 분화 세포에서 간세포와 비간세포를 분류하기 위한 게이팅 전략(27일). (A) FSC-A 대 FSC-A를 사용한 표적 세포 집단 게이팅(Gating) SSC-A 플롯. (B) FSC-H 대 (A) 단계를 사용하여 게이트 개체군을 확장하는 단계 FSC-W는 이중항 세포를 플로팅하고 제외합니다. (C) SSC-H 대 (B) 단계를 사용하여 gated population을 추가로 확장합니다. SSC-W 플롯 및 이중선 셀 제외. (D) 및 (E) FITC-A (ALCAM)를 사용하여 단계 (C)에서 게이트 모집단을 확장하는 것과 비교. PE-A(TMRM) 플롯. (D) TMRM 및 2차 항체로 염색된 세포. (E) TMRM 및 1차 및 2차 항체로 염색된 세포. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
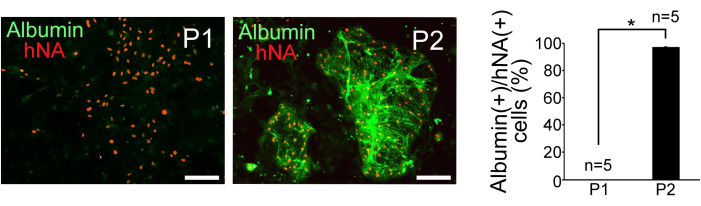
그림 3: 면역조직화학 결과. 분류된 P1 및 P2 세포에서 알부민 및 인간 핵 항원(hNA)의 면역조직화학적 검출 및 hNA(+) 세포에서 알부민(+) 세포 분획의 정량화. 스케일 바 = 100 μm. 데이터는 평균 ± 표준 편차(SD)(n = 5)로 표시됩니다. 통계 분석은 스튜던트 t-검정을 사용하여 수행되었습니다. *P < 0.05. 이 그림은 Yamashita et al.14에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
영양소 대사와 해독 작용을 하기 때문에, 간세포는 다른 세포 유형에 비해 상대적으로 많은 수의 미토콘드리아를 보유하고있다 15. ALCAM은 면역글로불린 슈퍼패밀리의 구성원이며 세포 접착 및 이동에 중요한 역할을 합니다. 간세포, 상피세포, 림프구세포, 골수세포, 섬유아세포, 신경세포 등 다양한 세포 유형에서 발현된다16. 미토콘드리아 기반 방법과 ALCAM 항체의 조합을 활용하여 인간 iPS 세포 유래 간세포를 성공적으로 식별했습니다.
정제된 간세포의 분비 기능 또는 효소 활성을 특성화하기 위한 분석은 수행되지 않았지만, 정제된 인간 iPS 세포 유래 간세포에서 CYP3A4 유전자의 mRNA 발현을 검증했습니다. 또한, 인간 ES 세포에서 유래한 배아체에서 분리된 TMRM(높음) 및 ALCAM(+)을 가진 간세포 집단은 ES 세포 유래 심근세포에 비해 간세포 관련 유전자 세트(VTN, SERPINA1, CYP1A1, FGB, FGA, FGG, AFP, ALB 및 APOB)의 발현이 더 높았다(14).
프로토콜 내에서 중요한 단계는 TMRM 염색을 위한 미토콘드리아 활성의 보존을 보장하면서 최소한의 손상으로 배양 접시에서 2D 간 분화 세포를 부드럽게 분리하는 것입니다. 분화 상태에 따라 간세포는 효소 처리로도 접시에서 분리되는 것에 대한 저항성을 보일 수 있으며, 이는 0.25mM EDTA를 첨가하여 효과적으로 해결할 수 있습니다.
FACS를 통한 간세포의 정제를 위한 기존 방법은 간세포 발현 유전자에 특이적인 프로모터의 다운스트림에 리포터 유전자를 도입하는 것을 포함한다. 그러나 이 접근 방식은 유전자 변형과 관련된 부작용의 잠재적 위험을 수반합니다. 반면에 미토콘드리아 방법은 이러한 우려를 제거합니다. 성인 또는 태아 간 줄기/전구 세포의 여러 세포 표면 마커가 확인되었으며18 인간 만능 줄기 세포에서 유래한 간 전구 세포는 CD13+CD133+ 집단을 사용하여 분류할 수 있었다19. 한편, 만능줄기세포 유래 간세포 중 성숙한 간세포의 극히 일부만 간세포에 특이적인 유일한 세포 표면 마커인 ASGR1(asialoglycoprotein receptor 1) 항체17을 사용하여 분류할 수 있었습니다. 높은 미토콘드리아 및 ALCAM 양성을 나타내는 세포 집단은 CD13+CD133+ 세포와 ASGR1+ 세포로 표시된 집단을 모두 포함하는 것으로 입증되었습니다. 이는 높은 미토콘드리아 및 ALCAM 양성 집단이 다양한 성숙도를 가진 광범위한 간세포를 포함할 수 있음을 시사한다14. 결과적으로, 이 방법은 거의 손실없이 간세포 집단의 정제를 가능하게 할 수 있습니다.
이 방법을 사용하여 배아 14.5일에 마우스 태아 전체 내장을 분석한 결과, 근세포와 간세포 모두에서 ALCAM이 발현되는 것이 밝혀졌다14. 다른 이전 연구에서는 쥐 심근 전구 세포에서 ALCAM 발현을 보고했습니다21. 인간 만능 줄기세포 유래 세포의 경우, 심근세포는 ALCAM 음성 집단에서 확인되었습니다. 이러한 데이터는 심장 및 간 계통에서 ALCAM 발현이 종과 세포 성숙 단계에 따라 다르다는 것을 보여줍니다. 그러나 간세포에 비해 심근세포의 미토콘드리아 분율이 높기 때문에 마우스 전체 배아에서 유래한 혼합 세포에서도 FACS로 두 세포 유형을 분리하는 것이 실제로 성공했습니다. 이는 제안된 방법이 다른 동물 종의 간세포 및 심근세포를 정제하는 데 유용할 수 있음을 시사합니다.
본 명세서에 기술된 간세포 정제 기술은 인간 iPS 세포 유래 간세포의 이식과 관련된 종양 형성의 잠재적 위험을 완화함으로써 재생 의학 분야를 발전시키는 데 중추적인 역할을 할 것으로 예상됩니다. 그러나, 이 기술에 의해 정제된 간세포 집단에서 기형종 형성 능력의 무효화는 수행되지 않았습니다. 안전 보장을 위한 추가 연구가 수행되어야 합니다.
간세포와 같은 크고 부착된 세포는 FACS 분류 중 기계적 손상에 매우 취약하여 생존 가능한 세포의 상당한 손실을 초래합니다. 임상적 응용을 위해서는 심근세포 정제를 위한 젖산법(Lactate Method for cardiomyocyte purification)과 같이 간세포의 생존만을 가능하게 하는 배양 환경을 조성하는 새로운 정제법을 개발하는 것이 필수적이다22.
공개
저자는 밝힐 것이 없습니다.
감사의 말
이 작업은 문부과학성 보조금 번호[23390072]의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 253G1 human iPS cell line | RIKEN BioResource Research Center | HPS0002 | |
| 4% paraformaldehyde | FUJIFILM Wako Pure Chemical Corporation | 163-20145 | |
| Activin A Solution, Human, Recombinant | NACALAI TESQUE, INC. | 18585 | |
| Anti-Nuclei Antibody, clone 235-1 | Chemicon | MAB1281 | Antibody against human nuclear antigen |
| B-27 Supplement (50x), serum free | Thermo Fisher Scientific | 17504044 | |
| BD FACSAria III | BD Biosciences | Cell sorter | |
| CHIR-99021 | MedChemExpress | HY-10182 | |
| Ciclosporin A | FUJIFILM Wako Pure Chemical Corporation | 035-18961 | |
| Collagenase | FUJIFILM Wako Pure Chemical Corporation | 034-22363 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | Corning | 354230 | Gel-like basement membrane matrix |
| CultureSure Y-27632 | FUJIFILM Wako Pure Chemical Corporation | 036-24023 | ROCK inhibitor |
| Dexamethasone | FUJIFILM Wako Pure Chemical Corporation | 047-18863 | |
| Dimethyl sulfoxide (DMSO) | FUJIFILM Wako Pure Chemical Corporation | 047-29353 | |
| Donkey anti-Goat IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Thermo Fisher Scientific | A-11055 | |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 546 | Thermo Fisher Scientific | A10036 | |
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Thermo Fisher Scientific | A-21206 | |
| Falcon 5 mL Round Bottom Polystyrene Test Tube, with Cell Strainer Snap Cap | Corning | 352235 | |
| Fetal Bovine Serum | Biowest | 51820-500 | |
| GlutaMAX Supplement | Thermo Fisher Scientific | 35050061 | Dipeptide L-Alanyl-L-Glutamine |
| Human/Mouse/Rat/Canine ALCAM/CD166 Antibody | R&D Systems | AF1172 | |
| Hydrocortisone 21-hemisuccinate sodium salt | Sigma-Aldrich | H2270 | |
| iMatrix-511 silk | Nippi | 892021 | |
| ImmunoBlock | KAC | CTKN001 | Blocking solution |
| ITS-G Supplement(×100) | FUJIFILM Wako Pure Chemical Corporation | 090-06741 | |
| Leibovitz's L-15 Medium | FUJIFILM Wako Pure Chemical Corporation | 128-06075 | |
| N-Hexanoic-Try-Ile-(6)-amino Hexanoic amide (Dihexa) | Toronto Research Chemicals | H293745 | |
| Polyclonal Rabbit Anti-Human Albumin | Dako | A0001 | |
| Polyoxyethylene Sorbitan Monolaurate (Tween 20) | NACALAI TESQUE, INC. | 28353-85 | |
| RPMI-1640 | FUJIFILM Wako Pure Chemical Corporation | 189-02025 | |
| Sodium L-Ascorbate | NACALAI TESQUE, INC. | 03422-32 | |
| StemFit AK02N | REPROCELL | RCAK02N | |
| TBS (10x) | NACALAI TESQUE, INC. | 12748-31 | |
| Tetramethylrhodamine, methyl ester (TMRM) | Thermo Fisher Scientific | T668 | |
| Triton X-100 | NACALAI TESQUE, INC. | 28229-25 | |
| Trypan Blue Solution | NACALAI TESQUE, INC. | 20577-34 | |
| TRYPSIN 250 | Difco | 215240 | |
| Tryptose phosphate broth solution | Sigma-Aldrich | T8159 |
참고문헌
- Yamamoto, T., et al. Differentiation potential of pluripotent stem cells correlates to the level of CHD7. Scientific Reports. 8 (1), 241 (2018).
- Laco, F., et al. Unraveling the inconsistencies of cardiac differentiation efficiency induced by the GSK3β inhibitor CHIR99021 in human pluripotent stem cells. Stem Cell Reports. 10 (6), 1851-1866 (2018).
- Anderson, N. C., et al. Balancing serendipity and reproducibility: Pluripotent stem cells as experimental systems for intellectual and developmental disorders. Stem Cell Reports. 16 (6), 1446-1457 (2021).
- Chen, C. X. -. Q., et al. Standardized quality control workflow to evaluate the reproducibility and differentiation potential of human iPSCs into neurons. bioRxiv. , (2021).
- Duinsbergen, D., Salvatori, D., Eriksson, M., Mikkers, H. Tumors originating from induced pluripotent stem cells and methods for their prevention. Annals of the New York Academy of Sciences. 1176, 197-204 (2009).
- Nori, S., et al. Long-term safety issues of iPSC-based cell therapy in a spinal cord injury model: oncogenic transformation with epithelial-mesenchymal transition. Stem Cell Reports. 4 (3), 360-373 (2015).
- Hentze, H., et al. Teratoma formation by human embryonic stem cells: evaluation of essential parameters for future safety studies. Stem Cell Research. 2 (3), 198-210 (2009).
- Anderson, D., et al. Transgenic enrichment of cardiomyocytes from human embryonic stem cells. Molecular Therapy. 15 (11), 2027-2036 (2007).
- Hidaka, K., et al. Chamber-specific differentiation of Nkx2.5-positive cardiac precursor cells from murine embryonic stem cells. The FASEB Journal. 17 (6), 740-742 (2003).
- Gassanov, N., Er, F., Zagidullin, N., Hoppe, U. C. Endothelin induces differentiation of ANP-EGFP expressing embryonic stem cells towards a pacemaker phenotype. The FASEB Journal. 18 (14), 1710-1712 (2004).
- Duan, Y., et al. Differentiation and enrichment of hepatocyte-like cells from human embryonic stem cells in vitro and in vivo. Stem Cells. 25 (12), 3058-3068 (2007).
- Takayama, K., et al. Enrichment of high-functioning human iPS cell-derived hepatocyte-like cells for pharmaceutical research. Biomaterials. 161, 24-32 (2018).
- Hattori, F., et al. Nongenetic method for purifying stem cell-derived cardiomyocytes. Nature methods. 7, 61-66 (2009).
- Yamashita, H., Fukuda, K., Hattori, F. Hepatocyte-like cells derived from human pluripotent stem cells can be enriched by a combination of mitochondrial content and activated leukocyte cell adhesion molecule. JMA Journal. 2 (2), 174-183 (2019).
- Fernandez-Vizarra, E., Enríquez, J., Pérez-Martos, A., Montoya, J., Fernández-Silva, P. Tissue-specific differences in mitochondrial activity and biogenesis. Mitochondrion. 11, 207-213 (2010).
- Swart, G. W. M. Activated leukocyte cell adhesion molecule (CD166/ALCAM): Developmental and mechanistic aspects of cell clustering and cell migration. European Journal of Cell Biology. 81 (6), 313-321 (2002).
- Peters, D. T., et al. Asialoglycoprotein receptor 1 is a specific cell-surface marker for isolating hepatocytes derived from human pluripotent stem cells. Development. 143 (9), 1475-1481 (2016).
- Kamiya, A., Inagaki, Y. Stem and progenitor cell systems in liver development and regeneration. Hepatology Research. 45 (1), 29-37 (2015).
- Yanagida, A., Ito, K., Chikada, H., Nakauchi, H., Kamiya, A. An In vitro expansion system for generation of human ips cell-derived hepatic progenitor-like cells exhibiting a bipotent differentiation potential. PLOS One. 8 (7), e67541 (2013).
- Siller, R., Greenhough, S., Naumovska, E., Sullivan, G. J. Small-molecule-driven hepatocyte differentiation of human pluripotent stem cells. Stem Cell Reports. 4 (5), 939-952 (2015).
- Hirata, H., et al. ALCAM (CD166) is a surface marker for early murine cardiomyocytes. Cells, Tissues, Organs. 184 (3-4), 172-180 (2006).
- Tohyama, S., et al. Distinct metabolic flow enables large-scale purification of mouse and human pluripotent stem cell-derived cardiomyocytes. Cell Stem Cell. 12 (1), 127-137 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유