Method Article
تطبيق تلطيخ الميتوكوندريا الحية في فرز الخلايا لتنقية خلايا الكبد المشتقة من الخلايا الجذعية متعددة القدرات التي يسببها الإنسان
In This Article
Summary
يمكن تنقية خلايا الكبد المشتقة من الخلايا الجذعية متعددة القدرات من خلال فرز الخلايا ، باستخدام مزيج من تلطيخ الميتوكوندريا وجزيء التصاق خلايا الكريات البيض المنشط (ALCAM ، المعروف أيضا باسم CD166).
Abstract
الجذع الجنيني البشري (ES) والخلايا الجذعية المستحثة متعددة القدرات (iPS) لها تطبيقات محتملة في الطب التجديدي القائم على الخلايا لعلاج الأعضاء المريضة بشدة بسبب تكاثرها غير المحدود وخصائصها متعددة القدرات. ومع ذلك ، فإن التمييز بين الخلايا الجذعية الجنينية / الجذعية المستحثة متعددة القدرات البشرية إلى أنواع خلايا مستهدفة نقية بنسبة 100٪ يمثل تحديا بسبب حساسيتها العالية للبيئة. يحدث تكوين الورم بعد الزرع بسبب الخلايا الملوثة والمكاثرة وغير المتمايزة ، مما يجعل تقنية التنقية العالية ضرورية لتحقيق آمن للطب التجديدي. للتخفيف من خطر تكوين الأورام، تم تطوير تقنية عالية التنقية لخلايا الكبد البشرية المشتقة من الخلايا الجذعية المستحثة متعددة القدرات. تستخدم الطريقة FACS (فرز الخلايا المنشط بالتألق) باستخدام مزيج من المحتوى العالي للميتوكوندريا وعلامة سطح الخلية ALCAM (جزيء التصاق خلايا الكريات البيض المنشط) دون تعديل وراثي. 97٪ ± 0.38٪ (ن = 5) من خلايا الكبد المنقاة باستخدام هذه الطريقة أظهرت تعبيرا عن بروتين الألبومين. تهدف هذه المقالة إلى توفير إجراءات مفصلة لهذه الطريقة ، كما هو مطبق على أحدث طريقة تمايز ثنائية الأبعاد لخلايا iPS البشرية إلى خلايا الكبد.
Introduction
تعتبر الخلايا الجذعية الجنينية والمستحثة متعددة القدرات (ES و iPS ، على التوالي) مصادر خلايا واعدة للعلاجات التجديدية. ومع ذلك ، يمكن أن تختلف كفاءة تمييز هذه الخلايا إلى أنواع محددة من الخلايا المستهدفة ، حتى عند استخدام نفس خط الخلية والبروتوكول والمجرب1،2،3،4. يمكن أن يعزى هذا التباين إلى الحساسية العالية لخلايا ES / iPS البشرية لبيئتها. لذلك ، من الصعب حاليا الحصول على خلايا مستهدفة نقية باستمرار. لتحقيق الطب التجديدي الآمن للغاية ، من الأهمية بمكان القضاء على الخلايا التكاثرية والخلايا الجذعية غير المتمايزة في الخلايا العلاجية ، وتكنولوجيا التنقية المتقدمة للخلايا المستهدفة ضرورية5،6،7.
فارز الخلايا هو جهاز يحلل الخلايا الفردية على الفور ويفرز الخلايا الحية ذات الأهمية بناء على قوة إشارة الفلورسنت ، مما يوفر حلا واعدا. يمكن تحقيق ذلك من خلال تلطيخ الأجسام المضادة لعلامات السطح الخاصة بنوع الخلية أو من خلال استخدام التعبيرات الجينية للمراسل الخاص بنوع الخلية. باستخدام هذه التقنية ، هناك العديد من التقارير حول طرق تنقية خلايا عضلة القلب المشتقة من الخلايا الجذعيةمتعددة القدرات 8،9،10 وخلايا الكبد11،12. طور هاتوري وآخرون طريقة مبتكرة لتنقية الميتوكوندريا باستخدام فارز الخلايا13. الاستفادة من حقيقة أن خلايا عضلة القلب لها متطلبات طاقة عالية من خلال نشاط الميتوكوندريا ، يمكن استخدام تلطيخ الخلايا بالصبغة الحية الإرشادية للميتوكوندريا TMRM (رباعي ميثيل رودامين ميثيل استر) لتسمية وتنقية خلايا عضلة القلب بدرجة عالية بواسطة FACS من الأجسام الجنينية المشتقة من الخلايا الجذعية الجنينية البشرية التي تحتوي على أنواع مختلفة من الخلايا. تم تأكيد عدم وجود ورم من خلال فحوصات تشكيل الورم المسخي مع خلايا عضلة القلب المنقى. علاوة على ذلك ، اكتشف Yamashita et al. بشكل غير متوقع طريقة لتنقية خلايا الكبد من الأجسام الجنينية المشتقة من الخلايا الجذعية الجنينية البشرية عن طريق عزل الكسور ذات النشاط العالي للميتوكوندريا والتعبير الإيجابي ALCAM14. الأساس المنطقي لهذه الطريقة هو أن خلايا الكبد تحتوي أيضا على عدد كبير نسبيا من الميتوكوندريا بسبب استهلاكها العالي ل ATP لاستقلاب المغذياتوإزالة السموم 15 ، وتعبر خلايا الكبد عن ALCAM ، وهو عضو في عائلة الغلوبولين المناعي الفائقة ، والتي تلعب دورا في التصاق الخلايا والهجرة16.
تطلبت الطرق السابقة عالية التنقية لخلايا الكبد المشتقة من الخلايا الجذعية متعددة القدرات تعديلات وراثية ، وكانت طرق التنقية غير الجينية منخفضةالكفاءة 17. الطريقة غير الوراثية للميتوكوندريا لها ميزة لتحقيق نقاء عالي. عند الحاجة إلى الخلايا السلفية الكبدية ، يمكن اختيار الطرق المستندة إلى CD133 و CD13 أو Dlk118,19. على الرغم من تقدم دقة تقنية تحرير الجينوم ، إلا أنه لا يمكن القضاء تماما على المخاطر المحتملة للتغيرات الجينومية غير المتوقعة (مثل التسرطن). يمكن أن تكون الطرق القائمة على نشاط الميتوكوندريا ، دون إشراك التعديل الوراثي ، خالية من هذه المخاطر.
نتيجة لفحص مؤشرات الميتوكوندريا المختلفة في خلايا عضلة القلب للفئران حديثي الولادة ، لوحظ أن TMRM تختفي تماما في غضون 24 ساعة ، بينما بقيت الأصباغ الأخرى لمدة 5 أيام على الأقل13. علاوة على ذلك ، من المهم ملاحظة أن TMRM و JC-1 لم يؤثرا على صلاحية الخلية عند تقييمهما باستخدام مقايسة بروميد 3- (4،5-ثنائي ميثيل ثيازول-2-يل) -2،5-ثنائي فينيل تيترازوليوم بروميد (MTT) ، بينما أظهرت أصباغ أخرى تأثيرات متفاوتة على صلاحية الخلية13. TMRM يدل على سلامة أعلى.
حتى الآن ، تم تطوير العديد من طرق التمايز ثنائية الأبعاد (2D) كنهج أكثر كفاءة لإحداث التمايز مقارنة بتكوين الجسم الجنيني ثلاثي الأبعاد (3D). وذلك لأن المركبات المحفزة للتمايز التدريجي أو السيتوكينات يمكن أن تدار بشكل موحد للخلايا على مستوى 2D ، بدلا من مساحة 3D. في هذه الدراسة ، تم تعديل الطريقة20 المبلغ عنها سابقا للحث على التمايز في خلايا الكبد البشرية المشتقة من الخلايا الجذعية المستحثة متعددة القدرات. هنا ، يتم وصف تفاصيل إجراءات تمايز 2D الحديثة وتنقية خلايا الكبد المشتقة من خلايا iPS البشرية.
Protocol
استخدمت هذه الدراسة خلايا iPS البشرية التي تم الحصول عليها تجاريا (سلالة 253G1) (انظر جدول المواد).
1. صيانة الخلايا الجذعية المستحثة متعددة القدرات البشرية
- الحفاظ على الخلايا الجذعية المستحثة متعددة القدرات البشرية في ظروف خالية من التغذية في وسط AK02 على أطباق الاستزراع المغلفة ب 0.25 ميكروغرام / سم2 iMatrix-511 (انظر جدول المواد).
2. التمايز الكبدي للخلايا الجذعية المستحثة متعددة القدرات البشرية في الثقافات ثنائية الأبعاد
ملاحظة: راجع الشكل 1 أ لمعرفة الجدول اليومي للتمايز الكبدي. طوال العملية ، استخدم ألواح استزراع 6 آبار وأضف 2 مل من وسط الغسيل أو الاستزراع المخصص لكل بئر. الحفاظ على حالة زراعة الخلايا عند رطوبة 100٪ ، 5٪ CO2 ، و 20٪ O2 عند 37 درجة مئوية.
- قم بتغطية كل بئر من صفيحة 6 آبار ب 1 مل من مصفوفة الغشاء القاعدي (مخففة 1/25 في PBS (-)) ، واحتضانها عند 37 درجة مئوية لمدة 1 ساعة.
- تمرير الخلايا الجذعية المستحثة متعددة القدرات البشرية على الطبق المطلي بكثافة 20000-30000 خلية / سم² باستخدام وسط AK02N المكمل بمثبط 10 ميكرومتر ROCK (Y-27632) (انظر جدول المواد). استبدل الوسيط بدون Y-27632 في اليوم التالي والثقافة لمدة 2 أيام إضافية.
- اغسل الخلايا مرة واحدة باستخدام وسيط RPMI-1640. بدء تمايز الأديم الباطن عن طريق استبدال الوسط ب RPMI-B27-Glu (RPMI-1640 + 2٪ B27 Insulin + 1٪ Dipeptide L-Alanyl-L-Glutamine) المكمل ب 3-6 ميكرومتر CHIR-99021 و 100 نانوغرام / مل Activin A لمدة 24 ساعة (انظر جدول المواد).
- استبدل الوسط ب RPMI-B27-Glu المكمل ب 50 نانوغرام / مل Activin A لمدة 24 ساعة.
- للحث على تمايز السلف الكبدي ، استبدل الوسط ب RPMI-B27-Glu المكمل ب 1٪ ثنائي ميثيل سلفوكسيد (DMSO) لمدة 5 أيام.
- لتعزيز نضوج خلايا الكبد ، قم بالتبديل إلى وسط نضوج خلايا الكبد: وسط ليبوفيتز L-15 الذي يحتوي على 10 ميكرومتر هيدروكورتيزون 21-هيميسوكسينات ، 8.3٪ مرق فوسفات التربتوز ، 100 نانومتر ديكساميثازون (DEX) ، 50 ميكروغرام / مل صوديوم-L-أسكوربات ، 0.58٪ أنسولين ترانسفيرين-سيلينيوم (ITS) ، 8.3٪ مصل بقري جنيني (FBS) ، 2 مللي متر ثنائي الببتيد L-Alanyl-L-Glutamine ، و 100 نانومتر N-Hexanoic-Try-Ile- (6) - أمينو أميد هيكسانويك (Dihexa) (انظر جدول المواد).
- تغيير الوسيط كل يومين لمدة 20 يوما. قم بفرز الخلايا بعد 27 يوما تقريبا من بدء التمايز.
3. تحضير الخلايا لتنقية خلايا الكبد البشرية المشتقة من الخلايا الجذعية المستحثة متعددة القدرات
- اغسل الخلايا الكبدية المتمايزة ب 2 مل من برنامج تلفزيوني (-) لكل بئر.
- أضف 1 مل من محلول الإنزيم لكل بئر ، والذي يتضمن 0.1٪ كولاجيناز ، 0.083٪ تربسين ، مثبط 10 ميكرومتر ROCK (Y-27632) ، 20 نانومتر سيكلوسبورين أ ، و 50 ميكروغرام / مل صوديوم-إل-أسكوربات في مخزن الإعلانات المؤقت (116 مللي مول كلوريد الصوديوم ، 12.5 مللي مول NaH2PO4 ، 20 مللي مول HEPES ، 5.4 ملليمتر KCl ، 5.6 ملليمتر جلوكوز ، و 0.8 مللي مول MgSO4 ؛ درجة الحموضة 7.35) (انظر جدول المواد). افصل الخلايا عن الألواح عن طريق الدوران أفقيا عند 37 درجة مئوية لمدة 2 ساعة تقريبا.
- بعد التأكد من فصل الخلايا وتقريبها تحت المجهر ، قم بتفريقها إلى خلايا مفردة عن طريق سحب لطيف ، واجمعها في أنبوب سعة 50 مل.
- خلايا الطرد المركزي عند 200 × جم لمدة 5 دقائق عند 18 درجة مئوية لتكويتها. قم بإزالة المادة الطافية باستخدام شفاط.
- تلطيخ الميتوكوندريا من الخلايا عن طريق تفريقها في 5 مل من وسط نضوج خلايا الكبد التي تحتوي على 100 نانومتر TMRM (رباعي ميثيل رودامين ، ميثيل استر) (انظر جدول المواد). احتضانها لمدة 30 دقيقة على درجة حرارة 37 درجة مئوية مع الحماية من الضوء عن طريق تغليفها بورق الألمنيوم.
- أجهزة الطرد المركزي الخلايا في 200 × غرام لمدة 5 دقائق عند 18 درجة مئوية لتكويتها. إزالة الطاف.
- أعد تعليق الخلايا ب 1-5 مل من مخزن الإعلانات البارد الذي يحتوي على 2٪ FBS.
- احسب رقم الخلية باستخدام محلول أزرق Trypan بنسبة 0.4٪ ولوحة عد الخلايا.
- أجهزة الطرد المركزي الخلايا في 200 × غرام لمدة 5 دقائق عند 4 درجات مئوية لتكويتها. إزالة الطاف.
- قم بتخفيف الجسم المضاد المضاد ل ALCAM (الجسم المضاد الأساسي ، انظر جدول المواد) بنسبة 1:50 في مخزن الإعلانات المؤقت ، وأضف 100 ميكرولتر من الجسم المضاد المخفف لكل 106 خلايا. تلطيخ الخلايا لمدة 50 دقيقة على الجليد. تحضير الخلايا غير الملطخة بالجسم المضاد الأساسي كعنصر تحكم سلبي.
- اغسل الخلايا بمخزن مؤقت للإعلانات الباردة يحتوي على 2٪ FBS مرتين.
- قم بتخفيف IgG المضاد للحمار Alexa Fluor 488 (الجسم المضاد الثانوي ، انظر جدول المواد) بنسبة 1: 100 في مخزن الإعلانات المؤقت ، وأضف 100 ميكرولتر من الجسم المضاد المخفف لكل 106 خلايا. تلطيخ الخلايا لمدة 30 دقيقة على الجليد. الخلايا الملطخة التي لم تكن ملطخة بالجسم المضاد الأولي باستخدام الجسم المضاد الثانوي.
- اغسل الخلايا بمخزن مؤقت للإعلانات الباردة يحتوي على 2٪ FBS مرتين.
- أعد تعليق الخلايا في المخزن المؤقت للإعلانات وقم بتصفيتها من خلال مصفاة خلية ذات غطاء مفاجئ (شبكة 35 ميكرومتر) قبل الفرز بواسطة FACS لإزالة كتل الخلايا الكبيرة والحطام.
4. تحليل FACS وفرز خلايا الكبد المشتقة من الخلايا الجذعية المستحثة متعددة القدرات البشرية
- قم بإعداد جهاز FACS لفرز الخلايا باتباع إرشادات الشركة المصنعة (انظر جدول المواد).
ملاحظة: استخدم حجم فوهة 85 ميكرومتر أو 100 ميكرومتر ومرشح ND 2.0 لخلايا الكبد. استخدم قناة FITC للكشف عن دقيق Alexa 488 ل ALCAM وقناة PE للكشف عن مضان TMRM للميتوكوندريا. - اضبط جهد FSC (التشتت الأمامي) و SSC (التشتت الجانبي) لتصور محتوى الخلية بشكل صحيح.
- اضبط الفولتية لقنوات الفلورسنت FITC و PE. ابدأ بالخلايا غير المسماة وقم بتوسيط محتوى الخلية في أسفل كل مخطط قناة. تأكد من وضع الخلايا المصنفة بشكل مناسب داخل قطعة الأرض.
- استخدم استراتيجية بوابات مشتركة للتخلص من الثنائيات: بوابة FSC-A الرئيسية مقابل. سكان SSC-A (الشكل 2 أ) ، يليهم FSC-H مقابل. -W ، ثم SSC-H مقابل. -W (الشكل 2 ب ، ج).
- قم ببوابة TMRMhi و ALCAM + (P2 في الشكل 2E) لفرز خلايا الكبد. بوابة TMRMhi و ALCAM- السكان (P1 في الشكل 2E) لفرز الخلايا غير الكبدية. جمع خلايا الكبد المصنفة وغير الكبدية في أنابيب جمع 15 مل تحتوي على وسط نضوج خلايا الكبد.
- جهاز طرد مركزي أنبوب التجميع الذي يحتوي على الخلايا المصنفة عند 200 × جم لمدة 5 دقائق عند 18 درجة مئوية.
- إزالة طاف وإعادة تعليق الخلايا في وسط نضوج خلايا الكبد.
- قم بزرع الخلايا على الخلايا الليفية الجنينية للفأر المعالج بالميتوميسين C (MEFs) أو مصفوفة الغشاء القاعدي الشبيهة بالهلام مع وسط نضوج خلايا الكبد المكمل ب 10 ميكرومتر Y-27632 و 20 نانومتر سيكلوسبورين أ. استزراع الخلايا في حاضنة CO2 37 درجة مئوية لمدة 5 أيام.
5. الكيمياء الخلوية المناعية للكشف عن خلايا الكبد البشرية المشتقة من الخلايا الجذعية المستحثة متعددة القدرات
- اغسل الخلايا المزروعة لمدة 5 أيام بعد الفرز باستخدام PBS (-).
- إصلاح الخلايا مع 4 ٪ بارافورمالدهيد لمدة 5 دقائق في درجة حرارة الغرفة.
- اغسل الخلايا باستخدام المخزن المؤقت TBS-T (1x TBS مع 1٪ Tween 20) مرتين لإزالة البارافورمالديهايد.
- احتضان الخلايا مع 0.1٪ Triton X-100 المخفف TBS-T العازلة لمدة 5 دقائق في درجة حرارة الغرفة.
- اغسل الخلايا باستخدام المخزن المؤقت TBS-T مرتين لإزالة Triton X-100.
- أضف محلول الحجب المتاح تجاريا (انظر جدول المواد) إلى الخلايا لمدة 30 دقيقة في درجة حرارة الغرفة.
- أضف أجساما مضادة أولية ضد الألبومين (علامة خلايا الكبد) والمستضد النووي البشري (hNA ، انظر جدول المواد) ، مخففة 1:50 في محلول الحظر.
- احتضان الخلايا عند 4 درجات مئوية طوال الليل. اغسل الخلايا باستخدام المخزن المؤقت TBS-T مرتين.
- أضف أجساما مضادة ثانوية: Alexa Fluor 488 حمار مضاد للأرانب IgG و Alexa Fluor 546 حمار مضاد للفأر IgG ، مخفف 1: 100 في محلول مانع (انظر جدول المواد).
- احتضان الخلايا في درجة حرارة الغرفة لمدة 30 دقيقة. اغسل الخلايا باستخدام المخزن المؤقت TBS-T مرتين.
- تقييم نقاء خلايا الكبد عن طريق حساب الخلايا الإيجابية للألبومين والخلايا الإيجابية hNA تحت المجهر الفلوري. احسب النسبة المئوية للخلايا الإيجابية للألبومين لكل خلية إيجابية hNA لكل من السكان P1 و P2.
النتائج
يوضح الجدول الزمني للعمليات التي تحفز الخلايا الجذعية المستحثة متعددة القدرات البشرية على التمايز إلى خلايا كبدية من خلال ثقافة ثنائية الأبعاد (الشكل 1 أ) وخصائص الخلية التمثيلية (الشكل 1 ب). تقريبا في يوم التمايز 12 ، بدأت الخلايا في إظهار أشكال الخلايا متعددة الأضلاع والنوى المستديرة ، وهي سمة من سمات خلايا الكبد. أظهرت بعض خلايا الكبد أيضا تعدد النوى.
تم إجراء تحليل FACS باستخدام الخلايا في يوم التمايز 27. لتحديد مجتمع ALCAM + ، يتم عرض مخططات مقارنة مع وبدون أول جسم مضاد مضاد ل ALCAM في الشكل 2D ، E ، على التوالي. إحداث تمايز كبدي من خلال ثقافة ثنائية الأبعاد ، وجد أن عدد خلايا الكبد (P2) يبلغ 10.1٪ في هذه التجربة ، وهو ما يمثل زيادة كبيرة عن 0.8٪ (البيانات غير معروضة) الموجودة باستخدام طريقة تكوين الجسم الجنيني ثلاثي الأبعاد.
تم استزراع خلايا P1 و P2 التي تم فرزها على الخلايا الليفية الجنينية للفأر المعالجة بالميتوميسين C. أظهرت خلايا P2 تكوين مستعمرة كروية مدمجة ، بينما كانت خلايا P1 مشتتة وكان لها مورفولوجيا مسطحة. أكد التلوين الكيميائي المناعي لمولد الضد النووي البشري (hNA) والألبومين إثراء الخلايا الشبيهة بالخلايا الكبدية في P2 ، كما هو موضح في الشكل 3. لتقييم نقاء خلايا الكبد في خلايا P1 و P2 ، تم حساب نسبة الخلايا الإيجابية للألبومين إلى الخلايا الإيجابية hNA (n = 5). كشفت النتائج أن 0٪ من خلايا P1 و 97٪ ± 0.38٪ من خلايا P2 مشتقة من iPSCs البشرية وأظهرت خصائص تشبه خلايا الكبد (الشكل 3).
لتأكيد الفرز الناجح لخلايا الكبد أثناء تجربة FACS ، يوصى بمشاركة تلطيخ ASGR1 مع جسمه المضاد المحدد المترافق مع فلوروفورات مختلفة والتأكد من أن P2 يحتوي على خلايا إيجابية ASGR1.
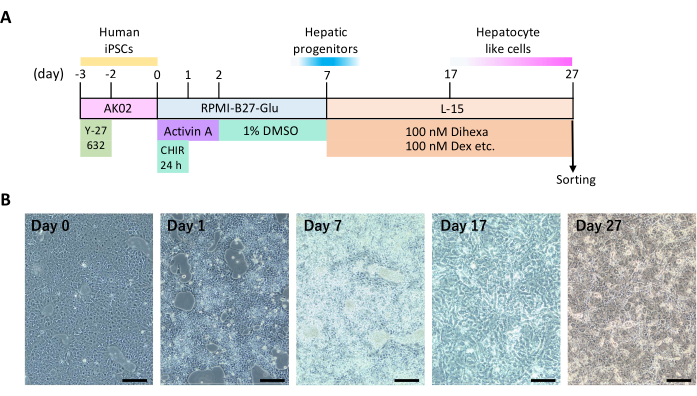
الشكل 1: 2D التمايز الكبدي للمتفرعات الجذعية المستحثة متعددة القدرات البشرية. أ: الجدول الزمني للتمايز الكبدي. هذا الرقم مقتبس من Yamashita et al.14. ب: التغيرات المورفولوجية أثناء التمايز الكبدي. قضبان المقياس = 200 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: استراتيجية البوابات لفرز الخلايا الكبدية وغير الكبدية في الخلايا الكبدية المتمايزة (اليوم 27). (أ) بوابة مجتمع الخلية المستهدفة باستخدام FSC-A مقابل مؤامرة SSC-A. (ب) توسيع عدد السكان المسورة من الخطوة (أ) باستخدام FSC-H مقابل. رسم FSC-W واستبعاد الخلايا المزدوجة. (ج) زيادة توسيع عدد السكان المسورة من الخطوة (ب) باستخدام SSC-H مقابل مخطط SSC-W واستبعاد الخلايا المزدوجة. (د) و (ه) توسيع عدد السكان المسورة من الخطوة (ج) باستخدام FITC-A (ALCAM) مقابل. PE-A (TMRM) مؤامرة. د: الخلايا الملطخة ب TMRM والجسمالمضاد 2. ه: الخلايا الملطخة ب TMRM والأجسام المضادة1 و 2. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
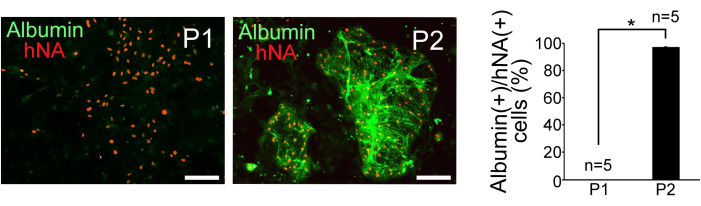
الشكل 3: نتائج الكيمياء الهيستولوجية المناعية. الكشف الكيميائي المناعي للألبومين والمستضد النووي البشري (hNA) في خلايا P1 و P2 المصنفة ، والقياس الكمي لجزء خلية الألبومين (+) في خلايا hNA (+). قضبان المقياس = 100 ميكرومتر. يتم تمثيل البيانات كمتوسط ± الانحراف المعياري (SD) (n = 5). تم إجراء التحليل الإحصائي باستخدام اختبار t للطالب. * P < 0.05. هذا الرقم مقتبس من Yamashita et al.14. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
نظرا لوظائفها في استقلاب المغذيات وإزالة السموم ، تمتلك خلايا الكبد عددا كبيرا نسبيا من الميتوكوندريا مقارنة بأنواع الخلاياالأخرى 15. ALCAM هو عضو في عائلة الغلوبولين المناعي الفائقة ويلعب دورا في التصاق الخلايا والهجرة. يتم التعبير عنها في أنواع مختلفة من الخلايا ، بما في ذلك الخلايا الكبدية والظهارية واللمفاوية والنخاعية والخلايا الليفيةوالخلايا العصبية 16. من خلال استخدام مزيج من الطريقة القائمة على الميتوكوندريا والجسم المضاد ALCAM ، تم تحديد خلايا الكبد البشرية المشتقة من الخلايا الجذعية المستحثة متعددة القدرات بنجاح.
في حين لم يتم إجراء المقايسات لتوصيف الوظيفة الإفرازية أو نشاط الإنزيم لخلايا الكبد المنقاة ، تم التحقق من تعبير mRNA لجين CYP3A4 في خلايا الكبد البشرية المشتقة من الخلايا الجذعية المستحثة متعددة القدرات المنقى. علاوة على ذلك ، فإن عدد خلايا الكبد مع TMRM (مرتفع) و ALCAM (+) معزول من الأجسام الجنينية المشتقة من الخلايا الجذعية الجنينية البشرية ، والتي لوحظت تعبيرات أعلى لمجموعات الجينات المرتبطة بخلايا الكبد (VTN و SERPINA1 و CYP1A1 و FGB و FGA و FGG و AFP و ALB و APOB) مقارنة بخلايا عضلة القلب المشتقة من الخلايا الجذعية الجنينية14.
تتمثل الخطوة الحاسمة في البروتوكول في فصل الخلايا الكبدية المتمايزة 2D بلطف عن أطباق الاستزراع بأقل قدر من الضرر مع ضمان الحفاظ على نشاط الميتوكوندريا لتلطيخ TMRM. اعتمادا على حالة التمايز ، قد تظهر خلايا الكبد مقاومة للانفصال عن الطبق حتى مع العلاج بالإنزيم ، وهو تحد يمكن معالجته بفعالية بإضافة 0.25 mM EDTA.
تتضمن الطرق الحالية لتنقية خلايا الكبد عبر FACS إدخال جينات المراسل في اتجاه مجرى المروجين الخاصة بالجينات المعبر عنها بخلايا الكبد. ومع ذلك ، فإن هذا النهج ينطوي على مخاطر محتملة من الآثار الجانبية المرتبطة بالتعديلات الجينية. من ناحية أخرى ، فإن طريقة الميتوكوندريا تقضي على هذه المخاوف. تم تحديد العديد من علامات سطح الخلية للخلايا الجذعية / السلفية للكبد البالغةأو الجنينية 18 ، ويمكن فرز الخلايا السلفية الكبدية المشتقة من الخلايا الجذعية البشرية متعددة القدرات باستخدام CD13 + CD133 +السكان 19. من ناحية أخرى ، من بين خلايا الكبد المشتقة من الخلايا الجذعية متعددة القدرات ، يمكن فرز جزء صغير من خلايا الكبد الناضجة باستخدام ASGR1 (مستقبلات البروتين الآسيوي 1) 17 ، وهو علامة سطح الخلية الوحيدة الخاصة بخلايا الكبد. وقد ثبت أن عدد الخلايا التي تظهر إيجابية عالية للميتوكوندريا و ALCAM يحتوي على كل من المجموعات المميزة بخلايا CD13 + CD133 + وخلايا ASGR1 +. هذا يشير إلى أن ارتفاع عدد السكان من الميتوكوندريا و ALCAM قد يحتوي على مجموعة واسعة من خلايا الكبد ذات آجال النضج المختلفة14. وبالتالي ، قد تمكن هذه الطريقة من تنقية مجموعة خلايا الكبد مع القليل من الخسارة.
كشف تحليل الأحشاء الكاملة لجنين الفأر في اليوم الجنيني 14.5 باستخدام هذه الطريقة عن تعبير ALCAM في كل من الخلايا العضلية وخلايا الكبد14. أبلغت دراسات سابقة أخرى عن تعبير ALCAM في الخلايا السلفية لعضلة القلب21. في حالة الخلايا البشرية المشتقة من الخلايا الجذعية متعددة القدرات ، تم تحديد خلايا عضلة القلب في السكان السلبيين ALCAM. تظهر هذه البيانات أن تعبير ALCAM في السلالات القلبية والكبدية يختلف باختلاف كل من الأنواع ومراحل نضج الخلية. ومع ذلك ، نظرا لارتفاع جزء الميتوكوندريا في خلايا عضلة القلب مقارنة بخلايا الكبد ، فقد نجح في الواقع في فصل نوعي الخلايا بواسطة FACS حتى من الخلايا المختلطة المشتقة من جنين الفأر الكامل. هذا يشير إلى أن الطريقة المقترحة يمكن أن تكون مفيدة لتنقية خلايا الكبد وخلايا عضلة القلب من الأنواع الحيوانية الأخرى.
من المتوقع أن تلعب تقنية تنقية خلايا الكبد الموصوفة هنا دورا محوريا في تطوير مجال الطب التجديدي من خلال التخفيف من المخاطر المحتملة لتشكيل الورم المرتبط بزرع خلايا الكبد البشرية المشتقة من الخلايا الجذعية المستحثة متعددة القدرات. ومع ذلك ، لم يتم نفي القدرة على تشكيل الورم المسخي في سكان خلايا الكبد المنقاة بهذه التقنية. يجب إجراء مزيد من الدراسات لضمان السلامة.
الخلايا الكبيرة والملتصقة مثل خلايا الكبد معرضة بشدة للتلف الميكانيكي أثناء فرز FACS ، مما يؤدي إلى فقدان كبير للخلايا القابلة للحياة. بالنسبة للتطبيقات السريرية ، من الضروري تطوير طريقة تنقية جديدة تنشئ بيئة استزراع تمكن من بقاء خلايا الكبد حصريا مثل طريقة اللاكتات لتنقية خلايا عضلة القلب22.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل وزارة التعليم والثقافة والرياضة والعلوم والتكنولوجيا رقم المنحة [23390072].
Materials
| Name | Company | Catalog Number | Comments |
| 253G1 human iPS cell line | RIKEN BioResource Research Center | HPS0002 | |
| 4% paraformaldehyde | FUJIFILM Wako Pure Chemical Corporation | 163-20145 | |
| Activin A Solution, Human, Recombinant | NACALAI TESQUE, INC. | 18585 | |
| Anti-Nuclei Antibody, clone 235-1 | Chemicon | MAB1281 | Antibody against human nuclear antigen |
| B-27 Supplement (50x), serum free | Thermo Fisher Scientific | 17504044 | |
| BD FACSAria III | BD Biosciences | Cell sorter | |
| CHIR-99021 | MedChemExpress | HY-10182 | |
| Ciclosporin A | FUJIFILM Wako Pure Chemical Corporation | 035-18961 | |
| Collagenase | FUJIFILM Wako Pure Chemical Corporation | 034-22363 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | Corning | 354230 | Gel-like basement membrane matrix |
| CultureSure Y-27632 | FUJIFILM Wako Pure Chemical Corporation | 036-24023 | ROCK inhibitor |
| Dexamethasone | FUJIFILM Wako Pure Chemical Corporation | 047-18863 | |
| Dimethyl sulfoxide (DMSO) | FUJIFILM Wako Pure Chemical Corporation | 047-29353 | |
| Donkey anti-Goat IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Thermo Fisher Scientific | A-11055 | |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 546 | Thermo Fisher Scientific | A10036 | |
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Thermo Fisher Scientific | A-21206 | |
| Falcon 5 mL Round Bottom Polystyrene Test Tube, with Cell Strainer Snap Cap | Corning | 352235 | |
| Fetal Bovine Serum | Biowest | 51820-500 | |
| GlutaMAX Supplement | Thermo Fisher Scientific | 35050061 | Dipeptide L-Alanyl-L-Glutamine |
| Human/Mouse/Rat/Canine ALCAM/CD166 Antibody | R&D Systems | AF1172 | |
| Hydrocortisone 21-hemisuccinate sodium salt | Sigma-Aldrich | H2270 | |
| iMatrix-511 silk | Nippi | 892021 | |
| ImmunoBlock | KAC | CTKN001 | Blocking solution |
| ITS-G Supplement(×100) | FUJIFILM Wako Pure Chemical Corporation | 090-06741 | |
| Leibovitz's L-15 Medium | FUJIFILM Wako Pure Chemical Corporation | 128-06075 | |
| N-Hexanoic-Try-Ile-(6)-amino Hexanoic amide (Dihexa) | Toronto Research Chemicals | H293745 | |
| Polyclonal Rabbit Anti-Human Albumin | Dako | A0001 | |
| Polyoxyethylene Sorbitan Monolaurate (Tween 20) | NACALAI TESQUE, INC. | 28353-85 | |
| RPMI-1640 | FUJIFILM Wako Pure Chemical Corporation | 189-02025 | |
| Sodium L-Ascorbate | NACALAI TESQUE, INC. | 03422-32 | |
| StemFit AK02N | REPROCELL | RCAK02N | |
| TBS (10x) | NACALAI TESQUE, INC. | 12748-31 | |
| Tetramethylrhodamine, methyl ester (TMRM) | Thermo Fisher Scientific | T668 | |
| Triton X-100 | NACALAI TESQUE, INC. | 28229-25 | |
| Trypan Blue Solution | NACALAI TESQUE, INC. | 20577-34 | |
| TRYPSIN 250 | Difco | 215240 | |
| Tryptose phosphate broth solution | Sigma-Aldrich | T8159 |
References
- Yamamoto, T., et al. Differentiation potential of pluripotent stem cells correlates to the level of CHD7. Scientific Reports. 8 (1), 241 (2018).
- Laco, F., et al. Unraveling the inconsistencies of cardiac differentiation efficiency induced by the GSK3β inhibitor CHIR99021 in human pluripotent stem cells. Stem Cell Reports. 10 (6), 1851-1866 (2018).
- Anderson, N. C., et al. Balancing serendipity and reproducibility: Pluripotent stem cells as experimental systems for intellectual and developmental disorders. Stem Cell Reports. 16 (6), 1446-1457 (2021).
- Chen, C. X. -. Q., et al. Standardized quality control workflow to evaluate the reproducibility and differentiation potential of human iPSCs into neurons. bioRxiv. , (2021).
- Duinsbergen, D., Salvatori, D., Eriksson, M., Mikkers, H. Tumors originating from induced pluripotent stem cells and methods for their prevention. Annals of the New York Academy of Sciences. 1176, 197-204 (2009).
- Nori, S., et al. Long-term safety issues of iPSC-based cell therapy in a spinal cord injury model: oncogenic transformation with epithelial-mesenchymal transition. Stem Cell Reports. 4 (3), 360-373 (2015).
- Hentze, H., et al. Teratoma formation by human embryonic stem cells: evaluation of essential parameters for future safety studies. Stem Cell Research. 2 (3), 198-210 (2009).
- Anderson, D., et al. Transgenic enrichment of cardiomyocytes from human embryonic stem cells. Molecular Therapy. 15 (11), 2027-2036 (2007).
- Hidaka, K., et al. Chamber-specific differentiation of Nkx2.5-positive cardiac precursor cells from murine embryonic stem cells. The FASEB Journal. 17 (6), 740-742 (2003).
- Gassanov, N., Er, F., Zagidullin, N., Hoppe, U. C. Endothelin induces differentiation of ANP-EGFP expressing embryonic stem cells towards a pacemaker phenotype. The FASEB Journal. 18 (14), 1710-1712 (2004).
- Duan, Y., et al. Differentiation and enrichment of hepatocyte-like cells from human embryonic stem cells in vitro and in vivo. Stem Cells. 25 (12), 3058-3068 (2007).
- Takayama, K., et al. Enrichment of high-functioning human iPS cell-derived hepatocyte-like cells for pharmaceutical research. Biomaterials. 161, 24-32 (2018).
- Hattori, F., et al. Nongenetic method for purifying stem cell-derived cardiomyocytes. Nature methods. 7, 61-66 (2009).
- Yamashita, H., Fukuda, K., Hattori, F. Hepatocyte-like cells derived from human pluripotent stem cells can be enriched by a combination of mitochondrial content and activated leukocyte cell adhesion molecule. JMA Journal. 2 (2), 174-183 (2019).
- Fernandez-Vizarra, E., Enríquez, J., Pérez-Martos, A., Montoya, J., Fernández-Silva, P. Tissue-specific differences in mitochondrial activity and biogenesis. Mitochondrion. 11, 207-213 (2010).
- Swart, G. W. M. Activated leukocyte cell adhesion molecule (CD166/ALCAM): Developmental and mechanistic aspects of cell clustering and cell migration. European Journal of Cell Biology. 81 (6), 313-321 (2002).
- Peters, D. T., et al. Asialoglycoprotein receptor 1 is a specific cell-surface marker for isolating hepatocytes derived from human pluripotent stem cells. Development. 143 (9), 1475-1481 (2016).
- Kamiya, A., Inagaki, Y. Stem and progenitor cell systems in liver development and regeneration. Hepatology Research. 45 (1), 29-37 (2015).
- Yanagida, A., Ito, K., Chikada, H., Nakauchi, H., Kamiya, A. An In vitro expansion system for generation of human ips cell-derived hepatic progenitor-like cells exhibiting a bipotent differentiation potential. PLOS One. 8 (7), e67541 (2013).
- Siller, R., Greenhough, S., Naumovska, E., Sullivan, G. J. Small-molecule-driven hepatocyte differentiation of human pluripotent stem cells. Stem Cell Reports. 4 (5), 939-952 (2015).
- Hirata, H., et al. ALCAM (CD166) is a surface marker for early murine cardiomyocytes. Cells, Tissues, Organs. 184 (3-4), 172-180 (2006).
- Tohyama, S., et al. Distinct metabolic flow enables large-scale purification of mouse and human pluripotent stem cell-derived cardiomyocytes. Cell Stem Cell. 12 (1), 127-137 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved