Method Article
Метод статической силовой тренировки для мышей с диабетом 2 типа
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол обеспечивает простой метод изготовления статического тренировочного оборудования для мышей. Устройство поддерживает изометрическое сокращение мышц конечностей мышей, чтобы проверить влияние традиционных физических упражнений на сахарный диабет 2 типа (СД2) и обеспечивает новую терапию физическими упражнениями для клинического лечения СД2.
Аннотация
Лечение сахарного диабета 2 типа (СД2) является одной из основных трудностей в улучшении здоровья пациента. Физические упражнения являются одним из основных вмешательств при СД2. Статические силовые тренировки являются одной из ключевых форм традиционных видов спорта в Китае. Исследования показывают, что статическая силовая тренировка является эффективным клиническим методом вмешательства при СД2, но экспериментального устройства, подходящего для статической тренировки на мышах, не существует. Одной из трудностей при переходе от клинических к фундаментальным исследованиям является разработка соответствующих экспериментальных устройств. С целью дальнейшего изучения механизма статического обучающего вмешательства при СД2 в данной работе представлен простой метод создания статического обучающего устройства для мышей. Это устройство обладает такими преимуществами, как простота в эксплуатации, дешевый материал и высокая практичность. Предыдущие исследования, проведенные в рамках этого протокола, показали, что статические тренировки могут эффективно снижать уровень глюкозы в крови и улучшать митохондриальную функцию клеток скелетных мышц у мышей с СД2. Цель внедрения этого устройства состоит в том, чтобы способствовать исследованию механизма традиционных физических упражнений при СД2 и заложить основу для количественного вмешательства физических упражнений.
Введение
Сахарный диабет 2 типа (СД2) — хроническое заболевание, характеризующееся инсулинорезистентностью и дисфункцией β-клеток, которое представляет собой значительную угрозу для глобального здравоохранения1. Физические упражнения являются важным вмешательством в лечение диабета 2 типа. Многочисленные исследования показали, что традиционные китайские методы физических упражнений, такие как тайцзицюань и ба дуань цзинь, значительно улучшают уровень глюкозы в крови и качество жизни у людей с СД2 2,3,4,5. Чтобы выполнить эти движения, тренер должен поддерживать устойчивое положение тела и суставов в течение определенного периода времени. Статическое положение поддерживается за счет выполнения статических сокращений мышц, которые обычно называют статической силой6.
Однако механизм вмешательства в статическую силовую тренировку при СД2 не был выяснен. Чтобы ответить на этот вопрос, необходимы эксперименты на животных. Во время изометрических упражнений мышцы активизируются, поддерживают постоянную длину и безопасно достигают максимального напряжения7. В экспериментах со статической силовой тренировкой от испытуемого животного требуется выполнение изометрических мышечных сокращений и поддержание этого состояния мышечного сокращения. Как проводить статические силовые тренировки на мышах, крысах и других лабораторных животных, стало большой проблемой в исследованиях. Во-первых, животные изо всех сил пытаются подчиняться командам и сокращать мышцы по мере необходимости. Во-вторых, животному трудно сохранять устойчивое положение при сопротивлении, а цель изометрического сокращения мышц не может быть достигнута. Позволяя животным тренироваться по мере необходимости, важно решать проблемы, связанные с благополучием животных, такие как снятие стресса и беспокойства, минимизация боли и улучшение общих условий. Этот протокол относится к модели статической тренировки крыс 8,9, и здесь мы представляем простое устройство для статической тренировки мышей. Когда задние лапы мышей подняты, их мышцы живота сокращаются за счет выпрямляющего рефлекса, передние лапы захватывают перекладину спереди, а затем передние и задние конечности сокращаются против силы тяжести. Мыши не могут двигаться после захвата короткой перекладины, в результате чего их мышцы находятся в состоянии изометрического сокращения.
протокол
Все эксперименты на животных были одобрены Комитетом по уходу за животными и их использованию Нанкинского университета китайской медицины (разрешение No 202209A033). Были отобраны здоровые самцы мышей C57BL/6J с SPF-классом, возрастом 8 недель и массой тела 20 ± 4 г. Мышей содержали в 12-часовом цикле свет/темнота при температуре 20-22 °C, при этом поддерживалась относительная влажность 45-50%. Животные едят и пьют свободно.
1. Создание мышиной модели СД2
- Сначала кормите мышей в течение 1 недели на обычном рационе и дайте им адаптироваться к новой среде животного центра. Через 1 неделю обеспечить диету с высоким содержанием жиров (состав рациона: 20,0% сала, 10,0% сахарозы, 2,5% холестерина, 1,0% холат, 66,5% обычной диеты) сроком на 4 недели.
- С1-го числа5-й недели мышам внутрибрюшинно вводят раствор стрептозотоцина в дозе 35 мг/кг каждый день в течение 3 дней подряд. Приготовьте 1 мл раствора стрептозотоцина с 10 мг порошка стрептозотоцина, с 0,1 М/л буфера цитрата натрия в качестве растворителя.
ПРИМЕЧАНИЕ: Инъекция должна быть завершена в течение 30 минут после приготовления раствора, а во время использования раствор следует хранить вдали от света. - Случайным образом проверяют уровень глюкозы в крови на 5 и 7 день после первого введения раствора стрептозотоцина. Животные с двумя случайными уровнями сахара в крови выше 16,7 мМоль/л считаются успешными моделями СД2.
- Начинайте тренировочное вмешательство на 8-й день после первого введения раствора стрептозотоцина.
2. Группировка и лечение у мышей
- Разделите мышей с СД2 на модельную группу, тренировочную группу и группу метформина методом таблицы случайных чисел, по 6 мышей в каждой группе.
- Не выполняйте вмешательство для модельной группы.
- Таблетки метформина измельчить в порошок и растворить в чистой воде. Дают метформин в группу метформинов через зонд в дозе 200 мг/кг, 1 раз в сутки, в течение 3 недель.
- Пусть тренировочная группа занимается по 30 минут статической силовой тренировки, один раз в день, 5 дней в неделю, в течение 3 недель. Тренировки проводятся с понедельника по пятницу во второй половине дня.
- Случайным образом распределите 6 мышей без СД2 в качестве контрольной группы. Эти мыши не подвергаются моделированию и вмешательству.
3. Изготовление устройства для статической силовой тренировки
- Подготовьте прозрачную акриловую доску толщиной 5 мм с размерами 20 см х 20 см. Используйте прозрачную доску для того, чтобы наблюдать за тренировкой мышей.
- Приобретите деревянные палочки диаметром 3 мм и рулон скотча шириной 1 см. С помощью ножа для бумаги отрежьте две палочки длиной 4 см и четыре палочки длиной 1 см.
- Прикрепите две палочки, каждая длиной 1 см, к концам палочки длиной 4 см с помощью ленты (рисунок 1А). Короткие палочки должны быть закреплены с той же стороны, что и длинная.
- Положите прозрачную доску на ровную поверхность и прикрепите к тарелке два набора коротких палочек по 1 см с помощью пистолета для горячего клея. Следите за тем, чтобы деревянные палочки длиной 4 см не соприкасались с доской. Оставьте зазор в 2 см между длинной палкой и доской, чтобы удерживать мышей на месте (Рисунок 1B). Пусть две длинные палочки будут выровнены и параллельны, с расстоянием между ними 6 см (Рисунок 1C).

Рисунок 1: Соберите и закрепите палочки на прозрачной доске. (A) Прикрепите палочку длиной 1 см к обоим концам палочки диаметром 4 см. (B) Используйте термоклей для соединения палочки длиной 1 см и прозрачной доски, длина зазора составляет 2 см. (C) Две палочки по 4 см расположены на расстоянии 6 см друг от друга. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
4. Статическая силовая тренировка у мышей
- Отрежьте два куска шерстяной пряжи длиной 15 см. С помощью узла завяжите кусок шерстяной пряжи на каждой верхней лодыжке мыши (Рисунок 2А).
ПРИМЕЧАНИЕ: Эластичная веревка не может зафиксировать осанку мышей, а пеньковая веревка будет утомлять лодыжки мышей, поэтому здесь выбирают неэластичную, но мягкую шерстяную пряжу. - Поставьте доску горизонтально на стол палочками вверх. Осторожно нажмите на мышь между двумя длинными джойстиками, расположив ее голову и хвост так, чтобы они совпадали с промежутками под джойстиками.
- Проденьте пряжу через зазор на конце хвоста. Затем отрегулируйте пряжу до тех пор, пока лодыжки мыши плотно не прилегают к краю палочки.
- Закрепите шерстяную пряжу лентой (Рисунок 2В). Конец шерстяной пряжи должен быть закреплен, иначе мышь будет карабкаться по упавшей шерсти. Натяните шерсть как можно туже, иначе мышь легко вырвется на свободу.
- Переверните прозрачную доску. Приобретите 2 коробки одинаковой высоты (15-20 см высотой) на обоих концах прозрачной доски. Расположите доску горизонтально на определенной высоте. Коробка расположена на обоих концах головы и хвоста мыши. Если он слишком высок, экспериментатор не сможет с ним легко справиться; Если он слишком низкий, мышь может коснуться столешницы.
- Как только доска переворачивается, мышь висит вниз головой. Из-за рефлекса выпрямления мыши сгибают живот и вытягивают передние конечности, чтобы ухватиться за задние конечности или палки. На этом этапе расположите 20-сантиметровую палочку перед мышью и осторожно направляйте ее, чтобы захватить палочку передними конечностями. Повторяйте этот процесс до тех пор, пока мышь не научится хвататься за мобильный джойстик.
- С помощью джойстика переместите переднюю конечность мыши на другую 4-сантиметровую палочку на прозрачной доске. Постоянно регулируйте угол наклона палочки, чтобы мыши могли активно захватывать неподвижную палочку длиной 4 см на доске (рисунок 2C).
- Повторите предыдущий шаг, когда мышь отпустит переднюю лапу, пока мышь не выдохнется. Через 30 минут большинство крыс не смогли поднять верхнюю часть тела и ухватиться за палку передними конечностями.
ПРИМЕЧАНИЕ: Перед проведением вмешательства необходимо провести неделю обучения мышам по привыканию. Начальная продолжительность тренировки составляет 10 минут в день, которую затем следует увеличивать на 5 минут каждый день, пока не достигнет в общей сложности 30 минут в день. - После 30 минут тренировки немедленно отпустите мышь и распутайте шерсть, чтобы предотвратить появление красных и опухших ног, вызванных длительным связыванием.
- Если после тренировки у мышей на лодыжке появились повреждения кожи, прекратите дрессировку мышей и обратитесь за ветеринарной помощью, пока лодыжка не станет здоровой.
- Некоторым мышам иногда удается освободиться благодаря интенсивной борьбе во время тренировок. Мыши борются, когда их задние лапы не были прочно зафиксированы. Чтобы избежать травм из-за борьбы, наблюдайте за мышами на протяжении всей тренировки. Когда обнаруживается, что задние конечности не закреплены прочно или мыши начинают бороться, ослабьте мышей и снова зафиксируйте.
Примечание: Предыдущие эксперименты показали, что подвешивание мышей вниз головой в течение 30 минут в день, 5 дней в неделю, не вызывает износа лодыжек, при условии, что они освобождены вовремя. Мыши могут научиться и привыкнуть к тренировке за 1-3 сеанса.

Рисунок 2: Метод фиксации у мыши. (А) Завяжите верхнюю часть лодыжки с помощью узла. (B) Конец веревки пропускается через зазор и туго натягивается, а затем фиксируется лентой. (В) Статическая силовая тренировка у мышей. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Результаты
Следуя вышеописанному протоколу, задние конечности мыши фиксируются, а передние автономно захватывают переднюю планку. Узкий диапазон движений удерживает мышь в относительно фиксированном положении. Сокращение мышц мышей можно подтвердить, прикоснувшись к мышцам живота и ног. Это согласуется с необходимостью состояния изометрического сокращения мышц в статических силовых тренировках. Тренировка мышей в соответствии с протоколом, с увеличением времени обучения, поможет мышам адаптироваться к тренировке, одновременно снижая их желание бороться. Борьбы за побег можно избежать.
Влияние на уровень глюкозы и инсулина в крови у мышей с СД2
В общей сложности 24 мыши C57BL/6J были случайным образом разделены на контрольную группу (n=6) и модельную группу T2DM (n=18). Затем мыши с СД2 были случайным образом разделены на модельную группу, тренировочную группу и группу метформина. В контрольной группе не проводилось моделирование или вмешательство, а мышам в модельной группе не проводилось никакого вмешательства. Мыши в тренировочной группе получали 30 минут статической силовой тренировки один раз в день, 5 дней в неделю в течение 3 недель. Мышам в группе метформина давали метформин в дозе 200 мг/кг один раз в сутки в течение 3 недель. Результаты измерения уровня глюкозы в крови натощак (ОБРГ) через 3 недели вмешательства показаны на рисунке 3А. Как видно из рисунка, уровни FBG у мышей модели T2DM были значительно выше, чем у контрольных мышей. Мыши, обученные статическому обучению, показали значительно более низкие уровни FBG по сравнению с модельной группой, что позволяет предположить, что статическое обучение эффективно в снижении FBG у мышей с СД2. Уровни инсулина в сыворотке крови натощак (FINS) в модельной группе были значительно ниже, чем в контрольной группе, как показано на рисунке 3В. В тренировочной группе и группе метформина уровни FINS увеличились по сравнению с модельной группой. На рисунке 3C мыши в модельной группе имели значительно более высокий индекс инсулинорезистентности (HOMA-IR), чем в контрольной группе, в то время как HOMA-IR в группах статического обучения и метформина был значительно ниже, чем в модельной группе, что свидетельствует об их эффективности в облегчении состояния инсулинорезистентности у мышей с СД2. Эти результаты показывают, что стратегия статической силовой тренировки, обеспечиваемая этим режимом, имеет схожие эффекты с метформином в регулировании уровня глюкозы в крови мышей с СД2.
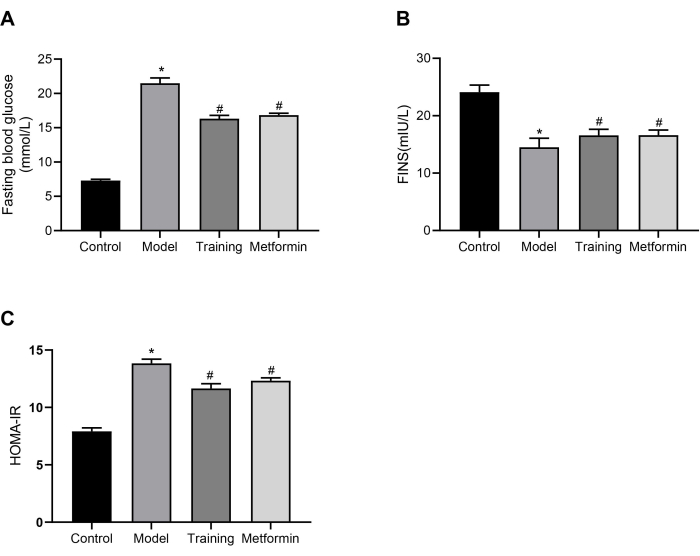
Рисунок 3: Уровень сахара в крови и уровень инсулина. (A) Сравнение уровня глюкозы в крови натощак у мышей с СД2 после 3 недель вмешательства. * p <0,05 против контрольной группы, # p <0,05 против модельной группы. (Б) Сравнение уровней инсулина в сыворотке крови натощак у мышей с СД2 после 3 недель вмешательства. * p <0,05 против контрольной группы, # p <0,05 против модельной группы. (В) Сравнение индекса инсулинорезистентности у мышей с СД2 после 3 недель вмешательства. * p <0,05 против контрольной группы, # p <0,05 против модельной группы. Для статистического анализа был проведен односторонний дисперсионный анализ (ANOVA). Количественные данные выражаются в виде среднего ± SEM (n=6). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Влияние на скелетную мускулатуру у мышей с СД2
Икроножную мышцу мышей наблюдали методом просвечивающей электронной микроскопии. По сравнению с контрольными мышами миоциты скелетных мышц мышей с СД2 были дегенерированы, структура миофибрилл была рыхлой, а расположение саркомеров неравномерным (рис. 4А, Б). После статической тренировки, описанной в протоколе, на рисунке 4C показана плотная структура миогенных волокон в мышечной структуре и симметричное расположение локальных мышечных сегментов. Это говорит о том, что статические силовые тренировки могут регулировать морфологию скелетных мышц у мышей с СД2. С другой стороны, у икроножных мышц контрольных мышей митохондрии были локально распределены, с неповрежденными мембранами, и местами разделенными или слитыми митохондриями (обозначены красными стрелками). Точно так же в скелетных мышцах мышей после статических силовых тренировок количество митохондрий в норме; Некоторые из них явно сросшиеся или разделенные (красная стрелка). В модели СД2 у мышей, напротив, количество митохондрий меньше, а активность низкая. (См. Рисунок 4) Это говорит о том, что статические силовые тренировки могут влиять на функцию митохондрий и активность в клетках скелетных мышц.

Рисунок 4: Влияние статической тренировки на скелетные мышцы мышей с СД2. (А) Контрольная группа; (Б) модельная группа СД2; (В) Стационарная учебная группа. Буква М представляет митохондрии. Белые масштабные линейки представляют 50 мкм, а красные — 10 мкм. Нижнее изображение представляет собой частичное увеличение верхнего изображения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Статические силовые тренировки могут уменьшить накопление жира, помочь похудеть и ускорить метаболизм8. Кроме того, он усиливает экспрессию PGC-1α и митохондриальный биогенез в клетках скелетных мышц, что приводит к улучшению метаболизма глюкозы у мышей с сахарным диабетом 2 типа и последующему снижению уровня глюкозы в крови11. Для подтверждения влияния и механизма статической тренировки на СД2 необходимо разработать соответствующие устройства для проведения статической тренировки на экспериментальных животных.
Этот протокол представляет собой устройство для статической тренировки у мышей. Необходимое оборудование, такое как акриловые пластины, палочки, шерстяная пряжа и пистолеты для горячего клея, легко доступно, а метод производства прост и легок. Это позволяет эффективно снизить стоимость эксперимента и повысить его осуществимость и повторяемость. Поддержание фиксированного положения мышей во время тренировки может быть сложной задачей при разработке статического тренировочного устройства. В этом протоколе ножки мыши можно закрепить на передней части маленькой палочки, затянув мягкую шерсть. Рефлекс выпрямления заставляет мышь наклонять верхнюю часть тела вверх, тем самым позволяя ей захватывать переднюю планку передними лапами. Планка короткая, ограничивающая амплитуду движений для передних лап. После двух-трех сеансов адаптивной дрессировки мыши смогли сохранить стабильную осанку. Из-за ограниченной силы передних лап мыши часто теряют сцепление с перекладиной. Экспериментаторам необходимо все время наблюдать за мышами, чтобы помочь им ухватиться перекладиной передними конечностями и предотвратить случайное травмирование мышей. Благодаря тренировке мыши могут сохранять фиксированное положение в течение 1-2 минут за раз, повторяя это несколько раз, в течение примерно 30 минут после истощения. Когда мыши были истощены, они больше не переворачивали брюшко и не поднимали передние лапы. Когда мышь направлялась палкой, чтобы схватиться передними лапами, мышь могла хватать, но ее верхняя часть тела не могла повернуться вверх. Развяжите узел как можно скорее после того, как уложите мышей, что может эффективно избежать отека лодыжки и износа.
Предварительные эксперименты показывают, что после периода статического обучения уровень глюкозы в крови у мышей с СД2 значительно снизился по сравнению с контрольной группой модельных мышей. Скелетные мышцы являются важнейшим компонентом в периферическом метаболизме глюкозы и необходимы для поддержания гомеостаза глюкозы в крови12. Анализ электронной микроскопии показал, что тяжелая дегенерация произошла в икроножных клетках мышей с СД2, в то время как статическая тренировка смягчает дегенерацию мышечной ткани. Эти результаты свидетельствуют о том, что статическая тренировка может быть вовлечена в регуляцию функции скелетных мышц. Исследования показали, что поддержание функции скелетных мышц в значительной степени зависитот митохондриальной динамики. Мы наблюдали заметное снижение количества митохондрий и отсутствие митохондриальной активности в мышечных клетках икроножной мышцы модельной группы мышей с СД2 по сравнению с дикими мышами и мышами со статическими упражнениями. Эти результаты свидетельствуют о том, что статические тренировки могут способствовать функции скелетных мышц за счет улучшения митохондриальной функции в клетках скелетных мышц. На основании приведенных выше экспериментальных результатов можно определить, что статическая тренировка может значительно повысить метаболизм глюкозы и инсулина в крови у мышей с СД2. Механизм вмешательства может быть связан с регуляцией митохондриальной функции скелетных мышц путем статической тренировки.
Этот протокол имеет некоторые ограничения. Первоначально было трудно связать задние конечности мышей по отдельности одним человеком, так как для этого требовалось, чтобы один человек захватывал задние ноги, в то время как другой выполнял связывание. С некоторыми корректировками и повышением мастерства со стороны экспериментатора, мыши стали более податливыми. Это позволяло самостоятельно связывать задние лапы. Кроме того, мягкая шерсть может уменьшить синяки на лодыжках мышей.
В заключение, этот протокол предусматривает простой метод изготовления статического тренировочного оборудования для мышей. Точно так же можно сделать простое статическое тренировочное оборудование для крыс, увеличив размеры досок и палочек. Устройство может поддерживать изометрическое сокращение мышц конечностей мышей, чтобы проверить влияние традиционных китайских упражнений на СД2 и обеспечить свежий взгляд на клиническое лечение СД2.
Раскрытие информации
Авторы заявляют, что им нечего раскрывать.
Благодарности
Эта работа была поддержана вторым пакетом специальных научно-исследовательских проектов Национальной клинической исследовательской базы традиционной китайской медицины (JDZX2015127, на базе Больницы китайской медицины провинции Аньхой).
Материалы
| Name | Company | Catalog Number | Comments |
| Acrylic boards | Transparent acrylic boards with 5mm thickness. The size should be larger than 20cm×20cm | ||
| Boxes | Two boxes of the same height (15~20cm) | ||
| ELISA KIT | H203-1-2 | Nanjing Jiancheng Bioengineering Institute | |
| Hot melt glue gun | Avoid touching the gun head to cause burns | ||
| Knives | No special requirement | ||
| Metformin tablets | 1396309 | Sigma | |
| scissors | No special requirement | ||
| Sticks | Several wooden sticks with a diameter of 3mm | ||
| Streptozotocin | S0130 | Sigma | |
| Tape | No special requirement | ||
| Transmission Electron Microscope (TEM) | HT7700 | HITACHI |
Ссылки
- Zheng, Y., Ley, S. H., Hu, F. B. Global aetiology and epidemiology of type 2 diabetes mellitus and its complications. Nat Rev Endocrino. 14 (2), 88-98 (2018).
- Li, X., et al. Effects of fitness qigong and tai chi on middle-aged and elderly patients with type 2 diabetes mellitus. Public Lib Sci. 15 (12), e0243989 (2020).
- Qin, J., et al. Effect of tai chi on quality of life, body mass index, and waist-hip ratio in patients with type 2 diabetes mellitus: A systematic review and meta-analysis. Front Endocrino. 11, 543627 (2020).
- Yang, H., Wu, X., Wang, M. Effect of conventional medical treatment plus Qigong exercise on type 2 diabetes mellitus in Chinese patients: A Meta-analysis. J Trad Chinese Med. 38 (2), 167-174 (2018).
- Yu, X., Chau, J. P. C., Huo, L. The effectiveness of traditional Chinese medicine-based lifestyle interventions on biomedical, psychosocial, and behavioral outcomes in individuals with type 2 diabetes: A systematic review with meta-analysis. Int J Nurs Stud. 80, 165-180 (2018).
- Ağgön, E., et al. Effect of dynamic and static strength training on hormonal activity in elite boxers. Baltic J Health Phys Activity. 12 (3), 1-10 (2020).
- Merico, A., et al. Effects of combined endurance and resistance training in Amyotrophic Lateral Sclerosis: A pilot, randomized, controlled study. Eur J Translat Myo. 28 (1), 7278 (2018).
- Liu, Y., et al. Eight weeks of high-intensity interval static strength training improves skeletal muscle atrophy and motor function in aged rats via the PGC-1α/FNDC5/UCP1 pathway. Clin Interven Aging. 16, 811-821 (2021).
- Jun, X., et al. Animal model for static massage training. Massage Guid. (02), 5-6 (2000).
- Wei, J., et al. Mechanism by which static exercise improves insulin resistance in skeletal muscle of type 2 diabetes. Chinese J Tiss Eng Res. 28 (08), 1271-1276 (2024).
- Zhenrui, L., Fang, L., Wu, W., Huang, J. The effect of static training on upper limb motor ability in aged rats was studied based on PGC-1α signal pathway RNA interference. Lishizhen Medicine and Materia Medica Research. 30 (01), 247-249 (2019).
- Lee, S. H., Park, S. Y., Choi, C. S. Insulin resistance: From mechanisms to therapeutic strategies. Diab Metab J. 46 (1), 15-37 (2022).
- Campos, J. C., et al. Exercise preserves physical fitness during aging through AMPK and mitochondrial dynamics. Proc Natl Acad Sci U S A. 120 (2), e2204750120 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены