Method Article
Méthode d’entraînement en force statique pour les souris diabétiques de type 2
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole fournit une méthode simple pour fabriquer des équipements d’entraînement statique pour les souris. L’appareil maintient la contraction isométrique musculaire des membres des souris afin de vérifier l’effet d’intervention de l’exercice traditionnel sur le diabète de type 2 (DT2) et fournit une nouvelle thérapie par l’exercice pour le traitement clinique du DT2.
Résumé
Le traitement du diabète sucré de type 2 (DT2) est une difficulté majeure pour améliorer la santé des patients. L’exercice est l’une des principales interventions pour le DT2. L’entraînement en force statique est l’une des principales formes de sports traditionnels en Chine. La recherche montre que l’entraînement en force statique est une méthode clinique efficace pour l’intervention contre le DT2, mais il n’existe aucun dispositif expérimental adapté à l’entraînement statique chez la souris. L’une des difficultés du passage de la recherche clinique à la recherche fondamentale est de concevoir des dispositifs expérimentaux adaptés. Afin d’étudier plus en détail le mécanisme de l’intervention d’entraînement statique dans le DT2, une méthode simple de fabrication d’un dispositif d’entraînement statique pour les souris est présentée dans cet article. Cet appareil présente les avantages d’un fonctionnement simple, d’un matériau bon marché et d’une grande faisabilité. Des études antérieures menées dans le cadre de ce protocole ont montré que l’entraînement statique peut réduire efficacement la glycémie et améliorer la fonction mitochondriale des cellules musculaires squelettiques chez les souris T2DM. L’objectif de l’introduction de ce dispositif est de promouvoir la recherche sur le mécanisme de l’exercice traditionnel dans l’intervention du DT2 et de jeter les bases de l’intervention quantitative de l’exercice.
Introduction
Le diabète sucré de type 2 (DT2) est une maladie chronique caractérisée par une résistance à l’insuline et un dysfonctionnement des cellules β qui constitue une menace importante pour la santé mondiale1. L’exercice est une intervention cruciale dans la prise en charge du diabète de type 2. De nombreuses études ont montré que les méthodes d’exercice traditionnelles chinoises, telles que le Tai Chi et le Ba Duan Jin, améliorent considérablement la glycémie et la qualité de vie des personnes atteintes de DT2 2,3,4,5. Pour exécuter ces mouvements, l’entraîneur doit maintenir une position stable du corps et des articulations pendant un certain temps. La position statique est maintenue en effectuant des contractions musculaires statiques, ce que l’on appelle communément la force statique6.
Cependant, le mécanisme d’intervention de l’entraînement en force statique dans le DT2 n’a pas été clarifié. Pour répondre à cette question, l’expérimentation animale est indispensable. Pendant les exercices isométriques, les muscles sont activés, maintiennent une longueur constante et atteignent en toute sécurité une tension maximale7. Dans les expériences d’entraînement à la force statique, l’animal d’essai doit effectuer des contractions musculaires isométriques et maintenir cet état de contraction musculaire. La mise en œuvre d’un entraînement de force statique sur des souris, des rats et d’autres animaux de laboratoire est devenue un gros problème dans la recherche. Tout d’abord, les animaux ont du mal à obéir aux ordres et à contracter leurs muscles au besoin. Deuxièmement, il est difficile pour l’animal de maintenir une position stable sous la résistance, et l’objectif de la contraction musculaire isométrique ne peut pas être atteint. Tout en laissant les animaux s’entraîner au besoin, il est important de répondre aux préoccupations liées au bien-être des animaux, telles que le soulagement du stress et de l’anxiété, la minimisation de la douleur et l’amélioration des conditions générales. Ce protocole se rapporte à un modèle d’entraînement statique pour les rats 8,9, et nous présentons ici un dispositif simple pour l’entraînement statique des souris. Lorsque les pattes arrière des souris sont levées, leurs muscles abdominaux se contractent en raison du réflexe de redressement, les pattes avant saisissent la barre transversale à l’avant, puis les membres avant et arrière se contractent contre la gravité. Les souris ne peuvent pas bouger après avoir saisi la barre courte, ce qui fait que leurs muscles sont dans un état de contraction isométrique.
Protocole
Toutes les expériences sur les animaux ont été approuvées par le Comité de soin et d’utilisation des animaux de l’Université de médecine chinoise de Nanjing (autorisation n° 202209A033). Des souris mâles C57BL/6J en bonne santé, âgées de 8 semaines et pesant entre 20 ± 4 g ont été sélectionnées. Les souris ont été logées dans un cycle lumière/obscurité de 12 heures à une température de 20-22 °C, et une humidité relative de 45 % à 50 % a été maintenue. Les animaux mangent et boivent librement.
1. Etablissement d’un modèle murin de DT2
- Nourrissez d’abord les souris pendant 1 semaine avec un régime régulier et laissez les souris s’adapter au nouvel environnement du centre animalier. Après 1 semaine, fournissez un régime riche en graisses (composition de l’alimentation : 20,0% de saindoux, 10,0% de saccharose, 2,5% de cholestérol, 1,0% de cholate, 66,5% de régime conventionnel) pendant une période de 4 semaines.
- À partir du 1erjour de la 5ème semaine, injecter par voie intrapéritonéale à des souris une solution de streptozotocine à une dose de 35 mg/kg chaque jour pendant 3 jours consécutifs. Préparez 1 mL de solution de streptozotocine avec 10 mg de poudre de streptozotocine, avec 0,1 M/L de tampon de citrate de sodium comme solvant.
REMARQUE : L’injection doit être terminée dans les 30 minutes suivant la préparation de la solution et la solution doit être conservée à l’abri de la lumière pendant l’utilisation. - Testez au hasard la glycémie le jour 5 et le jour 7 après l’administration de la première injection de solution de streptozotocine. Les animaux dont la glycémie est supérieure à 16,7 mM/L sont considérés comme des modèles de DT2 réussis.
- Commencer l’intervention d’entraînement le jour 8 après la première injection de solution de streptozotocine.
2. Groupage et traitement chez la souris
- Divisez les souris DT2 en un groupe modèle, un groupe d’entraînement et un groupe de metformine à l’aide de la méthode de la table de nombres aléatoires, avec 6 souris dans chaque groupe.
- N’effectuez aucune intervention pour le groupe modèle.
- Broyer les comprimés de metformine en poudre et les dissoudre dans de l’eau pure. Donnez de la metformine au groupe metformine par gavage à une dose de 200 mg / kg, une fois par jour, pendant 3 semaines.
- Laissez le groupe d’entraînement faire 30 minutes d’entraînement de force statique, une fois par jour, 5 jours par semaine, pendant 3 semaines. La formation a lieu du lundi au vendredi après-midi.
- Attribuez au hasard 6 souris non T2DM comme groupe témoin. Ces souris ne subissent pas de modélisation et d’intervention.
3. Fabrication de l’appareil de musculation statique
- Préparez un panneau acrylique transparent de 5 mm d’épaisseur aux dimensions de 20 cm x 20 cm. Utilisez une planche transparente afin d’observer l’entraînement des souris.
- Procurez-vous des bâtons en bois d’un diamètre de 3 mm et un rouleau de ruban adhésif d’une largeur de 1 cm. À l’aide d’un coupe-papier, coupez deux bâtonnets de 4 cm de long et quatre bâtonnets de 1 cm de long.
- Fixez deux bâtonnets d’une longueur de 1 cm chacun aux extrémités d’un bâton d’une longueur de 4 cm à l’aide de ruban adhésif (Figure 1A). Les bâtons courts doivent être fixés du même côté que le bâton long.
- Placez la planche transparente sur une surface plane et fixez deux jeux de bâtonnets courts de 1 cm à la plaque à l’aide d’un pistolet à colle chaude. Assurez-vous que les bâtonnets en bois de 4 cm n’entrent pas en contact avec la planche. Laissez un espace de 2 cm entre le long bâton et la planche pour maintenir les souris en place (Figure 1B). Laissez les deux longs bâtons être alignés et parallèles, avec une distance de 6 cm entre eux (Figure 1C).

Figure 1 : Assemblez et fixez les bâtonnets au panneau transparent. (A) Collez le bâton de 1 cm aux deux extrémités du bâton de 4 cm. (B) Utilisez un adhésif thermofusible pour relier le bâton de 1 cm de long et le panneau transparent, et la longueur de l’espace est de 2 cm. (C) Deux bâtonnets de 4 cm espacés de 6 cm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Entraînement de la force statique chez la souris
- Coupez deux morceaux de fil de laine de 15 cm de long. À l’aide d’un noeud coulant, attachez un morceau de fil de laine sur la partie supérieure de la cheville de la souris (figure 2A).
REMARQUE : La corde élastique ne peut pas fixer la posture des souris, et la corde de chanvre portera les chevilles des souris, donc un fil de laine inélastique mais doux est choisi ici. - Placez la planche horizontalement sur la table avec les bâtons vers le haut. Appuyez soigneusement sur la souris entre deux longs bâtons, en positionnant sa tête et sa queue pour qu’elles s’alignent avec les espaces sous les bâtons.
- Passez le fil dans l’espace à l’extrémité de la queue. Ensuite, ajustez le fil jusqu’à ce que les chevilles de la souris s’ajustent parfaitement contre le bord du bâton.
- Fixez le fil de laine avec du ruban adhésif (Figure 2B). L’extrémité du fil de laine doit être sécurisée, sinon la souris grimpera sur la laine tombée. Tirez la laine aussi fort que possible ou la souris se libérera facilement.
- Retournez le panneau transparent. Placez 2 boîtes de la même hauteur (15-20 cm de haut) à chaque extrémité de la planche transparente. Placez la planche horizontalement à une certaine hauteur. La boîte est située à chaque extrémité de la tête et de la queue de la souris. S’il est trop élevé, l’expérimentateur ne pourra pas le manipuler facilement ; S’il est trop bas, la souris peut toucher le dessus de la table.
- Une fois le plateau renversé, la souris se suspend à l’envers. En raison du réflexe de redressement, les souris courbent leur abdomen et étendent leurs membres antérieurs pour saisir leurs membres postérieurs ou leurs bâtons. À ce stade, placez un bâton de 20 cm devant la souris et guidez-la soigneusement pour saisir le bâton avec ses membres antérieurs. Répétez le processus jusqu’à ce que la souris devienne capable de saisir le stick mobile.
- Utilisez le bâton pour déplacer le membre antérieur de la souris vers un autre bâton de 4 cm sur la planche transparente. Ajustez constamment l’angle du bâton pour permettre aux souris de saisir activement le bâton fixe de 4 cm sur la planche (Figure 2C).
- Répétez l’étape précédente pendant que la souris relâche la patte avant jusqu’à ce que la souris soit épuisée. Après 30 minutes, la plupart des rats étaient incapables de soulever le haut de leur corps et de saisir le bâton avec leurs membres antérieurs.
REMARQUE : Avant de mettre en œuvre l’intervention, une semaine d’entraînement à l’habituation sur les souris est nécessaire. La durée de l’entraînement initial est de 10 minutes par jour, qui doit ensuite être augmentée de 5 minutes chaque jour jusqu’à atteindre un total de 30 minutes par jour. - Après 30 min d’entraînement, relâchez immédiatement la souris et démêlez la laine pour éviter les pieds rouges et enflés causés par un bandage prolongé.
- Si des lésions cutanées apparaissent sur la cheville des souris après l’entraînement, arrêtez de dresser les souris et consultez un vétérinaire jusqu’à ce que la cheville soit en bonne santé.
- Certaines souris peuvent parfois réussir à se libérer grâce à une lutte intense pendant l’entraînement. Les souris se débattent lorsque leurs pattes arrière n’étaient pas fermement fixées. Pour éviter les blessures dues à la lutte, observez les souris tout au long de l’entraînement. Lorsqu’il est constaté que les membres postérieurs ne sont pas fermement fixés ou que les souris commencent à se débattre, desserrez les souris et fixez-les à nouveau.
REMARQUE : Des expériences antérieures ont montré que le fait de suspendre des souris à l’envers pendant 30 minutes par jour, 5 jours par semaine, ne provoque pas d’usure de la cheville, à condition qu’elles soient libérées en temps voulu10. Les souris peuvent apprendre et s’habituer à l’entraînement en 1 à 3 séances.

Figure 2 : Méthode de fixation chez la souris. (A) Attachez le haut de la cheville avec un nœud coulant. (B) L’extrémité de la corde est passée dans l’espace et tirée fermement, puis fixée avec du ruban adhésif. (C) Entraînement de la force statique chez la souris. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
En suivant le protocole ci-dessus, les membres postérieurs de la souris sont fixes et les membres antérieurs saisissent de manière autonome la barre avant. L’amplitude de mouvement étroite maintient la souris dans une position relativement fixe. Il peut être confirmé que les muscles des souris se contractent en touchant les muscles de leur abdomen et de leurs pattes. Ceci est cohérent avec la nécessité de l’état de contraction musculaire isométrique dans l’entraînement de force statique. L’entraînement des souris selon le protocole, avec l’augmentation des temps d’entraînement, aidera les souris à s’adapter à l’entraînement tout en réduisant leur désir de lutter. Une lutte pour s’échapper peut être évitée.
Effets sur la glycémie et le taux d’insuline chez les souris DT2
Au total, 24 souris C57BL/6J ont été divisées au hasard dans le groupe témoin (n = 6) et le groupe modèle T2DM (n = 18). Les souris T2DM ont ensuite été divisées au hasard dans le groupe modèle, le groupe d’entraînement et le groupe de metformine. Aucune modélisation ou intervention n’a été donnée au groupe témoin, et aucune intervention n’a été donnée aux souris du groupe modèle. Les souris du groupe d’entraînement ont reçu 30 minutes d’entraînement de force statique une fois par jour, 5 jours par semaine pendant 3 semaines. Les souris du groupe metformine ont reçu de la metformine à raison de 200 mg/kg une fois par jour pendant 3 semaines. Les résultats de la glycémie à jeun (FBG) après 3 semaines d’intervention sont présentés à la figure 3A. Comme on peut le voir sur la figure, les niveaux de FBG des souris modèles T2DM étaient significativement plus élevés que ceux des souris témoins. Les souris entraînées à l’entraînement statique ont montré des niveaux de FBG significativement plus faibles par rapport au groupe modèle, ce qui suggère que l’entraînement statique est efficace pour réduire les FBG chez les souris T2DM. Les taux d’insuline sérique à jeun (FINS) dans le groupe modèle étaient significativement plus faibles que dans le groupe témoin, comme le montre la figure 3B. Dans les groupes d’entraînement et de metformine, les niveaux de FINS ont augmenté par rapport au groupe modèle. Dans la figure 3C, les souris du groupe modèle avaient un indice de résistance à l’insuline (HOMA-IR) significativement plus élevé que celles du groupe témoin, tandis que l’HOMA-IR des groupes d’entraînement statique et de metformine était significativement inférieur à celui du groupe modèle, démontrant leur efficacité à atténuer l’état de résistance à l’insuline des souris T2DM. Ces résultats montrent que la stratégie d’entraînement en force statique fournie par ce régime a des effets similaires à ceux de la metformine dans la régulation de la glycémie des souris DT2.
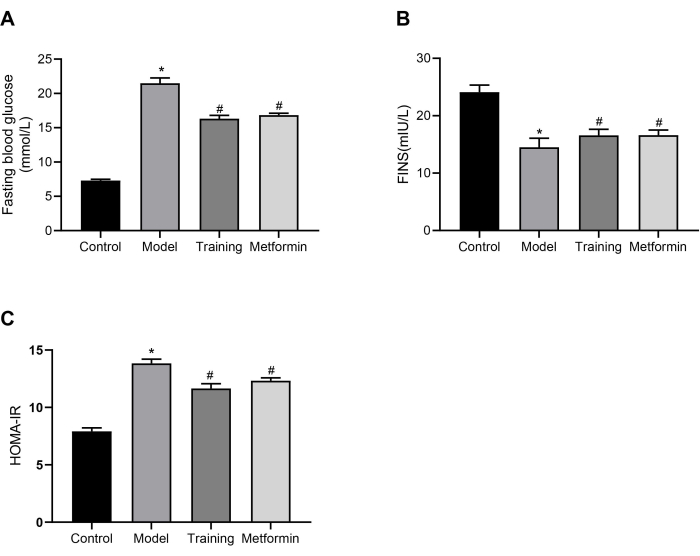
Figure 3 : Taux de sucre dans le sang et d’insuline. (A) Comparaison de la glycémie à jeun chez les souris DT2 après 3 semaines d’intervention. * p <0,05 par rapport au groupe témoin, # p <0,05 par rapport au groupe modèle. (B) Comparaison des taux d’insuline sérique à jeun chez les souris DT2 après 3 semaines d’intervention. * p <0,05 par rapport au groupe témoin, # p <0,05 par rapport au groupe modèle. (C) Comparaison de l’indice de résistance à l’insuline chez les souris DT2 après 3 semaines d’intervention. * p <0,05 par rapport au groupe témoin, # p <0,05 par rapport au groupe modèle. Une analyse de variance à un facteur (ANOVA) a été effectuée pour l’analyse statistique. Les données quantitatives sont exprimées en moyenne ± MEB (n = 6). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Effets sur les muscles squelettiques chez les souris DT2
Le gastrocnémien de souris a été observé par microscopie électronique à transmission. Par rapport aux souris témoins, les myocytes des muscles squelettiques des souris DT2 étaient dégénérés, la structure des myofibrilles était lâche et la disposition des sarcomères était irrégulière (Figure 4A, B). Après l’entraînement statique décrit dans le protocole, la figure 4C montre la structure serrée des fibres myogéniques dans la structure musculaire et la disposition symétrique des segments musculaires locaux. Cela suggère que l’entraînement en force statique peut réguler la morphologie des muscles squelettiques chez les souris T2DM. D’autre part, chez le gastrocnémien des souris témoins, les mitochondries étaient localement distribuées, avec des membranes intactes, et des mitochondries localement divisées ou fusionnées (indiquées par des flèches rouges). De même, dans le muscle squelettique des souris après un entraînement de force statique, le nombre de mitochondries est normal ; Certains d’entre eux sont manifestement fusionnés ou divisés (flèche rouge). Dans le modèle T2DM chez la souris, en revanche, le nombre de mitochondries est inférieur et l’activité est faible. (Voir la figure 4) Cela suggère que l’entraînement en force statique peut affecter la fonction mitochondriale et l’activité des cellules musculaires squelettiques.

Figure 4 : Effet de l’entraînement statique sur le muscle squelettique de souris DT2. (A) Groupe témoin ; (B) groupe de modèles DT2 ; (C) Groupe d’entraînement statique. Les M représentent les mitochondries. Les barres d’échelle blanches représentent 50 m et les barres d’échelle rouges représentent 10 m. L’image du bas est un agrandissement partiel de l’image du haut. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
L’entraînement en force statique peut réduire l’accumulation de graisse, aider à perdre du poids et augmenter le métabolisme. De plus, il améliore l’expression de PGC-1α et la biogenèse mitochondriale dans les cellules musculaires squelettiques, ce qui entraîne une amélioration du métabolisme du glucose chez les souris atteintes de diabète sucré de type 2 et une réduction conséquente de la glycémie11. Pour confirmer l’impact et le mécanisme de l’entraînement statique sur le DT2, des dispositifs appropriés doivent être développés pour effectuer l’entraînement statique sur des animaux de laboratoire.
Ce protocole introduit un dispositif d’entraînement statique chez la souris. L’équipement requis, tel que des plaques acryliques, des bâtons, du fil de laine et des pistolets à colle chaude, est facilement disponible, et la méthode de production est simple et facile. Cela peut réduire efficacement le coût de l’expérience et augmenter sa faisabilité et sa répétabilité. Le maintien d’une position fixe pour les souris pendant l’entraînement peut être difficile lors de la conception d’un dispositif d’entraînement statique. Dans ce protocole, les pieds de la souris peuvent être fixés à l’avant du petit bâton en resserrant la laine douce. Le réflexe de redressement fait plier le haut du corps de la souris vers le haut, ce qui lui permet de saisir la barre devant avec ses pattes avant. La barre est courte, ce qui limite l’amplitude de mouvement des pattes avant. Après deux ou trois séances d’entraînement adaptatif, les souris ont pu maintenir une posture stable. En raison de la force limitée des pattes avant, les souris perdent souvent leur prise sur la barre transversale. Il est nécessaire pour les expérimentateurs de surveiller les souris tout le temps afin de les aider à saisir la barre transversale avec leurs membres antérieurs et à prévenir les souris de blessures accidentelles. Grâce à l’entraînement, les souris peuvent maintenir une position fixe pendant 1 à 2 minutes à la fois, répétée plusieurs fois, pendant environ 30 minutes après l’épuisement. Lorsqu’elles étaient épuisées, les souris ne roulaient plus leur abdomen ou ne levaient plus leurs pattes avant. Lorsque la souris était guidée par le bâton pour saisir avec ses pattes avant, la souris pouvait saisir, mais le haut de son corps était incapable de se tourner vers le haut. Défaites le nœud dès que possible après avoir abattu les souris, ce qui peut éviter efficacement l’œdème et l’usure de la cheville.
Des expériences préliminaires indiquent qu’après une période d’entraînement statique, le taux de glucose dans le sang des souris DT2 a diminué de manière significative par rapport au groupe témoin de souris modèles. Le muscle squelettique est un composant essentiel du métabolisme périphérique du glucose et est essentiel au maintien de l’homéostasie de la glycémie12. Les analyses en microscopie électronique ont indiqué qu’une dégénérescence sévère s’est produite dans les cellules gastrocnémiennes des souris DT2, tandis que l’entraînement statique a permis d’atténuer la dégénérescence des tissus musculaires. Ces résultats suggèrent que l’entraînement statique peut être impliqué dans la régulation de la fonction des muscles squelettiques. Des recherches ont montré que le maintien de la fonction musculaire squelettique est considérablement affecté par la dynamique mitochondriale13. Nous avons observé une réduction marquée du nombre de mitochondries et un manque d’activité mitochondriale dans les cellules musculaires gastrocnémiennes du groupe modèle de souris T2DM par rapport aux souris sauvages et aux souris d’exercice statique. Ces résultats suggèrent que l’entraînement statique peut favoriser la fonction musculaire squelettique en améliorant la fonction mitochondriale dans les cellules musculaires squelettiques. Sur la base des résultats expérimentaux précédents, il peut être déterminé que l’entraînement statique peut améliorer considérablement le métabolisme de la glycémie et de l’insuline chez les souris DT2. Le mécanisme d’intervention peut être lié à la régulation de la fonction mitochondriale du muscle squelettique par l’entraînement statique.
Ce protocole présente certaines limitations. Initialement, il était difficile de lier individuellement les membres postérieurs des souris par une seule personne, car il fallait qu’un individu saisisse les pattes arrière pendant qu’un autre effectuait la liaison. Avec quelques ajustements et une habileté croissante de la part de l’expérimentateur, les souris sont devenues plus dociles. Cela permettait de lier indépendamment les pattes arrière. De plus, la laine douce peut réduire les ecchymoses aux chevilles des souris.
En conclusion, ce protocole fournit une méthode simple pour fabriquer des équipements d’entraînement statique pour les souris. De même, un équipement d’entraînement statique simple pour les rats peut être fabriqué en augmentant la taille des planches et des bâtons. L’appareil peut maintenir la contraction isométrique musculaire des membres des souris afin de vérifier l’effet d’intervention de l’exercice traditionnel chinois sur le DT2 et d’offrir une nouvelle perspective pour le traitement clinique du DT2.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par le deuxième lot de projets de recherche scientifique spéciaux de la Base nationale de recherche clinique de la médecine traditionnelle chinoise (JDZX2015127, basée sur l’hôpital provincial de médecine chinoise de l’Anhui).
matériels
| Name | Company | Catalog Number | Comments |
| Acrylic boards | Transparent acrylic boards with 5mm thickness. The size should be larger than 20cm×20cm | ||
| Boxes | Two boxes of the same height (15~20cm) | ||
| ELISA KIT | H203-1-2 | Nanjing Jiancheng Bioengineering Institute | |
| Hot melt glue gun | Avoid touching the gun head to cause burns | ||
| Knives | No special requirement | ||
| Metformin tablets | 1396309 | Sigma | |
| scissors | No special requirement | ||
| Sticks | Several wooden sticks with a diameter of 3mm | ||
| Streptozotocin | S0130 | Sigma | |
| Tape | No special requirement | ||
| Transmission Electron Microscope (TEM) | HT7700 | HITACHI |
Références
- Zheng, Y., Ley, S. H., Hu, F. B. Global aetiology and epidemiology of type 2 diabetes mellitus and its complications. Nat Rev Endocrino. 14 (2), 88-98 (2018).
- Li, X., et al. Effects of fitness qigong and tai chi on middle-aged and elderly patients with type 2 diabetes mellitus. Public Lib Sci. 15 (12), e0243989(2020).
- Qin, J., et al. Effect of tai chi on quality of life, body mass index, and waist-hip ratio in patients with type 2 diabetes mellitus: A systematic review and meta-analysis. Front Endocrino. 11, 543627(2020).
- Yang, H., Wu, X., Wang, M. Effect of conventional medical treatment plus Qigong exercise on type 2 diabetes mellitus in Chinese patients: A Meta-analysis. J Trad Chinese Med. 38 (2), 167-174 (2018).
- Yu, X., Chau, J. P. C., Huo, L. The effectiveness of traditional Chinese medicine-based lifestyle interventions on biomedical, psychosocial, and behavioral outcomes in individuals with type 2 diabetes: A systematic review with meta-analysis. Int J Nurs Stud. 80, 165-180 (2018).
- Ağgön, E., et al. Effect of dynamic and static strength training on hormonal activity in elite boxers. Baltic J Health Phys Activity. 12 (3), 1-10 (2020).
- Merico, A., et al. Effects of combined endurance and resistance training in Amyotrophic Lateral Sclerosis: A pilot, randomized, controlled study. Eur J Translat Myo. 28 (1), 7278(2018).
- Liu, Y., et al. Eight weeks of high-intensity interval static strength training improves skeletal muscle atrophy and motor function in aged rats via the PGC-1α/FNDC5/UCP1 pathway. Clin Interven Aging. 16, 811-821 (2021).
- Jun, X., et al. Animal model for static massage training. Massage Guid. (02), 5-6 (2000).
- Wei, J., et al. Mechanism by which static exercise improves insulin resistance in skeletal muscle of type 2 diabetes. Chinese J Tiss Eng Res. 28 (08), 1271-1276 (2024).
- Zhenrui, L., Fang, L., Wu, W., Huang, J. The effect of static training on upper limb motor ability in aged rats was studied based on PGC-1α signal pathway RNA interference. Lishizhen Medicine and Materia Medica Research. 30 (01), 247-249 (2019).
- Lee, S. H., Park, S. Y., Choi, C. S. Insulin resistance: From mechanisms to therapeutic strategies. Diab Metab J. 46 (1), 15-37 (2022).
- Campos, J. C., et al. Exercise preserves physical fitness during aging through AMPK and mitochondrial dynamics. Proc Natl Acad Sci U S A. 120 (2), e2204750120(2023).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon