Method Article
제2형 당뇨병 마우스를 위한 정적 근력 훈련 방법
요약
이 프로토콜은 마우스를 위한 정적 훈련 장비를 만드는 간단한 방법을 제공합니다. 이 장치는 제2형 당뇨병(T2DM)에 대한 전통적인 운동의 중재 효과를 검증하기 위해 쥐 팔다리의 근육 등척성 수축을 유지하고 T2DM의 임상 치료를 위한 새로운 운동 요법을 제공합니다.
초록
제2형 당뇨병(T2DM)의 치료는 환자의 건강을 개선하는 데 큰 어려움입니다. 운동은 T2DM을 위한 주요 중재 중 하나입니다. 정적 근력 운동은 중국 전통 스포츠의 핵심 형태 중 하나입니다. 연구에 따르면 정적 근력 운동은 T2DM 중재에 효과적인 임상 방법이지만 마우스의 정적 훈련에 적합한 실험 장치는 없습니다. 임상 연구에서 기초 연구로 전환하는 데 있어 어려움 중 하나는 적절한 실험 장치를 설계하는 것입니다. T2DM에서 static training intervention의 메커니즘을 더 자세히 연구하기 위해 이 논문에서는 마우스를 위한 static training device를 만드는 간단한 방법을 소개합니다. 이 장치는 간단한 조작, 저렴한 재료 및 높은 실현 가능성의 장점이 있습니다. 이 프로토콜에 따라 수행된 이전 연구는 정적 훈련이 혈당 수치를 효과적으로 낮추고 T2DM 마우스에서 골격근 세포의 미토콘드리아 기능을 향상시킬 수 있음을 보여주었습니다. 이 장치를 소개하는 목적은 T2DM의 중재에서 전통적인 운동의 메커니즘에 대한 연구를 촉진하고 운동의 정량적 중재를 위한 기반을 마련하는 것입니다.
서문
제2형 당뇨병(T2DM)은 인슐린 저항성과 세포 β 기능 장애를 특징으로 하는 만성 질환으로 전 세계 건강에 심각한 위협이 됩니다1. 운동은 제2형 당뇨병 관리에 중요한 중재입니다. 수많은 연구에 따르면 태극권 및 Ba Duan Jin과 같은 전통적인 중국 운동 방법은 T2DM 2,3,4,5 환자의 혈당 수치와 삶의 질을 크게 향상시키는 것으로 나타났습니다. 이러한 동작을 수행하기 위해 트레이너는 일정 시간 동안 안정적인 몸과 관절 위치를 유지해야 합니다. 정적 자세는 일반적으로 정적 강도6라고 하는 정적 근육 수축을 수행하여 유지된다.
그러나 T2DM에서 정적 근력 훈련 중재의 메커니즘은 명확하지 않았습니다. 이 질문에 답하기 위해서는 동물 실험이 필수적입니다. 등척성 운동을 하는 동안에는 근육이 활성화되고 일정한 길이가 유지되며 안전하게 최대 장력을 얻을 수 있다7. 정적 근력 훈련을 이용한 실험에서, 실험 동물은 등척성 근육 수축을 수행하고 이러한 근육 수축 상태를 유지해야 합니다. 생쥐, 쥐 및 기타 실험실 동물에게 정적 근력 훈련을 구현하는 방법은 연구에서 큰 문제가 되었습니다. 첫째, 동물들은 명령에 복종하고 필요에 따라 근육을 수축하는 데 어려움을 겪습니다. 둘째, 동물이 저항 하에서 안정적인 자세를 유지하기 어렵고 등척성 근육 수축의 목적을 달성할 수 없습니다. 필요에 따라 동물을 훈련시키는 동시에 스트레스와 불안 완화, 통증 최소화, 전반적인 상태 개선과 같은 동물 복지와 관련된 우려 사항을 해결하는 것이 중요합니다. 이 프로토콜은 쥐 8,9에 대한 정적 훈련 모델과 관련이 있으며, 여기에서는 쥐의 정적 훈련을 위한 간단한 장치를 소개합니다. 쥐의 뒷다리를 들어 올리면 오른쪽 반사로 인해 복부 근육이 수축하고 앞발은 앞의 크로스바를 잡은 다음 앞다리와 뒷다리가 중력에 대해 수축합니다. 쥐는 짧은 막대를 잡은 후에는 움직일 수 없어 근육이 등척성 수축 상태에 있습니다.
프로토콜
모든 동물 실험은 Nanjing University of Chinese Medicine 동물 관리 및 사용 위원회(허가 번호 202209A033)의 승인을 받았습니다. SPF 등급, 생후 8주, 체중 20 ± 4g의 건강한 수컷 C57BL/6J 마우스를 선택했습니다. 마우스는 20-22 °C의 온도에서 12 시간 밝음/어두운 주기로 수용되었으며, 45%-50%의 상대 습도를 유지하였다. 동물들은 자유롭게 먹고 마신다.
1. T2DM 마우스 모델 구축의 건
- 먼저 규칙적인 식단으로 1주일 동안 쥐에게 먹이를 주고 쥐가 동물 센터의 새로운 환경에 적응하도록 합니다. 1주일 후 4주 동안 고지방 식단(식단 구성: 라드 20.0%, 자당 10.0%, 콜레스테롤 2.5%, 콜레이트 1.0%, 일반 식단 66.5%)을 제공합니다.
- 5주차의 1일째부터 연속 3일 동안 매일 35mg/kg의 용량으로 마우스에 스트렙토조토신 용액을 복강내 주사합니다. 스트렙토조토신 용액 1mL와 스트렙토조토신 분말 10mg을 준비하고 0.1M/L 구연산나트륨 완충액을 용매로 사용합니다.
알림: 용액 준비 후 30분 이내에 주입을 완료해야 하며 용액은 사용 중 빛으로부터 멀리 보관해야 합니다. - 스트렙토조토신 용액을 처음 주입한 후 5일째와 7일째에 혈당을 무작위로 테스트합니다. 두 가지 무작위 혈당 수치가 16.7mM/L보다 높은 동물은 성공적인 T2DM 모델로 간주됩니다.
- 스트렙토조토신 용액의 첫 번째 주사 후 8일째에 훈련 개입을 시작합니다.
2. 생쥐의 그룹화 및 처리
- T2DM 마우스를 난수 테이블 방법을 사용하여 모델 그룹, 훈련 그룹, 메트포르민 그룹으로 나누고 각 그룹에 6마리의 마우스를 배치합니다.
- 모델 그룹에 대해 개입을 수행하지 않습니다.
- 메트포르민 정제를 가루로 갈아 순수한 물에 녹입니다. 메트포르민군에 200mg/kg의 용량으로 1일 1회, 3주 동안 투여한다.
- 훈련 그룹이 3주 동안 하루에 한 번, 일주일에 5일, 30분 동안 정적 근력 운동을 하도록 합니다. 교육은 매주 월요일부터 금요일 오후까지 진행됩니다.
- T2DM이 아닌 마우스 6개를 대조군으로 무작위로 할당합니다. 이 마우스는 모델링 및 개입을 거치지 않습니다.
3. 정적 근력 훈련 장치 제조
- 20cm x 20cm 크기의 5mm 두께의 투명 아크릴 판을 준비합니다. 쥐 훈련을 관찰하기 위해 투명 보드를 사용하십시오.
- 지름 3mm의 나무 막대기와 너비 1cm의 테이프 롤을 가져옵니다. 종이 커터를 사용하여 4cm 길이의 막대기 2개와 1cm 길이의 막대기 4개를 자릅니다.
- 테이프를 사용하여 길이가 각각 1cm인 막대기 두 개를 길이가 4cm인 막대기 끝에 붙입니다(그림 1A). 짧은 막대기는 긴 막대기와 같은 쪽에 고정해야 합니다.
- 투명 보드를 평평한 표면에 놓고 뜨거운 글루건을 사용하여 1cm 짧은 스틱 두 세트를 플레이트에 부착합니다. 4cm 나무 막대기가 보드에 닿지 않도록 하십시오. 긴 막대와 보드 사이에 2cm의 간격을 두어 마우스를 제자리에 고정합니다(그림 1B). 두 개의 긴 막대기를 6cm의 거리를 두고 정렬하고 평행하게 합니다(그림 1C).

그림 1: 스틱을 조립하고 투명 보드에 고정합니다. (A) 1cm 스틱의 양쪽 끝에 4cm 스틱을 테이프로 붙입니다. (B) 핫멜트 접착제를 사용하여 1cm 길이의 스틱과 투명 보드를 연결하고 간격 길이는 2cm입니다. (C) 4cm 스틱 2개를 6cm 간격으로 배치합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 생쥐의 정적 근력 훈련
- 모사 두 개를 15cm 길이로 자릅니다. 슬립매듭을 사용하여 마우스의 양쪽 발목 위쪽에 모직 실 조각을 묶습니다(그림 2A).
참고 : 탄성 로프는 생쥐의 자세를 고정 할 수 없으며 대마 로프는 생쥐의 발목을 착용하므로 여기서는 탄력성이 없지만 부드러운 모사를 선택합니다. - 막대기를 위로 하여 보드를 테이블 위에 수평으로 놓습니다. 두 개의 긴 스틱 사이로 마우스를 조심스럽게 눌러 머리와 꼬리를 스틱 아래의 틈에 맞춥니다.
- 꼬리 끝의 틈을 통해 실을 통과시킵니다. 그런 다음 마우스의 발목이 스틱 가장자리에 꼭 맞을 때까지 실을 조정합니다.
- 모사를 테이프로 고정합니다(그림 2B). 모직물의 끝은 고정되어 있어야하며, 그렇지 않으면 마우스가 떨어진 양모를 기어 올라갑니다. 양모를 가능한 한 꽉 당기지 않으면 마우스가 쉽게 부러집니다.
- 투명 보드를 반전시킵니다. 투명 보드의 양쪽 끝에 같은 높이(높이 15-20cm)의 상자 2개를 가져옵니다. 보드를 특정 높이에 수평으로 놓습니다. 상자는 쥐의 머리와 꼬리 양쪽 끝에 있습니다. 너무 높으면 실험자가 쉽게 처리할 수 없습니다. 너무 낮으면 마우스가 테이블 상판에 닿을 수 있습니다.
- 보드가 뒤집히면 마우스가 거꾸로 매달려 있습니다. righting 반사로 인해 쥐는 복부를 말리고 앞다리를 뻗어 뒷다리나 막대기를 잡습니다. 이 단계에서 마우스 앞에 20cm 스틱을 놓고 앞다리로 스틱을 잡도록 조심스럽게 안내합니다. 마우스가 모바일 스틱을 잡는 데 능숙해질 때까지 이 과정을 반복합니다.
- 스틱을 사용하여 마우스의 앞다리를 투명 보드의 다른 4cm 스틱으로 이동합니다. 마우스가 보드에 고정된 4cm 스틱을 능동적으로 잡을 수 있도록 스틱의 각도를 지속적으로 조정합니다(그림 2C).
- 마우스가 소진될 때까지 마우스가 앞발을 놓을 때 이전 단계를 반복합니다. 30분이 지나자 대부분의 쥐들은 상체를 들어 올리지 못하고 앞다리로 막대기를 잡을 수 없었다.
참고: 중재를 시행하기 전에 생쥐에 대한 일주일의 습관화 훈련이 필요합니다. 초기 훈련 시간은 하루에 10분이며, 그 후에는 매일 5분씩 늘려 하루에 총 30분에 도달해야 합니다. - 30분의 훈련 후 즉시 마우스를 놓고 엉킨 양모를 풀어 장시간의 바인딩으로 인해 발이 빨갛게 붓는 것을 방지하십시오.
- 훈련 후 쥐의 발목에 피부 병변이 나타나면 쥐 훈련을 중단하고 발목이 건강해질 때까지 수의학 전문 치료를 받으십시오.
- 일부 쥐는 때때로 훈련 중 격렬한 투쟁을 통해 스스로를 해방시킬 수 있습니다. 쥐는 뒷다리가 단단히 고정되지 않았을 때 어려움을 겪습니다. 몸부림으로 인한 부상을 방지하려면 훈련 내내 쥐를 관찰하십시오. 뒷다리가 단단히 고정되지 않았거나 쥐가 힘들어하기 시작하면 쥐를 풀고 다시 고정하십시오.
참고 : 이전 실험에 따르면 일주일에 5 일, 하루에 30 분 동안 쥐를 거꾸로 매달아 놓으면 발목이 마모되지 않습니다10. 생쥐는 1-3 세션으로 배우고 훈련에 익숙해질 수 있습니다.

그림 2: 마우스의 고정 방법. (A) 발목 상단을 슬립매듭으로 묶습니다. (B) 로프의 끝은 틈을 통과하여 단단히 잡아 당긴 다음 테이프로 고정합니다. (C) 생쥐의 정적 근력 훈련. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
위의 프로토콜에 따라 쥐의 뒷다리는 고정되고 앞다리는 앞 막대를 자율적으로 잡습니다. 좁은 동작 범위는 마우스를 상대적으로 고정된 위치에 유지합니다. 생쥐의 근육은 복부와 다리의 근육을 만짐으로써 수축하는 것을 확인할 수 있습니다. 이것은 정적 근력 운동에서 이소 투영 근육 수축 상태에 대한 필요성과 일치합니다. 훈련 시간이 증가함에 따라 프로토콜에 따라 마우스를 훈련시키면 생쥐가 훈련에 적응하는 동시에 투쟁하려는 욕구를 줄이는 데 도움이 됩니다. 탈출하려는 몸부림은 피할 수 있습니다.
T2DM 마우스의 혈당 및 인슐린 수치에 미치는 영향
총 24마리의 C57BL/6J 마우스를 대조군(n=6)과 T2DM 모델군(n=18)으로 무작위로 나누었다. 그런 다음 T2DM 마우스를 모델 그룹, 훈련 그룹 및 메트포르민 그룹으로 무작위로 나눴습니다. 대조군에는 모델링이나 중재가 제공되지 않았으며, 모델 그룹의 마우스에는 어떠한 중재도 제공되지 않았습니다. 훈련 그룹의 쥐는 3 주 동안 일주일에 5 일, 하루에 한 번 30 분의 정적 강도 훈련을 받았습니다. 메트포르민 그룹의 마우스에게 3주 동안 하루에 한 번 메트포르민 200mg/kg을 투여했습니다. 중재 3주 후 공복 혈당(FBG)의 결과는 그림 3A에 나와 있습니다. 그림에서 알 수 있듯이, T2DM 모델 마우스의 FBG 수준은 대조 마우스보다 유의하게 높았다. 정적 훈련으로 훈련된 마우스는 모델 그룹에 비해 FBG 수준이 현저히 낮았으며, 이는 정적 훈련이 T2DM 마우스의 FBG를 줄이는 데 효과적임을 시사합니다. 모델 그룹의 공복 혈청 인슐린(FINS) 수치는 그림 3B와 같이 대조군보다 유의하게 낮았습니다. 훈련 그룹과 메트포르민 그룹에서는 모델 그룹에 비해 FINS 수치가 증가했습니다. 그림 3C에서 모델 그룹의 마우스는 대조군의 마우스보다 인슐린 저항성 지수(HOMA-IR)가 유의하게 높았지만, 정적 훈련 그룹과 메트포르민 그룹의 HOMA-IR은 모델 그룹보다 유의하게 낮았으며, 이는 T2DM 마우스의 인슐린 저항성 상태를 완화하는 데 효능이 있음을 입증했습니다. 이러한 결과는 이 요법이 제공하는 정적 근력 운동 전략이 T2DM 마우스의 혈당 수치를 조절하는 데 메트포르민과 유사한 효과가 있음을 보여줍니다.
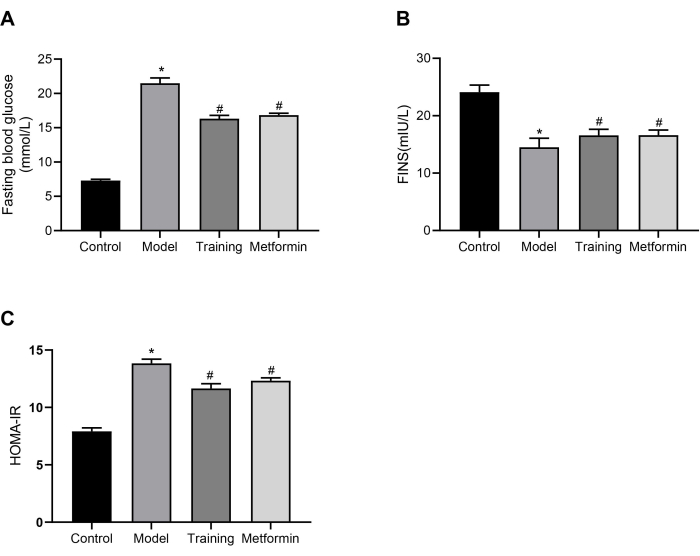
그림 3: 혈당과 인슐린 수치. (A) 개입 3주 후 T2DM 마우스의 공복 혈당 수치 비교. * p <0.05 vs. 대조군, # p <0.05 vs. 모델 그룹. (B) 개입 3주 후 T2DM 마우스의 공복 혈청 인슐린 수치 비교. * p <0.05 vs. 대조군, # p <0.05 vs. 모델 그룹. (C) 개입 3주 후 T2DM 마우스의 인슐린 저항성 지수 비교. * p <0.05 vs. 대조군, # p <0.05 vs. 모델 그룹. 통계 분석을 위해 일원 분산 분석(ANOVA)을 수행했습니다. 정량적 데이터는 평균± SEM(n=6)으로 표현됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
T2DM 마우스의 골격근에 미치는 영향
생쥐의 비복근은 투과 전자 현미경으로 관찰되었습니다. 대조군 마우스와 비교했을 때, T2DM 마우스의 골격근 근세포는 퇴화되었고, 근섬유의 구조는 느슨했으며, 육종 배열이 불규칙했습니다(그림 4A, B). 프로토콜에 설명된 정적 훈련 후, 그림 4C 는 근육 구조에서 근육 섬유의 단단한 구조와 국소 근육 분절의 대칭 배열을 보여줍니다. 이는 정적 근력 운동이 T2DM 마우스의 골격근 형태를 조절할 수 있음을 시사합니다. 반면에, 대조군 마우스의 비복근에서 미토콘드리아는 온전한 막과 함께 국부적으로 분포되어 있었고, 국부적으로 분할되거나 융합된 미토콘드리아(빨간색 화살표로 표시)가 있었습니다. 유사하게, 정적 근력 운동 후 생쥐의 골격근에서 미토콘드리아의 수는 정상입니다. 그들 중 일부는 분명히 융합되거나 분할되어 있습니다(빨간색 화살표). 대조적으로, 마우스의 T2DM 모델에서는 미토콘드리아의 수가 더 적고 활성이 낮습니다. ( 그림 4 참조) 이는 정적 근력 운동이 미토콘드리아 기능과 골격근 세포의 활동에 영향을 미칠 수 있음을 시사합니다.

그림 4: T2DM 마우스의 골격근에 대한 정적 훈련의 효과. (A) 대조군; (B) T2DM 모델 그룹; (C) 정적 훈련 그룹. M은 미토콘드리아를 나타냅니다. 흰색 눈금 막대는 50μm를 나타내고 빨간색 눈금 막대는 10μm를 나타냅니다. 아래 이미지는 위쪽 이미지를 부분적으로 확대한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
정적 근력 운동은 지방 축적을 줄이고 체중 감량을 도우며 신진대사를 증가시킬 수 있습니다8. 또한 골격근 세포에서 PGC-1α 및 미토콘드리아 생물 발생의 발현을 향상시켜 제2형 당뇨병이 있는 마우스의 포도당 대사를 개선하고 결과적으로 혈당 수치를 감소시킵니다11. static training이 T2DM에 미치는 영향과 기전을 확인하기 위해서는 실험동물에 대한 static training을 수행하기 위한 적절한 장치를 개발해야 합니다.
이 프로토콜은 마우스의 정적 훈련을 위한 장치를 소개합니다. 아크릴 판, 막대기, 모사, 핫 글루건과 같은 필요한 장비를 쉽게 구할 수 있으며 생산 방법이 간단하고 쉽습니다. 이를 통해 실험 비용을 효과적으로 절감하고 타당성과 반복성을 높일 수 있습니다. 훈련 중에 마우스의 고정 위치를 유지하는 것은 정적 훈련 장치를 설계할 때 어려울 수 있습니다. 이 프로토콜에서 쥐의 발은 부드러운 양모를 조여 작은 막대기 앞쪽에 고정할 수 있습니다. righting reflex는 마우스가 상체를 위쪽으로 구부려 앞발로 앞의 막대를 잡을 수 있도록 합니다. 바가 짧아서 앞발의 운동 범위가 제한됩니다. 두세 차례의 적응 훈련 후, 생쥐들은 안정적인 자세를 유지할 수 있었다. 앞발의 제한된 힘으로 인해 쥐는 종종 크로스바를 잡을 수 없게 됩니다. 실험자는 앞다리로 크로스바를 잡고 쥐가 우발적으로 부상을 입는 것을 방지하기 위해 쥐를 내내 모니터링해야 합니다. 훈련을 통해 쥐는 한 번에 1-2분 동안 고정된 위치를 유지할 수 있으며, 지친 후 약 30분 동안 여러 번 반복할 수 있습니다. 지쳤을 때, 쥐들은 더 이상 배를 굴리거나 앞다리를 들어 올리지 않았다. 생쥐가 막대기로 앞발로 잡도록 안내했을 때, 생쥐는 잡을 수 있었지만 상체는 위로 돌릴 수 없었다. 쥐를 내려 놓은 후 가능한 한 빨리 매듭을 풀면 발목 부종과 마모를 효과적으로 방지 할 수 있습니다.
예비 실험에 따르면 일정 기간의 정적 훈련 후 T2DM 마우스의 혈당 수준은 모델 마우스의 대조군과 비교할 때 크게 감소했습니다. 골격근은 말초 포도당 대사에 중요한 구성 요소이며 혈당 항상성을 유지하는 데 필수적입니다12. 전자 현미경 분석 결과, T2DM 마우스의 비복세포에서 심각한 퇴화가 발생했으며, 정적 훈련은 근육 조직 퇴화를 완화하는 것으로 나타났습니다. 이러한 발견은 정적 훈련이 골격근 기능의 조절과 관련이 있을 수 있음을 시사합니다. 연구에 따르면 골격근 기능을 유지하는 것은 미토콘드리아 역학에 의해 크게 영향을 받는다13. 우리는 야생 마우스 및 정적 운동 마우스에 비해 T2DM 마우스 모델 그룹의 비복근 세포에서 미토콘드리아의 수가 현저히 감소하고 미토콘드리아 활동이 부족한 것을 관찰했습니다. 이러한 발견은 정적 훈련이 골격근 세포의 미토콘드리아 기능을 향상시켜 골격근 기능을 촉진할 수 있음을 시사합니다. 선행의 실험 결과를 바탕으로, 정적 훈련이 T2DM 마우스에서 혈당 및 인슐린 대사를 상당히 향상시킬 수 있음을 확인할 수 있다. 중재 메커니즘은 정적 훈련에 의한 골격근 미토콘드리아 기능의 조절과 연결될 수 있습니다.
이 프로토콜에는 몇 가지 제한 사항이 있습니다. 처음에는 한 사람이 쥐의 뒷다리를 개별적으로 묶는 데 어려움이 있었는데, 한 개체가 뒷다리를 잡고 다른 개체가 묶는 작업을 수행해야 했기 때문입니다. 약간의 조정과 실험자의 기술 향상으로, 쥐들은 더 순응적이 되었다. 이것은 뒷다리를 독립적으로 묶을 수있게 해주었습니다. 또한 부드러운 양모는 쥐의 발목에 있는 멍을 줄일 수 있습니다.
결론적으로, 이 프로토콜은 마우스를 위한 정적 훈련 장비를 만드는 간단한 방법을 제공합니다. 마찬가지로, 쥐를 위한 간단한 정적 훈련 장비는 보드와 막대기의 크기를 늘려 만들 수 있습니다. 이 장치는 생쥐 팔다리의 근육 등척성 수축을 유지하여 T2DM에 대한 중국 전통 운동의 중재 효과를 검증하고 T2DM의 임상 치료에 대한 새로운 관점을 제공할 수 있습니다.
공개
저자는 공개할 것이 없다고 선언합니다.
감사의 말
이 연구는 중국 전통 의학 국가 임상 연구 기지 (JDZX2015127, Anhui Provincial Hospital of Chinese Medicine에 기반)의 두 번째 특별 과학 연구 프로젝트의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Acrylic boards | Transparent acrylic boards with 5mm thickness. The size should be larger than 20cm×20cm | ||
| Boxes | Two boxes of the same height (15~20cm) | ||
| ELISA KIT | H203-1-2 | Nanjing Jiancheng Bioengineering Institute | |
| Hot melt glue gun | Avoid touching the gun head to cause burns | ||
| Knives | No special requirement | ||
| Metformin tablets | 1396309 | Sigma | |
| scissors | No special requirement | ||
| Sticks | Several wooden sticks with a diameter of 3mm | ||
| Streptozotocin | S0130 | Sigma | |
| Tape | No special requirement | ||
| Transmission Electron Microscope (TEM) | HT7700 | HITACHI |
참고문헌
- Zheng, Y., Ley, S. H., Hu, F. B. Global aetiology and epidemiology of type 2 diabetes mellitus and its complications. Nat Rev Endocrino. 14 (2), 88-98 (2018).
- Li, X., et al. Effects of fitness qigong and tai chi on middle-aged and elderly patients with type 2 diabetes mellitus. Public Lib Sci. 15 (12), e0243989(2020).
- Qin, J., et al. Effect of tai chi on quality of life, body mass index, and waist-hip ratio in patients with type 2 diabetes mellitus: A systematic review and meta-analysis. Front Endocrino. 11, 543627(2020).
- Yang, H., Wu, X., Wang, M. Effect of conventional medical treatment plus Qigong exercise on type 2 diabetes mellitus in Chinese patients: A Meta-analysis. J Trad Chinese Med. 38 (2), 167-174 (2018).
- Yu, X., Chau, J. P. C., Huo, L. The effectiveness of traditional Chinese medicine-based lifestyle interventions on biomedical, psychosocial, and behavioral outcomes in individuals with type 2 diabetes: A systematic review with meta-analysis. Int J Nurs Stud. 80, 165-180 (2018).
- Ağgön, E., et al. Effect of dynamic and static strength training on hormonal activity in elite boxers. Baltic J Health Phys Activity. 12 (3), 1-10 (2020).
- Merico, A., et al. Effects of combined endurance and resistance training in Amyotrophic Lateral Sclerosis: A pilot, randomized, controlled study. Eur J Translat Myo. 28 (1), 7278(2018).
- Liu, Y., et al. Eight weeks of high-intensity interval static strength training improves skeletal muscle atrophy and motor function in aged rats via the PGC-1α/FNDC5/UCP1 pathway. Clin Interven Aging. 16, 811-821 (2021).
- Jun, X., et al. Animal model for static massage training. Massage Guid. (02), 5-6 (2000).
- Wei, J., et al. Mechanism by which static exercise improves insulin resistance in skeletal muscle of type 2 diabetes. Chinese J Tiss Eng Res. 28 (08), 1271-1276 (2024).
- Zhenrui, L., Fang, L., Wu, W., Huang, J. The effect of static training on upper limb motor ability in aged rats was studied based on PGC-1α signal pathway RNA interference. Lishizhen Medicine and Materia Medica Research. 30 (01), 247-249 (2019).
- Lee, S. H., Park, S. Y., Choi, C. S. Insulin resistance: From mechanisms to therapeutic strategies. Diab Metab J. 46 (1), 15-37 (2022).
- Campos, J. C., et al. Exercise preserves physical fitness during aging through AMPK and mitochondrial dynamics. Proc Natl Acad Sci U S A. 120 (2), e2204750120(2023).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유