Method Article
2型糖尿病マウスに対する静的筋力トレーニング法
要約
このプロトコルは、マウス用の静的トレーニング機器を作成する簡単な方法を提供します。本装置は、マウスの四肢の筋等尺性収縮を維持することで、従来の運動による2型糖尿病(T2DM)への介入効果を検証し、2型糖尿病の臨床治療に新たな運動療法を提供します。
要約
2型糖尿病(T2DM)の治療は、患者の健康を改善する上で大きな困難です。運動は、2型糖尿病の主な介入の1つです。静的筋力トレーニングは、中国の伝統的なスポーツの主要な形態の1つです。研究によると、静的筋力トレーニングは T2DM 介入の効果的な臨床方法ですが、マウスでの静的トレーニングに適した実験装置はありません。臨床研究から基礎研究に移行する際の難しさの一つが、適切な実験装置を設計することです。T2DMにおける静的トレーニング介入のメカニズムをさらに研究するために、この論文ではマウス用の静的トレーニングデバイスを作成するための簡単な方法を紹介します。このデバイスには、操作が簡単で、材料が安く、実現性が高いという利点があります。このプロトコルの下で実施された以前の研究では、静的トレーニングが T2DM マウスの血糖値を効果的に下げ、骨格筋細胞のミトコンドリア機能を改善することが示されています。本装置の導入は、伝統的な運動がT2DMの介入に及ぼすメカニズムの研究を推進し、運動の定量的介入の基礎を築くことを目的としています。
概要
2型糖尿病(T2DM)は、インスリン抵抗性とβ細胞機能障害を特徴とする慢性疾患であり、世界の健康に対する重大な脅威です1。運動は、2型糖尿病の管理における重要な介入です。多くの研究により、太極拳やBa Duan Jinなどの伝統的な中国の運動方法が、2型糖尿病2,3,4,5の個人の血糖値と生活の質を大幅に改善することが示されています。これらの動きを実行するには、トレーナーは一定時間安定した体と関節の位置を維持する必要があります。静的な位置は、一般に静的な強度6と呼ばれる静的な筋肉の収縮を行うことによって維持されます。
しかし、T2DMにおける静的筋力トレーニング介入のメカニズムは明らかにされていません。この問いに答えるためには、動物実験が欠かせません。等尺性運動中、筋肉は活性化され、一定の長さを維持し、安全に最大張力を達成します7。静的筋力トレーニングの実験では、試験動物は等尺性筋収縮を行い、この筋収縮状態を維持することが求められます。マウスやラットなどの実験動物に対して、静的筋力トレーニングをどのように実施するかは、研究において大きな問題となっています。まず、動物は命令に従うのに苦労し、必要に応じて筋肉を収縮させます。第二に、動物が抵抗下で安定した位置を維持することは困難であり、等尺性筋収縮の目的は達成できない。必要に応じて動物に訓練を任せる一方で、ストレスや不安の緩和、痛みの最小化、全体的な状態の改善など、動物福祉に関連する懸念に対処することが重要です。このプロトコルは、ラット8,9の静的学習モデルに関するもので、ここではマウスの静的学習のための簡単なデバイスを紹介する。マウスの後肢を持ち上げると、直立反射によって腹筋が収縮し、前足が前のクロスバーをつかみ、次に前肢と後肢が重力に逆らって収縮します。マウスは短いバーをつかむと動くことができず、その結果、筋肉は等尺性収縮状態になります。
プロトコル
すべての動物実験は、南京中医薬大学の動物管理および使用委員会によって承認されました(許可番号202209A033)。健康な雄C57BL/6Jマウス、SPFグレード、8週齢、体重20±4gのマウスを選抜しました。マウスを20〜22°Cの温度で12時間の明暗サイクルで飼育し、相対湿度45%〜50%を維持しました。動物たちは自由に食べたり飲んだりします。
1. T2DMのマウスモデルの確立
- 最初にマウスに通常の食事で1週間餌を与え、マウスを動物センターの新しい環境に適応させます。1週間後、高脂肪食(食事組成:ラード20.0%、スクロース10.0%、コレステロール2.5%、チョレート1.0%、従来の食事66.5%)を4週間提供します。
- 5週目の1日目から、マウスにストレプトゾトシン溶液を毎日35 mg / kgの用量で3日間連続して腹腔内注射します。.1 mLのストレプトゾトシン溶液を10 mgのストレプトゾトシン粉末で調製し、溶媒として0.1 M / Lクエン酸ナトリウム緩衝液を使用します。
注:注入は溶液を調製してから30分以内に完了し、使用中は溶液を光から遠ざける必要があります。. - ストレプトゾトシン溶液の最初の注射が投与された後、5日目と7日目に血糖値をランダムにテストします。ランダムな血糖値が16.7 mM/Lを超える2つの動物は、成功したT2DMモデルと見なされます。
- ストレプトゾトシン溶液の最初の注射後8日目にトレーニング介入を開始します。
2. マウスでのグループ化と治療
- 乱数表法を用いて、T2DMマウスをモデル群、学習群、メトホルミン群に分け、各群に6匹のマウスを配置します。
- モデル・グループに対して介入は実行しません。
- メトホルミン錠剤を粉末に粉砕し、純水に溶解します。メトホルミンをメトホルミン群に200 mg / kgの用量で1日1回、3週間強制経口投与します。.
- トレーニンググループに、1日1回、週5日、3週間、30分間の静的筋力トレーニングを行わせます。トレーニングは毎週月曜日から金曜日の午後に開催されます。
- 6 匹の非 T2DM マウスをコントロールグループとしてランダムに割り当てます。これらのマウスはモデリングと介入を受けません。
3. 静的筋力トレーニング装置の製造
- 厚さ5mm、寸法20cm×20cmの透明アクリル板を用意します。透明なボードを使用して、マウスのトレーニングを観察します。
- 直径3 mmの木の棒と幅1 cmのテープのロールを入手します。ペーパーカッターを使って、長さ4cmの棒2本と長さ1cmの棒4本を切ります。
- 長さ1cmのスティック2本を、長さ4cmのスティックの端にテープで取り付けます(図1A)。短いスティックは、長いスティックと同じ側に固定する必要があります。
- 透明ボードを平らな面に置き、ホットグルーガンを使用して1cmの短いスティックを2セットプレートに取り付けます。4cmの木の棒がボードに接触しないようにしてください。マウスを所定の位置に保持するために、長いスティックとボードの間に2cmの隙間を空けます(図1B)。2本の長いスティックを、それらの間に6cmの距離を空けて、位置を合わせて平行にします(図1C)。

図1:スティックを組み立てて透明ボードに固定します。 (A)1cmスティックを4cmスティックの両端にテープで固定します。(B)ホットメルト接着剤を使用して、長さ1cmのスティックと透明ボードを接続、ギャップの長さは2cm、(C)6cm間隔で2本の4cmスティックを接続します。 この図の拡大版を表示するには、ここをクリックしてください。
4. マウスの静的筋力トレーニング
- 長さ15cmのウール糸を2本カットします。スリップノットを使用して、マウスの足首の上部にそれぞれ毛糸を結びます(図2A)。
注:伸縮性のあるロープはネズミの姿勢を固定することはできず、麻縄はネズミの足首を着用するため、ここでは伸縮性がないが柔らかいウールの糸が選択されます。 - ボードをテーブルの上に水平に置き、スティックを立てます。マウスを 2 本の長いスティックの間に慎重に押し込み、ヘッドとテールをスティックの下の隙間に合わせます。
- 尾の端の隙間に糸を通します。次に、マウスの足首がスティックの端にぴったりと収まるまで糸を調整します。
- ウール糸をテープで固定します(図2B)。ウール糸の端は固定する必要があります、さもなければ、マウスは落ちたウールを登るでしょう。ウールをできるだけきつく引っ張らないと、マウスが簡単に自由になります。
- 透明基板を反転させます。透明なボードの両端に同じ高さ(高さ15〜20 cm)のボックスを2つ用意します。ボードを一定の高さで水平に置きます。ボックスは、マウスの頭と尻尾の両端にあります。高すぎると、実験者は簡単に扱うことができません。低すぎると、マウスがテーブルトップに触れる可能性があります。
- ボードがひっくり返ると、マウスは逆さまにぶら下がります。立ち直反射により、マウスは腹部を丸め、前肢を伸ばして後肢や棒をつかみます。この段階で、マウスの前に20cmのスティックを置き、前肢でスティックをつかむように慎重にガイドします。マウスがモバイルスティックをつかむのに習熟するまで、このプロセスを繰り返します。
- スティックを使用して、マウスの前肢を透明なボード上の別の4cmスティックに移動します。マウスがボード上の静止した4cmスティックを積極的につかむことができるように、スティックの角度を常に調整します(図2C)。
- マウスが消耗するまで、マウスが前足を離すときに前の手順を繰り返します。30分後、ほとんどのラットは上半身を持ち上げて前肢でスティックをつかむことができなくなりました。
注:介入を実施する前に、マウスの1週間の慣れトレーニングが必要です。最初のトレーニング時間は1日あたり10分で、その後、毎日5分ずつ増やし、1日あたり合計30分に達する必要があります。 - 30分間のトレーニング後、すぐにマウスを放し、ウールをほどいて、長時間のバインディングによる足の赤みや腫れを防ぎます。
- トレーニング後にマウスの足首に皮膚病変が現れた場合は、マウスのトレーニングを中止し、足首が健康になるまで獣医師の診察を受けてください。
- 一部のマウスは、トレーニング中に激しい闘争を通じて自分自身を解放することに成功している場合があります。マウスは、後ろ足がしっかりと固定されていないと苦労します。闘争による怪我を避けるために、トレーニング中はマウスを観察してください。後肢がしっかりと固定されていない、またはマウスがもがき始めたことがわかった場合は、マウスを緩めて再固定します。
注:以前の実験では、マウスを1日30分、週5日逆さまに吊るしても、足首の摩耗を引き起こさないことが示されています。マウスは1〜3回のセッションでトレーニングを学び、慣れることができます。

図2:マウスでの固定方法(A)足首の上部をスリップノットで結びます。(B)ロープの端を隙間に通してしっかりと引っ張った後、テープで固定します。(C)マウスの静的筋力トレーニング。この図の拡大版を表示するには、ここをクリックしてください。
結果
上記のプロトコルに従って、マウスの後肢を固定し、前肢を自律的に前肢をつかみます。可動範囲が狭いため、マウスは比較的固定された位置に保たれます。マウスの筋肉は、腹部や脚の筋肉に触れることで収縮していることを確認できます。これは、静的筋力トレーニングにおける等尺性筋収縮状態の必要性と一致しています。プロトコルに従ってマウスを訓練すると、訓練時間の増加に伴い、マウスが訓練に適応するのを助け、闘争への欲求を減らすことができます。逃げるのに苦労することは避けることができます。
2型糖尿病マウスの血糖値とインスリン値への影響
C57BL/6Jマウスの合計24匹を対照群(n=6)とT2DMモデル群(n=18)に無作為に分けた。次に、T2DMマウスをモデル群、訓練群、メトホルミン群に無作為に分けました。対照群にはモデリングや介入は行われず、モデル群のマウスには介入は行われませんでした。トレーニンググループのマウスは、1日1回、週5日、3週間、30分間の静的筋力トレーニングを受けました。メトホルミン群のマウスにメトホルミン200mg/kgを1日1回、3週間投与しました。3週間の介入後の空腹時血糖値(FBG)の結果を 図3Aに示します。図からわかるように、T2DMモデルマウスのFBGレベルは、対照マウスよりも有意に高かった。静的トレーニングで訓練されたマウスは、モデルグループと比較してFBGレベルが有意に低く、静的トレーニングがT2DMマウスのFBGを減らすのに効果的であることが示唆されました。 図3Bに示すように、モデル群の空腹時血清インスリン(FINS)レベルは、対照群よりも有意に低かった。トレーニング群とメトホルミン群では、モデル群と比較してFINSレベルが上昇しました。 図3Cでは、モデル群のマウスは対照群のマウスよりもインスリン抵抗性指数(HOMA-IR)が有意に高かったのに対し、静的トレーニング群とメトホルミン群のHOMA-IRはモデル群のマウスよりも有意に低く、T2DMマウスのインスリン抵抗性状態を緩和する有効性が実証されました。これらの結果は、このレジメンによって提供される静的筋力トレーニング戦略が、T2DMマウスの血糖値の調節においてメトホルミンと同様の効果を持っていることを示しています。
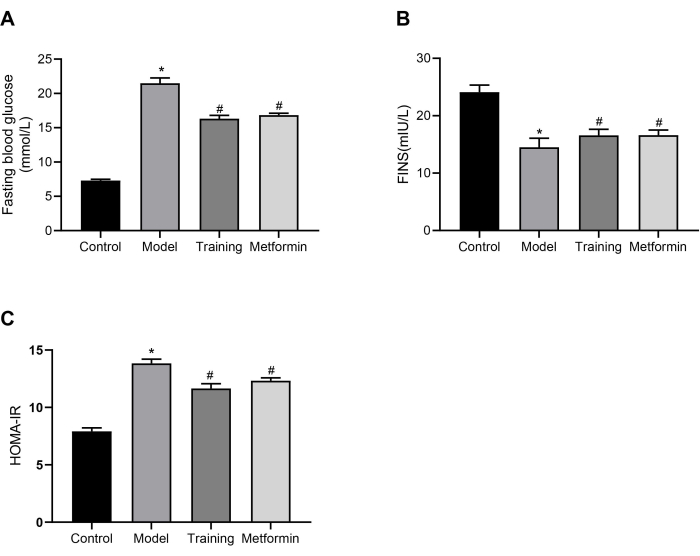
図3:血糖値とインスリンレベル(A)3週間の介入後の2型糖尿病マウスの空腹時血糖値の比較。* p <0.05 対対照群、# p <0.05 対 Model group.(B)3週間の介入後のT2DMマウスの空腹時血清インスリンレベルの比較。* p <0.05 対対照群、# p <0.05 対 Model group.(C)3週間の介入後のT2DMマウスのインスリン抵抗性指数の比較。* p <0.05 対対照群、# p <0.05 対 Model group.統計分析のために一元配置分散分析(ANOVA)を実行しました。定量的データは、SEM±平均(n = 6)で表されます。この図の拡大版を表示するには、ここをクリックしてください。
T2DMマウスの骨格筋への影響
マウスの腓腹筋を透過型電子顕微鏡で観察した。対照マウスと比較して、T2DMマウスの骨格筋筋細胞は変性し、筋原線維の構造は緩く、サルコメアの配置は不規則でした(図4A、B)。プロトコルに記載されている静的トレーニングの後、 図4C は、筋肉構造内の筋原性線維のタイトな構造と局所的な筋肉セグメントの対称的な配置を示しています。このことは、静的筋力トレーニングがT2DMマウスの骨格筋の形態を調節できることを示唆しています。一方、対照マウスの腓腹筋では、ミトコンドリアは局所的に分布しており、膜は無傷で、ミトコンドリアは局所的に分裂または融合していました(赤矢印で示)。同様に、静的筋力トレーニング後のマウスの骨格筋では、ミトコンドリアの数は正常です。それらのいくつかは明らかに融合または分割されています(赤い矢印)。対照的に、マウスのT2DMモデルでは、ミトコンドリアの数が少なく、活性が低いです。( 図4を参照)このことは、静的筋力トレーニングがミトコンドリアの機能と骨格筋細胞の活動に影響を与える可能性があることを示唆しています。

図4:T2型糖尿病マウスの骨格筋に対する静的トレーニングの効果(A)対照群;(B)T2DMモデルグループ。(C)静的トレーニンググループ。Mはミトコンドリアを表します。白い目盛り棒は50μm、赤い目盛りは10μmを表します。下の画像は上の画像を部分的に拡大したものです。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
静的筋力トレーニングは、脂肪の蓄積を減らし、体重減少を助け、代謝を高めることができます8。さらに、骨格筋細胞におけるPGC-1αの発現とミトコンドリア生合成を増強し、2型糖尿病マウスのグルコース代謝を改善し、その結果として血糖値を低下させます11。静的訓練が2型糖尿病に及ぼす影響やメカニズムを確認するためには、実験動物に対して静的訓練を行うための適切な装置を開発する必要がある。
このプロトコルでは、マウスの静的トレーニング用のデバイスを紹介します。アクリル板、スティック、毛糸、ホットグルーガンなど、必要な機器はすぐに入手でき、製造方法はシンプルで簡単です。これにより、実験のコストを効果的に削減し、実験の実現可能性と再現性を高めることができます。トレーニング中にマウスの位置を固定することは、静的トレーニングデバイスを設計する際に困難な場合があります。このプロトコルでは、柔らかいウールを締めることにより、マウスの足を小さな棒の前面に固定することができます。右転反射により、マウスは上半身を上向きに曲げ、前足で前方のバーをつかむことができます。バーは短く、前足の可動域を制限します。適応訓練を2、3回行った後、マウスは安定した姿勢を保つことができました。前足の力が限られているため、マウスはクロスバーを握る力を失うことがよくあります。実験者は、マウスが前肢でクロスバーをつかみ、マウスが偶発的な怪我をするのを防ぐために、マウスをずっと監視する必要があります。訓練により、マウスは疲労後約30分間、一度に1〜2分間、数回繰り返すことで固定位置を維持できます。疲れ果てると、マウスは腹部を丸めたり、前足を上げたりしなくなりました。ネズミが前足でつかむようにスティックに導かれたとき、ネズミはつかむことができましたが、上半身は上向きになれませんでした。ネズミを置いた後、できるだけ早く結び目をほどくと、足首の浮腫や摩耗を効果的に防ぐことができます。
予備実験では、静的な訓練を行った後、モデルマウスの対照群と比較して、T2DMマウスの血糖値が有意に低下したことが示されています。骨格筋は、末梢グルコース代謝の重要な構成要素であり、血糖恒常性を維持するために不可欠です12。電子顕微鏡による解析では、T2型糖尿病マウスの腓腹筋細胞に重度の変性が見られ、静的トレーニングでは筋組織の変性が緩和されることがわかった。これらの知見は、静的トレーニングが骨格筋機能の調節に関与している可能性を示唆している。研究によると、骨格筋の機能を維持することは、ミトコンドリアのダイナミクスによって大きく影響を受けることが示されています13。T2DMモデル群の腓腹筋細胞では、野生マウスや静止運動マウスと比較して、ミトコンドリア数の顕著な減少とミトコンドリア活性の欠如が観察されました。これらの知見は、静的トレーニングが骨格筋細胞のミトコンドリア機能を強化することにより、骨格筋の機能を促進する可能性を示唆しています。前述の実験結果に基づいて、静的トレーニングは T2DM マウスの血糖値とインスリン代謝を大幅に強化できると判断できます。介入メカニズムは、静的トレーニングによる骨格筋のミトコンドリア機能の調節に関連している可能性があります。
このプロトコルにはいくつかの制限があります。当初、マウスの後肢を1人で個別に縛ることは困難であり、1人が後肢をつかみ、もう1人が縛りを行う必要がありました。実験者側のいくつかの調整とスキルの向上により、マウスはより従順になりました。これにより、後肢を独立して結合することが可能になりました。さらに、柔らかいウールはマウスの足首の打撲傷を軽減する可能性があります。
結論として、このプロトコルは、マウス用の静的トレーニング機器を作成する簡単な方法を提供します。同様に、ラット用の単純な静的トレーニング機器は、ボードとスティックのサイズを大きくすることで作成できます。このデバイスは、マウスの四肢の筋肉等尺性収縮を維持して、伝統的な中国の運動がT2DMに及ぼす介入効果を検証し、T2DMの臨床治療に新たな視点を提供することができる。
開示事項
著者は、開示することは何もないと宣言します。
謝辞
この研究は、National Clinical Research Base of Traditional Chinese Medicine(JDZX2015127、安徽省中医薬病院に基づく)の特別科学研究プロジェクトの第2陣によって支援されています。
資料
| Name | Company | Catalog Number | Comments |
| Acrylic boards | Transparent acrylic boards with 5mm thickness. The size should be larger than 20cm×20cm | ||
| Boxes | Two boxes of the same height (15~20cm) | ||
| ELISA KIT | H203-1-2 | Nanjing Jiancheng Bioengineering Institute | |
| Hot melt glue gun | Avoid touching the gun head to cause burns | ||
| Knives | No special requirement | ||
| Metformin tablets | 1396309 | Sigma | |
| scissors | No special requirement | ||
| Sticks | Several wooden sticks with a diameter of 3mm | ||
| Streptozotocin | S0130 | Sigma | |
| Tape | No special requirement | ||
| Transmission Electron Microscope (TEM) | HT7700 | HITACHI |
参考文献
- Zheng, Y., Ley, S. H., Hu, F. B. Global aetiology and epidemiology of type 2 diabetes mellitus and its complications. Nat Rev Endocrino. 14 (2), 88-98 (2018).
- Li, X., et al. Effects of fitness qigong and tai chi on middle-aged and elderly patients with type 2 diabetes mellitus. Public Lib Sci. 15 (12), e0243989 (2020).
- Qin, J., et al. Effect of tai chi on quality of life, body mass index, and waist-hip ratio in patients with type 2 diabetes mellitus: A systematic review and meta-analysis. Front Endocrino. 11, 543627 (2020).
- Yang, H., Wu, X., Wang, M. Effect of conventional medical treatment plus Qigong exercise on type 2 diabetes mellitus in Chinese patients: A Meta-analysis. J Trad Chinese Med. 38 (2), 167-174 (2018).
- Yu, X., Chau, J. P. C., Huo, L. The effectiveness of traditional Chinese medicine-based lifestyle interventions on biomedical, psychosocial, and behavioral outcomes in individuals with type 2 diabetes: A systematic review with meta-analysis. Int J Nurs Stud. 80, 165-180 (2018).
- Ağgön, E., et al. Effect of dynamic and static strength training on hormonal activity in elite boxers. Baltic J Health Phys Activity. 12 (3), 1-10 (2020).
- Merico, A., et al. Effects of combined endurance and resistance training in Amyotrophic Lateral Sclerosis: A pilot, randomized, controlled study. Eur J Translat Myo. 28 (1), 7278 (2018).
- Liu, Y., et al. Eight weeks of high-intensity interval static strength training improves skeletal muscle atrophy and motor function in aged rats via the PGC-1α/FNDC5/UCP1 pathway. Clin Interven Aging. 16, 811-821 (2021).
- Jun, X., et al. Animal model for static massage training. Massage Guid. (02), 5-6 (2000).
- Wei, J., et al. Mechanism by which static exercise improves insulin resistance in skeletal muscle of type 2 diabetes. Chinese J Tiss Eng Res. 28 (08), 1271-1276 (2024).
- Zhenrui, L., Fang, L., Wu, W., Huang, J. The effect of static training on upper limb motor ability in aged rats was studied based on PGC-1α signal pathway RNA interference. Lishizhen Medicine and Materia Medica Research. 30 (01), 247-249 (2019).
- Lee, S. H., Park, S. Y., Choi, C. S. Insulin resistance: From mechanisms to therapeutic strategies. Diab Metab J. 46 (1), 15-37 (2022).
- Campos, J. C., et al. Exercise preserves physical fitness during aging through AMPK and mitochondrial dynamics. Proc Natl Acad Sci U S A. 120 (2), e2204750120 (2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved