Method Article
طريقة تدريب القوة الثابتة للفئران المصابة بالسكري من النوع 2
* These authors contributed equally
In This Article
Summary
يوفر هذا البروتوكول طريقة بسيطة لصنع معدات تدريب ثابتة للفئران. يحافظ الجهاز على تقلص العضلات متساوي القياس لأطراف الفئران للتحقق من تأثير التدخل للتمرين التقليدي على مرض السكري من النوع الثاني (T2DM) ويوفر علاجا جديدا للتمارين للعلاج السريري ل T2DM.
Abstract
علاج داء السكري من النوع 2 (T2DM) هو صعوبة كبيرة في تحسين صحة المريض. التمرين هو أحد التدخلات الرئيسية ل T2DM. تدريب القوة الثابتة هو أحد الأشكال الرئيسية للرياضات التقليدية في الصين. تظهر الأبحاث أن تدريب القوة الثابتة هو طريقة سريرية فعالة لتدخل T2DM ، ولكن لا يوجد جهاز تجريبي مناسب للتدريب الثابت في الفئران. تتمثل إحدى الصعوبات في الانتقال من البحث السريري إلى البحث الأساسي في تصميم الأجهزة التجريبية المناسبة. من أجل إجراء مزيد من الدراسة لآلية تدخل التدريب الثابت في T2DM ، تم تقديم طريقة بسيطة لصنع جهاز تدريب ثابت للفئران في هذه الورقة. يتميز هذا الجهاز بمزايا التشغيل البسيط والمواد الرخيصة والجدوى العالية. أظهرت الدراسات السابقة التي أجريت بموجب هذا البروتوكول أن التدريب الثابت يمكن أن يقلل بشكل فعال من مستويات الجلوكوز في الدم ويحسن وظيفة الميتوكوندريا لخلايا العضلات الهيكلية في الفئران T2DM. الغرض من تقديم هذا الجهاز هو تعزيز البحث حول آلية التمرين التقليدي في تدخل T2DM ووضع أساس للتدخل الكمي للتمرين.
Introduction
داء السكري من النوع 2 (T2DM) هو مرض مزمن يتميز بمقاومة الأنسولين واختلال وظائف الخلايا β التي تشكل تهديدا كبيرا للصحة العالمية1. التمرين هو تدخل حاسم في إدارة مرض السكري من النوع 2. أظهرت العديد من الدراسات أن طرق التمرين الصينية التقليدية ، مثل Tai Chi و Ba Duan Jin ، تحسن بشكل كبير مستويات الجلوكوز في الدم ونوعية الحياة للأفراد المصابين ب T2DM2،3،4،5. لتنفيذ هذه الحركات ، يجب على المدرب الحفاظ على جسم مستقر ووضع مشترك لفترة من الزمن. يتم الحفاظ على الوضع الثابت عن طريق إجراء تقلصات العضلات الثابتة ، والتي يشار إليها عادة باسم القوة الساكنة6.
ومع ذلك ، لم يتم توضيح آلية تدخل تدريب القوة الثابتة في T2DM. للإجابة على هذا السؤال ، التجارب على ضرورية. أثناء تمارين متساوي القياس ، يتم تنشيط العضلات ، والحفاظ على طول ثابت ، وتحقيق أقصى قدر من التوتر بأمان7. في التجارب مع تدريب القوة الثابتة ، يطلب من الاختبار إجراء تقلصات العضلات متساوية القياس والحفاظ على هذه الحالة من الانقباض العضلي. أصبحت كيفية تنفيذ تدريب القوة الثابتة على الفئران والجرذان المختبر الأخرى مشكلة كبيرة في البحث. أولا ، تكافح لإطاعة الأوامر وتقلص عضلاتها كما هو مطلوب. ثانيا ، من الصعب على الحفاظ على وضع مستقر تحت المقاومة ، ولا يمكن تحقيق الغرض من تقلص العضلات متساوي القياس. أثناء السماح للحيوانات بالتدريب كما هو مطلوب ، من المهم معالجة المخاوف المتعلقة برعاية ، مثل تخفيف التوتر والقلق وتقليل الألم وتحسين الظروف العامة. يتعلق هذا البروتوكول بنموذج تدريب ثابت للفئران 8,9 ، وهنا نقدم جهازا بسيطا للتدريب الثابت للفئران. عندما يتم رفع الأرجل الخلفية للفئران ، تنقبض عضلات البطن بسبب رد الفعل الصحيح ، وتمسك مقدمة الأقدام بالعارضة المتقاطعة في المقدمة ، ثم تنقبض الأطراف الأمامية والخلفية ضد الجاذبية. لا تستطيع الفئران التحرك بعد الإمساك بالقضيب القصير ، مما يؤدي إلى أن تكون عضلاتها في حالة تقلص متساوي القياس.
Protocol
تمت الموافقة على جميع التجارب على من قبل لجنة رعاية واستخدام بجامعة نانجينغ للطب الصيني (إذن رقم 202209A033). تم اختيار ذكور الفئران C57BL / 6J السليمة بدرجة SPF ، وعمر 8 أسابيع ، ووزن الجسم 20 ± 4 جم. تم إيواء الفئران في دورة ضوء / مظلمة لمدة 12 ساعة عند درجة حرارة 20-22 درجة مئوية ، وتم الحفاظ على رطوبة نسبية من 45٪ -50٪. تأكل وتشرب بحرية.
1. إنشاء نموذج الماوس من T2DM
- إطعام الفئران لمدة 1 أسبوع على نظام غذائي منتظم أولا والسماح للفئران التكيف مع البيئة الجديدة لمركز. بعد أسبوع واحد ، قم بتوفير نظام غذائي عالي الدهون (تكوين النظام الغذائي: 20.0٪ شحم الخنزير ، 10.0٪ سكروز ، 2.5٪ كوليسترول ، 1.0٪ كولات ، 66.5٪ نظام غذائي تقليدي) لمدة 4 أسابيع.
- مناليوم الأول من الأسبوع الخامس ، حقن الفئران داخل الصفاق بمحلول الستربتوزوتوسين بجرعة 35 مجم / كجم يوميا لمدة 3 أيام متتالية. تحضير 1 مل من محلول الستربتوزوتوسين مع 10 ملغ من مسحوق الستربتوزوتوسين ، مع 0.1 م / لتر من محلول سترات الصوديوم كمذيب.
ملاحظة: يجب إكمال الحقن في غضون 30 دقيقة بعد تحضير المحلول ، ويجب إبقاء المحلول بعيدا عن الضوء أثناء الاستخدام. - اختبار عشوائي الجلوكوز في الدم في اليوم 5 واليوم 7 بعد إعطاء الحقن الأول من محلول الستربتوزوتوسين. تعتبر التي تحتوي على مستويين عشوائيين من السكر في الدم أعلى من 16.7 ملليمتر / لتر نماذج T2DM ناجحة.
- ابدأ تدخل التدريب في اليوم 8 بعد الحقن الأول لمحلول الستربتوزوتوسين.
2. التجميع والعلاج في الفئران
- قسم الفئران T2DM إلى مجموعة نموذجية ومجموعة تدريب ومجموعة ميتفورمين باستخدام طريقة جدول الأرقام العشوائية ، مع 6 فئران في كل مجموعة.
- لا تقم بإجراء أي تدخل لمجموعة الطرازات.
- طحن أقراص الميتفورمين إلى مسحوق وتذوب في الماء النقي. إعطاء الميتفورمين لمجموعة الميتفورمين عن طريق التزويج بجرعة 200 ملغ/كغ، مرة واحدة يوميا، لمدة 3 أسابيع.
- دع مجموعة التدريب تقوم ب 30 دقيقة من تدريب القوة الثابتة ، مرة واحدة يوميا ، 5 أيام في الأسبوع ، لمدة 3 أسابيع. يقام التدريب كل يوم اثنين إلى بعد ظهر الجمعة.
- قم بتعيين 6 فئران غير T2DM بشكل عشوائي كمجموعة تحكم. هذه الفئران لا تخضع للنمذجة والتدخل.
3. تصنيع جهاز تدريب القوة الثابتة
- قم بإعداد لوح أكريليك شفاف بسمك 5 مم بأبعاد 20 سم × 20 سم. استخدم لوحة شفافة لمراقبة تدريب الفئران.
- احصل على عصي خشبية بقطر 3 مم ولفافة من الشريط بعرض 1 سم. استخدم قاطع الورق لقص اثنين من العصي بطول 4 سم وأربعة أعواد بطول 1 سم.
- قم بتوصيل عصوين ، يبلغ طول كل منهما 1 سم ، بأطراف عصا بطول 4 سم باستخدام شريط (الشكل 1 أ). يجب تثبيت العصي القصيرة على نفس جانب العصا الطويلة.
- ضع اللوح الشفاف على سطح مستو وقم بتوصيل مجموعتين من العصي القصيرة 1 سم باللوحة باستخدام مسدس الغراء الساخن. تأكد من أن العصي الخشبية مقاس 4 سم لا تتلامس مع اللوح. اترك فجوة 2 سم بين العصا الطويلة واللوح لتثبيت الفئران في مكانها (الشكل 1 ب). دع العصي الطويلة تكون محاذاة ومتوازية ، بمسافة 6 سم بينهما (الشكل 1C).

الشكل 1: قم بتجميع العصي وتثبيتها على اللوحة الشفافة. (أ) ألصق العصا التي طولها ١ سم بطرفي العصا التي يبلغ طولها ٤ سم. (ب) استخدم مادة لاصقة تذوب بالحرارة لتوصيل العصا التي يبلغ طولها 1 سم واللوح الشفاف ، وطول الفجوة 2 سم. (ج) عصوان 4 سم متباعدتان 6 سم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. تدريب القوة الثابتة في الفئران
- قطع قطعتين من خيوط الصوف بطول 15 سم. استخدم عقدة منزلقة لربط قطعة من الخيوط الصوفية على كل من الكاحل العلوي للفأر (الشكل 2 أ).
ملاحظة: لا يمكن للحبل المرن إصلاح وضعية الفئران ، وسوف يرتدي حبل القنب كاحلي الفئران ، لذلك يتم اختيار خيوط صوفية غير مرنة ولكن ناعمة هنا. - ضع اللوحة أفقيا على الطاولة مع رفع العصي. اضغط على الماوس بعناية بين عصوين طويلتين ، وضع رأسه وذيله لمحاذاة الفجوات الموجودة أسفل العصي.
- مرر الغزل عبر الفجوة الموجودة في نهاية الذيل. بعد ذلك ، اضبط الخيط حتى يتناسب كاحلي الماوس بشكل مريح مع حافة العصا.
- قم بتأمين الخيوط الصوفية بشريط (الشكل 2 ب). يجب تأمين نهاية الخيوط الصوفية وإلا فإن الماوس سوف يتسلق الصوف الساقط. اسحب الصوف بإحكام قدر الإمكان وإلا فإن الماوس سوف يتحرر بسهولة.
- اعكس اللوحة الشفافة. احصل على صندوقين من نفس الارتفاع (15-20 سم) على طرفي اللوحة الشفافة. ضع اللوحة أفقيا على ارتفاع معين. يقع الصندوق في طرفي رأس الفأر وذيله. إذا كان مرتفعا جدا ، فلن يتمكن المجرب من التعامل معه بسهولة ؛ إذا كان منخفضا جدا ، فقد يلمس الماوس سطح الطاولة.
- بمجرد قلب اللوحة ، يتدلى الماوس رأسا على عقب. بسبب رد الفعل الصحيح ، تقوم الفئران بتجعيد بطنها وتمديد أطرافها الأمامية للإمساك بأطرافها الخلفية أو العصي. في هذه المرحلة ، ضع عصا 20 سم أمام الماوس ووجهها بعناية للإمساك بالعصا بأطرافها الأمامية. كرر العملية حتى يصبح الماوس بارعا في الإمساك بعصا الهاتف المحمول.
- استخدم العصا لتحريك الطرف الأمامي للماوس إلى عصا أخرى مقاس 4 سم على اللوحة الشفافة. اضبط زاوية العصا باستمرار لتمكين الفئران من الإمساك بنشاط بالعصا الثابتة مقاس 4 سم على اللوحة (الشكل 2 ج).
- كرر الخطوة السابقة حيث يطلق الماوس المخلب الأمامي حتى يتم استنفاد الماوس. بعد 30 دقيقة ، لم تتمكن معظم الفئران من رفع الجزء العلوي من الجسم والإمساك بالعصا بأطرافها الأمامية.
ملاحظة: قبل تنفيذ التدخل ، من الضروري إجراء أسبوع من التدريب على التعود على الفئران. مدة التدريب الأولية هي 10 دقائق في اليوم ، والتي يجب زيادتها بعد ذلك بمقدار 5 دقائق كل يوم حتى تصل إلى إجمالي 30 دقيقة في اليوم. - بعد 30 دقيقة من التدريب ، حرر الماوس على الفور وفك تشابك الصوف لمنع احمرار القدمين وتورمها الناجم عن الربط لفترات طويلة.
- إذا ظهرت آفات جلدية على كاحل الفئران بعد التدريب ، فتوقف عن تدريب الفئران واطلب الرعاية المهنية البيطرية حتى يصبح الكاحل بصحة جيدة.
- قد تتمكن بعض الفئران أحيانا من تحرير نفسها من خلال صراع شديد أثناء التدريب. تكافح الفئران عندما لم تكن أرجلها الخلفية ثابتة بإحكام. لتجنب الإصابة بسبب النضال ، راقب الفئران طوال التدريب. عندما يتبين أن الأطراف الخلفية ليست ثابتة بإحكام أو تبدأ الفئران في النضال ، قم بفك الفئران وإعادة إصلاحها.
ملاحظة: أظهرت التجارب السابقة أن تعليق الفئران رأسا على عقب لمدة 30 دقيقة في اليوم ، 5 أيام في الأسبوع ، لا يسبب تآكل الكاحل ، بشرط تحريرها في الوقت المناسب10. يمكن للفئران التعلم والتعود على التدريب في 1-3 جلسات.

الشكل 2: طريقة التثبيت بالماوس. (أ) اربط الجزء العلوي من الكاحل بعقدة منزلقة. (ب) يمرر طرف الحبل عبر الفجوة ويشد بإحكام، ثم يثبت بشريط لاصق. ج: تدريب القوة الساكنة في الفئران. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
باتباع البروتوكول أعلاه ، يتم إصلاح الأطراف الخلفية للماوس ، وتمسك الأطراف الأمامية بشكل مستقل بالشريط الأمامي. يحافظ النطاق الضيق للحركة على الماوس في وضع ثابت نسبيا. يمكن تأكيد تقلص عضلات الفئران عن طريق لمس عضلات البطن والساقين. هذا يتوافق مع الحاجة إلى حالة تقلص العضلات متساوي القياس في تدريب القوة الثابتة. تدريب الفئران وفقا للبروتوكول ، مع زيادة أوقات التدريب ، سيساعد الفئران على التكيف مع التدريب مع تقليل رغبتها في النضال. يمكن تجنب النضال من أجل الهروب.
التأثيرات على مستوى الجلوكوز في الدم والأنسولين في الفئران T2DM
تم تقسيم ما مجموعه 24 فأرا C57BL / 6J عشوائيا إلى مجموعة التحكم (n = 6) ومجموعة نموذج T2DM (n = 18). ثم تم تقسيم الفئران T2DM عشوائيا إلى مجموعة النموذج ومجموعة التدريب ومجموعة الميتفورمين. لم يتم إعطاء أي نمذجة أو تدخل للمجموعة الضابطة ، ولم يتم إعطاء أي تدخل للفئران في المجموعة النموذجية. تلقت الفئران في مجموعة التدريب 30 دقيقة من تدريب القوة الثابتة مرة واحدة في اليوم ، 5 أيام في الأسبوع لمدة 3 أسابيع. أعطيت الفئران في مجموعة الميتفورمين الميتفورمين 200 ملغم / كغم مرة واحدة في اليوم لمدة 3 أسابيع. تظهر نتائج صيام الجلوكوز في الدم (FBG) بعد 3 أسابيع من التدخل في الشكل 3 أ. كما يتضح من الشكل ، كانت مستويات FBG للفئران النموذجية T2DM أعلى بكثير من تلك الموجودة في الفئران الضابطة. أظهرت الفئران المدربة في التدريب الثابت مستويات FBG أقل بكثير مقارنة بمجموعة النماذج ، مما يشير إلى أن التدريب الثابت فعال في تقليل FBG في الفئران T2DM. كانت مستويات الأنسولين في مصل الصيام (FINS) في المجموعة النموذجية أقل بكثير مما كانت عليه في المجموعة الضابطة ، كما هو موضح في الشكل 3B. في مجموعات التدريب والميتفورمين ، زادت مستويات FINS مقارنة بمجموعة النموذج. في الشكل 3C ، كان لدى الفئران في المجموعة النموذجية مؤشر مقاومة أنسولين أعلى بكثير (HOMA-IR) من تلك الموجودة في المجموعة الضابطة ، في حين أن HOMA-IR لمجموعات التدريب الثابت والميتفورمين كانت أقل بكثير من المجموعة النموذجية ، مما يدل على فعاليتها في التخفيف من حالة مقاومة الأنسولين للفئران T2DM. تظهر هذه النتائج أن استراتيجية تدريب القوة الثابتة التي يوفرها هذا النظام لها تأثيرات مماثلة للميتفورمين في تنظيم مستوى الجلوكوز في الدم لدى الفئران T2DM.
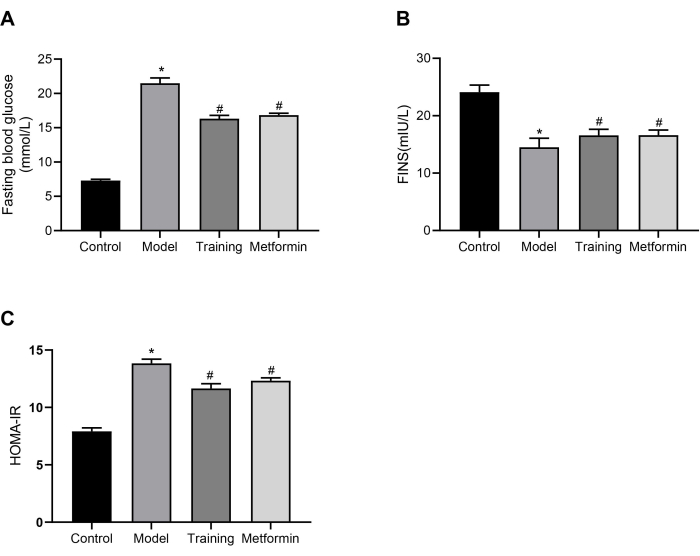
الشكل 3: مستويات السكر في الدم والأنسولين. (أ) مقارنة مستويات الجلوكوز في الدم الصائم في الفئران T2DM بعد 3 أسابيع من التدخل. * p <0.05 مقابل المجموعة الضابطة ، # p <0.05 مقابل مجموعة الطرازات. (ب) مقارنة مستويات الأنسولين في مصل الصيام في الفئران T2DM بعد 3 أسابيع من التدخل. * p <0.05 مقابل المجموعة الضابطة ، # p <0.05 مقابل مجموعة الطرازات. (ج) مقارنة مؤشر مقاومة الأنسولين في الفئران T2DM بعد 3 أسابيع من التدخل. * p <0.05 مقابل المجموعة الضابطة ، # p <0.05 مقابل مجموعة الطرازات. تم إجراء تحليل التباين أحادي الاتجاه (ANOVA) للتحليل الإحصائي. يتم التعبير عن البيانات الكمية كمتوسط ± SEM (ن = 6). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
التأثيرات على العضلات الهيكلية في الفئران T2DM
لوحظ gastrocnemius من الفئران عن طريق المجهر الإلكتروني الإرسال. بالمقارنة مع الفئران الضابطة ، تدهورت الخلايا العضلية الهيكلية للفئران T2DM ، وكانت بنية اللييفات العضلية فضفاضة ، وكان ترتيب القطعة العضلية غير منتظم (الشكل 4A ، B). بعد التدريب الثابت الموصوف في البروتوكول ، يوضح الشكل 4C التركيب المحكم للألياف العضلية في بنية العضلات والترتيب المتماثل لأجزاء العضلات المحلية. هذا يشير إلى أن تدريب القوة الثابتة يمكن أن ينظم مورفولوجيا العضلات الهيكلية في الفئران T2DM. من ناحية أخرى ، في gastrocnemius من الفئران السيطرة ، تم توزيع الميتوكوندريا محليا ، مع أغشية سليمة ، والميتوكوندريا مقسمة محليا أو تنصهر (يشار إليها بالأسهم الحمراء). وبالمثل ، في العضلات الهيكلية للفئران بعد تدريب القوة الثابتة ، يكون عدد الميتوكوندريا طبيعيا. من الواضح أن بعضها منصهر أو مقسم (السهم الأحمر). في نموذج T2DM في الفئران ، على النقيض من ذلك ، يكون عدد الميتوكوندريا أقل ، وهناك نشاط منخفض. (انظر الشكل 4) يشير هذا إلى أن تدريب القوة الساكنة قد يؤثر على وظيفة الميتوكوندريا ونشاطها في خلايا العضلات الهيكلية.

الشكل 4: تأثير التدريب الساكن على العضلات الهيكلية للفئران T2DM. (أ) المجموعة الضابطة؛ (ب) مجموعة نماذج T2DM؛ (ج) مجموعة تدريب ثابتة. يمثل M الميتوكوندريا. تمثل قضبان المقياس الأبيض 50 ميكرومتر ، وتمثل قضبان المقياس الأحمر 10 ميكرومتر. الصورة السفلية هي تكبير جزئي للصورة العلوية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يمكن أن يقلل تدريب القوة الثابتة من تراكم الدهون ، ويساعد على إنقاص الوزن ، وزيادة التمثيل الغذائي8. بالإضافة إلى ذلك ، فإنه يعزز التعبير عن PGC-1α والتكوين الحيوي للميتوكوندريا في خلايا العضلات والهيكل العظمي ، مما يؤدي إلى تحسين استقلاب الجلوكوز في الفئران المصابة بداء السكري من النوع 2 وبالتالي انخفاض مستويات الجلوكوز في الدم11. لتأكيد تأثير وآلية التدريب الثابت على T2DM ، يجب تطوير الأجهزة المناسبة لأداء التدريب الثابت على التجارب.
يقدم هذا البروتوكول جهازا للتدريب الثابت على الفئران. المعدات المطلوبة ، مثل ألواح الأكريليك والعصي والخيوط الصوفية ومسدسات الغراء الساخن ، متوفرة بسهولة ، وطريقة الإنتاج بسيطة وسهلة. هذا يمكن أن يقلل بشكل فعال من تكلفة التجربة ويزيد من جدواها وتكرارها. قد يكون الحفاظ على وضع ثابت للفئران أثناء التدريب أمرا صعبا عند تصميم جهاز تدريب ثابت. في هذا البروتوكول ، يمكن تثبيت أقدام الماوس في مقدمة العصا الصغيرة عن طريق شد الصوف الناعم. يتسبب رد الفعل الصحيح في ثني الفأر للجزء العلوي من جسمه لأعلى ، مما يمكنه من الإمساك بالقضيب الأمامي بأقدامه الأمامية. الشريط قصير ، مما يحد من نطاق الحركة للأقدام الأمامية. بعد جلستين أو ثلاث جلسات من التدريب التكيفي ، تمكنت الفئران من الحفاظ على وضع مستقر. بسبب القوة المحدودة للأقدام الأمامية ، تفقد الفئران في كثير من الأحيان قبضتها على العارضة. من الضروري أن يراقب المجربون الفئران طوال الوقت لمساعدتهم في الاستيلاء على العارضة بأطرافهم الأمامية ومنع الفئران من الإصابة العرضية. من خلال التدريب ، يمكن للفئران الحفاظ على وضع ثابت لمدة 1-2 دقيقة في المرة الواحدة ، تتكرر عدة مرات ، لمدة 30 دقيقة تقريبا بعد الإرهاق. عند الإرهاق ، لم تعد الفئران تدحرج بطونها أو ترفع أرجلها الأمامية. عندما تم توجيه الفأر بواسطة العصا للإمساك بأقدامه الأمامية ، كان بإمكان الفأر الإمساك به ، لكن الجزء العلوي من جسمه لم يكن قادرا على الدوران لأعلى. قم بفك العقدة في أسرع وقت ممكن بعد وضع الفئران ، والتي يمكن أن تتجنب بشكل فعال وذمة الكاحل والتآكل.
تشير التجارب الأولية إلى أنه بعد فترة من التدريب الثابت ، انخفض مستوى الجلوكوز في الدم لدى الفئران T2DM بشكل ملحوظ عند مقارنته بمجموعة التحكم في الفئران النموذجية. تعد العضلات الهيكلية مكونا مهما في استقلاب الجلوكوز المحيطي، وهي ضرورية للحفاظ على توازن الجلوكوزفي الدم 12. أشارت تحليلات المجهر الإلكتروني إلى حدوث تنكس شديد في خلايا الساق في الفئران T2DM ، بينما تم العثور على تدريب ثابت للتخفيف من تنكس الأنسجة العضلية. تشير هذه النتائج إلى أن التدريب الثابت قد يكون متورطا في تنظيم وظيفة العضلات الهيكلية. أظهرت الأبحاث أن الحفاظ على وظيفة العضلات الهيكلية يتأثر بشكل كبير بديناميكيات الميتوكوندريا13. لاحظنا انخفاضا ملحوظا في عدد الميتوكوندريا ونقص نشاط الميتوكوندريا في خلايا عضلات الساق في مجموعة نموذج الفئران T2DM مقارنة بالفئران البرية وفئران التمرين الثابتة. تشير هذه النتائج إلى أن التدريب الثابت قد يعزز وظيفة العضلات الهيكلية من خلال تعزيز وظيفة الميتوكوندريا في خلايا العضلات الهيكلية. بناء على النتائج التجريبية السابقة ، يمكن تحديد أن التدريب الثابت يمكن أن يعزز بشكل كبير استقلاب الجلوكوز في الدم والأنسولين في الفئران T2DM. يمكن ربط آلية التدخل بتنظيم وظيفة الميتوكوندريا العضلية الهيكلية عن طريق التدريب الثابت.
هذا البروتوكول له بعض القيود. في البداية ، كانت هناك صعوبة في ربط الأطراف الخلفية للفئران بشكل فردي من قبل شخص واحد ، حيث تطلب الأمر من فرد واحد أن يمسك بالساقين الخلفيتين بينما يقوم شخص آخر بالربط. مع بعض التعديلات وزيادة المهارة من جانب المجرب ، أصبحت الفئران أكثر قابلية للتكيف. هذا يسمح للربط المستقل للساقين الخلفيتين. بالإضافة إلى ذلك ، قد يقلل الصوف الناعم من الكدمات في كاحلي الفئران.
في الختام ، يوفر هذا البروتوكول طريقة بسيطة لصنع معدات تدريب ثابتة للفئران. وبالمثل ، يمكن صنع معدات تدريب ثابتة بسيطة للفئران عن طريق زيادة حجم الألواح والعصي. يمكن للجهاز الحفاظ على تقلص العضلات متساوي القياس لأطراف الفئران وذلك للتحقق من تأثير التدخل للتمرين الصيني التقليدي على T2DM وتوفير منظور جديد للعلاج السريري ل T2DM.
Disclosures
يعلن أصحاب البلاغ أنه ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل الدفعة الثانية من مشاريع البحث العلمي الخاصة للقاعدة الوطنية للبحوث السريرية للطب الصيني التقليدي (JDZX2015127 ، استنادا إلى مستشفى مقاطعة آنهوي للطب الصيني).
Materials
| Name | Company | Catalog Number | Comments |
| Acrylic boards | Transparent acrylic boards with 5mm thickness. The size should be larger than 20cm×20cm | ||
| Boxes | Two boxes of the same height (15~20cm) | ||
| ELISA KIT | H203-1-2 | Nanjing Jiancheng Bioengineering Institute | |
| Hot melt glue gun | Avoid touching the gun head to cause burns | ||
| Knives | No special requirement | ||
| Metformin tablets | 1396309 | Sigma | |
| scissors | No special requirement | ||
| Sticks | Several wooden sticks with a diameter of 3mm | ||
| Streptozotocin | S0130 | Sigma | |
| Tape | No special requirement | ||
| Transmission Electron Microscope (TEM) | HT7700 | HITACHI |
References
- Zheng, Y., Ley, S. H., Hu, F. B. Global aetiology and epidemiology of type 2 diabetes mellitus and its complications. Nat Rev Endocrino. 14 (2), 88-98 (2018).
- Li, X., et al. Effects of fitness qigong and tai chi on middle-aged and elderly patients with type 2 diabetes mellitus. Public Lib Sci. 15 (12), e0243989(2020).
- Qin, J., et al. Effect of tai chi on quality of life, body mass index, and waist-hip ratio in patients with type 2 diabetes mellitus: A systematic review and meta-analysis. Front Endocrino. 11, 543627(2020).
- Yang, H., Wu, X., Wang, M. Effect of conventional medical treatment plus Qigong exercise on type 2 diabetes mellitus in Chinese patients: A Meta-analysis. J Trad Chinese Med. 38 (2), 167-174 (2018).
- Yu, X., Chau, J. P. C., Huo, L. The effectiveness of traditional Chinese medicine-based lifestyle interventions on biomedical, psychosocial, and behavioral outcomes in individuals with type 2 diabetes: A systematic review with meta-analysis. Int J Nurs Stud. 80, 165-180 (2018).
- Ağgön, E., et al. Effect of dynamic and static strength training on hormonal activity in elite boxers. Baltic J Health Phys Activity. 12 (3), 1-10 (2020).
- Merico, A., et al. Effects of combined endurance and resistance training in Amyotrophic Lateral Sclerosis: A pilot, randomized, controlled study. Eur J Translat Myo. 28 (1), 7278(2018).
- Liu, Y., et al. Eight weeks of high-intensity interval static strength training improves skeletal muscle atrophy and motor function in aged rats via the PGC-1α/FNDC5/UCP1 pathway. Clin Interven Aging. 16, 811-821 (2021).
- Jun, X., et al. Animal model for static massage training. Massage Guid. (02), 5-6 (2000).
- Wei, J., et al. Mechanism by which static exercise improves insulin resistance in skeletal muscle of type 2 diabetes. Chinese J Tiss Eng Res. 28 (08), 1271-1276 (2024).
- Zhenrui, L., Fang, L., Wu, W., Huang, J. The effect of static training on upper limb motor ability in aged rats was studied based on PGC-1α signal pathway RNA interference. Lishizhen Medicine and Materia Medica Research. 30 (01), 247-249 (2019).
- Lee, S. H., Park, S. Y., Choi, C. S. Insulin resistance: From mechanisms to therapeutic strategies. Diab Metab J. 46 (1), 15-37 (2022).
- Campos, J. C., et al. Exercise preserves physical fitness during aging through AMPK and mitochondrial dynamics. Proc Natl Acad Sci U S A. 120 (2), e2204750120(2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved